Lơxêmi cấp tiền tuỷ bào (TTB) (Acute promyelocytic leukimia = APL) được phát hiện và mô tả lâm sàng từ đầu thế kỷ 20, nhưng cũng ít người quan tâm nghiên cứu, mãi tới khoảng 3 thập niên gần đây nhờ tiến bộ của khoa học các kỹ thuật di truyền phân tử và sự ra đời của ATRA (1988) và Arsenic Trioside (1990) từ Trung Quốc nhiều nhà khoa học của nhiều nước như Trung Quốc, Mỹ, Anh, Ý, Pháp… đã quan tâm đặc biệt tới các nghiên cứu về di truyền phân tử, bệnh lý gene và khả năng điều trị “đích” theo biến đổi gene di truyền, đặc điểm dịch tễ và vùng địa lý.
Các đặc điểm vể bệnh
về dịch tễ học:
Theo phân loại của FAB (1986) và bổ sung bởi Lichman (1995) lơxêmi cấp tiền tuỷ bào được gọi là M3(10). Bệnh có liên quan tới vùng địa lý, chủng tộc và di truyền. Ở Trung Quốc theo tài liệu của Huang (9) APL chiếm tỷ lệ 25 – 30% trong AML (Acute myeloid leukemia); ở Mỹ theo thống kê 2005 có 11.930 trường hợp, trong đó, nam 6.350 và nữ 5.580 trường hợp. Nhìn chung ở Mỹ theo tài liệu này APL có khoảng 1-10% trong tổng số lơxêmi cấp dòng tuỷ (AML) (11); ở Mỹ La Tinh có tới 15 – 27% trong AML, da trắng 6% – 9%, da đen 5 – 18%; ở Costa Rica tỷ lệ APL rất cao, tới 34% trong AML; ở Tây Ban Nha, nghiên cứu trên 1.129 bệnh nhân AMI,, có 17% là APL, ở phía nam 21%, phía hắc 17% (11); Ở Việt Nam có khoảng 10-15% trong số AML (1,2). Về tuổi, thường gặp ở tuổi 15 – 55. Ở Việt Nam gặp tuổi rất trẻ 16 – 40, chiếm tỷ lệ cao, trẻ hơn và già hơn (> 60) hiếm gặp (1,2).
Về lâm sàng: bệnh diễn biến nhanh, với các triệu chứng: xuất huyết, mệt mỏi, thiếu máu, sốt, đau xương, nhiễm trùng, bệnh nhân có thể nhanh chóng tử vong do xuất huyết não.
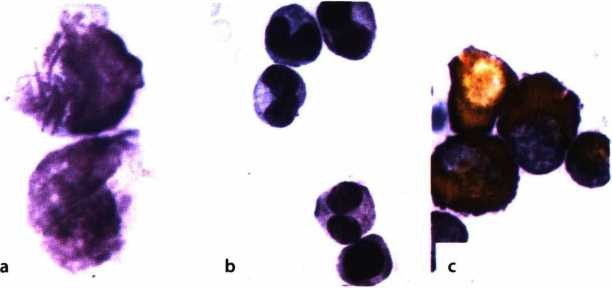
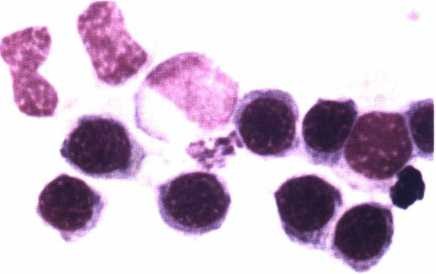
Xét nghiệm tế bào máu, tế bào tủy: cho kết quả TB blast tiền tuỷ bào tăng cao > 30% trong tuỷ, có khi tới 80 – 90%. Tế bào to, NSC (nguyên sinh chất) có các hạt to và thô, chúng liên kết lại thành các bó lớn (thể Auer), loại này (M3) (H.4.7a) chiếm > 85%; thể thứ 2 (M3v) ít hơn (khoảng 15%) (H.4.7b), tế bào nhỏ, dạng mono, nhân cuộn, đặc biệt có nhân đối xứng hình gương, hạt đặc hiệu trong NSC rất nhỏ, khi cần biết phải quan sát dưới kính hiển vi điện tử, nhuộm hoá tế bào dương tính với PO và Sudan đen; kiểm tra dấu ấn (CD) có CD33+; cấy tế bào phát hiện biến đổi NST (nhiễm sắc thể), thường gặp dạng chuyển đoạn NST t(15;17); (q22;q21); (q11;q13); (q22;q11-12); t(11;17); t(11;23); (5q35)… Trong đó chuyển đoạn t(15;17) chiếm > 80% (7,8,9), bằng phương pháp phân tử (PCR) còn phát hiện các gen đặc trưng APL đó là PML/RARa, đây là gen gây APL chủ yếu (hình 4.8).
|
Thay đổi hình thái tế bào: Hình 4.7. Hình thái tế bào máu nhôm Giemsa ở bệnh nhân APL |
a.Tế bào blast (non) tiền tuỳ bào, NSC rộng, nhiều hạt đặc hiệu thô, liên kết thành bó (thể Auer);
b.Thể M3v: giống monoyt, hạt đặc hiệu nhỏ, tế bào nhỏ hơn thể M3, có dạng nhân đối xứng.
c.Esterase không đặc hiệu (+): tế bào blast bắt màu vàng cam.
Các xét nghiệm về đông máu: Rối loạn đông máu là rối loạn nặng nhất của M3, thường dẫn đến tử vong do xuất huyết não, các biểu hiện của RLĐM là xuất huyết nhiều nơi: da, niêm mạc, nội tạng, sinh dục, tiêu hoá, tiết niệu,…, ở da với nhiều hình thái chấm, nốt, đám, liên kết thành mảng lớn. Xét nghiệm cho thấy prothrombin giảm nặng, sợi huyết giảm, APTT, PT giảm, giảm tiểu cầu. Nhìn chung rối loạn đông máu theo hướng giảm đông, tiêu sợi huyết, D. Dimer (+), xuất hiện đông máu rải rác trong lòng mạch (80 – au%) trong số bệnh nhân được chấn đoán là APL (M3), đây là một trong các nguyên nhân quan trọng gây chảy máu và tử vong (3,4).
Về di truyền: APL liên quan đến chuyển đoạn NST và liên kết gene PML/RAR α, trong đó > 80% có chuyển đoạn NST t (15; 17) (q22;q21) và liên quan tới liên kết gen PML/RAR-α (7,8,13). Đây là bằng chứng quan trọng để bàn về bệnh sinh học của bệnh là cơ sở khoa học cho nguyên lý điều trị “đích” APL bằng ATRA và Asrenic Trioside.
Các xét nghiệm về miễn dịch: các dấu miễn dịch thường gặp: CDM CD34 CD.i8‘, CD,3… đặc điểm của các dấu ấn nói trên có giá trị chẩn đoán APL, khi lui bệnh hoàn toàn bạch cầu trung tính trở lại bình thường, lúc này có thêm các dấu ấn CD,315. Điều đó chứng tở APL bắt nguồn từ tế bào gốc tiền thân dòng bạch cầu hạt trung tính (G-CFU).
Vai trò di truyền phân tử trong bệnh sinh của apl
Rối loạn quá trình biệt hoá binh thường của tế bào gốc tạo máu thể tiền tủy bào
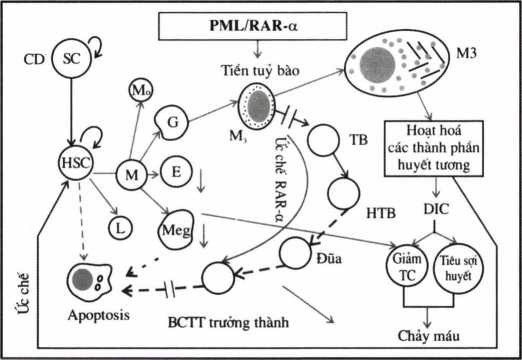
Bình thường tế bào tiền tuỷ bào (Promyclocytes) bắt nguồn từ tế bào gốc dòng tuỷ (CFU-GEMM) phát triển và biệt hoá thành tế bào gốc 2 dòng: momo và bạch cầu hạt (GM-CFU), tiếp theo GM-CFU tách riêng tế bào gốc đầu dòng bạch cầu hạt trung tính (G-CFU) và đầu dòng mono (M-CFU), G-CFU tiếp tục phát triển thành bạch cầu hạt trung tính trưảng thành, quá trình trưởng thành (chín = maturation) này có vai trò của thụ thể RAR-α (Retinoic Acide Receptor) và các cytokin: G-CSF, IL-3…. Trên cơ sở này, bệnh lý có thể xảy ra ở bất kỳ giai đoạn nào của quá trình biệt hoá, lơxêmi cấp tiền tuỷ bào chính là bệnh lý đơn dòng do đột biến ở giai đoạn tiền tuỷ bào (10), đột biến này đã chặn đường biệt hoá của tiên tuỷ bào thành bạch cầu trung tính, đồng thời phát triển thành tế bào ung thư (APL) (hình 4.8).
sc = stem cells = Tế bào gốc; HSC = Hemopoietic stem cells = TBG tạo máu
PML = Promyelocytic leukemia = Lơxèmi cấp tiền tuỳ bào; RAR- α = Retinoic Acide Receptor
Hình 4.8. Cơ chế di truyền phân tử trong sinh bệnh của APL (M3)
Biến đổi nst và sự hình thành liên kết gen pmurar-α
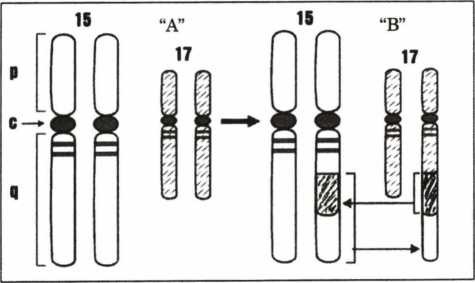
APL phát hiện và được mô tả từ đầu thế kỷ 20, nhưng mãi tới 1990, Chomiene (7) khi nghiên cứu đặc điểm cấu trúc và chức năng của acid retinoic và tác dụng của all-trans retionic acid đối với APL, ông đã nhận thấy có sai lệch về truyền tin giữa RAR-α và ARN. Sau đó, bằng phương pháp phân tử (RT-PCR) nhiều tác giả đã nhận thấy đột biến RAR-α nằm trên vị trí đứt gãy của cánh dài của NST 17 và đột biến của PML (Proncyelocytic leukimia) nằm trên vị trí đứt gãy của cánh dài của NST 15. Chính sự chuyển đoạn của NST 17 sang 15 t (17;15) này đã tạo ra liên kết giữa PML và RAR-a (PML/RAR-a) (hình 4.9).
Hinh 4.9. Sơ đổ chuyển đoạn NST 15, 17 ở bệnh nhân lơxêmi cấp tiền tủy bào
”A”: NST bình thưởng, “B”: NST bệnh lý
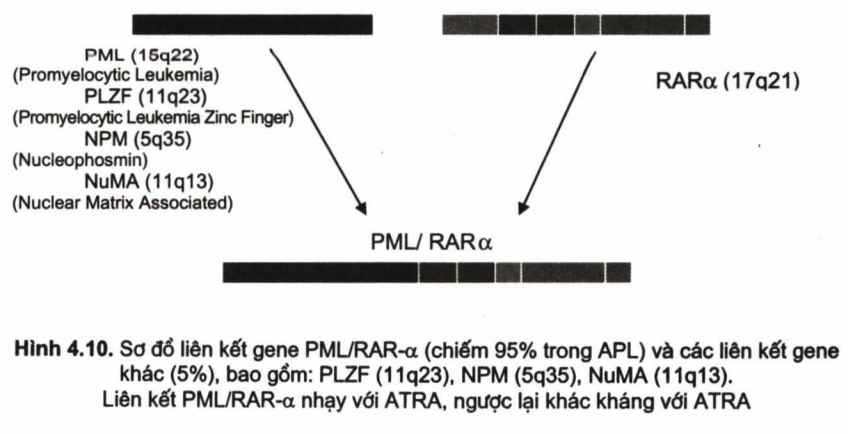
Sự hình thành liên kết gene PML/RAR-α: Các tác giả cho rằng: các tác nhân gây bệnh (tia xạ, hóa chất, thuốc, vì môi trường tác động vào NST 15, 17, tạo ra chuyển đoạn NSTt (15; 17). Đột biến này tạo nên liên kết gene PML/RAR-2 (Promyelocytic leukemia/ Retionic acide Receptor-2). Sự tạo thành liên kết này như sau: PML liên kết với nơi đứt gãy ở cánh dài NST (17q21), từ đó sẽ tạo thành PML/RAR-α. Liên kết PML/RAR-α chiếm 95% APL, còn 5% là các liên kết khác (H4.10).
Vai trò của liên kết gene pml/rar-α trong bệnh sinh của apl
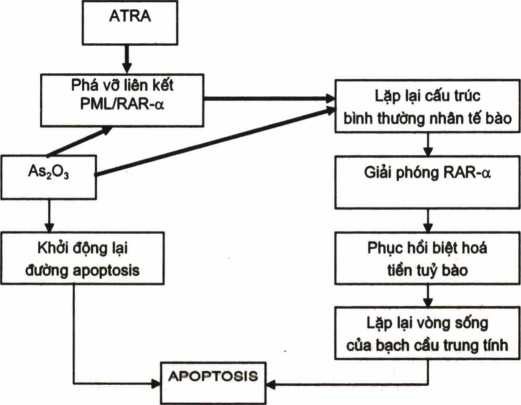
Khi liên kết gene PML/RAR-α được hình thành, một mặt chúng ức chế (ràng buộc) hoạt động của receptor RAR-α đối với sự phát triển và biệt hoá của tiền tuỷ bào, do đó quá trình trưởng thành của TTB tới bạch cầu trung tính bị gián đoạn (bị chặn lại). Mặt khác, liên kết gene PML/RAR-α chiếm chỗ của thể nhân tế bào (Nuclear bodies) làm mất truyền tín hiệu từ RAR-α tới ARN do đó tiền tuỷ bào phát triển thiếu kiểm soát, đồng thời đường apoptosis (chết theo chương trình) cũng bị gián đoạn, do đó tế bào tiền tủy bào trở thành tế bào ung thư (lơxêmi cấp tiền tuỷ bào = Acute promyelocytic leukemia = APL) (6, 7, 14). Giả thuyết này đã được chứng minh trên thực nghiệm khi nghiên cứu chức năng của acid retinoic (7). Acid retinoic có tác dụng kích thích sự phát triển của bạch cầu hạt trung tính từ các tê bào gốc dòng tuỷ, nhưng nó chỉ có tốc dụng khi có mặt của receptor tiếp nhận RAR-α (6).
Với các hiểu biết trên đây các nhà khoa học Trung Quốc đã sớm ứng dụng ATRA và As203 điều trị APL, ATRA (all-Trans-Retinoic Acide) (1 hoạt chất của sinh tố A) có tác dụng giải phóng RAR-α từ liên kết PML/RAR-α. Khi RAR-α được giải phóng, cấu trúc bình thường của nhân tê bào trở lại bình thường, đường biệt hoá của TTB được tái lập, bạch cầu trung tính được trưởng thành (7), cùng với RAR-α được giải phóng, đường apoptosis được khởi động, vòng sống của bạch cầu hạt trở lại bình thường.
Cơ chế rối loạn đông máu ở bệnh nhàn apl: đây là biến chứng nguy hiểm nhất của apl
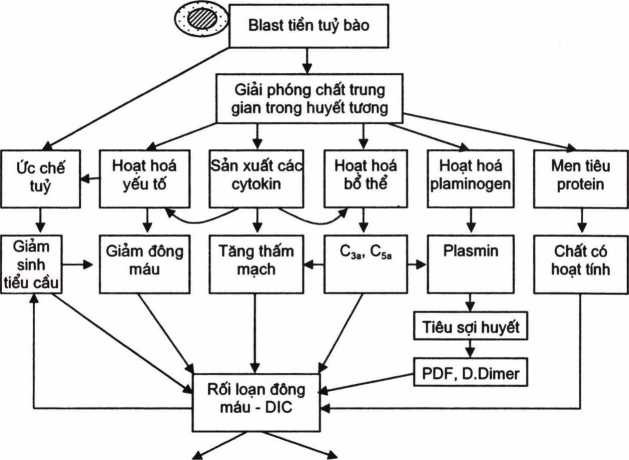
Cơ chế rối loạn đông máu được khởi động bởi các hạt đặc hiệu của TTB-blast, giải phóng nhiều chất gây hoạt hoá các yếu tố đông máu, hoạt hoá bổ thể tạo ra các chất trung gian như C5a, C3a, hoạt hoá plasminogen tạo ra plasmin tiêu sợi huyết, tạo các cytokin; mặt khác do tuỷ xương bị ức chế và do tiêu thụ tiểu cầu bởi DIC, v.v… cùng tác động và gây rối loạn đông máu nặng (H.4.11).
|
Xuất huyết Chảy máu |
Hình 4.11. Sơ đổ cơ chế rối loạn đông máu trong lơxêmi cấp tiền tuỷ bào (M3)
Qua sơ đồ trên có thể thấy, có 6 yếu tố cùng tham gia gây rối loạn đông máu RLĐM), trong đó có một yếu tố thuộc tế bào (tiểu cầu) và 5 yếu tố thuộc huyết ương. Cơ chế trên cho phép giải thích tính nghiêm trọng của RLĐM ở bệnh nhân lơxêmi cấp thể tiền tuỷ bào. Trong đó 3 yếu tố rất đáng quan tâm, đó là giảm tiểu cầu, giảm các yếu tố đông máu, tăng thấm mạch, 3 yếu tố này là mũi tấn công rất mãnh liệt gây chảy máu – đồng thòi đó cũng là đích điều trị RLĐM ở bệnh nhân này. Mặt khác cần lưu ý tối vai trò của các phản ứng miễn dịch không đặc hiệu như loạt hoá bổ thể, hoạt hoá các chất trung gian hoà tan, tăng các cytokin, đây là làn sóng thứ hai tấn công vào rối loạn đông máu và các rối loạn chức năng khác của cơ thể.
Vai trò của atra và as20, trong điều trị apl
Từ những năm 90 của thế kỷ trước, nhờ phát minh của Trung Quốc (một nước có tỷ lệ APL cao), về ATRA (All-trans-Rétionic Acide) điều trị APL, cho tới nay đã có khoảng > 3500 bệnh nhân từ nhiều nước trên thế giới đã được điều trị, tỷ lệ đạt ơi bệnh hoàn toàn rất cao (70 – 80%), tỷ lệ sống không bệnh trên 5 năm đạt trên 0% – 80%, tỷ lệ tái phát 30 – 40% (2,4,9). Từ năm 1995 nhiều tài liệu quốc tế từ
Anh, Nhật, Tây Ban Nha, Mỹ đã công bố kết quả điều trị APL bằng As203 (arsenic trioside) một chất chống ung thư đã sử dụng từ thế kỷ 18, nó bị lãng quyên một thời gian dài, nay lại được áp dụng điểu trị APL, tỷ lệ đạt lui bệnh rất cao (80 – 90%), tối phát ít, ít tác dụng phụ, điểu trị tái phát APL rất hiệu quả (5,6,12), nếu phối hợp với ATRA thì kết quả lại càng tốt, tỷ lệ tái phát thấp và thời gian tái phát kéo dài (13). Với các kết quả thu được, nhiều nhà nghiên cứu lớn của thế giới đã minh chứng ATRA và As203 là các thuốc đầu tiên điều trị theo cơ chế gene di truyền phân tử. ATRA và As203 có tác dụng phá vỡ liên kết gen PML/RAR-α, giải phóng receptor RAR-α, lặp lại cấu trúc của nhân tế bào, phục hồi quá trình sinh sản và biệt hoá của tế bào TTB trở thành bạch cầu hạt trung tính, đồng thời giải phóng đường tự tiêu huỷ bình thường (apoptosis), lặp lại vòng sống bình thường của tế bào tiền tuỷ bào (promyelocytic cells).
Hình 4.12. Sơ đồ phác hoạ cơ chế tác dụng điều trị “đích”
lơxê mi cấp tiền tuỷ bào (APL) bằng ÁTRA và As203
Vai trò của điều trị hỗ trợ:
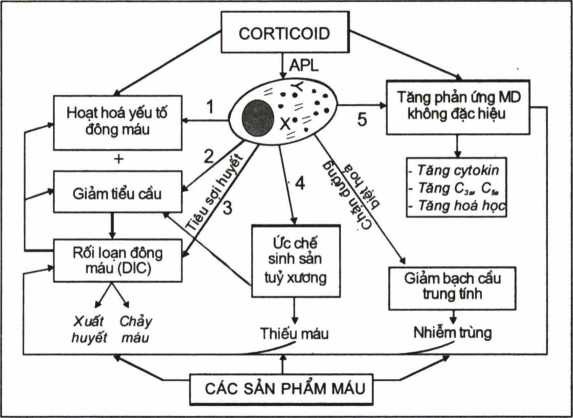
Bên cạnh điều trị “đích” chống liên kết PML/RAR-CC bằng ATRA và Arsenic trioside, còn phải đặc biệt chú ý điều trị cốc rối loạn do lơxêmi cấp tiền tuỷ bào gây nên, như rối loạn đông máu do giảm hoạt tính các yếu tố đông máu, giảm tiểu cầu, nhiễm trùng nặng do giảm nặng bạch cầu hạt trung tính; thiếu máu do tuỷ xương bị ức chế; tăng sản xuất các yếu tố miễn dịch không đặc hiệu (tăng các cytokin, tăng sản phẩm hoạt hoá bổ thể, tăng các men tiêu protein…). Điều trị các rối loạn này tập trung vào hai hướng: ức chế hoạt hoá các yếu tố đông máu, bổ thể, cytokin… bằng corticoid và bù đắp các sản phẩm máu hợp lý.
Hinh 4.13. Sơ đồ phác họa các hướng điều trị hỗ trợ lơxêmi cấp tiền tuỷ bào
Các số 1, 2, 3, 4, 5 chỉ các rối loạn do APL gây nên; Số 6 và 7 chỉ hướng can thiệp.
Sơ đồ trên cho thấy trong điều trị hỗ trợ cần đặc biệt chú ý sử dụng corticoid liều cao (solumedrol tiêm nhỏ giọt đường tĩnh mạch), bù đắp các sản phẩm máu thiếu, chống nhiễm trùng bằng kháng sinh phổ rộng, hoặc truyền khối bạch cầu tươi.
Kết quả điều trị apl bằng atra và as2oa tại viện hhtm tw:
Sau khi đã chẩn đoán xác định là APL, bằng cả 4 phương pháp: hình thái, hoá tế bào, miễn dịch và di truyền, từ 1999 với sự hỗ trợ của BV Thiên Tân và Công ty Hanyi (Trung Quốc), chúng tôi đã điều trị ATRA cho 71 bệnh nhân APL với liều 40mg/ngày X 30 ngày, sau đó dùng liều 20mg X 60 ngày, tổng cộng 90 ngày điểu trị chính thức.
Kết quả cho thấy có 57 bệnh nhân lui bệnh hoàn toàn (LBHT) (>80%) sau 15 – 27 ngày điều trị, chỉ tiêu đánh giá lui bệnh hoàn toàn dựa theo tiêu chuẩn WHO (2001). Tỷ lệ tái phát sau 24 tháng là 31%, trong đó có 2 bệnh nhân tái phát lần 2.
Để điều trị APL tái phát, chúng tôi đã điều trị cho 8 bệnh nhân bằng AS2O3 đơn độc (Sở dĩ chì có 8 bệnh nhân tái phát lần đầu được điều trị bằng As203 vì khi đó chúng tôi chỉ có 8 liều As203 từ hãng Hanyi (TQ) tài trợ). Kết quả cho thấy cả 8 bệnh nhân LBHT sau 20 ngày điều trị, tiếp theo bệnh nhân được điều trị đủ 30 ống (10mg/ống/ngày). Thời gian lui bệnh hoàn toàn theo tiêu chuẩn WHO của 8 bệnh nhân này là 15 – 20 ngày. Qua theo dõi không nhận thấy có tác dụng phụ nào cả ở 8 bệnh nhân. Có 2 bệnh nhân tái phát lần 2 được điều trị bằng As203, một bệnh nhân LBHT, 1 bệnh nhân tử vong trong thời gian điều trị, bệnh nhân tái phát đã LBHT và tử vong sau 3 tháng LBHT. Tới tháng 10/2002 hết thuốc điều trị, nhưng số bệnh nhân LBHT sau ATRA (49 bệnh nhân) và sau As203 (8 bệnh nhân) vẫn được theo dõi, khám và kiểm tra sức khoẻ 2 – 3 tháng một lần.
Kết quả theo dõi sau 5 – 8 năm cho thấy có 49 bệnh nhân trong số 57 bệnh nhân LBHT còn liên hệ, số còn lại thay đổi địa chỉ không liên hệ được (8 bệnh nhân). Trong số 49 còn liên hệ có 25 bệnh nhân sống, 24 bệnh nhân tử vong do không có As203 để điều trị tái phát (chưa được nhập). 25 bệnh nhân sống được khám lâm sàng, làm các xét nghiệm: công thức máu, tủy đồ, cấy nhiễm sắc thể, dấu ấn miễn dịch (các CD34,33,38,13,14,15; CD3,4,8,16/61), chức năng thực bào của bạch cầu hạt trung tính với tụ cầu trắng không gây bệnh và hạt latex, được đánh giá trên 3 chỉ số: % thực bào, chỉ số thực bào và % diệt khuẩn của thực bào (tỷ lệ tụ cầu bị diệt trong thực bào).
Kết quả sau kiểm tra cho thấy:
Về lâm sàng: cả 25 bệnh nhân sống (51%), họ đã trở về làm việc với chuyên môn của mình, có 4 bệnh nhân làm việc nội chợ, 3 bệnh nhân (2 nữ, 1 nam) đã xây dựng gia đình và sinh con khoẻ mạnh, sau 10-13 năm theo dõi số bệnh nhân này sống khỏe mạnh (ảnh trang cuối).
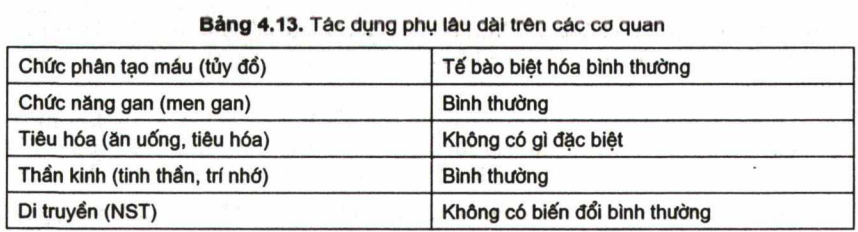
Về xét nghiêm, tất cả đều không phát hiện thấy tế bào blast ở máu – số lượng HC > 4 triệu, HST > 130g/l, tiểu cầu > 200g/l, tuỷ đồ không thấy tế bào blast; nguyên tuỷ bào 0,7%, tiền tuỷ bào 2,8%, dòng bạch cầu hạt phát triển hoàn toàn bình thường, số lượng bạch cầu > 7G/l, trong đó bạch cầu trung tính chiếm 4G/l, tỷ số này hoàn toàn giống người bình thường (đây là dòng bạch cầu đã bị bệnh) (hình 4.14). Kiểm tra về khả năng thực bào và diệt khuẩn cho kết quả hoàn toàn giống người bình thường (nhóm chứng – người bình thường). Điều này nói lên chức năng chính của bạch cầu hạt trung tính đã phục hồi hoàn toàn (H4.15a, 4.15b, 4.15c). Chất lượng sống tốt 80% trở lại công việc cũ, 20% lao động trong gia đình. Trong đó có 4 thanh niên (1 nam, 3 nữ) xây dựng gia đình và đã có cháu (cháu nhỏ nhất 3 tuổi, cháu lớn nhất 6 tuổi), (hình 4.16) – Theo dõi tác dụng phụ của ATRA và As203 sau 9 – 10 năm chưa phát hiện thấy biến đổi gì ơ các cơ quan.
Kết luận
Nhờ các tiến bộ về khoa học kỹ thuật cơ chế bệnh lý gene trong APL đã được chứng minh do liên kết gene PML/RAR-α, liên kết này đã làm bất hoạt RAR-α cản trở biệt hoá của dòng tiền tuỷ bào và phát triển thành ung thư APL. ATRA và As203 có tác dụng giải phóng RAR-α lặp lại cấu trúc nhân tế bào, lặp lại câu trúc bình thường của NST 15,17; phục hồi đường biệt hoá của tiền tuỷ bào, cùng với tác dụng hỗ trợ của corticoid và các sản phẩm máu, RLĐM sớm được cải thiện. Tạo máu của bệnh nhân phục hồi nhanh chóng nhất là tiểu cầu và bạch cầu hạt trung tính, số bệnh nhân LBHT không bệnh (51%)có chất lượng sống tốt, sau 8-9 năm sống và lao động gần như bình thường, nếu được chẩn đoán sớm và có đủ thuốc ATRA và As203 thì tỷ lệ này còn tăng >80%. Do đó, có thể nói ATRA và As203 là thuốc hàng đầu có hiệu quả điều trị “đích” rối loạn gene RAR-α ở bệnh nhân lơxêmi cấp tiền tuỷ bào.
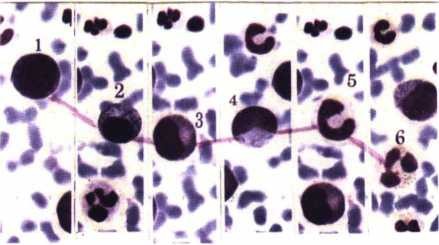
Kết quả theo dõi phục hồi tế bào tủy xương sau LBHT:
Hình 4.14a. Tế bào tuỷ xương bệnh nhân APL đạt lui bệnh hoàn toàn sau 30 ngày điều trị
bằng ATRA hoặc As2O3
|
1 2 3 4 5 6 |
Hình 4.14b. Hình ảnh biệt hoá trở lại của dòng bạch cẩu hạt trung tính
sau 3 tuần điều trị bằng ATRA, hoặc As203
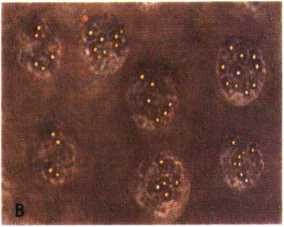
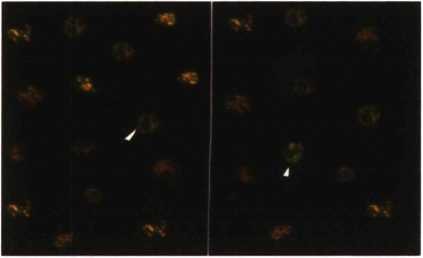
Hình 4.15a. Thực bào hạt latex: chứng (A), nghiệm (B)
A. Người bình thường (chứng +) B. Bệnh nhân M3 lui bệnh hoàn toàn
Hình 4.15b. Thực bào tụ cầu
|
A. Người bình thường. Tụ cầu bắt màu vàng cam (tụ cầu chết) |
B. BN M3 CR. Tụ cầu bắt màu xanh (tụ cầu sống) |
Hình 4.15c. Khả năng diệt khuẩn của tụ cấu trở lại bình thường.
Màu xanh là tê bào sống, màu da cam là tế bào chết

|
Hai bệnh nhân LBHT đã xây dựng gia đình |
Các bệnh nhân đã lui bệnh hoàn toàn, sống |
Gia đinh bệnh nhân Ph. (x) (M3) Sau 14 năm điếu trị hiện tại sức khoe tốt, lao động bình thường. Các con của bệnh
nhân đều khoẻ mạnh.Nay mở xưởng gỗ có 10 công nhân (SỐ 60 Đức Minh, Thanh Bình,TP Hải Dương)
Bệnh nhân Ngô Mạnh H.(x) Sau điều trị 12 năm (2001 – 2013) đã khỏi bệnh hoàn toàn.
Hiện tại sống không bệnh, lao động và sinh hoạt binh thường (20/01/2014)
(Số 30 Trần Quốc Toản – Hà Nội)
(Khi bố bị bệnh con mới lên 4, nay con (XX)
đó vào Đại học Y Quân đội năm thứ nhất
|
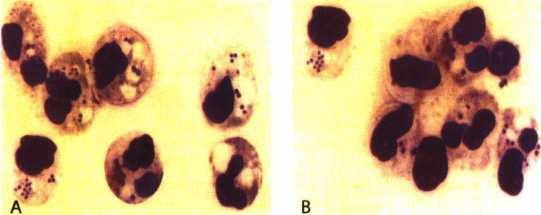
Hình thái tế bào tủy giai đoạn khỏi bệnh |

Hình thái tế bào tủy giai đoạn cấp tính
Hình 4.16. Một vài hình ảnh về kết quả điều trị bệnh ung thư máu ác tính
thể tiền tủy bào (M3)
Phác đồ (quy trình) chẩn đoán
Nguyên tắc
Chẩn đoán sớm, chính xác, đánh giá mức độ RLĐM, thiếu máu, nhiễm trùng, sớm bù đắp lặp lại cân bằng nội mỏi.
Phải coi các xét nghiệm cho đối tượng này là xét nghiêm cấp cứu, để có quyết định điểu trị.
Tiêu chuẩn có giá trị chẩn đoán
lâm sàng:
Bệnh xuất hiện đột ngột, diễn biến nhanh ở người trẻ khoẻ mạnh với các biểu hiện: xuất huyết nhiều nơi, thiếu máu, nhiễm trùng, sốt, suy sụp toàn thắn.
xét nghiệm
Máu: bạch cẩu hạt trung tinh, tiểu cầu, hồng cầu giảm nặng, có tế bào non tiền tuỷ bào (10-90%).
Đông máu: giảm các yếu tố đông máu, PT, APTT tibrinogen giảm, nghiệm pháp rượu (+), von Kaulla (+), sản phẩm tiêu sợi huyết (D-Dimer) (+), DIC (+).
Tuỷ đổ: số lượng tế bào tuỷ tăng, (có thể giảm), tế bào ác tính (blast tiền tuỷ bào) tăng >20%, nguyên sinh chất có hạt đặc hiệu thô liên kết thành bó (thể Auer); M3v: có nhân đối xứng, NCS có hạt đặc hiệu, nhỏ khó phát hiện.
Hoá tế bào: MPO (+), Sudanden (+), PAS(-), nhuộm esteraza không đặc hiệu (+): có CD34 (-) CDm(+); có NST t(15,17), có gene bệnh lý PML/RAR-α (+).
Chẩn đoán (+)
Lâm sàng diễn biến nhanh, xuất huyết rầm rộ ở người trẻ, suy sụp toàn thân.
Xét nghiệm có blast tiền tuỷ bào thể M3 hoặc M3v; rối loạn đồng máu theo hướng giảm đông, DIC (+), di truyền t (15,17), có gene bệnh PML/RAR-α.
Phác đổ điều trị
nguyên tắc
Cùng với điều trị “đích” bằng ATRA hoặc As203 hoặc phối hợp cả hai; phải bồi phụ kịp thời các yếu tố đông máu, lượng HST theo kết quả XN).
Sử dụng ngay từ đẩu liều cao corticoid hoặc dexamithason để ngăn ngừa hoạt hoá các yếu tố đông máu, bổ thể, huyết tương, ngăn tác dụng kích hoạt của các sản phẩm blast tiền tuỷ bào.
phác đồ điều trị
Điều trị đích: ATRA (all-trans-retinoic acid) 10mg/v X 4v/ngày, chia 2 lần uống cách nhau 12 giờ, uống liên tục trong 30 ngày, sau LBHT tiếp tục uống cho tới ngày thứ 90 với liều 2v/ngày, chia 2 lần. Điều trị bằng arsemic triosid 1 ống (10mg)/ngày + 500ml nước muối 0,9% truyền TM X 30 ngày.
Điều trị ức chế kích hoạt các yếu tổ đông máu, bổ thể và các yếu tố khác của huyết tương: corticoid 2-5mg/kg/ngày cho tới khi ngừng xuất huyết. Thường dùng solumedrol tiêm truyền tĩnh mạch 2-4 ổng loại 40mg/ống tiêm truyền tĩnh mạch với huyết thanh mặn – ngọt. Dùng cho tới hết xuất huyết.
Bồi phụ các sản phẩm máu (truyền máu từng phẩn):
Khối tiểu cầu đậm đặc khi số lượng TC
Huyết tương tươi đông lạnh khi có giảm các yếu tố đông máu.
Tủa lạnh khi có giảm sợi huyết (DIC +)
Chăm sóc bệnh nhân: tinh thẩn, dinh dưỡng, chống nhiễm trùng.
theo dõi
Tình trạng lâm sàng, xuất huyết, hội chứng ATRA.
Xét nghiệm máu 3 ngày 1 lần tế bào máu, đông máu nếu bệnh nhân nặng: cách ngày xét nghiệm máu 1 lần, chú ý sự thay đổi của blast TTB, BC hạt, TC, DIC
Theo dõi và xử lý kịp thời các tác dụng phụ nhất là hội chứng ATRA.
tiên lượng:
dựa vào các chỉ tiêu
Phác đồ trên cho kết quả sau 10-15 ngày điều trị, đạt LBHT sau 25-30 ngày, phục hồi nhanh.
Lâu dài: chất lượng sống tốt, cấy cụm (Colony) tố bào tủy phát triển tốt; mất chuyển đoạn NST t (15, 17) gen bệnh PML/RAR-α (-).