Gene mã hóa TAFI nằm ở 13q14.11 và chứa 11 exon dài 48kb.
Có ít nhất 2 đồng phân TAFI riêng biệt trong huyết tương nhưng sự khác biệt về mặt chức năng của chúng chưa được báo cáo.
Giới thiệu
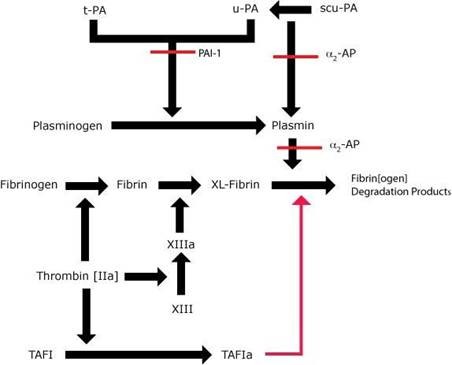
TAFI là một enzyme lưu hành trong huyết tương và liên quan đến việc điều hòa tiêu sợi huyết. TAFI được hoạt hóa thành TAFIa, nó sẽ ức chế tiêu sợi huyết thông qua việc loại bỏ thành phần lysine khỏi firbin trong cục đông lúc nó bị bộc lộ trong quá trình thoái giáng bởi plasmin. Như thế, việc gắn t-PA vào sẽ fibrin sẽ bị hạn chế, dẫn đến ngăn cản chuyển plasminogen thành plasmin (nhớ rằng plasminogen gắn với lysine trong fibrin để chuyển thành plasmin) và vì vậy, cục đông fibrin sẽ được bảo vệ khỏi tiêu sợi huyết.
|
TAFI |
Thrombin-Activatable Fibrinolysis Inhibitor |
|
XL-Fibrin |
Cross-Linked Fibrin |
|
α2-AP |
Alpha 2 antiplasmin [Plasmin inhibitor] |
|
t-PA |
Tissue Plasminogen Activator |
|
u-PA |
Urinary Plasminogen Activator [Urokinase] |
|
scu-PA |
Single Chain Urinary Plasminogen Activator |
TAFI được hoạt hóa sẽ điều hòa ngược quá trình tiêu sợi huyết bằng việc loại bỏ lysiene ở đầu C tận của fibrin. Hậu quả, việc gắn plasminogen và t-PA vào fibrin bị ức chế.
TAFI được tổng hợp ở gan là một propeptide 423 amino acid. Sự hoạt hóa TAFI tạo thành dạng hoạt tính xảy ra bởi việc cắt protein tại Arg92 tạo ra một peptide hoạt hóa 19kDa. TAFIa có thời gian bán hủy nhiều giờ.
Tiêu sợi huyết được khởi động sau khi cục đông fibrin tạo thành. Bình thường, sự hoạt hóa plasminogen thành plasmin rất chậm/không đáng kể nếu không có fibrin, nhưng sẽ tăng lên rõ rệt khi có fibrin, vì các sợi fibrin bộc lộ vị trí gắn của cả PLG và t-PA, mang chúng lại gần nhau và định vị ở vị trí tạo cục máu đông. Hơn nữa, plasmin gắn với fibrin trong cục đông sẽ được bảo vệ khỏi sự bất hoạt của α2-antiplasmin. Plasmin cắt fibrin và tạo ra một lysine mới đầu C tận và thúc đẩy sự tạo thành plasmin xa hơn.
TAFI ức chế tiêu sợi huyết bằng cách loại bỏ lysine đầu C tận khỏi fibrin và vì vậy ngăn cản sự gắn PLG và t-PA vào cục đông fibrin. Hơn nữa, TAFIa cũng ức chế sự chuyển GluPlg thành Glu-plasmin và sự chuyển Glu-Plg thành Lys-Plg. Sự hoạt hóa TAFI thành TAFIa tương đối không hiệu quả nếu vắng mặt Thrombomodulin (Tm) – Tm tăng tốc độ hoạt hóa lên 1000 lần. Nồng độ thrombin cao cũng cần để chuyển TAFI thành TAFIa, ngược lại nồng độ thrombin thấp lại cần để phục hồi fibrinogen thành fibrin. Vì những lý do đó, sự hoạt hóa TAFI diễn ra trong suốt con đường đông máu nội sinh thông qua FXI. Sự suy giảm hoặc bất thường chức năng TAFI có thể góp phần quan trọng trong việc tạo nên kiểu hình chảy máu gặp ở bệnh nhân suy giảm FXI và cũng góp phần tạo nên chảy máu nặng ở bệnh nhân suy giảm FVIII, FIX. Điều thú vị là ở mô hình chuột loại bỏ (“knockout”) TAFI cho thấy quá trình phát triển phôi bình thường, sinh sản bình thường và không xuất hiện tăng rối loạn chảy máu hay huyết khối. Tuy nhiên, ít nhất một số chuộc K/O cho thấy suy giảm làm lành vết thương gợi ý vai trò của TAFI trong sửa chữa mô. Một SNP trong gene TAFI dẫn đến sự thay thế Threonine bằng Isoleucin tại vị trí 325 và sự thay thế này làm tăng thời gian bán hủy gấp đôi (từ 8 đến 15 phút ở 37 độ C) và kết quả làm tăng hoạt tính phân cắt fibrin. Tuy nhiên, SNP này cũng liên kết với giảm hoạt tính miễn dịch TAFI, có thể do liên kết với các SNP khác trong gene TAFI mà ảnh hưởng dến biểu hiện gene.
Nguyên lý và phương pháp
ELISA:
Các giếng phủ kháng thể chống TAFI. Sau đó kháng thể thứ hai là kháng thể anti-human TAFI gắn enzyme HRP. Cách thức đã trình bày ở nhiều bài trước.
Xét nghiệm chức năng:
Sự làm chậm tiêu cục đông bởi TAFIa: xét nghiệm này dựa vào khả năng làm chậm ly giải cục đông huyết tương gây ra bởi rt-PA. TAFI được hoạt hóa bởi thrombin và Tm. Sự hiện hiện TAFI trong huyết tương dẫn đến ức chế tiêu sợi huyết, có thể đo được qua sự thay đổi OD. Trong sự thiếu hụt hoặc bất thường chức năng TAFI sẽ khiếm khuyết, hoạt tính tiêu sợi huyết sẽ không bị cản trở, sự thay đổi OD sẽ nhanh hơn.
Huyết tương được hoạt hóa bởi Thrombin-Thrombodulin. Sau 10 phút, sự hoạt hóa dừng lại bằng cách cho thêm PPACK (một chất ức chế protease) và TAFIa được đo bởi cơ chất đặc hiệu Hippuryl-Arg.
Phân tích
Chảy máu: Sự suy giảm hoặc bất thường chức năng TAFI có thể góp phần quan trọng trong việc tạo nên kiểu hình chảy máu gặp ở bệnh nhân suy giảm FXI và cũng góp phần tạo nên chảy máu nặng ở bệnh nhân suy giảm FVIII, FIX.
Vai trò của TAFI trong sinh bệnh học của huyết khối vẫn chưa rõ.
Khoảng tham chiếu
Kháng nguyên TAFI: 5.8-10.0µg/ml [100-172nM.]
Tài liệu tham khảo
Bajzar, L. (2000) Thrombin activatable fibrinolysis inhibitor and an antifibrinolytic pathway. Arterioscler Thromb Vasc Biol, 20, 2511-2518.
Bouma, B.N., Marx, P.F., Mosnier, L.O. & Meijers, J.C. (2001) Thrombin-activatable fibrinolysis inhibitor (TAFI, plasma procarboxypeptidase B, procarboxypeptidase R, procarboxypeptidase U). Thromb Res, 101, 329-354.
Bouma, B.N. & Mosnier, L.O. (2006) Thrombin activatable fibrinolysis inhibitor (TAFI)–how does thrombin regulate fibrinolysis? Ann Med, 38, 378-388.
Meltzer, M.E., Lisman, T., de Groot, P.G., Meijers, J.C., le Cessie, S., Doggen, C.J. & Rosendaal, F.R. (2010) Venous thrombosis risk associated with plasma hypofibrinolysis is explained by elevated plasma levels of TAFI and PAI-1. Blood, 116, 113