Ann Transl Med. 2018 Oct; 6(19): 387. doi: 10.21037/atm.2018.05.53
Dịch: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Các nghiên cứu gần đây đã chỉ ra cả tác dụng có lợi và có hại của nỗ lực hô hấp của bệnh nhân trong thở máy. Định lượng nỗ lực hô hấp có thể cho phép bác sĩ lâm sàng chuẩn độ hỗ trợ máy thở đến mức sinh lý của hoạt động cơ hô hấp. Trong bài tổng quan này, chúng tôi sẽ mô tả nền tảng sinh lý và các vấn đề của các phương pháp được sử dụng thường xuyên nhất để định lượng nỗ lực hô hấp, bao gồm đo áp lực thực quản, công thở, tích số áp lực thời gian, điện cơ và siêu âm. Chúng tôi cũng sẽ thảo luận về mức độ nỗ lực hô hấp có thể được coi là tối ưu khi thở máy ở các giai đoạn khác nhau của bệnh nặng.
Giới thiệu
Trong thập kỷ qua, nhiều nghiên cứu quan trọng đã nhấn mạnh rằng việc duy trì nỗ lực hô hấp của bệnh nhân khi thở máy là con dao hai lưỡi (1-5). Tác động tích cực của nỗ lực hô hấp của bệnh nhân có thể bao gồm cải thiện việc huy động vùng đáy phổi và oxy hóa được cải thiện (5,6). Hơn nữa, bảo tồn nỗ lực hô hấp của bệnh nhân có thể bảo vệ chống lại sự phát triển của teo cơ hoành và rối loạn chức năng co thắt do không sử dụng (2). Mặt khác, bệnh nhân có trung khu kiểm soát hô hấp cao có thể tạo ra một thể tích khí lưu thông cao không phù hợp với thông khí bảo vệ phổi, một hiện tượng gọi là tổn thương phổi tự gây ra cho bệnh nhân (P-SILI, patient self-inflicted lung injury) (7). Ngoài ra, các nghiên cứu trong giai đoạn đầu của hội chứng suy hô hấp cấp tính (ARDS) đã chứng minh rằng việc truyền liên tục thuốc ức chế thần kinh cơ cisatracurium giúp cải thiện khả năng sống sót, có thể bằng cách hủy bỏ nỗ lực hô hấp (4). Tạo sự cân bằng giữa các tác động có lợi và có hại của nỗ lực hô hấp là một trong những thách thức hiện đại trong quản lý thở máy (8). Người ta đã đề xuất rằng hỗ trợ máy thở nên được chuẩn độ theo từng tình trạng cá nhân cụ thể của bệnh nhân, dựa trên trung khu kiểm soát hô hấp, áp lực của cơ hô hấp và cơ học phổi (5,810).
Tuy nhiên, rất khó để đánh giá hoạt động của bơm cơ hô hấp trong quá trình thở máy mà không có kỹ thuật chẩn đoán cụ thể (11). Các thông số tiêu chuẩn vàng là công thở (WOB, work of breathing) và tích số áp lực-thời gian (PTP, pressure-time product), dựa trên các phép đo áp lực (12). Các phép đo này có thể khó có được và giải thích. Do đó, PTP và WOB hiếm khi được sử dụng trong chăm sóc lâm sàng và hầu hết được coi là một công cụ nghiên cứu (13). Gần đây, điện cơ hoành (9) và siêu âm (14) đã trở nên ngày càng phổ biến để đánh giá nỗ lực hô hấp trong nghiên cứu và chăm sóc lâm sàng. Mục đích của tổng quan này là để mô tả cơ sở sinh lý của đánh giá nỗ lực hô hấp. Chúng tôi sẽ thảo luận về cách áp lực thực quản (Pes), áp lực dạ dày (Pga), PTP, WOB, siêu âm và điện cơ có thể được sử dụng để định lượng nỗ lực hô hấp trong khi thở máy và làm nổi bật các vấn đề kỹ thuật liên quan đến các phép đo này. Hơn nữa, chúng tôi sẽ thảo luận về mức độ nỗ lực hô hấp nào có thể được coi là mong muốn trong khi thở máy ở các giai đoạn khác nhau của bệnh nặng.
Sinh lý
Định nghĩa của nỗ lực hô hấp
Mặc dù thuật ngữ nỗ lực hô hấp cảm thấy trực quan không có định nghĩa rõ ràng, và nhiều tác giả và sách giáo khoa định nghĩa nó khác nhau. Trong tổng quan này, chúng tôi đã xác định nỗ lực hô hấp là bất kỳ hoạt động tiêu tốn năng lượng nào của cơ hô hấp nhằm mục đích điều khiển hô hấp.
Chức năng của bơm cơ hô hấp
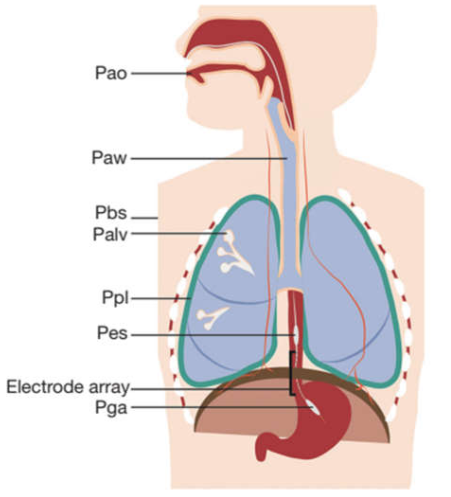
Bơm cơ hô hấp bao gồm nhiều cơ xương hoạt động theo kiểu phối hợp để duy trì thông khí phế nang theo các nhu cầu trao đổi chất khác nhau. Nỗ lực hô hấp được kiểm soát chặt chẽ để phù hợp với nhu cầu hô hấp của cơ thể. Sự mất cân bằng giữa nỗ lực hô hấp và nhu cầu hô hấp của cơ thể sẽ dẫn đến suy hô hấp. Thông khí cơ học là biện pháp cứu sống bệnh nhân suy hô hấp bằng cách tiếp quản WOB bệnh nhân, khôi phục lại sự cân bằng giữa tải trọng hô hấp và khả năng. Trong quá trình thông khí được hỗ trợ một phần, WOB được chia sẻ bởi bệnh nhân và máy thở. Để đánh giá bệnh nhân đóng góp tương đối vào thông khí, rất hữu ích khi tách bơm cơ hít vào và thở ra. Xem Hình 1 và Bảng 1 để thể hiện sơ đồ của hệ hô hấp, áp lực cơ và độ chênh áp lực.
Hình 1. Sơ đồ biểu diễn của hệ hô hấp và áp lực liên quan. Lưu ý ống thông đơn được trang bị bóng áp lực thực quản, bóng áp lực dạ dày và một dãy điện cực ở giữa hai quả bóng. Đường màu cam đại diện cho các dây thần kinh hoành. Để tính toán độ chênh áp lực tham khảo văn bản. Pao, áp lực mở đường thở; Paw, áp lực đường thở; Pbs, áp lực ở bề mặt cơ thể; Palv, áp lực phế nang; Ppl, áp lực màng phổi; Pes, áp lực thực quản; Pga, áp lực dạ dày.
|
Bảng 1. Độ chênh áp lực của hệ hô hấp
|
Bơm cơ hít vào
Hít vào chủ yếu được thúc đẩy bởi cơ hoành ở những người khỏe mạnh trong quá trình thở khí lưu thông (15). Cơ hoành là một cơ hình vòm mỏng (± 2.0 mm) tạo thành ranh giới giữa ngực và bụng (16). Các sợi cơ được chia thành hai phần chính: phần màng cứng (crural portion) bám vào ba đốt sống thắt lưng đầu tiên, và phần xương sườn (costal portion) bám vào xương sườn và mũi xương ức. Các sợi cơ của cơ hoành bám trực tiếp vào khung xương sườn dưới tạo thành vùng định vị (zone of apposition) (16-18). Ở dạng đơn giản, cơ hoành hoạt động giống như một pít-tông trong một cái thùng. Việc rút ngắn các sợi cơ trong vùng định vị đi xuống vòm của cơ hoành, làm tăng kích thước của khoang ngực và ép khoang bụng. Do đó, áp lực trong màng phổi (Ppl, intrapleural pressure) giảm và áp lực ổ bụng (Pab, abdominal pressure) tăng lên, tạo ra một độ chênh áp lực gọi là áp lực xuyên cơ hoành (Pdi, transdiaphragmatic pressure) (19,20).
Pdi (cmH2O) = Pab (cmH2O) – Ppl (cmH2O) [1] Việc giảm áp lực màng phổi sẽ tạo ra một áp lực trên phổi, gọi là áp lực xuyên phổi (PL, transpulmonary pressure), có thể được tính bằng cách trừ Ppl khỏi áp lực mở đường thở (Pao):
PL (cmH2O) = Pao (cmH2O) – Ppl (cmH2O) [2]
Các chu kỳ tăng và giảm trong PL cuối cùng điều khiển thông khí phế nang.
Trên lâm sàng, Ppl và Pab thường được ước tính bằng Pes và Pga. Việc đánh giá Ppl và Pab yêu cầu đặt bóng thực quản và/hoặc bóng dạ dày (Hình 1), có thể được coi là quá xâm lấn đối với một số bệnh nhân. Ngày nay, ống thông bóng có sẵn cũng có thể được sử dụng để nuôi ăn dạ dày và do đó đánh giá Pes và/hoặc Pga không xâm lấn hơn so với chăm sóc lâm sàng thông thường (13). Điều quan trọng cần lưu ý là ống thông bóng thực quản cung cấp ước tính áp lực màng phổi, nhưng áp lực thực tế trong khoang màng phổi khác nhau giữa các vùng do trọng lực và sự khác biệt trong cơ học hô hấp khộng gian (21). Tuy nhiên, các phép đo Pes cung cấp một ước tính hữu ích về áp lực màng phổi trung bình tại các vùng phổi phụ thuộc (21,22). Những ưu điểm, hạn chế và khía cạnh kỹ thuật của các phép đo Pes và Pga ở bệnh nhân bị bệnh nặng đã được thảo luận trong hai bài viết đánh giá xuất sắc (23,24).
Các nhóm cơ bổ sung được huy động khi tải hô hấp tăng cao. Các cơ hô hấp phụ quan trọng nhất là cơ ức chũm, cơ cạnh ức, cơ thang và cơ liên sườn (25). Giống như cơ hoành, sự co thắt của các cơ hô hấp phụ làm mở rộng lồng ngực và làm giảm Ppl, thúc đẩy sự gia tăng PL và bơm phồng phổi sau đó. Co thắt các cơ hô hấp phụ không tạo ra một độ chênh áp lực giữa bụng và khoang ngực nếu cơ hoành được thư giãn (12). Bất cứ lúc nào, Ppl phụ thuộc vào áp lực được tạo ra bởi tất cả các cơ hô hấp (Pmus) và độ chênh áp lực trên thành ngực (Pcw):
Ppl (cmH2O) = Pmus (cmH2O) + Pcw (cmH2O) [3]
Theo đó,
Pmus (cmH2O) = Ppl (cmH2O) – Pcw (cmH2O) [4]
Pmus cung cấp một đánh giá toàn cục về tất cả các cơ hô hấp, trong khi Pdi là đặc trưng cho cơ hoành (12,26). Pcw thường được tính bằng cách chia thể tích hít vào cho độ giãn nở lý thuyết của thành ngực (Ccw), ước tính là 4% dung tích sống. Theo đó, dung tích sống (dự đoán) là 4.000 mL sẽ cho Ccw ước tính là 160 mL/cmH2O (12). Giá trị tham chiếu cho Ccw nằm trong khoảng từ 150 đến 200 mL/cmH2O (12). Tuy nhiên, những giá trị này thu được ở những đối tượng khỏe mạnh và có thể không chính xác trong người bệnh nặng. Ccw thực tế của một bệnh nhân có thể được xác định bằng cách xây dựng một đường cong thể tích-áp lực cho Pes trong quá trình bơm phồng thụ động; Pmus bằng 0 trong quá trình bơm phồng thụ động và thuốc liệt cơ, có nghĩa là chỉ số quan sát được xác định hoàn toàn bởi Pcw {Eq. [3]} (26).
Bơm cơ thở ra
Thở ra là một quá trình thụ động trong khi thở yên tĩnh (19,26,27). Khi các cơ hít vào thư giãn, năng lượng đàn hồi tích tụ trong các cấu trúc của hệ hô hấp dẫn đến phổi xẹp xuống. Các cơ thở ra được huy động để hỗ trợ thở ra khi tải trọng đặt lên các cơ hít vào được tăng lên (28). Ngoài ra, các cơ thở ra được huy động khi thở ra thụ động bị cản trở do giảm độ đàn hồi của phổi (ví dụ, khí phế thũng) hoặc tăng sức cản hô hấp [ví dụ, cơn cấp bệnh phổi tắc nghẽn mạn tính (COPD)] (29). Các cơ thành bụng là cơ chính thở ra. Các cơ liên liên sườn trong và cơ tam giác sterni là cơ thở ra phụ (25). Co thắt các cơ thành bụng chèn ép khoang bụng, tăng Pab. Nếu cơ hoành được nới lỏng, tăng Pab sẽ được truyền đến ngực và tăng Ppl, tạo điều kiện cho phổi nhanh xẹp. Co thắt các cơ thở ra phụ trực tiếp làm tăng Ppl bằng cách ép ngực. Đáng chú ý, các cơ thở ra cũng có thể tạo điều kiện cho hít vào. Bằng cách co thắt trong giai đoạn thở ra, thể tích phổi giảm xuống dưới dung tích cặn chức năng và cơ hoành được chuyển sang vị trí tối ưu hơn (30,31). Khi các cơ thở ra thư giãn trong hít vào tiếp theo, cơ hoành sẽ hạ xuống và Ppl sẽ giảm, tạo điều kiện cho bơm phồng phổi (30). Trong hoạt động trung khu hô hấp cao, cơ hô hấp có thể tạo ra nhiều áp lực hơn lên cơ hoành (32). Do đó, đánh giá nỗ lực hô hấp ở mức tải cao cũng nên tính đến các cơ thở ra.
Định lượng nỗ lực hô hấp
Khám lâm sàng và kiểm tra dạng sóng máy thở
Các bác sĩ có thể dựa vào khám lâm sàng để đánh giá nỗ lực hô hấp trong thực hành lâm sàng. Ví dụ, huy động các cơ hô hấp phụ là một dấu hiệu của công hô hấp tăng (32).
Chuyển động của bụng vào bên trong khi hít vào (thở bụng nghịch chiều) có nghĩa là các cơ hô hấp phụ tác dụng lực mạnh hơn cơ hoành, thường được hiểu là dấu hiệu của mỏi cơ hoành (33). Hầu hết bệnh nhân phát triển kiểu thở đặc trưng bởi thể tích khí lưu thông thấp và tần số hô hấp cao trong thời gian mệt mỏi cơ kéo dài (34). Tuy nhiên, những kiểu thở này cho thấy công tăng lên và mệt mỏi sắp xảy ra, nhưng không cho phép đánh giá định lượng về nỗ lực hô hấp (35). Các dạng sóng áp lực và lưu lượng hiển thị trên máy thở cũng không đủ để đánh giá nỗ lực hô hấp trong khi thở được hỗ trợ một phần, vì chúng không thể phân biệt giữa nỗ lực hô hấp của bệnh nhân và công của máy thở (11).
Định lượng dựa trên áp lực của nỗ lực hô hấp
Bởi vì các cơ hô hấp phát huy chức năng của chúng bằng cách tạo ra áp lực, nỗ lực hô hấp có thể được đánh giá bằng cách phân tích các áp lực này. Các yêu cầu và giá trị tham chiếu của đánh giá dựa trên áp lực của nỗ lực hô hấp được tóm tắt trong Bảng 2.
Bảng 2. Kỹ thuật đánh giá nỗ lực hô hấp
|
Kỹ thuật |
Thông số |
Giá trị tham khảo |
Ghi chú |
|
Áp lực
|
Pes, Pga, Pdi |
Pdi và Pes: khác biệt tuyệt đối là 5–10 cmH2O mỗi nhịp thở trên đối tượng khỏe mạnh nghỉ ngơi (10,20,36,37) |
Thích hợp để đánh giá đầu giường mà không cần phần mềm chuyên dụng |
|
Công thở (WOB)
|
Pes, thể tích |
2.4–4 J/min (38,39) và 0.35–0.7 J/L (12,38) trên đối tượng khỏe mạnh nghỉ ngơi |
Đánh giá nỗ lực thở nâng cao. Có thể được chia thành các thành phần đàn hồi, sức cản và PEEP. Khả thi trong thông khí phút và lưu lượng cao. Không nhạy cảm với các cơn co thắt đẳng cự |
|
Phân tích thêm: Ccw, CL,dyn |
|||
|
Pressure- time product (PTP)
|
Pes, Pga, Pdi Phân tích thêm: Ccw, CL,dyn
|
50–150 cmH2O*s/min trên đối tượng khỏe mạnh nghỉ ngơi (23,40,41) |
Đánh giá nỗ lực thở nâng cao |
|
Có thể được chia thành các thành phần đàn hồi, sức cản và PEEP. Nhạy cảm với các cơn co thắt đẳng cự |
|||
|
Tension-time index (TTI)
|
Pes, Pga, Pdi, Pi,max, Ti/Ttot |
0.03 trên đối tượng khỏe mạnh nghỉ ngơi (42) |
Hữu ích để dự đoán liệu nỗ lực quan sát là bền vững. Điều chỉnh khi giảm hiệu quả cơ bắp |
|
TTIdi đến 0.15–0.18 có thể được tiếp tục vô thời hạn (43) |
Pimax có thể khó có được trên bệnh nhân ICU |
Biên độ áp lực (pressure amplitudes)
Nếu có một bóng thực quản và một bóng dạ dày, biên độ dao động của theo nhịp thở của Pes, Pdi và Pga có thể được nghiên cứu trong quá trình thông khí được hỗ trợ một phần bằng cách sử dụng phép tính sau:
ΔP (cmH2O) = P, thở ra (cmH2O) – P, hít vào (cmH2O) [5]
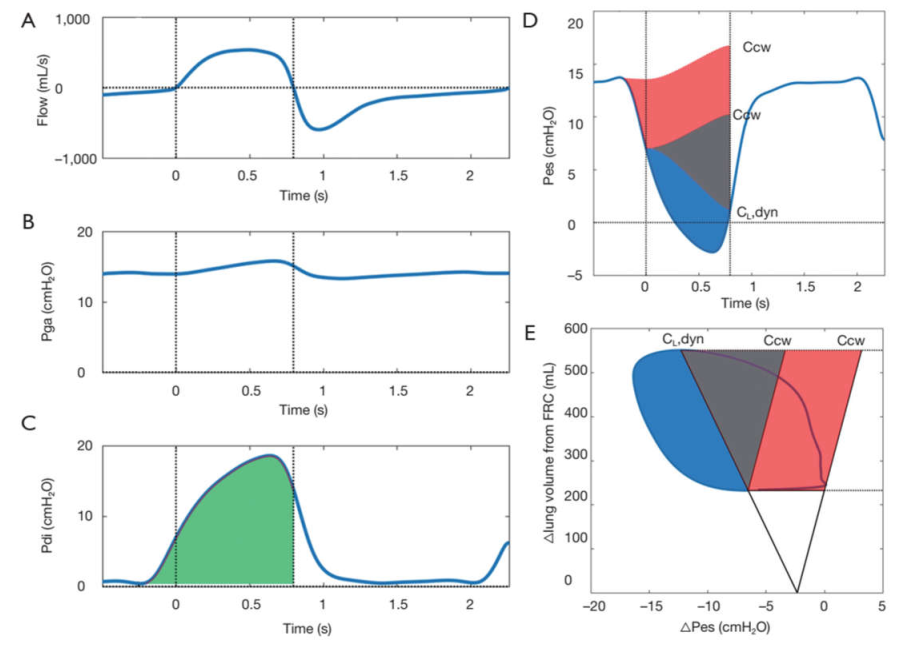
Công thức có thể được sử dụng với Pes, Pga và Pdi để có được sự dao động biên độ tương ứng của chúng trong khi hít vào và thở ra. Nếu cơ hô hấp của bệnh nhân đang hoạt động, Pes sẽ giảm và Pga và Pdi sẽ tăng trong khi hít vào (Hình 2A, B, C, D). Sự gia tăng Pga trong khi thở ra là một dấu hiệu của việc huy động cơ thở ra.
Đánh giá biên độ áp lực tương đối đơn giản và có thể được thực hiện theo thời gian thực tại giường, khiến việc quan sát xu hướng trong bệnh nhân trở nên đặc biệt hữu ích. Tuy nhiên, có một số hạn chế để đánh giá nỗ lực hô hấp chỉ dựa trên dao động của Pes và Pga. Biên độ dao động áp lực bỏ qua thời gian và tần suất của các cơn co thắt. Ngoài ra, dao động thường không được điều chỉnh theo áp lực giật đàn hồi của thành ngực và áp lực dương cuối thì thở ra nội sinh (PEEPi), có thể dẫn đến đánh giá Pmus cả dưới mức và quá cao. Do đó, các phép đo áp lực cho thấy mối tương quan khá kém với chi tiêu năng lượng (35). Phân tích sâu hơn về nỗ lực hô hấp có thể được bảo đảm ở những bệnh nhân bị bệnh nặng được lựa chọn.
PTP (pressure-time product)
Một thông số phức tạp hơn để định lượng nỗ lực hô hấp là PTP. PTP được tính là tích phân theo thời gian của Pmus (12):
PTP = P (cmH2O) × t (s) = ∫ Pdt (cmH2O * s) [6]
PTP thường được báo cáo trong khoảng thời gian 1 phút. PTP của áp lực cơ hô hấp (PTPmus) có thể được xây dựng nếu các phép đo Pes có sẵn như là một đánh giá về hoạt động của cơ hô hấp toàn cục (Hình 2D). Nếu Pga cũng có sẵn, PTP của áp lực cơ hoành (PTPdi) có thể được xây dựng như một phép đo cụ thể của nỗ lực cơ hoành (Hình 2C). Bởi vì PTP nhạy cảm với tần suất và thời gian của các cơn co thắt, nó tương quan tốt với chi tiêu năng lượng trong một phạm vi rộng của tải trọng hô hấp (44). PTP không nhạy cảm với những thay đổi về thể tích, có nghĩa là nó cũng có hiệu lực khi nỗ lực không dẫn đến việc tạo ra thể tích, chẳng hạn như trong các cơn co thắt đẳng cự (isometric). Điều này đặc biệt có liên quan ở bệnh nhân ICU bị PEEPi và tương tác kém với máy thở, điều này thể hiện những nỗ lực không hiệu quả (45). PTP của áp lực thực quản (PTPes) có thể được chia thành các phần để vượt qua các lực đàn hồi, sức cản và ngưỡng (tức là, PEEPi) (Hình 2D). Phân khu này có thể là mối quan tâm lâm sàng ở những bệnh nhân khó cai máy, hoặc theo dõi tác dụng của xử trí máy thở và can thiệp bằng thuốc. Các khía cạnh kỹ thuật của việc đo PTP đã được đề cập gần đây (23,24). Cũng có thể xây dựng PTP của cơ thở ra (PTPex) (46), nhưng kỹ thuật này hiếm khi được sử dụng và giá trị tham chiếu không có sẵn. Cần nhiều nghiên cứu hơn trước khi có thể đưa ra khuyến nghị chung về PTPex.
Có những hạn chế đối với PTP. Thể tích và lưu lượng không được xem xét, mặc dù các cơn co thắt ở lưu lượng cao hơn và thể tích kém hiệu quả hơn và do đó đòi hỏi nhiều nỗ lực hơn. Điều này đã được chứng minh trong các nghiên cứu trong đó các PTP bằng nhau được tạo ra ở các lưu lượng và thể tích khác nhau.
Hình 2
Đánh giá dựa trên áp lực của nỗ lực hô hấp trong giai đoạn hít vào. Các đường đứt nét biểu thị các giai đoạn của lưu lượng bằng không. (A) Dạng sóng lưu lượng; (B) áp lực dạ dày (Pga); (C) áp lực xuyên cơ hoành (Pdi), được tính bằng Pga – Pes. Khu vực màu xanh lá cây là tích số áp lực thời gian (PTP) của cơ hoành trong khi hít vào. Lưu ý sự hiện diện của Pdi trước khi bắt đầu lưu lượng hít vào, một dấu hiệu của PEEP nội tại (PEEPi); (D) theo dõi áp lực thực quản (Pes). Độ giãn nở của thành ngực (Ccw), ước tính khoảng 4% VC, đã được đặt lên trên Pes khi bắt đầu giảm Pes và bắt đầu tạo ra lưu lượng hít vào (đường thẳng đứng đầu tiên), cùng với độ giãn nở phổi động (CL, dyn). Vùng màu cho thấy ảnh hưởng đến tổng PTP của áp lực cơ hô hấp (Pmus). Vùng màu đỏ là PTP được quy cho PEEPi, vùng màu xám biểu thị PTP đàn hồi và vùng màu xanh biểu thị PTP sức cản; (E) đường cong thể tích áp lực của Pes và thể tích phổi. Ccw và CL, dyn giao nhau tại FRC. Vùng màu đỏ đại diện cho WOB được gán cho PEEPi, vùng màu xám biểu thị WOB đàn hồi và vùng màu xanh biểu thị WOB sức cản. PEEP, áp lực dương cuối thì thở ra; FRC, dung tích cặn chức năng; VC, năng lực dung tích sống.
Điều này dẫn đến mức độ khác nhau của chi phí oxy của hơi thở ở các PTP bằng nhau (44,47). Hơn nữa, tính toán PTPmus đòi hỏi phải đo Ccw, điều này rất khó khăn ở bệnh nhân khi thở máy được hỗ trợ một phần vì nó đòi hỏi bơm phồng thụ động và dùng thuốc liệt cơ (12). Mặc dù có những hạn chế này, PTP rất hữu ích vì nó liên quan tuyến tính đến hoạt động và chi tiêu năng lượng của bơm cơ hô hấp trong quá trình thông khí tương đối liên tục. Điều này đã được chứng minh trong các điều kiện lưu lượng dưới 1 L/s (48) và chu kỳ thở trong khoảng 0,3 đến 0,6 (44), áp dụng cho hầu hết bệnh nhân ICU (36).
Chỉ số áp lực – thời gian (TTI, Tension-time index)
Một phương pháp khác để đánh giá nỗ lực hô hấp là TTI, liên quan đến áp lực hít vào trung bình (Pi, trung bình) so với áp lực hít vào tối đa (Pi, max) mà bệnh nhân có thể tạo ra:
TTI = (Pi, trung bình/Pi, tối đa) * (Ti/Ttot) [7]
Trong đó Pi, trung bình có thể là Pdi, trung bình hoặc Pmus, trung bình và Ti/Ttot là tỷ lệ thời gian hít vào trong một chu kỳ hơi thở đầy đủ. Ví dụ: tạo Pdi, trung bình bằng 30% Pi, tối đa ở chu kỳ thở 0,5 sẽ mang lại TTI cơ hoành (TTIdi) là 0,15. Một số máy thở có thể tính toán Pi, trung bình trong một khoảng thời gian của một vài hơi thở. Ngoài ra, có thể lấy Pi, trung bình bằng cách chia PTP hít vào cho giai đoạn lấy mẫu (12). Ưu điểm của TTI so với các chỉ số khác là TTI điều chỉnh một phần việc giảm hiệu quả và yếu cơ bằng cách liên quan đến áp lực quan sát được với áp lực tối đa. TTI tương quan tốt với mức tiêu thụ oxy của bơm cơ hô hấp (43,44). TTI cũng tương quan với thời gian một tải trọng nhất định có thể được duy trì bởi cơ hoành. Ở những người khỏe mạnh, TTIdi dưới 0,15-0,18 có thể được duy trì thời gian lâu, trong khi giá trị cao hơn cuối cùng sẽ dẫn đến mệt mỏi và suy hô hấp (43,49).
Có một số hạn chế về kỹ thuật và lý thuyết của TTI. Về mặt kỹ thuật, rất khó để có được Pi đáng tin cậy, các phép đo tối đa ở bệnh nhân bị bệnh nặng vì nó đòi hỏi nỗ lực tự nguyện tối đa bị cản trở bởi thuốc an thần và sự cố gắng (12). Hơn nữa, TTI không tính đến thể tích và lưu lượng. Điều này đã được minh họa trong hai nghiên cứu trong đó TTIdi tối đa dao động từ 0,11 đến 0,22 và TTI tối đa của cơ hô hấp (TTImusc) dao động từ 0,16 đến 0,32 trong cùng một đối tượng, tùy thuộc vào lưu lượng, thể tích và chu kỳ thở (50,51) . Mặc dù có những hạn chế này, TTI là một thông số hữu ích về mặt lâm sàng đặc biệt là để đánh giá xem một tải trọng đặt trên máy bơm cơ hô hấp bệnh nhân có duy trì ổn định hay không.
Công thở – WOB (work of breathing)
Phương pháp cổ điển để đánh giá nỗ lực hô hấp là WOB. Công được thực hiện khi một lực di chuyển điểm ứng dụng của nó qua một khoảng cách. Trong trường hợp công của hệ hô hấp được thực hiện khi áp lực thay đổi thể tích của hệ thống (26).
WOB = P (cmH2O) × V (L) = ∫ P dv (J) [8]
WOB thường được báo cáo là công trên một lít (J/L), thu được bằng cách chia công trong mỗi chu kỳ thở cho thể tích khí lưu thông. Công tăng trên mỗi lít có nghĩa là cần nhiều áp lực hơn để tạo ra một thể tích bằng nhau. Điều này có thể được gây ra bởi một số yếu tố, chẳng hạn như giảm độ giãn nở phổi hoặc sự hiện diện của PEEPi (52). Có thể phân tích chi tiết WOB bằng sơ đồ Campbell để phân chia công thành các thành phần sức cản, đàn hồi và PEEPi (Hình 2E) (23,26,52). Hơn nữa, WOB của các cơ thở ra có thể được đánh giá bằng cách gán bất kỳ Pes quan sát nào trên đường cong Ccw cho hoạt động của cơ thở ra.
Ngoài ra, công trên mỗi chu kỳ thở có thể được nhân với tần số thở (số hơi thở mỗi phút) để có được năng lượng của nhịp thở (power of breathing) hoặc tốc độ làm việc (work rate) (12). Đây là một tham số thú vị từ quan điểm sinh lý, vì nó kết hợp kích thước thời gian và thể tích. Tốc độ làm việc tương quan chặt chẽ với mức tiêu thụ oxy của cơ hô hấp trong một loạt các lưu lượng, thể tích và chu kỳ thở (44,47). Đã có đề xuất rằng tốc độ làm việc, hoặc năng lượng cơ học (mechanical power), là một yếu tố thống nhất có thể dự đoán sự phát triển của tổn thương phổi do máy thở (VILI) (53,54).
Có những hạn chế đối với WOB. Đầu tiên, vì công chỉ được thực hiện khi thể tích bị dịch chuyển, WOB không nhạy cảm với các cơn co thắt đẳng cự. Thứ hai, thời gian và tần suất của các cơn co thắt cũng không được xem xét. Ví dụ, cùng một hơi thở có thể tạo ra cùng một thể tích khí lưu thông tại cùng một Pes, nhưng có thể mất gấp đôi thời gian. Công sẽ không khác nhau giữa hai hơi thở này, mặc dù hơi thở dài hơn sẽ tiêu tốn nhiều năng lượng hơn.
Bảng 3. Các thông số, giá trị tham khảo và nhận xét về đánh giá điện cơ học của nỗ lực hô hấp
|
Kỹ thuật |
Thông số |
Giá trị tham khảo |
Ghi chú |
|
Hoạt động điện cơ hoành (EAdi) |
EAdi trong khi hít vào và thở ra |
Biên độ 5–20 µV mỗi nhịp thở ở BN ICU (ý kiến chuyên gia) |
Thông số của trung khu hô hấp. Cho phép đánh giá tương tác máy thở – bệnh nhân |
|
Chỉ số hiệu quả thần kinh cơ (NME) |
EAdi, Pes, Pga |
0.5–2 cmH2O/µV ở BN ICU (ý kiến chuyên gia) |
Thông số hiệu quả của cơ |
|
Đóng góp hơi thở bệnh nhân (PVBC) |
EAdi và Vt trong thời gian thở hỗ trợ và không hỗ trợ |
Không có sẳn |
Không xác nhận trong đoàn hệ ICU lớn |
|
Điện cơ bề mặt |
Hoạt động điện của các điện cực bề mặt trong khi hít vào và thở ra |
Không có sẳn |
Không xâm lấn, nhưng bị cản trở bởi tương tác chéo giữa các cơ lân cận và các nhiễu do chuyển động |
Bảng 4. Các thông số, giá trị tham khảo và ý kiến đánh giá siêu âm của nỗ lực hô hấp
|
Kỹ thuật |
Thông số |
Giá trị tham khảo |
Ghi chú |
|
Độ dày cơ hoành (Tdi) |
Độ dày cơ hoành cuối kỳ thở ra |
1.5–2.4 mm (55,56) ở cuối kỳ thở ra |
Không xâm lấn và hữu ích để đánh giá sự phát triển của teo cơ. Không phải là một phép đo nỗ lực. Cơ hoành trái có thể khó siêu âm |
|
Tỷ lệ độ dày (TFdi) |
TFdi = (Tdi,ei − Tdi,ee)/Tdi,ee |
24–53% trong thời gian thở tĩnh (57), tăng lên 157% khi thở gằng sức (58) |
Không cho phép định lượng trực tiếp áp lực cơ |
|
Dịch chuyền lên xuống |
M-mode của sự dịch chuyển cơ hoành trong mỗi nhịp thở |
1.6–1.8 cm trong thời gian thở tĩnh, tăng lên 7.5 cm trong khi thở sâu (59) |
Không thể phân biệt công của bệnh nhân với công máy thở trong khi thông khí được hỗ trợ một phần |
Các phương pháp khác để định lượng nỗ lực hô hấp
Các kỹ thuật khác để định lượng nỗ lực hô hấp không phụ thuộc vào đánh giá trực tiếp áp lực đã được phát triển, bao gồm hoạt động điện của cơ hoành (Eadi, electrical activity of the diaphragm) và siêu âm. Xem Bảng 3,4 để biết chi tiết, bao gồm các giá trị tham chiếu về các kỹ thuật này.
Điện cơ hô hấp
Kiểm soát thần kinh của nỗ lực hô hấp được kết hợp chặt chẽ với nhu cầu hô hấp của cơ thể. Như vậy, cả điện cực bề mặt và điện cực đặt trên ống thông mũi dạ dày đã được sử dụng để thu được tín hiệu điện cơ của cơ hô hấp để đánh giá nỗ lực hô hấp trong nghiên cứu và chăm sóc lâm sàng.
Các điện cực bề mặt đã được sử dụng để đo hoạt động của cơ hoành, cơ hô hấp phụ và cơ thở ra. Mặc dù không xâm lấn, chất lượng của các bản ghi có thể bị suy giảm nghiêm trọng khi tương tác chéo giữa các cơ lân cận và các yếu tố khác như mỡ dưới da, phù và các nhiễu do chuyển động (60,61). Hơn nữa, không có quy trình chuẩn hóa để đặt và phân tích tín hiệu điện cực bề mặt và không có giá trị tham chiếu đáng tin cậy nào. Do đó, cần nghiên cứu thêm trước khi kỹ thuật này có thể được sử dụng để định lượng nỗ lực hô hấp trong chăm sóc lâm sàng.
Tín hiệu EAdi giải tỏa một số khó khăn kỹ thuật của điện cơ bề mặt. Tín hiệu EAdi có thể được theo dõi theo thời gian thực bằng cách sử dụng ống thông dạ dày chuyên dụng với các điện cực có dây được đặt ở cấp độ của cơ hoành (Hình 1) (62). Ống thông này ban đầu được thiết kế để điều khiển máy thở ở chế độ thông gió cụ thể [hỗ trợ thông khí điều chỉnh tự nhiên (NAVA, neurally adjusted ventilatory assist)], nhưng các báo cáo gần đây cho thấy các bản ghi EAdi rất hữu ích để theo dõi nỗ lực hô hấp và tương tác máy thở – bệnh nhân (63-65). Việc đo EAdi thường không yêu cầu các thủ tục xâm lấn bổ sung vì hầu hết bệnh nhân ICU thở máy đều được gắn ống nuôi dưỡng để chăm sóc thường xuyên. Các điện cực có được sự tổng hợp không gian và thời gian của các điện thế tác động từ các đơn vị vận động trong cơ hoành. Có một mối tương quan chặt chẽ giữa hoạt động điện từ các bộ phận cơ bản và chi phí của cơ hoành (66). Hơn nữa, tín hiệu EAdi độc lập với những thay đổi về thể tích phổi (67). EAdi tương quan tốt với Pdi ở những người khỏe mạnh và bệnh nhân ICU (67). Do đó, EAdi dường như là một ước tính đáng tin cậy về hoạt động cơ hoành toàn cục ở bệnh nhân ICU (68-70).
Hoạt động điện không đồng nghĩa với co cơ và tạo lực. Sự kết hợp giữa hoạt động điện và áp lực được biểu thị bằng chỉ số hiệu quả thần kinh cơ (NME, neuromuscular efficiency index):
NME (cmH2O/PhaV) = Pdi (cmH2O)/EAdi (PhaV) [9]
NME có thể được sử dụng để tính áp lực từ EAdi khi giả sử khớp nối không đổi theo thời gian. NME thu được trong quá trình thở ra và nhân với EAdi quan sát được dường như là một ước tính đáng tin cậy của Pmus trong các điều kiện khác nhau của hỗ trợ máy thở (9). Một chỉ số khác có nguồn gốc từ EAdi là sự đóng góp của bệnh nhân vào hơi thở của máy thở (PVBC, patient-ventilator breath contribution). PVBC ước tính sự đóng góp tương đối của bệnh nhân vào việc tạo ra thể tích khí lưu thông trong NAVA bằng cách so sánh các đỉnh EAdi với thể tích khí lưu thông trong hơi thở được hỗ trợ và không được hỗ trợ (71). PVBC đáng tin cậy dự đoán tỷ lệ nỗ lực hô hấp của bệnh nhân trong một nhóm nhỏ bệnh nhân ARDS (72).
Mặc dù đầy hứa hẹn, vẫn còn những hạn chế của các thông số có nguồn gốc EAdi để đánh giá nỗ lực hô hấp. Các thông số có nguồn gốc EAdi không nhất thiết là thước đo trực tiếp của nỗ lực hô hấp, nhưng có liên quan chặt chẽ hơn với trung khu kiểm soátthần kinh. EAdi không nhạy cảm với việc huy động các cơ hô hấp phụ, khiến nó không phù hợp để đánh giá nỗ lực hô hấp ở công thở cao. Hơn nữa, các giá trị tham chiếu cho các tham số có nguồn gốc EAdi vẫn chưa được biết. Các chỉ số NME và PVBC cần được đánh giá thêm ở các quần thể ICU lớn hơn trước khi cả hai chỉ số có thể được thực hiện rộng rãi trong thực hành lâm sàng hàng ngày.
Siêu âm
Siêu âm đã trở nên phổ biến như một công cụ chẩn đoán trong quản lý và nghiên cứu lâm sàng trong ICU (14). Vai trò của siêu âm để đánh giá chức năng và nỗ lực của cơ hô hấp đã được thảo luận trong các bài báo gần đây (65,73). Các thành phần của bơm cơ hô hấp, bao gồm cơ hoành, cơ thành bụng và cơ hô hấp phụ, được định vị tương đối nông và có thể dễ dàng truy cập để siêu âm. Thay đổi độ dày tuyệt đối của cơ hô hấp theo thời gian trong một bệnh nhân có thể được sử dụng để nhận biết sự phát triển của teo cơ (2,74,75). Phần dày của cơ hoành (TFdi) trong khi hít vào có thể được sử dụng như một thước đo hoạt động co thắt cơ (76,77). Điều này đòi hỏi phải đo độ dày cơ hoành (Tdi) cuối thì thở ra (Tdi, ee) và cuối thì hít vào (Tdi, ei) (73):
TFdi = (Tdi, ei – Tdi, ee)/Tdi, ee * 100% [10]
TFdi đã cho thấy mối tương quan tốt với Pdi (78), PTPdi và PTPes (76,77) trong một số nghiên cứu, nhưng không tương quan đáng kể với Pdi trong một nghiên cứu khác (55). Chuyển động của vòm hoành trong khi hít vào cũng đã được sử dụng để đánh giá chức năng cơ hoành và các giá trị tham chiếu có sẵn (Bảng 4). Để nghiên cứu chuyển động cơ hoành, đầu dò siêu âm được đặt ở vị trí dưới lồng ngực, sử dụng gan làm cửa sổ ở bên phải và lá lách ở bên trái. Trái ngược với TFdi, việc đánh giá chuyển động cơ hoành chỉ nên được tiến hành ở những bệnh nhân bị ngắt kết nối với máy thở, vì sự trợ giúp của máy thở sẽ dẫn đến chuyển động của cơ hoành, ngay cả ở bệnh nhân dùng thuốc ức chế thần kinh cơ. Như vậy, có một mối tương quan yếu giữa chuyến động cơ hoành và TFdi, PTPes và PTPdi trong quá trình thông khí được hỗ trợ một phần (77).
Ưu điểm của siêu âm bao gồm bản chất không xâm lấn, chi phí thấp, đường cong học tập dốc và tính toán đơn giản cho phép đánh giá đầu giường về nỗ lực hô hấp (73). Tuy nhiên, một số hạn chế về kỹ thuật và phương pháp áp dụng để đánh giá siêu âm nỗ lực hô hấp. Bởi vì cơ hoành rất mỏng, các lỗi nhỏ trong đo lường có thể dẫn đến sự đánh giá quá cao và đánh giá thấp độ dày và phần dày (73). Ngoài ra, phân nữa cơ hoành bên trái khó hình dung hơn bên phải (78). Hơn nữa, TFdi không nhạy cảm với thời gian và tần suất của các cơn co thắt và không tính đến việc huy động cơ hô hấp phụ (59). Mặc dù có những hạn chế này, siêu âm là một kỹ thuật rất hứa hẹn trong chăm sóc lâm sàng, đặc biệt là một công cụ đánh giá đầu giường.
Ý nghĩa lâm sàng
Mặc dù đánh giá nỗ lực hô hấp đã được áp dụng trong nghiên cứu sinh lý và nghiên cứu lâm sàng trong nhiều thập kỷ, nhưng phạm vi nỗ lực hô hấp tối ưu ở bệnh nhân bị bệnh nặng vẫn chưa được thiết lập. Các thử nghiệm so sánh các mức độ nỗ lực khác nhau đã không được công bố cho đến nay. Do đó, chúng tôi phụ thuộc vào các nguyên tắc sinh lý và lý luận để hướng dẫn thông khí bảo vệ phổi và cơ hoành (79).
Nỗ lực hô hấp không đủ
Các nghiên cứu trong thập kỷ vừa qua đã thúc đẩy ý tưởng rằng nỗ lực hô hấp không đủ dẫn đến teo và yếu cơ hoành, một quá trình gọi là rối loạn chức năng cơ hoành do máy thở (VIDD, ventilator-induced diaphragm dysfunction) (80,81). Ví dụ, teo cơ hoành đáng kể đã được quan sát sau khi không hoạt động hoàn toàn của cơ hoành trong 18 đến 69 giờ ở những người hiến tạng chết não (1). Các nghiên cứu sau đó đã chứng minh rằng teo cơ hoành cũng xảy ra trong quá trình thông khí được hỗ trợ một phần (8285), và mức độ teocơ có liên quan đến mức độ hỗ trợ của máy thở (2). Gần đây, sự phát triển của teo cơ hoành có liên quan đến việc nhập viện ICU kéo dài và tăng nguy cơ biến chứng (86), hỗ trợ thêm cho ý tưởng hỗ trợ máy thở quá mức và VIDD.
Các yếu tố bổ sung có thể đóng một vai trò trong sự phát triển của yếu cơ và teo cơ ở bệnh nhân ICU bao gồm viêm (87), thuốc độc cơ (88), thiếu dinh dưỡng và trạng thái dị hóa (89). Thuật ngữ yếu cơ hoành liên quan đến bệnh nghiêm trọng (CIADW, illness-associated diaphragm weakness) hiện được ưa thích hơn VIDD để mô tả tình trạng yếu cơ hô hấp ở bệnh nhân bị bệnh nặng (90). Đáng chú ý, các nghiên cứu lâm sàng đã chỉ ra rằng thuốc ức chế thần kinh cơ được sử dụng trong 48 giờ đầu tiên từ ARDS vừa đến nặng giúp cải thiện kết quả mà không phát triển yếu cơ liên quan đến lâm sàng (4,91-93). Gần đây, nó đã được quan sát thấy rằng bệnh nhân thở máy kiểm soát hỗ trợ thường xuyên biểu hiện các cơn co thắt của cơ hoành, một loại không đồng bộ được gọi là kích hoạt đảo ngược (94). Cơ chế này ngăn chặn sự bất hoạt hoàn toàn của cơ hoành và có thể cản trở sự phát triển của bệnh teo cơ trong quá trình thông khí được kiểm soát. Thật vậy, các phiên ngắn hàng ngày của nhịp độ tần số thấp ngăn ngừa sự phát triển của bệnh teo cơ ở cơ xương ngoại biên của bệnh nhân ICU (95,96). Trong một nghiên cứu trường hợp trên một bệnh nhân duy nhất được thở máy có kiểm soát trong tám tháng, việc tạo kích thích điện cơ tần số thấp một lần 30 phút mỗi ngày đã ngăn chặn sự phát triển của bệnh teo cơ lan tòa của cơ vân do không sử dụng ở bệnh nhân ICU(97). Mặc dù nghiên cứu sâu hơn cần được tiến hành, có thể các mức dưới nỗ lực hô hấp nghỉ ngơi có thể ngăn ngừa sự phát triển của bệnh teo cơ do khộng sử dụng (40).
Nỗ lực hô hấp quá mức
Ngăn chặn nỗ lực hô hấp quá mức bằng cách dỡ các cơ hô hấp là nền tảng của thở máy. Nỗ lực quá mức có thể gây bất lợi cho cơ học phổi và chức năng của bơm cơ hô hấp.
Ảnh hưởng có hại đến phổi
Những nỗ lực mạnh mẽ có thể tạo ra áp lực màng phổi âm tính đáng kể (98), có khả năng dẫn đến PL cao gây tổn thương ở bệnh nhân thở máy (7,99-101). Vì vậy, nên giữ mức cực đại PL dưới 25 cmH2O và biên độ khí lưu thông dao động dưới 12 cmH2O dựa trên các nguyên tắc sinh lý của ứng suất (stress) và biến dạng (strain) (23.102). Hơn nữa, nỗ lực của bệnh nhân mạnh mẽ có thể dẫn đến sự đồng bộ kém với máy thở và làm suy yếu quá trình oxy hóa và sự thoải mái (103), cần phải an thần và liệt cơ (91). Ppl giảm có thể gây ra sự dịch chuyển không khí trong phổi từ không phụ thuộc vào các vùng phụ thuộc (Pendelluft), có khả năng dẫn đến tổn thương phế nang quá mức và vỡ (3). Ngoài ra, Ppl giảm do nỗ lực mạnh mẽ của bệnh nhân làm tăng áp lực xuyên thành mạch máu và có thể dẫn đến tưới máu phổi tăng cao và phát triển phù phế nang (22,23). Tăng hoạt động của các cơ hô hấp có thể dẫn đến tăng Ppl trong khi thở ra. Nếu Ppl cao hơn áp lực phế nang (Palv) thì phế nang có xu hướng sụp đổ, thúc đẩy quá trình xẹp phổi và có thể huy động phế nang theo chu kỳ (atelectrauma) (99-104). Có thể các tác dụng có lợi của thuốc giãn cơ trong quá trình điều trị ARDS sớm có thể được quy cho việc ngăn ngừa nỗ lực cơ hô hấp quá mức (4,92,93), mặc dù nỗ lực không được đo lường trong các nghiên cứu này.
Tác dụng bất lợi cho cơ hô hấp
Nỗ lực hô hấp quá mức có thể kích thích các cơn co thắt bất thường của các nhóm cơ đối kháng, ví dụ như kích hoạt đồng thời cơ hoành và cơ bụng. Các cơn co thắt lệch tâm đã được tìm thấy gây ra sự gián đoạn sarcolemmal và viêm ở mức độ vi mô trong mô hình động vật (105,106). Hơn nữa, sự gián đoạn sarcolemmal đã được quan sát thấy trong các mô hình động vật thở máy sau nỗ lực hô hấp cao (107-109) và ở bệnh nhân mắc COPD (110). Xâm nhập các tế bào viêm đã được quan sát thấy trong các sợi cơ hoành thu được từ bệnh nhân ICU thở máy (83). Ngoài ra, các bệnh nhân thể hiện những nỗ lực cao được đánh giá bằng siêu âm cơ hoành cho thấy Tdi tăng theo thời gian, có thể là dấu hiệu của viêm cơ và/hoặc chấn thương (2). Tuy nhiên, cả hai nghiên cứu đều quan sát, do đó, liệu nỗ lực hô hấp mạnh mẽ có dẫn đến tổn thương sarcolem ở bệnh nhân bị bệnh nghiêm trọng hay không, và ở mức độ nỗ lực này xảy ra, cần nghiên cứu thêm.
Nỗ lực phù hợp trong các giai đoạn khác nhau của bệnh
Dựa trên những cân nhắc đã nói ở trên, chúng tôi khuyên bạn nên theo dõi nỗ lực hô hấp ở những bệnh nhân thở máy được lựa chọn (65,111). Trong giai đoạn đầu của bệnh hô hấp, hoạt động trung khu hô hấp có thể quá mức, dẫn đến co thắt cơ hô hấp gây tổn thương và làm tổn thương PL, đặc biệt là trong ARDS (98). Trong giai đoạn đầu này, nỗ lực cao xảy ra trong môi trường cống lại cơ hô hấp, đặc trưng bởi viêm hệ thống và cục bộ. Điều hợp lý là ưu tiên dỡ tải các cơ hô hấp để ngăn ngừa tổn thương phổi và rối loạn chức năng cơ hoành trong các điều kiện này (7,79). Sử dụng chế độ được hỗ trợ một phần để lấy lại hoạt động hô hấp của bệnh nhân là điều nên làm sau giai đoạn đầu của bệnh nặng, mặc dù vẫn cần phải nỗ lực hết sức (79,101). Chiến lược này có khả năng cho phép thông khí đồng thời bảo vệ phổi và cơ hoành.
Kết luận
Cả hỗ trợ máy thở quá mức và hỗ trợ dưới mức có thể có tác dụng phụ đối với chức năng cơ hô hấp. Như đã nêu trong tổng quan này, mức độ nỗ lực của cơ hô hấp mong muốn phụ thuộc vào đặc điểm của bệnh nhân, đặc biệt là giai đoạn bệnh nặng và đầu ra cơ học của cơ hô hấp. Định lượng nỗ lực hô hấp đòi hỏi kỹ thuật theo dõi và tính toán cụ thể. Đây là một lĩnh vực đang phát triển và các nghiên cứu mới sẽ giúp chúng tôi xác định rõ hơn mức độ hoạt động cơ hô hấp tối ưu ở bệnh nhân ICU. Thực tế là chúng tôi không có nghiên cứu lâm sàng để chứng minh rằng việc theo dõi chức năng cơ hô hấp giúp cải thiện kết quả. Các thử nghiệm lâm sàng trong tương lai sẽ cung cấp dữ liệu nếu quản lý máy thở hướng dẫn về nỗ lực hô hấp giúp cải thiện kết quả của bệnh nhân bị bệnh nặng.
References
Levine S, Nguyen T, Taylor N, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med 2008;358:1327-35. 10.1056/NEJMoa070447 [PubMed] [CrossRef] [Google Scholar]
Goligher EC, Fan E, Herridge MS, et al. Evolution of diaphragm thickness during mechanical ventilation:Impact of inspiratory effort. Am J Respir Crit Care Med 2015;192:1080-8. 10.1164/rccm.201503-0620OC [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Uchiyama A, Fujino Y. The role of spontaneous effort during mechanical ventilation:Normal lung versus injured lung. J Intensive Care 2015;3:18. 10.1186/s40560-015-0083-6 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Papazian L, Forel JM, Gacouin A, et al. Neuromuscular Blockers in Early Acute Respiratory Distress Syndrome. N Engl J Med 2010;363:1107-16. 10.1056/NEJMoa1005372 [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Fujino Y, Amato MBP, et al. Fifty Years of Research in ARDS. Spontaneous Breathing during Mechanical Ventilation. Risks, Mechanisms, and Management. Am J Respir Crit Care Med 2017;195:985-92. 10.1164/rccm.2016040748CP [PubMed] [CrossRef] [Google Scholar]
Putensen C, Zech S, Wrigge H, et al. Long-term effects of spontaneous breathing during ventilatory support in patients with acute lung injury. Am J Respir Crit Care Med 2001;164:43-9. 10.1164/ajrccm.164.1.2001078 [PubMed] [CrossRef] [Google Scholar]
Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med 2017;195:438-42. 10.1164/rccm.201605-1081CP [PubMed] [CrossRef] [Google Scholar]
Goligher EC, Ferguson ND, Brochard LJ. Clinical challenges in mechanical ventilation. Lancet 2016;387:1856-66. 10.1016/S0140-6736(16)30176-3 [PubMed] [CrossRef] [Google Scholar]
Bellani G, Mauri T, Coppadoro A, et al. Estimation of Patient’s Inspiratory Effort From the Electrical Activity of the Diaphragm*. Crit Care Med 2013;41:1483-91. 10.1097/CCM.0b013e31827caba0 [PubMed] [CrossRef] [Google Scholar]
Carteaux G, Mancebo J, Mercat A, et al. Bedside Adjustment of Proportional Assist Ventilation to Target a Predefined Range of Respiratory Effort*. Crit Care Med 2013;41:2125-32. 10.1097/CCM.0b013e31828a42e5 [PubMed] [CrossRef] [Google Scholar]
Colombo D, Cammarota G, Alemani M, et al. Efficacy of ventilator waveforms observation in detecting patientventilator asynchrony*. Crit Care Med 2011;39:2452-7. 10.1097/CCM.0b013e318225753c [PubMed] [CrossRef] [Google Scholar]
American Thoracic Society/European Respiratory Society ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med 2002;166:518-624. 10.1164/rccm.166.4.518 [PubMed] [CrossRef] [Google Scholar]
Bellani G, Laffey JG, Pham T, et al. Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries. JAMA 2016;315:788-800. 10.1001/jama.2016.0291 [PubMed] [CrossRef] [Google Scholar]
Zambon M, Greco M, Bocchino S, et al. Assessment of diaphragmatic dysfunction in the critically ill patient with ultrasound:a systematic review. Intensive Care Med 2017;43:29-38. 10.1007/s00134-016-4524-z [PubMed] [CrossRef] [Google Scholar]
Grimby G, Goldman M, Mead J. Respiratory muscle action inferred from rib cage and abdominal V-P partitioning. J Appl Physiol 1976;41:739-51. 10.1152/jappl.1976.41.5.739 [PubMed] [CrossRef] [Google Scholar]
Troyer AD, Wilson TA. Action of the diaphragm on the rib cage. J Appl Physiol (1985) 2016;121:391-400. [PubMed] [Google Scholar]
Mead J. Functional significance of the area of apposition of diaphragm to rib cage. Am Rev Respir Dis 1979;119:31-2. [PubMed] [Google Scholar]
De Troyer A, Estenne M. Functional anatomy of the respiratory muscles. Clin Chest Med 1988;9:175-93. [PubMed] [Google Scholar]
Hess DR. Respiratory Mechanics in Mechanically Ventilated Patients. Respir Care 2014;59:1773-94. 10.4187/respcare.03410 [PubMed] [CrossRef] [Google Scholar]
Laporta D, Grassino A. Assessment of transdiaphragmatic pressure in humans. J Appl Physiol 1985;58:1469-76. 10.1152/jappl.1985.58.5.1469 [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Amato MBP, Grieco DL, et al. Esophageal Manometry and Regional Transpulmonary Pressure in Lung Injury. Am J Respir Crit Care Med 2018;197:1018-26. 10.1164/rccm.201709-1806OC [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Brochard L. Ten tips to facilitate understanding and clinical use of esophageal pressure manometry. Intensive Care Med 2018;44:220-2. 10.1007/s00134-017-4906-x [PubMed] [CrossRef] [Google Scholar]
Mauri T, Yoshida T, Bellani G, et al. Esophageal and transpulmonary pressure in the clinical setting:meaning, usefulness and perspectives. Intensive Care Med 2016;42:1360-73. 10.1007/s00134-016-4400-x [PubMed] [CrossRef] [Google Scholar]
Akoumianaki E, Maggiore SM, Valenza F, et al. The application of esophageal pressure measurement in patients with respiratory failure. Am J Respir Crit Care Med 2014;189:520-31. 10.1164/rccm.201312-2193CI [PubMed] [CrossRef] [Google Scholar]
De Troyer A, Boriek AM. Mechanics of the respiratory muscles. Compr Physiol 2011;1:1273-1300. [PubMed] [Google Scholar]
Tobin MJ. Principles and Practise of Intensive Care Monitoring. 1st edition. The McGraw-Hill Companies, Inc., 1997. [Google Scholar]
Grinnan DC, Truwit JD. Clinical review: Respiratory mechanics in spontaneous and assisted ventilation. Crit Care 2005;9:472-84. 10.1186/cc3516 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
De Troyer A, Estenne M, Ninane V, et al. Transversus abdominis muscle function in humans. J Appl Physiol 1990;68:1010-6. 10.1152/jappl.1990.68.3.1010 [PubMed] [CrossRef] [Google Scholar]
Ninane V, Rypens F, Yernault JC, et al. Abdominal muscle use during breathing in patients with chronic airflow obstruction. Am Rev Respir Dis 1992;146:16-21. 10.1164/ajrccm/146.1.16 [PubMed] [CrossRef] [Google Scholar]
Dodd DS, Brancatisano T, Engel LA. Chest wall mechanics during exercise in patients with severe chronic air-flow obstruction. Am Rev Respir Dis 1984;129:33-8. [PubMed] [Google Scholar]
Smith J, Bellemare F. Effect of lung volume on in vivo contraction characteristics of human diaphragm. J Appl Physiol 1987;62:1893-900. 10.1152/jappl.1987.62.5.1893 [PubMed] [CrossRef] [Google Scholar]
Aliverti A, Cala SJ, Duranti R, et al. Human respiratory muscle actions and control during exercise. J Appl Physiol 1997;83:1256-69. 10.1152/jappl.1997.83.4.1256 [PubMed] [CrossRef] [Google Scholar]
Cohen CA, Zagelbaum G, Gross D, et al. Clinical manifestations of inspiratory muscle fatigue. Am J Med 1982;73:308-16. 10.1016/0002-9343(82)90711-2 [PubMed] [CrossRef] [Google Scholar]
Yang KL, Tobin MJ. A Prospective Study of Indexes Predicting the Outcome of Trials of Weaning from Mechanical Ventilation. N Engl J Med 1991;324:1445-50. 10.1056/NEJM199105233242101 [PubMed] [CrossRef] [Google Scholar]
Banner MJ, Kirby RR, Kirton OC, et al. Breathing frequency and pattern are poor predictors of work of breathing in patients receiving pressure support ventilation. Chest 1995;108:1338-44. 10.1378/chest.108.5.1338 [PubMed] [CrossRef] [Google Scholar]
Jubran A, Tobin MJ. Pathophysiologic basis of acute respiratory distress in patients who fail a trial of weaning from mechanical ventilation. Am J Respir Crit Care Med 1997;155:906-15. 10.1164/ajrccm.155.3.9117025 [PubMed] [CrossRef] [Google Scholar]
Sassoon CS, Light RW, Lodia R, et al. Pressure-time product during continuous positive airway pressure, pressure support ventilation, and T-piece during weaning from mechanical ventilation. Am Rev Respir Dis 1991;143:469-75. 10.1164/ajrccm/143.3.469 [PubMed] [CrossRef] [Google Scholar]
Mancebo J, Isabey D, Lorino H, et al. Comparative effects of pressure support ventilation and intermittent positive pressure breathing (IPPB) in non-intubated healthy subjects. Eur Respir J 1995;8:1901-9. 10.1183/09031936.95.08111901 [PubMed] [CrossRef] [Google Scholar]
Ballantine T V, Proctor HJ, Broussard ND, et al. The work of breathing: potential for clinical application and the results of studies performed on 100 normal males. Ann Surg 1970;171:590-4. 10.1097/00000658-197004000-00017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Tobin MJ, Laghi F, Jubran A. Narrative review: ventilator-induced respiratory muscle weakness. Ann Intern Med 2010;153:240-5. 10.7326/0003-4819-153-4-201008170-00006 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Brochard L, Martin GS, Blanch L, et al. Clinical review: Respiratory monitoring in the ICU – a consensus of 16. Crit Care 2012;16:219. 10.1186/cc11146 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Banner MJ. Respiratory muscle loading and the work of breathing. J Cardiothorac Vasc Anesth 1995;9:192-204. 10.1016/S1053-0770(05)80195-8 [PubMed] [CrossRef] [Google Scholar]
Field S, Sanci S, Grassino A. Respiratory muscle oxygen consumption estimated by the diaphragm pressure-time index. J Appl Physiol 1984;57:44-51. 10.1152/jappl.1984.57.1.44 [PubMed] [CrossRef] [Google Scholar]
Collett PW, Perry C, Engel LA. Pressure-time product, flow, and oxygen cost of resistive breathing in humans. J Appl Physiol 1985;58:1263-72. 10.1152/jappl.1985.58.4.1263 [PubMed] [CrossRef] [Google Scholar]
Nava S, Bruschi C, Fracchia C, et al. Patient-ventilator interaction and inspiratory effort during pressure support ventilation in patients with different pathologies. Eur Respir J 1997;10:177-83. 10.1183/09031936.97.10010177 [PubMed] [CrossRef] [Google Scholar]
Jubran A, Van de Graaff WB, Tobin MJ. Variability of patient-ventilator interaction with pressure support ventilation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1995;152:129-36. 10.1164/ajrccm.152.1.7599811 [PubMed] [CrossRef] [Google Scholar]
Dodd DS, Kelly S, Collett PW, et al. Pressure-time product, work rate, and endurance during resistive breathing in humans. J Appl Physiol 1988;64:1397-404. 10.1152/jappl.1988.64.4.1397 [PubMed] [CrossRef] [Google Scholar]
Dodd DS, Yarom J, Loring SH, et al. O2 cost of inspiratory and expiratory resistive breathing in humans. J Appl Physiol 1988;65:2518-23. 10.1152/jappl.1988.65.6.2518 [PubMed] [CrossRef] [Google Scholar]
Bellemare F, Grassino A. Effect of pressure and timing of contraction on human diaphragm fatigue. J Appl Physiol 1982;53:1190-5. 10.1152/jappl.1982.53.5.1190 [PubMed] [CrossRef] [Google Scholar]
McCool FD, McCann DR, Leith DE, et al. Pressure-flow effects on endurance of inspiratory muscles. J Appl Physiol 1986;60:299-303. 10.1152/jappl.1986.60.1.299 [PubMed] [CrossRef] [Google Scholar]
Clanton TL, Ameredes BT, Thomson DB, et al. Sustainable inspiratory pressures over varying flows, volumes, and duty cycles. J Appl Physiol 1990;69:1875-82. 10.1152/jappl.1990.69.5.1875 [PubMed] [CrossRef] [Google Scholar]
Cabello B, Mancebo J. Work of breathing. Intensive Care Med 2006;32:1311-4. 10.1007/s00134-006-0278-3 [PubMed] [CrossRef] [Google Scholar]
Cressoni M, Gotti M, Chiurazzi C, et al. Mechanical Power and Development of Ventilator-induced Lung Injury. Anesthesiology 2016;124:1100-8. 10.1097/ALN.0000000000001056 [PubMed] [CrossRef] [Google Scholar]
Gattinoni L, Tonetti T, Cressoni M, et al. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 2016;42:1567-75. 10.1007/s00134-016-4505-2 [PubMed] [CrossRef] [Google Scholar]
Oppersma E, Hatam N, Doorduin J, et al. Functional assessment of the diaphragm by speckle tracking ultrasound during inspiratory loading. J Appl Physiol 2017;123:1063-70. 10.1152/japplphysiol.00095.2017 [PubMed] [CrossRef] [Google Scholar]
Carrillo-Esper R, Perez-Calatayud AA, Arch-Tirado E, et al. Standardization of Sonographic Diaphragm Thickness Evaluations in Healthy Volunteers. Respir Care 2016;61:920-4. 10.4187/respcare.03999 [PubMed] [CrossRef] [Google Scholar]
Santana PV, Prina E, Albuquerque ALP, et al. Identifying decreased diaphragmatic mobility and diaphragm thickening in interstitial lung disease: the utility of ultrasound imaging. J Bras Pneumol 2016;42:88-94. 10.1590/S180637562015000000266 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Thimmaiah VT, MJ G, Jain KP. Evaluation of Thickness of Normal Diaphragm by B Mode Ultrasound. Int J Contemp Med Res 2016;3:2658-60. [Google Scholar]
Boussuges A, Gole Y, Blanc P. Diaphragmatic motion studied by M-mode ultrasonography. Chest 2009;135:391-400. 10.1378/chest.08-1541 [PubMed] [CrossRef] [Google Scholar]
De Troyer A, Farkas GA. Linkage between parasternals and external intercostals during resting breathing. J Appl Physiol 1990;69:509-16. 10.1152/jappl.1990.69.2.509 [PubMed] [CrossRef] [Google Scholar]
De Troyer A, Peche R, Yernault JC, et al. Neck muscle activity in patients with severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1994;150:41-7. 10.1164/ajrccm.150.1.8025770 [PubMed] [CrossRef] [Google Scholar]
Sinderby C, Navalesi P, Beck J, et al. Neural control of mechanical ventilation in respiratory failure. Nat Med 1999;5:1433-6. 10.1038/71012 [PubMed] [CrossRef] [Google Scholar]
Carteaux G, Cordoba-Izquierdo A, Lyazidi A, et al. Comparison between Neurally Adjusted Ventilatory Assist and Pressure Support Ventilation Levels in Terms of Respiratory Effort. Crit Care Med 2016;44:503-11. 10.1097/CCM.0000000000001418 [PubMed] [CrossRef] [Google Scholar]
Doorduin J, Sinderby CA, Beck J, et al. Automated patient-ventilator interaction analysis during neurally adjusted non-invasive ventilation and pressure support ventilation in chronic obstructive pulmonary disease. Crit Care 2014;18:550. 10.1186/s13054-014-0550-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Heunks LMA, Doorduin J, Van Der Hoeven JG. Monitoring and preventing diaphragm injury. Curr. Opin. Crit Care 2015;21:34-41. 10.1097/MCC.0000000000000168 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Kim MJ, Druz WS, Danon J, et al. Effects of lung volume and electrode position on the esophageal diaphragmatic EMG. J Appl Physiol Respir Environ Exerc Physiol 1978;45:392-8. [PubMed] [Google Scholar]
Beck J, Sinderby C, Lindstrom L, et al. Effects of lung volume on diaphragm EMG signal strength during voluntary contractions. J Appl Physiol 1998;85:1123-34. 10.1152/jappl.1998.85.3.1123 [PubMed] [CrossRef] [Google Scholar]
Sinderby C, Spahija J, Beck J, et al. Diaphragm activation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163:1637-41. 10.1164/ajrccm.163.7.2007033 [PubMed] [CrossRef] [Google Scholar]
Sinderby C, Beck J, Spahija J, et al. Voluntary activation of the human diaphragm in health and disease. J Appl Physiol 1998;85:2146-58. 10.1152/jappl.1998.85.6.2146 [PubMed] [CrossRef] [Google Scholar]
Beck J, Sinderby C, Lindström L, et al. Diaphragm interference pattern EMG and compound muscle action potentials:effects of chest wall configuration. J Appl Physiol 1997;82:520-30. 10.1152/jappl.1997.82.2.520 [PubMed] [CrossRef] [Google Scholar]
Liu L, Liu S, Xie J, et al. Assessment of patient-ventilator breath contribution during neurally adjusted ventilatory assist in patients with acute respiratory failure. Crit Care 2015;19:43. 10.1186/s13054-015-0775-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Grasselli G, Beck J, Mirabella L, et al. Assessment of patient-ventilator breath contribution during neurally adjusted ventilatory assist. Intensive Care Med 2012;38:1224-32. 10.1007/s00134-012-2588-y [PubMed] [CrossRef] [Google Scholar]
Haaksma M, Tuinman PR, Heunks L. Ultrasound to assess diaphragmatic function in the critically ill—a critical perspective. Ann Transl Med 2017;5:114. 10.21037/atm.2017.01.37 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Zambon M, Beccaria P, Matsuno J, et al. Mechanical ventilation and diaphragmatic atrophy in critically ill patients: An ultrasound study. Crit Care Med 2016;44:1347-52. 10.1097/CCM.0000000000001657 [PubMed] [CrossRef] [Google Scholar]
Grosu HB, Lee YI, Lee J, et al. Diaphragm muscle thinning in patients who are mechanically ventilated. Chest 2012;142:1455-60. 10.1378/chest.11-1638 [PubMed] [CrossRef] [Google Scholar]
Vivier E, Mekontso Dessap A, Dimassi S, et al. Diaphragm ultrasonography to estimate the work of breathing during non-invasive ventilation. Intensive Care Med 2012;38:796-803. 10.1007/s00134-012-2547-7 [PubMed] [CrossRef] [Google Scholar]
Umbrello M, Formenti P, Longhi D, et al. Diaphragm ultrasound as indicator of respiratory effort in critically ill patients undergoing assisted mechanical ventilation: A pilot clinical study. Crit Care 2015;19:161. 10.1186/s13054-0150894-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Goligher EC, Laghi F, Detsky ME, et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med 2015;41:642-9. 10.1007/s00134-015-3687-3 [PubMed] [CrossRef] [Google Scholar]
Heunks L, Ottenheijm C. Diaphragm-Protective Mechanical Ventilation to Improve Outcomes in ICU Patients? Am J Respir Crit Care Med 2018;197:150-2. 10.1164/rccm.201710-2002ED [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Powers SK, Wiggs MP, Sollanek KJ, et al. Ventilator-induced diaphragm dysfunction: cause and effect. Am J Physiol Regul Integr Comp Physiol 2013;305:R464-77 10.1152/ajpregu.00231.2013 [PubMed] [CrossRef] [Google Scholar]
Vassilakopoulos T, Petrof BJ. Critical Care Perspective Ventilator-induced Diaphragmatic Dysfunction. Am J Respir Crit Care Med 2004;169:336-41. 10.1164/rccm.200304-489CP [PubMed] [CrossRef] [Google Scholar]
Hooijman PE, Beishuizen A, de Waard MC, et al. Diaphragm Fiber Strength Is Reduced in Critically Ill Patients and Restored by a Troponin Activator. Am J Respir Crit Care Med 2014;189:863-5. 10.1164/rccm.201312-2260LE [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Hooijman PE, Beishuizen A, Witt CC, et al. Diaphragm muscle fiber weakness and ubiquitin-proteasome activation in critically ill patients. Am J Respir Crit Care Med 2015;191:1126-38. 10.1164/rccm.201412-2214OC [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Demoule A, Molinari N, Jung B, et al. Patterns of diaphragm function in critically ill patients receiving prolonged mechanical ventilation: A prospective longitudinal study. Ann Intensive Care 2016;6:75. 10.1186/s13613-016-0179-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Jaber S, Petrof BJ, Jung B, et al. Rapidly Progressive Diaphragmatic Weakness and Injury during Mechanical Ventilation in Humans. Am J Respir Crit Care Med 2011;183:364-71. 10.1164/rccm.201004-0670OC [PubMed] [CrossRef] [Google Scholar]
Goligher EC, Dres M, Fan E, et al. Mechanical Ventilation-induced Diaphragm Atrophy Strongly Impacts Clinical Outcomes. Am J Respir Crit Care Med 2018;197:204-13. 10.1164/rccm.201703-0536OC [PubMed] [CrossRef] [Google Scholar]
van Hees HW, Schellekens WJM, Linkels M, et al. Plasma from septic shock patients induces loss of muscle protein. Crit Care 2011;15:R233. 10.1186/cc10475 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Annane D. What Is the Evidence for Harm of Neuromuscular Blockade and Corticosteroid Use in the Intensive Care Unit? Semin Respir Crit Care Med 2016;37:51-6. 10.1055/s-0035-1570355 [PubMed] [CrossRef] [Google Scholar]
Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness. JAMA 2013;310:1591600. 10.1001/jama.2013.278481 [PubMed] [CrossRef] [Google Scholar]
Dres M, Goligher EC, Heunks LMA, et al. Critical illness-associated diaphragm weakness. Intensive Care Med 2017;43:1441-52. 10.1007/s00134-017-4928-4 [PubMed] [CrossRef] [Google Scholar]
Bourenne J, Hraiech S, Roch A, et al. Sedation and neuromuscular blocking agents in acute respiratory distress syndrome. Ann Transl Med 2017;5:291. 10.21037/atm.2017.07.19 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Gainnier M, Roch A, Forel JM, et al. Effect of neuromuscular blocking agents on gas exchange in patients presenting with acute respiratory distress syndrome*. Crit Care Med 2004;32:113-9. 10.1097/01.CCM.0000104114.72614.BC [PubMed] [CrossRef] [Google Scholar]
Forel JM, Roch A, Marin V, et al. Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome*. Crit Care Med 2006;34:2749-57. 10.1097/01.CCM.0000239435.87433.0D [PubMed] [CrossRef] [Google Scholar]
Akoumianaki E, Lyazidi A, Rey N, et al. Mechanical ventilation-induced reverse-triggered breaths: A frequently unrecognized form of neuromechanical coupling. Chest 2013;143:927-38. 10.1378/chest.12-1817 [PubMed] [CrossRef] [Google Scholar]
Gerovasili V, Stefanidis K, Vitzilaios K, et al. Electrical muscle stimulation preserves the muscle mass of critically ill patients: A randomized study. Crit Care 2009;13:R161. 10.1186/cc8123 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Hirose T, Shiozaki T, Shimizu K, et al. The effect of electrical muscle stimulation on the prevention of disuse muscle atrophy in patients with consciousness disturbance in the intensive care unit. J Crit Care 2013;28:536.e1-7. 10.1016/j.jcrc.2013.02.010 [PubMed] [CrossRef] [Google Scholar]
Ayas NT, McCool FD, Gore R, et al. Prevention of human diaphragm atrophy with short periods of electrical stimulation. Am J Respir Crit Care Med 1999;159:2018-20. 10.1164/ajrccm.159.6.9806147 [PubMed] [CrossRef] [Google Scholar]
Doorduin J, Sinderby CA, Beck J, et al. Assisted Ventilation in Patients with Acute Respiratory Distress Syndrome. Anesthesiology 2015;123:181-90. 10.1097/ALN.0000000000000694 [PubMed] [CrossRef] [Google Scholar]
Slutsky AS, Ranieri VM. Ventilator-Induced Lung Injury. N Engl J Med 2013;369:2126-36. 10.1056/NEJMra1208707 [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Roldan R, Beraldo MA, et al. Spontaneous Effort During Mechanical Ventilation. Crit Care Med 2016;44:e678-88. 10.1097/CCM.0000000000001649 [PubMed] [CrossRef] [Google Scholar]
Doorduin J, Nollet JL, Roesthuis LH, et al. Partial Neuromuscular Blockade during Partial Ventilatory Support in Sedated Patients with High Tidal Volumes. Am J Respir Crit Care Med 2017;195:1033-42. 10.1164/rccm.2016051016OC [PubMed] [CrossRef] [Google Scholar]
Gattinoni L, Carlesso E, Caironi P. Stress and strain within the lung. Curr Opin Crit Care 2012;18:42-7. 10.1097/MCC.0b013e32834f17d9 [PubMed] [CrossRef] [Google Scholar]
Mellott KG, Grap MJ, Munro CL, et al. Patient ventilator asynchrony in critically ill adults: Frequency and types. Heart Lung 2014;43:231-43. 10.1016/j.hrtlng.2014.02.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Talmor D, Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med 2008;359:2095-104. 10.1056/NEJMoa0708638 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Gea J, Zhu E, Gáldiz JB, et al. Functional consequences of eccentric contractions of the diaphragm. Arch Bronconeumol 2009;45:68-74. [PubMed] [Google Scholar]
Watchko JF, Johnson BD, Gosselin LE, et al. Age-related differences in diaphragm muscle injury after lengthening activations. J Appl Physiol 1994;77:2125-33. 10.1152/jappl.1994.77.5.2125 [PubMed] [CrossRef] [Google Scholar]
Zhu E, Petrof BJ, Gea J, et al. Diaphragm muscle fiber injury after inspiratory resistive breathing. Am J Respir Crit Care Med 1997;155:1110-6. 10.1164/ajrccm.155.3.9116995 [PubMed] [CrossRef] [Google Scholar]
Jiang TX, Reid WD, Road JD. Delayed diaphragm injury and diaphragm force production. Am J Respir Crit Care Med 1998;157:736-42. 10.1164/ajrccm.157.3.9707056 [PubMed] [CrossRef] [Google Scholar]
Ebihara S, Hussain SNA, Danialou G, et al. Mechanical ventilation protects against diaphragm injury in sepsis: Interaction of oxidative and mechanical stresses. Am J Respir Crit Care Med 2002;165:221-8. 10.1164/ajrccm.165.2.2108041 [PubMed] [CrossRef] [Google Scholar]
Orozco-Levi M, Lloreta J, Minguella J, et al. Injury of the human diaphragm associated with exertion and chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:1734-9. 10.1164/ajrccm.164.9.2011150 [PubMed] [CrossRef] [Google Scholar]
Doorduin J, Van Hees HWH, Van Der Hoeven JG, et al. Monitoring of the respiratory muscles in the critically Ill. Am J Respir Crit Care Med 2013;187:20-7. 10.1164/rccm.201206-1117CP [PubMed] [CrossRef] [Google Scholar]