https://onlinelibrary.wiley.com/doi/pdf/10.1111/jth.14817
Dịch: BS Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Bối cảnh
Một tỷ lệ tử vong tương đối cao của bệnh coronavirus 2019 (COVID‐19) nặng là đáng lo ngại, việc áp dụng heparin trong COVID‐19 đã được một số chuyên gia đồng ý khuyến cáo do nguy cơ đông máu lan tỏa và tắc nghẽn tĩnh mạch. Tuy nhiên, hiệu quả của nó vẫn còn được xác nhận.
Phương pháp
Kết quả đông máu, thuốc và kết quả của các bệnh nhân liên tiếp được phân loại là COVID‐19 nặng tại bệnh viện Tongji đã được phân tích hồi cứu. Tỷ lệ tử vong trong 28 ngày giữa người sử dụng heparin và người không sử dụng được so sánh, cũng có nguy cơ bệnh lý đông máu khác nhau, được phân tầng theo tỷ lệ rối loạn đông máu do nhiễm trùng huyết (SIC) hoặc kết quả D‐dimer.
Các kết quả
Có 449 bệnh nhân mắc COVID‐19 nặng đăng ký tham gia nghiên cứu, 99 trong số họ đã nhận được heparin (chủ yếu là với heparin trọng lượng phân tử thấp, LMWH) trong 7 ngày hoặc lâu hơn. D ‐ dimer, thời gian và tuổi prothrombin là dương tính, và số lượng tiểu cầu là âm tính, tương quan với tỷ lệ tử vong 28 ngày trong phân tích đa biến. Không có sự khác biệt về tỷ lệ tử vong trong 28 ngày giữa người dùng và người không sử dụng heparin (30,3% so với 29,7%, P = 0,910). Nhưng tỷ lệ tử vong trong 28 ngày của người dùng heparin thấp hơn so với người không dùng thuốc Ở những bệnh nhân có điểm SIC ≥ 4 (40,0% so với 64,2%, P = 0,029) hoặc D ‐ dimer > 6 lần giới hạn trên của mức bình thường (32,8% so với 52,4% , P = 0,017).
Kết luận
Điều trị chống đông máu chủ yếu bằng LMWH dường như có liên quan đến tiên lượng tốt hơn ở bệnh nhân COVID‐19 nặng đáp ứng tiêu chí SIC hoặc với D‐dimer tăng rõ rệt.
Điểm chính
Điều trị bằng Heparin đã được khuyến nghị cho COVID‐19, tuy nhiên, hiệu quả của nó vẫn còn cần được xác nhận.
Tỷ lệ tử vong trong 28 ngày giữa người dùng heparin và người không dùng thuốc được so sánh ở những bệnh nhân theo phân tầng.
Tỷ lệ tử vong trong 28 ngày của người dùng heparin thấp hơn so với người không dùng thuốc ở những bệnh nhân có điểm SIC ≥ 4 hoặc D‐dimer > 3.0 μg/mL.
Điều trị bằng heparin dường như có liên quan đến tiên lượng tốt hơn ở những bệnh nhân nặng COVID‐19 bị rối loạn đông máu.
Như các nghiên cứu gần đây đã mô tả [1‐3], bệnh coronavirus 2019 (COVID‐19) nặng thường phức tạp với rối loạn đông máu, đông máu nội mạch lan tỏa (DIC) có thể tồn tại trong phần lớn các trường hợp tử vong. Do bằng chứng nhiễm virus và rối loạn chức năng hô hấp, nhiều bệnh nhân bị COVID‐19 nặng đáp ứng Định nghĩa Đồng thuận Quốc tế Thứ ba về Nhiễm trùng huyết (nhiễm trùng huyết‐3) [4]. Ngoài ra, nghỉ ngơi tại giường dài hạn và có khả năng được điều trị bằng hormone cũng làm tăng nguy cơ mắc bệnh huyết khối tĩnh mạch (VTE) trong COVID‐19 nặng. Vì những lý do này, việc áp dụng tích cực các thuốc chống đông máu (như heparin) cho bệnh nhân mắc COVID‐19 nặng đã được khuyến nghị bởi một số chuyên gia đồng thuận ở Trung Quốc [5], tuy nhiên, hiệu quả của nó vẫn còn được kiểm chứng.
Hiệp hội huyết khối và cầm máu quốc tế (ISTH) đã đề xuất một loại mới xác định một giai đoạn trước đó của DIC liên quan đến nhiễm trùng huyết, được gọi là rối loạn đông máu do sepsis gây ra (SIC) [6], mà bệnh nhân đáp ứng các tiêu chuẩn chẩn đoán của SIC điều trị chống đông máu đã được xác nhận [7]. Nghiên cứu của chúng tôi nhằm xác nhận tính hữu ích của điểm SIC và các thông số đông máu khác, trong sàng lọc những bệnh nhân có thể hưởng lợi từ thuốc chống đông máu thông qua phân tích hồi cứu.
Phương pháp
Liên tiếp bệnh nhân bị COVID‐19 nặng nhập viện Bệnh viện Tongji thuộc Đại học Khoa học và Công nghệ Huazhong ở Vũ Hán từ ngày 1 tháng 1 đến ngày 13 tháng 2 năm 2020, đã được ghi danh hồi cứu. Tiêu chí loại trừ là tình trạng chảy máu, thời gian nằm viện
Chẩn đoán COVID‐19 theo hướng dẫn tạm thời của Tổ chức Y tế Thế giới [8] và được xác nhận bằng phát hiện RNA của SARS‐CoV‐2 trong phòng thí nghiệm lâm sàng của bệnh viện Tongji. COVID‐19 nghiêm trọng được xác định là đáp ứng bất kỳ một trong những điều sau đây, theo Kế hoạch chẩn đoán và điều trị của COVID‐19 do Ủy ban Y tế Quốc gia Trung Quốc đề xuất [9]: Tần số thở ≥ 30 lần/phút; Độ bão hòa oxy động mạch ≤ 93% khi nghỉ ngơi; PaO2/FiO2 ≤ 300 mmHg.
Hệ thống điểm SIC bao gồm PT, số lượng tiểu cầu và đánh giá suy cơ quan tuần tự (SOFA) đã được mô tả trong bảng 1 [6], trong đó điểm số SOFA được phát triển bởi một nhóm chuyên gia quốc tế để mô tả quá trình rối loạn chức năng cơ quan thời gian bằng cách sử dụng một số lượng hạn chế của các biến đo thường xuyên [10]. Trong khi đó, trong nghiên cứu trước đây của chúng tôi [3], thời gian D‐dimer và prothrombin (PT) cao hơn khi nhập viện có liên quan đến tiên lượng xấu ở bệnh nhân mắc COVID‐19. Do đó, ba thông số này đã được đưa vào nghiên cứu này và kết quả được ghi nhận tại thời điểm bệnh nhân đáp ứng định nghĩa về COVID‐19 nặng. Nhóm điều trị chống đông máu được định nghĩa là sử dụng heparin không phân đoạn (UFH) hoặc heparin trọng lượng phân tử thấp (LMWH) trong 7 ngày hoặc lâu hơn [11], đây là liệu pháp chống đông máu được sử dụng phổ biến nhất cho COVID‐19 trong bệnh viện của chúng tôi.
Bảng 1 Hệ thống tính điểm ISTH SIC
|
Item |
Score |
Range |
|
Platelet count (×109/L) |
1 |
100‐150 |
|
2 |
||
|
PT ‐INR |
1 |
1.2‐1.4 |
|
2 |
>1.4 |
|
|
SOFA score |
1 |
1 |
|
2 |
≥2 |
|
|
Total score for SIC |
≥4 |
|
Các xét nghiệm đông máu, bao gồm PT và Ddimer đã được phát hiện bằng cách sử dụng máy phân tích đông máu STA‐R MAX và thuốcthử ban đầu (chẩn đoán Stago, Saint‐Denis, Pháp). Số lượng tiểu cầu được phân tích bằng máy phân tích huyết học Sysmex XE‐2100 (Sysmex, Kobe, Nhật Bản).
Thông thường và các biến định lượng phân phối bất thường được so sánh bằng cách sử dụng Student’ t‐test và Mann–Whitney U test, tương ứng. Các biến phân loại được so sánh bằng cách sử dụng kiểm tra chi bình phương. Các kết quả được đưa ra là độ lệch trung bình ± độ lệch chuẩn, trung vị (phạm vi liên dải) hoặc số (phần trăm), bất cứ khi nào thích hợp. Các biến phân loại và liên tiếp được đánh giá bằng phân tích hồi quy logistic cho khả năng dự đoán tỷ lệ tử vong trong 28 ngày. Giá trị P
Các kết quả
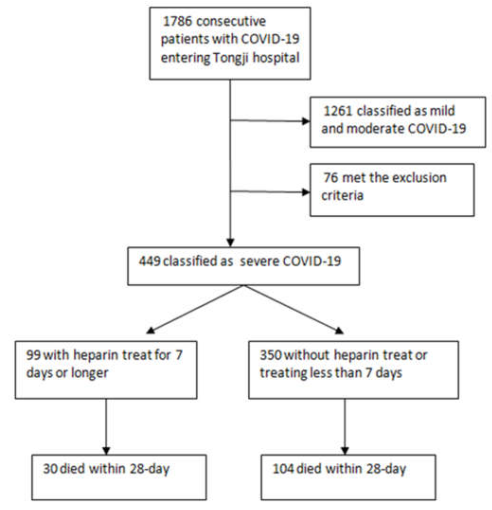
Bốn trăm bốn mươi chín bệnh nhân (181 nữ và 268 nam) được phân loại là COVID‐19 nặng được ghi danh vào nghiên cứu từ 1786 trường hợp được xác nhận liên tiếp. Tuổi trung bình lúc khởi phát bệnh là 65,1 ± 12,0 tuổi. Hai trăm bảy mươi hai (60,6%) bệnh nhân mắc một hoặc nhiều bệnh mạn tính tiềm ẩn, chủ yếu bao gồm tăng huyết áp (n = 177, 39,4%), tiểu đường (n = 93, 20,7%) và bệnh tim (n = 41, 9.1 %). Chín mươi chín (22,0%) bệnh nhân được điều trị bằng heparin trong ít nhất 7 ngày, trong đó 94 bệnh nhân được điều trị LMWH (40‐60 mg enoxaparin/ngày) và 5 người nhận được UFH (10000‐15000 U/ngày), không có thuốc chống đông máu nào khác ngoài heparin đã được sử dụng trong 7 ngày hoặc lâu hơn ở bệnh nhân của chúng tôi. Tất cả các bệnh nhân được điều trị bằng thuốc kháng vi‐rút và các liệu pháp hỗ trợ thích hợp sau khi nhập viện. Chín mươi bảy (21,6%) bệnh nhân đáp ứng các tiêu chí SIC (tổng số điểm ≥ 4) khi họ được phân loại là trường hợp nặng. Đến cuối ngày 13 tháng 3, vẫn còn 315 (70,2%) bệnh nhân sống sót và 134 (29,8%) bệnh nhân đã chết (Hình 1). Không có sự khác biệt về tỷ lệ tử vong trong 28 ngày được tìm thấy giữa người dùng heparin và người không sử dụng thuốc (30,3% so với 29,7%, P = 0,910).
Hình 1. Việc ghi danh bệnh nhân mắc COVID‐19 nặng
Các thông số của xét nghiệm đông máu và đặc điểm lâm sàng giữa những người sống sót và không sống sót được so sánh (Bảng 2). Sau đó, các tham số này đã được kiểm tra trong mô hình hồi quy logistic đa biến để xác định yếu tố tương quan độc lập của tử vong 28 ngày của COVID‐19 nghiêm trọng (Bảng 3). D‐dimer, PT và tuổi là dương tính, và số lượng tiểu cầu là âm tính, tương quan với tỷ lệ tử vong trong 28 ngày.
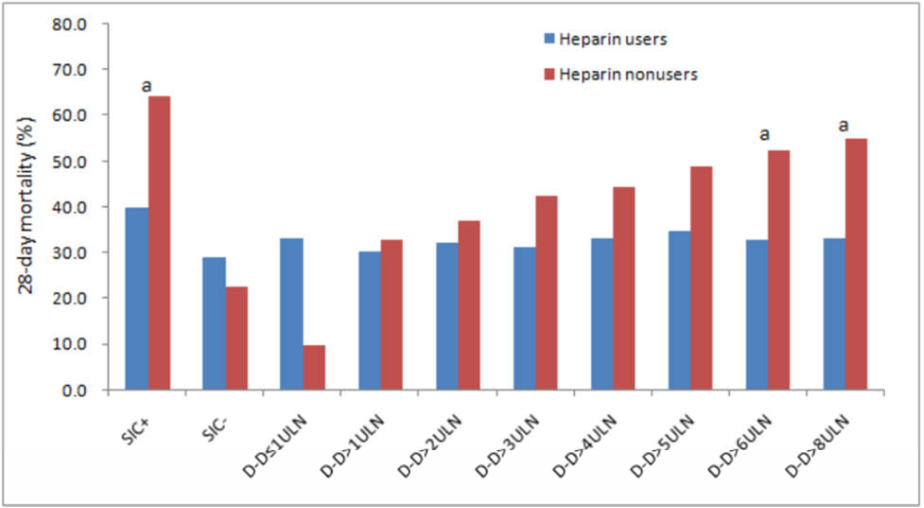
Mối liên quan giữa điều trị bằng heparin và kết quả ở bệnh nhân phân tầng theo điểm SIC hoặc kết quả D‐dimer đã được đánh giá (Bảng 4 và Hình 2). Điều trị bằng heparin có liên quan đến tỷ lệ tử vong thấp hơn ở những bệnh nhân có điểm SIC ≥ 4 (40,0% so với 64,2%, P = 0,029), nhưng không phải ở những người có điểm SIC
(gấp 6 lần giới hạn trên của mức bình thường, 6 ULN), đã giảm khoảng 20% tỷ lệ tử vong khi điều trị bằng heparin (32,8% so với 52,4%, P = 0,017).
Thảo luận
Rối loạn chức năng của các tế bào nội mô gây ra bởi nhiễm trùng dẫn đến việc tạo ra thrombin dư thừa và hủy fibrinogen, cho thấy tình trạng tăng đông ở bệnh nhân bị nhiễm trùng [12, 13], như COVID‐19. Ngoài ra, tình trạng thiếu oxy được tìm thấy trong COVID‐19 nghiêm trọng có thể kích thích huyết khối thông qua không chỉ làm tăng độ nhớt của máu, mà còn là con đường truyền tín hiệu phụ thuộc vào yếu tố phiên mã gây thiếu oxy [14]. Bằng chứng là sự tắc nghẽn và hình thành khối u trong các mạch nhỏ của bệnh nhân nguy kịch với COVID‐19 đã được báo cáo từ một ca phẫu thuật cắt bỏ nội tạng phổi gần đây [15]. Do đó, việc áp dụng sớm liệu pháp chống đông máu trong COVID‐19 nặng đã được đề xuất ở Trung Quốc để cải thiện kết quả [5], tuy nhiên, cho đến nay, không có tiêu chí loại trừ hoặc loại trừ cụ thể nào được chỉ ra. Vì thuốc chống đông máu hiếm khi được sử dụng ở giai đoạn đầu do thiếu hiểu biết về bệnh này và ngày càng được sử dụng sau này trong đợt bùng phát COVID‐19 này, chúng tôi có thể hồi cứu bao gồm các trường hợp đủ để phân tích sự khác biệt về kết quả giữa bệnh nhân có và không dùng thuốc chống đông máu.
Bảng 2 Đặc điểm lâm sàng và đông máu của bệnh nhân được phân loại là COVID‐19 nặng
|
Parameters |
Normal range |
Total (n=449) |
Survivors (n=315 ) |
Non‐survivors (n=134) |
P value |
|
Age (years) |
|
65.1±12.0 |
63.7±12.2 |
68.7±11.4 |
|
|
Sex ratio (male/female) |
|
268/181 |
178/137 |
90/44 |
0.036 |
|
With underlying diseases |
|
272 (60.6%) |
181 (57.5%) |
91 (67.9%) |
0.136 |
|
Receiving heparin |
|
99 (22.0%) |
69 (21.9%) |
30 (22.4%) |
0.910 |
|
Meeting SIC criteria |
|
97 (21.6%) |
42 (13.3%) |
55 (41.0%) |
|
|
Coagulation parameters |
|
|
|
|
|
|
PT (sec) |
11.5‐14.5 |
15.2±5.0 |
14.6±2.1 |
16.5±8.4 |
|
|
Platelet count (×109/L) |
125‐350 |
215±100 |
231±99 |
178±92 |
|
|
D‐dimer (ug/mL) |
1.94 (0.90‐9.44) |
1.47 (0.78‐4.16) |
4.70 (1.42‐21.00) |
Bảng 3 Các yếu tố tương quan đa biến của tỷ lệ tử vong trong 28 ngày ở COVID‐19 nặng
|
|
Multivariate analysis |
|
|
|
Odds ratio (95% CI) |
P value |
|
Age |
1.033 (1.013‐1.055) |
0.002 |
|
Sex ratio |
0.677 (0.425‐1.078) |
0.100 |
|
With underlying diseases |
0.861 (0.538‐1.379) |
0.534 |
|
Treating with heparin |
1.647 (0.929‐2.921) |
0.088 |
|
Prothrombin time |
1.107 (1.008‐1.215) |
0.033 |
|
Platelet count |
0.996 (0.993‐0.998) |
0.001 |
|
D‐dimer |
1.058 (1.028‐1.090) |
|
Bảng 4 Mối liên quan giữa điều trị bằng heparin và kết quả ở bệnh nhân phân tầng
|
|
28‐day mortality |
Univariate analysis |
||
|
|
Treating with Heparin |
Non‐treating with heparin |
Odds ratio (95% CI) |
P value |
|
SIC socre≥4 (n=97) |
40.0% |
64.2% |
0.372 (0.154‐0.901) |
0.029 |
|
SIC score≤4 (n=352) |
29.0% |
22.6% |
1.284 (0.700‐2.358) |
0.419 |
|
D‐dimer≤1 ULN (n=34) |
33.3% |
9.7% |
4.667 (0.320‐68.03) |
0.260 |
Hình 2. Biểu đồ thanh được ghép nối cho thấy tỷ lệ tử vong giữa người dùng heparin và người không sử dụng thuốc ở bệnh nhân phân tầng
LMWH là thuốc chống đông máu được sử dụng phổ biến nhất trong bệnh viện của chúng tôi để ngăn ngừa DIC và VTE ở bệnh nhân, cũng vì tác dụng chống viêm của nó [16]. Một lý do khác là các thuốc chống đông máu khác, chẳng hạn như thrombomodulin hòa tan tái tổ hợp hoặc antithrombin, chưa có sẵn ở Trung Quốc. Liều dự phòng LMWH đã được sử dụng ở hầu hết những người sử dụng heparin của chúng tôi, các biến chứng chảy máu là bất thường và thường nhẹ, không biết liệu liều cao hơn sẽ tốt hơn. Do các bằng chứng cho thấy tỷ lệ lưu hành và các yếu tố nguy cơ di truyền của VTE khác nhau đáng kể giữa các nhóm dân tộc và tỷ lệ mắc VTE ở dân số châu Á (21‐29 trường hợp trên 100.000 cá thể mỗi năm) là thấp nhất [17, 18], liều cao hơn LMWH có thể được xem xét ở những bệnh nhân không phải người châu Á bị COVID‐19 nặng. Tuy nhiên, hiệu quả của liệu pháp chống đông máu đối với DIC liên quan đến nhiễm trùng huyết vẫn còn gây tranh cãi [19, 20], ngay cả hướng dẫn của Nhật Bản về quản lý nhiễm trùng huyết đã chống lại việc sử dụng các chất tương tự heparin hoặc heparin như một phương pháp điều trị tiêu chuẩn trong DIC liên quan đến nhiễm trùng huyết [21], một số nghiên cứu cho rằng bệnh nhân nhiễm trùng huyết có thể chỉ được hưởng lợi từ việc nhận biết sớm và điều trị cụ thể [22, 23]. Khi số lượng tiểu cầu giảm và kéo dài PT có tương quan với tăng tỷ lệ tử vong và hạ glucose máu không phổ biến trong nhiễm trùng huyết, ISTH đã phát triển các tiêu chí SIC để hướng dẫn điều trị chống đông máu, tính hữu ích của điểm số đơn giản này đã được xác nhận trước đây [7].
Vì rối loạn chức năng nội tạng chủ yếu bị hạn chế ở phổi và virus là mầm bệnh chính, tính năng đông máu của COVID‐19 nghiêm trọng có thể không giống với nhiễm trùng huyết nói chung. Có lẽ do thrombopoietin tăng phản ứng sau viêm phổi [24], số lượng tiểu cầu có thể không phải là dấu hiệu nhạy cảm cho rối loạn đông máu của COVID‐19, trong nghiên cứu hiện tại, chỉ 21,6% bệnh nhân mắc COVID‐19 nghiêm trọng đáp ứng tiêu chí SIC, làm giới hạn bệnh nhân cần điều trị chống đông máu. Tuy nhiên, như một dấu hiệu gián tiếp của kích hoạt đông máu, D‐dimer tăng rõ rệt (> 6 ULN) cũng gợi ý lợi ích từ điều trị bằng heparin, ở một nhóm lớn bệnh nhân nặng hơn (161 trên 449, 35,9%).
Vì việc kích hoạt đông máu cũng góp phần ngăn chặn mầm bệnh và giảm sự xâm nhập của chúng [25], do đó, điều trị chống đông máu ở bệnh nhân không có rối loạn đông máu đáng kể có nguy cơ tiềm tàng. Điều này có thể giải thích tỷ lệ tử vong tương đối cao hơn của người dùng heparin so với người không dùng thuốc ở bệnh nhân có D‐dimer ≤1 ULN, mặc dù sự khác biệt không có ý nghĩa thống kê (P = 0,260).
Có một số hạn chế trong nghiên cứu hiện tại. Đầu tiên, xu hướng lựa chọn tiềm năng tồn tại trong nghiên cứu hồi cứu này, ví dụ, LMWH có thể có xu hướng được sử dụng ở những bệnh nhân có triệu chứng nhắm mục tiêu hoặc lịch sử y tế mà chúng tôi chưa kiểm soát được. Thứ hai, do không đủ tài nguyên y tế ở giai đoạn đầu của đợt bùng phát COVID‐19 tại Vũ Hán, Trung Quốc, mức độ nghiêm trọng và tử vong của các bệnh nhân bao gồm có thể không phải là đại diện. Thứ ba, ảnh hưởng của các phương pháp điều trị khác đối với những bệnh nhân này chưa được đánh giá, ngoài ra, khi chúng tôi đăng ký bệnh nhân trong khoảng thời gian 6 tuần, có thể một số thay đổi phi dược lý đã diễn ra trong việc quản lý bệnh nhân khi các bác sĩ biết thêm về bệnh này qua thời kỳ. Tuy nhiên, nghiên cứu này bao gồm một nhóm bệnh nhân nguy kịch lớn và do thiếu thuốc đặc hiệu chống nhiễm trùng SARS‐CoV‐2 cho đến nay [26], phần lớn bệnh nhân mắc COVID‐19 nặng nên được điều trị hỗ trợ tương tự sau đó nhận vào. Do đó, chúng tôi tin rằng kết quả của nghiên cứu hiện tại vẫn có ý nghĩa lâm sàng nhất định.
Tóm lại, tỷ lệ tử vong của COVID‐19 tương đối cao là đáng lo ngại, nghiên cứu của chúng tôi cho thấy thuốc chống đông máu có thể không có lợi cho bệnh nhân không được chọn, thay vào đó, chỉ những bệnh nhân đáp ứng tiêu chí SIC hoặc với D‐dimer tăng rõ rệt mới có thể được hưởng lợi từ liệu pháp chống đông máu. LMWH. Các nghiên cứu trong tương lai là cần thiết để xác nhận kết quả này.
References
Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020; 395(10223):507-513.
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020; 395(10223): 497-506.
Tang N, Li D, Wang X, Sun Z. Abnormal Coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020 [published online ahead of print].
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016; 315(8):801–810. 5. Shanghai Clinical Treatment Expert Group for COVID-19. Comprehensive treatment and management of coronavirus disease 2019: expert consensus statement from Shanghai (in Chinese). Chin J Infect. 2020, 38 [published online ahead of print].
Iba T, Levy JH, Warkentin TE, et al. Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost. 2019; 17(11):1989–1994.
Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: aretrospective analysis of a nationwide survey. BMJ Open. 2017; 7(9):e017046.
World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: interim guidance. Published January 28, 2020. Accessed January 31, 2020. https://www.who.int/publicationsdetail/clinical-management-of-severe-acute-respiratoryinfection-whennovel-coronavirus-(ncov)-infection-issuspected
National Health Commission of China. The diagnosis and treatment plan for the novel coronavirus disease (the seventh edition). 2020.
Vincent JL, Moreno R, Takala J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996; 22(7):707–710.
Venclauskas L, Llau JV, Jenny JY, KjaersgaardAndersen P, Jans Ø; ESA VTE Guidelines Task Force. European guidelines on perioperative venous thromboembolism prophylaxis: Day surgery and fasttrack surgery. Eur J Anaesthesiol. 2018; 35(2):134–138.
Levi M, van der Poll T. Coagulation and sepsis. Thromb Res. 2017; 149:38–44.
Schmitt FCF, Manolov V, Morgenstern J, et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: results of an observational pilot study. Ann Intensive Care. 2019; 9(1):19.
Gupta N, Zhao YY, Evans CE. The stimulation of thrombosis by hypoxia. Thromb Res. 2019;181:77–83. 15. Luo W, Yu H, Gou J, et al. Clinical Pathology of Critical Patient with Novel Coronavirus Pneumonia (COVID-19). Preprints. 2020, 2020020407.
Poterucha TJ, Libby P, Goldhaber SZ. More than an anticoagulant: Do heparins have direct anti- inflammatory effects?. Thromb Haemost. 2017; 117(3):437–444.
Stein PD, Kayali F, Olson RE, Milford CE. Pulmonary thromboembolism in Asians/Pacific Islanders in the United States: analysis of data from the National Hospital Discharge Survey and the United States Bureau of the Census. Am J Med. 2004; 116(7):435–442.
Zakai NA, McClure LA. Racial differences in venous thromboembolism. J Thromb Haemost. 2011; 9(10):1877–1882.
Aikawa N, Shimazaki S, Yamamoto Y, et al. Thrombomodulin alfa in the treatment of infectious patients complicated by disseminated intravascular coagulation: subanalysis from the phase 3 trial. Shock. 2011; 35(4):349–354.
Liu XL, Wang XZ, Liu XX, et al. Low-dose heparin as treatment for early disseminated intravascular coagulation during sepsis: A prospective clinical study. Exp Ther Med. 2014; 7(3):604–608.
Nishida O, Ogura H, Egi M, et al. The Japanese Clinical Practice Guidelines for Management of Sepsis and Septic Shock 2016 (J-SSCG 2016). Acute Med Surg. 2018; 5(1):3–89.
Umemura Y, Yamakawa K, Ogura H, Yuhara H, Fujimi S. Efficacy and safety of anticoagulant therapy in three specific populations with sepsis: a meta-analysis of randomized controlled trials. J Thromb Haemost. 2016; 14(3):518–530.
Iba T, Gando S, Thachil J. Anticoagulant therapy for sepsis-associated disseminated intravascular coagulation: the view from Japan. J Thromb Haemost. 2014; 12(7):1010–1019.
Menter DG, Kopetz S, Hawk E, et al. Platelet “first responders” in wound response, cancer, and metastasis. Cancer Metastasis Rev. 2017; 36(2):199–213.
Sun H, Wang X, Degen JL, Ginsburg D. Reduced thrombin generation increases host susceptibility to group A streptococcal infection. Blood. 2009; 113(6):1358–1364.
Dong L, Hu S, Gao J. Discovering drugs to treat coronavirus disease 2019 (COVID-19). Drug Discov Ther. 2020; 14(1):58–60.