Gerald Chanques
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Hội chứng nguy kịch hô hấp cấp tính (ARDS) là một trong những tình trạng đòi hỏi khắt khe nhất trong Đơn vị chăm sóc đặc biệt (ICU). Xử trí giảm đau và an thần trong ARDS đặc biệt khó khăn. Một hội đồng chuyên gia đã được triệu tập để đưa ra một bài báo “hiện đại” nhằm hỗ trợ các bác sĩ lâm sàng trong việc xử trí tối ưu giảm đau/an thần ở người lớn thở máy bằng ARDS, bao gồm cả những người có COVID-19. Các hướng dẫn giảm đau/an thần hiện tại của ICU thúc đẩy giảm đau trước tiên và giảm thiểu tác dụng an thần, tỉnh táo, ngăn ngừa mê sảng và phục hồi chức năng sớm để tạo điều kiện cho giải phóng máy thở và ra khỏi ICU. Tuy nhiên, những chiến lược này không phải lúc nào cũng được áp dụng cho những bệnh nhân mắc ARDS, những người đôi khi phải dùng thuốc an thần sâu và/hoặc liệt cơ. Những bệnh nhân bị ARDS nặng có thể dưới mức biểu hiện trong các nghiên cứu giảm đau/an thần và các chiến lược được khuyến nghị hiện nay có thể không khả thi. Với thuốc an thần nhẹ, các triệu chứng liên quan đến kích xúc (distress) (ví dụ, đau và khó chịu, lo lắng, khó thở) và sự không đồng bộ của bệnh nhân – máy thở nên được đánh giá và xử trí một cách có hệ thống thông qua sự hợp tác giữa các chuyên gia, ưu tiên giảm đau và giải lo âu. Việc điều chỉnh cài đặt máy thở (ví dụ, sử dụng chế độ cài đặt áp lực, thở tự phát, kích hoạt máy thở nhạy cảm) nên được xem xét một cách có hệ thống trước khi sử dụng các loại thuốc bổ sung. Xử trí máy thở cơ học là điều tối quan trọng để tránh sử dụng thuốc an thần sâu và/hoặc liệt cơ không cần thiết. Do đó, áp dụng gói “ABCDEF-R” (R = Kiểm soát trung khu hô hấp) có thể có lợi ở bệnh nhân ARDS. Cần có các nghiên cứu sâu hơn, đặc biệt là về việc sử dụng và tác dụng lâu dài của các loại thuốc hết tác dụng nhanh (ví dụ: Remifentanil, thuốc gây mê dễ bay hơi) và đánh giá điện sinh lý về giảm đau/an thần (ví dụ, thiết bị điện não đồ, sự thay đổi nhịp tim và đo đồng tử bằng video) . Đánh giá này đặc biệt có liên quan trong đại dịch COVID-19 do tình trạng thiếu thuốc và công suất giường ICU hạn chế.
Take-home message
Giảm đau và an thần là một thách thức ở bệnh nhân ARDS. Tuy nhiên, các hướng dẫn hiện hành cần được xem xét và áp dụng khi có thể. Hơn nữa, nên xem xét gói “ABCDEF-R” (R = Respiratory-drivecontrol) để ưu tiên xử trí các yếu tố liên quan đến máy thở cơ học và trung khu hô hấp và tránh sử dụng thuốc không cần thiết (đặc biệt là opioid, thuốc an thần và các thuốc phong tỏa thần kinh cơ) có thể làm chậm quá trình giải phóng máy thở và làm xấu đi kết cục khác của bệnh nhân.
Giới thiệu
Hội chứng nguy kịch hô hấp cấp (ARDS) có ở 10% bệnh nhân được đưa vào đơn vị chăm sóc đặc biệt (ICU), và có liên quan đến tỷ lệ tử vong tại bệnh viện từ 35 đến 46% [1]. ARDS là một trong những tình trạng nghiêm trọng nhất của bệnh hiểm nghèo và cũng là một trong những thách thức nhất liên quan đến việc điều trị giảm đau và an thần. Các hướng dẫn thực hành lâm sàng về giảm đau và an thần trong ICU (ví dụ, hướng dẫn về Đau, Kích động/an thần, Mê sảng, Bất động và gián đoạn giấc ngủ (PADIS, Agitation/sedation, Delirium, Immobility and Sleep disruption) [2]) đã nhất quán tập trung vào việc phục hồi chức năng sớm và giải phóng máy thở nhanh [3]. Để đạt được những mục tiêu này, điều trị đau, giảm thiểu thuốc an thần, ngăn ngừa mê sảng và cải thiện giao tiếp của bệnh nhân là những thành phần quan trọng [2]. Tuy nhiên, một số bệnh nhân ARDS cần dùng thuốc an thần sâu hoặc thậm chí phong tỏa thần kinh cơ, đặc biệt là trong giai đoạn đầu nhập viện [4, 5]. Do đó, bệnh nhân ARDS nặng có thể không được đại diện trong các nghiên cứu về giảm đau và an thần nhằm mục đích chủ yếu là đánh giá một chiến lược an thần tối thiểu [6]. Ngoài ra, tình trạng an thần sâu vẫn thường xuyên xảy ra ở bệnh nhân ICU nói chung trong 48 giờ đầu tiên [7] và chỉ có một số nghiên cứu về giảm đau/an thần đã đánh giá bệnh nhân trong thời gian đầu này [6, 8]. Một hội đồng gồm các chuyên gia, chủ yếu từ nhóm cộng tác, những người là tác giả của hướng dẫn PADIS, đã cung cấp một bản đánh giá tường thuật “hiện đại” để hỗ trợ các bác sĩ lâm sàng trong việc xử trí thuốc an thần/giảm đau ở bệnh nhân ARDS. Đây không phải là một hướng dẫn thực hành lâm sàng, mà là một đánh giá thông tin của các chuyên gia trong lĩnh vực này. Bản thảo được viết bởi các tác giả được nhóm theo từng phần, sau quá trình tìm kiếm tài liệu và kinh nghiệm của chính họ, sau đó được đồng nhất bởi các điều phối viên (GC, JPK) và được tất cả các tác giả xem xét và sửa đổi. Cơ sở lý luận cho việc xem xét này đặc biệt có liên quan trong thời kỳ đại dịch do coronavirus 2019 (COVID-19) đang diễn ra do những lo ngại khẩn cấp về tình trạng thiếu thuốc giảm đau, an thần và liệt cơ và số người nhập viện tăng cao áp đảo công suất giường bệnh của ICU [9–12].
Bệnh nhân dùng thuốc phong tỏa thần kinh cơ (giai đoạn đầu của ards nặng)
Bệnh nhân mắc ARDS hoặc các tình trạng đe dọa tính mạng khác có thể yêu cầu thuốc phong tỏa thần kinh cơ (NMBA, neuromuscular blocking agents) để tối ưu hóa thở máy (MV, mechanical ventilation) như đã thảo luận trong Hướng dẫn thực hành nhanh được xuất bản gần đây trên tạp chí Intensive Care Medicine [13]. Các báo cáo trường hợp bệnh nhân bị liệt cơ do thuốc nhưng tỉnh táo mô tả nỗi kinh hoàng mà những bệnh nhân này phải trải qua. Do đó, các tuyên bố về thực hành lâm sàng tốt nhất khuyến cáo sử dụng thuốc an thần sâu và mất trí nhớ, và giảm đau hiệu quả, trước khi phong tỏa thần kinh cơ [14]. Mặc dù một thử nghiệm năm 2010 đã báo cáo tỷ lệ sống sót được cải thiện ở những bệnh nhân ARDS nặng được sử dụng NMBA [5], một thử nghiệm lớn hơn sau đó đã không lặp lại những phát hiện này [15]. Do đó, các chỉ định cho NMBA trong ARDS vẫn còn đang tranh cãi [13]. NMBA nhiều nhất nên được coi là một liệu pháp cứu nguy cho những bệnh nhân bị ARDS nặng nhất.
Xử trí cơn đau và lo lắng ở bệnh nhân nhận NMBA lý tưởng nên dựa vào các thang đo hoặc công cụ đã được kiểm chứng. Tuy nhiên, việc đánh giá mức độ lo lắng và đau đớn khi bệnh nhân không thể giao tiếp hoặc thể hiện phản ứng hành vi là một thách thức. Trong số những bệnh nhân nhận NMBA, không phải là tiêu chuẩn vàng để đánh giá cơn đau (tức là bệnh nhân tự báo cáo) hoặc các biện pháp hành vi được khuyến nghị [2, 16], chẳng hạn như Thang điểm đau hành vi (BPS, Behavioral Pain Scale) và Công cụ quan sát cơn đau do chăm sóc tích cực (CPOT, Critical-Care Pain Observation Tool) có thể được sử dụng. Bằng chứng không hỗ trợ việc đánh giá các dấu hiệu sinh tồn đơn thuần để đánh giá cơn đau [2]. Các phương pháp tiếp cận mới để đánh giá cơn đau và an thần ở bệnh nhân liệt đang được khám phá, bao gồm chỉ biến thiên nhịp tim (ví dụ: Chỉ số giảm cảm nhận đau 0–100, Analgesia Nociception Index [17]) hoặc kết hợp với các thông số sinh lý khác (tức là, Chỉ số mức độ nhận thức 0–100, Nociception Level Index [18]). Chỉ số đau đồng tử (pupillary pain index) (1 = không cảm nhận đến 9 = cảm nhận cao), dựa trên sự gia tăng kích thước đồng tử, được đánh giá bằng cách sử dụng BPS làm thước đo đau tham chiếu trong quá trình hút đàm khí quản ở những bệnh nhân nặng được an thần [19]. Các chỉ số đau mới này yêu cầu xác nhận bổ sung để hỗ trợ việc triển khai chúng trong thực hành lâm sàng. Tương tự, việc đánh giá mức độ lo lắng ở một bệnh nhân bị liệt không giao tiếp cũng khó khăn không kém và không có công cụ nào để hướng dẫn đánh giá.
Trước khi sử dụng NMBA, bệnh nhân nên dùng thuốc giảm đau tiêm tĩnh mạch đủ để giảm đau có thể chấp nhận được, cũng như thuốc an thần có đặc tính gây quên (ví dụ, propofol hoặc benzodiazepine và KHÔNG PHẢI dexmedetomidine) để đạt được mức độ an thần sâu. Nên sử dụng thang điểm đã được xác thực, chẳng hạn như Thang kích động an thần (SAS, Sedation Agitation Scale) [20] hoặc Thang an thần kích thích của Richmond (RASS, Richmond Agitation Sedation Scale) [21], để xác nhận tình trạng an thần sâu, trong khi một công cụ đánh giá cơn đau đã được xác nhận (ví dụ: BPS hoặc CPOT [2, 16]) nên được sử dụng để xác nhận hiệu quả giảm đau. Những loại thuốc giảm đau và giải lo âu/thuốc an thần truyền tĩnh mạch nên được tiếp tục miễn là NMBA đang được sử dụng. Vì việc gián đoạn thuốc an thần hàng ngày được sử dụng trong nhiều ICU [2], theo cách tương tự, việc ngừng truyền NMBA nên được xem xét ít nhất hàng ngày; sau khi ngừng sử dụng thuốc NMBA, người ta có thể tiến hành làm nhẹ hoặc ngưng an thần.
Chiến lược chung về giảm đau/an thần để thông khí bảo vệ phổi mà không có nmba
Mục tiêu chính của việc giảm đau/an thần cho bệnh nhân được sử dụng chiến lược thông khí bảo vệ phổi là cung cấp sự thoải mái và an toàn, tạo điều kiện cho các can thiệp cứu sinh, và duy trì sự tương tác của bệnh nhân với nhân viên và gia đình để thúc đẩy hồi phục sớm về thể chất và nhận thức [2, 22, 23]. Một cách tiếp cận đa phương thức lấy bệnh nhân làm trung tâm, bao gồm giảm đau sớm hiệu quả, an thần tối ưu và không xuất hiện mê sảng/kích động là bắt buộc đối với tất cả người lớn trong ICU [7] và cũng nên được xem xét cho cả bệnh nhân ARDS. Tuy nhiên, không có nghiên cứu tiền cứu nào về giảm đau/an thần được thực hiện riêng trên bệnh nhân ARDS.
Chúng tôi tin rằng chiến lược an thần sâu ba cấp (tức là nhẹ (RASS + 1/- 1), vừa phải (RASS – 2/- 3), sâu (RASS – 4/- 5) [21]) có thể hữu ích. Không khuyến khích tuân thủ chặt chẽ chiến lược một kích thước phù hợp với tất cả. Thay vào đó, việc tuân thủ các nguyên tắc để đạt được sự an thần tối ưu ở hầu hết các bệnh nhân phải là mục tiêu:
Mục đích là giảm thiểu hoặc không dùng thuốc an thần ở hầu hết bệnh nhân, ưu tiên thuốc giảm đau đầy đủ và thuốc an thần tác dụng ngắn khi cần thiết [24].
Chấp nhận các khoảng thời gian ngắn của thuốc an thần vừa phải (RASS – 2/- 3) để khắc phục tình trạng không đồng bộ hoặc khó chịu gây ra do máy thở sau khi tối ưu hóa việc kiểm soát cơn đau và cài đặt máy thở [25].
Theo dõi mức độ an thần thường xuyên bằng một công cụ đã được kiểm chứng và đánh giá lại mức độ an thần mục tiêu ít nhất hai lần mỗi ngày. Thường xuyên theo dõi cơn đau và cơn mê sảng bằng các công cụ đã được kiểm chứng. Chuẩn độ tất cả các thuốc để đạt được mục tiêu an thần đã định. Một thuật toán bằng văn bản có thể hữu ích tùy thuộc vào giáo dục và đào tạo của điều dưỡng (xem “Các chiến lược để tránh dùng quá nhiều thuốc an thần và sự chậm trễ trong phục hồi nhận thức và cai thở máy”).
Đôi khi, thuốc an thần sâu (RASS – 4/- 5) có thể được yêu cầu. Trong trường hợp này, thuốc an thần nên được lựa chọn dựa trên tuổi của bệnh nhân, chức năng nội tạng và bệnh đi kèm (xem phần “Lựa chọn thuốc”).
Trong mọi trường hợp, hãy cân nhắc xử trí máy thở cơ học và trung khu hô hấp của bệnh nhân trước để tránh sử dụng thuốc an thần không cần thiết và nguy cơ gây ngủ sâu (xem “Phương pháp tiếp cận giảm đau/an thần toàn cầu phù hợp với bệnh nhân ARDS: đề xuất chiến lược xử trí thở máy trước tiên ”). Lưu ý, chiến lược độ sâu an thần ba bậc được đề xuất này không nên được áp dụng nghiêm ngặt theo mức độ nghiêm trọng của ARDS (tức là nhẹ, trung bình và nặng) vì một số bệnh nhân ARDS nặng chịu được thuốc an thần nhẹ mà không có sự mất đồng bộ đáng kể của bệnh nhân/máy thở.
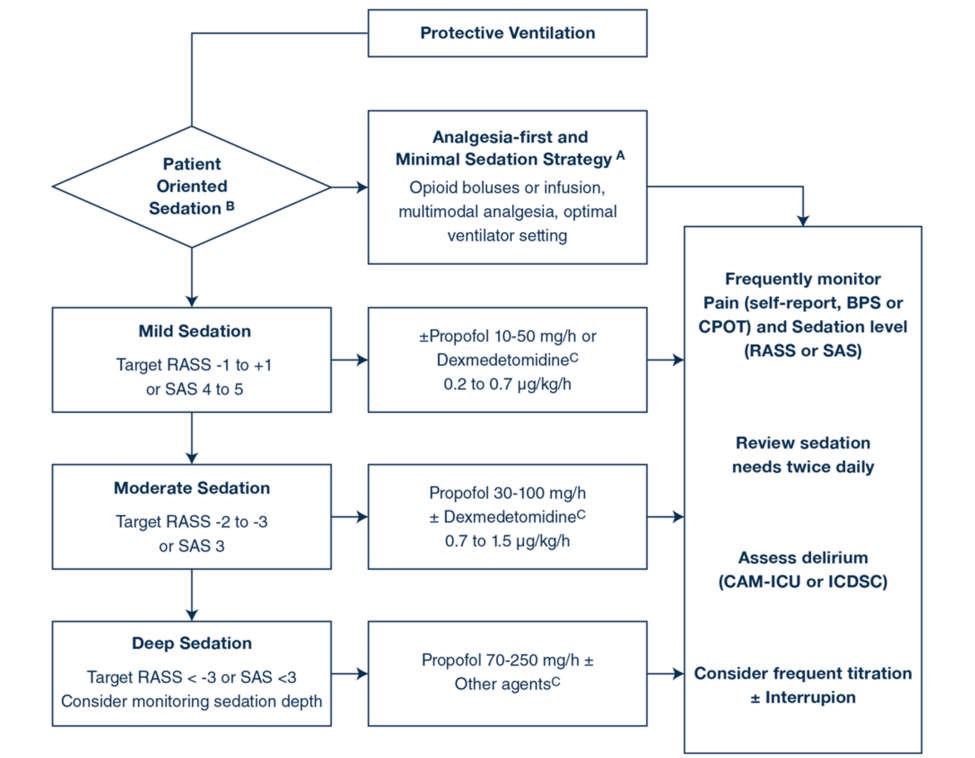
Hình 1 là một thuật toán được đề xuất để hướng dẫn xử trí an thần trong điều kiện thông khí bảo vệ không có NMBA, dựa trên các nguyên tắc trên.
Chiến lược chung về giảm đau/an thần đểthông khí bảo vệ phổi mà không có nmba
Khó khăn trong việc cung cấp thuốc an thần cho những người bị bệnh hiểm nghèo đã tăng lên do sự gián đoạn liên quan đến COVID-19 của chuỗi cung ứng cho các lựa chọn điều trị truyền thống do nhu cầu ngày càng tăng, dự trữ, tạm thời ngừng sản xuất và hạn chế xuất khẩu [12]. Các trang web quốc tế được cập nhật liên tục có sẵn để giúp xác định và giảm thiểu tình trạng thiếu thuốc này với các ví dụ nổi bật bao gồm fentanyl, propofol, midazolam và cisatracurium. Khi sự thiếu hụt này tiến triển, các loại thuốc ít được sử dụng hơn có thể cần được xem xét để giảm đau, an thần hoặc điều trị liệt mặc dù dữ liệu kiểm tra các thuốc cụ thể này có thể thiếu hoặc các hướng dẫn thông thường khuyến cáo nên tránh các loại thuốc như vậy. Việc sử dụng các thuốc thay thế được thảo luận dưới đây nên được hướng dẫn bởi bối cảnh của từng bệnh nhân, mục tiêu điều trị, đáp ứng và khả năng dung nạp. Trong trường hợp không có bằng chứng mới, việc làm quen với các thuốc thay thế do thiếu thuốc thông thường sẽ không dẫn đến việc tiếp tục sử dụng chúng khi có các thuốc đã được chứng minh (Bảng 1).
Hình 1
Giảm đau và an thần không có NMBA cho chiến lược thông khí bảo vệ phổi. A Giảm đau-đầu tiên/an thần tối thiểu là tùy chọn mặc định. B Bác sĩ lâm sàng chọn mức độ an thần mong muốn dựa trên các triệu chứng của bệnh nhân. C Propofol vẫn là thuốc đầu tiên để điều trị an thần. Thêm dexmedetomidine có thể được coi là để giảm tình trạng mê sảng và giảm liều tích lũy propofol. Trong một số trường hợp được chọn (bệnh nhân khó dùng propofol ± dexmedetomidine an thần, hoặc giảm liều thuốc an thần), cân nhắc sử dụng ngắt quãng benzodiazepine, thuốc chống loạn thần hoặc thuốc mê dễ bay hơi. RASS: Thang an thần kích thích Richmond (- 5: không phản ứng với kích thích vật lý, – 4: mắt mở hoặc cử động với kích thích vật lý, – 3: mắt mở hoặc cử động với giọng nói, – 2 giao tiếp bằng mắt 10 s, 0 tỉnh táo và bình tĩnh, + 1 bồn chồn, + 2 kích động, + 3 rất kích động, + 4 chống cự) [21]. SAS: Thang điểm kích động an thần (1: không đáp ứng, 2: rất an thần, 3: an thần, 4: bình tĩnh và hợp tác và dễ tỉnh táo, 5: kích động, 6: rất kích động và 7: kích động nguy hiểm) [20]. BPS: Thang điểm Đau về Hành vi [2, 16]. CPOT: Công cụ quan sát cơn đau do chăm sóc nghiêm trọng [2, 16]. CAM-ICU: Phương pháp Đánh giá Lú lẫn – Đơn vị Chăm sóc Đặc biệt [2]. ICDSC: Danh sách kiểm tra sàng lọc mê sảng trong chăm sóc chuyên sâu [2]
Bảng 1 So sánh thuốc giảm đau và thuốc an thần bậc một và bậc hai
|
Thuốca |
Thời gian khởi phát (ph) |
Thời gian hết tác dụng |
Tác dụng giảm đau |
An thần sâub |
Ức chế trung khu hô hấp |
Nguy cơ sảng |
Nguy cơ ngưng thuốc |
Liều |
Ghi chúc |
|
Thuốc đầu tiên |
|
|
|
|
|
|
|
||
|
Thuốc gây nghiện |
|
|
|
|
|
|
|
||
|
Fentanyl |
1–2 |
1–4 h |
+ + + |
N |
Y |
+ |
+ + |
0.3–0.5 mcg/kg IVP q1-2 h ± 0.7–10 mcg/kg/h |
Cân nhắc khi cần hoặc tiêm TM nhanh theo lịch trình trước khi bắt đầu truyền liên tục |
|
Hydromorphone |
10–20 |
2–6 h |
+ + + |
N |
Y |
+ |
+ + |
0.2–0.6 mg IVP q12 h ± 0.5–5.0 mg/h |
|
|
Sufentanil |
1–3 |
0.5–2 h |
+ + + |
N |
Y |
+ |
+ + |
0.1–1.0 mcg/kg/h |
|
|
Thuốc giảm đau không gây nghiện |
|
|
|
|
|
|
|
||
|
Paracetamol |
30 |
4–6 h |
+ |
N |
N |
– |
– |
1 g IV/PO Q6h |
IV hoặc PO hoạt động như nhau; Sử dụng IV liên quan đến hạ huyết áp |
|
Ketamine (liều thấp) |
15–20 |
20–30 min |
+ + |
N |
N |
+ |
+ |
0.1– 1.0 mg/kg/h |
Liều > 1 mg/kg/h tạo ra an thần rõ rệt |
|
Nefopam |
30 |
4–6 h |
+ + |
N |
N |
+ |
– |
20 mg IV /4–6 h |
Tránh ở bệnh nhân co giật. Sử dụng như truyền chậm trong 30 phút sẽ làm giảm đỏ bừng |
|
Thuốc an thần |
|||||||||
|
Dexmedetomidine |
15–20 |
60–90 min |
+ |
N |
N |
– |
+ + |
0.2–1.5 mcg/kg/h |
Liều> 1,5 mcg/kg/giờ làm tăng độc tính trên tim; không tăng thêm lợi ích lâm sàng |
|
Midazolam |
2–5 |
1–72 hrd |
– |
Y |
Y |
+ + + |
+ + |
1–10 mg/h |
Cân nhắc khi cần hoặc TM nhanh theo lịch trình trước khi bắt đầu truyền liên tục |
|
Propofol |
0.5–1 |
5–10 min |
– |
Y |
Y |
+ |
– |
10–250 mg/h |
Thời gian hết tác dụng ↑ ở người lớn tuổi/ truyền > 72 giờ. Tránh nếu chất béo trung tính > 800 mg/dL. Giám sát PRIS |
|
Thuốc nhóm thứ hai |
|||||||||
|
Thuốc gây nghiện |
|||||||||
|
Morphine |
5–10 |
3–5 h |
+ + + |
N |
Y |
+ |
+ |
2–5 mg IVP q1-2 h ± 2– 30 mg/h |
Cân nhắc PRN hoặc IVP theo lịch trình trước khi bắt đầu truyền liên tục. Giải phóng histamine liên quan đến hạ huyết áp và co thắt phế quản; tích tụ khi suy thận |
|
Remifentanil |
1–3 |
3–10 min |
+ + + |
N |
Y |
+ |
+ + + |
0.5–15 mcg/kg/h |
Không tích lũy trong suy gan/thận; thu hồi được báo cáo nhiều hơn so với các opioid IV khác |
|
Thuốc an thần, thuốc chống loạn thần |
|||||||||
|
Haloperidol |
5–10 |
15–30 min |
– |
N |
N |
– |
– |
2–5 mg IV q6h |
Liều cao hơn liên quan đến kéo dài khoảng QTc và EPS |
|
Sevoflurane /Isoflurane dạng hít |
1–2 |
4–7 min |
+ |
Y |
Y |
– |
– |
Expired gas fractions of 0.2–1.4%; dependent on goal sedation target |
Không tích lũy trong suy gan/thận; hiếm trường hợp đái tháo nhạt sau khi dùng sevoflurane kéo dài ở liều cao; nguy cơ tăng thân nhiệt ác tính rất hiếm nhưng cần điều trị khẩn cấp |
|
Ketamine (liều cao) |
15–20 |
30–60 min |
+ + + |
Y |
N |
+ + |
+ |
1–3 mg/kg/h |
Tụt huyết áp và giảm cung lượng tim được báo cáo khi dùng liều cao |
|
Lorazepam |
5–10 |
1–24 h |
– |
Y |
Y |
+ + + |
+ + |
1–10 mg/h |
Cân nhắc khi cần hoặc YM nhanh theo lịch trình trước khi bắt đầu truyền liên tục. Theo dõi độc tính của propylene glycol sau 24 giờ bằng cách kiểm tra khoảng trống thẩm thấu |
|
Phenobarbital |
5–10 |
12–24 h |
– |
Y |
Y |
– |
– |
7.5 mg/kg IVP then 1–2 mg/kg q12hr |
Theo dõi độc tính của propylene glycol sau 24 giờ bằng cách kiểm tra khoảng trống thẩm thấu |
|
Quetiapine |
20–30 |
1–6 h |
– |
N |
N |
– |
– |
25–100 mg PO q8h |
Tác dụng an thần liên quan đến liều lượng |
|
Sodium gamma hydroxy butyrate (GHB, gamma-OH) |
0.5–1 |
1–6 h |
– |
Y |
Y |
+ + |
– |
2–4 g IVP q 4–6 h |
Nguy cơ hạ kali máu, tăng natri máu, nhiễm kiềm chuyển hóa giảm clo máu |
Sử dụng bằng cách tiêm tĩnh mạch bolus và/hoặc truyền dịch ngoại trừ quetiapine
+ Nhẹ nhàng; + + Vừa phải; + + + Cao; N: không; Y: có; EPS: Triệu chứng ngoại tháp; IVP: bơm trực tiếp tĩnh mạch; PRIS: Hội chứng tiêm truyền liên quan đến Propofol; PRN: khi cần thiết a Hầu hết các mối quan tâm về an toàn là phần mở rộng liên quan đến liều lượng của tác dụng dược lý. Vui lòng tham khảo hướng dẫn kê đơn và/hoặc dược sĩ để biết các biện pháp phòng ngừa an toàn chi tiết hơn b Mặc dù việc sử dụng opioid ở liều cao hơn đôi khi có thể tạo ra sự an thần sâu; opioid không nên được sử dụng như là thuốc duy nhất khi an thần sâu là mục tiêu an thần c Gián đoạn an thần hàng ngày hoặc các phương pháp tiếp cận theo phác đồ khác để duy trì bệnh nhân ở mục tiêu an thần mong muốn nên được xem xét ở những bệnh nhân dùng thuốc an thần và opioid IV liên tục d Thời gian hết tác dụng có thể kéo dài hàng giờ trong ngày ở những bệnh nhân được truyền liều cao trong> 3 ngày, đặc biệt khi đối mặt với bệnh béo phì, bệnh thận giai đoạn cuối và/hoặc bệnh gan giai đoạn cuối
Các chiến lược để tránh dùng quá nhiều thuốc an thần và sự chậm trễ trong phục hồi nhận thức và cai thở máy
Các chiến lược hiệu quả nhắm mục tiêu giảm thiểu an thần và giảm tích tụ thuốc [2]. Việc sử dụng các loại thuốc tác dụng ngắn không có hoặc tối thiểu chất chuyển hóa có hoạt tính (ví dụ: propofol, dexmedetomidine, fentanyl, sufentanil, Remifentanil) có thể mang lại kết quả tốt hơn [2], nhưng chúng có thể tốn kém và tính khả dụng của chúng bị hạn chế do nguồn lực hạn chế, chẳng hạn như đại dịch COVID-19 hiện nay [11].
Các chiến lược sử dụng: thuật toán, gián đoạn hàng ngày và sử dụng không liên tục
Việc sử dụng các phác đồ giảm đau/an thần do điều dưỡng hướng dẫn, cho phép điều dưỡng tại giường điều chỉnh opioid và thuốc an thần (thường sử dụng thang giảm đau và an thần) có thể làm giảm tiếp xúc với thuốc gây nghiện và đẩy nhanh quá trình giải phóng khỏi MV và ICU [26, 27]. Mặc dù một thuật toán chính thức có thể không cần thiết và cũng không mang lại lợi ích gì thêm nếu bệnh nhân đã được xử trí bằng một chiến lược an thần tối thiểu bởi các điều dưỡng có tay nghề cao [28], tình trạng quá tải vẫn phổ biến ở nhiều ICU do đó phác đồ giảm đau/an thần thường có lợi. Tuy nhiên, vai trò của điều dưỡng và khả năng điều chỉnh thuốc giảm đau-an thần của họ dựa trên một phác đồ hay không, phụ thuộc vào tổ chức ICU, văn hóa và các khả năng pháp lý [29, 30]. Vai trò của bác sĩ cũng là tối quan trọng trong mọi trường hợp, giúp điều chỉnh liều lượng thuốc hoặc thảo luận các vấn đề cụ thể với nhóm ICU, bất kể việc sử dụng một phác đồ nào và thảo luận về mục tiêu chung của việc giảm đau-an thần cho từng cá nhân. Điều này đặc biệt cần thiết trong trường hợp ARDS là một tình huống khó giảm đau-an thần. Ở những bệnh nhân được truyền opioid và/hoặc thuốc an thần, việc gián đoạn truyền hàng ngày có liên quan đến việc giảm thời lượng MV và các lợi ích khác, có thể là do: (1) thúc đẩy đánh giá lại nhu cầu an thần, (2) giảm tích lũy thuốc, và ( 3) thúc đẩy quá trình chuyển đổi sang
các chiến lược sử dụng gián đoạn/“khi cần thiết” [31]. Khi được thêm vào một phác đồ an thần nhằm mục tiêu an thần nhẹ, chiến lược gián đoạn hàng ngày không làm giảm thêm số ngày MV [26]. Mặc dù không có thử nghiệm ngẫu nhiên có đối chứng (RCT) ở người lớn mắc ARDS so sánh giữa việc dùng thuốc ngắt quãng và liên tục, một RCT ở trẻ em đã trải qua phẫu thuật lồng ngực [32] và một nghiên cứu quan sát ở người lớn [33] cho thấy rằng chiến lược ngắt quãng có thể liên quan đến ít thuốc hơn và thời gian ngắn hơn của MV. Tuy nhiên, cần có các nghiên cứu sâu hơn trước khi có thể khuyến cáo phương pháp điều trị gián đoạn thay vì liên tục ở tất cả các bệnh nhân. Các nghiên cứu như vậy phải tính đến rủi ro cạnh tranh của hai chiến lược này (ví dụ, có khả năng tăng kích động và tự rút ống với chiến lược ngắt quãng; chậm tỉnh táo và phục hồi nhận thức với chiến lược liên tục).
Tuy nhiên, lựa chọn thuốc an thần có thể quan trọng như chiến lược dùng thuốc đối với kết quả của bệnh nhân ARDS. Trong một RCT của bệnh nhân ICU thở máy, lorazepam ngắt quãng có liên quan đến thời gian MV dài hơn so với propofol truyền liên tục [34]. Cuối cùng, như đã thảo luận ở trên (“Bệnh nhân dùng thuốc phong tỏa thần kinh cơ (giai đoạn đầu của ARDS nặng)”), thế hệ giám sát thần kinh mới, có hoặc không có bộ điều khiển vòng kín tự động, có thể giúp điều chỉnh thuốc để tránh quá tải trong tương lai. Điều này có thể đặc biệt hữu ích khi bắt buộc phải dùng thuốc an thần sâu, để đánh giá tình trạng giảm đau và nhu cầu an thần trong phạm vi mà các công cụ lâm sàng có thể không đủ (tức là bệnh nhân không phản ứng trong trạng thái giảm đau lâm sàng sâu) [19, 35].
Các chiến lược định hướng triệu chứng: giảm đau trước và an thần dựa trên giảm đau
Việc sử dụng tối ưu thuốc giảm đau và thuốc an thần có thể mang lại sự thoải mái cho bệnh nhân thở máy, đẩy nhanh quá trình giải phóng máy thở [29, 36], và có thể làm giảm tỷ lệ đau mãn tính [37]. “Giảm đau-an thần” ủng hộ việc sử dụng thuốc giảm đau trước thuốc an thần để giảm đau (“thuốc giảm đau trước”) hoặc thuốc giảm đau có đặc tính an thần (“thuốc an thần trên nền giảm đau”) [2]. Những cách tiếp cận này đã được phát triển để tránh hoặc giảm việc sử dụng thuốc an thần và tạo điều kiện tốt hơn cho việc cai máy thở [29, 36]. Một cách tiếp cận đa phương thức để giảm đau kết hợp việc sử dụng nhiều hơn một loại thuốc giảm đau, mỗi loại có cơ chế hoạt động khác nhau. Sử dụng các loại thuốc giảm đau khác nhau có thể đạt được hiệu quả có lợi trong khi làm giảm tác dụng phụ của từng thuốc [38]. Bệnh nhân có thể được bảo vệ khỏi các tác dụng phụ của opioid như an thần, ảo giác và tăng nồng độ/phụ thuộc/cai opioid bằng cách sử dụng đồng thời các thuốc không phải opioid như ketamine liều thấp [37], paracetamol và/hoặc nefopam [2]. Chuẩn độ cẩn thận thuốc giảm đau (thuật toán, ngắt quãng hàng ngày và dùng ngắt quãng) và can thiệp nhẹ nhàng không dùng thuốc (ví dụ: âm nhạc hoặc kỹ thuật thư giãn) [2] có thể giúp tránh chậm trễ trong phục hồi nhận thức, một điều kiện tiên quyết quan trọng để cai máy thở.
Lựa chọn thuốc
Các yếu tố liên quan đến bệnh nhân quyết định việc lựa chọn thuốc bao gồm:
Tuổi tác: Bệnh nhân cao tuổi thể hiện dược động học và dược lực học khác nhau [39, 40] với giảm độ thanh thải và tăng nhạy cảm với thuốc giảm đau, thuốc an thần và thuốc chống loạn thần. Họ có nhiều nguy cơ bị thông khí kéo dài, mê sảng và tử vong. Ngược lại, những bệnh nhân trẻ hơn có thể yêu cầu liều lượng thuốc giảm đau, thuốc an thần và thuốc hỗ trợ cao hơn. Họ có nguy cơ mê sảng thấp hơn và dễ dung nạp hơn với opioid và benzodiazepine.
Phụ thuộc: Những bệnh nhân ARDS sử dụng opioid và/hoặc thuốc kích thích thần kinh thường xuyên có thể yêu cầu liều opioid và/hoặc thuốc an thần cao hơn.
Rối loạn chức năng cơ quan: Rối loạn chức năng cơ quan cấp tính hoặc cấp tính trên nền mãn tính (ví dụ, chấn thương thận cấp tính, bệnh cơ tim nhiễm trùng, rối loạn chức năng gan cấp tính) dẫn đến những thay đổi dược động học và dược lực học phản ánh những thay đổi ở người cao tuổi [41], như đã thảo luận ở trên.
Bảng 1 báo cáo các đặc điểm chính của các loại thuốc đầu tiên và thứ hai được sử dụng để giảm đau và an thần. Đối với người lớn thở máy, hướng dẫn khuyến cáo giảm đau trước tiên, và nếu cần dùng thuốc an thần liên tục, propofol hoặc dexmedetomidine thay vì midazolam [2]. Tuy nhiên, các thử nghiệm thông báo các khuyến nghị này đã thu nhận một số bệnh nhân ARDS; bệnh nhân cần điều trị liệt cơ, oxygen hóa qua màng ngoài cơ thể (ECMO) hoặc bị sốc thường bị loại trừ; các gói chăm sóc an thần nhẹ (ví dụ, ABCDEF [42–45]), phòng ngừa mê sảng và cai theo phác đồ hiếm khi được sử dụng; và các phương pháp tiếp cận giảm đau/an thần đa phương thức bị hạn chế [2, 10]. Khi cá nhân hóa liệu pháp giảm đau/an thần cho người lớn mắc ARDS, cần xem xét sự khác biệt về dược lý giữa các thuốc [11].
Thuốc giảm đau
Opioid với tác dụng khởi phát nhanh, phụ thuộc vào liều lượng, và khả năng làm giảm quá mức trung khu điều hòa hô hấp vẫn là thuốc giảm đau chính trong ARDS [46]. Tuy nhiên, chúng không phải là không có tác dụng phụ: (1) ức chế miễn dịch, (2) tích tụ thuốc dẫn đến an thần kéo dài và ức chế hô hấp có thể ảnh hưởng đến sự giải phóng máy thở, (3) dung nạp trong vòng 48 giờ, (4) dấu hiệu cai nghiện sau khi ngừng thuốc [47], (5) tăng trương lực và các hội chứng đau mãn tính khi sử dụng kéo dài, và (6) liệt ruột có khả năng dẫn đến tăng áp lực ổ bụng và làm xấu đi cơ hô hấp sau đó. Mặc dù không được đánh giá nghiêm ngặt trong ARDS, thuốc giảm đau không opioid (ví dụ, paracetamol, ketamine và nefopam) được sử dụng theo phương thức đa phương thức, có thể làm giảm việc sử dụng opioid và các tác dụng phụ của chúng, nhưng cũng cải thiện việc kiểm soát cơn đau ở người lớn bị bệnh nặng [2, 48]. Ketamine, một chất đối kháng thụ thể N-methyl-D-aspartate (NMDA), gây giảm đau mạnh mà không ảnh hưởng đến hệ thống hô hấp, làm cho nó trở thành một chất bổ sung có khả năng hữu ích cho opioid ở những bệnh nhân ARDS đã sẵn sàng để thở máy [49]. Tuy nhiên, một RCT đơn trung tâm, bao gồm 40% bệnh nhân bị suy hô hấp cấp, đã so sánh Remifentanil và ketamine liều thấp với Remifentanil và giả dược, và không cho thấy bất kỳ tác dụng nào của opioid [50]. Cần có các nghiên cứu sâu hơn trước khi ketamine có thể được khuyến nghị về tác dụng làm giảm opioid của nó. Truyền ≥ 1 mg/kg/h gây an thần sâu do tác dụng gây mê phân ly của ketamine, cùng với việc tăng nguy cơ xuất hiện ảo giác và tăng huyết áp. Tác dụng giảm đau của nefopam có thể so sánh với opioid liều thấp mà không ảnh hưởng đến hệ thống hô hấp hoặc ý thức. Paracetamol theo lịch trình (uống hoặc IV) sẽ làm giảm tiêu thụ opioid dù sử dụng IV có thể gây nhịp tim nhanh và hạ huyết áp.
Thuốc an thần
Propofol và midazolam (cả hai chất chủ vận GABA) làm giảm trung khu điều hòa hô hấp, gây ức chế miễn dịch và có thể gây an thần sâu [2, 46]. Propofol được ưu tiên hơn midazolam vì nó ít an thần kéo dài và/hoặc mê sảng, dễ điều chỉnh hơn và độ thanh thải không phụ thuộc vào chức năng gan và thận. Tuy nhiên, propofol có thể gây tăng triglycerid máu và hội chứng tiêm truyền liên quan đến propofol (PRIS), thường ở liều ≥ 60 mcg/kg/phút. Dexmedetomidine, một chất chủ vận alpha-2, không gây ức chế miễn dịch cũng như không làm giảm trung khu điều hòa hô hấp, có đặc tính giảm đau và không giống như propofol hoặc midazolam, có thể cải thiện giấc ngủ và có thể liên quan đến tỷ lệ mê sảng thấp hơn. Không thể dùng dexmedetomidine ở mức độ rất sâu để an thần [2, 11, 51]. Khi được sử dụng làm thuốc an thần chính trong RCT lớn của một nhóm bệnh nhân ICU thở máy không đồng nhất, hai phần ba số bệnh nhân được chọn ngẫu nhiên dexmedetomidine cũng nhận được propofol và kết quả tương tự giữa hai nhóm [8]. Ở những bệnh nhân ARDS cần an thần sâu, có thể cần dùng midazolam tiêm tĩnh mạch hoặc thuốc chống loạn thần bổ sung ở những bệnh nhân không được an thần đầy đủ bằng opioid liên tục, propofol và dexmedetomidine. Tuy nhiên, benzodiazepine có liên quan đến nguy cơ mê sảng cao hơn [2]. Thuốc mê dễ bay hơi (ví dụ, isoflurane, sevoflurane) sẽ gây mê từ nhẹ đến sâu, ngay cả ở những bệnh nhân khó an thần bằng benzodiazepine và opioid [52]. Một RCT trung tâm đơn lẻ cho thấy sevoflurane có liên quan đến thời gian thức tỉnh và rút nội khí quản ngắn hơn khi so sánh với propofol-IV hoặc midazolam [53]. Khi so sánh sevoflurane với midazolam ở bệnh nhân ARDS, quá trình oxy hóa được cải thiện, và giảm viêm phế nang/toàn thân và tổn thương biểu mô phổi [54]. Kết quả từ một thử nghiệm lớn đang diễn ra ở giai đoạn III về thuốc an thần ICU với thuốc mê dễ bay hơi đang chờ xử lý (ClinicalTrials.gov: NCT04235608). Thuốc an thần ICU dạng hít yêu cầu thiết bị chuyên dụng (máy xông hơi thu nhỏ nội tuyến có đặc tính làm ẩm/kháng khuẩn), theo dõi (thể tích khí lưu thông, nồng độ khí cuối nhịp thở đối với các chất dễ bay hơi và CO2, nhiệt độ để phát hiện có thể tăng thân nhiệt ác tính) và dò khí. Khi thiết bị ICU chuyên dụng được sử dụng để an thần qua đường hô hấp, không thể sử dụng thiết bị tạo ẩm và ấm vì thiết bị đã có đặc tính trao đổi nhiệt và độ ẩm. Nhóm ICU nên nắm rõ những vấn đề kỹ thuật này trước khi sử dụng thuốc an thần hít trong thực tế [55].
Phương pháp tiếp cận giảm đau/an thần toàn cầu phù hợp với bệnh nhân ards: đề xuất chiến lược xử trí thởmáy đầu tiên
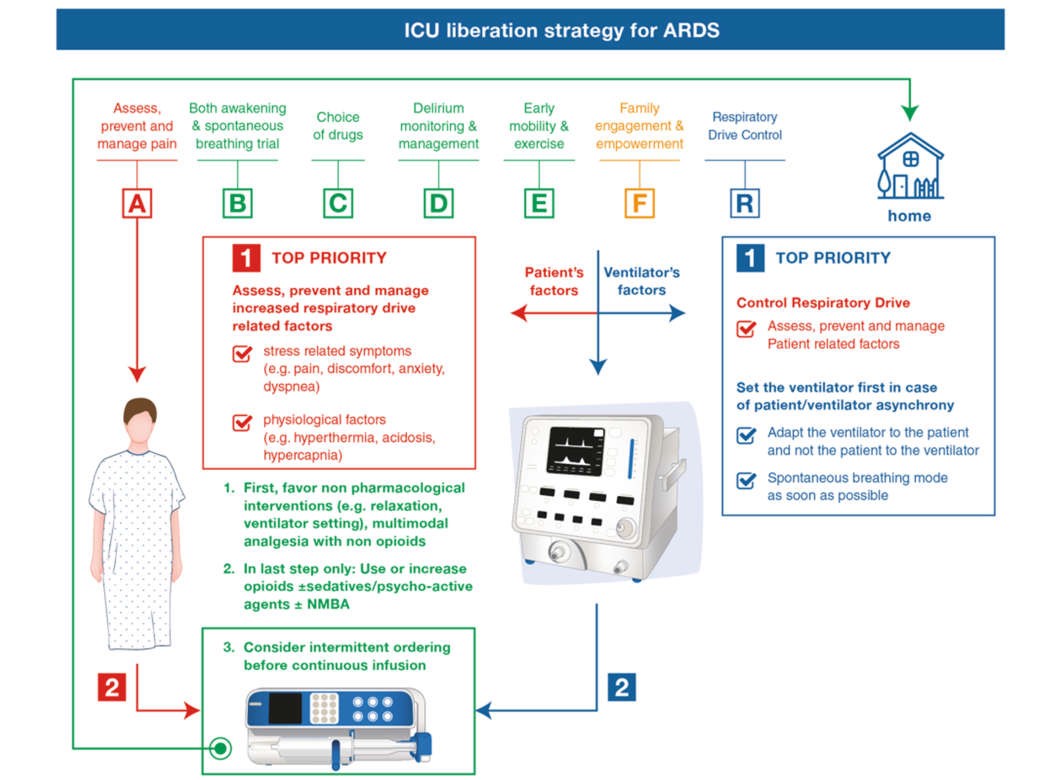
Các chiến lược giảm đau/an thần toàn cầu như Gói ABCDEF [42–45] đã được mô tả và xác nhận bởi các nghiên cứu đa trung tâm lớn nhằm cải thiện kết quả của bệnh nhân, thúc đẩy phục hồi nhanh và giải phóng ICU: [A] Đánh giá và xử trí cơn đau; [B] Cả hai thử nghiệm thức tỉnh và thở; [C] Chọn thuốc an thần tối ưu (tránh dùng benzodiazepin khi có thể) và điều chỉnh đến mức an thần nhẹ nhất có thể; [D] Đánh giá và xử trí mê sảng; [E] Vận động sớm; và [F] Sự tham gia của gia đình khi có thể.
Ở những bệnh nhân mắc ARDS, thuốc an thần sâu, mặc dù không phải lúc nào cũng cần thiết, có thể được sử dụng để duy trì các cài đặt bảo vệ phổi hoặc điều trị bệnh không đồng bộ. Chiến lược tiêu chuẩn trước hết là giảm đau, điều chỉnh máy thở để giảm thiểu sự không đồng bộ và kiểm soát trung khu điều hòa hô hấp của bệnh nhân có thể làm giảm nhu cầu tăng liều thuốc an thần. Duy trì nhịp thở tự phát có thể có lợi cho bệnh nhân ARDS. Trong nghiên cứu LUNG-SAFE, những bệnh nhân có nhịp thở tự phát ít cần dùng thuốc an thần hơn những bệnh nhân không được phép thở tự phát; thở tự phát có liên quan đến tăng số ngày không thở máy và thời gian nằm ICU ngắn hơn [56]. Một RCT ở những bệnh nhân không có ARDS cho thấy thở tự phát sớm cũng có liên quan đến việc tiết kiệm thuốc an thần và giảm số ngày thở máy [6]. Tuy nhiên, trong khi thích thở tự phát, cần chú ý đến việc bệnh nhân gắng sức quá mức, vì giảm đau/an thần không đủ cũng có thể làm tổn thương cả cơ hoành và phổi do nỗ lực thở [57]. Mặt khác, giảm đau/an thần quá mức có thể gây teo cơ hoành [58, 59].
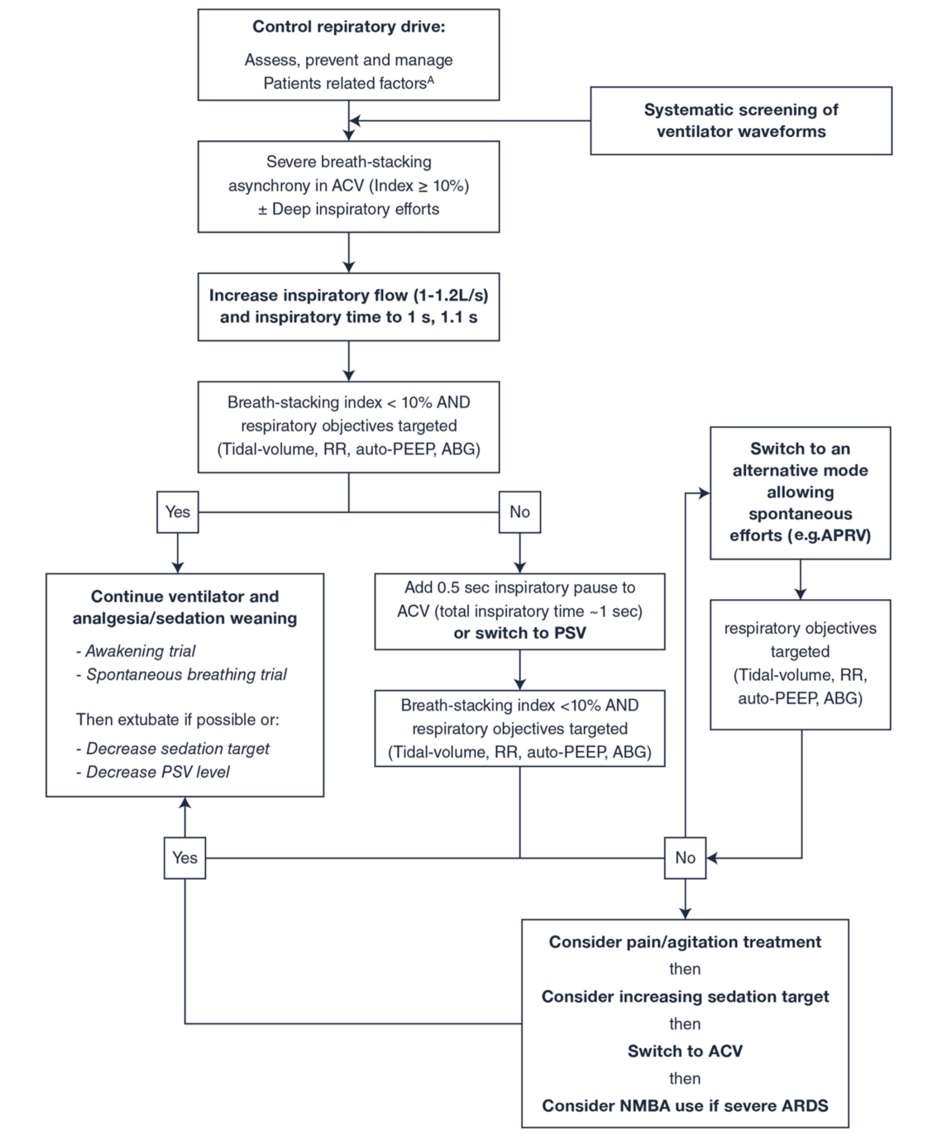
Xử trí máy thở cơ học trước trước khi tăng độ sâu của thuốc an thần có thể được coi là một chiến lược hàng đầu. Chữ “R” có tính đến “kiểm soát trung khu điều hòa hô hấp” có thể là một bổ sung hữu ích cho Gói ABCDEF dành cho bệnh nhân ARDS. Điều này có thể được thực hiện bằng cách tối ưu hóa cài đặt máy thở để nhắm mục tiêu đồng bộ máy thở của bệnh nhân trước khi tăng thuốc an thần và thuốc giảm đau hoặc chuyển sang NMBA [25]. Điều trị tăng thân nhiệt và nhiễm toan khi có thể cũng có thể làm giảm trung khu điều hòa hô hấp. Một thuật toán để khắc phục sự cố điều chỉnh máy thở cơ học được đề xuất (Hình 2). ABCDEF + R có thể là gói an thần mới cho bệnh nhân ARDS nói chung, mặc dù cần có thêm dữ liệu để kiểm tra ý tưởng mới lạ này. Hình 3 cho thấy gói ACBDEF toàn cầu với R được kết hợp mới.
Giảm đau và an thần cho bệnh nhân nằm sấp
Ở những bệnh nhân ARDS, nên nằm sấp khi tỷ số PaO2/FIO2
Hình 2 Đề xuất thuật toán xử lý sự cố điều chỉnh máy thở cơ học, phỏng theo [6, 25]. Các yếu tố liên quan đến bệnh nhân bao gồm các triệu chứng liên quan đến căng thẳng (ví dụ: đau, khó chịu, lo lắng, khó thở) và các yếu tố sinh lý (ví dụ: tăng thân nhiệt, nhiễm toan, tăng CO2). ABG: khí máu động mạch, ACV: thể tích hỗ trợ kiểm soát, APRV: thông khí giải phóng áp lực đường thở, ARDS: hội chứng nguy kịch hô hấp cấp, PEEP: áp lực dương cuối thì thở ra, PSV: thông khí hỗ trợ áp lực, NMBA: thuốc ngăn chặn thần kinh cơ, RR: tần số hô hấp
Hình 3 Đã cập nhật gói ABCDEF-R cho bệnh nhân thở máy, bao gồm cả bệnh nhân ARDS, điều chỉnh từ [42–45]
Thuốc an thần/giảm đau phải được tối ưu hóa trong quá trình xoay và trong thời gian nằm sấp vì nằm sấp có thể gây đau. Tuy nhiên, không có nghiên cứu tiền cứu về an thần khi nằm sấp, cho dù NMBA có được sử dụng hay không. Các nghiên cứu không kiểm soát gần đây đã báo cáo tính khả thi và an toàn của việc thông khí nằm sấp ở bệnh nhân ARDS đặt nội khí quản dưới sự hỗ trợ thở bằng thuốc an thần nhẹ (thuốc mê dễ bay hơi) [62], và bệnh nhân không đặt nội khí quản không dùng thuốc an thần [63].
Giảm đau và an thần cho bệnh nhân ecmo
Hầu hết các cân nhắc liên quan đến an thần ở bệnh nhân nặng cũng được áp dụng cho bệnh nhân điều trị ECMO. Tuy nhiên, một số khía cạnh cụ thể cần được thảo luận. Bệnh nhân điều trị ECMO có một cơ quan bổ sung, bao gồm một hệ thống mạch máu ngoài cơ thể (ống polyvinyl clorua) và nhu mô (màng phổi). Sự hiện diện của lá phổi nhân tạo này có hai ý nghĩa chính.
Đầu tiên, bệnh nhân có thêm nguy cơ, tức là dịch chuyển/trục trặc của hệ thống ECMO, đặc biệt là cannulae nội mạch (nói chung là tiếp cận tĩnh mạch). Một sự kiện như vậy, có thể do cử động/kích động của bệnh nhân, có thể gây tử vong. Vì lý do này, bệnh nhân ECMO thường được an thần sâu và thường xuyên bị liệt cơ. Cách tiếp cận này, nhằm mục đích tránh sự dịch chuyển ống thông, vẫn thường được áp dụng khi ECMO được bắt đầu trong giai đoạn rất cấp tính của ARDS. Tuy nhiên, trong những năm gần đây ngày càng có nhiều sự quan tâm đến việc sử dụng thuốc an thần nhẹ cho bệnh nhân ECMO — một phương pháp “ECMO tỉnh táo” [64]. Cách tiếp cận “ECMO tỉnh táo”, tuy độc đáo và mang tính khiêu khích, là một chiến lược nhằm tránh dùng thuốc an thần sâu trong ECMO. Cách tiếp cận này thậm chí có thể cho phép cai và rút nội khí quản cho bệnh nhân khi vẫn đang điều trị ECMO [65], có thể làm giảm các nguy cơ liên quan đến an thần và thở máy xâm lấn. Ngoài ra, có thể thực hiện phục hồi thể chất sớm khi vẫn đang điều trị ECMO [66]. Tuy nhiên, hiện có rất ít bằng chứng về tính khả thi và an toàn của phương pháp này.
Hàm ý thứ hai có liên quan là sự hiện diện của hệ thống ngoài cơ thể có khả năng làm thay đổi đáng kể dược động học của một số loại thuốc và do đó làm giảm sinh khả dụng của chúng. Do tăng thể tích phân phối và hấp thụ, đặc biệt với các thuốc ưa mỡ trong hệ thống ngoài cơ thể [67, 68], nồng độ thuốc trong huyết tương có thể thấp hơn dự kiến. Vì những lý do này, việc theo dõi cẩn thận mức độ an thần ở bệnh nhân điều trị ECMO là cực kỳ quan trọng.
Giảm đau và an thần cho bệnh nhân covid-19
Những kinh nghiệm ban đầu trong đại dịch COVID19 đã cho thấy những thay đổi trong cách tiếp cận với thuốc an thần, với xu hướng hướng tới sự an thần sâu và sự hồi sinh của việc sử dụng dịch truyền benzodiazepine [9]. Điều này được thúc đẩy bởi tình trạng thiếu propofol và fentanyl và lo ngại rằng tổn thương phổi khi gặp COVID-19 có thể khác và cần các chiến lược thông khí tích cực hơn đòi hỏi phải an thần sâu [69]. Ngoài ra, sự kích động và tự rút ống nội khí quản, đặc biệt là khi nằm sấp, đã dẫn đến việc các nhà cung cấp dịch vụ chăm sóc sức khỏe sợ tiếp xúc với COVID-19. Tuy nhiên, mỗi ngày đặt nội khí quản không cần thiết sẽ làm tăng nguy cơ biến chứng liên quan đến thở máy [70], bao gồm các tình huống nguy cấp có thể cần can thiệp cấp cứu ngay lập tức (ví dụ như tắc nghẽn hoặc dịch chuyển ống khí quản) do những người chăm sóc sức khỏe không thể có đủ thời gian để tự bảo vệ mình, dẫn đến nguy cơ ô nhiễm cao hơn. Câu hỏi về sự bảo vệ của nhà cung cấp dịch vụ chăm sóc sức khỏe là rất quan trọng, nhưng nguy cơ nhiễm vi rút trong các quy trình tiêu chuẩn có lẽ đã được ước tính quá mức [71]. Do đó, các nhà cung cấp dịch vụ chăm sóc sức khỏe có lẽ nên tập trung vào các nguyên lý cơ bản đã được chứng minh về xử trí hỗ trợ ngay cả trong ARDS do COVID-19 — hướng dẫn PADIS [2] và Gói ABCDEF [42–45]. Để tối ưu hóa chiến lược giải phóng máy thở, có lẽ bắt buộc phải cải thiện các chiến lược phức tạp về giảm đau/an thần và cài đặt máy thở/kiểm soát trung khu hô hấp (Hình 2). Một “R” có thể được thêm vào từ viết tắt ABCDEF (Hình 3) để tăng cường tác động của các bộ phận đã được chứng minh trước đây của gói này [44, 45].
Giảm đau
Theo các hướng dẫn gần đây, nên ưu tiên giảm đau trước khi dùng thuốc an thần, xem xét giảm đau trước và/hoặc một chiến lược dựa trên giảm đau đơn thuần [2]. Các opioid tiêm tĩnh mạch được sử dụng phổ biến nhất bao gồm hydromorphone, fentanyl, sufentanil, Remifentanil và morphin, thận trọng đối với trường hợp suy thận sau này. Các thuốc tiết chế opioid (ví dụ, gabapentin, paracetamol, nefopam, lidocain, carbamazepine, clonidine, dexmedetomidine và ketamine liều thấp) có thể được sử dụng trong phương pháp giảm đau đa phương thức với lợi ích bổ sung là một số loại thuốc này có đặc tính an thần [48].
Thuốc chống viêm không steroid nên được sử dụng hết sức thận trọng ở tất cả những bệnh nhân bị bệnh nặng (có và không có ARDS) vì nguy cơ tác dụng phụ cao hơn ở nhóm đối tượng này, bao gồm cả tác dụng ức chế miễn dịch và tổn thương thận. Gây tê tại chỗ và/hoặc vùng nên được sử dụng khi có chỉ định, đặc biệt là sau chấn thương hoặc phẫu thuật [72].
Thuốc an thần
Sự lựa chọn thuốc an thần được quyết định bởi độ sâu mong muốn của thuốc an thần, nhu cầu về tác dụng gây quên và dễ chuẩn độ. Đối với hầu hết các bệnh nhân thở máy, propofol và dexmedetomidine là những thuốc lý tưởng, với midazolam truyền liên tục như một giải pháp thay thế hàng thứ hai. Sự thiếu hụt các thuốc này đặt ra một thách thức lớn, đặc biệt là khi cần phải an thần sâu, chẳng hạn như trong điều trị liệt cơ [9]. Các thuốc benzodiazepin khác, ketamine, phenobarbital, thuốc mê dễ bay hơi (ví dụ: sevoflurane, isoflurane) hoặc thậm chí natri gamma-hydroxy-butyrate (GHB, gamma-OH) cũng có thể được sử dụng để đạt được an thần sâu nếu cần. Khi bệnh nhân không cần dùng thuốc an thần sâu, các lựa chọn thay thế bao gồm: benzodiazepin ngắt quãng liều thấp để điều trị lo âu (lorazepam, diazepam, clonazepam), thuốc chống loạn thần (levomepromazine, loxapine, haloperidol, cyamemazine, chlorpromazine và quetiapine) và clonidine. Nhiều thuốc trong số này đã không được nghiên cứu như thuốc an thần chính cho bệnh nhân nặng.
Thuốc liệt cơ (NMBA)
Truyền liên tục cisatracurium, atracurium, hoặc rocuronium thường được dành cho bệnh nhân ARDS với tình trạng thiếu oxy nặng hoặc khó chữa mặc dù đã tối ưu hóa máy thở [13]. Trong trường hợp thiếu thuốc, một cách để bảo quản các thuốc này là cung cấp chúng không liên tục (liều lượng nhanh) hoặc “khi cần thiết” được hướng dẫn bởi đồng bộ thông khí hoặc dựa trên theo dõi thần kinh cơ. Nếu có thể, việc truyền thêm magiê có thể làm tăng hiệu ứng NMBA [73]. Vecuronium là một thuốc khác có thể được xem xét nhưng có liên quan đến tình trạng liệt cơ kéo dài do rối loạn chức năng cơ quan, đặc biệt là suy thận [74].
Kết luận
Giảm đau và an thần là một thách thức ở bệnh nhân ARDS mà thuốc an thần sâu và NMBA thường được chỉ định. Để rút ngắn thời gian giải phóng khỏi thở máy, cải thiện kết cục của bệnh nhân và tiết kiệm các nguồn lực của ICU, chỉ định của họ phải được chứng minh thường xuyên và các hướng dẫn hiện hành về an thần/giảm đau được xem xét và áp dụng càng sớm càng tốt. Xử trí máy thở cơ học là điều tối quan trọng để tránh gây mê sâu không cần thiết. Phương pháp ABCDEF có thể nhận được một chữ cái mới là “R” để kiểm soát hệ thống hô hấp, ABCDEF-R là gói dành cho bệnh nhân ARDS hoặc thậm chí nói chung là dành cho bệnh nhân thở máy. Cần có bằng chứng để hỗ trợ cách tiếp cận mới này. Cần có các nghiên cứu sâu hơn liên quan đến việc xác nhận các công cụ điện sinh lý mới để đánh giá giảm đau/an thần ở bệnh nhân liệt và hiệu quả của các loại thuốc mới với thời gian đào thải nhanh. Những chiến lược mới này có thể tránh được cả việc lạm dụng thuốc và các triệu chứng đau đớn của bệnh nhân được điều trị không hiệu quả. Cuối cùng, việc sử dụng tài liệu hợp tác gồm các chuyên gia từ Bắc Mỹ, Châu Âu và Úc này nên được coi là bước đầu tiên trong khi sự hợp tác sâu hơn với các chuyên gia từ các quốc gia khác nhau vẫn là một mục tiêu quan trọng cho công việc trong tương lai trong lĩnh vực này.
Tài liệu tham khảo
Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [PubMed] [CrossRef] [Google Scholar]
Devlin JW, Skrobik Y, Gelinas C, Needham DM, Slooter AJC, Pandharipande PP, Watson PL, Weinhouse GL, Nunnally ME, Rochwerg B, Balas MC, van den Boogaard M, Bosma KJ, Brummel NE, Chanques G, Denehy L, Drouot X, Fraser GL, Harris JE, Joffe AM, Kho ME, Kress JP, Lanphere JA, McKinley S, Neufeld KJ, Pisani MA, Payen JF, Pun BT, Puntillo KA, Riker RR, Robinson BRH, Shehabi Y, Szumita PM, Winkelman C, Centofanti JE, Price C, Nikayin S, Misak CJ, Flood PD, Kiedrowski K, Alhazzani W. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018;46:e825–e873. doi: 10.1097/CCM.0000000000003299. [PubMed] [CrossRef] [Google Scholar]
Chanques G, Drouot X, Payen JF. 2008–2018: ten years of gradual changes in the sedation guidelines for critically ill patients. Anaesth Crit Care Pain Med. 2018;37:509–511. doi: 10.1016/j.accpm.2018.10.014. [PubMed] [CrossRef] [Google Scholar]
Papazian L, Aubron C, Brochard L, Chiche JD, Combes A, Dreyfuss D, Forel JM, Guerin C, Jaber S, Mekontso-Dessap A, Mercat A, Richard JC, Roux D, Vieillard-Baron A, Faure H. Formal guidelines: management of acute respiratory distress syndrome. Ann Intensive Care. 2019;9:69. doi: 10.1186/s13613-019-0540-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Papazian L, Forel JM, Gacouin A, Penot-Ragon C, Perrin G, Loundou A, Jaber S, Arnal JM, Perez D, Seghboyan JM, Constantin JM, Courant P, Lefrant JY, Guerin C, Prat G, Morange S, Roch A, Investigators AS. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med. 2010;363:1107–1116. doi: 10.1056/NEJMoa1005372. [PubMed] [CrossRef] [Google Scholar]
Chanques G, Conseil M, Roger C, Constantin JM, Prades A, Carr J, Muller L, Jung B, Belafia F, Cisse M, Delay JM, de Jong A, Lefrant JY, Futier E, Mercier G, Molinari N, Jaber S. Immediate interruption of sedation compared with usual sedation care in critically ill postoperative patients (SOS-Ventilation): a randomised, parallel-group clinical trial. Lancet Respir Med. 2017;5:795–805. doi: 10.1016/S2213-2600(17)30304-1. [PubMed] [CrossRef] [Google Scholar]
Shehabi Y, Bellomo R, Kadiman S, Ti LK, Howe B, Reade MC, Khoo TM, Alias A, Wong YL, Mukhopadhyay A, McArthur C, Seppelt I, Webb SA, Green M, Bailey MJ. Sedation intensity in the first 48 hours of mechanical ventilation and 180-day mortality: a multinational prospective longitudinal cohort study. Crit Care Med. 2018;46:850–859. doi: 10.1097/CCM.0000000000003071. [PubMed] [CrossRef] [Google Scholar]
Shehabi Y, Howe BD, Bellomo R, Arabi YM, Bailey M, Bass FE, Bin Kadiman S, McArthur CJ, Murray L, Reade MC, Seppelt IM, Takala J, Wise MP, Webb SA. Early sedation with dexmedetomidine in critically ill patients. N Engl J Med. 2019;380:2506–2517. doi: 10.1056/NEJMoa1904710. [PubMed] [CrossRef] [Google Scholar]
Payen JF, Chanques G, Futier E, Velly L, Jaber S, Constantin JM. Sedation for critically ill patients with COVID-19: Which specificities? One size does not fit all. Anaesth Crit Care Pain Med. 2020;39:341–343. doi: 10.1016/j.accpm.2020.04.010. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Devlin JW, O’Neal HR, Jr, Thomas C, Barnes Daly MA, Stollings JL, Janz DR, Ely EW, Lin JC. Strategies to optimize ICU liberation (A to F) bundle performance in critically ill adults with Coronavirus disease 2019. Crit Care Explor. 2020;2:e0139. doi: 10.1097/CCE.0000000000000139. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ammar MA, Sacha GL, Welch SC, Bass SN, Kane-Gill SL, Duggal A, Ammar AA. Sedation, analgesia, and paralysis in COVID-19 patients in the setting of drug shortages. J Intensive Care Med. 2020 doi: 10.1177/0885066620951426. [PubMed] [CrossRef] [Google Scholar]
Siow WT, Tang SH, Agrawal RV, Tan AYH, See KC. Essential ICU drug shortages for COVID-19: what can frontline clinicians do? Crit Care. 2020;24:260. doi: 10.1186/s13054-020-02971-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Alhazzani W, Belley-Cote E, Moller MH, Angus DC, Papazian L, Arabi YM, Citerio G, Connolly B, Denehy L, FoxRobichaud A, Hough CL, Laake JH, Machado FR, Ostermann M, Piraino T, Sharif S, Szczeklik W, Young PJ, Gouskos A, Kiedrowski K, Burns KEA. Neuromuscular blockade in patients with ARDS: a rapid practice guideline. Intensive Care Med. 2020;46:1977–1986. doi: 10.1007/s00134-020-06227-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Murray MJ, DeBlock H, Erstad B, Gray A, Jacobi J, Jordan C, McGee W, McManus C, Meade M, Nix S, Patterson A, Sands MK, Pino R, Tescher A, Arbour R, Rochwerg B, Murray CF, Mehta S. Clinical practice guidelines for sustained neuromuscular blockade in the adult critically ill patient. Crit Care Med. 2016;44:2079–2103. doi: 10.1097/CCM.0000000000002027. [PubMed] [CrossRef] [Google Scholar]
National Heart, Lung, and Blood Institute PETAL Clinical Trials Network, Moss M, Huang DT, Brower RG, Ferguson ND, Ginde AA, Gong MN, Grissom CK, Gundel S, Hayden D, Hite RD, Hou PC, Hough CL, Iwashyna TJ, Khan A, Liu KD, Talmor D, Thompson BT, Ulysse CA, Yealy DM, Angus DC (2019) Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med 380:1997–2008 [PMC free article] [PubMed]
Gelinas C, Joffe AM, Szumita PM, Payen JF, Berube M, Shahiri TS, Boitor M, Chanques G, Puntillo KA. A psychometric analysis update of behavioral pain assessment tools for noncommunicative, critically ill adults. AACN Adv Crit Care. 2019;30:365–387. doi: 10.4037/aacnacc2019952. [PubMed] [CrossRef] [Google Scholar]
Chanques G, Tarri T, Ride A, Prades A, De Jong A, Carr J, Molinari N, Jaber S. Analgesia nociception index for the assessment of pain in critically ill patients: a diagnostic accuracy study. Br J Anaesth. 2017;119:812–820. doi: 10.1093/bja/aex210. [PubMed] [CrossRef] [Google Scholar]
Shahiri TS, Richard-Lalonde M, Richebe P, Gelinas C. Exploration of the nociception level (NOL) index for pain assessment during endotracheal suctioning in mechanically ventilated patients in the intensive care unit: an observational and feasibility study. Pain Manag Nurs. 2020 doi: 10.1016/j.pmn.2020.02.067. [PubMed] [CrossRef] [Google Scholar]
Vinclair M, Schilte C, Roudaud F, Lavolaine J, Francony G, Bouzat P, Bosson JL, Payen JF. Using pupillary pain index to assess nociception in sedated critically ill patients. Anesth Analg. 2019;129:1540–1546. doi: 10.1213/ANE.0000000000004173. [PubMed] [CrossRef] [Google Scholar]
Riker R, Fraser G, Simmons L, Wilkins M. Validating the sedation-agitation scale with the bispectral index and visual analog scale in adult ICU patients after cardiac surgery. Intensive Care Med. 2001;27:853–858. doi: 10.1007/s001340100912. [PubMed] [CrossRef] [Google Scholar]
Sessler CN, Gosnell MS, Grap MJ, Brophy GM, O’Neal PV, Keane KA, Tesoro EP, Elswick RK. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. Am J Respir Crit Care Med. 2002;166:1338–1344. doi: 10.1164/rccm.2107138. [PubMed] [CrossRef] [Google Scholar]
Vincent JL, Shehabi Y, Walsh TS, Pandharipande PP, Ball JA, Spronk P, Longrois D, Strom T, Conti G, Funk GC, Badenes R, Mantz J, Spies C, Takala J. Comfort and patient-centred care without excessive sedation: the eCASH concept. Intensive Care Med. 2016;42:962–971. doi: 10.1007/s00134-016-4297-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Mehta S, Spies C, Shehabi Y. Ten tips for ICU sedation. Intensive Care Med. 2018;44:1141–1143. doi: 10.1007/s00134-017-4992-9. [PubMed] [CrossRef] [Google Scholar]
Strom T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. Lancet. 2010;375:475–480. doi: 10.1016/S0140-6736(09)62072-9. [PubMed] [CrossRef] [Google Scholar]
Chanques G, Kress JP, Pohlman A, Patel S, Poston J, Jaber S, Hall JB. Impact of ventilator adjustment and sedationanalgesia practices on severe asynchrony in patients ventilated in assist-control mode. Crit Care Med. 2013;41:2177– 2187. doi: 10.1097/CCM.0b013e31828c2d7a. [PubMed] [CrossRef] [Google Scholar]
Mehta S, Burry L, Cook D, Fergusson D, Steinberg M, Granton J, Herridge M, Ferguson N, Devlin J, Tanios M, Dodek P, Fowler R, Burns K, Jacka M, Olafson K, Skrobik Y, Hebert P, Sabri E, Meade M. Daily sedation interruption in mechanically ventilated critically ill patients cared for with a sedation protocol: a randomized controlled trial. JAMA. 2012;308:1985–1992. doi: 10.1001/jama.2012.13872. [PubMed] [CrossRef] [Google Scholar]
Brook AD, Ahrens TS, Schaiff R, Prentice D, Sherman G, Shannon W, Kollef MH. Effect of a nursing-implemented sedation protocol on the duration of mechanical ventilation. Crit Care Med. 1999;27:2609–2615. doi: 10.1097/00003246199912000-00001. [PubMed] [CrossRef] [Google Scholar]
Bucknall TK, Manias E, Presneill JJ. A randomized trial of protocol-directed sedation management for mechanical ventilation in an Australian intensive care unit. Crit Care Med. 2008;36:1444–1450. doi: 10.1097/CCM.0b013e318168f82d. [PubMed] [CrossRef] [Google Scholar]
Chanques G, Jaber S, Barbotte E, Violet S, Sebbane M, Perrigault PF, Mann C, Lefrant JY, Eledjam JJ. Impact of systematic evaluation of pain and agitation in an intensive care unit. Crit Care Med. 2006;34:1691–1699. doi: 10.1097/01.CCM.0000218416.62457.56. [PubMed] [CrossRef] [Google Scholar]
Dodek P, Chanques G, Brown G, Norena M, Grubisic M, Wong H, Jaber S. Role of organisational structure in implementation of sedation protocols: a comparison of Canadian and French ICUs. BMJ Qual Saf. 2012;21:715–721. doi: 10.1136/bmjqs-2011-000083. [PubMed] [CrossRef] [Google Scholar]
Kress JP, Pohlman AS, O’Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med. 2000;342:1471–1477. doi: 10.1056/NEJM200005183422002. [PubMed] [CrossRef] [Google Scholar]
Penk JS, Lefaiver CA, Brady CM, Steffensen CM, Wittmayer K. Intermittent versus continuous and intermittent medications for pain and sedation after pediatric cardiothoracic surgery; a randomized controlled trial. Crit Care Med. 2018;46:123–129. doi: 10.1097/CCM.0000000000002771. [PubMed] [CrossRef] [Google Scholar]
Kollef MH, Levy NT, Ahrens TS, Schaiff R, Prentice D, Sherman G. The use of continuous i.v. sedation is associated with prolongation of mechanical ventilation. Chest. 1998;114:541–548. doi: 10.1378/chest.114.2.541. [PubMed] [CrossRef] [Google Scholar]
Carson SS, Kress JP, Rodgers JE, Vinayak A, Campbell-Bright S, Levitt J, Bourdet S, Ivanova A, Henderson AG, Pohlman A, Chang L, Rich PB, Hall J. A randomized trial of intermittent lorazepam versus propofol with daily interruption in mechanically ventilated patients. Crit Care Med. 2006;34:1326–1332. doi: 10.1097/01.CCM.0000215513.63207.7F. [PubMed] [CrossRef] [Google Scholar]
Le Guen M, Liu N, Bourgeois E, Chazot T, Sessler DI, Rouby JJ, Fischler M. Automated sedation outperforms manual administration of propofol and remifentanil in critically ill patients with deep sedation: a randomized phase II trial. Intensive Care Med. 2013;39:454–462. doi: 10.1007/s00134-012-2762-2. [PubMed] [CrossRef] [Google Scholar]
Payen JF, Bosson JL, Chanques G, Mantz J, Labarere J. Pain assessment is associated with decreased duration of mechanical ventilation in the intensive care unit: a post Hoc analysis of the DOLOREA study. Anesthesiology. 2009;111:1308–1316. doi: 10.1097/ALN.0b013e3181c0d4f0. [PubMed] [CrossRef] [Google Scholar]
Puntillo KA, Naidu R. Chronic pain disorders after critical illness and ICU-acquired opioid dependence: two clinical conundra. Curr Opin Crit Care. 2016;22:506–512. doi: 10.1097/MCC.0000000000000343. [PubMed] [CrossRef] [Google Scholar]
Stollings J, Szumita P, Devlin J. Choice of analgesia and sedation. In: Posa SP, Stollings JL, editors. ICU liberation. Mount Prospect: Society of Critical Care Medicine; 2020. [Google Scholar]
Hutchison LC, O’Brien C. Changes in pharmacokinetics and pharmacodynamics in the elderly patient. J Pharm Pract. 2007;20:4–12. doi: 10.1177/0897190007304657. [CrossRef] [Google Scholar]
Mangoni AA, Jackson SH. Age-related changes in pharmacokinetics and pharmacodynamics: basic principles and practical applications. Br J Clin Pharmacol. 2004;57:6–14. doi: 10.1046/j.1365-2125.2003.02007.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Young C, Knudsen N, Hilton A, Reves JG. Sedation in the intensive care unit. Crit Care Med. 2000;28:854–866. doi: 10.1097/00003246-200003000-00041. [PubMed] [CrossRef] [Google Scholar]
Pandharipande P, Banerjee A, McGrane S, Ely EW. Liberation and animation for ventilated ICU patients: the ABCDE bundle for the back-end of critical care. Crit Care. 2010;14:157. doi: 10.1186/cc8999. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ely EW. The ABCDEF bundle: science and philosophy of how ICU liberation serves patients and families. Crit Care Med. 2017;45:321–330. doi: 10.1097/CCM.0000000000002175. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Barnes-Daly MA, Phillips G, Ely EW. Improving hospital survival and reducing brain dysfunction at seven california community hospitals: implementing pad guidelines via the ABCDEF bundle in 6,064 patients. Crit Care Med. 2017;45:171–178. doi: 10.1097/CCM.0000000000002149. [PubMed] [CrossRef] [Google Scholar]
Pun BT, Balas MC, Barnes-Daly MA, Thompson JL, Aldrich JM, Barr J, Byrum D, Carson SS, Devlin JW, Engel HJ, Esbrook CL, Hargett KD, Harmon L, Hielsberg C, Jackson JC, Kelly TL, Kumar V, Millner L, Morse A, Perme CS, Posa PJ, Puntillo KA, Schweickert WD, Stollings JL, Tan A, McGowan L, Ely EW. Caring for critically ill patients with the ABCDEF bundle: results of the ICU liberation collaborative in over 15,000 adults. Crit Care Med. 2019;47:3–14. doi: 10.1097/CCM.0000000000003482. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Devlin JW, Roberts RJ. Pharmacology of commonly used analgesics and sedatives in the ICU: benzodiazepines, propofol, and opioids. Anesthesiol Clin. 2011;29:567–585. doi: 10.1016/j.anclin.2011.09.001. [PubMed] [CrossRef] [Google Scholar]
Arroyo-Novoa C, Figueroa-Ramos M, Puntillo K. Opioid and benzodiazepine iatrogenic withdrawal syndrome in patients in the Intensive Care Unit. AACN. 2019;30:353–364. [PMC free article] [PubMed] [Google Scholar]
Wheeler KE, Grilli R, Centofanti JE, Martin J, Gelinas C, Szumita PM, Devlin JW, Chanques G, Alhazzani W, Skrobik Y, Kho ME, Nunnally ME, Gagarine A, Ergan BA, Fernando S, Price C, Lewin J, Rochwerg B. Adjuvant analgesic use in the critically ill: a systematic review and meta-analysis. Crit Care Explor. 2020;2:e0157. doi: 10.1097/CCE.0000000000000157. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Dzierba AL, Brodie D, Bacchetta M, Muir J, Wasson L, Colabraro M, Gannon W, Connolly K, Biscotti M, Rietdijk W, Moitra V, Bakker J. Ketamine use in sedation management in patients receiving extracorporeal membrane oxygenation. Intensive Care Med. 2016;42:1822–1823. doi: 10.1007/s00134-016-4519-9. [PubMed] [CrossRef] [Google Scholar]
Perbet S, Verdonk F, Godet T, Jabaudon M, Chartier C, Cayot S, Guerin R, Morand D, Bazin JE, Futier E, Pereira B, Constantin JM. Low doses of ketamine reduce delirium but not opiate consumption in mechanically ventilated and sedated ICU patients: a randomised double-blind control trial. Anaesth Crit Care Pain Med. 2018;37:589–595. doi: 10.1016/j.accpm.2018.09.006. [PubMed] [CrossRef] [Google Scholar]
Skrobik Y, Duprey MS, Hill NS, Devlin JW. Low-dose nocturnal dexmedetomidine prevents ICU delirium. a randomized, placebo-controlled trial. Am J Respir Crit Care Med. 2018;197:1147–1156. doi: 10.1164/rccm.2017101995OC. [PubMed] [CrossRef] [Google Scholar]
L’Her E, Dy L, Pili R, Prat G, Tonnelier JM, Lefevre M, Renault A, Boles JM. Feasibility and potential cost/benefit of routine isoflurane sedation using an anesthetic-conserving device: a prospective observational study. Respir Care. 2008;53:1295–1303. [PubMed] [Google Scholar]
Mesnil M, Capdevila X, Bringuier S, Trine PO, Falquet Y, Charbit J, Roustan JP, Chanques G, Jaber S. Long-term sedation in intensive care unit: a randomized comparison between inhaled sevoflurane and intravenous propofol or midazolam. Intensive Care Med. 2011;37:933–941. doi: 10.1007/s00134-011-2187-3. [PubMed] [CrossRef] [Google Scholar]
Jabaudon M, Boucher P, Imhoff E, Chabanne R, Faure JS, Roszyk L, Thibault S, Blondonnet R, Clairefond G, Guerin R, Perbet S, Cayot S, Godet T, Pereira B, Sapin V, Bazin JE, Futier E, Constantin JM. Sevoflurane for sedation in acute respiratory distress syndrome. a randomized controlled pilot study. Am J Respir Crit Care Med. 2017;195:792–800. doi: 10.1164/rccm.201604-0686OC. [PubMed] [CrossRef] [Google Scholar]
Jerath A, Parotto M, Wasowicz M, Ferguson ND. Volatile anesthetics. Is a new player emerging in critical care sedation? Am J Respir Crit Care Med. 2016;193:1202–1212. doi: 10.1164/rccm.201512-2435CP. [PubMed] [CrossRef] [Google Scholar]
van Haren F, Pham T, Brochard L, Bellani G, Laffey J, Dres M, Fan E, Goligher EC, Heunks L, Lynch J, Wrigge H, McAuley D. Spontaneous breathing in early acute respiratory distress syndrome: insights from the large observational study to understand the global impact of severe acute respiratory failure study. Crit Care Med. 2019;47:229–238. doi: 10.1097/CCM.0000000000003519. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Goligher EC, Dres M, Patel BK, Sahetya SK, Beitler JR, Telias I, Yoshida T, Vaporidi K, Grieco DL, Schepens T, Grasselli G, Spadaro S, Dianti J, Amato M, Bellani G, Demoule A, Fan E, Ferguson ND, Georgopoulos D, Guerin C, Khemani RG, Laghi F, Mercat A, Mojoli F, Ottenheijm CAC, Jaber S, Heunks L, Mancebo J, Mauri T, Pesenti A, Brochard L. Lung and diaphragm-protective ventilation. Am J Respir Crit Care Med. 2020;191:1105–1115. [Google Scholar]
Jung B, Constantin JM, Rossel N, Le Goff C, Sebbane M, Coisel Y, Chanques G, Futier E, Hugon G, Capdevila X, Petrof B, Matecki S, Jaber S. Adaptive support ventilation prevents ventilator-induced diaphragmatic dysfunction in piglet: an in vivo and in vitro study. Anesthesiology. 2010;112:1435–1443. doi: 10.1097/ALN.0b013e3181d7b036. [PubMed] [CrossRef] [Google Scholar]
Demoule A, Molinari N, Jung B, Prodanovic H, Chanques G, Matecki S, Mayaux J, Similowski T, Jaber S. Patterns of diaphragm function in critically ill patients receiving prolonged mechanical ventilation: a prospective longitudinal study. Ann Intensive Care. 2016;6:75. doi: 10.1186/s13613-016-0179-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Guerin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, Mercier E, Badet M, Mercat A, Baudin O, Clavel M, Chatellier D, Jaber S, Rosselli S, Mancebo J, Sirodot M, Hilbert G, Bengler C, Richecoeur J, Gainnier M, Bayle F, Bourdin G, Leray V, Girard R, Baboi L, Ayzac L. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368:2159–2168. doi: 10.1056/NEJMoa1214103. [PubMed] [CrossRef] [Google Scholar]
Guerin C, Beuret P, Constantin JM, Bellani G, Garcia-Olivares P, Roca O, Meertens JH, Maia PA, Becher T, Peterson J, Larsson A, Gurjar M, Hajjej Z, Kovari F, Assiri AH, Mainas E, Hasan MS, Morocho-Tutillo DR, Baboi L, Chretien JM, Francois G, Ayzac L, Chen L, Brochard L, Mercat A. A prospective international observational prevalence study on prone positioning of ARDS patients: the APRONET (ARDS Prone Position Network) study. Intensive Care Med. 2018;44:22–37. doi: 10.1007/s00134-017-4996-5. [PubMed] [CrossRef] [Google Scholar]
Heider J, Bansbach J, Kaufmann K, Heinrich S, Loop T, Kalbhenn J. Does volatile sedation with sevoflurane allow spontaneous breathing during prolonged prone positioning in intubated ARDS patients? A retrospective observational feasibility trial. Ann Intensive Care. 2019;9:41. doi: 10.1186/s13613-019-0517-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Solverson K, Weatherald J, Parhar KKS. Tolerability and safety of awake prone positioning COVID-19 patients with severe hypoxemic respiratory failure. Can J Anaesth. 2020 doi: 10.1007/s12630-020-01787-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Langer T, Santini A, Bottino N, Crotti S, Batchinsky AI, Pesenti A, Gattinoni L. “Awake” extracorporeal membrane oxygenation (ECMO): pathophysiology, technical considerations, and clinical pioneering. Crit Care. 2016;20:150. doi: 10.1186/s13054-016-1329-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Swol J, Shekar K, Protti A, Tukacs M, Broman LM, Barrett NA, Mueller T, Peek GJ, Buscher H. Extubate before VV ECMO decannulation or decannulate while remaining on the ventilator? The EuroELSO 2019 weaning survey. ASAIO J. 2020 doi: 10.1097/MAT.0000000000001237. [PubMed] [CrossRef] [Google Scholar]
Lehr CJ, Zaas DW, Cheifetz IM, Turner DA. Ambulatory extracorporeal membrane oxygenation as a bridge to lung transplantation: walking while waiting. Chest. 2015;147:1213–1218. doi: 10.1378/chest.14-2188. [PubMed] [CrossRef] [Google Scholar]
Lemaitre F, Hasni N, Leprince P, Corvol E, Belhabib G, Fillatre P, Luyt CE, Leven C, Farinotti R, Fernandez C, Combes A. Propofol, midazolam, vancomycin and cyclosporine therapeutic drug monitoring in extracorporeal membrane oxygenation circuits primed with whole human blood. Crit Care. 2015;19:40. doi: 10.1186/s13054-015-0772-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Shekar K, Fraser JF, Smith MT, Roberts JA. Pharmacokinetic changes in patients receiving extracorporeal membrane oxygenation. J Crit Care. 2012;27(741):e718–e749. [PubMed] [Google Scholar]
Marini J, Gattinoni L. Management of COVID-19 respiratory distress. JAMA. 2020;323:2329–2330. doi: 10.1001/jama.2020.6825. [PubMed] [CrossRef] [Google Scholar]
Girard TD, Kress JP, Fuchs BD, Thomason JW, Schweickert WD, Pun BT, Taichman DB, Dunn JG, Pohlman AS, Kinniry PA, Jackson JC, Canonico AE, Light RW, Shintani AK, Thompson JL, Gordon SM, Hall JB, Dittus RS, Bernard GR, Ely EW. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet. 2008;371:126–134. doi: 10.1016/S0140-6736(08)60105-1. [PubMed] [CrossRef] [Google Scholar]
Huang L, Lin G, Tang L, Yu L, Zhou Z. Special attention to nurses’ protection during the COVID-19 epidemic. Crit Care. 2020;24:120. doi: 10.1186/s13054-020-2841-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Capdevila M, Ramin S, Capdevila X. Regional anesthesia and analgesia after surgery in ICU. Curr Opin Crit Care. 2017;23:430–439. doi: 10.1097/MCC.0000000000000440. [PubMed] [CrossRef] [Google Scholar]
Queiroz Rangel Micuci AJ, Vercosa N, Filho PAG, de Boer HD, Barbosa DD, Cavalcanti IL. Effect of pretreatment with magnesium sulphate on the duration of intense and deep neuromuscular blockade with rocuronium: a randomised controlled trial. Eur J Anaesthesiol. 2019;36:502–508. doi: 10.1097/EJA.0000000000001003. [PubMed] [CrossRef] [Google Scholar]
Segredo V, Caldwell J, Matthay M, Sharma M, Gruenke L, Miller R. Persistent paralysis in critically ill patients after long-term administration of vecuronium. N Engl J Med. 1992;327:524–528. doi: 10.1056/NEJM199208203270804. [PubMed] [CrossRef] [Google Scholar]