José Antonio Benítez Lozano1, José Manuel Serrano Simón2*
1Intensive Care Unit, Hospital Quirónsalud, Málaga, Spain
2Intensive Care Unit, Hospital Regional Universitario “Reina Sofía”, Córdoba, Spain
*Correspondence should be addressed to José Manuel Serrano Simón; jm.serranosimon@gmail.com
Received date: July 06, 2020,
Accepted date: September 10, 2020
Copyright: © 2020 Benítez Lozano JA, et al. This is an open-access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Abstract
Kích hoạt đảo ngược là nỗ lực cơ được kích hoạt bởi máy thở, liên quan đến sự cuốn theo, đặc biệt được thấy ở bệnh nhân được dùng thuốc an thần. Sự kích hoạt đảo ngược thường xuyên gây ra kích hoạt kép/chu kỳ kép, với tăng thể tích khí lưu thông và áp lực xuyên phổi. Ở những bệnh nhân được theo dõi của chúng tôi, chúng tôi đã quan sát thấy các loại kích hoạt kép khác nhau do không đồng bộ gây ra tương tự như kích hoạt đảo ngược, chúng tôi đã sử dụng thuật ngữ “kích hoạt giả đảo ngược”. Theo hiểu biết của chúng tôi, lần đầu tiên chúng tôi mô tả sự không đồng bộ này cả trong thông khí trợ giúp-điều khiển cũng như trong quá trình thông khí hỗ trợ áp lực. Những loại không đồng bộ này phải được công nhận trong thực hành lâm sàng để được hiệu chỉnh theo cách cá nhân hóa.
Keywords:
Reverse triggering; Pseudo-reverse-triggering; Double triggering; Double cycling; Advanced respiratory monitoring
Kích hoạt kép (double trigger, DT) là loại không đồng bộ thường gặp thứ hai, sau các mất đồng bộ chu kỳ [1]. So với loại sau, nó có thể gây tổn thương nhiều hơn vì nó thường làm tăng thể tích khí lưu thông (Vt), áp lực xuyên màng phổi và xuyên mạch máu đến mức có thể gây tổn thương phổi do máy thở [2,3]; và bệnh nhân tự gây ra (P_SILI) [4], cũng như chấn thương cơ hoành. DT và Kích hoạt ngược (reverse triggering, RT) có thể liên quan với nhau, mặc dù không phải lúc nào cũng vậy. Tuy nhiên, mối quan hệ giữa DT và nỗ lực mạnh mẽ của bệnh nhân là 1 đặc điểm chung.
Chúng tôi trình bày ba trường hợp bệnh nhân nặng được đưa vào ICU có biểu hiện không đồng bộ này khi bắt đầu giai đoạn cai thở máy (MV). Tất cả các bệnh nhân được an thần, điểm RASS 4.
Trường hợp đầu tiên tương ứng với một bệnh nhân nam 54 tuổi, có tiền sử ghép thận và viêm phổi COVID-19, MV 10 ngày, ở chế độ trợ giúp-kiểm soát thể tích với lưu lượng không đổi (ACV) (Hình 1). Trường hợp thứ hai là một bệnh nhân nam 62 tuổi nhập viện trong tình trạng xuất huyết khoang dưới nhện, có biến chứng nhồi máu do co thắt mạch. Sau khi giảm an thần, theo dõi được thực hiện sau bốn ngày trong chế độ ACV (Hình 2). Trường hợp thứ ba là bệnh nhân nam 57 tuổi trong ngày hậu phẫu đầu tiên được ghép phổi đôi do mất mô bào X; trong trường hợp này, giám sát được thực hiện trong quá trình thông khí hỗ trợ áp lực (PSV), (Hình 3). Như một ví dụ điển hình của RT thực sự, mặc dù không có DT, chúng tôi đưa ra trường hợp 4, một phụ nữ 69 tuổi bị viêm phổi COVID-19, trong PSV và sau 19 ngày trong MV (Hình 4).
Thu thập dữ liệu
Ở bệnh nhân thứ hai và thứ ba; tín hiệu lưu lượng thu được bằng cách sử dụng máy pneumotachograph Hans Rudolph 4700® được kết nối với đầu dò chênh áp Sensortechnics®, LBAS025B. Áp lực đường thở (Paw), thực quản (Peso) và dạ dày (Pgas) được thu được bằng cách sử dụng đầu dò áp lực Sensortechnics® SQ7500. Áp lực bàng quang (Pvesical) được thu bằng cách sử dụng cảm biến mạch máu (Edwards TruWave®). Các phép đo Peso và Pgas được thực hiện bằng cách sử dụng một đầu dò đặc hiệu, Nutrivent, Sindam®. Tất cả các tín hiệu được thu thập bởi bộ chuyển đổi tín hiệu tương tự sang kỹ thuật số Teensy 3.5® được lấy mẫu ở 1045 Hz/kênh trong 60 phút.
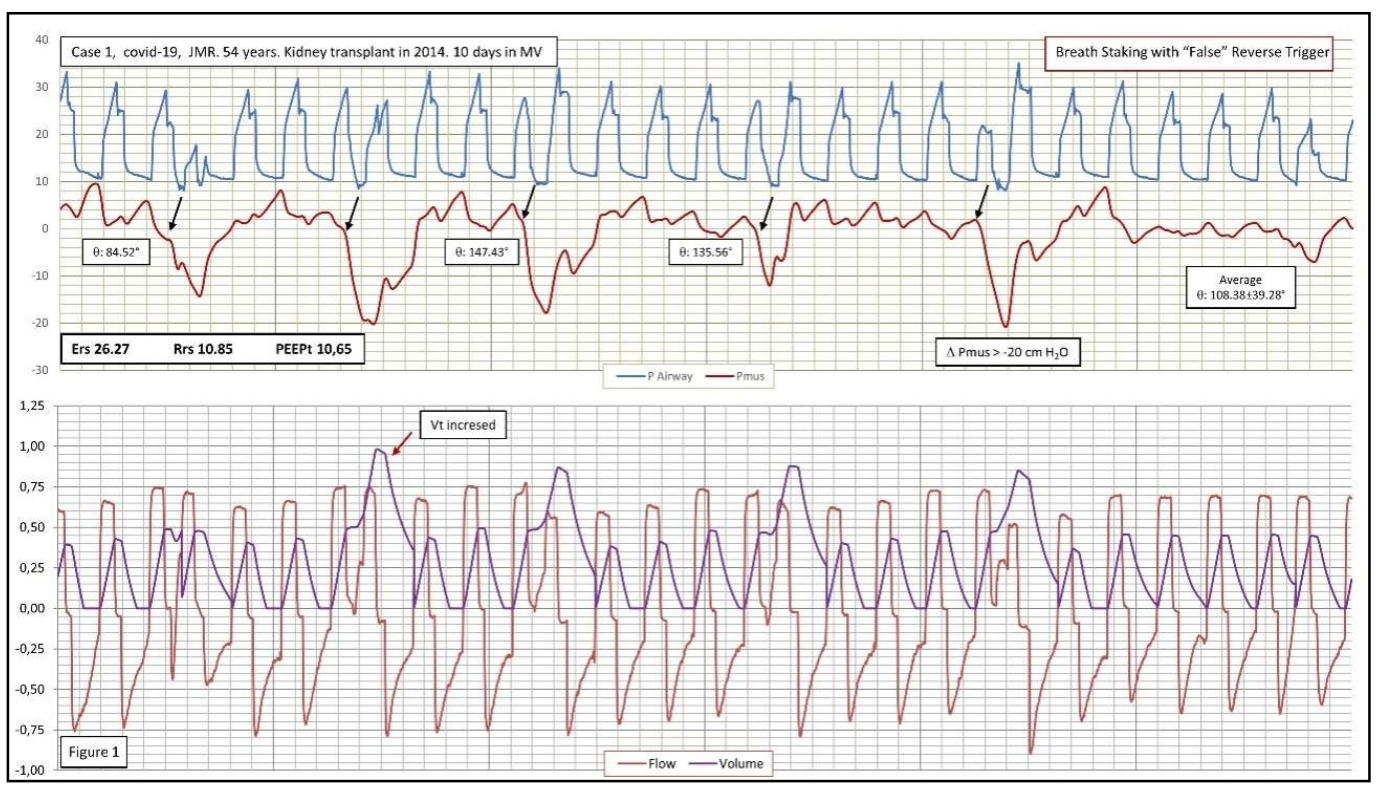
Hình 1: Bệnh nhân 1 bị viêm phổi do COVID-19. 23 chu kỳ liên tiếp tương ứng với 60 giây được thể hiện (5 với nhịp thở). Chế độ ACV với lưu lượng không đổi; Nhịp thở chồng (Breath Staking) là do sự chồng chéo của trình điều khiển hô hấp của bệnh nhân trong các chu kỳ được lập trình trong máy thở. Chúng tôi đã sử dụng 5 chu kỳ hoàn toàn thụ động cuối cùng để thu được, bằng cách sử dụng Hồi quy đa tuyến tính, các biến cần thiết cho phương trình chuyển động của hệ hô hấp: Độ đàn hồi (Ers), Sức cản (Rrs) và Tổng PEEP (PEEPt). Pmus, màu đỏ, được tính theo công thức: Pmus = Paw – (Ers * Volume + Rrs * Flow + (PEEPtotal – PEEPapparent). Sự khởi đầu của trình điều khiển thần kinh của bệnh nhân được biểu thị bằng một mũi tên màu đen. Độ trễ giữa các nơron chu kỳ của máy thở được biểu thị dưới dạng pha góc (angular phase). Độ phân tán góc (angular dispersion) rất thay đổi. Xung thần kinh xuất hiện nhịp nhàng, mạnh mẽ (∆ -20 cm H2O), tự chủ và không bị cuốn theo chu kỳ của máy thở. Chúng tôi đã gắn nhãn trường hợp này là VDT (Ventilator Double Trigger, Kích hoạt kép máy thở) và nó tương ứng với mô tả ban đầu về Kích hoạt giả kép (Pseudo-double Triggering) [5]; trong khi một số người gọi nó là Kích hoạt ngược với nhịp thở chồng (Reverse Triggering with Breath Staking)
Đối với bệnh nhân thứ nhất và thứ tư, cả hai bệnh nhân COVID-19, các tín hiệu hô hấp thu được khi kết nối với giao thức Medibus của máy thở Evita bằng phần mềm cá nhân, bằng cách thu thập các tín hiệu Paw, lưu lượng và thể tích được lấy mẫu ở 125 Hz/kênh. Phương pháp luận này cho phép chúng tôi duy trì hệ thống giám sát ô nhiễm thông thường của chúng tôi. Chúng tôi đã thay thế các thông số thu được từ việc theo dõi thực quản bằng áp lực cơ suy ra từ phương trình chuyển động (Hình 1 và 4).
Trong cả hai hệ thống theo dõi, các thông số liên quan đến nỗ lực và hoạt động hô hấp đã được phân tích, cũng như độ trễ giữa thời gian bắt đầu nhịp thở máy thở và nhịp thở thần kinh (dP). dP chia cho khoảng thời gian theo chu kỳ cơ học (Ttot) và nhân với 360° cung cấp góc pha (θ). Tần số và tỷ lệ kết hợp của hai hiện tượng DT và RT, cũng được ghi lại.
Trong trường hợp đầu tiên và trường hợp thứ hai, sau khi đánh giá sự không đồng bộ, chế độ thở được thay đổi thành PSV, cải thiện sự tương tác với máy thở. Trong trường hợp thứ ba, cần thiết phải tăng thuốc an thần. Trong trường hợp thứ tư, trong quá trình PSV, áp lực hít vào được tăng lên.
Ban đầu DT được mô tả là hệ quả của một nỗ lực cơ thở mạnh và rộng gây ra hiện tượng chu kỳ kép của máy thở [1].
Kích hoạt giả kép (Pseudo-double-triggering) được mô tả là một chu kỳ kép xảy ra sau một chu kỳ do máy thở khởi tạo ban đầu, sau đó là xung thần kinh cơ hít vào tiếp theo gây ra chu kỳ thứ hai của máy thở [5].
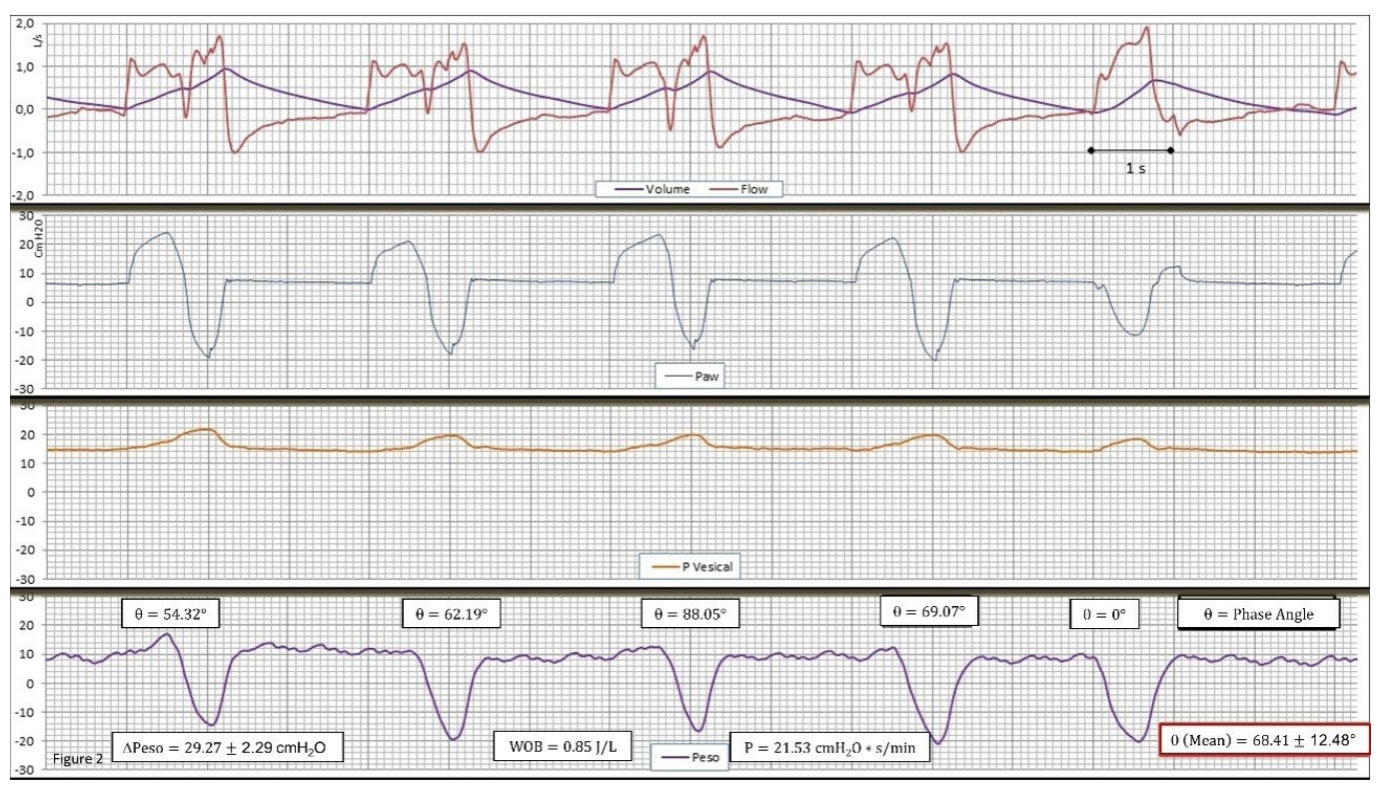
Hình 2: Bản ghi lưu lượng (Flow) và thể tích (Volume), áp lực đường thở (Paw), áp lực bàng quang (Pvesical), và áp lực thực quản (Peso) trong thông khí hỗ trợ thể tích và lưu lượng không đổi trong trường hợp 2. Lưu ý trong bốn chu kỳ kép đầu tiên liên tiếp của loại DTV. Trong tất cả các chu kỳ, bệnh nhân có một nỗ lực mạnh mẽ, biểu hiện rõ ràng ở dạng sóng hình delta của Peso, mặc dù ở tần số thấp hơn tần số được chỉ định trong máy thở. Có thể thấy như thế nào ở chu kỳ 5, bệnh nhân kích hoạt máy thở dưới dạng trợ giúp điển hình mà không có DT hoặc RT. Như có thể thấy trong hình, có hai trình điều khiển được xác định rõ ràng, một do máy thở và một do bệnh nhân. Cả hai đều có cường độ tương tự nhau (WOB của bệnh nhân ở 0,85 J/L và PTP là 222,53 cm H2O*s/L). Nỗ lực hít vào của bệnh nhân là tương tự trong tất cả các chu kỳ, ngoại trừ chu kỳ thứ 5 được trợ giúp, điều này cho thấy bệnh nhân tự động điều khiển cường độ trung khu (delta Peso khoảng 30 cm H2O), ít thường xuyên và đều đặn hơn so với chu kỳ của máy. Phép đo pha góc (Θ = 68,41 ± 12,48°) giữa chu kỳ bệnh nhân và máy thở rất khác nhau, điều này cũng đi ngược lại cơ chế phản xạ. Trong trường hợp này, tỷ lệ DT-RT 1:1 xuất hiện trong 60%, phần còn lại có thể thay đổi với tỷ lệ 1:2 và 1:3. Trong trường hợp này, mức tăng Vt được đánh giá cao trùng với DTV, gần như gấp đôi. Đồng thời, I/E đã được giảm xuống 1:1, một hiệu ứng có lẽ là không mong muốn. Những phát hiện này nhấn mạnh sự cần thiết phải giám sát chặt chẽ cho mục đích thông khí bảo vệ.
Đồng thời, một hiện tượng rất tương tự đã được mô tả ở những bệnh nhân bị suy hô hấp bao gồm các nỗ lực cơ được kích hoạt bằng máy thở. Thuật ngữ này được mô tả là RT, và có thể thúc đẩy DT (6). Nỗ lực cơ bắp này, dường như được kích hoạt bởi máy thở, được cho là do một hiện tượng phản xạ. Về nguyên tắc, cơ chế điều khiển hô hấp của bệnh nhân có thể được kết hợp hoặc cuốn theo thần kinh theo cơ chế phản xạ này [6].
Sau đó, DT đã được phân loại thành ba biến thể [7]: DT với xung động ban đầu do bệnh nhân tạo ra (DTP), tương đương với DT ban đầu, và kích hoạt kép với xung ban đầu được tạo ra bởi tần số cài đặt trong máy thở sau đó bởi xung thần kinh cơ của bệnh nhân (DTV) tương đương với kích hoạt giả kép. Cuối cùng đó có một biến thể: do máy thở tự động kích hoạt (DTA). Hai biến thể sau được các tác giả khác gọi là DT do RT.
Lưu ý rằng RT có thể thúc đẩy hoặc không thúc đẩy chu kỳ kép (double cycling, DC) và trong cả hai trường hợp, nó sẽ đi kèm với sự gia tăng thể tích và áp lực xuyên phổi, một ví dụ điển hình được cung cấp trong các hình và do đó có khả năng gây hại cho cả hai phổi (VILI, P -SILI và cơ hoành do co bóp đa kích thước.
Sự tồn tại của RT trong sự hiện diện của một bệnh nhân trình điều khiển hô hấp mạnh mẽ không liên quan đế một phản xạ hoặc hiện tượng cuốn theo vẫn chưa được làm sáng tỏ đầy đủ cho đến nay, ngoại trừ mô tả của thuật ngữ DTV [5], trong đó một hiện tượng tương đương với RT không liên quan sang cơ chế phản xạ.
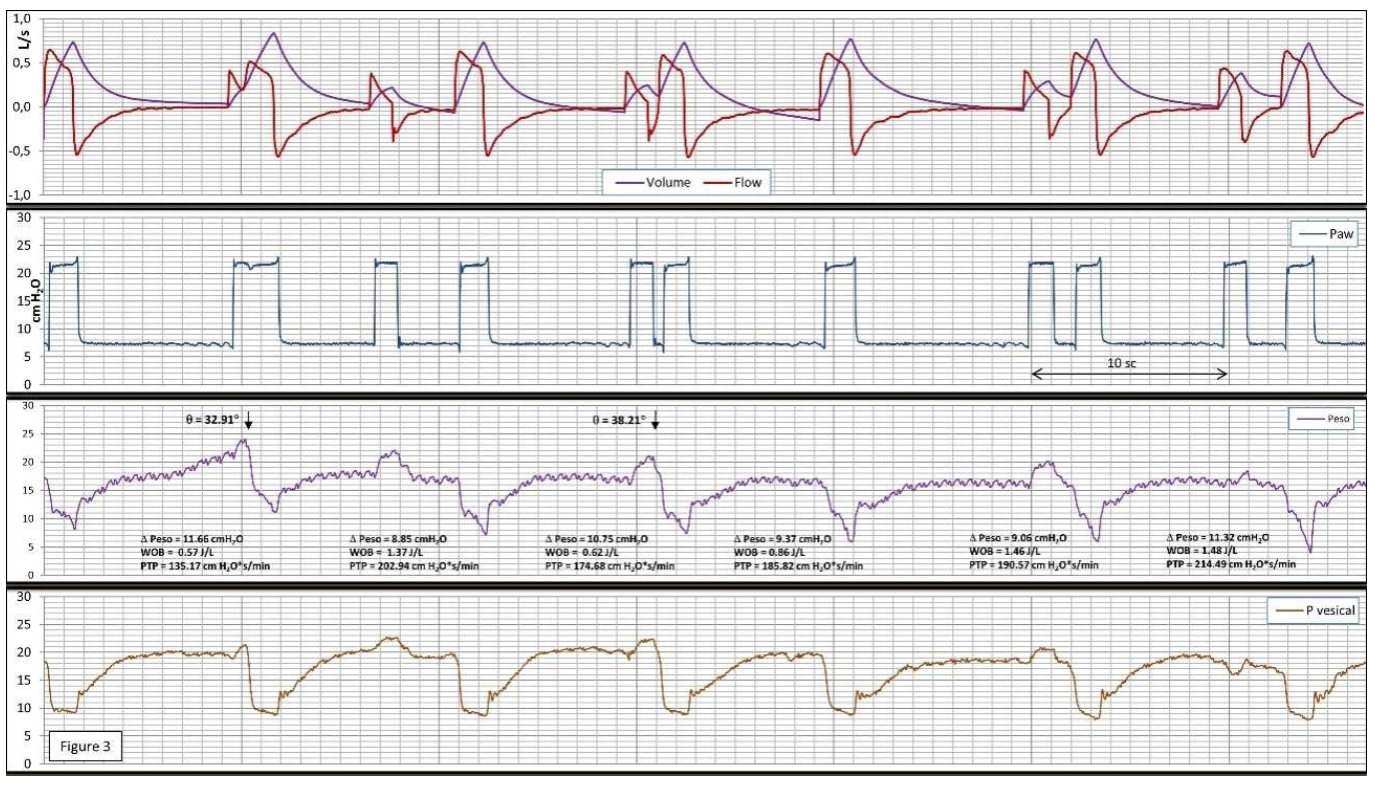
Hình 3: Ghi lại các tín hiệu (Lưu lượng và thể tích), Paw, Peso và áp lực bàng quang (Pvesical) trong quá trình thông khí với áp lực hỗ trợ trong trường hợp 3. Trong trường hợp này, chúng tôi hiển thị một chu kỳ kép được định nghĩa là DTA, bằng tự động kích hoạt máy thở; nhưng trình điều khiển bệnh nhân (Kích hoạt ngược theo nghĩa rộng là do giải phóng thở ra chủ động mạnh mẽ, thể hiện rõ ràng trong tín hiệu bàng quang. Sự co thắt của cơ hoành tiếp sau đó bởi sự thư giãn của thở ra chủ động. Hãy nghĩ rằng trình điều khiển này, trong đó bao gồm việc giải phóng thở ra gắng sức và nỗ lực hít vào sau đó của bệnh nhân, là nguyên nhân của hiện tượng phản xạ rất khó xảy ra. Mối quan hệ giữa chu kỳ cơ học và chu kỳ thần kinh là thay đổi trong trường hợp này. Các thông số liên quan đến nỗ lực hít vào: Delta Peso: 11,55 ± 1,22 cm H2O và có thể nhận thấy sự gia tăng chu kỳ kích hoạt kép; WOB 1,06 ± 0,42 J/L và PTP 183,95 ± 27,59 cm H2O*s/ phút. Trong trường hợp này, WOB có liên quan đến thể tích được tạo ra bởi chu kỳ xếp chồng lên nhau tương ứng với chu kỳ kép. Sự xuất hiện của chu kỳ kép cho thấy một mối quan hệ thay đổi
Loại trình điều khiển kép này (một từ máy thở đi trước, thứ hai từ bệnh nhân) không gây ra DT có thể xảy ra thường xuyên và có khả năng nguy hiểm như loại gây ra nó.
Trong tất cả các nghiên cứu trước đây, họ đề cập đến bệnh nhân được thở máy ở chế độ ACV với cả kiểm soát thể tích và kiểm soát áp lực. Theo hiểu biết của chúng tôi, lần đầu tiên chúng tôi cung cấp các trường hợp có thông khí hỗ trợ áp lực (PSV), kết hợp với tự động kích hoạt, tương tự như Thông khí kiểm soát áp lực (Hình 3-4).
Ý kiến của chúng tôi là trong ba trường hợp đầu tiên, kích hoạt kép và đảo ngược là do sự không tương xứng đơn giản của hai trình điều khiển khác nhau, nơron đủ mạnh để tạo ra sự gia tăng Vt. Để chứng minh RT đúng, chúng tôi đề xuất hủy chu kỳ cơ học của máy thở sử dụng phương pháp thủ thuật tắc nghẽn hoặc thay đổi sang một chu kỳ ngắn của CPAP xen kẽ, điều này sẽ cho biết liệu xung động của bệnh nhân có liên quan đến chu kỳ cơ học hay không, như thể hiện trong Hình 4.
Chúng tôi muốn gọi những sự không đồng bộ này là Reverse Trigger theo nghĩa rộng hoặc Trình điều khiển kiểu DTV kép, trong đó chu trình cơ học đi trước nơ-ron. Theo kinh nghiệm của chúng tôi, kích hoạt kép thường xuyên nhất ở chế độ ACV là DTV và DTA trong hệ thống thông khí hỗ trợ. Chúng tôi hiếm khi gặp DTP cổ điển [8].
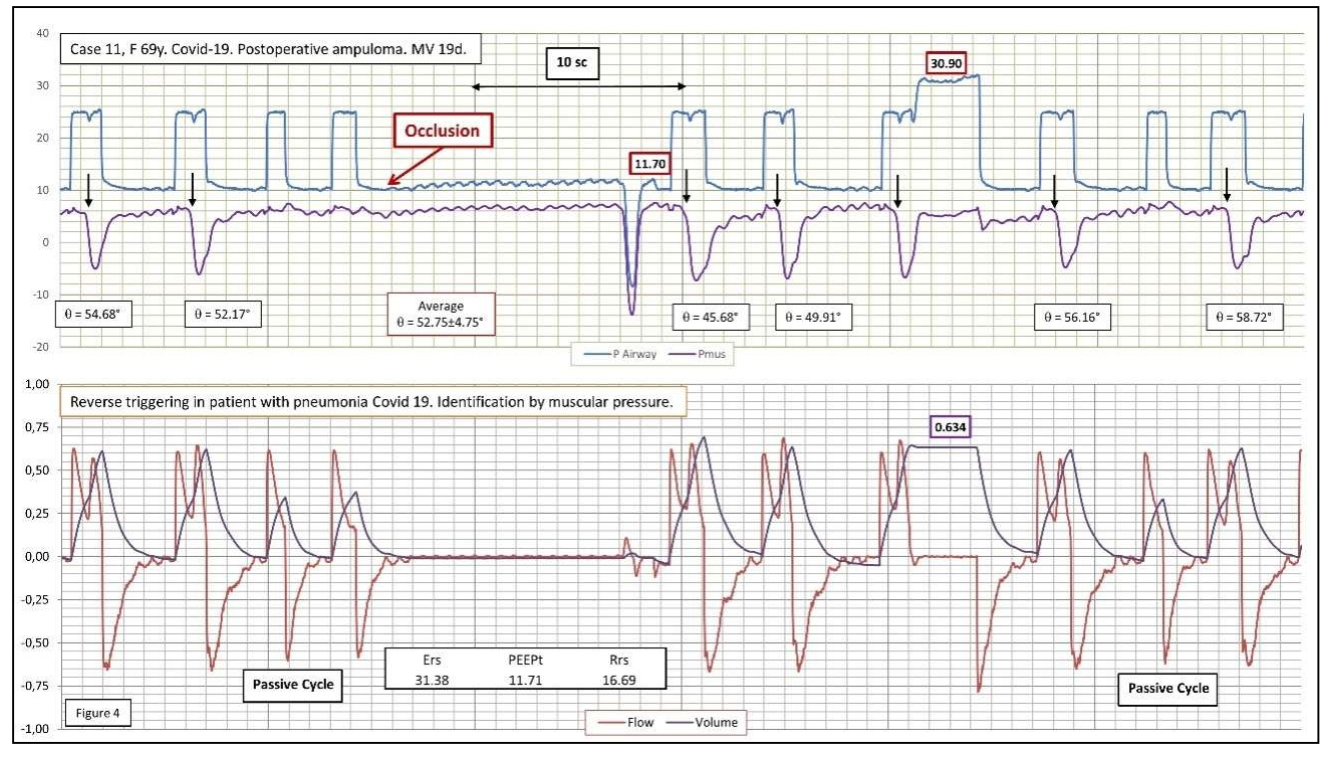
Hình 4: Trường hợp đại diện của RT “đúng” không có chu kỳ kép trong trường hợp này. Bệnh nhân cũng có biểu hiện viêm phổi do COVID-19, như thông báo trên văn bản, thở máy ở chế độ PSV, áp lực hít vào 15/ PEEP 10 cm H2O. Phát hiện chính: Tự động kích hoạt theo sau là RT. Ở bệnh nhân của chúng tôi, đó là sự không đồng bộ thường xuyên nhất do RT trong PSV. Pmus đã được hạ thấp 5 cm để có hình dung tốt hơn về Paw. Tắc đường thở thể hiện một trình điều khiển hô hấp tự phát chậm hơn nhưng không kém cường độ hơn so với RT. Xung thần kinh của RT xuất hiện sau khi bắt đầu chu kỳ cơ học với đủ độ trễ đồng đều (được đo dưới dạng pha góc). Sự bắt đầu của mỗi chu kỳ với RT được chỉ ra trong hình với một mũi tên màu đen. Chu kỳ 3 và 9 hoàn toàn bị động. Pmus thu được bằng phương trình chuyển động như mô tả trong Hình 1. Thể tích do RT tạo ra gần như gấp đôi so với thể tích cài đặt có thể nhận thấy, điều này làm tăng áp suất bình nguyên lên hơn 30 cm H2O
Conflicts of interest
The authors declare that have no conflicts of interest.
Author contributions
BL JA, conducted and designed the study. SS JM collected and analyzed the patient data. Both authors have interpreted all data, written, and revised the manuscript.
Ethics approval and consent to participate
Study approved by the Research Ethics Board, University Hospital Reina Sofía of Cordoba, Spain (RT-PSV 2017).
Written Informed consent for publication was obtained from the patient’s family.
Acknowledgments
We thank Almudena Serrano Benítez, for their valuable assistance in reviewing the manuscript.
References
1.Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Medicine. 2006 Oct 1; 32(10):1515-22.
2.Pohlman MC, McCallister KE, Schweickert WD, Pohlman AS, Nigos CP, Krishnan JA, et al. Excessive tidal volume from breath stacking during lung-protective ventilation for acute lung injury. Critical Care Medicine. 2008 Nov 1;36(11):3019-23.
3.Beitler JR, Sands SA, Loring SH, Owens RL, Malhotra A, Spragg RG, et al. Quantifying unintended exposure to high tidal volumes from breath stacking dyssynchrony in ARDS: the BREATHE criteria. Intensive Care Medicine. 2016 Sep 1;42(9):1427-36.
4.Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. American Journal of Respiratory and Critical Care Medicine. 2017 Feb 15;195(4):438-42.
5.Chang-Wen C, Wei-Chieh L, Hsu CH. Pseudo-doubletriggering. Intensive Care Medicine. 2007 Apr1;33(4):742.
6.Akoumianaki E, Lyazidi A, Rey N, Matamis D, PerezMartinez N, Giraud R, et al. Mechanical ventilation- induced reverse-triggered breaths: a frequently unrecognized form of neuromechanical coupling. Chest. 2013 Apr 1;143(4):927-38.
7.Liao KM, Ou CY, Chen CW. Classifying different types ofdouble triggering based on airway pressure and flow deflection in mechanically ventilated patients. Respiratory Care. 2011 Apr 1;56(4):460-6.
8.Lozano JB, de la Fuente Martos C, Simón JS. Double Trigger and Pseudo-reverse-trigger?. Medicina Intensiva. S0210-5691.