Mục đích đánh giá
Tạo điều kiện thở tự nhiên đã được khuyến cáo theo truyền thống trong thở máy ở hội chứng nguy kịch hô hấp cấp tính (ARDS). Tuy nhiên, sử dụng sớm, ngắn hạn phong bế thần kinh cơ dường như để cải thiện khả năng sống sót, và nỗ lực tự phát đã được chứng minh là gây tổn thương phổi trong các nghiên cứu lâm sàng và động vật. Mục đích của tổng quan này là để mô tả các tác động có lợi và có hại của việc thở tự nhiên trong ARDS, giải thích các cơ chế tiềm ẩn về tác hại và đưa ra các đề xuất hiện đại cho quản lý lâm sàng.
Những phát hiện gần đây
Nỗ lực tự phát nhẹ nhàng có thể cải thiện chức năng phổi và ngăn ngừa teo cơ hoành. Tuy nhiên, bằng chứng tích lũy chỉ ra rằng nỗ lực tự phát có thể gây ra hoặc làm tổn thương phổi và cơ hoành, đặc biệt là nếu ARDS nghiêm trọng hoặc nỗ lực tự phát là mạnh mẽ. Gần đây, chấn thương phổi phụ thuộc vào nỗ lực như vậy đã được gọi là tổn thương phổi tự gây ra cho bệnh nhân (P-SILI). Cuối cùng, một số cách tiếp cận để giảm thiểu P-SILI trong khi duy trì một số hoạt động của cơ hoành (ví dụ như phong tỏa thần kinh cơ một phần, PEEP cao) có vẻ đầy hứa hẹn.
Tóm lược
Chúng tôi cập nhật và tóm tắt vai trò của thở tự nhiên trong thở máy trong ARDS, có thể có lợi hoặc có hại, tùy thuộc vào sức mạnh của nỗ lực tự phát và mức độ nghiêm trọng của tổn thương phổi. Các nghiên cứu trong tương lai là cần thiết để xác định các chiến lược máy thở giúp giảm thiểu chấn thương nhưng duy trì một số hoạt động của cơ hoành.
Những điểm chính
Nỗ lực tự phát nhẹ nhàng có lợi trong chấn thương phổi và bảo tồn chức năng cơ hô hấp. Nỗ lực tự phát nên được tạo điều kiện khi chấn thương phổi và nỗ lực này là nhẹ.
Nỗ lực mạnh mẽ có thể gây ra hoặc làm tổn thương phổi và cơ hoành và nỗ lực tự phát có khả năng mạnh mẽ hơn khi chấn thương phổi nghiêm trọng. Vì vậy, sử dụng sớm, ngắn hạn các thuốc phong bế thần kinh cơ được khuyến cáo trong ARDS nặng để giảm thiểu tác hại của nỗ lực tự phát.
Hiểu được thời gian của nỗ lực tối ưu, mức độ chấn thương và giai đoạn chấn thương phổi sẽ cần nghiên cứu liên tục.
Giới thiệu
Duy trì nỗ lực tự phát trong quá trình thông khí cơ học từ lâu đã được công nhận để cải thiện quá trình oxy hóa, và vì oxy là mục tiêu quản lý quan trọng, nên nỗ lực này đã được coi là có lợi [1]. Ngoài ra, mất chức năng ảnh hưởng đến các cơ ngoại biên và cơ hoành đã ngày càng được công nhận là một biến chứng quan trọng của việc không sử dụng cơ bắp [2]; do đó, duy trì hoạt động cơ bắp tự phát có thể là lợi thế. Cuối cùng, dữ liệu dịch tễ học cho thấy sự gia tăng dần dần trong việc sử dụng các chế độ hỗ trợ thông khí một phần (so với đầy đủ) cho bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS) [3], và mô hình này đòi hỏi nhiều nỗ lực của bệnh nhân hơn. Tuy nhiên, bằng chứng tích lũy chỉ ra rằng nỗ lực tự phát trong khi thở máy có thể gây ra hoặc làm nặng thêm tổn thương phổi cấp tính, đặc biệt là khi nỗ lực tự phát mạnh mẽ và tổn thương phổi nghiêm trọng [4-13,14]. Gần đây, chấn thương phổi phụ thuộc vào nỗ lực đã được gọi là tổn thương phổi tự gây ra cho bệnh nhân (P-SILI, patient self-inflicted lung injury) [15].
Tổng quan hiện nay tóm tắt vai trò của việc thở tự nhiên trong quá trình thở máy cơ học trong ARDS, cung cấp các cơ chế của P-SILI và quản lý việc thở tự nhiên trong ARDS.
Lợi ích của thở tự nhiên
Nỗ lực tự phát trong quá trình thở máy đã được báo cáo để cải thiện trao đổi khí và sục khí phổi (bằng chứng là CT) trong nhiều nghiên cứu thử nghiệm và lâm sàng [16-21]. Điều này một phần là do làm giảm áp lực màng phổi [1,22]. Các cơn co thắt cơ hít vào mở rộng phổi một cách tích cực, dẫn đến sự gia tăng áp lực xuyên phổi [PL, là sự khác biệt giữa áp lực đường thở (Paw) và áp lực màng phổi (Ppl)]. Trương lực cơ liên tục của cơ hoành duy trì PL trong khi thở ra, và điều này giúp ngăn ngừa mất thể tích phổi cuối thì thở ra [23,24]. Thật vậy, một nghiên cứu gần cho thấy co bóp cơ hoành thì thở ra nhẹ nhàng chống lại sự xẹp phổi [25]; do đó, duy trì nhịp thở tự nhiên (có lẽ là nhẹ nhàng) trong khi thở máy có thể được coi là một phương pháp xâm lấn tối thiểu trong việc huy động phổi [26]. Điều quan trọng là lợi ích của nỗ lực tự phát đối với cơ hoành chỉ được quan sát khi nỗ lực tự phát trong thở máy ở mức độ khiêm tốn, nghĩa là nỗ lực tự phát mạnh mẽ gây ra chấn thương cơ hoành và không có nỗ lực tự phát gây ra teo cơ, cả hai đều liên quan đến thở máy kéo dài phụ thuộc [27,28].
Tác hại của nỗ lực tự phát
Chứng cớ
Một nghiên cứu mang tính bước ngoặt 30 năm trước đã chứng minh tác hại liên quan đến nỗ lực tự phát [29]. Ở cừu, nỗ lực tự phát đã được tăng lên nhờ tiêm natri salicylate (chất kích thích hô hấp) vào cisterna magna, làm tăng thể tích khí lưu thông (VT), và thông khí phút, và gây ra tổn thương phổi nghiêm trọng [29]. Sau nghiên cứu này, việc tích lũy bằng chứng chỉ ra rằng nỗ lực tự phát có thể gây ra và/hoặc làm tổn thương phổi nặng hơn, đặc biệt là nếu chấn thương ban đầu là nghiêm trọng và/hoặc nỗ lực này rất mạnh mẽ [4-13,14], như sau. Đầu tiên, dữ liệu phòng thí nghiệm cung cấp bằng chứng trực tiếp nhất. Ở thỏ và lợn thở máy có tổn thương phổi đã thành lập, nỗ lực tự phát mạnh mẽ làm tổn thương phổi nghiêm trọng hơn mặc dù có giới hạn của áp lực cao nguyên [6]. ARDS nặng có liên quan đến nỗ lực tự phát mạnh hơn so với ARDS nhẹ, và tác động gây tổn thương của thở tự nhiên trong quá trình thở máy kéo dài nổi bật hơn trong bệnh nặng [8]. Thứ hai, các báo cáo trường hợp cá nhân tiết lộ rằng nỗ lực mạnh mẽ trong thở máy có liên quan đến oxy hóa kém, phù phổi và barotrauma [4,5,30,31]. Cuối cùng, ba thử nghiệm ngẫu nhiên báo cáo rằng phong tỏa cơ thần kinh (để ngăn chặn nỗ lực tự phát) dẫn đến cải thiện chức năng phổi, giảm tình trạng viêm và tăng tỷ lệ sống sót trong ARDS nặng [3234]. Trong nghiên cứu lớn nhất (340 bệnh nhân), sử dụng sớm phong bế thần kinh cơ ở bệnh nhân ARDS (PaO2/FiO2 dưới 150 mmHg) dẫn đến ít barotrauma (4 so với 11,7%) và tỷ lệ tử vong ở 90 ngày thấp hơn ở bệnh nhân PaO2/FiO2 dưới 120 mmHg (30,8 so với 44,6%) [34]. Ở trẻ em bị ARDS, nỗ lực tự phát mạnh mẽ, trong môi trường thông khí giải phóng áp lực đường thở (APRV), tỷ lệ tử vong tăng gấp đôi, so với nỗ lực khiêm tốn trong thông khí áp lực [14]. Ngoài ra, dữ liệu từ một cơ sở dữ liệu lớn (> 7000 bệnh nhân) cho thấy tỷ lệ tử vong tại bệnh viện ở bệnh nhân thở máy bị nhiễm trùng huyết nặng giảm từ 4 đến 12% (tùy theo phân tích) ở những người được cho thuốc phong bế thần kinh cơ trong 2 ngày đầu vào bệnh viện [35].
Khái niệm về tổn thương phổi do bệnh nhân tự gây ra
Gần đây, khái niệm chấn thương phổi phụ thuộc vào nỗ lực đã được gọi là “P-SILI” [15]. Ý tưởng này được hỗ trợ bởi các nghiên cứu được đề cập ở trên, cũng như dữ liệu mới hơn được báo cáo từ các nghiên cứu về thông khí không xâm lấn. Bệnh nhân bị suy hô hấp cấp tính thất bại với thông khí không xâm lấn hiện được biết là có hoạt động trung khu hô hấp cao (không thấp) [36] và những bệnh nhân này có tiên lượng đặc biệt kém [37].
Cơ chế
Ở đây chúng tôi đã mô tả ba cơ chế tiềm ẩn của tổn thương phổi do nỗ lực tự phát: tăng căng thẳng phổi (lung stress), tăng tưới máu phổi và không đồng bộ bệnh nhân – máy thở.
Căng thẳng phổi tăng
Nỗ lực tự phát trong quá trình thở máy không làm thay đổi đáng kể Paw; tuy nhiên vì Ppl bị giảm; PL, và căng thẳng phổi toàn cục, được tăng lên. Nếu tính chất cơ học của phổi không thay đổi, VT kết quả sẽ được tăng lên, và mức độ tăng sẽ tỷ lệ thuận với tăng PL. Tất nhiên, VT lớn và căng thẳng phổi cao hơn gây ra tổn thương phổi và barotrauma [4].
Tuy nhiên, điều quan trọng cần lưu ý là ngay cả khi VT và PL toàn cục bị hạn chế (có kiểm soát), nỗ lực tự phát có thể gây tổn thương phổi bằng cách tăng căng thẳng phổi cục bộ [7,11 1313]. Ở phổi bị thương (tức là “phổi đặc”), Ppl thì hít vào sau khi co thắt cơ hoành không bị tiêu tan, nhưng chủ yếu được tập trung vào các vùng phụ thuộc mà nó được tạo ra (bằng cách co thắt cơ hoành; Hình 1, Hình cho đang phát slideshow, http://links.lww.com/COCC/A20) [7,12]. Do đó, nỗ lực mạnh mẽ hơn dẫn đến “sự dao động” áp lực cục bộ âm tính hơn ở Ppl trong phổi phụ thuộc so với phần còn lại của phổi (trái ngược với phổi bình thường “giống như chất lỏng”
trong đó sự dao động Ppl được lan tỏa nhanh chóng trên toàn bộ bề mặt phổi). Căng thẳng phổi cục bộ (phụ thuộc) cao hơn gây ra chấn thương cục bộ [7]; nó cũng dẫn đến việc huy động đáng kể trong phổi phụ thuộc [11,12] bằng cách hút khí từ các vùng phổi khác, ví dụ, phổi không phụ thuộc (tức là gọi là Pendelluft [7]) hoặc từ máy thở (Hình 2). Dữ liệu gần đây đã xác nhận rằng phần lớn tổn thương phổi liên quan đến nỗ lực tự phát xảy ra ở phổi phụ thuộc, đó là cùng một khu vực trong đó nỗ lực tự phát mạnh mẽ gây ra kéo căng và căng thẳng thì hít vào lớn hơn (Hình 3) [13].
Tăng tưới máu phổi
Nỗ lực tự phát tạo ra một Ppl âm tính hơn, từ đó làm tăng áp lực xuyên thành mạch máu, đó là sự khác biệt giữa áp lực nội mạch và áp lực ngoài thành. Áp lực xuyên thành mạch máu là áp lực ròng làm căng phồng các mạch máu trong lồng ngực; thêm nữa, nỗ lực tự phát mạnh mẽ trong quá trình thông khí kiểm soát thể tích VT thấp (trong đó Ppl trở nên cực kỳ âm tính, vì nỗ lực hít vào vẫn tiếp tục nhưng luồng khí vào phổi bị ngưng lại) có thể gây phù phổi ở ARDS [31]. Cuối cùng, nỗ lực tự phát mạnh mẽ gần đây đã được chứng minh là làm tăng tưới máu phổi và tỷ lệ phù nề, và làm xấu đi kết cục ở trẻ em bị hen suyễn cấp tính [40].
HÌNH 1. Truyền áp lực không đồng nhất với sự có mặt của mô phổi đặc do xẹp phổi. ΔPpl âm tính do co thắt cơ hoành được truyền kém sang phần còn lại của bề mặt màng phổi vì xẹp phổi ngăn chặn truyền ΔPpl. Áp lực cao hơn ở phổi phụ thuộc cục bộ sẽ hút khí từ phổi không phụ thuộc (được gọi là Pendelluft), hoặc từ khí quản và máy thở, về phía phổi phụ thuộc. Điều này gây ra sự huy động quá mức trong phổi phụ thuộc, với sự nỗ lực tự phát mạnh mẽ và “mô đặ” ở vùng xẹp phổi. Được sửa đổi với sự cho phép của Hiệp hội Y học Chăm sóc Chuyên sâu Châu Âu [38].
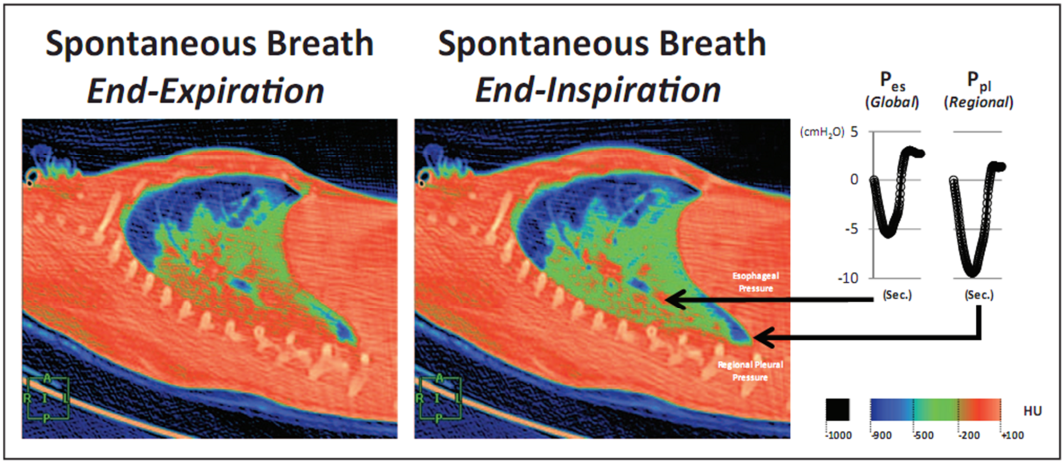
HÌNH 2. Quét CT động khi thở ra (hình bên trái) chứng tỏ rằng phổi được sục khí (màu xanh) là không phụ thuộc, trong khi phổi phụ thuộc đông đặc ở màu đỏ (màu đỏ). Ở cuối thì hít vào trong một hơi thở tự phát (hình giữa), có rất ít thay đổi trong phổi thông khí tốt, không phụ thuộc (màu xanh); phổi phụ thuộc, trước đây dày đặc (màu đỏ) bây giờ được sục khí một phần (màu xanh lá cây/đỏ). Các đường cong áp lực màng phổi thì hít vào (hình bên phải), được đo ở đầu mũi tên, cho thấy độ lệch âm của Ppl khu vực và Pes toàn cục trong khi hít vào. Tuy nhiên, ‘swing’ trong Ppl khu vực lớn hơn (2) so với ‘swing’ trong Pes, cho thấy sự co thắt cơ hoành dẫn đến áp lực căng lớn hơn áp dụng cho phổi khu vực gần cơ hoành so với áp lực truyền đến phần còn lại của phổi (tức là Pes). Đơn vị HU, Hounsfield; Pes, áp lực thực quản; Ppl, áp lực màng phổi. Bản quyền 2019 Hiệp hội lồng ngực Hoa Kỳ [39]
Không đồng bộ máy thở-bệnh nhân
Sự không đồng bộ có khả năng làm tổn thương phổi. Thật vậy, tác động bất lợi của bệnh nhân không đồng bộ máy thở ngày càng được công nhận và dữ liệu từ 50 bệnh nhân thở máy cho thấy mối liên quan giữa tăng tỷ lệ không đồng bộ và tỷ lệ tử vong cao hơn [41]. Ví dụ, ‘Kích hoạt kép (Double triggering), sự xuất hiện của hai lần hít vào liên tiếp sau một nỗ lực hít vào duy nhất [42], gây tổn thương vì VT đã được tăng lên. Kích hoạt kép là phổ biến hơn ở những bệnh nhân có hoạt động trung khu hô hấp cao hơn [43]. Ngược lại với nỗ lực tự phát mạnh mẽ, dễ phát hiện và được công nhận rộng rãi là có hại [39,43], kích hoạt ngược có thể xảy ra ở những bệnh nhân bị an thần nặng, một kịch bản trong đó các bác sĩ lâm sàng coi nguy cơ không đồng bộ là tối thiểu [44]. Kích hoạt ngược (reverse triggering) có thể làm tăng PL và/hoặc VT, và – thông qua Pendelluft – có thể làm tăng căng thẳng phổi phụ thuộc và kéo căng [45].
Quản lý nỗ lực tự phát trong hội chứng nguy kịch hô hấp cấp
Tổn thương phổi nhẹ
Nhiều dữ liệu lâm sàng và thực nghiệm cho thấy ARDS nhẹ đến trung bình là một tình huống lâm sàng, trong đó lợi ích của việc thở tự nhiên trong khi thở máy có thể được quan sát [16, 21]. Năm 2001, Putensen và cộng sự. [16] đã thực hiện một nghiên cứu lâm sàng ngẫu nhiên ở những bệnh nhân bị tổn thương phổi cấp tính (PaO2/FiO2 300 mmHg) liên quan đến chấn thương và thấy rằng nỗ lực tự phát (so với liệt cơ) đã cải thiện oxy hóa, và rút ngắn thời gian hỗ trợ thở máy và thời gian ở lại ICU. Có những lý do quan trọng tại sao nỗ lực tự phát có thể có ích trong tổn thương phổi nhẹ. Đầu tiên, thở máy của những bệnh nhân như vậy thường sử dụng áp lực cao nguyên và áp lực đẩy thấp hơn, có lẽ vì độ giãn nở phổi ít bị giảm hơn so với bệnh nặng [46]. Do đó, việc bổ sung một nỗ lực tự phát nhất định vào áp lực cao nguyên thấp hơn (như xảy ra ở ARDS nhẹ hơn so với ARDS nặng hơn) dẫn đến PL thấp hơn, sẽ ít gây tổn thương hơn [8,17]. Thay vào đó, PL tăng nhẹ sẽ có hiệu quả để huy động phổi. Thứ hai, mức độ của nỗ lực tự phát thường ít hơn khi tổn thương phổi ít nghiêm trọng hơn. Quan sát này đã được xác nhận trong một nghiên cứu thực nghiệm [8], và có thể là kết quả của tình trạng viêm hệ thống ít hơn và mất thể tích phổi ít hơn – cả hai đều nổi bật trong ARDS nặng. Gần đây, một nghiên cứu lâm sàng với ECMO cũng báo cáo những phát hiện tương tự trong đó bảo tồn nỗ lực tự phát là khả thi hơn ở những bệnh nhân ít nghiêm trọng hơn [47]. Tóm lại, có vẻ như nỗ lực tự phát nên được tạo điều kiện trong ARDS ít nghiêm trọng hơn.
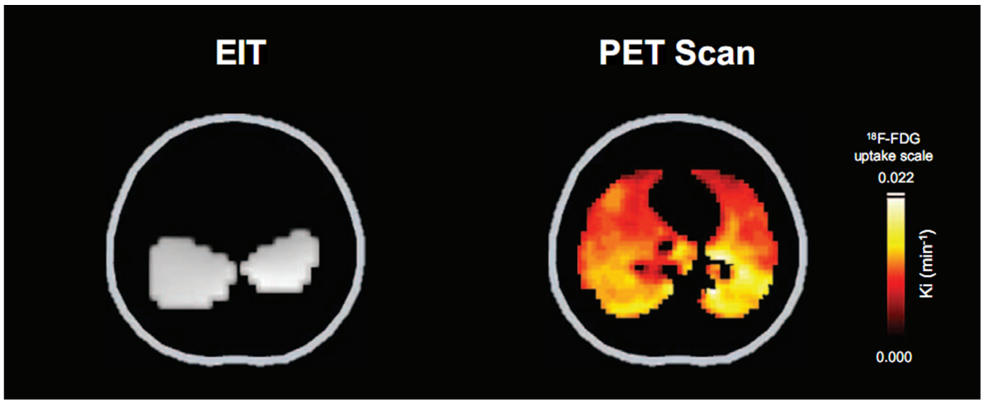
HÌNH 3. Hình ảnh EIT và PET được trình bày. Hình ảnh EIT này cho thấy các vùng phổi nơi độ giãn của phổi tăng lên do Pendelluft (sự chuyển dịch khí từ vùng không phụ thuộc sang các vùng phổi phụ thuộc trong khi hít vào), màu trắng. Thể tích khí lưu thông được duy trì ở mức 7 mL/kg, nhưng cường độ của sự căng phổi phụ thuộc cục bộ (vùng trắng) do ΔPpl âm tính hơn ở khu trú vùng này (tức là căng thẳng phổi cục bộ cao hơn) tương đương với áp lực của thể tích khí lưu thông 14 ml/kg trong quá trình liệt cơ, nghĩa là volutrauma cục bộ. Tương ứng, hình ảnh PET xác nhận rằng tình trạng viêm phổi chủ yếu xảy ra ở các khu vực phụ thuộc, cùng khu vực xảy ra tình trạng volutrauma cục bộ. EIT, chụp cắt lớp trở kháng điện; PEEP, áp lực cuối đường thở tích cực; PET, chụp cắt lớp phát xạ positron. In lại với sự cho phép của Hiệp hội lồng ngực Hoa Kỳ. Bản quyền 2019 Hiệp hội lồng ngực Hoa Kỳ [13].
Tổn thương phổi nặng
Tác hại liên quan đến nỗ lực tự phát thể hiện rõ hơn ở ARDS nặng, có thể là do áp lực đường thở cao hơn được sử dụng cùng với mức độ Ppl âm tính phản ánh nỗ lực hít vào lớn hơn [39]. Nỗ lực mạnh mẽ hơn được gây ra bởi một số yếu tố bao gồm tăng natri máu, toan máu, giảm oxy máu, đau, sốt và viêm phổi và hệ thống – tất cả đều là thường gặp trong ARDS, và ở mức độ lớn hơn trong bệnh nặng hơn. Hơn nữa, thông khí cơ học trong ARDS nặng thường đòi hỏi áp lực cao nguyên (và áp lực đẩy) cao hơn, phù hợp với độ giãn nở hệ hô hấp thấp [46]. Khi nỗ lực tự phát được thêm vào áp lực cao nguyên cao hơn, PL kết quả sẽ rất cao [8].
Mô hình này được phản ánh trong dữ liệu từ các nghiên cứu lâm sàng. Trong thử nghiệm lâm sàng lớn kiểm tra tác động của phong tỏa thần kinh cơ sớm ở ARDS, chỉ những bệnh nhân mắc bệnh nặng (PaO2/FiO22/FiO2
Một cách để ngăn chặn tác hại từ nỗ lực tự phát trong ARDS nặng là sử dụng phong bế thần kinh cơ trong hai ngày đầu [34]. Tuy nhiên, điều này cần phải được cân bằng trước nguy cơ mắc bệnh yếu cơ do ICU gây ra do phong tỏa thần kinh cơ và cách tiếp cận để giảm thiểu P-SILI trong khi duy trì một số hoạt động cơ bắp trong ARDS nghiêm trọng vẫn không bị ảnh hưởng. Một số báo cáo gần đây cho thấy hứa hẹn: phong tỏa thần kinh cơ một phần có thể tạo điều kiện cho nhịp thở tự nhiên được dung nạp tốt trong khi ngăn ngừa VT lớn và PL cao [48]; và, mức PEEP cao hơn có thể làm giảm cường độ của nỗ lực tự phát (có thể bằng cách thay đổi hiệu quả cơ học thần kinh của cơ hoành), giảm thiểu tổn thương phổi do nỗ lực tự phát mạnh trong ARDS nặng [11,13,21].
Oxy hóa qua màng ngoài cơ thể
Vai trò của nỗ lực tự phát ở những bệnh nhân mắc ARDS nặng trải qua quá trình oxy hóa qua màng ngoài cơ thể (ECMO) hoặc loại bỏ carbon dioxide ngoài cơ thể (ECCO2R) là không chắc chắn. Trong một mô hình thử nghiệm ARDS nghiêm trọng, hỗ trợ nỗ lực tự phát trong quá trình loại bỏ carbon dioxide ngoài cơ thể làm tăng viêm phổi [9]. Một nghiên cứu lâm sàng chứng minh rằng việc thở tự nhiên trong quá trình oxy hóa qua màng ngoài cơ thể là hầu như không thể ở những bệnh nhân mắc ARDS nặng [47]. Hơn nữa, loại bỏ carbon dioxide (bằng cách tăng lưu lượng khí quét) là không đủ để ngăn chặn nỗ lực hô hấp tự phát có hại và do đó giữ PL trong giới hạn an toàn [10,47]. Tác động của nhiễm toan máu (từ hypercapnia) đối trọng với kiểm soát của thở máy nên được tìm hiểu trong các nghiên cứu tương lai.
Dữ liệu lâm sàng gần đây nhất và sắp tới
Gần đây, dữ liệu phân tích LUNG SAFE được hình thành để mô tả các đặc điểm và kết quả của bệnh nhân với nỗ lực tự phát, kết hợp với bệnh nhân không có nỗ lực tự phát, trong 48 giờ đầu tiên của ARDS [49]. van Haren và Phạm kết luận rằng sau khi phù hợp với điểm số của xu hướng (tỷ lệ P/F trung bình: 172,1 61,4 so với 172,5 62,9 mmHg; có và không có nỗ lực tự phát), nỗ lực tự phát không liên quan đến tỷ lệ tử vong, nhưng có liên quan với thời gian ICU và thời gian nằm viện ngắn hơn.
Một hạn chế lớn của nghiên cứu này là định nghĩa về nỗ lực tự phát. Sự khác biệt giữa nỗ lực tự phát và không nỗ lực tự phát dựa trên sự hiện diện của bất kỳ nỗ lực tự phát nào mà bệnh nhân được chỉ định nỗ lực tự phát, nếu nhịp thở vượt quá giá trị đặt ra. Do đó, khoảng 10% bệnh nhân trong nhóm nỗ lực tự phát, nhận được sự phong tỏa cơ bắp, so với 25% bệnh nhân trong nhóm không có nỗ lực tự phát. Thông điệp từ nghiên cứu này là nỗ lực tự phát có thể mang lại lợi ích cho bệnh nhân mắc ARDS (ví dụ: thời gian ICU/thời gian nằm viện ngắn hơn) nếu nỗ lực tự phát được dung nạp tốt trong quá trình lâm sàng. Đáng chú ý, trong nghiên cứu này, những bệnh nhân không duy trì được nỗ lực tự phát và được chuyển sang nhóm nỗ lực không tự phát có tỷ lệ tử vong cao hơn.
Thở tự nhiên sớm trong hội chứng nguy kịch hô hấp cấp tính (BiRDS, NCT01862016) đã được thực hiện ở những bệnh nhân mắc ARDS nặng vừa (n = 702) để kiểm tra giả thuyết rằng việc tạo ra nỗ lực tự phát bằng chế độ BiPAPAPRV (10-50% tổng thông khí phút) có thể cho phép giảm tỷ lệ tử vong ở bệnh nhân mắc ARDS, so với thông khí có kiểm soát và không thấy có sự khác biệt về tất cả nguyên nhân tử vong của bệnh viện (33,2 so với 33,0%, BiPAP-APRV so với kiểm soát; P 0,82) (trình bày dữ liệu của JC Richard. 2018 Critical Care Canada Forum). Đáng chú ý, một nghiên cứu lâm sàng trước đây đã chỉ ra rằng BiPAP-APRV (so với thông khí hỗ trợ) làm tăng sức mạnh của nỗ lực tự phát và do đó hoạt động của hơi thở [50], có thể phủ nhận lợi ích tiềm năng của nỗ lực tự phát quan sát được trong thử nghiệm BiRDS.
Kể từ năm 2016, việc đánh giá lại thử nghiệm ức chế thần kinh cơ sớm (ROSE) toàn thân đã được đưa ra (NCT02509078) [51] và kết quả hiện đang chờ xử lý. Điều quan trọng là làm nổi bật sự khác biệt chính giữa các thử nghiệm ACURASYS [34] và ROSE [51]. Thử nghiệm ACURASYS sử dụng PEEP thấp hơn dựa trên bảng PEEP/FiO2 [52], trong khi thử nghiệm ROSE sử dụng chiến lược PEEP phổi mở cao hơn, dựa trên các chiến lược PEEP cao trước đó [53,54]; do đó, thử nghiệm ROSE dường như báo cáo tổn thương thấp do tê liệt và tổn thương thấp trong nhóm kiểm soát (nghĩa là PEEP cao hơn có thể khiến nỗ lực tự phát ít gây tổn thương hơn [11,13,21]), do đó gây ra ‘tác động’ của can thiệp (liệt cơ).
Kết hợp tất cả các dữ liệu thực nghiệm và lâm sàng, chúng tôi đề xuất rằng nỗ lực tự phát có thể được bảo tồn trong quá trình thở máy trừ khi nỗ lực này mạnh mẽ. Nỗ lực mạnh mẽ có lẽ nên tránh để bảo vệ phổi và cơ hoành. Nỗ lực tự phát có khả năng mạnh hơn ở những bệnh nhân bị bệnh nặng hơn. Cải thiện cách giám sát nỗ lực tự phát, ví dụ, đo áp lực thực quản, EIT, siêu âm là cần thiết để tạo điều kiện cho nỗ lực tự phát được dung nạp tốt trong ARDS. Nghiên cứu sâu hơn sẽ là cần thiết để xác định nỗ lực tự phát được dung nạp tốt là gì và hoạt động nỗ lực tự phát mà chúng ta nên hoặc chúng ta có thể tạo điều kiện trong ARDS.
Phần kết luận
Chúng tôi cập nhật và tóm tắt vai trò của thở tự phát trong thở máy trong ARDS. Các nghiên cứu trong tương lai để điều tra chiến lược thông khí để giảm thiểu P-SILI trong khi vẫn duy trì một số hoạt động tự phát sẽ cần thiết.
References and recommended reading
Papers of particular interest, published within the annual period of review, have been highlighted as: of special interest of outstanding interest
Putensen C, Hering R, Wrigge H. Controlled versus assisted mechanical ventilation. Curr Opin Crit Care 2002; 8:51–57.
Levine S, Nguyen T, Taylor N, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med 2008; 358: 1327–1335.
Esteban A, Frutos-Vivar F, Muriel A, et al. Evolution of mortality over time in patients receiving mechanical ventilation. Am J Respir Crit Care Med 2013; 188:220–230.
Leray V, Bourdin G, Flandreau G, et al. A case of pneumomediastinum in a patient with acute respiratory distress syndrome on pressure support ventila-tion. Respir Care 2010; 55:770–773.
Sasidhar M, Chatburn RL. Tidal volume variability during airway pressure release ventilation: case summary and theoretical analysis. Respir Care 2012; 57:1325–1333.
Yoshida T, Uchiyama A, Matsuura N, et al. Spontaneous breathing during lung-protective ventilation in an experimental acute lung injury model: high transpulmonary pressure associated with strong spontaneous breathing effort may worsen lung injury. Crit Care Med 2012; 40:1578–1585.
Yoshida T, Torsani V, Gomes S, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med 2013; 188:1420–1427.
Yoshida T, Uchiyama A, Matsuura N, et al. The comparison of spontaneous breathing and muscle paralysis in two different severities of experimental lung injury. Crit Care Med 2013; 41:536–545.
Guldner A, Kiss T, Bluth T, et al. Effects of ultraprotective ventilation, extracorporeal carbon dioxide removal, and spontaneous breathing on lung morphofunction and inflammation in experimental severe acute respiratory distress syndrome. Anesthesiology 2015; 122:631–646.
Mauri T, Langer T, Zanella A, et al. Extremely high transpulmonary pressure in a spontaneously breathing patient with early severe ARDS on ECMO. Intensive Care Med 2016; 42:2101–2103.
Yoshida T, Roldan R, Beraldo MA, et al. Spontaneous effort during mechan-ical ventilation: maximal injury with less positive end-expiratory pressure. Crit Care Med 2016; 44:e678–e688.
Yoshida T, Nakahashi S, Nakamura MAM, et al. Volume-controlled ventilation does not prevent injurious inflation during spontaneous effort. Am J Respir Crit Care Med 2017; 196:590–601.
Morais CCA, Koyama Y, Yoshida T, et al. High positive end-expiratory pressure renders spontaneous effort noninjurious. Am J Respir Crit Care Med 2018; 197:1285–1296.
Lalgudi Ganesan S, Jayashree M, Chandra Singhi S, Bansal A. Airway pressure release ventilation in pediatric acute respiratory distress syndrome. a randomized controlled trial. Am J Respir Crit Care Med 2018; 198:1199–1207. This is the first to reveal the association between vigorous effort and worse clinical outcome in pediatric patients with ARDS.
Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med 2017; 195:438–442. This is an elegant review to introduce the concept of patient self-inflicted lung injury.
Putensen C, Zech S, Wrigge H, et al. Long-term effects of spontaneous breathing during ventilatory support in patients with acute lung injury. Am J Respir Crit Care Med 2001; 164:43–49.
Wrigge H, Zinserling J, Neumann P, et al. Spontaneous breathing improves lung aeration in oleic acid-induced lung injury. Anesthesiology 2003; 99:376–384.
Neumann P, Wrigge H, Zinserling J, et al. Spontaneous breathing affects the spatial ventilation and perfusion distribution during mechanical ventilatory support. Crit Care Med 2005; 33:1090–1095.
Spieth PM, Carvalho AR, Pelosi P, et al. Variable tidal volumes improve lung protective ventilation strategies in experimental lung injury. Am J Respir Crit Care Med 2009; 179:684–693.
Guldner A, Braune A, Carvalho N, et al. Higher levels of spontaneous breathing induce lung recruitment and reduce global stress/strain in experi-mental lung injury. Anesthesiology 2014; 120:673–682.
Magalhaes PAF, Padilha GA, Moraes L, et al. Effects of pressure support ventilation on ventilator-induced lung injury in mild acute respiratory distress syndrome depend on level of positive end-expiratory pressure: A randomised animal study. Eur J Anaesthesiol 2018; 35:298–306.
Guldner A, Pelosi P, Gama de Abreu M. Spontaneous breathing in mild and moderate versus severe acute respiratory distress syndrome. Curr Opin Crit Care 2014; 20:69–76.
Froese AB, Bryan AC. Effects of anesthesia and paralysis on diaphragmatic mechanics in man. Anesthesiology 1974; 41:242–255.
Hedenstierna G, Tokics L, Lundquist H, et al. Phrenic nerve stimulation during halothane anesthesia. Effects of atelectasis. Anesthesiology 1994; 80:751–760.
Pellegrini M, Hedenstierna G, Roneus A, et al. The diaphragm acts as a brake during expiration to prevent lung collapse. Am J Respir Crit Care Med 2017;195:1608–1616. This study clarifies an important role of diaphragm to maintain lung volume.
Marini JJ. Spontaneously regulated vs. controlled ventilation of acute lung injury/ acute respiratory distress syndrome. Curr Opin Crit Care 2011; 17:24–29.
Goligher EC, Fan E, Herridge MS, et al. Evolution of diaphragm thickness during mechanical ventilation. Impact of inspiratory effort. Am J Respir Crit Care Med 2015; 192:1080–1088.
Goligher EC, Dres M, Fan E, et al. Mechanical ventilation-induced diaphragm atrophy strongly impacts clinical outcomes. Am J Respir Crit Care Med 2018; 197:204–213.
Mascheroni D, Kolobow T, Fumagalli R, et al. Acute respiratory failure following pharmacologically induced hyperventilation: an experimental animal study. Intensive Care Med 1988; 15:8–14.
Coggeshall JW, Marini JJ, Newman JH. Improved oxygenation after muscle relaxation in adult respiratory distress syndrome. Arch Intern Med 1985; 145:1718–1720.
Kallet RH, Alonso JA, Luce JM, Matthay MA. Exacerbation of acute pulmonary edema during assisted mechanical ventilation using a low-tidal volume, lung-protective ventilator strategy. Chest 1999; 116:1826–1832.
Gainnier M, Roch A, Forel JM, et al. Effect of neuromuscular blocking agents on gas exchange in patients presenting with acute respiratory distress syndrome. Crit Care Med 2004; 32:113–119.
Forel JM, Roch A, Marin V, et al. Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome. Crit Care Med 2006; 34:2749–2757.
Papazian L, Forel JM, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010; 363:1107–1116.
Steingrub JS, Lagu T, Rothberg MB, et al. Treatment with neuromuscular blocking agents and the risk of in-hospital mortality among mechanically ventilated patients with severe sepsis. Crit Care Med 2014; 42:90–96.
Carteaux G, Millan-Guilarte T, De Prost N, et al. Failure of noninvasive ventilation for de novo acute hypoxemic respiratory failure: role of tidal volume. Crit Care Med 2016; 44:282–290.
Bellani G, Laffey JG, Pham T, et al. Noninvasive ventilation of patients with acute respiratory distress syndrome. insights from the LUNG SAFE Study. Am J Respir Crit Care Med 2017; 195:67–77.
Yoshida T, Amato MBP, Kavanagh BP. Understanding spontaneous vs. ventilator breaths: impact and monitoring. Intensive Care Med 2018; 44: 2235–2238.
Yoshida T, Fujino Y, Amato MB, Kavanagh BP. Fifty years of research in ARDS. Spontaneous breathing during mechanical ventilation. risks, me-chanisms, and management. Am J Respir Crit Care Med 2017; 195:985–992.
Kantor DB, Hirshberg EL, McDonald MC, et al. Fluid balance is asso-ciated with clinical outcomes and extravascular lung water in children with acute asthma exacerbation. Am J Respir Crit Care Med 2018; 197:1128–1135.
Blanch L, Villagra A, Sales B, et al. Asynchronies during mechanical ventilation are associated with mortality. Intensive Care Med 2015; 41:633–641.
Pohlman MC, McCallister KE, Schweickert WD, et al. Excessive tidal volume from breath stacking during lungprotective ventilation for acute lung injury. Crit Care Med 2008; 36:3019–3023.
Thille AW, Rodriguez P, Cabello B, et al. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med 2006; 32:1515–1522.
Akoumianaki E, Lyazidi A, Rey N, et al. Mechanical ventilation-induced reverse-triggered breaths: a frequently unrecognized form of neuromechanical cou-pling. Chest 2013; 143:927–938.
Yoshida T, Nakamura MAM, Morais CCA, et al. Reverse triggering causes an injurious inflation pattern during mechanical ventilation. Am J Respir Crit Care Med 2018; 198:1096–1099.
Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA 2016; 315:788–800.
Crotti S, Bottino N, Ruggeri GM, et al. Spontaneous breathing during extracorporeal membrane oxygenation in acute respiratory failure. Anesthe-siology 2017; 126:678–687. This is a clinical–physiological study illustrating the difficulty of preserving spon-taneous effort in patients with severe ARDS during ECMO.
Doorduin J, Nollet JL, Roesthuis LH, et al. Partial neuromuscular blockade during partial ventilatory support in sedated patients with high tidal volumes.Am J Respir Crit Care Med 2017; 195:1033–1042. This is clinical study explores a novel strategy to minimize effort-dependent lung injury while maintaining some muscle activity.
van Haren F, Pham T, Brochard L, et al. Spontaneous breathing in early acute respiratory distress syndrome: insights from the Large Observational Study to UNderstand the Global Impact of Severe Acute Respiratory FailurE Study. Crit Care Med 2019; 47:229–238.
Rittayamai N, Beloncle F, Goligher EC, et al. Effect of inspiratory synchroniza-tion during pressure-controlled ventilation on lung distension and inspiratory effort. Ann Intensive Care 2017; 7:100.
Huang DT, Angus DC, Moss M, et al. Design and rationale of the reevaluation of systemic early neuromuscular blockade trial for acute respiratory distress syndrome. Ann Am Thorac Soc 2017; 14:124–133.
Brower RG, Matthay MA, Morris A, et al., Acute Respiratory Distress Syn-drome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000; 342:1301–1308.
Brower RG, Lanken PN, MacIntyre N, et al. Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med 2004; 351:327–336.
Mercat A, Richard JC, Vielle B, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 2008; 299:646–655.