Mục đích
Mô tả kỹ thuật nhuộm soi trực tiếp tìm AFB (Acid –Fast- Bacilli) theo phương pháp nhuộm Ziehl-Neelsen (ZN) sử dụng kính hiển vi quang học.
Bệnh phẩm
Loại bệnh phẩm
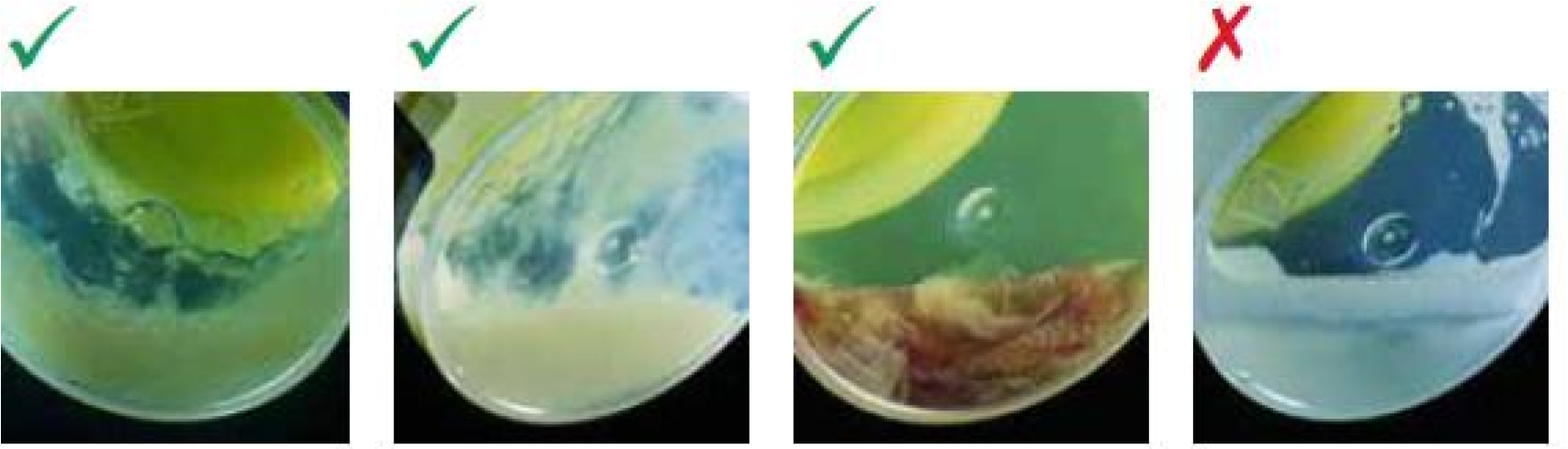
Bệnh phẩm đờm đạt chất lượng: có nhày mủ, thể tích mẫu ít nhất 2 ml.
Đờm nhày Đờm mủ Có máu Nước bọt
Cặn bệnh phẩm sau ly tâm.
Khuẩn lạc mọc trên môi trường đặc.
Canh khuẩn từ týp MGIT (+).
Yêu cầu về hành chính
Mẫu phải đựng trong cốc/týp theo qui định.
Mẫu phải đầy đủ thông tin trên thân dụng cụ chứa mẫu.
Phiếu xét nghiệm (XN) phải đủ thông tin người bệnh.
Thông tin trên mẫu và phiếu xét nghiệm phải phù hợp.
Trang thiết bị – vật liệu
Thiết bị
Tủ an toàn sinh học cấp I được kiểm chuẩn hàng năm.
Đèn gas hoặc đèn cồn để cố định tiêu bản.
Máy làm khô tiêu bản (ở nơi có số lượng mẫu nhiều trong ngày).
Bồn nhuộm tiêu bản.
Đồng hồ phút.
Kính hiển vi quang học 2 mắt với vật kính 100X, 10X.
Nồi hấp hoặc lò đốt.
Thùng rác có nắp đậy.
Vật liệu
Lam kính có đầu mờ.
Bút chì đen HB.
Que phết đờm dùng 1 lần (tre, gỗ).
Vòi nước.
Bộ hóa chất nhuộm ZN.
Que có đầu bông (gạc) để đốt lửa hơ nóng tiêu bản.
Giá nhuộm tiêu bản.
Giấy lau kính.
Hộp đựng tiêu bản.
Giá để tiêu bản sau khi dàn, giá để tiêu bản sau khi nhuộm.
Giấy lọc thuốc nhuộm.
Dụng cụ và túi nilon chứa chất thải.
Dầu soi kính.
Hóa chất
Chuẩn bị hóa chất nhuộm zn
Dung dịch nhuộm màu Ziehl s Carbol Fuchsin 0,3%
Công thức:
Phenol tinh thể……………………………50gam
Cồn Ethylic 950 …… …………………….100ml
Fuchsin basis………………………………3gam
Nước cất ………………………………..850ml
Cách pha: Hoà tan phenol trong 100ml cồn, thêm 3 g Fuchsin hòa tan, lọc hỗn dịch trên vào 850 ml nước cất, lắc đều.
Dung dịch tẩy màu cồn acid HCl 3%
Công thức:
Acid HCl đậm đặc…………………………30ml
Cồn Ethylic 950…………………………..970ml
Cách pha: Cho từ từ acid đậm đặc vào chai chứa 970 cồn. Không làm ngược lại vì gây nổ.
Dung dịch nhuộm nền xanh Methylen 0,3%
Công thức:
Methylen blue ………………………………3gam
Nước cất…………………………………1000ml.
Cách pha: Hòa tan 3g Methylen blue trong 1000ml nước cất.
Bảo quản và hạn sử dụng
Tuyến tỉnh pha hóa chất nhuộm ZN, lọc và kiểm tra chất lượng đạt yêu cầu, cấp cho tuyến huyện theo chu kỳ hàng tháng.
Hóa chất màu của ZN phải được bảo quản trong chai thủy tinh màu.
Bộ hóa chất nhuộm ZN và bộ chai bảo quản thuốc nhuộm phải dán nhãn ghi tên hóa chất, nồng độ, ngày pha và hạn sử dụng.
Bảo quản hóa chất ở nơi thoáng mát, tránh ánh nắng mặt trời.
Khi thay hóa chất mới, phải rửa sạch chai cũ tránh tạo cặn fuchsin gây lỗi sai dương.
Nguyên lý
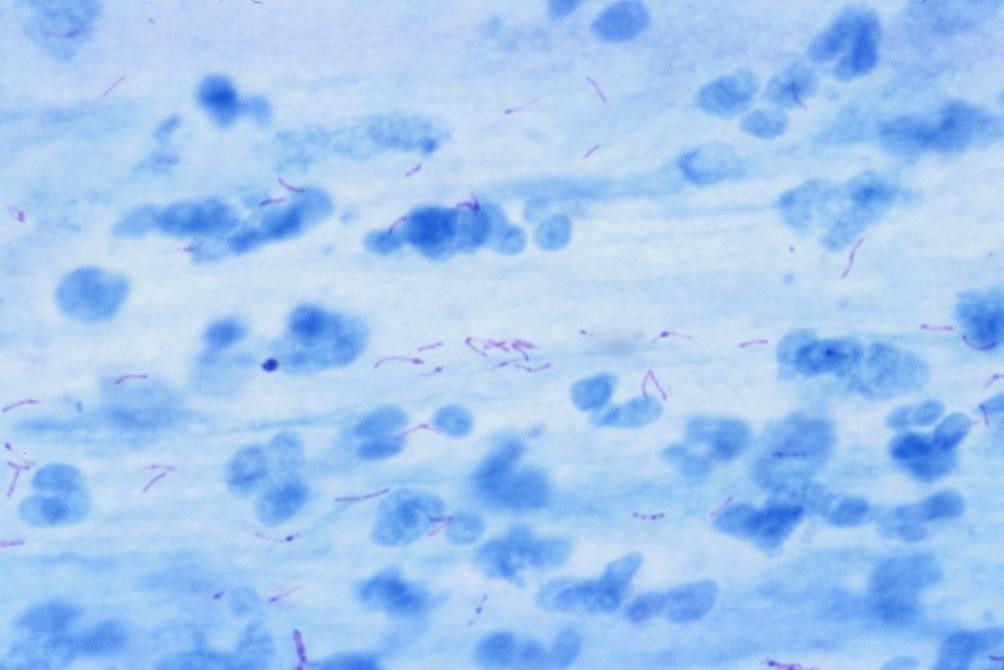
Mycobacteria (trong đó có vi khuẩn lao) có lớp vách sáp dày nên khó bắt màu với thuốc nhuộm thông thường và có tính kháng cồn – acid. Phương pháp nhuộm Ziehl do thuốc nhuộm có chứa phenol và hơ nóng khi nhuộm nên fuchsin ngấm qua lớp vách của vi khuẩn, khi tẩy màu bằng dung dịch cồn-acid 3%, AFB vẫn giữ được màu đỏ Fuchsin trong khi các tế bào và vi khuẩn khác bị tẩy mất màu đỏ, bước nhuộm nền tạo sự tương phản giữa AFB màu đỏ trên màu nền xanh sáng.
Các bước thực hiện
Chuẩn bị
Sử dụng lam kính mới, không có vết xước hoặc mốc, đã lau cồn 950 và làm khô.
Cập nhật thông tin người bệnh vào sổ xét nghiệm trước khi thực hiện kỹ thuật.
Số xét nghiệm thống nhất từ sổ xét nghiệm, phiếu xét nghiệm, cốc đờm và lam kính. Số xét nghiệm gồm 2 phần: tử số là số thứ tự trong sổ xét nghiệm, mẫu số là số thứ tự của mẫu (Ví dụ: 120/1, 120/2). Đối chiếu và kiểm tra các thông tin cẩn thận tránh nhầm lẫn. Số xét nghiệm theo thứ tự từ đầu năm đến cuối năm.
Dùng bút chì đen HB viết số xét nghiệm lên đầu mờ của lam kính. Không chạm tay vào phần lam kính còn lại.
Sắp xếp cốc đờm và lam kính theo thứ tự tránh nhầm lẫn.
Khởi động tủ ATSH trước khi sử dụng ít nhất 15 phút để thanh lọc khí.
Sắp xếp dụng cụ/vật liệu cần thiết vào tủ ATSH: máy làm khô tiêu bản (bật máy ở 50600C), que dàn tiêu bản, bô can chứa chất sát khuẩn, giá đựng tiêu bản, khay có lót khăn, giấy thấm dung dịch sát khuẩn, lam kính và cốc đờm.
Dàn tiêu bản
Bệnh phẩm đờm
Mở nắp cốc đờm nhẹ nhàng, đặt nắp ngửa trên khay.
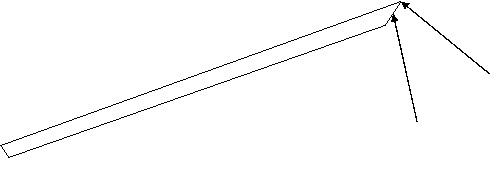
Quan sát kỹ mẫu đờm, dùng đầu vát của que phết đờm chọn mảnh đờm nhày mủ, nhẹ nhàng cắt mẩu đờm bằng cách di cạnh vát que tre vào thành cốc đờm.
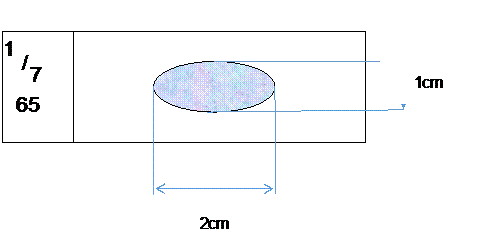
Đặt mẩu đờm lên giữa lam kính trùng số với cốc đờm, dùng mặt vát que tre dàn đờm trên lam theo hình bầu dục kích thước 1x2cm, quay mũi nhọn que tre dàn tiếp tạo độ mịn cho vết dàn. Dàn đờm đều đặn, liên tục theo hình xoắn ốc từ trung tâm ra ngoài hoặc theo kiểu tóc rối, dàn đến khi thấy đờm hơi se. Không dàn khi đờm đã khô.
Hủy que phết đờm vào bô can có chất sát khuẩn.
Đặt tiêu bản lên giá để khô tự nhiên hoặc làm khô trên máy làm khô tiêu bản.
Đậy lại nắp cốc đờm.
Sử dụng que tre có đầu vát theo hình ảnh
Cặn bệnh phẩm sau li tâm
Nhỏ 1 – 2 giọt cặn lên giữa lam kính, dàn tiêu bản theo kích thước 1 x 2 cm.
Các bước tiếp theo giống như tiêu bản đờm.
Canh khuẩn mgit (+)
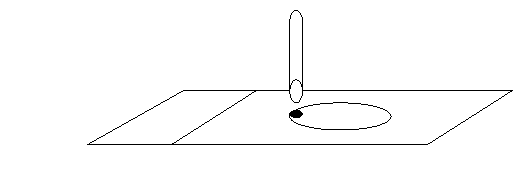
Quan sát tuýp MGIT (+) nếu có cặn vụn ở đáy tuýp, dùng pipet nhựa vô trùng hút nhẹ lớp cặn vụn nhỏ 1 giọt vào lam kính đã tạo nền albumin, dàn nhẹ nhàng.
Nếu canh khuẩn đục đều hút 1 – 2 giọt làm tiêu bản.
Các bước tiếp theo giống như tiêu bản đờm.
Khuẩn lạc từ nuôi cấy đặc
Lấy khuẩn lạc từ tuýp cấy nghiền nhẹ vào 1 giọt nước cất trên lam kính tạo huyền dịch hơi đục, dàn tiêu bản.
Các bước tiếp theo giống như tiêu bản đờm.
Cố định tiêu bản:
Hơ nóng tiêu bản qua ngọn lửa đèn cồn 3 lần mỗi lần khoảng 3 giây (mặt tiêu bản ngửa lên trên).
Nhuộm tiêu bản:
3 bước
Nhuộm màu
Xếp tiêu bản theo thứ tự trên giá nhuộm, mỗi tiêu bản cách nhau ít nhất 1 cm.
Phủ dung dịch Fuchsin 0,3% kín toàn bộ bề mặt lam kính.
Hơ nóng tiêu bản từ phía dưới đến khi Fuchsin bốc hơi.
Để ít nhất 5 phút.
Nếu Fuchsin tràn ra ngoài, bổ sung thêm Fuchsin và hơ nóng lại.
Rửa tiêu bản nhẹ nhàng cho trôi hết thuốc nhuộm.
Nghiêng tiêu bản cho ráo nước.
Tẩy màu
Phủ đầy dung dịch acid – cồn lên tiêu bản, để 3 phút.
Rửa nước. Nghiêng tiêu bản cho ráo nước.
Sau khi rửa, các tiêu bản không còn màu hồng.
Nếu tiêu bản vẫn còn màu hồng, tẩy lại lần 2, thời gian từ 1 – 3 phút cho đến khi hết màu hồng, rửa lại nước.
Nhuộm nền
Phủ đầy dung dịch xanh Methylene 0,3% lên tiêu bản.
Để 30 giây – 1 phút.
Rửa nước, nghiêng tiêu bản cho ráo nước.
Chú ý: cho vòi nước chảy nhẹ nhàng từ đầu tiêu bản. KHÔNG xối vòi nước thẳng vào vết dàn.
Làm khô tiêu bản
Xếp tiêu bản lên giá để khô tự nhiên, hoặc bằng máy làm khô tiêu bản.
Chú ý: KHÔNG làm khô tiêu bản bằng cách hơ tiêu bản qua ngọn lửa hay dùng khăn hoặc giấy để thấm khô.
Soi kính hiển vi
Lấy vi trường
Bật nguồn điện.
Lau thị kính, vật kính và tụ quang bằng giấy lau chuyên dụng.
Xoay vật kính x10 vào trục quang học.
Đặt tiêu bản lên mâm kính, sử dụng vật kính x10 để lấy vi trường.
Nhỏ một giọt dầu soi vào đầu trái của vết dàn, để giọt dầu rơi tự do không chạm đầu ống nhỏ giọt vào vết dàn tránh nhiễm chéo.
Xoay vật kính x100 vào trục quang học. Dầu soi tạo thành 1 lớp mỏng giữa vật kính x100 và tiêu bản.
Không để vật kính chạm tiêu bản.
Điều chỉnh ốc vi cấp nhẹ nhàng để nhìn hình ảnh rõ nét.
Chú ý: Không soi tiêu bản ướt vì không rõ vi trường và có thể hỏng vật kính Chỉ dùng ốc vi cấp với vật kính x100.
Cách soi tiêu bản và nhận định kết quả
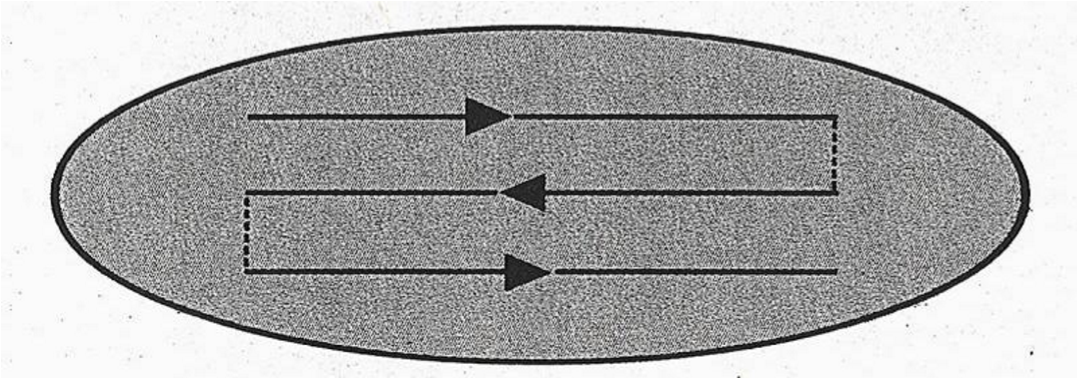
Cách soi: cần phải hệ thống và chuẩn hóa, soi dòng giữa từ trái sang phải (tương đương với 100 vi trường). Điều chỉnh ốc vi cấp cho hình ảnh rõ nét nhất, quan sát kỹ từ ngoại vi vào trung tâm vi trường để phát hiện AFB. Đọc xong vi trường thứ nhất, chuyển sang đọc các vi trường kế tiếp cho đến hết dòng. Khi cần đọc >100 vi trường, chuyển dòng kế tiếp từ phải qua trái (theo hình vẽ).
Soi tiêu bản một cách hệ thống
Nhận định kết quả:
Hình ảnh AFB từ bệnh phẩm: AFB có hình que mảnh, hơi cong, bắt màu đỏ, đứng riêng biệt hay xếp thành từng cụm, dễ nhận biết trên nền xanh. Đếm số lượng AFB và ghi kết quả theo qui định như bảng 1.
Bảng 1: Quy định ghi kết quả xét nghiệm AFB nhuộm ZN
|
Số lƯợng AFB |
Kết quả |
Phân loại |
|
0 AFB / 100 vi trường |
|
Âm tính |
|
1 – 9 AFB / 100 vi trường |
Dương tính |
Ghi số lượng AFB cụ thể |
|
10 – 99 AFB / 100 vi trường |
Dương tính |
1+ |
|
1 -10 AFB /1 vi trường (soi ít nhất 50 vi trường) |
Dương tính
|
2+ |
|
>10 AFB / 1 vi trường (soi ít nhất 20 vi trường) |
Dương tính
|
3+ |
Hình ảnh AFB từ khuẩn lạc trên nuôi cấy đặc: AFB màu đỏ xếp thành đám dày đặc hoặc thành từng búi lớn.
Hình ảnh AFB từ tuýp MGIT(+): AFB màu đỏ kết thành cuộn thừng (cord forming) hoặc thành đám hoặc rải rác riêng biệt.
Lưu trữ tiêu bản
Không ghi kết quả soi trên tiêu bản.
Các tiêu bản sau khi soi xong, làm sạch dầu soi bằng cách xếp tiêu bản vào hộp bảo quản có lót giấy mềm để thấm dầu soi chảy xuống. Hôm sau, lau phần dầu soi còn đọng lại ở cạnh tiêu bản.
Xếp các tiêu bản vào hộp đựng tiêu bản theo thứ tự trong sổ xét nghiệm để phục vụ cho công tác kiểm định tiêu bản.
Hộp tiêu bản lưu ở nơi thoáng, khô ráo và tránh ánh nắng trực tiếp.
Ghi chép và báo cáo kết quả
Kiểm tra số XN trên tiêu bản trùng với số ghi trên phiếu XN.
Ghi kết quả soi kính vào phần xét nghiệm của phiếu XN và sổ xét nghiệm.
Ghi ngày tháng làm XN và ký tên vào phiếu và sổ xét nghiệm.
Kết quả dương tính phải ghi bằng mực đỏ trong sổ xét nghiệm.
Thực hiện báo cáo tháng, báo cáo quý và báo cáo năm theo qui định của CTCLQG.
Kiểm tra chất lượng
Kiểm tra chất lượng thuốc nhuộm
Kiểm tra chất lượng thuốc nhuộm ngay sau khi pha lô mới:
Chuẩn bị sẵn lô tiêu bản từ mẫu đờm biết trước kết quả âm tính và dương tính ở mức độ 1 +.
Mỗi lô thuốc nhuộm mới pha nhuộm 3 tiêu bản dương và 3 tiêu bản âm đúng qui trình kĩ thuật.
Kết quả thuốc nhuộm đạt chất lượng: tiêu bản dương thấy AFB bắt màu đỏ trên nền xanh sáng, không thấy cặn thuốc nhuộm, tiêu bản âm không thấy AFB.
Kết quả thuốc nhuộm không đạt chất lượng: tiêu bản dương không thấy AFB hoặc AFB nhạt màu, nền xanh tối, thấy cặn thuốc nhuộm, tiêu bản âm thấy AFB.
Kiểm tra chất lượng nhuộm tiêu bản hàng ngày: nhuộm chứng dương và âm cùng mẻ nhuộm tiêu bản thông thường. Đọc kết quả chứng dương và chứng âm trước khi đọc tiêu bản của ngừơi bệnh.
Khi kết quả kiểm tra không đạt, phải xem xét lại toàn bộ quá trình từ thuốc nhuộm, tiêu bản chứng đến kỹ thuật nhuộm soi, nhuộm thêm lô tiêu bản chứng mới nếu kết quả vẫn không đạt phải hủy bỏ thuốc nhuộm.
Chỉ sử dụng và cấp phát thuốc nhuộm đã kiểm tra đảm bảo chất lượng.
Phải có sổ pha, kiểm tra, quản lý và cấp phát thuốc nhuộm.
Hạn sử dụng thuốc nhuộm 1 tháng theo qui định của CTCLQG.
Chai lọ đựng thuốc nhuộm phải được dán nhãn và hạn sử dụng, được bảo quản nơi thoáng mát, khô ráo và tránh ánh nắng mặt trời.
Kiểm tra chất lượng tiêu bản theo 6 tiêu chuẩn
Chất lượng bệnh phẩm
Sự có mặt của bạch cầu đa nhân, đại thực bào.
Chất lượng bệnh phẩm đạt yêu cầu khi soi:
Có trên 25 bạch cầu đa nhân/1VT ở độ phóng đại 100x (vật kính 10x, thị kính 10x) hay 3-4 bạch cầu đa nhân/1VT với vật kính dầu.
Hoặc có đại thực bào.
Bệnh phẩm đạt chất lượng kết quả xét nghiệm mới chính xác.
Kích thước tiêu bản
Kích thước 1x2cm, cú hình ovan nằm ở giữa lam kính
Độ mịn
Bệnh phẩm được dàn đều để đạt độ mịn cần thiết.
Tiêu bản đạt về độ mịn:
Bề mặt tiêu bản liên tục, đều đặn, không bị rỗng, bong trụi.
Soi kính: Các vi trường liên tục không có nhiều vi trường rỗng, độ sáng đều đặn.
Độ dày
Tiêu bản đạt tiêu chuẩn có độ dày khoảng 0,04 mm, khi tiêu bản khô, chưa nhuộm có thể kiểm tra bằng cách để một tờ giấy có chữ in xuống dưới tiêu bản cách 4-5 cm nếu nhìn thấy chữ mờ có thể đọc được là đạt, không đọc được chữ là dày, nhìn chữ quá rõ là mỏng.


Quá mỏng Đạt độ dày Quá dày
Nếu quá dày tiêu bản có nhiều lớp, không soi thấu, vi trường xanh tối; Nếu quá mỏng các vi trường thưa thớt, nền xanh nhạt.
Nhuộm và tẩy màu
Tiêu bản nhuộm và tẩy màu đạt: AFB bắt mầu đỏ phân biệt rõ ràng với nền màu xanh –Tiêu bản nhuộm và tẩy màu không đạt:
AFB nhạt mầu có thể do tẩy quá hoặc nhuộm chưa đủ (thời gian, sức nóng…).
Nền cũng màu đỏ do tẩy màu chưa đủ khó phân biệt rõ AFB (những tiêu bản nhìn bằng mắt thường còn màu đỏ là tẩy chưa đạt).
Nền xanh đậm, AFB tối do nhuộm nền quá lâu.
Độ sạch
Tiêu bản đạt độ sạch: Soi không thấy các cặn bẩn, cặn Fuchsin, tinh thể..
Tiêu bản không đạt độ sạch: Soi thấy các cặn bẩn, cặn Fuchsin, tinh thể…do thuốc nhuộm cú cặn hoặc do hơ quá nóng trong khi nhuộm Fuchsin.
Kiểm định tiêu bản
Thực hiện kiểm định tiêu bản theo phương pháp kiểm định theo lô (LQAS) –PXN tuyến tỉnh thực hiện kiểm định tiêu bản hàng tháng cho tuyến huyện.
PXN tuyến trung ương kiểm định cho tuyến tỉnh hàng quí hoặc kiểm tra ngẫu nhiên trong các đợt KTGS quí.
Đọc sai kết quả – hậu quả – cách phòng ngừa
Hậu quả lỗi sai dương
Người bệnh “bị” điều trị một cách không cần thiết.
Đánh giá sai kết quả, tăng tỉ lệ người bệnh lao.
Lãng phí thuốc.
Người bệnh không tin tưởng vào xét nghiệm.
Phòng ngừa lỗi sai dương
Chất lượng kính hiển vi tốt.
Sử dụng tiêu bản mới, không có vết xước.
Sử dụng que phết đờm riêng cho từng bệnh phẩm.
Hóa chất nhuộm Ziehl đạt chất lượng.
Không để dung dịch Fuchsin khô trong khi nhuộm.
Không có thức ăn hoặc chất xơ trong mẫu đờm.
Lau vật kính dầu sau mỗi lần soi tiêu bản dương.
Đối chiếu số xét nghiệm chính xác, thông tin người bệnh phù hợp.
Ghi chép và báo cáo kết quả chính xác.
Hậu quả của lỗi sai âm
Người bệnh lao không được điều trị có thể tử vong.
Người bệnh tiếp tục truyền bệnh cho những người xung quanh.
Đánh giá kết quả điều trị sai lệch.
Người bệnh không tin tưởng vào xét nghiệm.
Phòng ngừa lỗi sai âm
Chất lượng kính hiển vi tốt.
Đảm bảo đờm đạt chất lượng (ít nhất 2 ml, có nhày mủ).
Hóa chất nhuộm Ziehl đạt chất lượng.
Thực hiện đúng qui trình kĩ thuật: Chọn mảnh đờm đặc, mủ để làm tiêu bản, dàn tiêu bản đạt độ dày, cố định tiêu bản tốt, nhuộm fuchsin đủ độ nóng và đủ thời gian.
Phải đọc đủ 100 vi trường.
Đối chiếu số xét nghiệm chính xác, thông tin người bệnh phù hợp.
Ghi chép và báo cáo kết quả chính xác.
Các vấn đề phát sinh khi soi kính và cách giải quyết
|
Vấn đề |
Nguyên nhân |
Giải pháp |
|
Độ sáng của vi trường không đạt |
Tụ quang để quá thấp Tụ quang bị đóng |
Nâng tụ quang lên Mở chắn sáng ra |
|
Bóng tối trong vi trường chuyển động khi xoay thị kính |
Thị kính bị bẩn Bề mặt của thị kính bị xước |
Lau sạch thị kính Thay thị kính mới |
|
Hình ảnh không rõ khi soi vật kính dầu |
Mặt tiêu bản bị lật ngược Có bọt khí trong dầu
Chất lượng dầu soi kém Vật kính bị bẩn |
Lật tiêu bản lên Di chuyển vật kính x 100 nhanh từ bên này sang bên kia Chỉ sử dụng dầu soi chất lượng tốt. Lau sạch vật kính |
|
Hình ảnh không rõ khi soi vật kính độ phóng đại nhỏ |
Có dầu ở vật kính Có lớp bụi trên bề mặt của vật kính Vật kính có thể bị vỡ |
Lau sạch vật kính
Thay vật kính mới |
Bảo quản kính hiển vi
Đặt KHV ở nơi vững chắc, khô ráo, không có bụi, tránh ánh nắng trực tiếp. Độ ẩm cao có thể làm mốc bộ phận quang học (vật kính, thị kính, tụ quang..) và bộ phận cơ học bị han rỉ.
Tránh va chạm mạnh làm hỏng kính hiển vi, không để vật kính chạm vào tiêu bản
Chỉ sử dụng ốc vi cấp khi soi vật kính dầu
Lau bộ phận quang học bằng giấy lau chuyên dụng, lau sạch dầu soi trên bề mặt vật kính dầu ngay sau khi sử dụng
Vệ sinh kính sau mỗi ngày sử dụng.
Khi không sử dụng để kính ở trạng thái “nghỉ”: tắt nguồn điện, xoay vật kính ra khỏi trục quang học, hạ tụ quang, phủ kính tránh bụi.
Nếu có điều kiện bảo quản KHV trong tủ bảo quản kính chuyên dụng.
Nếu phát hiện kính bị hỏng tuyệt đối không được tự ý tháo ra sửa chữa phải báo người có trách nhiệm giải quyết.
Thực hành an toàn pxn
Sắp xếp bố trí phòng xét nghiệm nhuộm soi trực tiếp hợp lý.
Sử dụng tủ ATSH theo qui định, đảm bảo luồng khí lưu thông trong tủ không bị ảnh hưởng bởi các vật liệu che lấp. Kết thúc công việc, lau tủ bằng cồn 700.
Các thao tác kỹ thuật phải nhẹ nhàng tránh tạo hạt mù: mở nắp lọ đờm, lấy mảnh đờm, dàn tiêu bản., cố định khi tiêu bản chưa khô hoàn toàn.
Khử nhiễm vật liệu lây nhiễm theo qui định.