XÉT NGHIỆM GEN BẰNG KỸ THUẬT FISH
(Fluorescence in situ hybridization)
GENE ANALYSIS BY FLUORESCENCE IN SITU HYBRIDIZATION
NGUYÊN LÝ
Kỹ thuật FISH được tiến hành dựa trên cơ sở của phản ứng lai ghép. Trong tế bào, phân tử ADN tồn tại dưới dạng phân tử kép gồm 2 chuỗi đơn gắn kết bổ sung với nhau thông qua liên kết hydro. Liên kết hydro là liên kết yếu nên dễ dàng bị đứt gãy dưới tác động của nhiệt độ hay pH cao. Lúc đó, phân tử ADN bị tách thành 2 chuỗi đơn. Tuy nhiên khi nhiệt độ hay pH giảm, các chuỗi đơn lại ghép nhau theo nguyên tắc bổ sung.
Dựa trên đặc tính này, kỹ thuật FISH sử dụng các probe là đoạn ADN đặc hiệu có gắn huỳnh quang để lai ghép với các đoạn ADN tương đồng trên nhiễm sắc thể. Từ đó, chúng ta có thể phát hiện bất thường nhiễm sắc thể một cách chính xác và nhanh chóng.
CHỈ ĐỊNH
Xét nghiệm này được chỉ định ở giai đoạn chẩn đoán bệnh hoặc giai đoạn theo dõi điều trị bệnh cho tất cả người bệnh mắc bệnh máu ác tính liên quan đến các bất thường nhiễm sắc thể đặc hiệu.
CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
CHUẨN BỊ
Người thực hiện
Kỹ thuật viên xét nghiệm Di truyền – Sinh học phân tử đã được đào tạo.
Phương tiện, hóa chất
Phương tiện
Thiết bị: bể ổn nhiệt, máy lai, máy ly tâm, máy trộn mẫu, và kính hiển vi huỳnh quang;
Dụng cụ: kẹp kim loại, 10 cóng Coplin, nhiệt kế, coverslip 22×22, pipetman 100 μl, 10 μl, xi măng cao su, ống đong, giấy thấm.
Hóa chất
Probe phù hợp tương ứng với đoạn gen cần phát hiện;
Dung dịch 10% formamide: 5 ml formamide + 30 ml H2O + 15 ml 20X SSC;
Dung dịch 2X SSC;
Dung dịch rửa 0,1% NP40: 2X SSC + 0,1% NP40; – Dung dịch rửa 0,3% NP – 40: 0,4X SSC + 0,3% NP40; – Cồn 70o, 85o, 100o.
Bệnh phẩm
2ml máu ngoại vi hoặc dịch hút tủy xương được đựng trong bơm tiêm có tráng chất chống đông heparin 5.000 đơn vị/ml.
CÁC BƯỚC TIẾN HÀNH
Lấy bệnh phẩm
2ml máu ngoại vi hoặc dịch hút tủy xương được đựng trong bơm tiêm có tráng chất chống đông heparin 5.000 đơn vị/ml. Máu hoặc tủy xương được nuôi cấy trong 24 giờ.
Sau 24 giờ, tiến hành thu hoạch huyền dịch tế bào.
Tiến hành kỹ thuật
Chuẩn bị tiêu bản
Nếu sử dụng kỹ thuật FISH trên các cụm kỳ giữa (metaphase) thì cần nuôi cấy và chuẩn bị tiêu bản như kỹ thuật xét nghiệm công thức nhiễm sắc thể.
Trong trường hợp sử dụng trên nhân tế bào thì có thể bỏ qua bước nuôi cấy.
Nhỏ huyền dịch tế bào lên tiêu bản.
Yêu cầu: hình thái nhân rõ ràng, tế bào dàn đều, các cụm nhiễm sắc thể kỳ giữa to và bung đẹp.
Dùng bút kim cương đánh dấu trên bề mặt tiêu bản những vùng đáp ứng được yêu cầu trên.
Rửa tiêu bản
Ngâm tiêu bản vào dung dịch 2X SSC ở 37±1oC trong 15 phút;
Rửa tiêu bản qua cóng chứa dung dịch 2X SSC ở nhiệt độ phòng trong 5 phút;
Chuyển tiêu bản qua cóng chứa dung dịch formaldehyde 10% ở nhiệt độ phòng trong 5 phút;
Rửa tiêu bản qua cóng chứa dung dịch 2X SSC ở nhiệt độ phòng trong 5 phút;
Chuyển tiêu bản qua cóng chứa cồn 70o trong 1 phút;
Chuyển tiêu bản qua cóng chứa cồn 85o trong 1 phút;
Chuyển tiêu bản qua cóng chứa cồn 100o trong 1 phút;
Để tiêu bản khô hoàn toàn ở nhiệt độ phòng.
Chuẩn bị probe
Trộn đều các dung dịch sau trong 1 ống PCR (1 μl probe + 7 μl LSI + 2 μl dH2O) /1tiêu bản.
Ly tâm nhẹ.
Lai
Nhỏ 10 μl dung dịch probe vào khu vực đánh dấu trên tiêu bản sau đó che phủ bằng coverslip.
Yêu cầu: dung dịch probe thấm đều trên tiêu bản, không có bọt khí.
Phủ kín coverslip bằng cao su xi măng.
Đặt tiêu bản vào máy lai, chọn chương trình biến tính ở 73oC trong 3 phút và ủ 37oC trong 16 – 20 giờ.
Rửa sau khi lai
Gỡ bỏ xi măng cao su và coverslip;
Ngâm và lắc mạnh tiêu bản lần lượt qua các cóng Coplin sau.
+ Dung dịch (0,4X SSC/ 0.3% NP40): 2 phút, 73oC;
+ Dung dịch (2X SSC/ 0,1% NP40): 1phút, nhiệt độ phòng.
Làm khô tiêu bản.
Chống mất màu probe
Nhỏ 10 – 20 μl dung dịch DAPI/antifade (1: 20) lên bề mặt tiêu bản để chống mất màu probe và nhuộm nhân tế bào.
Phủ kín tiêu bản bằng coverslip.
Yêu cầu: dung dịch dàn đều trên tiêu bản và không có bọt khí
NHẬN ĐỊNH KẾT QUẢ
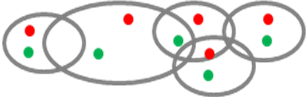
Quan sát dưới kính hiển vi huỳnh quang, với kỹ thuật dual colour FISH, chúng ta sẽ thấy 3 màu.
+ Màu xanh da trời đậm: màu nhân tế bào
+ Màu xanh lá cây: màu của probe
+ Màu đỏ: màu của probe
Nguyên tắc phân tích kết quả được liệt kê trong bảng sau:
|
|
Hướng dẫn đọc kết quả trong Dual colour FISH |
|
|
1 |
|
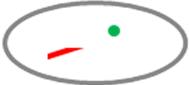
Không đếm. Hai nhân tế bào xếp chồng lên nhau. |
|
2 |
|
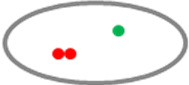
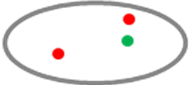
Một tín hiệu đỏ và một tín hiệu xanh. Tín hiệu đỏ bị khuyếch tán . |
|
3 |
|
Không đếm. Các nhân tế bào quá gần nhau, không xác định được ranh giới. |
|
4 |
|
Một tín hiệu đỏ và một tín hiệu xanh. Tín hiệu đỏ bị phân hóa. |
|
5 |
|
Một tín hiệu đỏ và hai tín hiệu xanh. Một tín hiệu xanh và một tín hiệu đỏ bị phân hóa. |
|
6 |
|
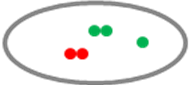
Hai tín hiệu đỏ và một tín hiệu xanh. |
|
7 |
|
Ba tín hiệu đỏ và một tín hiệu xanh. |
|
8 |
|
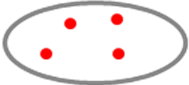
Bốn tín hiệu đỏ. |
NHỮNG SAI SÓT VÀ XỬ TRÍ
|
Vấn đề |
Nguyên nhân |
Cách khắc phục |
|
Không có tín hiệu hoặc tín hiệu yếu |
Kính hiển vi không thích hợp hoặc có sự cố |
Kiểm tra lại kính và các vật kính |
|
Probe không biến tính hoàn toàn |
Kiểm tra nhiệt độ bể ấm có đúng (73+/ – 1) oC |
|
|
Điều kiện lai không thích hợp |
Kiểm tra nhiệt độ tủ ấm có đúng 37oC hay không. Tăng thời gian lai lên 1giờ. |
|
|
Điều kiện rửa không thích hợp |
Kiểm tra nhiệt độ bể ấm có đúng 73oC Kiểm tra các thành phần dung dịch rửa (pH…) |
|
|
Xuất hiện bọt khí giữa tiêu bản và coverslip |
Loại bỏ bọt khí |
|
|
Bảo quản probe không đúng cách |
Bảo quản probe ở – 20oC, không ánh sang |
|
|
Tín hiệu đặc trưng yếu |
Điều kiện lai không thích hợp |
Kiểm tra nhiệt đổ tủ ấm có đúng 37oC |
|
Nhiệt độ dung dịch rửa quá thấp |
Duy trì nhiệt độ dung dịch rửa ở (73+/ – 1)oC |
|
|
Nền quá bẩn |
Tiêu bản làm già quá mức cho phép hoặc chứa nhiều tế bào chất |
Tăng thời gian biến tính của tiêu bản lên 10 phút |
|
Tiêu bản không sạch hoặc nhiều mảnh vỡ tế bào trên tiêu bản |
Chuẩn bị lại tiêu bản |
|
|
Các mảnh ADN không sạch |
Thực hiện lại bước rửa tiêu bản sau khi lai với formamide |
|
|
Dung dịch rửa sai thành phần và nhiệt độ |
Kiểm tra lại dung dịch rửa |
|
|
Hình thái các nhiễm sắc thể bị co cụm, biến dạng |
Để tiêu bản bị quá khô |
Tăng độ ẩm hoặc tăng nhiệt độ bể ấm trong quá trình tiến hành thí nghiệm |
|
Tiêu bản chưa được sấy khô trước khi biến tính |
Chuẩn bị lại xét nghiệm với tiêu bản mới Làm già tiêu bản trước khi tiến hành FISH 24 giờ |
|
|
Tiêu bản chưa khô sau biến tính |
Sấy tiêu bản ở nhiệt độ 45 oC trong 10 – 15 phút sau biến tính |
|
|
|
Nhiệt độ bể ấm quá cao |
Kiểm tra nhiệt độ bể ấm có đúng (73+/ – 1) oC |
|
|
Thời gian biến tính quá lâu |
Giảm thời gian biến tính 1 phút |
|
Tín hiệu quá mạnh |
Nồng độ probe sử dụng quá cao so với dải màu của KHV |
Cố gắng chỉnh kính thay thế bằng các dải màu trung lập |
TÀI LIỆU THAM KHẢO
Tài liệu hướng dẫn sử dụng của công ty Vysis.
Lynda J. Cambell, (2011), “Cancer cytogenetic”, Human Press.