Đại cương
Năm 1898, nữ bác học Marie Curie phát hiện ra nguyên tố Radium-226 (226Ra), sau đó không lâu đồng vị phóng xạ (ĐVPX) đã được ứng dụng trong điều trị bệnh. Cũng bắt đầu từ đấy đã ra đời lĩnh vực sinh học phóng xạ và ung thư học phóng xạ. 30 năm sau chiến tranh thế giới thứ II là thời kỳ nhiều ĐVPX được phát minh và ứng dụng trong y học. Ngày nay, ĐVPX được ứng dụng rộng rãi trong điều trị bệnh. YHHN ứng dụng tác dụng sinh học của bức xạ ion hóa lên các tế bào, các mô bị bệnh, điều đó đã làm cho YHHN trở thành một chuyên ngành trong lâm sàng.
So với chẩn đoán, điều trị phải dùng liều lớn hơn, do đó tác động của phóng xạ lên mô lành cũng lớn hơn nhiều. Đó là một trong những khó khăn và hạn chế của điều trị bằng phóng xạ, tuy nhiên, trong nhiều trường hợp thì đây là phương pháp điều trị hữu hiệu, nhanh gọn, đơn giản, an toàn và ưu việt hơn so với các phương pháp điều trị khác.
Các phương thức điều trị bằng bức xạ ion hóa (Radiotherapy) của các ĐVPX:
Xạ trị chuyển hoá ( Metabolictherapy).
Xạ trị áp sát (Brachytherapy).
Xạ trị chiếu ngoài (Teletherapy).
Các phương thức ứng dụng đvpx trong điều trị
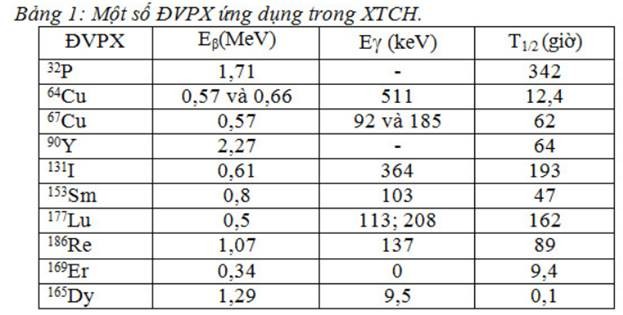
Một số đvpx dùng trong xạ trị chuyển hoá:
Xạ trị chuyển hoá (XTCH): là sử dụng ĐVPX giới dạng dược chất phóng xạ (DCPX), đưa đến cơ quan đích theo đường uống hoặc đường tiêm thông qua chuyển hóa của cơ thể.
Với cơ sở trên thì bất cứ cơ quan, tổ chức nào của cơ thể có hấp thu một loại ĐVPX bất kỳ nào đó, thì ta có thể sử dụng nó để điều trị.
Ví dụ dùng iod-131 để điều trị một số bệnh tuyến giáp. Tuy nhiên số cơ quan, tổ chức trong cơ thể người hấp thu đặc hiệu một nguyên tố hoá học nào đó là rất ít, vì vậy người ta phải sử dụng chất mang để đưa ĐVPX đến được mô đích cần điều trị?
Trong XTCH, ĐVPX sử dụng lý tưởng nhất là đồng vị chỉ phát bức xạ beta đơn thuần, mà không có tia gamma kèm theo. Tia beta đi được trong mô khoảng 1-2 mm, nó truyền hầu hết năng lượng (gần 95%) cho các tế bào trên quãng đường đi, cho nên nó chỉ tác động chủ yếu ở mô đích mà hầu như không tác động đến mô lành lân cận vì thế nó rất thích hợp cho điều trị.
Nhiều ĐVPX được dùng dưới dạng muối của chúng, chẳng hạn như 131I sodium iodide, 89Sr strontium chloride. Một số ĐVPX được gắn với chất mang ổn định như diphosphonate ethylene diamine tetramethylene phosphonate (EDTMP) – samarium -153.
Ngoài ra ĐVPX có thể gắn với kháng thể như 131I –tositumomab, điều trị bằng phương pháp này người ta gọi là xạ trị miễn dịch.
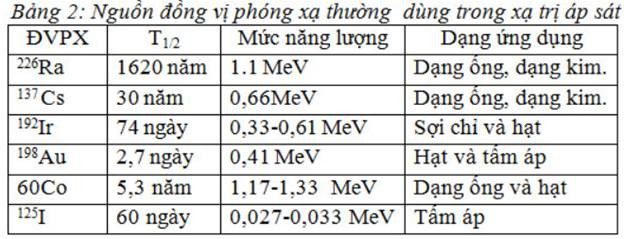
Một số đvpx dùng trong xạ trị áp sát:
Còn gọi là: xạ trị trong, xạ trị tiếp cận, Curie liệu pháp để ghi nhớ công ơn bác học Marie Curie, người đầu tiên chủ trương sử dụng phương pháp này.
Nguyên tắc chung của xạ trị áp sát là: “Cường độ phóng xạ tỷ lệ nghịch với bình phương khoảng cách”
Với nguyên tắc này, nếu nguồn phóng xạ càng được đưa vào sát tổn thương, sát các tế bào ung thư, thì liều chiếu xạ sẽ rất cao tại chỗ ung thư càng cao, còn các mô lành xung quanh chỉ phải nhận liều xạ rất thấp.
Các vị trí được xạ trị áp sát bao gồm tất cả các vị trí trong cơ thể mà các kỹ thuật hiện nay có thể đưa nguồn phóng xạ tới được các vị trí tổn thương.
Để đưa nguồn xạ tới vị trí cần chiếu người ta có thể sử dụng một trong các kỹ thuật sau :
Qua một hệ thống ống dẫn nguồn (ống áp – applicator) dùng trong XT nạp nguồn sau để điều trị ung thư các vị trí ở hốc tự nhiên của cơ thể như trực tràng, cổ tử cung, amidal, vòm họng, thực quản… .
Dùng kim PX cắm trực tiếp vào khối u như : lưỡi, amydal, cổ tử cung …
Dùng tấm áp 32P để điều trị cho các loại u ngoài da như u máu nông.
Kỹ thuật cấy hạt xạ (Sed) vào trong lòng khối u…
Xạ trị chiếu ngoài:
Còn gọi là xạ trị từ xa, hoặc Cobalt liệu pháp vì đây là phưong pháp được sử dụng đầu tiên và cho đến nay nó vẫn đang được dùng phổ biến trên thế giới đặc biệt là ở các nước đang phát triển, mặc dù hiện nay dã có rất nhiều thế hệ máy Gia tốc ưu việt ra đời, nhưng đòi hỏi sự đầu tư phải rất lớn .
Một số ứng dụng đvpx trong điều trị
131i ứng dụng trong điều trị một số bệnh lý tuyến giáp
131I có T1/2 = 8ngày và phát ra hai loại bức xạ:
Beta (β) có năng lượng 0,61MeV, quãng đường đi 2-3mm
Gamma có năng lượng 364keV, quãng đường đi dài (khả năng đam xuyên lớn) do đó cần có biện pháp bảo đảm an toàn trong điều trị.
Nếu dùng 131I để điều trị một số bệnh ác tính khác không phải tuyến giáp cần “phong bế” tuyến giáp bằng lugol iodine hoặc dung dịch potassiumiodide nồng độ cao.
NaI trong dung dịch đệm NaHCO3/Na2CO3 không chứa chất mang.
Iốt được tập trung ở tuyến giáp nhờ cơ chế vận chuyển tích cực, nồng độ cao hơn trong máu 250-10000 lần, do đó dùng để điều trị bệnh lý tuyến giáp như Basedow, UTTG thể biệt hóa sau phẫu thuật, như là một “phẫu thuật siêu chọn lọc” hay là một liệu pháp trúng đích.
Điều trị bệnh đa hồng cầu nguyên phát (bệnh vaquez), bệnh bạch cầu mạn tính bằng 32p
Phospho là thành phần cần thiết cho tổng hợp các axit nhân nên 32P thâm nhập nhiều vào nhân tế bào bệnh, ức chế phân bào, dựa vào sự nhạy cảm phóng xạ của tế bào bệnh cao hơn tế bào máu bình thường. Xếp theo thứ tự nhạy cảm phóng xạ: lympho bào trong bệnh bạch cầu > bạch cầu hạt trong bệnh bạch cầu> hồng cầu trong bệnh đa hồng cầu > lympho bào bình thường > hồng cầu bình thường.
Bệnh đa hồng cầu là một bệnh hiếm gặp. Những chỉ tiêu chính để chẩn đoán là: thể tích hồng cầu tăng (> 36ml/kg ở nam và > 32 ml/kg ở nữ), bão hoà ôxy động mạch (>92%), lách to. Nếu chỉ có hai triệu chứng đầu tiên thì phải tính đến hai trong số các triệu chứng phụ: tiểu cầu > 400 G/l, bạch cầu > 12G/l, tăng phosphatase kiềm của lymphocyte và B12 huyết thanh >900 pg/ml.
Có nhiều phương pháp điều trị. Trong trường hợp cấp tính, để tránh tắc mạch người ta có thể chích huyết, phương pháp điều trị thông thường là dùng hóa chất để làm giảm số lượng hồng cầu, giảm sự sinh sản hồng cầu bằng hóa chất busulphan hoặc hydroxyurea (ức chế men ribonucleotit).
32P được dùng để điều trị đa hồng cầu từ những năm 1930.
32P phát bức xạ beta đơn thuần, năng lượng Eb = 1,71MeV
Chu kỳ bán hủy T1/2 = 14,3 ngày
Dạng sử dụng: dung dịch muối phosphat (Na2HPO4), tiêm tĩnh mạch hoặc uống ( liều dùng đường uống chỉ đạt khoảng 75% của đường tiêm).
Thời gian tồn tại của 32P trong tuỷ xương từ 7-9 ngày.
Thường được ưu tiên chỉ định cho những bệnh nhân trên 40 tuổi.
Liều dùng:
Điều trị bệnh đa hồng cầu: 2,3 mCi/m2 diện tích da cơ thể. Có tác giả cho rằng liều > 2,7 mCi/m2 thì thời gian ổn định bệnh kéo dài hơn.
Nếu điều trị lại lần 2, lần 3, thì khoảng cách giữa các lần tối thiểu là 3 tháng với liều cao hơn lần trước đó 25%. Tổng liều không vượt quá 7 mCi. Sau 2 năm có thể điều trị lại một đợt khác.
Điều trị bệnh leukemia: Tổng liều 1-2,5 mCi, tiêm làm nhiều lần. Nếu dùng đường uống, bệnh nhân cần nhịn ăn trước đó vài giờ
Điều trị u máu bằng tấm áp 32p
U máu (dị dạng mạch máu bẩm sinh), thường gặp ở trẻ em, xuất hiện ngay khi sinh hoặc trong vài tuần, vài tháng sau sinh, u thường phát triển nhanh từ tháng thứ 6-10 và có thể bắt đầu quá trình thoái triển tự nhiên sau 1 năm.
Về hình thái, u máu được chia làm 3 loại:
U máu mao mạch: xuất hiện như một vết son hay một mảng màu rượu chát trên cùng mặt phẳng với da bình thường, ấn xuống không mất màu. U thườn lớn dần theo cơ thể trẻ em, phát triển nhanh hay chậm tuỳ theo từng vị trí. Chẳng hạn, những u máu ở vùng gần niêm mạc như môi, mắt, vùng cổ, tuyến nước bọt sẽ phát triển nhanh hơn những u ở bề mặt da, tứ chi, ngực, bụng…
U máu dạng hang: thường lớn, nhô khỏi mặt da. Trong đa số trường hợp, u lan rộng và xâm lấn mô dưới da, cơ và có thể làm biến dạng cơ thể. Loại u này có thể xuất hiện cả ở các cơ quan nội tạng hay trong não.
U máu hỗn hợp: thường gồm cả thể nang và mạch bạch huyết, gặp nhiều nhất ở tuyến mang tai, thương tổn nằm cả trong và dưới da.
Trước đây để điều trị u máu người ta thường sử dụng các phương pháp tiêm xơ, phẫu thuật… Tuy nhiên, những biện pháp này gây đau đớn và để lại sẹo xấu.
Một số phương pháp mới được áp dụng trong điều trị u máu như dùng tia laser hay kháng thể Interpheron Alpha đều mang lại hiệu quả nhất định.
Tấm áp 32P do Viện nghiên cứu hạt nhân Đà Lạt sản suất, hoạt độ riêng 15mCi/cm2 được sử dụng điều trị u máu phẳng ở trẻ em. Liều điều trị 250 – 300 cGy/lần x 5 lần/tuần, tổng liều 3000 cGy. Phương pháp có ưu điểm đơn giản, hiệu quả, không đau đớn, an toàn, tiết kiệm.
Điều trị giảm đau do ung thư di căn xương
Hơn 2/3 số BN ung thư có đau vừa đến đau nặng, đặc biệt trong UT di căn xương. BN ung thư phải chịu đựng đau đớn dai dẳng, kéo dài, tăng dần nếu không được điều trị.
Đau trong ung thư di căn xương nguyên nhân có thể do:
Làm căng màng xương tại chỗ.
Chèn ép, xâm lấn, của khối u ra các tổ chức xung quanh.
Phá huỷ xương, gãy xương bệnh lý.
Bởi các chất trung gian hoá học như: Prostaglandin, Kinin, Bradykinin…, và các yếu tố hoại tử khối u…
Các phương pháp điều trị giảm đau
Phẫu thuật.
Hoá trị.
Dùng thuốc chống đau theo ba bậc của WHO:
Bâc 1: Giảm đau không có thuốc phiện và +/- chất bổ trợ.
Bậc 2: Giảm đau có opiod nhẹ, +/- chất bổ trợ.
Bậc 3: Giảm đau có opiod mạnh, liều lớn, +/- chất bổ trợ.
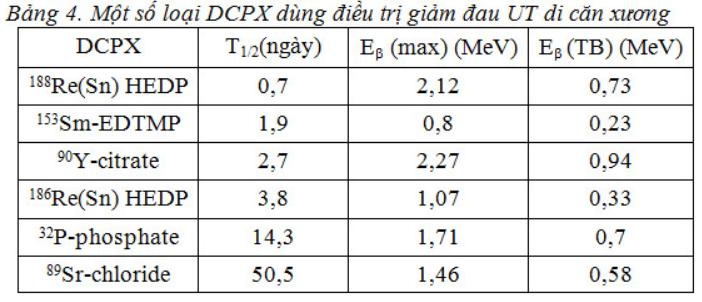
Xạ trị (chiếu ngoài và chiếu trong): một biện pháp rất hiệu quả, không cần dùng các chất giảm đau loại thuốc phiện là dùng các DCPX. Những DCPX đã được thử nghiệm trên người là: 32P, 89Sr, 153Sm, 186Re và 188Re.
Nguyên lý điều trị giảm đau bằng DCPX
Dựa vào các đặc tính chuyển hoá đặc hiệu của tổ chức xương đối với canxi và phospho. Tổ chức xương bị xâm lấn và phá huỷ gây tổn thương dẫn đến thay đổi và tăng nhanh quá trình chuyển hoá, tân mạch phát triển, tuần hoàn tăng lên, phân bào tăng mạnh tại khối u. Nhu cầu cung cấp các chất như canxi, phospho tăng mạnh. Do đó nếu đưa 32P hay đồng vị giống với canxi vào, chúng sẽ tập trung cao ở xương, nhất là những nơi có tổn thương (tăng sinh mạch máu, tăng sinh tế bào).
Cơ chế giảm đau:
Giảm chèn ép cơ học do giảm tế bào ung thư.
Giảm tác nhân gây đau hoá học.
Điều hoà đáp ứng sinh học (biomodulation): sự thay đổi nhạy cảm của cơ thể nơi tổn thương bị chiếu xạ, diễn ra nhanh ngay sau chiếu xạ 6-8 giờ, khi mà số lượng tế bào ung thư chưa giảm.
Chỉ định điều trị giảm đau di căn xương bằng DCPX
Xạ hình xương dương tính tương ứng với vị trí đau.
Kết quả xét nghiệm máu: bạch cầu > 3,5 G/L; tiểu cầu >100 G/L; bạch cầu hạt > 1500, Creatinine huyết thanh
Bệnh nhân không điều trị chiếu ngoài ít nhất 6 tuần trước đó, không dùng hóa chất gây ức chế tủy xương trước đó 6-8 tuần, không điều trị bằng thuốc khác gây ức chế hấp thu phosphat trong 6 tuần trước đó.
Bệnh nhân phải được giải thích đầy đủ bằng văn bản về quy trình điều trị, tác dụng của thuốc DCPX.
Chống chỉ định: Không điều trị bằng DCPX cho bệnh nhân đau có dấu hiệu chèn ép tuỷ sống, có di căn ở hộp sọ, có bằng chứng gãy xương bệnh lý.
32P – Photpho-32
Friedell (1950) là người đầu tiên dùng 32P điều trị di căn ung thư xương. Năm 1952 và 1958, J.R. Maxfield đã công bố những nghiên cứu về vấn đề này. 32P là chất phát ra beta đơn thuần, có T1/2 = 14,3 ngày, năng lượng cực đại của bức xạ beta Eb = 1,71 MeV, quãng đường đi trong mô mềm là 8mm và trong xương là 3mm. Cơ thể người lớn có chứa 700 đến 800g phosphate, 85% ở trong bộ xương, vì vậy sau khi đưa vào, 32P sẽ tiếp cận được các ổ di căn.
Sau khi vào cơ thể, 32P vào xương, gan và 5%-10% 32P vào đường tĩnh mạch sẽ được thải qua thận trong 24giờ đầu, 20% đến 50% thải ra trong vòng 1 tuần và thải ra theo phân không đến 2%. Friedell cho rằng: khoảng 1/3 32P tồn lưu ở trong xương cho đến khi phân rã hoàn toàn.
Liều điều trị: 5-10 mCi tiêm tĩnh mạch, hoặc 10-12 mCi dùng theo đường uống, đáp ứng tốt: 50%, vừa phải 30%. Đáp ứng điều trị trong khoảng 5-14 ngày, duy trì hiệu lực 2-4 tháng.
Vì 32P tập trung không chỉ ở xương mà còn có thể vào tủy xương, nên có thể làm giảm các dòng máu, giảm nhiều nhất ở tuần thứ tư, thứ năm và hồi phục ở tuần thứ sáu, thứ bảy. Mặc dù vậy, trong y văn thế giới cho đến nay mới chỉ thấy một trường hợp suy tủy dẫn đến tử vong có liên quan đến 32P. Có ý kiến cho rằng 32P có thể làm phát sinh leukemia trong vòng 6 -10 năm, nhưng điều đó không có ý nghĩa vì những người có di căn UT ít khi sống thêm quá 2 năm.
89Sr – Strontium-89:
Strontium (89SrCl2) có đặc tính sinh học giống canxi, do đó tập trung cao ở xương theo chuyển hoá chung của cơ thể một cách tự nhiên. T1/2 = 50,5 ngày. Phân rã beta có năng lượng Emax = 1,46MeV.
Năm 1976, Frusian công bố nghiên cứu về điều trị giảm đau di căn ung thư tuyến tiền liệt bằng 89Sr. Robinson ở Trung tâm Y học trường Đại học tổng hợp Kansas đã phát triển hướng nghiên cứu này. Từ năm 1977 đến 1994, tại đây đã điều trị 622 bệnh nhân ung thư di căn bằng 89Sr, trong đó có ung thư vú, tuyến tiền liệt, phổi, thận và sarcoma xương. Phân tích sâu cho thấy nếu di căn vào xương không nhiều thì 20% liều đưa vào còn tích đọng đến 90 ngày, nếu di căn vào bộ xương nhiều thì có thể 88% liều đưa vào vẫn tích đọng trong xương tới 90 ngày. Với xương bình thường, 89Sr sẽ thải ra với T1/2 =14 ngày, 89Sr đọng ở ổ di căn lâu dài, không thải ra.
89Sr được tiêm tĩnh mạch chậm, vào khoảng 2 phút. Tiêm nhanh sẽ có hiện tượng nóng bừng mặt như khi tiêm calcium. Khoảng 2% bệnh nhân có hiện tượng đau trội lên vào ngày thứ tư sau đó mới giảm dần. Hiệu quả giảm đau đạt được tối ưu ở cuối tuần thứ nhất hoặc tuần thứ hai. Nếu đến tuần thứ ba vẫn không giảm đau là liệu pháp không có hiệu quả. 80% giảm đau rõ, khoảng 20% không kết quả. Trong số giảm đau có gần 10% giảm rất nhiều, bệnh nhân vận động thoải mái, cuộc sống được cải thiện rõ rệt.
Từ tuần thứ 3 trở đi tiểu cầu có xu hướng giảm, giảm nhiều nhất ở khoảng tuần thứ 9, sau đó hồi phục nhưng đến tuần thứ 12 chưa về được mức ban đầu. Số lượng bạch cầu cũng giảm nhiều nhất ở tuần lễ thứ 9.
89Sr là DCPX có hiệu lực và an toàn trong điều trị. Với thời gian bán huỷ dài (50,5 ngày) 89Sr thuận tiện cho người sử dụng. Liều dùng: từ 40mCi/kg đến 60mCi/kg, trung bình là 4 mCi/bệnh nhân đã đạt hiệu quả. Cần xét nghiệm máu trước và sau điều trị, nhất là tiểu cầu. Những trường hợp tạo cốt và multiple myeloma đều có đáp ứng tốt với 89Sr.
153Sm – Samarium-153:
153Sm có thời gian bán huỷ ngắn: 46,3 giờ. Khi phân rã, 153Sm phát bức xạ beta và gamma. Bức xạ beta có nhiều mức năng lượng khác nhau: 810 keV (20%), 710 keV (50%), 640 keV (30%) thâm nhập vào mô một quãng tương đối ngắn (0,83 mm trong nước). Bức xạ gamma có năng lượng là 103 keV (29,8%) cho phép ghi hình được. 153Sm sẽ được gắn với ethylene diamine tetramethylene phosphonate (EDTMP), tập trung ở tổn thương cao hơn mô xương lành theo tỷ số 4:1. 153Sm-EDTMP tồn tại trong xương khoảng 42 giờ, liều hấp thu ở xương khoảng 20-32 rad/mCi, với tủy xương khoảng 4,6 – 7,5 rad/mCi.
Liều dùng 1mCi/kg, cao nhất là 2,5 mCi/kg, nếu dùng liều cao hơn nữa sẽ ức chế mạnh tủy xương. Khi dùng 153Sm, bạch cầu xuống thấp nhất vào tuần thứ 3 và tiểu cầu thấp nhất vào tuần thứ 3 hoặc thứ 4. Chỉ 87% hồi phục được bạch cầu và tiểu cầu, số còn lại không hồi phục được vì ảnh hưởng tới tủy xương. Tác dụng giảm đau đạt khoảng 76%, tác dụng rõ sau 1-2 tuần, có khoảng 12% đau trội lên sau điều trị rồi mới thuyên giảm. Giảm đau duy trì được 2-3 tháng. Dùng liều thấp (1mCi/kg) kém hiệu quả hơn dùng liều cao (2,5 mCi/kg).
186Re – Rhenium-186
186Re phát ra bức xạ beta và gamma. Beta có năng lượng tối đa 1,07 MeV và gamma có năng lượng 137 keV (9%). Bức xạ beta đi được 0,5mm trong xương đặc và 1mm trong mô mềm.
Thời gian bán huỷ của 186Re là 90,6 giờ, dài gần gấp hai lần 153Sm. 186Re cần phải gắn với hydroxyethylene diphosphonic acid (HEDP) mới có hiệu lực. Thời gian bắt đầu giảm đau từ 1- 3 tuần và tác dụng kéo dài trung bình 7 tuần. 3-5 tuần sau khi tiêm 186Re có hiện tượng giảm bạch cầu, tiểu cầu và đến tuần thứ 8 trở về mức ban đầu.
Tóm lại, DCPX 32P, 89Sr, 153Sm-lexidronam, 86Re đều được ứng dụng điều trị giảm đau ung thư di căn xương đạt hiệu quả giảm đau 60-80%. Có thể có bệnh nhân không hết đau hoàn toàn nhưng chất lượng cuộc sống của họ cũng được cảI thiện một phần. Lưu ý là ở một số bệnh nhân có thể triệu chứng đau trội lên sau điều trị sau đó mới giảm dần và hiệu quả giảm đau đạt tối ưu ở cuối tuần thứ nhất đến tuần thứ hai
Có thể điều trị lặp lại sau 12 tuần hoặc chậm hơn. Đáp ứng giảm đau của điều trị lại khoảng 50%.
Một số ứng dụng khác
Điều trị bệnh ung thư gan nguyên phát
Một số phương pháp, điều trị ung thư gan nguyên phát cụ thể là:
Phẫu thuật cắt khối u gan hoặc để thắt động mạch gan, tuy nhiên phẫu thuật chỉ có khả năng thực hiện trên một số ít bệnh nhân (khoảng 10%), vì hầu hết bệnh nhân phát hiện bệnh quá muộn và nặng nên chỉ định mổ rất khó khăn.
Ghép gan
Thuyên tắc hoá – dầu động mạch gan (TACE)
Tiêm ethanol, acidacetic vào khối u gan
Nhiệt trị bằng sóng radio, vi sóng
Nhiệt lạnh
Xạ phẫu bằng cyberknife
Liệu pháp gene
Hoá trị liệu
Điều trị bằng DCPX
Thay vì tiêm các chất gây tắc mạch hoặc hóa chất tại chỗ, người ta tiêm DCPX qua ống thông vào động mạch gan. Các DCPX này đến được tổ chức ung thư, lưu lại đó nhiều mà thoát ra rất ít. Bức xạ beta sẽ có tác dụng tiêu diệt các tế bào ung thư.
Chỉ định
Bệnh nhân từ 18 tuổi trở lên. Đường kính khối u
Bệnh nhân phải còn có khả năng đi lại được. Không có suy thận, nồng độ creatinin huyết thanh
Số lượng tiểu cầu > 100000/ml
Bệnh nhân phải cam kết bằng văn bản tình nguyện xin được điều trị bằng phương pháp này.
Chống chỉ định
Bệnh nhân ở giai đoạn C theo bảng phân loại tình trạng bệnh của Child.
Bệnh nhân suy tim nặng giai đoạn III, IV.
Bệnh nhân có bệnh về phổi hoặc bị các bệnh nặng khác.
Phụ nữ có thai hoặc đang cho con bú.
Tiên lượng thời gian sống của bệnh nhân ít hơn 1 tháng.
Bệnh nhân có di căn ngoài gan.
Bệnh nhân có dị ứng với các loại thuốc cản quang tĩnh mạch.
Các loại dược chất phóng xạ
Lipiodol – 131I, Lipiodol-188Re:
Lipiodol-131I dạng thương phẩm được gọi là Lipiocis-131I. Dầu Lipiodol khu trú hạn chế trong mô gan và mạch máu mà không khuếch tán ra xa tới tổ chức lành. Liều sản xuất thường là 60 mCi. Liều đó được tiêm trực tiếp và từng nhánh của động mạch gan sau khi đã luồn ống thông vào đúng vị trí. Đôi khi phẫu thuật viên kết hợp kỹ thuật điều trị YHHN này ngay khi mổ, sau khi nhận thấy không thể cắt bỏ được hết tổ chức ung thư. Hiện nay Lipiodol-188Re đang được triển khai mạnh thay cho 131I. Chất mới này có nhiều ưu điểm hơn.
Điều trị ung thư gan nguyên phát bằng vi cầu phóng xạ:
Trước đây người ta đã sử dụng 90Y dạng hạt để đưa vào hố yên điều trị u tuyến yên. Từ 1985, nó được sản xuất dưới dạng microsphere để bơm vào động mạch gan điều trị ung thư gan nguyên phát. Có thể phối hợp cả 90Y và Macroaggregated albumin (MAA) đánh dấu 99mTc.
Holmium-166 (166Ho) là ĐVPX phát tia beta có năng lượng yếu hơn của 90Y, thời gian bán rã ngắn hơn (26,8 giờ) nên có thể tiêm cho bệnh nhân liều lớn hơn. 166Ho-microsphere tập trung nhanh về mô gan ung thư, sau 2 giờ đã đạt được tỷ lệ 6/1 giữa mô ung thư và mô lành của gan.
Ngoài ra còn có các vi hạt gắn phóng xạ như 188Re microsphere.
Cho đến nay chưa có một phương pháp điều trị nào có ưu điểm nổi bật cho ung thư gan. Kỹ thuật YHHN đóng góp thêm lựa chọn cho người thầy thuốc trước những bệnh nhân cụ thể. Nó cũng có những hạn chế trong chỉ định như trước đó phải xác định xem có biến chứng viêm tắc tĩnh mạch cửa, có nối thông động tĩnh mạch không, khối u còn khu trú không…
Điều trị các khối u trong phúc mạc, phế mạc
Cơ thể con người có 3 màng thanh mạc sinh ra từ trung bì, đó là: màng bụng (phúc mạc), màng phổi (phế mạc) và màng ngoài tim (ngoại tâm mạc). Màng thường có 2 lớp: lớp mô liên kết và lớp mesothelium. Các tế bào khối u, các kháng thể và các keo phóng xạ đều có thể bám vào lớp màng mesothelium. Mesothelium có chứa các vi mao làm cho nên diện tích của nó tăng lên và tăng cả khả năng tiết dịch.
Điều trị UT di căn vào phúc mạc
Tại bệnh viện Norwegium Radium, người ta đã dùng keo 32P tiêm vào màng bụng để điều trị. Liều dùng: 7–10 mCi. Kết quả cho thấy tần suất sống thêm đạt cao hơn so với điều trị bằng hoá chất cisplatin. Theo dõi sau điều trị thấy thời gian sống thêm bệnh không tiến triển cũng như thời gian sống thêm toàn bộ ở nhóm 32P dài hơn nhóm cisplatin.
Có thể điều trị cho bệnh nhân ung thư buồng trứng có di căn vào màng bụng bằng cách tiêm nhỏ giọt vào màng bụng 32P chromic phosphate (5 mCi) phối hợp với dùng cisplatin.
Các hợp chất platinum được áp dụng có kết quả, thuốc được tiêm vào tĩnh mạch hoặc đưa trực tiếp vào màng bụng, dùng đơn thuần hoặc phối hợp với hoá chất. DCPX được dùng là 193mPt hoặc 195mPt. Cần nghiên cứu thêm về phối hợp platinum với 32P và với những chất bảo vệ phóng xạ, tránh tắc ruột.
Các kháng thể đánh dấu phóng xạ dùng trong điều trị ung thư di căn màng bụng có thể được đưa vào bằng đường tĩnh mạch hoặc tiêm trực tiếp vào màng bụng. Đối với ung thư buồng trứng, tiêm tĩnh mạch đơn giản hơn. Kháng thể sẽ qua máu vào màng bụng, trên đường đi có thể gặp các ổ di căn ở nơi mà tiêm màng bụng không đến được. Có tác giả cho rằng: tiêm màng bụng tuy khó khăn nhưng hiệu lực điều trị cao hơn vì tỷ số hoạt độ khối u: mô lành khi tiêm màng bụng có thể cao gấp 50 lần so với tiêm tĩnh mạch.
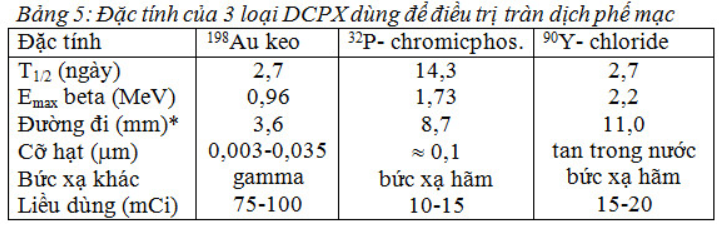
Điều trị tràn dịch màng phổi
Khoảng 50% tràn dịch phế mạc là do ung thư. Ung thư loại nào cũng có thể di căn vào phế mạc, nhưng hay gặp nhất là ung thư vú, ung thư phổi, lymphoma. Tràn dịch màng phổi do ung thư có thể chẩn đoán được bằng xạ hình vì bắt phóng xạ 99mTc- diphosphonate.
Có 3 loại DCPX hay được ding để điều trị TDMP là: 198Au-keo, 32P-chromic phosphate, 90Y-chloride với những đặc tính nêu trong bảng 5.
Tia beta có thể phá hủy các tế bào u trong dịch màng phổi và chính màng phổi làm giảm sự tạo thành dịch bởi mesothelium, đồng thời một số hạt keo phóng xạ bị thực bào làm cho hạch bạch huyết bị chiếu xạ.
Biến chứng có thể gặp khi tiêm keo phóng xạ vào màng phổi là: khó thở nhẹ và sốt. Tai biến nghiêm trọng hầu như không có.
Tuy nhiên dùng các chất phóng xạ để điều trị TDMP cũng không được chỉ định nhiều vì cơ thể sẽ bị chiếu xạ với một liều nhất định như: dùng 198Au thì có thêm gamma, dùng 32P và 90Y thì có bức xạ hãm đều bất lợi cho cơ thể. Hơn nữa điều trị bằng keo phóng xạ chỉ là điều trị tạm thời nhằm mục đích giảm tiết dịch chứ không phải là điều trị triệt căn.
Điều trị bệnh tim mạch
Nổi bật của YHHN ứng dụng trong tim mạch là góp phần điều trị bệnh động mạch vành. sau nong mạch vành và đặt stent có một tỷ lệ nhất định tái hẹp, điều trị lại là rất khó khăn. Nguyên nhân là do sự tăng sinh của tổ chức nội mạc trong lòng mạch, nơi đặt stent dẫn đến tái hẹp. Các nghiên cứu cho thấy liều phóng xạ từ 10-30Gy có khả năng ức chế quá trình tăng sinh của tổ chức nội mạc, duy trì sự thông suốt động mạch. Phương pháp này được áp dụng từ 1990 và được gọi là phương pháp điều trị áp sát trong lòng mạch. 32P là ĐVPX thích hợp đưa vào áp sát lòng mạch nhất. Nguồn phóng xạ đưa vào dưới dạng một nguồn kín. Stent được chế tạo bằng Titani nguyên chất, hợp kim Titani-Nitin và được tráng một lớp 32P bền vững về hóa học, cứng và chịu được ma sát.
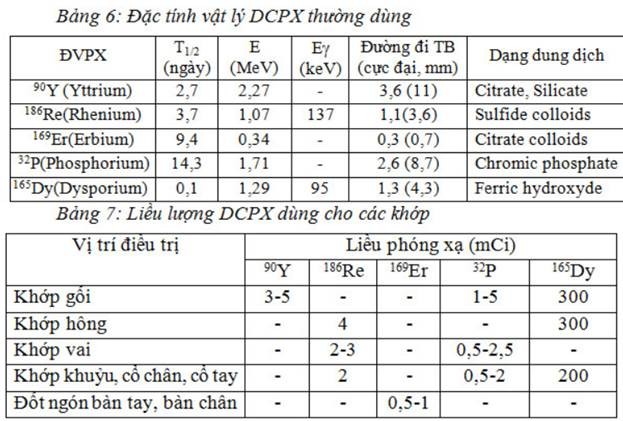
Điều trị một số bệnh khớp bằng ĐVPX
Trước đây người ta đã cắt bỏ bao hoạt dịch bằng phẫu thuật (Synovectomy) để điều trị một số bệnh khớp, dùng corticoid tiêm vào khớp. Gần đây phương pháp dùng dược chất phóng xạ tiêmvào ổ khớp để tiêu hủy bao hoạt dịch mang lại kết quả tốt trong các bệnh khớp viêm mạn tính không phải do nhiễm khuẩn.
ĐVPX được gắn với chất mang dưới dạng các hạt keo, kích thước hạt đủ nhỏ để các tế bào hoạt dịch (Synovial) có thể “thực bào” được, phân bố đều trong bao khớp. Đồng thời kích thước hạt lại phải đủ lớn để không thoát ra ngoài theo mao mạch hoặc hạch bạch huyết, gây chiếu xạ cho gan, lách, sụn khớp. Kích thước hạt tối ưu khoảng 2-5 mm. Các ĐVPX phát tia b có năng lượng đủ lớn để xuyên qua bề dày màng bao hoạt dịch viêm.
Chỉ định cho viêm đa khớp dạng thấp, các bệnh viêm khớp mạn tính không do nhiễm khuẩn, tràn dịch bao hoạt dịch kéo dài, viêm bao hoạt dịch thể tăng sinh, bệnh khớp ưa chảy máu. Không điều trị bằng phương pháp này cho bệnh nhân trẻ em.
Sau khi tiêm DCPX, các khớp điều trị phải được bất động 48 giờ. Kết quả tùy thuộc vào tiến triển của bệnh và sự phá hủy của xương. Trong các bệnh khớp không có phá hủy xương nghiêm trọng cải thiện tốt được 70-80% trường hợp, tương đương với phẫu thuật cắt bỏ bao hoạt dịch. Liều lượng phóng xạ được chỉ định phụ thuộc vào loại ĐVPX lựa chọn và kích thước khớp.
Xạ trị miễn dịch
Nguyên lý của phương pháp là dùng một lượng KT đặc hiệu (KT đơn dòng) đánh dấu bằng các ĐVPX phát tia beta như 131I, 32P, 90Y, 186Re, 111In tấn công vào tổ chức ung thư. Lượng KT đánh dấu phóng xạ thâm nhập vào khối u, tia bức xạ sẽ làm hoại tử tế bào u. Hiệu quả điều trị phụ thuộc lượng kháng thể tập trung ở khối u. Hiệu quả tốt với khối u nhỏ (90Y Ibritumomab tiuxetan (ZEVALIN) và 131I tositumomab (BEXXAR) là những sản phẩm đã được sử dụng để điều trị lymphoma tế bào B cho kết quả tốt: đáp ứng với điều trị 60-80%, trong đó đáp ứng hoàn toàn 47 – 64%. Thời gian đáp ứng trung bình 12 – 18 tháng. HMFG2 hoặc HI7E2 gắn 131I dùng điều trị ung thư buồng trứng…
Những tiến bộ mới trong lĩnh vực phân tử cho thấy không riêng các KT có gắn KN tạo cơ sở kỹ thuật cho xạ trị miễn dịch. Nhiều phân tử peptid, nucleotid. receptor, hormon cũng có khả năng gắn chọn lọc vào các mô ung thư vì ở một số tế bào ung thư có các cơ quan thụ cảm đặc hiệu đối với phân tử hữu cơ đó. Người ta còn đánh dấu các hạt nhân phóng xạ vào lipiodol, các phân tử albumin huyết thanh (Macroagregat Serum Albumin – MASA) hoặc các microsphere để điều trị theo cơ chế khuếch tán chậm hoặc tắc mạch tạm thời. Từ đó khái niệm xạ trị miễn dịch được mở rộng là điều trị bằng các hợp chất hữu cơ đánh dấu, điều trị hướng đích. Chẳng hạn dùng 131I-MIBG điều trị ung thư tuyến giáp thể tủy, u nguyên bào thần kinh, u thần kinh nội tiết, u tủy thượng thận… Dùng 131I-lipiodol. 188Re-lipiodol, 188Re-microsphere. 90Y, 166Ho-microsphere điều trị ung thư gan nguyên phát không có khả năng phẫu thuật.
Ở các nước tiên tiến, người ta còn dùng các ĐVPX phát tia alpha thời gian bán rã ngắn để gắn vào các hợp chất sinh học dùng cho điều trị như Astatine-211 (211At), Bismuts-213 (213Bi). Hiệu ứng sinh học do tia alpha gây ra rất lớn và do vậy có khả năng tiêu diệt tế bào ung thư mạnh. Vấn đề cần quan tâm là lựa chọn liều thích hợp sao cho đạt hiệu quả mà không gây hại cho tổ chức lành.
Tài liệu tham khảo
Bài giảng Y học hạt nhân, Đại học Y khoa Hà Nội, Nxb Y học, 2012.
Giáo trình Y học hạt nhân, Học viện Quân y, Nxb QĐND, 2010.
Janet F. Nuclear Medicine Therapy. INFORMA Healthcare USA Inc. 2007.
Baert A.L.; Sartor K.: Diagnostic Nuclear Medicine, Springer Verlag 2006.