Kỹ thuật miễn dịch phóng xạ
Đại cương về các kỹ thuật miễn dịch
Các kỹ thuật miễn dịch rất phong phú, tuy nhiên đều dựa trên một nguyên lý chung là mối tương tác đặc hiệu kiểu thuận nghịch giữa kháng nguyên (KN) và kháng thể (KT).
Các kỹ thuật miễn dịch có thể xếp vào hai nhóm chính là:
Các kỹ thuật miễn dịch có thể quan sát trực tiếp bằng mắt thường (lên bông, kết tủa, ngưng kết, cố định bổ thể, trung hoà).
Các kỹ thuật miễn dịch dùng chất đánh dấu.
Mục đích nhằm:
Biến một phản ứng không quan sát trực tiếp được thành một phản ứng có thể quan sát và nhận định kết quả được.
Tăng độ nhạy, độ chính xác của phản ứng.
Tăng khả năng tự động hoá.
Có thể áp dụng trên cơ thể sống.
Các chất đánh dấu có thể xếp vào hai nhóm chính, đó là: các chất đánh dấu không phải phóng xạ (các enzym, ferritin, luciferin), và các chất đánh dấu là đồng vị phóng xạ. Dựa trên loại chất đánh dấu được dùng, các kỹ thuật miễn dịch hiện hành được phân làm 4 nhóm sau đây:
Đồng vị phóng xạ: radioimmunoassay (RIA) hoặc immunometric assay(IRMA).
Enzym: kỹ thuật miễn dịch enzym (immunoenzymometric assay: EIA).
Huỳnh quang: miễn dịch huỳnh quang (immunofluorometric assay).
Hoá phát quang: miễn dịch hoá phát quang (immunochemiluminometric assay).
Mặc dù các kỹ thuật miễn dịch phóng xạ là cực kỳ nhạy, nhưng hiện nay miễn dịch phóng xạ đang bị các kỹ thuật không phóng xạ cạnh tranh vì 3 lý do: các hợp chất phóng xạ có hại cho sức khoẻ; đời sống ngắn; và mới phát triển một số kỹ thuật không phóng xạ có độ nhạy vô cùng cao, như hoá phát quang (chemiluminescence) và hoá điện tử (electrochemical).
nguyên lý chung của định lượng miễn dịch phóng xạ
Định lượng miễn dịch phóng xạ là một trong những kỹ thuật chẩn đoán YHHN in vitro. Những người đầu tiên xây dựng kỹ thuật này là Rosalyn S. Yalow và Solomon A. Berson khi dùng insulin đánh dấu phóng xạ (insulin*) để xác định thời gian tồn tại của insulin trong máu tuần hoàn. Kết quả cho thấy thời gian tồn tại của insulin* ở bệnh nhân tiểu đường dài hơn so với người khoẻ bình thường. Nguyên nhân là do insulin* đã gắn với anti-insulin có trong huyết thanh của những bệnh nhân tiểu đường. Từ những kết quả thí nghiệm ban đầu đó, hai tác giả trên đã phát minh ra kỹ thuật miễn dịch phóng xạ và đoạt giải Nobel vào năm 1997. Với độ đặc hiệu và độ chính xác rất cao kỹ thuật này có thể định lượng được hầu hết các nội tiết tố trong cơ thể, định lượng các chất có nồng độ cực thấp trong huyết thanh.
Phương pháp định lượng miễn dịch phóng xạ RIA
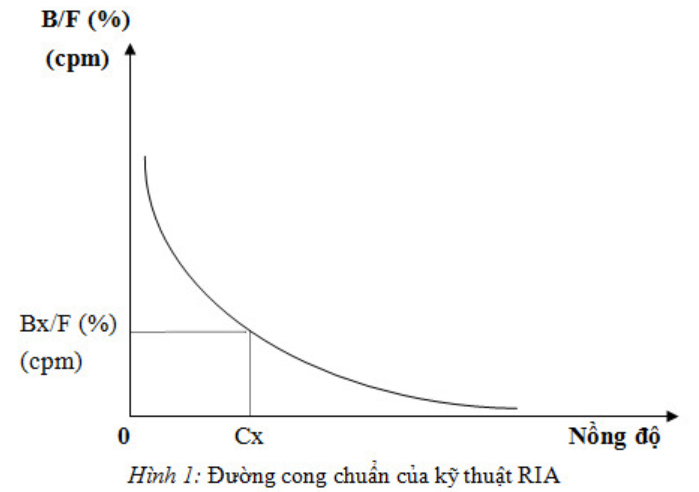
Dựa trên tính đặc hiệu cao của phản ứng miễn dịch trong đó chất cần định lượng đóng vai trò là KN cùng với KN đồng nhất về miễn dịch nhưng được đánh dấu bằng đồng vị phóng xạ (KN*) liên kết với KT đặc hiệu để tạo thành các phức hợp (KN*-KT) + (KN-KT). Nếu có một lượng dư thừa KN* và một lượng hạn chế KT, ta có:
KN* + KT + KN → (KN*-KT) + (KN-KT) + KN* + KN
Có sự cạnh tranh KT. Nếu KN cao thì KN*-KT thấp.
KN*-KT: phần kết hợp; có thể tách ra khỏi KN* vì tính chất kết tủa của phức KN-KT.
Hoạt tính phóng xạ của phức B (KN*-KT) tỷ lệ nghịch với nồng độ KN cần định lượng. Xây dựng đồ thị chuẩn ta sẽ xác định được nồng độ chất cần định lượng bằng cách so sánh số đếm xung của bệnh phẩm với xung của các mẫu chuẩn được làm song song.
Để đảm bảo độ chính xác, tất cả các mẫu thử, bao gồm các mẫu bệnh phẩm cũng như các mẫu chuẩn, đều phải được xử lý và xét nghiệm hoàn toàn như nhau và trong cùng các điều kiện như nhau về thời gian ủ, khối lượng, nhiệt độ, pH, thời gian và tốc độ quay ly tâm…
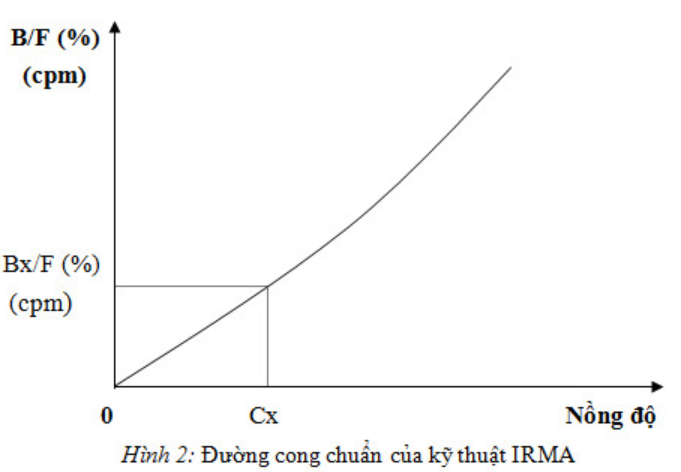
Kỹ thuật đo miễn dịch phóng xạ (IRMA)
Kháng thể được đánh dấu phóng xạ và được dùng ở một lượng dư thừa. Do đó, KT* có thể phản ứng với tất cả KN, và do vậy, hoạt tín phóng xạ đo được ở dạng kết hợp sẽ tỷ lệ thuận với nồng độ của KN, hay chất cần định lượng. Trong trường hợp này, đường cong chuẩn có hình dạng theo hướng đi lên.
Ngày nay, các kháng thể đơn dòng (monoclonal antibodies) được dùng rất phổ biến trong hệ thống IRMA pha rắn, trong đó một KT dùng làm KT bắt giữ (KT lạnh) có thể là KT đơn dòng hoặc KT đa dòng, và KT thứ hai được gắn ĐVPX. Hai KT này phát hiện các quyết định KN (epitope) với các vị trí gắn (binding site) khác nhau trên phân tử KN, mỗi KT chỉ phản ứng với một vị trí gắn duy nhất trên bề mặt phân tử KN. Nhờ vậy, tránh được dùng KN tinh chế đắt tiền để sản xuất KT khiết dùng cho đánh dấu, một hạn chế đáng kể của các kỹ thuật KT đánh dấu trước đây.
Tuy nhiên, kỹ thuật IRMA đòi hỏi KN phải là các chất có trọng lượng phân tử tương đối lớn để có ít nhất hai loại vị trí gắn khác nhau đảm bảo cho KT lạnh và KT đánh dấu đồng thời có thể gắn được lên phân tử KN.
Kỹ thuật miễn dịch phóng xạ bánh kẹp (sandwich)
Ủ KN tự do có trong mẫu thử với kháng thể bắt giữ, rửa loại bỏ các thành phần không tham gia vào phản ứng KN-KT đặc hiệu. Sau đó cho thêm KT thứ hai có đánh dấu phóng xạ (kháng thể phát hiện) và ủ tiếp, rửa lần hai để loại bỏ các KT đánh dấu không tham gia phản ứng (dạng tự do). Cuối cùng, đo hoạt tính phóng xạ. Lượng KT đánh dấu càng nhiều thì lượng KN có trong mẫu thử càng lớn, và ngược lại (tỷ lệ thuận).
Những điểm khác nhau căn bản giữa RIA và IRMA
Trong phản ứng RIA có sự cạnh tranh giữa chất cần định lượng đóng vai trò KN với KN* để gắn với KT thiếu. Trong IRMA người ta đưa vào một lượng KT dư thừa, chất cần định lượng đóng vai trò KN kết hợp không hạn chế với KT, không có sự cạnh tranh.
Phương pháp RIA người ta đánh dấu vào kháng nguyên (KN*), còn trong IRMA người ta đánh dấu vào kháng thể (KT*).
Độ nhạy IRMA 10-12 mol/l, RIA 10-10mol/l
Độ đặc hiệu IRMA > RIA vì dùng KT đơn dòng
Ưu nhược điểm của phương pháp định lượng MDPX
Ưu điểm: độ nhạy và độ chính xác cao, có thể định lượng được các phân tử sinh học ở miền nồng độ rất thấp cỡ 10-9g (ng), thậm chí tới 10-12g (pg). Kỹ thuật tương đối đơn giản, kết quả ổn định, không bị ảnh hưởng bởi nhiệt độ.
Nhược điểm: phải sử dụng hoá chất phóng xạ nên phòng xét nghiệm cần phải được thiết kế thích hợp để bảo đảm các quy định về an toàn phóng xạ.
định lượng các nội tiết tố liên quan đến tuyến giáp bằng kỹ thuật miễn dịch phóng xạ ria và irma
Bệnh tuyến giáp chiếm tỷ lệ lớn nhất trong các bệnh nội tiết. Biểu hiện lâm sàng và xét nghiệm labo của các bệnh này rất phong phú. Có nhiều phương pháp khác nhau để đánh giá chức năng hoạt động của tuyến giáp, cũng như để chẩn đoán, theo dõi diễn biến và tiên lượng bệnh tuyến giáp. Trong đó, phương pháp miễn dịch phóng xạ có vai trò đặc biệt quan trọng, vì nó cho phép trực tiếp định lượng rất chính xác nồng độ của các nội tiết tố tuyến giáp, các nội tiết tố khác có liên quan mật thiết với chức năng tuyến giáp, cũng như một số chất liên quan với cấu trúc mô học tuyến giáp. Các nội tiết tố của tuyến giáp và các nội tiết tố của một số tuyến nội tiết khác có ảnh hưởng mật thiết tới chức năng tuyến giáp thường được gọi dưới một thuật ngữ chung là các nội tiết tố liên quan với tuyến giáp (thyroid-related hormones).
giá trị chẩn đoán một số hormon liên quan đến tuyến giáp
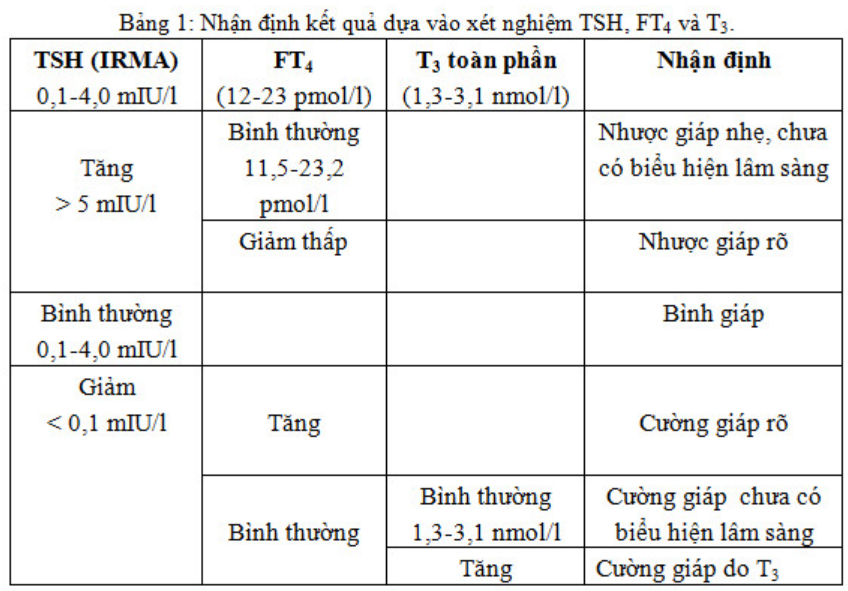
Những biến đổi về hàm lượng các nội tiết tố tuyến giáp (T3, T4) và TSH gặp trong hầu hết các bệnh tại tuyến giáp, ở các mức độ khác nhau tùy theo từng loại bệnh và tình trạng bệnh.
Tuyệt đại đa số các bệnh có cường giáp (hyperthyroidism) đều làm tăng tốc độ tổng hợp và bài tiết T3, T4. Do đó, nồng độ T3, T4 toàn phần hay tự do đều tăng. Song không phải lúc nào các mức tăng T3, T4 đều song hành với các biểu hiện lâm sàng ở bệnh nhân cường giáp. Trường hợp chỉ có tăng đơn độc T3 mà T4 trong phạm vi bình thường được gọi là nhiễm độc giáp do T3 (T3-thyrotoxicosis). Nếu chỉ có tăng đơn độc T4 mà T3 trong giới hạn bình thường, ta có nhiễm độc giáp do T4 (T4-thyrotoxicosis).
Ngược lại, trong suy giáp, các liên bào tuyến giáp giảm hoặc mất khả năng tổng hợp và bài tiết các nội tiết tố tuyến giáp. Do vậy, ở tuyệt đại đa số các trường hợp đều có mức T3, T4 thấp dưới mức bình thường. Nồng độ TSH ở những bệnh nhân suy giáp thay đổi tùy theo tình trạng tổn thương thực thể diễn ra tại tuyến giáp hay tại tuyến yên. Khi có tổn thương thực thể tại tuyến giáp (suy giáp tiên phát) thì nồng độ TSH tăng cao, đáp ứng với TRH kéo dài và tăng quá mức. Nếu tổn thương tại tuyến yên (suy giáp thứ phát), nồng độ TSH giảm thấp dưới mức bình thường, khả năng đáp ứng với TRH giảm hoặc mất.
Một số bệnh và một số yếu tố ngoài tuyến giáp ảnh hưởng đến hàm lượng T3, T4 toàn phần như bệnh gan (viêm gan virus, viêm gan mạn, xơ gan…), bệnh thận (viêm thận mạn, hội chứng thận hư…), suy dinh dưỡng, thai nghén, hoặc một số thuốc (tránh thai, amiodaron, diazepam, rifamixin). Để chẩn đoán xác định và chẩn đoán phân biệt trong những trường hợp này, cần cho xét nghiệm FT4 và TSH vì 2 hormon này thường chỉ thay đổi khi có các bệnh lý thực sự tại TG.
Các xét nghiệm khác thường được chỉ định trong các bệnh tuyến giáp: Các xét nghiệm chuyên khoa bao gồm: siêu âm, chụp xạ hình tuyến giáp bằng các ĐVPX (131I, 99mTc, 201Tl), đo độ tập trung iode tại tuyến giáp (iodine uptake), xét nghiệm miễn dịch (tìm thyroid stimulating immunoglobins: TSI; thyroid receptor antibody: TRAb; TSH-binding inhibitory immunoglobulin, TBII; thyroglobulin, Tg; anti-thyroglobulin antibody, TgAb).
một số hội chứng quan trọng thường gặp
Cường giáp, điển hình là bệnh Graves-Basedow
T3 toàn phần (giá trị bình thường: 1,30-3,10 nmol/l): hàm lượng thường tăng ở 80-90% các trường hợp. Tuy nhiên, khoảng 10% trường hợp T3 thay đổi không rõ ràng. Thể nhiễm độc giáp do T3 gặp ở khoảng 2% các trường hợp cường giáp, và bệnh cảnh lâm sàng giống như các thể Basedow khác. Đối với chẩn đoán Basedow, định lượng T3 là quan trọng hơn vì có thể cường giáp chỉ có tăng T3 mà T4 không tăng. Sau khi điều trị thì T3 thay đổi sớm hơn T4 và thay đổi sớm hơn triệu chứng lâm sàng.
T4 toàn phần (58,1 – 140,9 nmol/l): tăng ở khoảng 80% trường hợp. T3 có giá trị chẩn đoán cao hơn T4, vì T4 trong máu ngoại vi chịu ảnh hưởng của nhiều yếu tố khác nhau. Chẳng hạn bệnh nhân ốm yếu, già cả hoặc cả hai do sự ức chế chuyển T4 – T3, nên T4 tăng cao nhưng T3 bình thường, hoặc thấp.
FT4 (11,5 – 23,2 pmol/l): tăng trong tuyệt đại đa số các trường hợp cường giáp. Do vậy, để chẩn đoán xác định cường giáp, cần chỉ định xét nghiệm FT4. FT3 thường cũng tăng cao, tuy nhiên, thường không làm xét nghiệm vì 80% T3 từ T4 chuyển sang, chỉ 20% T3 do tuyến giáp trực tiếp sản xuất ra.
TSH (định lượng bằng phương pháp IRMA): hàm lượng giảm thấp ở các trường hợp cường giáp. Đây là xét nghiệm quan trọng nhất, nếu TSH thấp mới thực sự là có cường giáp.
Bình thường : 0,03 – 3,5 mU/l
Cường giáp :
Nhược giáp : > 5mU/l
Khi điều trị cường giáp TSH thường thay đổi chậm, vì vậy TSH là một chỉ tiêu đánh giá kết quả sau điều trị rất có giá trị, chính xác và trung thực.
Trường hợp bệnh nhân đã được điều trị, việc nhận định các kết quả xét nghiệm thường rất khó. Do vậy, cần kết hợp với lâm sàng để nhận định và kết luận. Nếu T4 giảm, T3 vẫn tăng: vẫn cường giáp. T4 giảm, T3 bình thường hoặc thấp: đã bình giáp. Vì thế, ở bệnh nhân theo dõi sau điều trị, cần cho làm xét nghiệm cả FT4, TSH, T3 và T4.
Hội chứng bình giáp bệnh lý
Có 4 khả năng:
T4 toàn phần bình thường: chỉ có T3 giảm do T4 không chuyển thành T3 được do một số nguyên nhân (gan suy, bệnh kéo dài mạn tính, suy nhược cơ thể, tuổi già, chấn thương nặng về tinh thần). Xét nghiệm: T4 toàn phần bình thường, FT4 tăng (do không liên kết được với các protein một cách đầy đủ), T3 giảm, rT3 hoặc tăng hoặc bình thường.
T4 toàn phần thấp: do nhiều nguyên nhân (giảm chế tiết T4 vì nhược giáp, do giảm chế tiết TSH ở tuyến yên, do tác động của một số cytokine). Bên cạnh FT4 giảm, TSH giảm, rT3 huyết thanh tăng. rT3 tăng là dấu hiệu quan trọng giúp chẩn đoán phân biệt với suy giáp do tuyến yên (có rT3 giảm).
T4 toàn phần tăng (tăng thyroxine máu bình giáp, euthyroid hyperthy-roxinemia): hiếm gặp (khoảng 1% hội chứng bình giáp bệnh lý), thường thấy ở phụ nữ nhiều tuổi, người dùng thuốc chứa nhiều iốt, bệnh nhân tâm thần (khoảng 20% có T4 tăng, TSH bình thường hoặc tăng nhẹ). Xét nghiệm: T4 tăng, FT4 tăng có thể tạm thời hoặc lâu dài. Vì vậy dễ nhầm với nhiễm độc T4, tuy nhiên chẩn đoán phân biệt với nhiễm độc T4 bởi TSH giảm và rT3 > T3.
Bất thường về liên kết hormone: do giảm các protein gắn T4 trong máu (có thể do giảm TBG ở người bệnh mạn tính, giảm tổng hợp transthyretin (TTR) là một prealbumin gắn T4, do có chất phong bế sự liên kết, hoặc giảm chuyển từ T4 thành T3). Xét nghiệm: nồng độ T4 trong máu giảm, T3 giảm. Điều trị bằng hormone giáp không hiệu quả.
Suy giáp (hypothyroidism)
T3: giảm ở khoảng 70-80% các trường hợp.
T4: giảm ở khoảng 90% các trường hợp. Chẩn đoán T4 có giá trị hơn T3.
FT4, FT3: giảm ở đại đa số các trường hợp suy giáp.
TSH: tăng cao trong suy giáp nguyên phát.
Bướu cổ
Những người sống ở vùng bướu cổ địa phương có nồng độ T3, T4 bình thường hoặc tăng nhẹ, độ tập trung iode thường là bình thường. Do đó những người có bướu cổ địa phương vẫn ở trạng thái bình giáp.
Tóm lại: để chẩn đoán bệnh tuyến giáp nên chỉ định xét nghiệm ít nhất 2 loại hormon liên quan tuyến giáp khác nhau, đặc biệt nên cho làm TSH (IRMA).
một số ứng dụng lâm sàng khác
Định lượng kháng thể kháng receptor của TSH
TRAb (TSH receptor Antibodies): kháng thể này kích thích tuyến giáp như sự kích thích đặc hiệu của TSH. Nhiều nghiên cứu cho thấy cường chức năng tuyến giáp trong bệnh Basedow thực sự là do TRAb. Nồng độ TRAb của các bệnh nhân Basedow thường tăng rất cao (nhiều khi gấp hàng trăm lần so với bình thường) trước điều trị, nhất là ở những bệnh nhân còn cường giáp. Sau điều trị giảm mạnh. Do đó, TRAb ít có giá trị trong chẩn đoán cường giáp nhưng có giá trị trong đánh giá hiệu quả điều trị và theo dõi sau điều trị.
Định lượng một số loại hormon
Kích tố phát triển (Growth hormone- GH): GH là một loại protein được tổng hợp bởi tế bào α của thuỳ trước tuyến yên. Định lượng GH trong máu có giá trị trong chẩn đoán và theo dõi điều trị một số bệnh như: bệnh to đầu chi, chứng khổng lồ, bệnh lùn do tuyến yên…
Hormon tuyến cận giáp (Parathyroid hormone- PTH): PTH là một loại hormon được bài tiết bởi tuyến cận giáp, bản chất hoá học là một loại polypeptid. Nó có vai trò quan trọng trong chuyển hoá calci, phospho.
Một số loại hormon khác: có thể định lượng bằng kỹ thuật IRMA một số loại hormon như Cortisol, Insulin, Calcitonin, Prolactin, ACTH… Calcitonin là hormon do tế bào cạnh nang của tuyến giáp bài tiết (tế bào C), được coi như là một chất chỉ điểm đối với ung thư giáp thể tuỷ.
định lượng một số chất chỉ điểm khối u
Chất chỉ điểm khối u hay dấu ấn ung thư là các đại phân tử, phần lớn là các protein với thành phần carbohydrat hoặc lipid mà sự có mặt và/hoặc nồng độ của chúng thay đổi trong máu ngoại vi và/hoặc dịch khác của cơ thể liên quan tới một mức độ nhất định với sự có mặt và phát triển của khối ác tính trong cơ thể bị bệnh. Các chất này hình thành từ trong hoặc ở trên tế bào ung thư hoặc bằng cách kích thích tế bào khác sản sinh ra.
Dấu ấn ung thư phải được tiết vào máu ngoại vi ở nồng độ có thể phát hiện được chỉ sau khi tế bào sản sinh ra nó chuyển thành ác tính. Việc phát hiện ra nó cho phép rút ra kết luận vị trí xuất phát của khối u (nguyên phát).
Trong thực tế không có chất nào đáp ứng một cách đầy đủ các yêu cầu này.
Hiện nay kỹ thuật IRMA thường được sử dụng để định lượng các dấu ấn ung thư. Việc sử dụng các xét nghiệm này vào mục đích sàng lọc, phát hiện và chẩn đoán bệnh còn hạn chế vì độ nhạy và độ đặc hiệu thấp, nhưng lại có giá trị trong theo dõi diễn biến bệnh, đánh giá hiệu quả điều trị, tiên lượng bệnh cũng như phát hiện sớm di căn tái phát.
Alphafetoprotein – AFP (protein alpha bào thai)
Alpha-fetoprotein (AFP) là một glycoprotein có trọng lượng phân tử 70.000 daltons (70 kDa). ở các điều kiện sinh lý bình thường, nó được hình thành trong túi lòng đỏ trứng, trong gan bào thai, và trong đường dạ dày-ruột bào thai. Cho tới nay, nhờ có sự hỗ trợ đắc lực của các kháng thể đơn dòng người ta đã xác định được từ 3 đến 7 biểu vị (epitopes) khác nhau trên mỗi phân tử AFP.
AFP có thể phát hiện được trong huyết thanh bào thai từ tuần thứ 4 của thời kỳ mang thai. Trong bào thai, nồng độ AFP đạt tới đỉnh cao giữa tuần thứ 12 và 16 và sau đó giảm dần cho tới khi sinh. Vào 1 năm tuổi, mức AFP bình thường trong huyết thanh tương tự như ở người lớn, có nghĩa là dưới 15 ng/ml.
Do AFP vượt qua nhau thai, nó có thể thấy với nồng độ rất cao trong máu thai phụ, đạt tới đỉnh cao giữa tuần thứ 32 – 36 của thai kỳ. AFP là một thông số sinh hoá lâm sàng quan trọng trong chăm sóc tiền sản. AFP cao rõ rệt trên mức bình thường khi có thai trong tuần lễ theo dõi nào đó gặp trong một số trường hợp bệnh lý, ví dụ các khuyết tật ống thần kinh. Một mức AFP thấp bất thường sau tuần lễ thứ 10 mang thai có thể được coi như là dấu hiệu của hội chứng Down. Xét nghiệm AFP trong dịch ối cũng quan trọng đối với chăm sóc sức khoẻ tiền sản. Nhìn chung, mức AFP tăng cao rõ rệt trong dịch ối (trong trường hợp mang một thai) nói lên có nhiều khả năng có khuyết tật ống thần kinh.
AFP có hai ứng dụng lâm sàng chủ yếu: thứ nhất, để phát hiện và theo dõi giám sát ung thư tế bào gan nguyên phát, thường phát triển ở các gan bị xơ; và thứ hai, theo dõi giám sát đáp ứng với điều trị, hoặc giúp cho chẩn đoán tới một mức độ nhất định, các khối u tế bào mầm.
Mức AFP tăng cao cũng thấy ở khoảng 9% các bệnh nhân bị ung thư gan thứ phát do di căn từ các ung thư khác tới, như tuyến vú, phế quản, và đại trực tràng. Tuy nhiên, giá trị AFP thấy ở các bệnh nhân như thế ít khi vượt quá 100 ng/ml và hầu như không bao giờ đạt trên 500 ng/ml. Tuy vậy, phần lớn các bệnh nhân này có mức CEA tăng rất mạnh, do đó xác định được cả AFP và CEA sẽ cho phép chẩn đoán phân biệt rất rõ hai nhóm ung thư này.
Do có độ nhạy cao, xét nghiệm AFP thích hợp cho việc phát hiện sớm ung thư tế bào gan ở các nhóm nguy cơ cao (như bệnh nhân xơ gan, viêm gan mạn, HBsAg dương tính, hoặc thiếu hụt alpha-antitrypsin) nên những bệnh nhân bị các loại bệnh này cần phải được xét nghiệm AFP mỗi năm 2 lần. Tiếp tục tăng hoạt tính các enzym GGT, GLDH, AP, và GOT hoặc tăng các alpha-globulin trong điện di ở bệnh nhân xơ gan cần phải luôn được coi là các trường hợp cần chỉ định làm xét nghiệm AFP nhằm phát hiện ung thư tế bào gan nguyên phát tại thời kỳ càng sớm càng tốt. Khi thấy mức AFP tăng đáng kể, thì những thay đổi như thế rất nhiều khả năng do ung thư gan nguyên phát hơn là do một đợt cấp tính nặng lên của xơ gan có kèm theo ứ mật.
AFP tăng cao thấy ở các bệnh gan lành tính, dẫu rằng thông thường chỉ là cách đoạn, lúc có, lúc không và chỉ ở phần thấp của phạm vi bệnh lý (rất hiếm khi trên 500 ng/ml). Những bệnh nhân có AFP tăng cao (“dương tính”) như thế có tần suất mắc mới ung thư tế bào gan tăng lên và tiên lượng 5 năm xấu hơn.
Carcinoembryonic antigen – CEA (KN ung thư phôi thai)
Kháng nguyên CEA là một glycoprotein có trọng lượng phân tử 180.000 daltons. Những nghiên cứu bằng các kháng thể đơn dòng cho tới nay đã nhận biết được 6 quyết định KN khác nhau.
Giống như AFP, CEA là một KN ung thư phôi thai được sản xuất trong đời sống phôi và bào thai. Sự sản xuất CEA bị kìm hãm sau khi sinh, các chất này hầu như không bao giờ phát hiện thấy trong huyết thanh người lớn bình thường. Tuy nhiên, các KN này xuất hiện trở lại do kết quả giải tỏa kìm hãm ở các tế bào của một số loại ung thư nhất định đang phát triển.
CEA thấy chủ yếu trong ống dạ dày, ruột và trong huyết thanh bào thai, thấy với lượng nhỏ hơn trong các tổ chức ruột, tuyến tụy và gan ở người trưởng thành. CEA chỉ thấy với lượng rất nhỏ trong huyết thanh và các dịch cơ thể khác của người bình thường. Nồng độ CEA cao gặp trong ung thư biểu mô tuyến (adenocarcinoma) đại trực tràng.
Giới hạn trên của phạm vi tham chiếu đối với những người không hút thuốc lá từ 2,5 đến 5 ng/ml, phụ thuộc vào phương pháp xét nghiệm.
Mức CEA chịu ảnh hưởng bởi các tập quán hút thuốc và ở một mức độ ít hơn bởi uống rượu. Giới hạn trên của phạm vi tham chiếu cho những người bình thường có hút thuốc lá từ 7 đến 10 ng/ml.
Tuy nhiên, tăng nhẹ đến tăng vừa của CEA cũng gặp ở 20 đến 50% những bệnh nhân bị các bệnh lành tính, đặc biệt ở những người có bệnh đường ruột, tuyến tụy, gan và phổi. Do vậy, hiện tượng này thấy ở xơ gan, viêm gan mạn tính, viêm tuyến tụy, viêm đại tràng loét, bệnh Crohn, viêm phổi, viêm phế quản, lao phổi, khí phế thũng, tăng độ nhớt của máu, và các bệnh tự miễn dịch. Trong các bệnh lành tính này, mức CEA thường ở phần thấp của phạm vi bệnh lý, hiếm khi vượt quá 10 ng/ml. Hơn nữa, sự tăng nhẹ hoặc kéo dài, hoặc thất thường gặp trong các xét nghiệm theo dõi định kỳ có khuynh hướng mất đi sau khi tình trạng lâm sàng tốt lên. Trái lại, trong các u ác tính không được điều trị thì mức CEA tăng lên liên tục, khởi đầu tăng theo kiểu cấp số mũ.
Áp dụng chủ yếu của thử nghiệm CEA là theo dõi giám sát tiến triển và đáp ứng với điều trị ở những bệnh nhân ung thư đại trực tràng.
Tỷ lệ của mức CEA dương tính thực, có nghĩa là độ nhạy ở một số khối u đặc ác tính (đại trực tràng, dạ dày, tụy, phổi, tuyến vú) với độ đặc hiệu 95% (so sánh với các nhóm tham chiếu tương ứng gồm các bệnh dạ dày ruột lành tính, bệnh tuyến vú, các bệnh phổi lành tính) từ 22%- 50%. CEA được dùng trong giám sát ung thư đại trực tràng và các khối u ác tính đã nêu trên đây tốt đến mức nó đã đóng vai trò như một dấu ấn chuẩn mà tất cả các dấu ấn ung thư mới phải được so sánh với CEA.
Kháng nguyên đặc hiệu tuyến tiền liệt
Kháng nguyên đặc hiệu tuyến tiền liệt (prostate – specific antigen – PSA) là một glycoprotein có trọng lượng phân tử 34.000 daltons. PSA có trong các ống ngoại tiết của tuyến tiền liệt, nó là một sản phẩm ngoại tiết sinh lý bình thường và có liên quan với kallikrein. PSA hoạt động như một enzym serine proteaza làm lỏng tinh dịch. Tuy đặc hiệu cho cơ quan, nhưng PSA không đặc hiệu cho ung thư. PSA trong tinh dịch ở thể đơn phân, còn trong huyết tương nó vừa ở dạng đơn phân vừa ở dạng kết hợp với alpha-antichymotrypsin (trọng lượng phân tử khoảng 100.000 daltons). Hiện còn chưa rõ là xét nghiệm PSA tự do (không kết hợp), hoặc dạng kết hợp, hoặc một hỗn hợp của cả hai dạng là có ý nghĩa nhiều hơn cho phát hiện và giám sát carcinoma tuyến tiền liệt.
Vì PSA còn được tiết ra ở các tuyến cận niệu đạo nên có thể thấy với lượng rất nhỏ PSA ở phụ nữ. PSA phụ thuộc vào phương pháp xét nghiệm được dùng, giới hạn trên ở những người đàn ông khoẻ mạnh bình thường không có phì đại tuyến tiền liệt là 4 ng/ml. Thời gian nửa vòng đời sinh học của PSA từ 2- 3 ngày. Đôi khi thấy mức PSA trong huyết thanh tăng đáng kể ở người phì đại tuyến tiền liệt cũng như trong các bệnh cảnh viêm nhiễm của tuyến tiền liệt. Với mức ngưỡng bệnh lý là 10 ng/ml, độ đặc hiệu của PSA đối với các bệnh lý lành tính của tuyến tiền liệt đạt 90%.
Thủ thuật thăm khám qua trực tràng, soi bàng quang, soi đại tràng, sinh thiết qua niệu đạo, chiếu laser, đo công năng cơ (ergometry), và ứ đọng nước tiểu đều có thể gây tăng mức PSA ít hoặc nhiều, dài hoặc ngắn. Tác động của các yếu tố này lên mức PSA lớn nhất ở ngày tiếp sau đó và rõ rệt nhất ở những bệnh nhân phì đại tuyến tiền liệt. Do mức độ gây ra các biến đổi như thế không thể đoán trước được cho từng cá thể, cho nên cần lấy máu làm xét nghiệm PSA hoặc một ngày trước, hoặc 1 tuần lễ sau các thăm khám như thế. Hai ứng dụng chính của thử nghiệm PSA là:
Giám sát diễn biến và đáp ứng với điều trị của ung thư tuyến tiền liệt.
Giám sát các bệnh nhân bị phì đại tuyến tiền liệt nhằm phát hiện sự có mặt của ung thư tuyến tiền liệt khi thật sớm có thể được.
Các nghiên cứu gần đây gợi cho thấy rằng PSA thích hợp cho sàng lọc phát hiện ung thư tuyến tiền liệt ở những người đàn ông trên 50 tuổi. Động học của PSA cho thông tin quan trọng hơn so với các giá trị đơn lẻ.
Thyroglobulin (Tg)
Thyroglobulin là một glucoprotein của tuyến giáp. Trong UTTG, Tg được coi như một chất chỉ điểm về sự tồn tại của mô giáp bình thường hoặc mô giáp bệnh lý (ung thư giáp tái phát, di căn…).
Định lượng Tg trong huyết thanh thường được tiến hành cho các bệnh nhân UTTG thể biệt hoá. UTTG thể tuỷ và thể không biệt hoá không tiết Tg. Trong trường hợp này cần định lượng calcitonin phối hợp với các KN ung thư phôi thai để phát hiện, chẩn đoán và theo dõi.
Nồng độ Tg cao ở những bệnh nhân UTTG thể nang và thấp ở thể nhú. Có thể thấy nồng độ Tg tăng ở một số trường hợp bệnh tuyến giáp không ung thư như Basedow, bướu giáp đơn thuần, viêm tuyến giáp.
Tg và xạ hình toàn thân với 131I có giá trị đặc biệt trong đánh giá kết quả sau điều trị UTTG thể biệt hoá bằng 131I. 80-85% các trường hợp có sự phù hợp giữa kết quả định lượng Tg và xạ hình toàn thân phát hiện tái phát di căn UTTG. Sau điều trị mức Tg phải dưới 2 ng/ml. Có 15-20% không phù hợp giữa xạ hình và Tg. Có thể trên xạ hình dương tính nhưng Tg và ngược lại. Nhiều cơ sở YHHN tiến hành điều trị lại bằng 131I khi Tg tăng cao trên 10ng/ml (có cơ sở điều trị lại khi Tg trên 5ng/ml). Liều điều trị 131I có thể làm giảm nồng độ Tg ở phần lớn bệnh nhân có nghi ngờ tái phát do di căn. Nồng độ Tg cao ở những bệnh nhân có di căn xa, còn di căn hạch thì Tg thấp hơn.
CA-125 trong ung thư buồng trứng
CA-125 không có ý nghĩa sàng lọc ung thư buồng trứng vì nhiều lý do. Trước hết, ở giai đoạn I của bệnh, CA-125 chỉ tăng ở 50% bệnh nhân. Hơn nữa, còn thấy CA-125 tăng ị một số bệnh ung thư biểu mô biệt hóa giống ung thư tuyến và một số bệnh lý khác như viêm niêm mạc tử cung, viêm các thành phần trong khung chậu, kén buồng trứng, 3 tháng đầu tiên của thai kỳ, phụ nữ có kinh nguyệt, bệnh lý gan…
CA-125 có giá trị trong tiên lượng bệnh trong ung thư buồng trứng. Những trường hợp điều trị hóa chất, nếu nồng độ CA-125 dưới 10U/ml, thời gian sống thêm trung bình là 60 tháng; nếu nồng độ CA-125 trên 100U/ml, thời gian sống thêm trung bình chỉ có 7 tháng. Tuy nhiên, CA-125 có giá trị tiên lượng hạn chế ở những trường hợp ung thư buồng trứng giai đoạn sớm.
CA-125 rất có giá trị trong đánh giá đáp ứng với điều trị, đặc biệt ở bệnh nhân đã được phẫu thuật triệt để.
CA27-29 và CA15 -3 trong ung thư vú
CA27-29 và CA15-3 có giá trị theo dõi đánh giá đáp ứng với điều trị. Độ nhạy của CA15-3 cao hơn so với CA27-29. Ở những bệnh nhân trị liệu hormon, một số trường hợp bệnh tiến tiến triển rất nhanh trong vòng vài tuần hoặc vài tháng, đồng thời nồng độ các dấu ấn ung thư tăng cao. Vai trò của các dấu ấn nói trên rất quan trọng để xác định thể bệnh này. Vì những bệnh nhân này đáp ứng điều trị tốt nên không cần thay đổi phác đồ điều trị.
Theo dõi nồng độ CA27-29 và CA15-3 giúp chẩn đoán sớm sự tái phát của bệnh. Nồng độ 2 loại dấu ấn này tăng lên có thể phát hiện trước khi có triệu chứng lâm sàng nhiều tháng.
hCG (Human chronic gonadotropin) trong ung thư tinh hoàn
hCG và AFP (Alpha fetoprotein) không có giá trị sàng lọc ung thư tinh hoàn vì chưa đến 20% bệnh nhân ở giai đoạn I của bệnh có tăng nồng độ 2 dấu ấn này.
Tế bào không sinh tinh sản xuất AFP và hCG, nên nồng độ 2 dấu ấn này tăng giúp chẩn đoán ung thư tinh hoàn týp tế bào không sinh tinh. Chỉ có 15% ung thư tế bào sinh tinh có tăng hCG. Tuy vậy, nồng độ AFP và hCG cũng tăng trong ung thư tế bào trung gian không biệt hóa của tuyến tùng, trung thất, sau phúc mạc. hCG tăng nhưng ở nồng độ thấp trong ung thư phổi, ung thư vú, dạ dày. Vì vậy, hCG ít giá trị chẩn đoán trong ung thư tế bào mầm.
Nồng độ AFP và hCG tăng ở phần lớn bệnh nhân ung thư tế bào không sinh tinh, vì vậy 2 dấu ấn này có giá trị trong theo dõi đáp ứng với điều trị và đánh giá ung thư tái phát. Khi điều trị hóa chất có hiệu quả, nồng độ hCG giảm một nửa trong 3 ngày đầu, nồng độ AFP giảm một nửa trong 7 ngày đầu. Nếu nồng độ 2 dấu ấn này không giảm chứng tỏ điều trị không hiệu quả. Những trường hợp nồng độ các dấu ấn không giảm hoặc giảm ít, cần chỉ định hóa trị liệu tấn công. Những trường hợp nồng độ dấu ấn quá cao ở thời điểm chẩn đoán, chúng chỉ giảm về bình thường sau 1 – 2 tháng điều trị. 1/3 trường hợp bệnh vẫn tiến triển mặc dù nồng độ dấu ấn đã về bình thường.