Máy cobalt-60
Nguồn Cobalt-60 phát tia gamma 1,25 MeV. T = 5,26 năm.
Ứng dụng sớm, từ những năm 1950.
Đến nay các nước tiên tiến không dùng Cobalt nữa.
Máy gia tốc tuyến tính (linac)
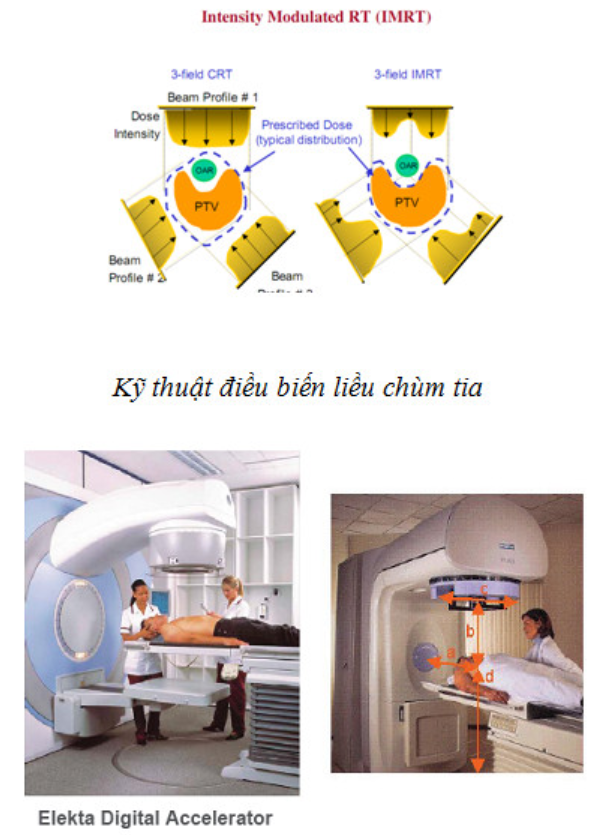
LINAC phát 2 loại bức xạ: chùm hạt electron được gia tốc trực tiếp và chùm photon tia X được tạo ra do điện tử đập vào đối âm cực. Năng lượng của chùm tia có rất nhiều mức khác nhau, từ 3MeV đến 15 MeV, 18MeV…Máy hiện đại có ống định hướng chùm tia (collimator) đa lá (Multi Leaf Collimator – MLC) với sự điều khiển tự động của máy tính, cho phép thực hiện được các kỹ thuật điều trị điều biến liều (Intensity Modulated Radiation Therapy -IMRT). IMRT là một kỹ thuật hiện đại trong điều trị UT, liều xạ được phân bố tối đa theo hình dạng khối u được hạn chế tối thiểu ở tổ chức lành xung quanh.
Dao gamma và dao tia x
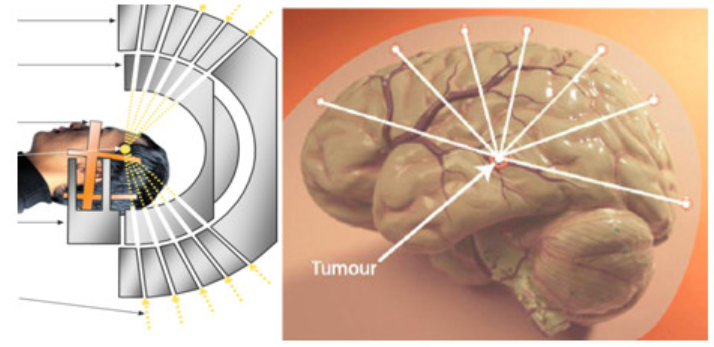
Về thiết bị, dao gamma (gammaknife) và dao tia X (cyberknife) được ứng dụng ngày càng rộng rãi và hiệu quả. Dao tia X thực chất là một máy gia tốc LINAC năng lượng 6 MeV được gắn trên một tay robot 6 khuỷu rất linh động, có thể tạo ra chùm tia hội tụ với tâm điểm là khối u. Còn dao gamma sử dụng bức xạ tia gamma của nguồn Co-60. Dao gamma cổ điển sử dụng 201 nguồn Co-60 sắp xếp trên một mũ chụp hình cầu có các collimator định hướng. Nhờ kỹ thuật định vị không gian 3 chiều, thiết bị này đem lại độ chính xác cao, hiệu quả điều trị tốt và an toàn.
Nguyên lý hoạt động của dao gamma khá đơn giản. Sau khi xác định được điểm cần phẫu thuật, dựa vào chụp cắt lớp mô phỏng định vị khối u, sau đó sẽ dùng chính tia GAMMA (nhiều tia xuất phát từ các vị trí khác nhau xung quanh hộp sọ cùng chiếu một lúc và các tia này sẽ hội tụ vào đúng vị trí u đã được định vị). Vì vậy điểm tập trung các tia này có độ lớn tổng hợp sẽ phá hủy và tiêu diệt khối u mà vùng não xung quanh hầu như không bị tổn thương. Bởi vì các tia riêng lẻ có liều hấp thụ nhỏ hơn rất nhiều so với phương pháp chiếu tia gamma thông thường. Đó là ưu điểm nổi bật so với mổ mở.
Bệnh nhân được gây mê trong khi một bộ phận đặc biệt sẽ giữ cho đầu được hoàn toàn cố định. Sau đó từ hình ảnh MRI, CT hay X-Quang có chất cảng quang, ví trị được xác định và kết quả được gửi cho hệ thống chương trình của dao gamma. Những người điều trị sử dụng chương trình máy tính để thiết lập chính xác dựa trên mối quan hệ giữa vùng tổn thương và các cấu trúc xung quanh để dao gamma điều trị có kết quả nhất. Nhà vật lý và người điều trị thường xem xét, tinh chỉnh nhiều lần cho đến khi đạt được phương án tối ưu nhất. Đồng thời lựa chọn liều chiếu tối ưu nhất.
Sử dụng hệ thống định vị 3 chiều trong việc lập kế hoạch điều trị. Khung định vị này sẽ đảm bảo độ chính xác cho dao gamma khi được kích hoạt. Quá trình điều trị kéo dài từ vài phút đến vài giờ tuỳ theo yêu cầu về liều chiếu và hình dạng của mụch tiêu cần điều trị. Bệnh nhân khộng hề cảm thấy sự có mặtcủa tia bức xạ. Sau khi điều trị khung định vị sẽ được lấy ra khỏi người bệnh.
Hệ gamma quay cũng dựa theo nguyên lý dao gamma cổ điển nhưng thay cho mũ collimator cố định là hệ thống collimator quay quanh đầu. Hệ thống xạ phẫu gamma quay sử dụng bộ điều khiển đồng tâm (isocenter) được tạo bởi 30 nguồn phóng xạ Co-60. Nhờ bộ collimator quay mà hệ gamma quay không đòi hỏi phải chụp mũ và cố định mũ định hướng. Với hệ thống gamma quay, suất liều tại các điểm đồng tâm có thể đạt 3Gy/phút với độ lệch vị trí
Để đạt được liều đủ lớn ở điểm hội tụ và liều cực tiểu tới các mô lành xung quanh, các chùm tia gamma phát ra từ các nguồn phải mảnh và hội tụ tốt. Vì vậy, về nguyên tắc chỉ nên dùng dao gamma để tiêu diệt các khối u có kích thước nhỏ, thường dưới 5cm.
Tia gamma có thể tiêu diệt được hầu hết các loại khối u trong hộp sọ tuỳ vào liều tia xạ. Tuy nhiên, để không gây tổn thương các tổ chức lành xung quanh, liều chiếu phải được hạn chế. Đến nay người ta đã thống nhất các chỉ định điều trị bằng dao gamma cho các trường hợp sau đây:
Các khối u di căn vào não, điều trị bằng dao gamma đạt hiệu quả tốt.
U màng não ở các vị trí khác nhau, đặc biệt là vùng không can thiệp được bằng phẫu thuật hoặc phẫu thuật gây ra nhiều biến chứng như: u ở vùng rãnh trượt (Cluvis), u góc cầu tiểu não, u gần các mạch máu lớn, u ở phần ba trong cánh nhỏ xương bướm.
U thần kinh đệm độ I, II, III.
U tuyến yên, đặc biệt là những khối u xâm lấn vào tổ chức xung quanh như động mạch cảnh, xoang tĩnh mạch, mổ hở không lấy được hết u.
U sọ hầu thể đặc.
U vùng tuyến tùng như: u tế bào mầm, u màng não, u thần kinh đệm.
U dây thần kinh số V, số VIII, u dây thần kinh hỗn hợp…
Các khối di dạng mạch máu não…
CyberKnife được giáo sư John R. Adler thuộc Khoa Phẫu thuật thần kinh và Xạ phẫu ung bướu của Đại học Stanford (Mỹ) phát minh năm 1994. Sau nhiều lần được cải tiến, năm 2001 CyberKnife được Cục Quản lý Dược – Thực phẩm Hoa Kỳ cấp phép lưu hành. Tại Mỹ, ban đầu CyberKnife được dùng trong điều trị u não, sau đó ung thư phổi, tiếp đến là ung thư cổ, đầu, tuyến tụy… Sau gần 10 năm, đến nay đã có hàng trăm trung tâm ứng dụng công nghệ CyberKnife trên thế giới, như ở Nhật, Malaysia, Đức, Anh, Ý… Ước tính hơn 40.000 bệnh nhân toàn cầu đã được điều trị ung thư bằng phương pháp tân tiến này.
Phạm vi điều trị
Các khối u ác tính
Nguyên phát (não, phổi, gan, tụy…)
Di căn (não, phổi, gan…)
Các u lành tính
U dây thần kinh thính giác
U sọ hầu
U tế bào Schwan
U màng não
U tuyến yên
Các dị dạng mạch máu
Dị dạng động tĩnh mạch (AVM’s)
U máu thể hang (Cavernous)
Các rối loạn chức năng
U dây V
Các khối u và tổn thương ngoài sọ
Nền sọ
Cổ
Cột sống
Tụy
Gan
Phổi
Các khối u, tổn thương khác trong cơ thể khi có chỉ định
Ưu điểm
Là phương pháp điều trị không dùng dao kéo
Độ chính xác dưới milimet
Không cần khung cố định, định vị
Ít tai biến, biến chứng
Cải thiện chất lượng cuộc sống
Điều trị ngoại trú
Phục hồi nhanh
Không đau
Không chảy máu
Không dao mổ
Không cạo tóc
Quy trình điều trị
Tạo khuôn cố định bệnh nhân (mặt nạ mềm, đệm xốp…) và đặt 5-6 hạt vàng nhỏ vào cơ thể (với điều trị ngoài sọ)
Chụp CT đa lát (theo tiêu chuẩn CyberKnife) và chụp thêm MRI/PET/Angio nếu cần
Lập kế hoạch và tối ưu hóa kế hoạch điều trị
Điều trị: Tùy theo tính chất của khối u có thể tiến hành điều trị từ 1-5 lần, mỗi ngày 1 lần, mỗi lần khoảng 30-90 phút
Theo dõi sau điều trị: chụp MRI để kiểm tra sau xạ phẫu 3, 6, 12, 24… tháng
|
Trước điều trị |
Sau 4 tháng |
Sau 10 tháng |
Bệnh nhân u tế bào sao được xạ phẫu 16Gy
|
Trước xạ phẫu |
Sau xạ phẫu 10 tháng |
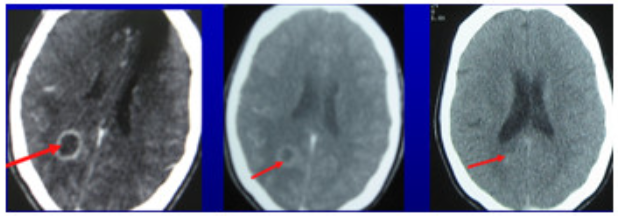
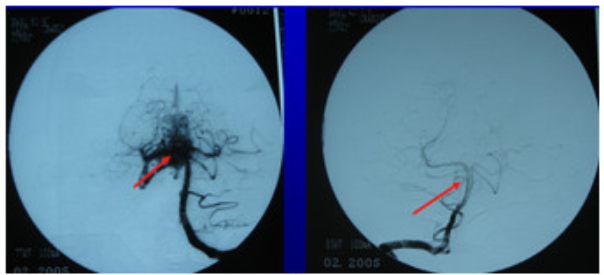
Khối dị dạng mạch máu não biến mất sau xạ phẫu 20Gy
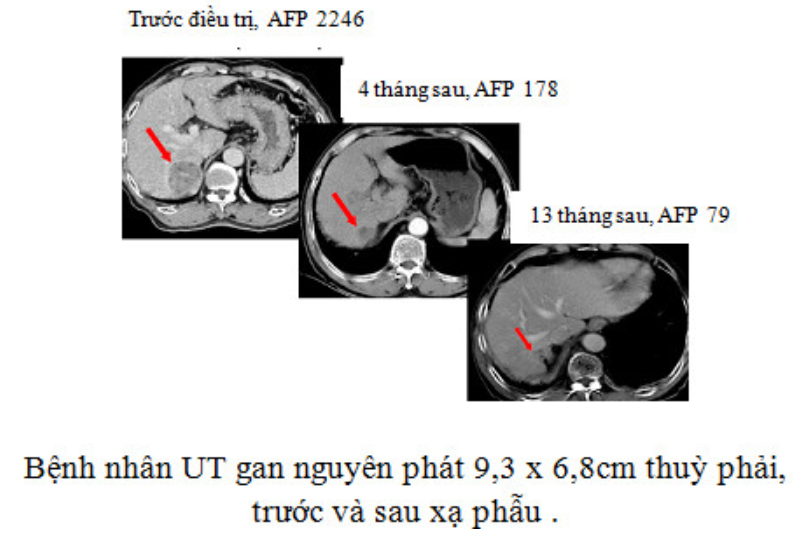
Dao tia X ngoài những chỉ định như dao gamma, do có năng lượng lớn hơn nên còn có chỉ định xạ phẫu cho cả u ngoài não như u gan, u phổi…
Gần đây một số công nghệ mới điều trị UT bằng bức xạ Proton, Neutron nhanh, Neutron chậm và Neutron bắt nguyên tố Boron, bằng các hạt nặng đã được ứng dụng. Các thiết bị này đều có ưu điểm là chùm hạt có năng lượng lớn, lên đến hàng trăm MeV, tuân theo hiệu ứng đỉnh Bragg, nghĩa là giải phóng năng lượng ở cùng một độ sâu trong mô; điều đó cho phép tạo ra năng lượng cực đại tại khối ung thư, trong khi đó ở các mô lành lân cận liều chiếu lại rất thấp, điều đó sẽ đưa lại hiệu quả điều trị khỏi bệnh và giảm thiểu được các biến chứng do tia xạ gây nên.
Cùng với các thế hệ máy xạ trị, các công cụ hỗ trợ cũng lần lượt ra đời giúp cho việc điều trị được tối ưu hoá, đạt hiệu quả cao nhưng lại giảm thiểu được các biến chứng trong điều trị như:
Lập kế hoạch điều trị theo không gian 3 chiều (3D).
Mô phỏng bằng máy CT.
Các thiết bị chụp phim điện tử kiểm tra trong điều trị.