Douglas A. Simonetto, Laura Piccolo Serafim, Alice Gallo de Moraes, Ognjen Gajic and Patrick S .Kamath
Nhiễm trùng huyết ở bệnh nhân xơ gan có liên quan đến tỷ lệ tử vong cao. Đáp ứng miễn dịch suy giảm là nguyên nhân làm tăng nguy cơ nhiễm trùng ở những bệnh nhân này. Những thay đổi về huyết động và hệ thống gợi ý nhiễm trùng huyết có thể được quan sát thấy ở bệnh nhân xơ gan khi không có nhiễm trùng; do đó, chẩn đoán và điều trị nhiễm trùng huyết có thể bị trì hoãn. Việc quản lý điều trị tối ưu bệnh nhân nặng bị nhiễm trùng huyết và xơ gan chưa được thiết lập tốt và thường được ngoại suy từ các hướng dẫn đồng thuận và các khuyến nghị của chuyên gia về quản lý bệnh nhân không xơ gan có nhiễm trùng huyết. Mặc dù thiếu bằng chứng mạnh mẽ, chúng tôi đề xuất một cách tiếp cận thực dụng hiện đại để quản lý điều trị nhiễm trùng huyết ở bệnh nhân xơ gan, bao gồm lựa chọn dịch truyền, thuốc vận mạch và kháng sinh.
Giới thiệu
Nhiễm trùng huyết là một phần của phổ bệnh từ nhiễm trùng đến sốc nhiễm trùng và vẫn là một vấn đề chăm sóc sức khỏe lớn trên toàn thế giới.
Xơ gan được xác định là một yếu tố nguy cơ tử vong độc lập ở bệnh nhân sốc nhiễm trùng (tỷ lệ chênh = 2,5 [2,3; 2,8]) (1) Sự phát triển của nhiễm trùng huyết ở bệnh nhân xơ gan làm tăng đáng kể tỷ lệ tử vong ngắn và dài hạn. (2) Những thay đổi về huyết động và miễn dịch toàn thân được quan sát thấy ở xơ gan có thể ảnh hưởng đến kết quả và do đó cả điều trị của nhiễm trùng huyết và sốc nhiễm trùng. (3) Trong khi việc chăm sóc bệnh nhân nặng bị nhiễm trùng huyết đã được thiết lập tốt trong nhóm dân số nhiễm trùng huyết nói chung, (4) có rất ít nghiên cứu trên bệnh nhân xơ gan. Mặc dù kết quả cải thiện của bệnh nhân xơ gan và sốc nhiễm trùng trong những thập kỷ qua, tỷ lệ tử vong tại đơn vị chăm sóc đặc biệt (ICU) vẫn cao, tới 65%. (5)
Định nghĩa
Các định nghĩa được chấp nhận rộng rãi là quan trọng để quản lý và nghiên cứu nhiễm trùng huyết. Người ta nhận thấy rằng tiêu chí hội chứng đáp ứng viêm hệ thống (SIRS), (6) trước đây được sử dụng để chẩn đoán nhiễm trùng huyết, có thể được đáp ứng ngay cả khi không có nhiễm trùng huyết, và ý nghĩa tiên lượng của nó vẫn chưa rõ ràng. Do đó, vào năm 2016, một nhóm các chuyên gia mới được triệu tập bởi Hiệp hội Y học Chăm sóc tích cực Châu Âu và Hoa Kỳ đã định nghĩa nhiễm trùng huyết là “rối loạn chức năng cơ quan đe dọa tính mạng do phản ứng của vật chủ bị rối loạn điều chỉnh đối với nhiễm trùng.” Rối loạn chức năng cơ quan được định nghĩa là sự gia tăng điểm số Sequential Organ Failure Assessment (SOFA) ≥ 2 điểm (Bảng 1). Cuối cùng, sốc nhiễm trùng được xác định bởi nhu cầu sử dụng thuốc vận mạch để duy trì áp lực động mạch trung bình (MAP) ≥ 65 mm Hg và mức lactate huyết thanh > 2 mmol / L. (1)
Điều quan trọng là vẫn còn những hạn chế liên quan đến việc chẩn đoán các hội chứng này. Đầu tiên, các bác sĩ lâm sàng không có hiểu biết đầy đủ về quá trình viêm trong quá trình phát triển của nhiễm trùng huyết (Hình 1); thứ hai, không có tiêu chí lâm sàng, sinh học, hình ảnh hoặc xét nghiệm đơn giản và rõ ràng nào xác định riêng một bệnh nhân nhiễm trùng huyết với mức độ tin cậy cao.
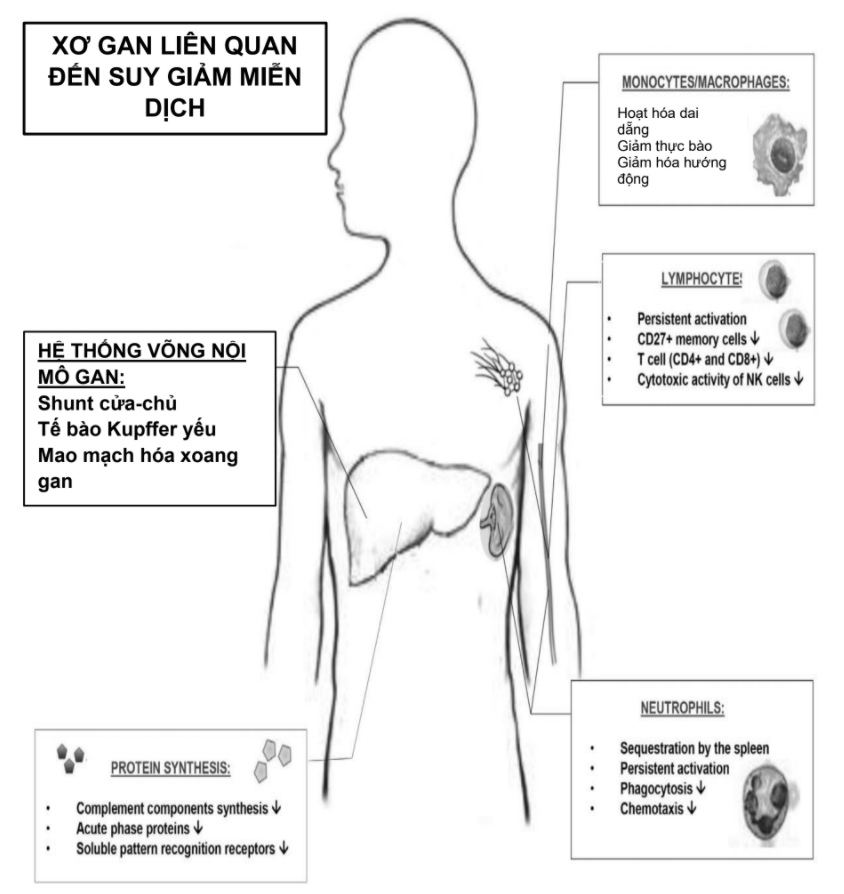
Xơ gan là một yếu tố nguy cơ độc lập của nhiễm trùng huyết và tử vong liên quan đến nhiễm trùng huyết. (7-9) Các tiêu chuẩn chẩn đoán trước đây và hiện tại cho nhiễm trùng huyết và sốc nhiễm trùng bao gồm những thay đổi sinh lý thường thấy ở bệnh nhân xơ gan tại mức nền, làm giảm độ chính xác của chẩn đoán nhiễm trùng huyết ở những bệnh nhân này . Giảm số lượng bạch cầu do cường lách, nhịp tim nền nhanh thứ phát do tăng tuần hoàn và tăng thông khí do bệnh não gan (HE) ảnh hưởng đến khả năng áp dụng các tiêu chuẩn SIRS trong dân số này (10) (Hình 2 và Bảng 2). Bất chấp những lo ngại này, sự hiện diện của hai hoặc nhiều tiêu chí SIRS có liên quan đến kết quả kém ở bệnh nhân xơ gan. (11)
Sự phát triển của nhiễm trùng huyết ở bệnh nhân xơ gan có thể dẫn đến rối loạn chức năng gan cấp tính, một tình trạng được xác định là suy gan cấp tính trên mãn tính (ACLF) đã được mô tả là ” một hội chứng xảy ra trên bệnh nhân có bệnh gan mãn đã được hay không được chẩn đoán xơ gan trước đó vớiđặc trưng tình trạng mất bù cấp tính ở gan dẫn đến suy gan (vàng da và kéo dài thời gian prothrombin) và một hoặc nhiều suy cơ quan ngoài gan có liên quan đến tăng tỷ lệ tử vong trong vòng 28 ngày và đến 3 tháng kể từ khi khởi phát”.(13 , 14) Nhiễm trùng huyết là một yếu tố thúc đẩy quan trọng của ACLF, chiếm khoảng 25% – 30% các trường hợp. (15,16) Đánh giá suy cơ quan bằng điểm SOFA (Bảng 1), theo định nghĩa mới về nhiễm trùng huyết, không giải thích cho yếu tố liên quan đến bệnh gan mãn tính, bao gồm giảm tiểu cầu, HE và MAP thấp. Một hệ thống cho điểm điều chỉnh các yếu tố này ở bệnh nhân ACLF gần đây đã được đề xuất (17); tuy nhiên, nó vẫn chưa được xác nhận để chẩn đoán nhiễm trùng huyết ở bệnh nhân xơ gan. Hơn nữa, nồng độ lactate huyết thanh được cho là sẽ cao hơn ở bệnh nhân xơ gan, do khả năng thanh thải lactate ở gan bị suy giảm.(18)
|
Bảng 1. Điểm SOFA |
||||
|
|
1 |
2 |
3 |
4 |
|
Bilirubin (mg%) |
1.2- 1.9 |
2.0 – 5.9 |
6.0 – 11.9 |
≥ 12.0 |
|
Creatine (mg%) |
1.2- 1.9 |
2.0 – 3.4 |
3.5 – 4.9 Nước tiểu |
≥ 5.0 hay |
|
GSC |
13-14 |
10 -12 |
6 – 9 |
≤ 6 |
|
Tiểu cầu x 103 |
||||
|
MAP (mmHg) |
Dopamine ≤5 dobutamine# terlipressin |
Dopamine >5 epinephrine ≤0.1# norepinephrine ≤0.1# |
Dopamine >15 epinephrine >0.1# norepinephrine >0.1# |
|
|
PaO2/FiO2 |
||||
*Bệnh nhân thở máy. # Dùng ít nhất 1 giờ
|
Bảng 2. Các thay đổi sinh lý ở bệnh nhân xơ gan và tiêu chuẩn SIRS |
||||
|
|
Nhiệt độ |
Nhịp tim |
Nhịp thở |
Bạch cầu máu |
|
SIRS |
> 380C hay |
> 90 lần/phút |
> 20 lần/ phút Hay PaCO2 mmHg |
> 12000 hay |
|
Đặc điểm nền của xơ gan |
Mất điều hòa nhiệt độ (có thể không sốt) |
Nhịp tim nhanh (tăng động tuần hoan) |
Thở nhanh (bệnh não gan/ cổ trướng) |
Giảm bạch cầu (cường lách) |
Điều trị ban đầu bệnh nhân xơ gan có nhiễm trùng huyết
Tương tự như những bệnh nhân không bị xơ gan, việc sử dụng sớm kháng sinh, dịch truyền, thuốc vận mạch và kiểm soát nguồn nhiễm là nền tảng của việc xử trí nhiễm trùng huyết. Các phương thức nhằm điều trị bệnh gan tiềm ẩn sẽ không được thảo luận ở đây.
Theo dõi huyết động
Mục tiêu của hồi sức truyền dịch là sớm phục hồi tưới máu để ngăn ngừa và hạn chế rối loạn chức năng cơ quan đích. Trong vài năm, phác đồ điều trị hướng tới mục tiêu sớm (EGDT) (19) đã được chấp nhận rộng rãi như là tiêu chuẩn vàng để xử trí ban đầu sốc nhiễm trùng. Tuy nhiên, các thử nghiệm ngẫu nhiên lớn, đa trung tâm gần đây không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong giữa EGDT và chăm sóc thông thường. (20,21) Cần phải nhấn mạnh rằng chỉ có một số ít bệnh nhân được đưa vào các nghiên cứu này bị xơ gan. Hiện nay, chiến lược được chấp nhận nhiều nhất để xử trí nhiễm trùng huyết sớm là sự kết hợp giữa EGDT và các thông số sinh lý, chẳng hạn như lượng nước tiểu, độ thanh thải lactate và sử dụng kháng sinh, trong vòng 1 giờ sau khi tiếp cận bệnh nhân. (20,22,23). Một điều quan trong được nhấn mạnh là tất cả những thông số nền của các vấn đề trên thường bất thường ở bệnh nhân xơ gan, và các tiêu chí tối ưu cho hồi sức ở nhóm bệnh nhân này vẫn chưa được xác định.
Giảm trương lực mạch máu và tăng động tuần hoàn, đặc điểm của xơ gan tiến triển, dẫn đến chỉ số tim cao, sức cản mạch hệ thống thấp, MAP thấp hơn và độ bão hòa oxy tĩnh mạch trung tâm cao hơn. (18,24) Ở bệnh nhân xơ gan, áp lực tĩnh mạch trung tâm (CVP) có thể phản ánh tăng áp lực trong ổ bụng, và các phép đo tĩnh chỉ có thể gây hiểu nhầm khi đánh giá tình trạng thể tích. Hệ thống đo áp suất ổ bụng (áp suất bàng quang) gần đây không khuyến cáo để xác định nhu cầu chọc dẫn lưu dịch báng. Thay vào đó, một phương pháp chọc dịch báng điều trị nên được xem xét dựa trên các kết quả khám thực thể về cổ trướng .. to hoặc căng. (28) Ở bệnh nhân không cổ trướng, sự thay đổi IVC theo nhịp hô hấp được xem xét là cách chính xác đánh giá cho sự đáp ứng với dịch truyền. Thay đổi > 12% -18% ở bệnh nhân thở máy và > 40% ở bệnh nhân thở tự nhiên, và sự gia tăng thời gian vận tốc đường ra thất trái tích hợp > 12% khi nâng chân thụ động, (29) có thể giúp phân biệt bệnh nhân nào đáp ứng với dịch truyền. Hơn nữa, các bất thường về chuyển động thành và đường kính thất trái tâm trương và tâm thu nhỏ có thể là dấu hiệu của giảm thể tích tuần hoàn, và các phép đo nối tiếp các thông số này có thể hữu ích trong việc theo dõi dịch truyền.(30) Hiện nay, sử dụng siêu âm tim để hướng dẫn hồi sức dịch được khuyến cáo ở bệnh nhân nhiễm trùng huyết (29); tuy nhiên, vai trò của các thông số này ở bệnh nhân xơ gan vẫn chưa được xác định. Việc sử dụng chỉ số đè sụp IVC ở bệnh nhân xơ gan có thể đặc biệt khó khăn do áp lực ổ bụng tăng lên ở bệnh nhân cổ trướng thể tích lớn, trong đó đường kính IVC có thể giảm giả và có thể xẹp.(31) Vì vậy, các thông số siêu âm tim nên được đánh giá một cách lý tưởng là sau khi chọc tháo dịch báng để có kết quả đáng tin cậy hơn.
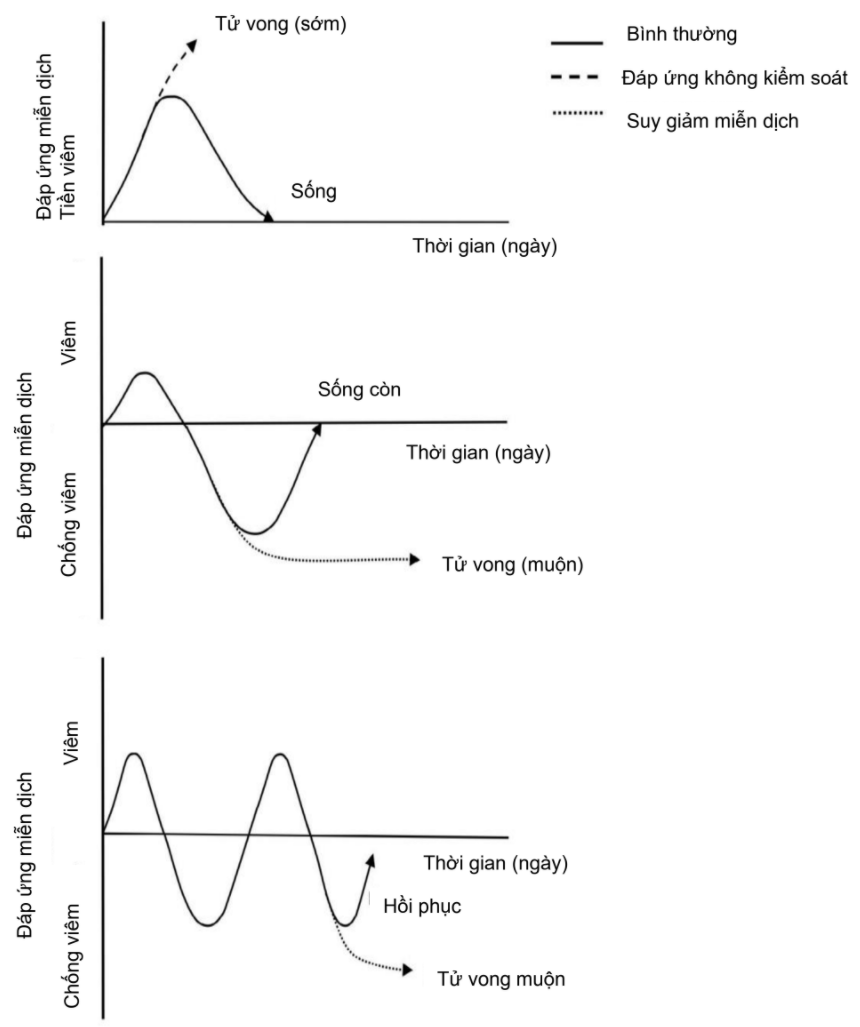
Hình. 1. Phản ứng miễn dịch của vật chủ đối với nhiễm trùng huyết. Hệ thống viêm và kháng viêm được kích hoạt đồng thời trong nhiễm trùng huyết. Ban đầu, một giai đoạn viêm rõ rệt phát triển sau đó là hồi phục hoặc phản ứng không kiểm soát được và tử vong sớm. Tình huống thứ hai bao gồm một giai đoạn viêm khiêm tốn hơn, sau đó là một phản ứng chống viêm mạnh mẽ dẫn đến hồi phục hoặc nhiễm trùng thứ phát và tử vong. Có thể quan sát thấy mô hình chu kỳ giữa các trạng thái viêm và chống viêm, đặc biệt là ở những bệnh nhân xơ gan có nhiễm trùng huyết, do suy giảm miễn dịch cơ bản.
Hình. 2. Các cơ chế liên quan đến rối loạn chức năng miễn dịch liên quan đến xơ gan.
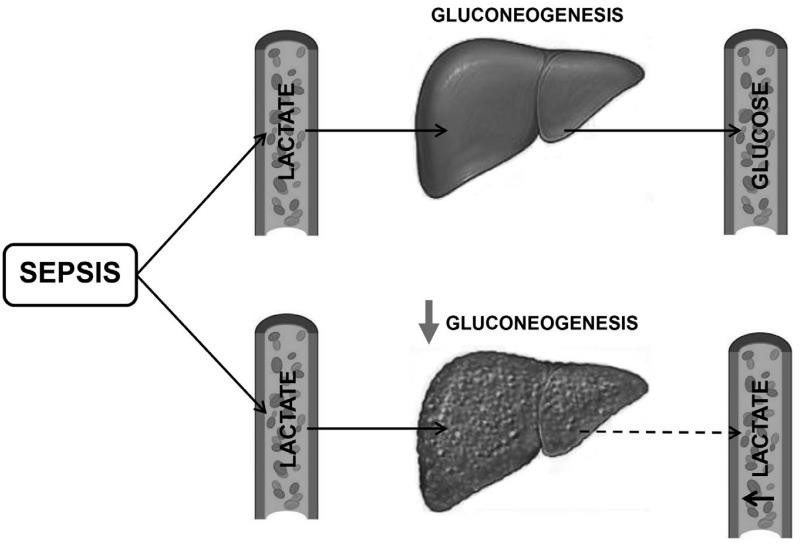
Lactate huyết thanh thường được sử dụng như một dấu hiệu gián tiếp của tình trạng thiếu oxy mô trong nhiễm trùng huyết và hiện là một phần của định nghĩa sốc nhiễm trùng. Sự chuyển hóa lactate ở gan thường bị suy giảm ở bệnh nhân xơ gan, và nồng độ lactate trong huyết thanh nên được giải thích một cách thận trọng ở nhóm đối tượng này (18,32) (Hình 3). Các phép đo lactate nối tiếp có khả năng cung cấp nhiều thông tin hơn và xu hướng có thể tương quan tốt hơn với tỷ lệ sống còn. Tuy nhiên, một điều quan trọng cần được nhấn mạnh là một sự gia tăng lactate (> 2 mmol/l) ở bệnh nhân xơ gan có huyết động không ổn định sẽ được cho là do sốc nhiễm trùng cho đến khi chứng minh ngược lại. Các dấu hiệu bổ sung về tình trạng thiếu oxy mô, bao gồm thang điểm da nổi bông (điểm ≥2) và độ bão hòa oxy mô (StO2 đầu gối
Hình. 3. Suy giảm chuyển hóa lactate trong bệnh xơ gan. Gan có vai trò trung tâm trong việc thanh thải lactate thông qua quá trình tạo tân tạo đường (gluconeogenesis). Do đó, những bệnh nhân bị rối loạn chức năng gan có thể có biểu hiện tăng nồng độ lactat trong huyết thanh, đặc biệt trong các tình trạng liên quan đến suy giảm oxy hóa mô và tăng đường phân kỵ khí như nhiễm trùng huyết.
Áp dụng phác đồ các gói xử lý nhiễm trùng huyết, theo hướng dẫn dựa trên bằng chứng của Chiến dịch nhiễm trùng huyết sống sót (SSC), (35) không được tìm thấy để cải thiện khả năng sống sót ở bệnh nhân xơ gan có sốc nhiễm trùng. (36) Mặc dù điều này chỉ được đánh giá trong một nghiên cứu quan sát nhỏ, kết quả này cho thấy sự cần thiết phải đánh giá lại các mục tiêu hồi sức sớm ở nhóm bệnh nhân này. Các khuyến nghị thống nhất từ một hội đồng chuyên gia quốc tế về quản lý bệnh nhân xơ gan bị bệnh nặng cho thấy mục tiêu MAP thấp hơn ở bệnh nhân xơ gan ≥ 60 mm Hg, thay vì 65 mm Hg. Nhóm không đề xuất bất kỳ mục tiêu cụ thể nào về áp suất, thể tích, lactate, hoặc ScvO2 làm đầy tâm thất. (27)
Các khuyến nghị đồng thuận bao gồm việc đặt đường theo dõi huyết áp động mạch xâm lấn và tĩnh mạch trung tâm ở bệnh nhân sốc tuần hoàn, và sử dụng catheter động mạch phổi (PAC) hoặc siêu âm tim để theo dõi trong quá trình hồi sức bằng dịch. Hơn nữa, PAC có thể được chỉ định ở những bệnh nhân bị rối loạn chức năng thất phải hoặc tăng áp động mạch phổi để được hướng dẫn điều trị. (27) Điều quan trọng là phải chỉ ra rằng tất cả các phương thức này đều có những hạn chế của chúng: Siêu âm tim là một kỹ thuật phụ thuộc nhiều vào người vận hành và nó không cho phép theo dõi liên tục, trong khi PAC thể hiện những rủi ro cố hữu của một phương pháp xâm lấn ở một nhóm dân số dễ bị nhiễm trùng và biến chứng chảy máu và hiện nay thường không được ưa chuộng. (37)
Cuối cùng, lượng nước tiểu được sử dụng để đánh giá ban đầu về tình trạng thể tích, nhưng điều quan trọng là phải nhận ra rằng thiểu niệu có thể là dấu hiệu duy nhất của rối loạn chức năng thận ở bệnh nhân xơ gan. Nồng độ creatinin huyết thanh thường đánh giá thấp rối loạn chức năng thận trong bệnh xơ gan vì tỷ lệ giảm khối cơ xương và suy dinh dưỡng cao trong dân số này. (27).
Hồi sức dịch truyền
Truyền dịch là một bước quan trọng trong quản lý nhiễm trùng huyết, nhằm mục đích ngăn ngừa tình trạng thiếu oxy mô và bảo tồn chức năng của các cơ quan. Việc lựa chọn dịch truyền hồi sức tĩnh mạch trong ICU là một lĩnh vực đang được tranh luận. (38) Dịch truyền hồi sức lý tưởng phải dẫn đến sự gia tăng thể tích nội mạch có thể dự đoán và bền vững và chứa thành phần hóa học tương tự như thành phần hóa học của dịch ngoại bào. Thật không may, một dịch truyền lý tưởng như vậy không tồn tại.
Dịch hồi sức được lựa chọn ở bệnh nhân xơ gan có nhiễm trùng huyết vẫn còn được thiết lập. Một số nghiên cứu đã so sánh việc sử dụng nước muối bình thường (0,9% natri clorua), các chất tinh thể “cân bằng” (ví dụ, Ringer’s lactate) và/ hoặc chất keo (chẳng hạn như albumin người) trong ICU. Mặc dù các nghiên cứu riêng lẻ không chứng minh được lợi ích của albumin so với nước muối sinh lý thông thường, (39,40) các phân tích tổng hợp gần đây cho thấy tỷ lệ tử vong với albumin thấp hơn so với dạng tinh thể hoặc starches ở bệnh nhân người lớn bị nhiễm trùng huyết (41) và giảm đáng kể tỷ lệ tử vong trong 90 ngày hồi sức bằng albumin ở những bệnh nhân sốc nhiễm trùng khi so sánh với các dịch tinh thể. (42) Số bệnh nhân xơ gan trong những nghiên cứu này là nhỏ. Starches hydroxyethyl có liên quan đến việc tăng tỷ lệ điều trị thay thế thận (RRT) khi được sử dụng cho bệnh nhân nhiễm trùng huyết (43,44) và việc sử dụng nó ở bệnh nhân xơ gan không được khuyến cáo vì làm tăng nguy cơ nhiễm độc thận. (27) Truyền albumin cũng đã được có liên quan đến nguy cơ chấn thương thận cấp tính phụ thuộc vào liều lượng, và nên thận trọng để tránh truyền máu quá mức. (45)
Albumin người đã được sử dụng rộng rãi trong bệnh xơ gan và có nhiều chức năng sinh học khác nhau ngoài chức năng của một chất giãn nở huyết tương đơn giản. Bệnh nhân xơ gan thường có nồng độ albumin huyết thanh thấp và chức năng albumin bị suy giảm. (46) Truyền albumin tĩnh mạch đã được chứng minh trong một số nghiên cứu để giảm tỷ lệ tử vong trong viêm phúc mạc do vi khuẩn tự phát (47) và hội chứng gan thận (48) và cải thiện kết quả sau khi chọc tháo dịch báng lượng lớn (49) Một nghiên cứu hồi cứu so sánh sự khác biệt về khả năng sống sót của bệnh nhân xơ gan có biểu hiện sốc nhiễm trùng trước và sau năm 2005 đã chứng minh kết quả cải thiện đáng kể trong những năm gần đây. (50) Các nhà nghiên cứu ghi nhận sự gia tăng sử dụng albumin thay vì tinh thể để hồi sức dịch ban đầu trong những năm gần đây, mà họ suy đoán có thể là lời giải thích cho những kết quả tốt hơn này.
Mặc dù cho đến nay không có bằng chứng chắc chắn nào liên quan đến việc lựa chọn albumin như là dịch hồi sức được lựa chọn đầu tay ở bệnh nhân xơ gan, nhưng có ý kiến cho rằng nên kết hợp dùng albumin ở bệnh nhân xơ gan nghi ngờ nhiễm trùng, với mục tiêu 50-100 g albumin/ ngày. (27) Tuy nhiên, điều quan trọng cần nhấn mạnh là hồi sức đủ thể tích là bắt buộc trong xử trí sốc nhiễm trùng không phụ thuộc vào dịch truyền được chọn.
Các thuốc vận mạch
Hiệu quả của các loại thuốc vận mạch khác nhau ở bệnh nhân xơ gan có sốc nhiễm trùng chưa được đánh giá đầy đủ. Việc sử dụng các thuốc này dựa trên các hướng dẫn đồng thuận và khuyến cáo của chuyên gia tương tự như dân số nói chung. (51) Norepinephrine được coi là thuốc đầu tay điều trị nhiễm trùng huyết và có ít tác dụng phụ hơn so với dopamine, loại thuốc không còn được khuyến cáo. ( 52)
Tác dụng co mạch của Norepinephrine cho phép gia tăng sự hồi lưu của tĩnh mạch và do đó, cải thiện tiền tải của tim. Tác dụng của nó cũng dựa vào sự gia tăng chức năng co bóp của tim và co mạch do kích thích thụ thể beta.(53) Sử dụng kéo dài thuốc này có khả năng gây ra nhịp tim chậm, các rối loạn nhịp khác, thiếu máu cục bộ cơ tim.(53). Epinephrine hoạt động tương tự như norepinephrine, với hạn chế chính là gây ra rối loạn nhịp nhanh, thiếu máu cục bộ cơ tim, tăng áp động mạch phổi, nhiễm toan axit lactic và tăng đường huyết(54). Những tác dụng phụ này phải được xem xét một cách cẩn thận trên bệnh nhân xơ gan do tình trạng kém thanh thải lactate.(54-56) Các inotrope, như dobutamine, được khuyến cáo sử dụng trên bệnh nhân nhiễm trùng huyết khi có rối loạn chức năng cơ tim. Tuy nhiên, bệnh nhân xơ gan thường có cung lượng tim cao và không có lợi khi sử dụng nó.Tình trạng tuần hoàn tăng động có trong cả sốc nhiễm trùng và xơ gan đều có liên quan đến sự thiếu hụt vasopressin nội sinh.(57) Mặc duSC không khuyến cáo sử dụng vasopressine đơn độc hay là thuốc vận mạch đầu tay trong điều trị sốc nhiễm trùng, (27) nhưng thuốc này có thể có lợi ở những bệnh nhân bị xơ gan vì những thay đổi huyết động vốn có của bệnh, cho phép huy động các thể tích máu từ các hồ máu trong các tạng. Tác dụng ngoại ý của vasopressin bao gồm loạn nhịp tim, giảm cung lượng tim (liều cao hơn 0,4 U/ phút), và thiếu máu cục bộ mô. (54)
Xử trí tình trạng suy huyết động kháng trị, dù đã dùng thuốc vận mạch liều cao, vẫn còn nhiều tranh cãi. Một thử nghiệm ngẫu nhiên gần đây cho thấy lợi ích tiềm năng của angiotensin II trong điều trị sốc giãn mạch kháng trị.
(58) Điều quan trọng được nêu ra, tuy nhiên, nhu cần vận mạch cao hơn và tình trạng giảm albumine máu là các dấu tiên lượng đáp ứng kém của angiotensin II, và nó có thể giới hạn các lợi ích ở bệnh nhân xơ gan.
Corticoid
Suy tuyến thượng thận thường gặp ở bệnh nhân xơ gan có biểu hiện nhiễm trùng huyết và sốc nhiễm trùng, mặc dù cũng có thể xuất hiện ở bệnh nhân xơ gan ổn định hoặc xơ gan mất bù.(59,60) Trong hồi sức, thiếu hụt tuyến thượng thận liên quan đến huyết động không ổn định, giảm đáp ứng với các thuốc vận mạch, và gia tăng tử vong. (60) Cơ chế chính xác của tình trạng suy thượng thận ở bệnh nhân xơ gan cho đến nay vẫn chưa rõ, nhưng có một vài giả thuyết được đề cập đến.(60)
Trong bệnh gan, không có sự thống nhất về cách kiểm tra và đánh giá chức năng tuyến thượng thận. Vì lý do này, tỷ lệ suy tuyến thượng thận là khác nhau giữa các nghiên cứu. (60) Corticosteroid thường được sử dụng ở bệnh nhân sốc nhiễm trùng, đặc biệt là những người không đáp ứng với thuốc vận mạch. (60) Bổ sung corticosteroid dẫn đến giải quyết sốc nhanh hơn và nhu cầu thuốc vận mạch thấp hơn, trong khi ảnh hưởng của chúng đối với sự sống còn vẫn chưa được giải quyết. Một thử nghiệm lớn, đa trung tâm gần đây cho thấy hydrocortisone đơn độc không làm giảm tỷ lệ tử vong so với giả dược, trong khi một nghiên cứu khác gần đây đã chứng minh rằng kết hợp hydrocortisone với fludrocortisone có thể cải thiện thời gian sống còn 90 ngày ở bệnh nhân sốc nhiễm trùng.(62)
Tuy nhiên, hiệu quả của liệu pháp corticosteroid ở những bệnh nhân bị bệnh gan nặng vẫn còn tranh cãi. (60) Một nghiên cứu đơn trung tâm, thiết kế ngẫu nhiên đã chúng minh giảm có ý nghĩa nhu cầu thuốc vạn mạch và tỷ lệ sốc hồi phục cao hơn ở bệnh nhân xơ gan bị sốc nhiễm trùng với liều thấp hydrocortisone. (58,59) Tuy nhiên, hydrocortisone không làm giảm tỷ lệ tử vong và có liên quan đến việc tăng tái phát sốc và xuất huyết tiêu hóa. (59)
Kháng sinh
Chẩn đoán nhiễm trùng huyết trong xơ gan có thể khó khăn và cần có chỉ số nghi ngờ cao. Điều này thường dẫn đến sự chậm trễ trong việc bắt đầu sử dụng kháng sinh theo kinh nghiệm, do đó, có liên quan đến kết quả tồi tệ hơn. Vì vậy, không chỉ lựa chọn kháng sinh mà thời điểm dùng thuốc cũng rất quan trọng.
Điều trị kháng sinh nên được bắt đầu trước hoặc khi bắt đầu sốc, có thể phát triển trước khi nhập viện ICU. (63) Mỗi giờ trì hoãn điều trị kháng sinh làm tăng tỷ lệ tử vong lên 1,86 lần. (64) Các yếu tố như kiểm soát nguồn nhiễm, nhiễm trùng cộng đồng hay bệnh viện, việc sử dụng kháng sinh gần đây, hoặc tiền sử vi sinh thường trú/ nhiễm trùng bởi các tác nhân vi sinh đa kháng nên được xem xét khi lựa chọn bao phủ kháng sinh (65) (Bảng 3). ß- Lactams (ví dụ, cephalosporin thế hệ thứ ba hoặc axit amoxicillin-clavulanic) thường là những lựa chọn ưu tiên đối với các bệnh nhiễm trùng mắc phải tại cộng đồng.(66,67) Đối với nhiễm trùng mắc phải trong bệnh viện, các dạng vinh sinh đề kháng kháng sinh tại chỗ cần được tính đến khi lựa chọn kháng sinh. Kháng sinh phổ rộng, có hoạt tính chống lại cầu khuẩn đường ruột nhạy cảm với vancomycin (VSE) / cầu khuẩn ruột kháng vancomycin (VRE) và tụ cầu vàng kháng methicillin (MRSA), chẳng hạn như daptomycin và linezolid, nên được xem xét ở những bệnh nhân có nguy cơ cao. (67) Một khi nguồn nhiễm đã được xác định và các tác nhân gây bệnh đặc hiệu được xác định, liệu pháp điều trị phải được điều chỉnh cho phù hợp nhất với loại kháng sinh đơn lẻ. Những bệnh nhân không có cải thiện lâm sàng trong vòng 48-72 giờ khi điều trị kháng sinh phổ rộng nên được xem xét điều trị kháng nấm theo kinh nghiệm. Người ta đã đề xuất rằng ở những bệnh nhân nặng ổn định, nồng độ procalcitonin
Ghép gan
Nhiễm trùng huyết là nguyên nhân chính của ACLF, và ghép gan (LT) là phương pháp điều trị dứt điểm cho bệnh nhân ACLF; tuy nhiên, do sự khan hiếm của tạng hiến, điều quan trọng là phải phân biệt những người sẽ nhận được lợi ích từ biện pháp này với những người mà việc cấy ghép là vô ích. Cho đến nay, không có tiêu chuẩn xác thực nào để hủy bỏ danh sách những bệnh nhân bị bệnh nặng và quá trình này thường dựa trên cơ sở chủ quan khác nhau ở các trung tâm cấy ghép.
Hỗ trợ gan nhân tạo, chẳng hạn như Hệ thống tái tuần hoàn chất hấp phụ phân tử (MARS – Molecular Adsorbent Recirculating System), được phát triển để hoạt động như một cầu nối để cấy ghép, (71) đã không chứng minh được lợi ích sống sót ở bệnh nhân ACLF. (72) Do đó, MARS hiện không có vai trò trong quản lý bệnh nhân nhiễm trùng huyết và xơ gan.
Hiệp hội nghiên cứu bệnh gan giai đoạn cuối ở Bắc Mỹ đã đánh giá tiền cứu những bệnh nhân bị ACLF liên quan đến nhiễm trùng. Trong số những bệnh nhân được liệt kê trước đó vì LT, 42% đã bị hủy danh sách hoặc tử vong, 35% đã trải qua LT và 24% đạt được khả năng sống sót sau 6 tháng không cần cấy ghép sau khi nhập viện. Bệnh nhân có tới hai cơ quan bị suy được coi là ứng cử viên có thể chấp nhận được cho thủ thuật, trong khi có nhiều hơn hai cơ quan bị suy có liên quan đến việc loại bỏ ra khỏi danh sách chờ ghép hoặc tử vong. (73). Trong một nghiên cứu dựa trên dữ liệu CANONIC (CLIF Acute-oN-ChrONic LIver Failure in Cirrhosis), bệnh nhân ACLF độ 2 hoặc 3 trong ngày 3-7, được cấy ghép trong vòng 28 ngày sau khi chẩn đoán ACLF, cho thấy tỷ lệ sống sót sau 180 ngày là 81%, so với 10% ở những người không được cấy ghép (Bảng 4). (74)
Ở những bệnh nhân xơ gan nặng, cửa sổ xem xét LT là hẹp. Bệnh nhân bị nhiễm trùng được kiểm soát đầy đủ và rối loạn chức năng hai hoặc ít cơ quan có thể được hưởng lợi từ LT, và nên cân nhắc lựa chọn này. Bên cạnh chỉ định hỗ trợ cơ quan, mức độ nghiêm trọng và thời gian suy cơ quan là những yếu tố cần tham gia vào quá trình ra quyết định vì chúng cũng có thể ảnh hưởng đến sự thành công của LT ở những bệnh nhân này.
Tóm lại
Sự hiện diện của xơ gan làm tăng tỷ lệ tử vong chung trong nhiễm trùng huyết. Chẩn đoán nhiễm trùng huyết ở bệnh nhân xơ gan còn nhiều thách thức vì những thay đổi toàn thân liên quan đến suy gan, bao gồm hạ huyết áp ban đầu, suy giảm độ thanh thải lactat, thở nhanh thứ phát do cổ trướng hoặc HE, và giảm số lượng bạch cầu trong huyết thanh do chứng cường lách. Cần có chỉ số nghi ngờ nhiễm trùng huyết cao để nhận biết và điều trị sớm là rất quan trọng để tránh biến chứng và tử vong. Dựa trên tổng quan tài liệu hiện tại, chúng tôi đề xuất một cách tiếp cận thực tế để quản lý bệnh nhân xơ gan có nhiễm trùng huyết (Bảng 5).
|
Bảng 4. Điểm CLIF-SOFA |
|||||
|
|
0 |
1 |
2 |
3 |
4 |
|
Bilirubin (mg%) |
1.2- 2.0 |
>2.0 – |
6.0 – |
≥ 12.0 |
|
|
Creatine (mg%) |
1.2- |
2.0 – |
3.5 – |
≥ 5.0 |
|
|
Độ HE |
Không |
I |
II |
III |
IV |
|
INR |
1.1 – |
1.25- |
1.5 – |
≥ 2.5 hay tiểu cầu ≤ 20000 |
|
|
MAP (mmHg) |
≥ 70 |
Dopamine ≤5 dobutamine terlipressin |
Dopamine >5 epinephrine ≤0.1 norepinephrine ≤0.1 |
Dopamine >15 epinephrine >0.1 norepinephrine >0.1 |
|
|
PaO2/FiO2 hay SpO2/FiO2 |
>400
>512 |
>300 – ≤400
>357 – ≤512 |
>200 – ≤300
>214 – ≤357 |
>100 – ≤200
>89 – ≤214 |
≤ 100
≤ 89 |
|
Bảng 5. cách tiếp cận thực tế để quản lý bệnh nhân xơ gan và nhiễm trùng huyết |
|
Đánh giá toàn bộ tình trạng nhiễm trùng phải được thực hiện khi nhập viện và bất cứ khi nào xảy ra tình trạng xấu đi trên lâm sàng. Công việc nên bao gồm chọc dò dịch báng chẩn đoán (viêm phúc mạc nguyên phát) với số lượng bạch cầu và nuôi cấy dịch cổ chướng, cấy nước tiểu và cặn lắng, cấy máu (hai vị trí riêng biệt) và chụp X quang phổi. Kháng sinh phổ rộng theo kinh nghiệm nên được sử dụng ngay lập tức và giảm liều tương ứng khi có tác nhân gây bệnh và tính nhạy cảm qua kháng sinh đồ. Thuốc kháng nấm nên được xem xét nếu không có cải thiện lâm sàng trong 48 giờ mặc dù điều trị kháng sinh tối ưu. Hồi sức bằng dịch (30 ml/ kg) trong vòng 3 giờ đầu, ít nhất một phần với 5% albumin Chọc dẫn lưu dịch báng điều trị nên được thực hiện sớm khi có cổ trướng căng, để tránh suy giảm tưới máu thận và có thể hiểu sai về CVP. Xu hướng lactat máu nối tiếp nên là một phần của đánh giá. Trong khi quá trình thanh thải lactate dự kiến sẽ bị trì hoãn, nồng độ lactate tăng cao ban đầu không nên qui kết do xơ gan. Trong tình trạng hạ huyết áp dai dẳng (MAP Cân nhắc sử dụng norepinephrine hoặc vasopressin làm thuốc vận mạch đầu tay. Việc bù steroid liều thấp nên được xem xét sớm, có thể với liều nhỏ hơn hoặc thời gian ngắn hơn (50 mg hydrocortisone mỗi ngày, thay vì TID). Tuy nhiên, nếu đáp ứng các tiêu chí về sốc nhiễm khuẩn kháng trị, thì nên bắt đầu dùng liều thông thường 50 mg mỗi 6 giờ. Khi cần đặt nội khí quản, tốt nhất nên dùng thuốc an thần bằng các thuốc tác dụng ngắn (ví dụ, propofol, dexmedetomidine với liều thông thường cho mỗi trọng lượng cơ thể lý tưởng của bệnh nhân) và tránh dùng thuốc benzodiazepine. Các biện pháp phòng ngừa viêm phổi hít phải được áp dụng ở những bệnh nhân có các yếu tố nguy cơ cao hơn (ví dụ, HE, ứ trệ dịch vị, tăng áp lực trong ổ bụng và xuất huyết tiêu hóa trên). Việc dự phòng huyết khối phải luôn được xem xét nếu không có chống chỉ định (ví dụ, chảy máu đang hoạt động hoặc gần đây hoặc tiểu cầu Nên sử dụng dự phòng loét do stress, tốt nhất là với PPI, với đánh giá định kỳ để tiếp tục điều trị dự phòng. LT nên được xem xét ở những bệnh nhân bị nhiễm trùng được kiểm soát và ACLF dai dẳng |
Tài liệu tham khảo
Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis- 3). JAMA 2016;315:801-810.
Arvaniti V, D’Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, Burroughs AK. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology 2010;139:1246- 1256, 1256.e1-5.
Fernández J, Aracil C, Solà E, Soriano G, Cinta Cardona M, Coll S, et al. Evaluation and treatment of the critically ill cirrhotic patient. [Article in Spanish] Gastroenterol Hepatol 2016;39:607-626.
Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 2013;41:580-637.
Galbois A, Aegerter P, Martel-Samb P, Housset C, Thabut D, Offenstadt G, et al. Improved prognosis of septic shock in patients with cirrhosis: a multicenter study. Crit Care Med 2014; 42:1666-1675.
American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med 1992;20:864-874.
Brun-Buisson C, Doyon F, Carlet J, Dellamonica P, Gouin F, Lepoutre A, et al. Incidence, risk factors, and outcome of severe sepsis and septic shock in adults. A multicenter prospective study in intensive care units. French ICU Group for Severe Sepsis. JAMA 1995;274:968-974.
Dhainaut JF, Claessens YE, Janes J, Nelson DR. Underlying disorders and their impact on the host response to infection. Clin Infect Dis 2005;41(Suppl 7):S481- S489.
Foreman MG, Mannino DM, Moss M. Cirrhosis as a risk factor for sepsis and death: analysis of the National Hospital Discharge Survey. Chest 2003;124:1016-1020.
Wong F, Bernardi M, Balk R, Christman B, Moreau R, GarciaTsao G, et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club. Gut 2005;54:718-725.
Cazzaniga M, Dionigi E, Gobbo G, Fioretti A, Monti V, Salerno F. The systemic inflammatory response syndrome in cirrhotic patients: relationship with their in- hospital outcome. J Hepatol 2009;51:475-482.
Asrani SK, Simonetto DA, Kamath PS. Acute-on-chronic liver failure. Clin Gastroenterol Hepatol 2015;13:2128-2139.
Kamath PS. Acute on chronic liver failure. Clin Liver Dis 2017; 9:86-88.
Jalan R, Yurdaydin C, Bajaj JS, Acharya SK, Arroyo V, Lin HC, et al. Toward an improved definition of acute-on-chronic liver failure. Gastroenterology 2014;147:4-10.
Sargenti K, Prytz H, Nilsson E, Kalaitzakis E. Predictors of mortality among patients with compensated and decompensated liver cirrhosis: the role of bacterial infections and infectionrelated acute-on-chronic liver failure. Scand J Gastroenterol 2015;50:875-883.
Moreau R, Jalan R, Gines P, Pavesi M, Angeli P, Cordoba J, et al. CANONIC Study Investigators of the EASL–CLIF Consortium. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology 2013;144:1426-1437, 1437.e1–9.
McPhail MJ, Shawcross DL, Abeles RD, Chang A, Patel V, Lee GH, et al. Increased survival for patients with cirrhosis and organ failure in liver intensive care and validation of the Chronic Liver Failure-Sequential Organ Failure Scoring System. Clin Gastroenterol Hepatol 2015;13:1353-1360.e8.
Moreau R, Lee SS, Soupison T, Roche-Sicot J, Sicot C. Abnormal tissue oxygenation in patients with cirrhosis and liver failure. J Hepatol 1988;7:98-105.
Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early goal- directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001;345:1368-1377.
Yealy DM, Kellum JA, Huang DT, Barnato AE, Weissfeld LA, Pike F, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med 2014;370:1683-1693.
Mouncey PR, Osborn TM, Power GS, Harrison DA, Sadique MZ, Grieve RD, et al. Protocolised Management In Sepsis (ProMISe): a multicentre randomised controlled trial of the clinical effectiveness and cost-effectiveness of early, goal- directed, protocolised resuscitation for emerging septic shock. Health Technol Assess 2015;19:i-xxv, 1-150.
Mouncey PR, Osborn TM, Power GS, Harrison DA, Sadique MZ, Grieve RD, et al. Trial of early, goal-directed resuscitation for septic shock. N Engl J Med 2015;372:1301-1311.
Peake SL, Delaney A, Bailey M, Bellomo R, Cameron PA, Cooper DJ, et al. Goal- directed resuscitation for patients with early septic shock. N Engl J Med 2014;371:1496-1506.
Moreau R, Hadengue A, Soupison T, Kirstetter P, Mamzer MF, Vanjak D, et al. Septic shock in patients with cirrhosis: hemodynamic and metabolic characteristics and intensive care unit outcome. Crit Care Med 1992;20:746-750.
Aspesi M, Gamberoni C, Severgnini P, Colombo G, Chiumello D, Minoja G, et al. The abdominal compartment syndrome. Clinical relevance. Minerva Anestesiol 2002;68:138-146.
Malbrain ML, De Waele JJ, De Weulenaer BL. What every ICU clinician needs to know about the cardiovascular effects caused by abdominal hypertension. Anaesthesiol Intensive Ther 2015;47:388-399.
Nadim MK, Durand F, Kellum JA, Levitsky J, O’Leary JG, Karvellas CJ, et al. Management of the critically ill patient with cirrhosis: a multidisciplinary perspective. J Hepatol 2016;64:717-735.
De Backer D, Fagnoul D. Intensive care ultrasound: VI. Fluid responsiveness and shock assessment. Ann Am Thorac Soc 2014;11:129-136.
Levitov A, Frankel HL, Blaivas M, Kirkpatrick AW, Su E, Evans D, et al. Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients–part II: cardiac ultrasonography. Crit Care Med 2016;44:1206-1227.
Porter TR, Shillcutt SK, Adams MS, Desjardins G, Glas KE, Olson JJ, et al. Guidelines for the use of echocardiography as a monitor for therapeutic intervention in adults: a report from the American Society of Echocardiography. J Am Soc Echocardiogr 2015;28: 40-56.
Via G, Tavazzi G, Price S. Ten situations where inferior vena cava ultrasound may fail to accurately predict fluid responsiveness: a physiologically based point of view. Intens Care Med 2016;42:1164-1167.
Sterling SA, Puskarich MA, Jones AE. The effect of liver disease on lactate normalization in severe sepsis and septic shock: a cohort study. Clin Exp Emerg Med 2015;2:197-202.
Funk GC, Doberer D, Kneidinger N, Lindner G, Holzinger U, Schneeweiss B. Acid- base disturbances in critically ill patients with cirrhosis. Liver Int 2007;27:901- 909.
Galbois A, Bige N, Pichereau C, Boelle PY, Baudel JL, Bourcier S, et al. Exploration of skin perfusion in cirrhotic patients with septic shock. J Hepatol 2015;62:549- 555.
Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 2008;36:296-327.
Rinaldi L, Ferrari E, Marietta M, Donno L, Trevisan D, Codeluppi M, et al. Effectiveness of sepsis bundle application in cirrhotic patients with septic shock: a single-center experience. J Crit Care 2013;28:152-157.
Huygh J, Peeters Y, Bernards J, Malbrain ML. Hemodynamic monitoring in the critically ill: an overview of current cardiac output monitoring methods. F1000Res 2016;5.pii:F1000 Faculty Rev-2855. doi: https://doi.org/10.12688/f1000research.8991.1. eCollection 2016.
Myburgh JA, Mythen MG. Resuscitation fluids. N Engl J Med 2013;369:1243-1251. 39)Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med2004;350:2247-2256.
Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al. Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med 2014;370:1412-1421.
Rochwerg B, Alhazzani W, Sindi A, Heels-Ansdell D, Thabane L, Fox-Robichaud A, et al. Fluid resuscitation in sepsis: a systematic review and network meta-analysis. Ann Intern Med 2014; 161:347-355.
Xu JY, Chen QH, Xie JF, Pan C, Liu SQ, Huang LW, et al. Comparison of the effects of albumin and crystalloid on mortality in adult patients with severe sepsis and septic shock: a meta-analysis of randomized clinical trials. Crit Care 2014;18:702. 43)Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Aneman A, et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med 2012;367:124-134.
Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med 2012;367:1901-1911.
Frenette AJ, Bouchard J, Bernier P, Charbonneau A, Nguyen LT, Rioux JP, et al. Albumin administration is associated with acute kidney injury in cardiac surgery: a propensity score analysis. Crit Care 2014;18:602.
Jalan R, Schnurr K, Mookerjee RP, Sen S, Cheshire L, Hodges S, et al. Alterations in the functional capacity of albumin in patients with decompensated cirrhosis is associated with increased mortality. Hepatology 2009;50:555-564.
Salerno F, Navickis RJ, Wilkes MM. Albumin infusion improves outcomes of patients with spontaneous bacterial peritonitis: a meta-analysis of randomized trials. Clin Gastroenterol Hepatol 2013;11:123-130.e1.
Ortega R, Gines P, Uriz J, Cardenas A, Calahorra B, De Las Heras D, et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study. Hepatology 2002;36(4 Pt 1):941- 948.
Bernardi M, Caraceni P, Navickis RJ, Wilkes MM. Albumin infusion in patients undergoing large-volume paracentesis: a meta-analysis of randomized trials. Hepatology 2012;55: 1172-1181.
Sauneuf B, Champigneulle B, Soummer A, Mongardon N, Charpentier J, Cariou A, et al. Increased survival of cirrhotic patients with septic shock. Crit Care 2013;17:R78.
Siddiqui MS, Stravitz RT. Intensive care unit management of patients with liver failure. Clin Liver Dis 2014;18:957-978.
De Backer D, Aldecoa C, Njimi H, Vincent JL. Dopamine versus norepinephrine in the treatment of septic shock: a metaanalysis. Crit Care Med 2012;40:725-730.
Stratton L, Berlin DA, Arbo JE. Vasopressors and inotropes in sepsis. Emerg Med Clin N Am 2017;35:75-91.
Herget-Rosenthal S, Saner F, Chawla LS. Approach to hemodynamic shock and vasopressors. Clin J Am Soc Nephrol 2008; 3:546-553.
Overgaard CB, Dzavik V. Inotropes and vasopressors: review of physiology and clinical use in cardiovascular disease. Circulation 2008;118:1047-1056.
Ellender TJ, Skinner JC. The use of vasopressors and inotropes in the emergency medical treatment of shock. Emerg Med Clin N Am 2008;26:759-786, ix
Wagener G, Bakker J. Vasopressin in cirrhosis and sepsis: physiology and clinical implications. Minerva Anestesiol 2015;81:1377-1383.
Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H, et al. Angiotensin II for the treatment of vasodilatory shock. N Engl J Med 2017;377:419-430.
Arabi YM, Aljumah A, Dabbagh O, Tamim HM, Rishu AH, Al-Abdulkareem A, et al. Low-dose hydrocortisone in patients with cirrhosis and septic shock: a randomized controlled trial. CMAJ 2010;182:1971-1977.
Fede G, Spadaro L, Tomaselli T, Privitera G, Germani G, Tsochatzis E, et al. Adrenocortical dysfunction in liver disease: a systematic review. Hepatology 2012;55:1282-1291.
Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R, et al. Adjunctive glucocorticoid therapy in patients with septic shock. N Engl J Med 2018;378:797- 808.
Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot JP, Siami S, et al. Hydrocortisone plus fludrocortisone for adults with septic shock. N Engl J Med 2018;378:809-818.
Arabi YM, Dara SI, Memish Z, Al Abdulkareem A, Tamim HM, Al-Shirawi N, et al. Antimicrobial therapeutic determinants of outcomes from septic shock among patients with cirrhosis. Hepatology 2012;56:2305-2315.
Karvellas CJ, Abraldes JG, Arabi YM, Kumar A. Appropriate and timely antimicrobial therapy in cirrhotic patients with spontaneous bacterial peritonitis- associated septic shock: a retrospective cohort study. Aliment Pharmacol Ther 2015;41:747-757.
Fernandez J, Gustot T. Management of bacterial infections in cirrhosis. J Hepatol 2012;56(Suppl 1):S1-S12.
Bunchorntavakul C, Chavalitdhamrong D. Bacterial infections other than spontaneous bacterial peritonitis in cirrhosis. World J Hepatol 2012;4:158-168.
Fernandez J, Arroyo V. Bacterial infections in cirrhosis: a growing problem with significant implications. Clin Liver Dis 2013;2:102-105.
Brechot N, Hekimian G, Chastre J, Luyt CE. Procalcitonin to guide antibiotic therapy in the ICU. Int J Antimicrob Agents. 2015;46(Suppl 1):S19-S24.
Rhee C. Using procalcitonin to guide antibiotic therapy. Open Forum Infect Dis 2017;4:ofw249.
Piano S, Morando F, Carretta G, Tonon M, Vettore E, Rosi S, et al. Predictors of early readmission in patients with cirrhosis after the resolution of bacterial infections. Am J Gastroenterol 2017;112:1575-1583.
Olson JC, Karvellas CJ. Critical care management of the patient with cirrhosis awaiting liver transplant in the intensive care unit. Liver Transpl 2017;23:1465- 1476.
Banares R, Nevens F, Larsen FS, Jalan R, Albillos A, Dollinger M, et al. Extracorporeal albumin dialysis with the molecular adsorbent recirculating system in acute-on-chronic liver failure: the RELIEF trial. Hepatology 2013;57:1153-1162.
Reddy KR, O’Leary JG, Kamath PS, Fallon MB, Biggins SW, Wong F, et al. High risk of delisting or death in liver transplant candidates following infections: results from the North American Consortium for the Study of End-Stage Liver Disease. Liver Transpl 2015;21:881-888.
Gustot T, Fernandez J, Garcia E, Morando F, Caraceni P, Alessandria C, et al. Clinical Course of acute-on-chronic liver failure syndrome and effects on prognosis. Hepatology 2015;62:243-252.