Tóm tắt
Suy tim có sẵn (HF) ở bệnh nhân nhiễm trùng huyết có liên quan đến kết quả lâm sàng tồi tệ hơn. Xử trí nhiễm trùng huyết bao gồm hồi sức tích cực thể tích, sau đó dùng thuốc vận mạch (và thuốc co mạch tiềm năng) nếu dịch không đủ để phục hồi tưới máu mô; tuy nhiên, liều lượng lớn dịch truyền và các thuốc vận mạch liên quan đến rối loạn chức năng tim của bệnh nhân HF. Tổng quan này tóm tắt bằng chứng về ảnh hưởng của HF đối với kết quả lâm sàng nhiễm trùng huyết, các lo ngại về sinh lý bệnh, mục tiêu hồi sức, can thiệp huyết động và xử trí hỗ trợ (như là thuốc chống loạn nhịp, hỗ trợ thở máy áp lực dương và điều trị thay thế thận) ở bệnh nhân nhiễm trùng huyết và có HF từ trước. Bệnh nhân nhiễm trùng huyết và có HF từ trước được truyền ít dịch hơn trong quá trình hồi sức; tuy nhiên, bằng chứng cho thấy các mục tiêu hồi sức bằng dịch truyền thống không làm tăng nguy cơ xảy ra các biến cố bất lợi ở bệnh nhân HF bị nhiễm trùng huyết và có khả năng cải thiện kết quả. Norepinephrine vẫn là thuốc vận mạch được ủng hộ tốt nhất cho bệnh nhân nhiễm trùng huyết có HF từ trước, trong khi dopamine có thể gây ra nhiều tác dụng phụ trên tim hơn. Dobutamine nên được sử dụng một cách thận trọng vì các tác dụng có hại nói chung của nó nhưng có thể có ứng dụng khi kết hợp với norepinephrine ở những bệnh nhân có cung lượng tim thấp. Việc quản lý các thuốc điều trị HF mãn tính cần được xem xét cẩn thận về việc tiếp tục hoặc ngừng khi bệnh nhân phát triển nhiễm trùng huyết, và thuốc chẹn beta có thể thích hợp để tiếp tục trong trường hợp không có mất bù huyết động cấp tính. Xử trí tối ưu rung nhĩ có thể bao gồm thuốc chẹn beta sau khi ổn định huyết động cấp tính vì chúng cũng cho thấy những lợi ích một cách độc lập trong bệnh cảnh nhiễm trùng huyết. Hỗ trợ thông khí áp lực dương và thay thế thận phải được theo dõi cẩn thận về các ảnh hưởng trên chức năng tim khi có HF.
Từ khóa: nhiễm trùng huyết, sốc nhiễm trùng, suy tim, dịch, hồi sức, thuốc vận mạch, thuốc co bóp cơ tim, thuốc chống loạn nhịp
Giới thiệu
Nhiễm trùng huyết/ sốc nhiễm trùng và suy tim (HF) góp phần gây ra bệnh tật và tử vong đáng kể.1 Tỷ lệ tử vong do sốc nhiễm trùng là khoảng 40%, 2 trong khi chẩn đoán HF đưa ra tỷ lệ tử vong 50% sau 5 năm.3-5 Nhiễm trùng huyết và HF được xếp hạng nhất và thứ hai, do các tình trạng có tỷ lệ tái nhập viện trong vòng 30 ngày cao nhất trong số các bệnh nhân Medicare vào năm 2018,6 và đáng chú ý, nhiễm trùng huyết/ sốc nhiễm trùng là nguyên nhân gây ra một phần tư số ca tử vong của bệnh nhân HF.7,8
|
Bảng 1. Định nghĩa |
|
|
Suy tim |
Các hội chứng lâm sàng gây ra từ bất kỳ sang thương cấu trúc hay suy giảm chức năng đổ đầy hay tống máu |
|
Suy tim có EF giảm |
Phân suất tống máu (EF) ≤ 40% |
|
Suy tim tâm thu |
Tương tự suy tim EF giảm |
|
Suy tim có EF bảo tồn |
EF ≥ 50% |
|
Bệnh cơ tim |
Bệnh cơ tim nguyên phát gây ra dãn, hay phì đại thất gây giảm chức năng. |
|
Rối loạn chức năng thất (LVD) |
Là một thuật ngữ mô tả chức năng thất không đủ cung cấp máu cho cơ thể (thường là giảm EF). |
|
Rối loạn chức năng tim |
Một thuật ngữ danh cho các vấn đề suy tim, bệnh cơ tim, LVD |
|
Suy tim trước đó |
Suy tim có trước khi bệnh nhân nhập viện vì nhiễm trùng huyết và đã không xuất hiện khi bệnh nhân nhập viện trước đó. |
Sinh lý bệnh của các trạng thái bệnh này dẫn đến huyết động và hiệu quả điều trị chồng chéo và cạnh tranh nhau. Thật vậy, xử trí nhiễm trùng huyết được đặc trưng bởi sự hồi sức tích cực thể tích với dịch tinh thể và hỗ trợ huyết động với thuốc vận mạch, có thể có vẻ trái ngược với xử trí HF thông thường, thúc đẩy giảm tiền tải và giảm hậu tải.9
Hiện tại, không có khuyến nghị nào về quản lý bệnh nhân nhiễm trùng huyết/ sốc nhiễm trùng và HF, và bằng chứng mô tả tác động của nhiễm trùng huyết đồng thời và HF đối với điều trị và kết quả là hạn chế. Tổng quan này thảo luận về ảnh hưởng của HF có từ trước đến kết quả nhiễm trùng huyết, mô tả sinh lý bệnh liên quan và đánh giá việc theo dõi huyết động, các biện pháp can thiệp và điều trị hỗ trợ ở nhóm bệnh nhân này.
Phương pháp học
Một tìm kiếm tài liệu đã được thực hiện để xác định các nghiên cứu bao gồm bệnh nhân nhiễm trùng huyết/ sốc nhiễm trùng và HF. Cơ sở dữ liệu PubMed đã được tìm kiếm cho các nghiên cứu bằng tiếng Anh được xuất bản từ tháng 1 năm 1995 đến tháng 2 năm 2020 bằng cách sử dụng kết hợp các cụm từ tìm kiếm suy tim, suy tim sung huyết, rối loạn chức năng thất trái, rối loạn chức năng tim, nhiễm trùng huyết, sốc nhiễm trùng, nhiễm trùng huyết nặng, truyền dịch, thuốc vận mạch, thuốc tăng co bóp, loạn nhịp tim, hỗ trợ thở máy và liệu pháp thay thế thận. Các nghiên cứu báo cáo những bệnh nhân có biểu hiện nhiễm trùng huyết/ sốc nhiễm trùng và HF đã được đưa vào. Các thiết kế nghiên cứu được đưa vào là tiến cứu, hồi cứu, quan sát hoặc can thiệp. Các tài liệu tham khảo trong các bài báo nghiên cứu ban đầu, bài báo đánh giá, bài xã luận, tóm tắt, phân tích tổng hợp và đánh giá hệ thống đã được sàng lọc để đưa vào.
Vì HF là một định nghĩa lâm sàng, thuật ngữ này không đồng nghĩa với các thiếu hụt như bệnh cơ tim và rối loạn chức năng thất trái (LVD) mà thường bao gồm các khuyết tật như các yếu tố thúc đẩy của nó. Bảng 1 cung cấp các định nghĩa được sử dụng.10 Với mục đích của bài đánh giá này, HF đề cập đến danh mục rộng của tất cả các nhóm phụ và bất kỳ đề cập nào về một biến thể cụ thể như HF với phân suất tống máu được bảo toàn (HFpEF) hoặc HF với phân suất tống máu giảm (HFrEF) được chú ý.
Tiên lượng và kết quả khác biệt
Lý luận lâm sàng cho thấy rối loạn chức năng tim cơ bản của HF sẽ khiến kết quả xấu đi trong tình trạng huyết động không ổn định như nhiễm trùng huyết/ sốc nhiễm trùng, và dữ liệu ủng hộ giả thuyết này, đặc biệt trong HFrEF.11-13 Alon et al cho thấy tỷ lệ tử vong ở bệnh nhân HF nhập viện do nhiễm trùng tăng cao so với cho những bệnh nhân không có HF nhập viện vì nhiễm trùng huyết (51% so với 41%; P=0,015).13 Một đánh giá hồi cứu trên 174 bệnh nhân (87 bệnh nhân có HfrEF và 87 bệnh nhân không có HFrEF) có nhiễm trùng huyết cho thấy HfrEF gây tử vong khi nhập viện cao hơn (57,5% so với 34,5%; P = .002).11 Ishak Gabra và cộng sự đã đánh giá bệnh nhân nhiễm trùng huyết và HFrEF và HFpEF đã có từ trước và quan sát thấy xu hướng tăng tỷ lệ tử vong.12 Không phải HFrEF (tỷ lệ chênh lệch [OR]: 1.88; P = .06) và HFpEF (OR: 1,56; P = 0.25) có liên quan thống kê với việc tăng tỷ lệ tử vong trong 28 ngày khi được điều chỉnh theo mức độ nghiêm trọng của bệnh, nhưng HFrEF có liên quan đến việc tăng loạn nhịp mới khởi phát (52% so với 23%; P 12 Prabhu và cộng sự quan sát thấy tỷ lệ tử vong ở bệnh nhân tăng lên nhiễm trùng huyết với EF .14 EF ban đầu trung bình ở nhóm không sống còn cũng thấp hơn (53% so với 63%; P = 0.029). Kết cuộc lâu dài của nhiễm trùng huyết cũng có thể xấu đi ở bệnh nhân HF. Bệnh nhân nhiễm trùng huyết nặng/ sốc nhiễm trùng và HF kèm theo có tỷ lệ tử vong 75% sau xuất viện 1 năm, tỷ lệ tử vong cao hơn 15% ở bệnh nhân nhiễm trùng huyết nặng trong 1 năm (40% -44%) 16,17 và 10 năm đối với nhiễm trùng huyết nặng (67%) và bệnh hiểm nghèo không sát trùng (57%). 18
Ngược lại, Ouellette và Shah không quan sát thấy mối liên quan giữa EF và kết cục lâm sàng ở bệnh nhân nhiễm trùng huyết.19 Tỷ lệ tử vong (32% so với 24%; P = 0.12) và đặt nội khí quản (49% so với 50%; P = 0 .687) là tương tự giữa bệnh nhân có EF giảm (EF trung bình = 35%) và nhóm chứng (EF trung bình = 60%). Hơn nữa, một phân tích tổng hợp xác định rằng LVD mới không phải là một yếu tố dự báo nhạy (48%) hoặc đặc hiệu (65%) cho tỷ lệ tử vong trong 30 ngày nhập viện20; tuy nhiên, rối loạn chức năng tim từ trước không được phân biệt với bệnh cơ tim nhiễm trùng, hạn chế nhận diện HF đã có từ trước.
Nhiều nghiên cứu trong số này chỉ giới hạn ở những bệnh nhân nhiễm trùng huyết với EF giảm, nơi tác động của bệnh cơ tim nhiễm trùng không được phân biệt với rối loạn chức năng tim đã có trước đó (Bảng 2), làm cho việc kiểm tra tác động thực sự của HF từ trước lên bệnh nhân nhiễm trùng huyết khó khăn. Tác động của HF trực tiếp đến kết quả nhiễm trùng huyết càng thêm rối loạn vì gần một nửa số bệnh nhân HF bị cản trở bởi tình trạng sức khỏe tàn phế, sự kết hợp của lão hóa và nhiều trạng thái bệnh phức tạp tạo ra sự suy giảm thêm vào gây ra tỷ lệ mắc bệnh và tử vong cao hơn. 21,22 Mức độ tàn phế cũng liên quan độc lập với gia tăng tử vong trong nhiễm trùng huyết.23 Tình trạng tàn phế xuất hiện thường xuyên hơn trong HFpEF so với HFrEF, 24 điều này gây ngạc nhiên khi xem xét các kết cuộc tiêu cực lớn hơn được đề xuất trong nhiễm trùng huyết và HFrEF. Tình trạng tàn phế có thể góp phần làm tăng tỷ lệ tử vong do nhiễm trùng huyết với HF từ trước, ngoài việc chỉ ra công tim kém hiệu quả của tim trên phổ HF, nó nhấn mạnh tầm quan trọng của việc chăm sóc y tế hoàn chỉnh ngoài việc quản lý tuần hoàn.
|
Bảng 2. Kết cuộc bệnh nhân nhiễm trùng huyết có suy tim trước đó |
||||
|
Tài liệu |
Loại nghiên cứu |
Dân số và mẫu |
Kết cuộc |
Kết quả liên quan đến suy tim có trước |
|
Abou Dagher11 |
Hồi cứu |
Có ST trước (EF |
Tác động ST có trước lên tử vong |
Bệnh nhân với ST có tử vong cao hơn( 57.5% vs 43.5%; p= 0.002) và OR tử vong cao (OR: 2.45; 95% CI:1.22-4.88; P=0.01) |
|
Ishak Gabra 12 |
Hồi cứu |
Shock NT, n=226 (96 có suy tim) |
Tác động ST có trước lên tử vong |
HFrEF không gây tử vong cao hơn trong 28 ngày (OR: 1.88; 95% CI: 0.98-3.63; P = 0.06). HFpEF không liên quan đến tử vong 28 ngày (OR: 1.56; P = 0.25). |
|
Alkhalaf 15 |
Hồi cứu |
NTH/ sốc NT, n = 195 |
ST ảnh hưởng đến sống còn sau 1 năm |
Tử vong cao sau 1 năm (75%) ở bệnh nhân NTH có ST trước đó |
|
Oullette & Shah 19 |
Hồi cứu, đối chứng cohort |
NTH có EF thấp (n=-197) và chứng (n=197), n= 394 |
Khác biệt kết cuộc bệnh nhân NTH có và không có ST trước đó |
Không có khác biệt tử vong (32% vs 24%; p = 0.12) hay NKQ (49% vs 50%; p = 0.687) giữa hai nhôm có EF thấp vs nhôm có EF bình thường |
Tóm lại, dữ liệu tích lũy cho thấy nhiễm trùng huyết và HF kết hợp làm xấu kết quả lâm sàng, và khả năng rối loạn chức năng cơ tim nhiễm trùng xảy ra ở bệnh nhân có HF từ trước làm tăng thêm các mối quan tâm về bệnh kết hợp. Trong khi kết cuộc lâm sàng xấu dường như không chỉ do chức năng chức tim xấu, mà việc kiểm tra quản lý chuyên khoa bệnh nhân nhiễm trùng huyết có HF từ trước là rất quan trọng khi xem xét tầm quan trọng của chức năng tim đối với các can thiệp huyết động.
Các xem xét các khía cạnh sinh lý bệnh
Trong nhiễm trùng huyết, đáp ứng miễn dịch qua trung gian vật chủ tạo ra rối loạn chức năng tế bào nội mô mạch máu dẫn đến tăng tính thấm của mao mạch và dịch chuyển dịch từ mạch máu sang khoảng kẽ, và sốc nhiễm trùng xảy ra khi mất dịch không ổn định huyết động.2 Biện pháp can thiệp lý tưởng cho nhiễm trùng huyết tập trung vào bổ sung thể tích nội mạch bằng các liều dịch truyền làm tăng tiền tải để tăng cung lượng tim (CO) và do đó phục hồi tưới máu cơ quan. Nhiễm trùng huyết ảnh hưởng trực tiếp đến chức năng tim bằng cách tăng cường hoạt hóa cytokine của nitric oxide tổng hợp, gây giảm nồng độ đỉnh canxi trong thì tâm thu làm suy giảm sự co bóp của tế bào, dẫn đến mức co bóp trở nên âm tính.26 Trong một trái tim hoạt động bình thường, nhịp tim nhanh do nhiễm trùng huyết cùng với giảm hậu tải do giãn mạch có thể bù đắp cho tiền tải giảm và suy giảm khả năng co bóp của cơ tim, dẫn đến không thay đổi hoặc tăng CO.27 Việc những tác dụng bù trừ này có gây hậu quả nguy hiểm ở người bị rối loạn chức năng tim từ trước hay không vẫn chưa được mô tả nhưng làm tăng mối quan tâm do tỷ lệ tử vong tăng ở nhiễm trùng huyết với HF đã có từ trước. Nhiễm trùng huyết cũng độc lập gây ra rối loạn chức năng tim (tức là ức chế cơ tim do nhiễm trùng) độc lập với HF, 28 có thể gây ra hậu quả tiêu cực kép với HF đã có từ trước.
|
Bảng 3. Tương tác giữa trạng thai bệnh và điều trị nhiễm trùng huyết lên huyết động |
|||||
|
|
Cung lượng tim |
||||
|
|
Thể tích nhát bóp |
||||
|
Bệnh/ tương tác |
MAP |
SVR |
HR |
Tiền tải |
Sức co bóp |
|
Suy tim |
↓ |
↑ |
↑ |
↑ |
↔↓ |
|
Nhiễm trùng huyết |
↓ |
↓ |
↑ |
↓ |
↑ |
|
Suy tim + NTH |
↓ |
↔ |
↑ |
↓ |
↕↔ |
|
+ Noradrenaline |
↑ |
↑ |
↑ |
↔ |
↔↑ |
|
+ Truyền dịch |
↕↔ |
↔ |
↔↓ |
↑ |
↕↔ |
|
+ Inotrope |
↕↔ |
↔ |
↑ |
↔ |
↑ |
Suy tim được đặc trưng bởi một chu kỳ giảm CO và các cơ chế bù trừ thần kinh-thể dịch dẫn đến tổn thương tim và giữ nước.29 Việc cung cấp oxy không đủ dẫn đến giải phóng catecholamine do hệ thần kinh giao cảm gây ra, có thể gây ra tác dụng độc tim trực tiếp và tăng công việc cơ tim. 30,31 Hệ thần kinh giao cảm sự hoạt hóa tiếp tục kích thích sự điều hòa hệ renin-angiotensin-aldosterone, gây ra co mạch động mạch, tăng thể tích nội mạch và mô kẽ do giữ natri và nước, và dẫn đến tái cấu trúc tim theo hướng bệnh lý.32,33 Trong HF mãn tính, giảm tính thấm nội mô mao mạch gây mất albumin nội mạch và áp suất thủy tĩnh giảm.32 Dịch đi theo gradient áp suất để vào khoảng kẽ, dẫn đến cân bằng nội môi dịch mới thông qua việc tăng thể tích nội mạch sau đó tương thích gia tăng thể tích. Theo thời gian, lượng tiền tải tăng lên kéo dài các cơ vượt quá độ đàn hồi vốn có của chúng, dẫn đến suy giảm khả năng co bóp, giảm thể tích nhát bóp (SV) và CO.
Vì phần lớn thể tích nội mạch nằm trong hệ thống tĩnh mạch (85%), sự gia tăng quá mức mãn tính này tạo ra một trạng thái sẵn sàng cho sự phát triển HF cấp tính hoặc mãn tính khi bệnh nặng, trong đó sự gia tăng catecholamine làm co thắt hệ thống tĩnh mạch dẫn đến hiện tượng “tự truyền dịch”, và phần lớn hầu hết sau đó, đi vào phế nang phổi.33,34 Sự tồn tại chồng chéo giữa các tác động huyết động của nhiễm trùng huyết và HF, nhưng liệu điều này có cần sự thay đổi điều trị hay không vẫn chưa được biết. Bảng 3 tóm tắt các tác động tương tác can thiệp tình trạng bệnh được đề xuất trên nền huyết động.
Thể tích hồi sức.
Đương nhiên, mối quan tâm tồn tại về thể tích ở những bệnh nhân đang hồi sức tích cực bị nhiễm trùng huyết với HF. Truyền dịch lớn (ví dụ 30 mL/ kg) có thể dẫn đến quá tải dịch, sau đó là phù phổi cần thở máy (MV). 35,36 Điều này có liên quan quan trọng ở bệnh nhân bệnh nặng khi quá tải dịch gắn liền với sự gia tăng tử vong ở bệnh nhân hồi sức. 35,37,38 Bệnh nhân bị HF có lượng máu tuần hoàn tăng và/ hoặc tâm thất giãn với tăng tiền tải ban đầu, 33 và ngược lại với nhiễm trùng huyết, giảm tiền tải về mặt dược lý thông qua giãn tĩnh mạch thường được sử dụng để điều trị bệnh nhân bị HF nặng.10,39 Ảnh hưởng của các tác động tổng hợp của các rối loạn điều hòa dịch và huyết động này cần được quan tâm.
Các thuốc co mạch.
Trong khi thuốc vận mạch được sử dụng phổ biến trong sốc nhiễm trùng, việc sử dụng chúng trong tim mạch có nhiều sắc thái hơn. Các khuyến nghị HF hiện tại thúc đẩy các chiến lược để giảm hậu tải tâm thất (để cải thiện CO và giảm nhu cầu oxy của cơ tim) và tối ưu hóa tiền tải của tim (tăng CO mà không ảnh hưởng đến nhu cầu oxy của cơ tim) .39,40 Thuốc vận mạch làm tăng hậu tải, có thể làm giảm CO và bù đắp nội sinh bằng cách tăng tiêu thụ oxy của cơ tim. 41,42 Xem xét CO trong HF nói chung có lợi hơn từ việc giảm hậu tải, điều này làm dấy lên lo ngại rằng tăng quá nhiều hậu tải qua trung gian thuốc vận mạch có thể đặc biệt làm giảm chức năng tim trong HF. Mối quan tâm này có thể giảm bớt vì HF cấp tính phát triển thành sốc tim có thể làm giảm sức cản mạch hệ thống thứ phát sau giải phóng cytokine, có thể bắt chước bệnh lý cơ bản của nhiễm trùng huyết và tạo động lực cho việc sử dụng thuốc vận mạch ở bệnh nhân có cả sốc nhiễm trùng và sốc tim.43
Ngoài ra, thuốc vận mạch có thể gây ra sự phân phối lại dịch từ hệ thống tĩnh mạch và thúc đẩy sự dịch chuyển dịch vào khoang nhu mô phổi.33.34 Bệnh nhân suy tim mãn tính có tình trạng gia tăng thể tích nội mạch, do đó, có nguy cơ dịch chuyển dịch quá mức khi kích thích với các thuốc co mạch từ các hồ chứa đầy dịch.34 Các cơ chế này tạo thành một khuôn khổ để tránh dùng thuốc vận mạch ở bệnh nhân HF; tuy nhiên, trong bối cảnh nhiễm trùng huyết và HF mãn tính, việc xử trí có thể bị nhầm lẫn.
Các thuốc tăng co bóp.
Nhiễm trùng huyết với HF đã có từ trước có thể biểu hiện một hình ảnh hỗn hợp của sốc tim và nhiễm trùng, có thể thông qua rối loạn chức năng cơ tim do nhiễm trùng huyết hoặc do giảm tưới máu do nhiễm trùng huyết kích thích quá mức nhu cầu của cơ tim bị suy và HF cấp tính sẽ xảy ra sau đó. 27 Rối loạn chức năng này có thể thích hợp với việc tăng CO thông qua sử dụng các inotrope, đặc biệt là khi quá trình hồi sức dịch và co mạch trên diện rộng không điều chỉnh được sự tưới máu mô.
Các mục tiêu và theo dõi hồi sức
Xử trí nhiễm trùng huyết cấp tính sử dụng các phép đo tình trạng oxy và huyết động, và các biện pháp này có thể gây nhầm lẫn ở những bệnh nhân có HF từ trước. Bảng 4 tóm tắt các tác động được đề xuất của HF đối với các thông số hồi sức nhiễm trùng huyết thường gặp.
Lactate.
Lactate là thông số lâm sàng duy nhất được khuyến nghị để hướng dẫn hồi sức nhiễm trùng huyết ban đầu như một đánh giá về lượng oxy đầy đủ.9 Định nghĩa nhiễm trùng huyết gần đây nhất sử dụng lactate lớn hơn 2 mmol/ L để chỉ ra tình trạng thiếu oxy do sốc nhiễm trùng.2 Lactate có thể phát triển trong nhiễm trùng huyết do các cơ chế khác giảm tưới máu, đặc biệt là kích thích quá mức adrenergic (đồng vận beta -2) bởi catecholamine nội sinh hoặc epinephrine ngoại sinh.44,45 Ngoài ra, vì lactate cũng được tạo ra từ quá trình chuyển hóa kỵ khí xảy ra thứ phát sau giảm tưới máu, việc cung cấp oxy bị suy giảm mãn tính trong HF có thể làm rối loạn việc đo lường. Trong một nhóm đoàn hệ gồm các bệnh nhân HF nặng nhập viện không có trong tình trạng sốc, 25% có lactate huyết tương tăng (được định nghĩa là > 2,1 mmol/ L).46 Với mức độ nghiêm trọng của các bệnh nhân trong nhóm đoàn hệ này (phân suất tống máu thất trái [LVEF]
|
Bảng 4. Tác động của suy tim lên các thông số hồi sức nhiễm trùng huyết |
||
|
Thông số hồi sức |
Tác động của suy tim |
Cơ chế suy tim làm nhiễu |
|
Lactate |
↑ |
Có thể gia tăng ở bệnh nhân suy tim nặng (EF |
|
CRT |
↔↑ |
Có khả năng chinh xác trừ khi bệnh nhân phù và có thể tăng |
|
ScVO2 |
↓ |
CO thấp mãn tinh có thể dung nạp với mức oxi hóa thấp do tinh trạng oxi hóa máu thấp vốn có |
|
PPV/SVV |
↑↔ |
Có thể bị nhiễu loạn trong suy tim phải do tăng áp phổi từ việc tăng hậu tải thất phải |
|
CVP |
↑ |
Chủ yếu trong suy tim phải, và suy tim mãn tính dẫn đến suy yếu độ đàn hồi thất gây sung huyết tinh mạch tăng CVP. |
Thời gian đổ đầy mao mạch.
Hồi sức theo hướng dẫn thời gian nạp lại mao mạch (CRT) gần đây đã được so sánh với hồi sức có hướng dẫn bằng lactate trong một thử nghiệm lâm sàng đa trung tâm trên 424 bệnh nhân sốc nhiễm trùng và các kết luận cho thấy có sự khác biệt về kết quả, nhưng xu hướng giảm tỷ lệ tử vong khi sử dụng chiến lược có hướng dẫn CRT (34,9% so với 43,4%; P = 0.06).47 Suy tim không phải là loại trừ trong nghiên cứu, nhưng tỷ lệ HF từ trước không được báo cáo.47 Thời gian đổ đầy mao mạch cũng liên quan đến việc tưới máu không đủ trong trạng thái sốc tim. 48 Thời gian đổ đầy mao mạch có thể kéo dài ở những bệnh nhân HF với CO thấp và mức độ phù tay có thể làm nhiễu phép đo.49 Do CRT cho thấy khả năng hồi sức so với hướng dẫn bằng lactate tương đương và có khả năng vượt trội, CRT có thể đáng tin cậy hơn ở những bệnh nhân HF nặng ví dụ: EF 9,50 nhưng CRT cung cấp một đánh giá hữu ích tại giường trong nhiễm trùng huyết với những bệnh nhân HF đã có từ trước khi xét đến tính dễ sử dụng và hiệu quả do các đặc điểm lâm sàng cho phép cung cấp test đáng tin cậy.
Độ bão hòa oxy tinh mạch.
Oxy hóa tĩnh mạch trộn (SvO2), và dấu hiệu thay thế của nó, độ bão hòa oxy tĩnh mạch trung tâm (ScvO2), đã được sử dụng để theo dõi sự thay đổi oxy trong đáp ứng với điều trị trong nhiễm trùng huyết, với các giá trị mục tiêu lần lượt trên 65% và 70%.51,52 Nhiều nghiên cứu đã chỉ ra mối liên quan giữa ScvO2 sớm 53,54 và SvO2 55 Ouellette và Shah phát hiện ra rằng trong số những bệnh nhân nhiễm trùng huyết với LVD đã có từ trước, những bệnh nhân tử vong có ScvO2 ban đầu thấp hơn (61% so với 70%; P = 0.002).19 Tuy nhiên, công dụng của ScvO2 như một mục tiêu điều trị đã bị nghi ngờ trong nhiều thập kỷ qua và đã bị loại bỏ khỏi Hướng dẫn SSC gần đây nhất.9,56 Trong nhiễm trùng huyết, CO có lẽ là bình thường hoặc tăng cao trong khi các mô không thể lấy oxy do rối loạn vi tuần hoàn.57 Việc kiên trì bảo tồn CO và chiết suất oxy thấp trong nhiễm trùng huyết có thể gây ra SvO2/ ScvO2 tăng cao một cách sai lầm. Velissaris và cộng sự báo cáo có tới 50% bệnh nhân có ScvO2 > 70% lúc ban đầu đáp ứng với dịch truyền trong quá trình nhiễm trùng huyết, cho thấy những bệnh nhân này cần được bù thể tích mặc dù dường như đã được cung cấp đủ oxy.58 Tình trạng sốc tim xuất hiện với mức oxy tĩnh mạch tương đối thấp hơn,57 tạo ra mối quan tâm chung rằng CO thấp trong HF có thể che lấp sự tăng bù CO trong quá trình nhiễm trùng huyết và do đó làm nhiễu các phép đo oxy trong tĩnh mạch. Bệnh nhân có CO thấp mãn tính có thể duy trì oxy mô đầy đủ ở trạng thái oxy tĩnh mạch hỗn hợp thấp thông qua sự thích nghi với chiết xuất oxi trên mức bình thường,59,60 làm nhiễu khả năng nhắm đến mục tiêu SvO2/ ScvO2 ở bệnh nhân HF bị nhiễm trùng huyết. Thật vậy, hiện tượng này đã được báo cáo ở những bệnh nhân có SvO2 mãn tính thấp tới 40%.60 Với những cân nhắc này, SvO2/ScvO2 không nên được sử dụng thường quy để hướng dẫn hồi sức trong nhiễm trùng huyết có HF từ trước.
Ppv & svv.
Sự thay đổi áp lực xung (PPV) và sự thay đổi thể tích nhát bóp (SVV) dựa trên sự thay đổi áp lực trong lồng ngực theo chu kỳ trong khi thở máy để đánh giá tình trạng hồi sức dịch. Các kết quả động học này là những yếu tố dự báo cao hơn về đáp ứng của dịch truyền khi so sánh với phép đo tĩnh của áp lực tĩnh mạch trung tâm (CVP).61 Cả hai phép đo PPV và SVV đều có thể tiên lượng gia tăng CO trong thì hít vào và sự gia tăng CO rõ ràng hơn cho thấy khả năng đáp ứng với dịch truyền được phản ánh bởi PPV và SVV dao động cao hơn. Giá trị PPV mục tiêu thay đổi đáng kể và PPV không thể dự đoán một cách đáng tin cậy khả năng đáp ứng với dịch truyền khi nằm trong khoảng từ 4% đến 17%, mức được báo cáo ở hầu hết bệnh nhân tại đơn vị chăm sóc đặc biệt (ICU).62 Sự thay đổi thể tích nhát bóp thậm chí có thể kém tin cậy hơn PPV và cần theo dõi với thiết bị chuyên biệt hơn.63 Trong HF, sự hiện diện của rối loạn chức năng thất phải (RV) hoặc LVD có thể làm giảm độ chính xác của PPV.64 Khi RV, SV bị suy giảm do tăng hậu tải RV hoặc rối loạn chức năng co bóp RV, chứ không phải do giảm tiền tải RV, PPV có thể là dấu hiệu sai về khả năng đáp ứng dịch truyền.65 Tuy nhiên, phổ HF có các mức độ khác nhau của RV và LVD, và sự biến đổi này rất có thể liên quan đến HF phải thứ phát sau tăng áp động mạch phổi.66 Suy tim có thể dẫn đến khuếch đại PPV và SVV, khi mà áp suất màng phổi gia tăng có thể có tác động lớn hơn khi tác động lên tâm thất vốn dĩ đã bị rối loạn chức năng. Tuy nhiên, PPV và SVV có thể cung cấp thông tin dự báo đáp ứng dịch truyền ở bệnh nhân HF tâm thu mà không có rối loạn chức năng RV, và cần nghiên cứu thêm để xác định tác động của chức năng LV bị suy giảm nghiêm trọng đến độ chính xác của các thông số này.
Áp lực tĩnh mạch trung tâm.
Đánh giá đo CVP đã bị loại bỏ khỏi Hướng dẫn SSC năm 2016 với lý do khả năng dự đoán tình trạng thể tích trong phạm vi CVP bình thường là 8 đến 12 mm Hg hạn chế vì nó chỉ dự đoán đáp ứng ở phạm vi cực hạn.9 Áp lực tĩnh mạch trung tâm chỉ có thể xác định được sự hồi sức đủ dịch 54% bệnh nhân nhiễm trùng huyết67 và không đáng tin cậy ngoài 12 giờ đầu hồi sức sốc nhiễm trùng để dự đoán cả tình trạng thể tích và khả năng đáp ứng dịch.68 Hơn nữa, CVP đã chứng minh mối tương quan thấp với cả thể tích nội mạch và thay đổi chỉ số tim.69 Áp lực tĩnh mạch trung tâm thậm chí có thể kém tin cậy hơn ở những bệnh nhân nhiễm trùng huyết có HF từ trước, vì áp lực đổ đầy ước tính tiền tải phụ thuộc vào compliance của thất,70 vốn dĩ thay đổi trong HF mãn tính. 32 Nói chung, rối loạn chức năng RV tạo ra CVP tăng giả, trong khi LVD và phù phổi đơn thuần có thể không làm thay đổi mạnh CVP.71,72 Bệnh nhân có thể có LVs quá giãn trong khi CVPs dưới 8 mm Hg, mà có thể dẫn đến tình trạng quá tải dịch do CVP hướng dẫn và vô tình gây ra HF cấp tính.73 Việc thiếu tính hữu ích tổng thể trong việc hướng dẫn hồi sức nhiễm trùng huyết và khả năng tăng cường độ không chắc chắn trong HF làm cho CVP trở thành một công cụ không hiệu quả để hướng dẫn hồi sức.
Siêu âm tại chỗ.
Rối loạn chức năng tim vốn có ở bệnh nhân nhiễm trùng huyết có HF từ trước có thể khiến các bác sĩ lâm sàng tìm kiếm hướng dẫn từ siêu âm ban đầu trong quá trình hồi sức để dự đoán khả năng đáp ứng bù dịch. Đánh giá của bác sĩ hồi sức trước khi bác sĩ tim mạch giải thích siêu âm xác định không chính xác 40% chức năng LV và 50% chức năng RV ở trên bệnh nhân cho thấy sự tham gia của chuyên gia, điều này không phải lúc nào cũng có sẵn, có thể vấn đề quan trọng đối với thực hành này.74 Thật vậy, bác sĩ tim mạch đã giải thích về siêu âm tại giường cải thiện niềm tin của bác sĩ lâm sàng trong việc ra quyết định liên quan đến việc sử dụng dịch truyền.74 Tuy nhiên, siêu âm tại giường ở khoa cấp cứu trước khi bắt đầu can thiệp sốc nhiễm trùng có liên quan đến tỷ lệ tử vong cao hơn so với không siêu âm hoặc siêu âm sau can thiệp.75 Siêu âm trước liên quan đến việc hồi sức dịch ít tích cực hơn có thể dẫn đến kết quả kém hơn. Điều thú vị là, phân tích độ nhạy không tìm thấy sự khác biệt nào về tỷ lệ tử vong đã điều chỉnh ở những bệnh nhân dùng thuốc vận mạch.75 Do khả năng xảy ra sai sót của người đánh giá và tác hại tiềm tàng, không nên sử dụng siêu âm tại giường trước khi hồi sức truyền dịch theo hướng dẫn nếu không có sự giải thích của chuyên gia. Các nghiên cứu tiến cứu trong tương lai là cần thiết để đánh giá xem liệu siêu âm tại điểm chăm sóc có thể cung cấp một cách tiếp cận sắc nét hơn để hồi sức đặc biệt ở những bệnh nhân nhiễm trùng huyết có HF từ trước hay không.
Sử dụng dịch truyền
Các hướng dẫn về nhiễm trùng huyết khuyến cáo nên dùng liều 30 mL/ kg dịch thể tinh thể trong vòng 3 giờ sau khi nhập viện để điều chỉnh hạ huyết áp ở những bệnh nhân nhiễm trùng huyết, bất kể các tình trạng bệnh đi kèm.9 Liệu pháp mục tiêu trực tiếp sớm (EGDT) cung cấp một nền tảng phân phối một thể tích lớn dịch truyền hồi sức cho tất cả bệnh nhân nhiễm trùng huyết. 51Tuy nhiên, EGDT và các mục tiêu của nó đã bị nghi ngờ bởi các thử nghiệm lớn, và nó bị bác bỏ hiệu quả của và cũng cho thấy cường độ chăm sóc tăng lên mà không có lợi ích lâm sàng.76-78 Một phân tích tổng hợp gần đây của các nhà điều tra PRISM cho thấy không có lợi ích về tử vong (tổng thể và trong một phân nhóm rối loạn chức năng tim mạch cơ bản) và chi phí nhập viện cao hơn với EDGT.79 Mặc dù những người quản lý nhiễm trùng huyết đã được định hướng lại, tài liệu về việc sử dụng dịch truyền ở bệnh nhân HF bị nhiễm trùng huyết chủ yếu giới hạn trong các nghiên cứu quan sát và hồi cứu vốn dĩ có các kết quả mâu thuẫn nhau (Bảng 5). Bằng chứng quy kết việc sử dụng dịch truyền truyền thống dẫn đến kết quả xấu hơn ở bệnh nhân HF bị nhiễm trùng huyết còn ít; tuy nhiên, việc cung cấp dịch theo hướng dẫn trong quá trình hồi sức cấp tính được đa số y văn ủng hộ vì nó có khả năng làm giảm tỷ lệ tử vong mà không có nguy cơ quá tải dịch và các biến cố bất lợi khác.
Một nghiên cứu hồi cứu cho thấy tỷ lệ tử vong gia tăng ở những bệnh nhân nhiễm trùng huyết nặng/ sốc nhiễm trùng và HFrEF được truyền > 3 L dịch.80 Liệu mối liên quan với tỷ lệ tử vong có thể do sự hiện diện của rối loạn chức năng tâm thu hoặc nhiễm trùng huyết nặng hơn hay không vẫn chưa rõ ràng. Lưu ý, 3 L dịch có thể đạt được khi dịch hồi sức truyền vượt quá 30 mL/ kg bolus ban đầu, vì trọng lượng trung bình là 70 kg sẽ chỉ cung cấp khoảng 2 L dịch. Ngoài ra, khung thời gian truyền chất lỏng không được báo cáo, gây khó khăn cho việc áp dụng mức giới hạn thể tích này. 80 Leisman và cộng sự đã báo cáo HF là dự đoán kiểu hình kháng trị với hồi sức dịch, nhưng ngay cả trong số những bệnh nhân HF, hơn một nửa số bệnh nhân ban đầu đáp ứng với dịch truyền. Chậm trễ truyền dịch là yếu tố tiên đoán nhất của kiểu hình kháng trị, 84 và truyền dịch bị trì hoãn đã được báo cáo trong HF qua các nghiên cứu quan sát. 90,91 Yếu tố này có thể ngụ ý rằng HF được tiên đoán do chậm truyền dịch. Kelm và cộng sự đã đánh giá tình trạng quá tải dịch sau EGDT ở 405 bệnh nhân bị sốc nhiễm trùng và không tìm thấy sự gia tăng đáng kể trong ngày đầu tiên hoặc tình trạng ứ dịch kéo dài trong một nhóm nhỏ gồm 60 bệnh nhân nhiễm trùng huyết và HF, mặc dù nghiên cứu không được thiết kế để đánh giá kết quả này.88 Trong số các nghiên cứu đoàn hệ nhiễm trùng huyết với 71% bệnh nhân có suy tim từ trước, Khan và cộng sự không tìm thấy sự khác biệt về tốc độ đặt nội khí quản giữa việc nhận 81 Nghiên cứu này là nghiên cứu đầu tiên đánh giá trực tiếp tác động của truyền dịch truyền thống đối với tỷ lệ đặt nội khí quản như là một kết cuộc chính, và không có tác hại từ dịch truyền từ việc lo ngại về phù phổi do hồi sức truyền dịch.
Một nghiên cứu hồi cứu lớn đánh giá nhiều quần thể cho thấy một phân nhóm gồm 1045 bệnh nhân HF bị nhiễm trùng huyết đã giảm tỷ lệ tử vong khi tuân thủ gói nhiễm trùng huyết kéo dài 3 giờ bao gồm 30 mL/ kg bolus dịch bắt đầu trong vòng 30 phút (tỷ lệ tử vong tại bệnh viện 60 ngày OR: 0,67; KTC 95%: 0,47- 0,95; P= 0.026).85 Lợi ích được nhấn mạnh một cách đáng ngạc nhiên trong phân nhóm HF so với nhóm tổng thể 85; tuy nhiên, những kết quả này có thể không chỉ do thể tích hồi sức, khi mà tác dụng kịp thời của việc thực hiện gói hồi sức không liên quan chặt chẽ đến dịch hồi sức và có thể là do sử dụng thuốc kháng sinh sớm, kiểm soát nguồn nhiễm và các biện pháp điều trị bổ sung. Liu và cộng sự đã nghiên cứu 4144 bệnh nhân HF trong các giai đoạn riêng biệt khi thực hiện trước và sau thực hiện theo gói và nhận thấy tỷ lệ tuân thủ theo gói giảm tỷ lệ tử vong ở bệnh nhân HF.86 Tỷ lệ tử vong sau gói đối với bệnh nhân HF giảm (11,6% so với 14,8%; P = 0,03). Việc giảm tỷ lệ tử vong loại trừ bệnh nhân bị HF và / hoặc bệnh thận và không nhìn thấy khi những bệnh nhân này bị loại khỏi phân tích.86 Shah và Ouellette báo cáo việc tuân thủ EGDT làm giảm tỷ lệ tử vong trong bệnh viện ở bệnh nhân nhiễm trùng huyết với EF giảm (16,7% so với 36,3%; P 92 Nói chung, dữ liệu chứng minh sự tuân thủ với liệu pháp hướng đến mục tiêu và mục tiêu dịch truyền có khả năng cải thiện tỷ lệ mắc bệnh và tử vong ở bệnh nhân HF bị nhiễm trùng huyết.
Việc không tuân thủ các gói điều trị nhiễm trùng huyết hoặc liệu pháp khuyến cáo theo hướng dẫn cho thấy tác dụng trung tính hoặc có hại trong nhiễm trùng huyết có HF từ trước, và việc điều chỉnh rộng rãi mục tiêu dịch truyền dựa trên sự hiện diện của HF mà không có đánh giá lâm sàng cẩn thận là không có cơ sở. Đề xuất với 1 kết quả trung tính, một nghiên cứu trên 1027 bệnh nhân bị sốc nhiễm trùng gần đây cho thấy việc không đạt được một lượng thể tích dịch 30 mL / kg ban đầu không ảnh hưởng đến tỷ lệ tử vong (OR: 1,03; KTC 95%: 0,76-1,41).82 Phát hiện này, cùng với mối quan tâm đối với dư thừa dịch làm tăng tỷ lệ tử vong do ICU, tiếp tục bác bỏ cách tiếp cận “một kích thước phù hợp với tất cả” trong hồi sức bằng dịch truyền, nhưng không có phân nhóm HF nào được phân tích. Seymour và cộng sự đã quan sát thấy sự gia tăng tỷ lệ tử vong cho mỗi giờ chậm trễ của gói hồi sức nhiễm trùng huyết 3 giờ ở bệnh nhân HF, nhưng kết quả này không được quan sát thấy cho mỗi giờ chậm truyền dịch bolus.87 Kết quả bị giới hạn bởi thời gian bắt đầu truyền dịch không chuẩn, và liệu thời gian 0 có thực sự liên quan đến thời điểm dịch được bắt đầu cho vào người bệnh nhân tại cấp cứu hay trại lâm sàng hay không là không xác định. Ngược lại, Kuttab và cộng sự cho thấy việc không đạt được 30 mL/ kg trong 3 giờ có liên quan đến việc tăng tỷ lệ tử vong khi nhập viện bất kể bệnh đi kèm (OR: 1,52; KTC 95%: 1,03-2,24).90 Tuy nhiên, không có sự khác biệt đáng kể về tử vong là quan sát thấy không đáp ứng được 30 mL/ kg sau 3 giờ trong HF (OR: 1,48, KTC 95%: 0,68-3,21), mặc dù nghiên cứu không được cung cấp để đánh giá phân nhóm này. 90 Một đoàn hệ gồm 333 bệnh nhân nhiễm trùng huyết nặng/ sốc nhiễm trùng với HF đã có từ trước cho thấy không đạt được 30 mL / kg không liên quan đến tăng tỷ lệ tử vong (25,6% so với 21%; P = 0.36).83 Tuy nhiên, ở nhóm bệnh nhân có HF và bị hạ huyết áp, được hồi sức truyền dịch đầy đủ liên quan đến tỷ lệ tử vong thấp hơn (23% so với 43%; P = 0.0015) và tỷ lệ đặt nội khí quản thấp hơn (46% so với 65%; P = 0.008).83 Những kết quả này nhấn mạnh tầm quan trọng của việc duy trì các mục tiêu dịch truyền theo hướng dẫn ở bệnh nhân HF với nhiễm trùng huyết do hồi sức không đầy đủ đã cho thấy kết quả tốt nhất, trung tính và xấu hơn.
Mặc dù có bằng chứng ủng hộ việc hồi sức truyền dịch theo hướng dẫn, các bác sĩ lâm sàng có xu hướng hồi sức dưới mức cho bệnh nhân HF do lo ngại về quá tải thể tích. Wardi và cộng sự gần đây đã khảo sát các bác sĩ lâm sàng chăm sóc tích cực, và 43% người được hỏi không tin rằng truyền dịch 30 mL/ kg là thích hợp cho bệnh nhân nhiễm trùng huyết với HFrEF, trong khi chỉ 11% cho rằng không phù hợp ở bệnh nhân không có HFrEF (P 93 Không có gì đáng ngạc nhiên khi không đạt được mức hồi sức dịch 30 mL/ kg ở bệnh nhân HF.82,89-91 Kuttab và cộng sự nhận thấy giảm được tỷ lện chênh khi đạt được mục tiêu 30 mL/ kg dịch trong 3 giờ ở bệnh nhân HF giảm. (14,3 mL/ kg ở bệnh nhân HF so với 30 mL/ kg ở bệnh nhân không có HF; OR: 0,42 [0,29-0,60]). 90 Leisman và cộng sự nhận thấy bệnh nhân có HF liên quan với thời gian bắt đầu truyền dịch lâu hơn (b = 20 phút; CI, 14 đến 25; P 91 Abou Dagher và cộng sự phát hiện bệnh nhân bị nhiễm trùng huyết và có từ trước HF nhận được ít dịch qua đường tĩnh mạch (IV) hơn trong 24 giờ đầu (2,75 + 2,28 L so với 3,67 + 2,82L; P = 0,038)
Trong khi lo ngại về mặt lâm sàng có thể gây hồi sức dưới mức ở bệnh nhân HF với nhiễm trùng huyết, dữ liệu có sẵn không hỗ trợ thực hành này và đại đa số các tài liệu ủng hộ việc chống lại phương pháp hồi sức dưới mức.
Sau giai đoạn hồi sức cấp tính của nhiễm trùng huyết, các chiến lược điều trị trong giai đoạn tối ưu hóa, ổn định và sơ tán (rút dich) của quản lý dịch truyền vẫn chưa rõ ràng.94 Nghiên cứu thí điểm Thử nghiệm dịch truyền IV hạn chế trong Nhiễm trùng huyết nặng và Sốc nhiễm trùng (Restrictive IV Fluid Trial in Severe Sepsis and Septic Shock) đã kiểm tra hiệu quả của việc quản lý dịch truyền bảo tồn (95 Không quan sát thấy sự khác biệt về tỷ lệ tử vong giữa phương pháp truyền dịch bảo tồn và chăm sóc thông thường (21,8% so với 22,8%; P = 0,99). Truyền ít dịch hơn được quan sát thấy trong 24 giờ đầu tiên sau khi phân nhóm ngẫu nhiên (7,8 so với 16,6 mL/ kg; P = 0,02); tuy nhiên, mỗi nhóm có khoảng 9 giờ từ phân loại đến ngẫu nhiên, trong đó cả hai đều nhận được > 30 mL/ kg dịch (34,4 so với 36,2 mL/ kg; P = 0.49), 95 cho thấy rằng cuộc thảo luận về quản lý dịch bảo tồn xảy ra sau lần đầu 30 mL/ kg bolus. Hjortrup và cộng sự đã kiểm tra tiền cứu chiến lược truyền dịch bảo tồn so với chăm sóc tiêu chuẩn trong 5 ngày sau khi hồi sức ban đầu và nhận thấy giảm tỷ lệ suy giảm chức năng thận trong nhóm hạn chế (37% so với 54%; P = 0.03) .96 Những kết quả này cung cấp cái nhìn sâu sắc về các cơ hội để giảm thiểu một cách an toàn việc truyền dịch thừa mà không ảnh hưởng đến lợi ích lâm sàng của hồi sức cấp tính, một chiến lược hấp dẫn cho bệnh nhân HF.
Dữ liệu cho thấy sự cân bằng dịch cao hơn trong thời gian nhập viện tương quan với tăng tỷ lệ tử vong, 38,68,97 nhưng bệnh nhân có dấu hiệu HF nặng đã bị loại khỏi các phân tích này. Điều thú vị là việc hạn chế dịch tích cực trong vài ngày đã không chứng tỏ kết quả cải thiện ở bệnh nhân HF cấp mất bù không nhiễm trùng.98,99 Một phân tích tổng hợp gần đây về hồi sức ở những bệnh nhân nặng cho thấy phương pháp truyền dịch bảo tồn dẫn đến ít ICU hơn và số ngày thở máy mà không làm tăng các biến cố bất lợi nhưng không ảnh hưởng đến tỷ lệ tử vong; tuy nhiên, tổng quan đã loại trừ các nghiên cứu bao gồm các bệnh nhân HF.100 Tác động của việc tối ưu hóa giai đoạn xuống thang hồi sức và hạn chế dịch sau khi hồi sức ban đầu trong nhiễm trùng huyết có HF từ trước đưa ra một câu hỏi lâm sàng hấp dẫn vẫn chưa được trả lời, nhưng bằng chứng hiện tại cho thấy có thể có lợi mà không có hại với cách tiếp cận thận trọng được áp dụng sau khi hồi sức ban đầu.
Tóm lại, những bệnh nhân có biểu hiện nhiễm trùng huyết và HF đã có từ trước không nên ngừng sử dụng liều lượng 30 mL/ kg dịch tinh thể được khuyến cáo trong giai đoạn hồi sức cấp tính. Đạt được 30 mL/ kg dịch trong 3 giờ là mục tiêu hợp lý ở bệnh nhân nhiễm trùng huyết có HF từ trước, vì nó đã cải thiện kết quả ở bệnh nhân nhiễm trùng huyết.82 Tuy nhiên, nên thận trọng ở bệnh nhân HF giai đoạn nặng và nghiên cứu về các phân nhóm cụ thể này (ví dụ: EF
Các biện pháp dược lý cho điều trị nhiễm trùng huyết có hf trước đó
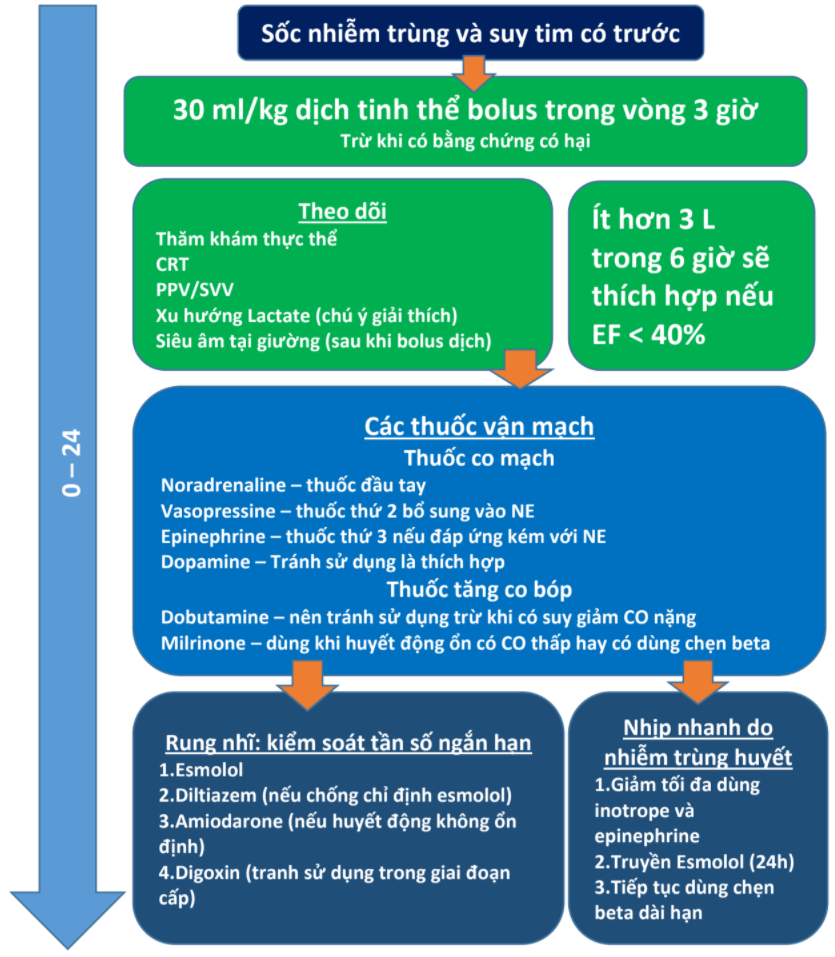
Các hướng dẫn về Nhiễm trùng huyết khuyến cáo norepinephrine (NE) như thuốc vận mạch đầu tay trong nhiễm trùng huyết và sốc nhiễm trùng, sau đó là vasopressin và có thể epinephrine hoặc dopamine như là lựa chọn hàng thứ hai hoặc thứ ba. Các khuyến cáo chất lượng thấp được đưa ra đối với việc sử dụng dopamine, epinephrine và dobutamine trong một số quần thể bệnh nhân được chọn lọc và bằng chứng chủ yếu dựa trên sự cải thiện các thông số huyết động và ảnh hưởng trung tính đến kết quả.9 Do thiếu bằng chứng liên quan đến thuốc vận mạch ở bệnh nhân nhiễm trùng huyết với HF đã có từ trước, dữ liệu chủ yếu được trích xuất từ các phân nhóm trong các nghiên cứu về nhiễm trùng huyết, sốc nhiễm trùng và các kiểu hình sốc khác. Hình 1 tóm tắt các can thiệp tối ưu được đề xuất trong hồi sức trong sốc nhiễm trùng với HF có từ trước liên quan đến cả liệu pháp truyền dịch và dược lý.
Norepinephrine.
Là thuốc vận mạch đầu tay trong nhiễm trùng huyết, 9 NE có bằng chứng ủng hộ nhất. Norepinephrine làm trung gian cho sự co thắt động mạch thông qua chủ vận adrenergic aipha-1, và tác động co bóp cơ tim tương đối hạn chế được quan sát thông qua kích thích beta -1.101 Hơn nữa, NE có thể trực tiếp kích thích sự giãn mạch vành ở những người suy tim.102 Tác động hỗn hợp này đã tạo ra sự quan tâm đến vai trò của NE trong hỗ trợ huyết động trong quá trình sốc tim.
Hình 1. Mô tả các biện pháp can thiệp tối ưu được đề xuất cho sốc nhiễm trùng với HF đã có từ trước trong 24 giờ xử trí đầu tiên. Dịch hồi sức nên bao gồm 30 mL/ kg được dùng trong 3 giờ đầu trừ khi có những phát hiện rõ ràng cho thấy có nguy cơ gây hại cao. Theo dõi nên bao gồm đánh giá lâm sàng cẩn thận và các chỉ số về tình trạng hồi sức thể tích. Truyền ít hơn 3 L dịch ở bệnh nhân HFrEF trong 6 giờ đầu cung cấp một mục tiêu bảo tồn hợp lý; tuy nhiên, không nên ngưng dịch truyền khi có nhiều chỉ số và tình trạng lâm sàng cho thấy nó sẽ rất có lợi. Thuốc vận mạch được ưu tiên là NE, vasopressin, và có thể là epinephrine, trong khi dopamine nên tránh dùng khi có thể. Inotropes không được khuyến cáo phổ biến, nhưng dobutamine có thể được xem xét ở những bệnh nhân có CO thấp kéo dài và EF thấp. Milrinone có thể hiệu quả hơn ở những bệnh nhân hiện đang điều trị bằng BB. Nếu có AF, có thể sử dụng esmolol và diltiazem trong thời gian ngắn, và amiodarone có thể thuận lợi hơn về mặt huyết động đối với những người có liên quan đến những thay đổi nhỏ về huyết áp. Digoxin không nên được sử dụng thường quy để xử trí AF cấp tính. Nhịp tim nhanh do nhiễm trùng do kích thích quá mức adrenergic và tăng công của tim có thể được giảm thiểu bằng cách tránh thuốc kích thích co bóp và epinephrine, và bằng cách truyền esmolol bắt đầu 24 giờ sau khi tối ưu hóa huyết động hoặc tiếp tục BB tại nhà.
Thử nghiệm Nhiễm trùng huyết xuất hiện ở bệnh nhân cấp tính (SOAP- Sepsis Occurrence in Acutely Ill Patients) II đã chứng minh sự vượt trội của NE so với dopamine ở 280 bệnh nhân bị sốc tim thông qua việc giảm so sánh tỷ lệ tử vong trong 28 ngày (P = 0,03) và tỷ lệ rối loạn nhịp tim thấp hơn trong tất cả các biến thể của sốc ( ví dụ, giảm thể tích, nhiễm trùng và tim mạch).103 Để phù hợp với những kết quả này, một phân tích tổng hợp năm 2015 đã thúc đẩy đưa ra các hướng dẫn khuyến cáo NE hơn dopamine làm thuốc vận mạch đầu tay trong sốc nhiễm trùng vì nó chứng minh tỷ lệ tử vong thấp hơn (tỷ lệ rủi ro [RR]: 0,89; 95 % CI: 0,81-0,98) và nguy cơ loạn nhịp tim thấp hơn (RR: 0,48; KTC 95%: 0,40- 0,58).104 Dữ liệu quan sát thấy nhịp tim thấp tương đối hơn (HR) là 19 nhịp mỗi phút khi so sánh NE với dopamine, có thể giảm thiểu sự gia tăng nhu cầu oxy của cơ tim. Một phân tích tổng hợp gần đây khác so sánh NE với dopamine trong sốc tim và một lần nữa kết luận NE có liên quan đến tỷ lệ tử vong và rối loạn nhịp tim thấp hơn trong 28 ngày bất kể căn nguyên của sốc tim.105 Norepinephrine được đánh giá tiến cứu so với epinephrine để xử trí sốc tim thứ phát sau nhồi máu cơ tim ở 57 bệnh nhân và NE giảm sốc kháng trị (7% so với 32%; P = 0,008) và có nhịp tim thấp hơn, ít lactate máu hơn và ít nhiễm toan hơn.106
Ngay cả khi các khía cạnh của sinh lý bệnh HF cho thấy hiệu quả giảm, NE có thể có tác dụng có lợi đối với chức năng tim. Norepinephrine làm tăng CO ở những bệnh nhân sốc nhiễm trùng và EF ban đầu trung bình là 47% những người có phản ứng tích cực với động tác nâng chân thụ động (tức là đáp ứng thể tích với dự trữ tiền tải của tim).107 Tương tự, Maas và cộng sự kết luận rằng SVV > 8,7% là dự đoán của tăng CO với NE gây ra. Tuy nhiên, bệnh nhân HF thường thiếu dự trữ tiền tải trước tim được phát hiện trong các đánh giá đáp ứng thể tích, 109 và sự thiếu hụt dự trữ tiền tải này gây ra lo ngại về việc giảm hiệu quả của NE. Mặt khác, hồi lưu tĩnh mạch tăng lên do co mạch có thể làm giảm nhu cầu truyền dịch thông qua việc huy động dịch từ các bể chứa mạch máu tĩnh mạch.110 Mặc dù gây nhiễu cơ học trong HF, một nghiên cứu quan sát cho thấy NE cải thiện chỉ số tim và chỉ số SV ở bệnh nhân EF 111 Thật thú vị, một nhóm nhỏ bệnh nhân bị giảm chỉ số tim sau khi dùng NE, điều này có thể đại diện cho một nhóm mà sự gia tăng hậu tải cho thấy rối loạn chức năng tâm thu là cơ bản của HF.111 Hamzaoui và cộng sự cho thấy NE tăng LVEF ở 38 bệnh nhân sốc nhiễm trùng. (49% -56%; P 112 Tổng hợp lại, những dữ liệu này chứng minh rằng những bệnh nhân đáp ứng với thể tích có thể tăng CO hơn do tác động của NE. Tuy nhiên, ngay cả trong bối cảnh lo ngại về khả năng đáp ứng thể tích thấp trong HF, NE cũng đã cải thiện EF trong HFrEF. Liệu việc tích cực huy động lượng dịch dư thừa hiện có trong mạch máu của bệnh nhân HF thông qua co mạch có thể thay thế cho việc truyền dịch sớm hay không vẫn chưa được biết. Nguyên tắc này có thể cho phép sử dụng NE sớm hơn ở những bệnh nhân lo lắng về tình trạng quá tải dịch bằng cách sử dụng thể tích tăng lên từ dung tích tĩnh mạch của bệnh nhân HF. Thử nghiệm Hồi sức sớm với dịch tinh thể tự do hay Vận mạch sớm trong nhiễm trùng huyết (CLOVERS – Crystalloid Liberal or Vasopressors Early Resuscitation in Sepsis) hiện đang được tuyển dụng mẫu và sẽ bắt đầu giải quyết suy nghĩ này vì nó so sánh chiến lược truyền dịch sớm với chiến lược vận mạch sớm trong nhiễm trùng huyết.113 Tóm lại, NE đã được chứng minh là an toàn và hiệu quả ở những bệnh nhân bị nhiễm trùng huyết và rối loạn chức năng tim và nên vẫn là thuốc vận mạch hàng đầu ở những bệnh nhân bị sốc nhiễm trùng và HF.
Vasopressin.
Vasopressin được khuyến cáo như một thuốc vận mạch thứ hai trong sốc nhiễm trùng9 nhưng không có khuyến cáo nào về việc sử dụng trong HF cấp tính hoặc sốc tim.10 Kích hoạt hệ thống renin-angiotensin-aldosterone qua trung gian suy tim dẫn đến tăng mãn tính nồng độ vasopressin nội sinh, 114 và đối kháng với vasopressin đã được áp dụng như một chiến lược điều trị trong HF.10 Ngược lại, sốc nhiễm trùng cho thấy thiếu hụt vasopressin nội sinh, đặc biệt là trong giai đoạn cuối của sốc.116 Những tác dụng cạnh tranh này có thể làm giảm hiệu quả của vasopressin ở bệnh nhân sốc nhiễm khuẩn và HF như đã có từ trước nồng độ vasopressin tăng cao trong HF có thể làm giảm mức độ thiếu hụt trong nhiễm trùng huyết và do đó, lợi ích của việc thay thế vasopressin. Việc sử dụng các thuốc đồng vận vasopressin trong HF dường như bị lấn cấn bởi các nguyên tắc sinh lý bệnh, nhưng vai trò của nó trong sốc nhiễm trùng vượt trội hơn những quan tâm về mặt lý thuyết này.
Là một chất co mạch mạnh, mối quan tâm tồn tại về tác động tiêu cực của vasopressin đối với tưới máu mạch vành, điều này đã được chứng minh trên các mô hình động vật.117,118 Ngoài ra, nên thận trọng ở những bệnh nhân bị nhiễm trùng hỗn hợp và sốc tim vì co mạch qua trung gian vasopressin thông qua hoạt hóa thụ thể V1 làm tăng hậu tải đáng kể mà không có hiệu ứng co bóp trực tiếp (không giống như NE), do đó làm giảm thêm CO.119
Tuy nhiên, không có dữ liệu nào trên người cho thấy sự gia tăng tổn thương tim hoặc giảm CO ở những bệnh nhân được điều trị bằng vasopressin. Nghiên cứu VASST (Vasppressin and Septic Shock Trial) so sánh vasopressin với noradrenaline và ghi nhận vasopressin gây giảm tử vong ở phân nhóm bệnh nhân nhiễm trùng huyết ít nghiêm trọng hơn (nhu cầu NE: 5-14 mcg/ phút).124 Phân tích hậu kiểm về tác dụng tim phổi của vasopressin trong thử nghiệm VASST (vasopressin so với NE trong sốc nhiễm trùng) cho thấy vasopressin không làm giảm chỉ số tim so với NE ngay cả ở nhóm bệnh nhân có CO thấp nhất. 121 Ngoài ra, vasopressin có liên quan đến nhịp tim thấp hơn so với NE.121. Thử nghiệm VASST đã loại trừ những bệnh nhân có HF nặng cơ bản (Hiệp hội Tim mạch New York [NYHA] loại III hoặc IV ) hạn chế các kết luận từ nghiên cứu vasopressin lớn nhất cho đến nay.124 Đáng chú ý, vasopressin gây co mạch mạch trong khu vực hồ chứa dịch của hệ thống mạch máu trong các tạng, 125 và tác động huy động thể tích này ở bệnh nhân HF làm tăng sự cẩn trọng, mặc dù không có bằng chứng nào chứng minh mối quan tâm này. Tóm lại, do thiếu dữ liệu trên người về tác dụng ngoại ý và hiệu quả khi kết hợp với NE, vasopressin nên vẫn là chất được lựa chọn để bổ sung vào NE trong nhiễm trùng huyết có HF từ trước.
Epinephrine.
Epinephrine được khuyên dùng như một thuốc vận mạch thứ hai để bổ sung NE trong xử trí sốc nhiễm trùng với chất lượng bằng chứng yếu.9 Trong khi epinephrine được sử dụng trong sốc nhiễm trùng, công dụng của nó ở trạng thái cung lượng thấp của HF cấp tính còn bị tranh cãi.126 Thông qua trung gian thụ thể beta-1, sức co bóp tăng, epinephrine làm tăng SV, EF và CO, 127 tất cả đều lý tưởng cho bệnh nhân HF. Epinephrine đã chứng minh kết cục so sánh với NE trong sốc nhiễm trùng nhưng có những lo ngại về tác dụng ngoại ý về chuyển hóa và tưới máu các tạng không có với NE.128-130
Trong một đoàn hệ hồi cứu, Sato và cộng sự cho thấy tăng loạn nhịp tim và tử vong khi sử dụng epinephrine trong sốc nhiễm trùng (tử vong HR: 4,79; KTC 95%: 2,12-10,82; P 131 Trong một thử nghiệm lâm sàng trên bệnh nhân ICU cần NE hoặc epinephrine, không có sự khác biệt về thời gian để đạt mục tiêu áp lực động mạch trung bình (MAP) hoặc tỷ lệ tử vong ở bệnh nhân nhiễm trùng huyết nặng và suy tuần hoàn.132 Tuy nhiên, epinephrine tạo ra nhiều tác dụng phụ về chuyển hóa hơn và nhịp tim nhanh.132 Levy et al so sánh epinephrine với NE + dobutamine để xử trí sốc tim không do nhồi máu cơ tim (90% bệnh nhân có tiền sử HF) và nhận thấy sự gia tăng tương tự về các đáp ứng huyết động toàn phần (ví dụ: chỉ số tim, MAP).133 Epinephrine làm tăng nhịp tim, loạn nhịp tim, lactate, và tưới máu niêm mạc dạ dày không đầy đủ so với NE/ dobutamine.133 Một thử nghiệm gần đây về epinephrine so với NE ở những bệnh nhân bị sốc tim do nhồi máu cơ tim cấp đã quan sát thấy nhiều sốc kháng trị hơn ở epinephrine nhóm dẫn đến kết thúc thử nghiệm sớm (37% so với 7%; P = 0.008).106 Nhịp tim, sản phẩm kép trên tim và nhiễm axit lactic tăng đáng kể với epinephrine, trong khi không thay đổi với NE.106
Lactate tăng cao từ epinephrine thường được coi là một tác dụng phụ; tuy nhiên, sự đánh chi tiêt hơn về sắc thái của lactate được cảnh báo. Lactate được tạo ra từ epinephrine đến từ sự đáp ứng thụ thể beta-2 của quá trình đường phân hiếu khí và không chỉ do thiếu oxy.45 Lactate ngoại sinh cho thấy sẽ thúc đẩy CO trong đợt suy tim cấp mất bù ở bệnh nhân HFrEF. 134 Ngoài ra, sự gia tăng lactate sau epinephrine có tiên lượng kết cuộc tốt hơn ở bệnh nhân sốc không đặc hiệu và sốc nhiễm trùng. 136 Lactate có thể không phải là hậu quả tiêu cực hoàn toàn của epinephrine, và các nghiên cứu trong tương lai nên điều tra lợi ích của epinephrine dựa trên mức lactate ban đầu.
Tóm lại, dữ liệu hạn chế hỗ trợ sử dụng epinephrine trong nhiễm trùng huyết và sốc nhiễm trùng với HF đã có từ trước. Epinephrine đã cho thấy các tác dụng phụ gây loạn nhịp tim mà không có lợi ích về huyết động so với các thuốc khác khi kiểm soát trạng thái sốc tim và nên tránh, nếu có thể, trong điều trị nhiễm trùng huyết có HF từ trước.
Dopamine.
Dopamine được khuyến cáo như một thuốc vận mạch cuối cùng cho sốc nhiễm trùng do nguy cơ loạn nhịp tim cao hơn so với các thuốc vận mạch khác.9 Tính co bóp và vận mạch của Dopamine đã làm cho nó hấp dẫn để quản lý huyết động101; tuy nhiên, bằng chứng cho thấy tác dụng có hại trên tim làm phức tạp việc sử dụng nó ở bệnh nhân HF bị nhiễm trùng huyết. De Backer và cộng sự kết luận dopamine có liên quan đến tỷ lệ tử vong cao hơn và loạn nhịp tim nhiều hơn so với NE trong sốc nhiễm trùng.137 Như đã mô tả trước đây, dopamine kém hơn NE trong thử nghiệm SOAP II và trong các phân tích tổng hợp về sốc không đặc hiệu, nhiễm trùng và sốc tim. 103-105 Cơ chế của những kết quả bất lợi này có thể là do sự gia tăng nhịp tim và tần suất loạn nhịp tim cao hơn, đặc biệt là rung nhĩ (AF), với dopamine so với NE.103,137 Tỷ lệ tử vong gia tăng không được thấy trong sốc nhiễm trùng hoặc giảm thể tích ở Thử nghiệm SOAP II, cho thấy các tác dụng có hại trên tim cụ thể.103 Bệnh nhân bị HF nặng có nguy cơ bị sốc tim tăng lên giữa nhiễm trùng huyết, càng khiến cho việc lựa chọn thuốc vận mạch thay đổi dopamine.138
Dopamine đã được đánh giá tiến cứu ở những bệnh nhân HF cấp tính với EFs trung bình từ 30% đến 35%.139,140 Những thử nghiệm này không chứng minh rằng dopamine gia tăng tác dụng phụ trên tim, nhưng một hạn chế lớn trong việc ngoại suy những dữ liệu này cho những bệnh nhân HF nhiễm trùng là liều sử dụng trong những thử nghiệm này. Các thử nghiệm HF là 5 mcg/ kg/ phút.139,140 Liều trong SOAP II đại diện cho liều lượng dopamine cho nhiễm trùng huyết/ sốc nhiễm trùng và dao động từ khoảng 12 đến 16 mcg/ kg/ phút trong 7 ngày đầu tiên.103 Xem xét liều dopamine ảnh hưởng lớn đến thụ thể mục tiêu, càng có nhiều tác dụng ngoại ý quan sát được từ dopamine ở liều cao hơn (đặc biệt là loạn nhịp tim) có thể hạn chế kết quả an toàn của các thử nghiệm trong HF cấp tính. Hơn nữa, Mebazaa và cộng sự quan sát thấy rằng dopamine có mối liên quan cao nhất với tỷ lệ tử vong trong số các thuốc co mạch khi được sử dụng trong HF cấp tính, phần lớn là do tỷ lệ tử vong tại bệnh viện cao hơn.141 Đáng chú ý, một phân tích tổng hợp gần đây về dopamine ở những bệnh nhân nặng bị rối loạn chức năng tim, dopamine không ảnh hưởng đến tỷ lệ tử vong; tuy nhiên, các thử nghiệm bao gồm có liều trong khoảng từ 2 đến 10 mcg/ kg/ phút, với hầu hết là dưới 5 mcg/ kg/ phút.142
Tóm lại, dữ liệu về dopamine đối với nhiễm trùng huyết với HF đã có từ trước bị hạn chế với tác dụng phụ thuộc vào liều lượng rõ ràng lên trên các kết cục bất lợi, cho thấy tác dụng phụ càng lớn khi dùng liều càng cao trong sốc nhiễm trùng. Do tác dụng phụ trong nhiễm trùng huyết và sốc tim, nguy hại được nghi ngờ trong HF cấp tính và không có lợi ở những bệnh nhân bị bệnh nặng có rối loạn chức năng tim, dopamine thường nên tránh ở những trường hợp nhiễm trùng huyết có HF từ trước.
Dobutamine.
Dobutamine được khuyên dùng để điều trị hạ huyết áp dai dẳng mặc dù đã truyền dịch và thuốc vận mạch ở bệnh nhân nhiễm trùng huyết9 và lịch sử trong bối cảnh cải thiện ScvO2 lên > 70% ở EGDT.51 Dobutamine cũng được sử dụng trong HF nặng để hỗ trợ bệnh nhân có CO thấp.10 Những ứng dụng này xuất phát từ hiệu ứng co bóp mạnh mẽ của nó làm tăng cường phân phối oxy, MAP và CO
Mặc dù có một cơ chế hấp dẫn, dobutamine phần lớn không cải thiện được quá trình oxy hóa và kết quả ở bệnh nhân nhiễm trùng huyết, nhưng một số nghiên cứu gần đây cho thấy một lợi ích. Lập luận chống lại việc sử dụng dobutamine, Sato et al ghi nhận có liên quan dobutamine với tỷ lệ tử vong và tần suất AF cao hơn trong sốc nhiễm trùng.131 Hernandez et al nhận thấy dobutamine không cải thiện được các thông số tưới máu trong sốc nhiễm trùng, mặc dù tăng HR, CO và EF.145 Hayes et al146 không tìm thấy cải thiện lâm sàng về chỉ số tim hoặc tình trạng oxy hóa từ dobutamine ở những bệnh nhân nặng (72% nhiễm trùng huyết/ sốc nhiễm trùng) và dobutamine liên quan làm tăng tỷ lệ tử vong tại bệnh viện (54% so với 34%; P = 0.04). Ngoài ra, điều trị bằng NE và bổ sung dobutamine khi cần thiết dựa trên chỉ số tim không cải thiện tỷ lệ sống sót hoặc kết quả khi so sánh với NE đơn thuần ở bệnh nhân sốc nhiễm trùng.129 Liên quan đến kết cục có liên quan HF, một phân tích tổng hợp bệnh nhân HF cấp mất bù so sánh dobutamine và nesiritide cho thấy tỷ lệ sống còn thấp hơn (OR: 0,48; KTC 95%: 0,36-0,63; P 147
Để hỗ trợ dobutamine, một phân tích tổng hợp gần đây cho thấy NE cộng với dobutamine có liên quan đến việc giảm tỷ lệ tử vong trong 28 ngày (điện tích dưới đường cong tích lũy [SUCRA] là 85,9% so với NE cộng với epinephrine [74,6%], epinephrine [72,5%) ], vasopressin [66,1%], và NE [59,8%]), đặc biệt là ở những bệnh nhân nhiễm trùng huyết với CO thấp. 148 SUCRA so sánh các can thiệp với can thiệp giả định là tốt nhất về kết quả, và tỉ lệ này càng cao thì can thiệp càng gần là can thiệp tốt nhất theo giả thuyết.149 Phương pháp xếp hạng SUCRA có thể bị ảnh hưởng bởi sự ưa thích/ quen thuộc của bác sĩ lâm sàng và mức độ chất lượng dữ liệu thay đổi đảm bảo việc giải thích thận trọng.150 Mặc dù không có dữ liệu kết cục rõ ràng, bệnh nhân nhiễm trùng huyết có HF từ trước có sử dụng dobutamine nhiều hơn những người bị nhiễm trùng huyết và không có HF. 11,15 Liệu dobutamine có tác động cụ thể đến kết quả ở những bệnh nhân có HF từ trước hay không vẫn chưa được biết.
Tóm lại, mặc dù dobutamine đưa ra một lựa chọn trực quan để điều trị hạ huyết áp dai dẳng trong HF nhiễm trùng huyết với CO thấp từ LVD, bằng chứng không cho thấy lợi ích lâm sàng rõ ràng. Bằng chứng phần lớn ủng hộ tác động tiêu cực hoặc trung tính đối với kết quả từ dobutamine. Dữ liệu gần đây cho thấy một ứng dụng cho dobutamine khi kết hợp với NE ở bệnh nhân nhiễm trùng huyết/ sốc nhiễm trùng và CO thấp. Dobutamine có thể được coi là một chất “hoạt động mạch” thứ hai như một chất hỗ trợ cho NE cho nhiễm trùng huyết có biểu hiện HF từ trước với lo ngại về giảm CO (tức là HFrEF nặng ) nhưng không nên được sử dụng thường xuyên trong HFpEF.
Milrinone.
Tác dụng co bóp dương tính của milrinone thường được sử dụng để cải thiện CO trong HF nặng.10 Tuy nhiên, milrinone gây giãn mạch nhiều hơn dobutamine khiến nó trở thành một lựa chọn khó có thể xảy ra trong nhiễm trùng huyết.151 Thật vậy, trong một thử nghiệm dùng milrinone trong nhiễm trùng huyết, tăng NE và epinephrine là cần thiết trong khi truyền milrinone để chống lại sự giãn mạch.152 Milrinone đã chứng minh mối tương quan vượt trội với oxy hóa tĩnh mạch so với dobutamine trong HF nặng, 153 nhưng một thử nghiệm lâm sàng tiền cứu trong HF cấp tính cho thấy milrinone làm trầm trọng thêm tình trạng hạ huyết áp, tăng loạn nhịp tim và có thể tăng tỷ lệ tử vong.154 Điều thú vị là Sato et al đã báo cáo milrinone không liên quan đến tăng tỷ lệ tử vong trong sốc nhiễm trùng (HR: 0,885; KTC 95%: 0,44-1,79; P = 0,734), không giống như epinephrine và dobutamine.131 Tuy nhiên, milrinone có liên quan đến tăng tỷ lệ AF tương tự như cả epinephrine và dobutamine.131 Milrinone không cho thấy tác dụng bất lợi và có thể tăng cường chức năng tim khi được sử dụng kết hợp với thuốc chẹn beta (BBs) trong nhiễm trùng huyết để chống lại những lo lắng về suy cơ tim do catecholamine gây ra bằng cách tránh dùng dobutamine. 55,156 Không giống như dobutamine, hiệu quả của chất ức chế phosphodiesterase không bị thay đổi bởi các BB đồng thời, 157 nhưng ứng dụng cụ thể của milrinone sử dụng ưu tiên cho bệnh nhân đang điều trị BB mãn tính không được thiết lập.
Tóm lại, tác dụng hạ huyết áp ở nhiễm trùng huyết và thiếu hiệu quả ở bệnh nhân HF cấp tính của milrinone cho thấy không nên dùng trong giai đoạn hồi sức cấp tính nhưng có thể sử dụng một cách thận trọng sau khi ổn định nếu có lo ngại về độc tính của catecholamine và giảm hiệu quả dobutamine (ví dụ, đồng thời BB).
Xem xét với các thuốc chẹn beta và ức chế angiotensin
Bệnh nhân bị HF mãn tính có khả năng được quản lý điều trị bằng BBs dài hạn, thuốc ức chế men chuyển (ACE-Is), thuốc chẹn thụ thể angiotensin (ARB), hoặc thuốc ức chế neprilysin thụ thể angiotensin (ARNi). 10,158 thuốc chẹn beta đã được quan tâm trong nhiễm trùng huyết làm bằng chứng đã cho thấy sự kích thích quá mức sâu sắc của các thụ thể adrenergic góp phần vào rối loạn chức năng tim.159 Trong nhiễm trùng huyết, BBs làm giảm các cytokine gây viêm, cải thiện chức năng tim, chống lại rối loạn điều hòa chuyển hóa và ngăn ngừa hậu quả tiêu cực do quá kích giao cảm.160,161 Trong khi phần lớn các nghiên cứu đã đánh giá việc truyền các chẹn beta tác dụng nhanh (ví dụ, esmolol) cho ứng dụng này, câu hỏi về cách quản lý liệu pháp BB tại nhà đồng thời vẫn còn, đặc biệt ở những bệnh nhân có thể được hưởng lợi từ dobutamine. Ngoài ra, ACE-Is làm giảm các chất trung gian gây viêm và tổn thương phổi cấp tính trên mô hình động vật nhiễm trùng huyết thực nghiệm, 162 mặc dù bằng chứng của chúng còn ít được phát triển cho vai trò này trong liệu pháp. Các tác dụng có lợi tiềm tàng của việc tiếp tục dùng thuốc thường bị lu mờ do sợ hậu quả huyết động tiêu cực.
b-Blockers.
Bệnh nhân điều trị bằng liệu pháp BB tại nhà có thể có các thụ thể beta được điều chỉnh, 163 có thể dẫn đến thay đổi liều lượng của các thuốc vận mạch cần thiết để đáp ứng huyết động mục tiêu. Trong việc thiết lập các thụ thể beta được điều chỉnh lên, việc ngưng BB đột ngột có thể làm lộ ra một số lượng cao bất thường các thụ thể đối với chất chủ vận từ catecholamine nội sinh trong quá trình nhiễm trùng huyết và có khả năng làm tăng tác dụng của các thuốc vận mạch có tính đồng vận beta. Ngược lại, việc tiếp tục dùng BB có thể cản trở sự gắn kết của các chất hoạt tính với thụ thể beta ở một mức độ không xác định và làm giảm hiệu quả. Điều thú vị là, ở người suy tim, carvedilol không điều hòa lên thụ thể beta do mô hình liên kết khác với metoprolol.164,165 Sự khác biệt về tác dụng huyết động giữa metoprolol và carvedilol đã được quan sát thấy khi dùng đồng thời dobutamine.166 Khi có metoprolol, tác dụng co bóp dobutamine bị làm giảm nhẹ, trong khi carvedilol gần như hoàn toàn làm mất tác dụng co bóp của dobutamine.166 Ngoài ra, chỉ dobutamine liều cao (15-20 mcg/ kg/ phút) làm tăng CO khi có sự phong tỏa của carvedilol mãn tính.157 Tác dụng làm giảm dobutamine lớn hơn của carvedilol có thể xảy ra do thiếu các thụ thể beta được điều chỉnh lên có sẵn để gắn kết dobutamine và sự gắn kết mạnh mẽ của carvedilol với các thụ thể beta ngăn cản sự dịch chuyển của dobutamine.167 Nhiễm trùng huyết cũng gây ra sự điều chỉnh xuống của các thụ thể beta, 160 và do không có sự điều chỉnh lên thụ thể beta với carvedilol, bệnh nhân sử dụng đồng thời carvedilol có thể yêu cầu liều dobutamine cao hơn, mặc dù liều cao hơn của dobutamine làm tăng nguy cơ loạn nhịp tim.168 Ảnh hưởng của các BB đồng thời lên khả năng gây loạn nhịp của dobutamine trong nhiễm trùng huyết vẫn chưa được biết. Điều thú vị là việc sử dụng BB đã ngăn ngừa loạn nhịp thất do dobutamine gây ra ở HF mất bù với EF 169
Ý nghĩa lâm sàng của tác động qua lại giữa điều hòa xuống thụ thể beta và quản lý nhiễm trùng huyết vẫn chưa được biết, và các hướng dẫn hiện hành không đưa ra khuyến nghị nào về việc quản lý điều trị bệnh nhân sử dụng BB mãn tính trong nhiễm trùng huyết.9 Điều thú vị là một nghiên cứu cho thấy rằng BB được kê đơn trước đó làm giảm tỷ lệ tử vong ở bệnh nhân sốc nhiễm trùng do 22,1% đến 17,7% (OR: 0,78; KTC 95%: 0,66-0,93; P = 0,005) .170 Các tác giả đưa ra giả thuyết về lợi ích từ việc ức chế BB dự phòng suy tim do nhiễm trùng trước khi phát triển nhiễm trùng huyết hoặc sốc nhiễm trùng.170 Ngoài ra , điều trị BB dài hạn có liên quan đến nồng độ lactate thấp hơn đáng kể trong nhiễm trùng huyết và sốc nhiễm trùng.171 Cho dù lactate thấp hơn là do thuốc chẹn beta ức chế đường phân qua trung gian beta -2 hay tác dụng bảo vệ nhiễm trùng huyết vẫn chưa được biết, nhưng cần thận trọng khi giải thích mức độ lactate khi có BBs. Các tác giả ghi nhận xu hướng giảm tỷ lệ tử vong ở nhóm BB sau 28 ngày (35% so với 49%; P = 0,08), trong khi thử nghiệm không đủ độ mạnh để kết luận tỷ lệ tử vong.171 DeMott và cộng sự đã tìm cách định lượng sự thay đổi liều lượng thuốc vận mạch dựa trên về điều trị tăng huyết áp dài hạn và thấy rằng liệu pháp BB đồng thời không ảnh hưởng đến việc dùng thuốc vận mạch sau 48 giờ.172 Trong khi việc sử dụng BB trước đó không bắt buộc phải tiếp tục trong thời gian nhiễm trùng huyết, nó đặt ra một câu hỏi lâm sàng thú vị, và việc ngừng sử dụng BB trong nhiễm trùng huyết đã là một cuộc tranh luận liên tục. Fuchs và cộng sự đã tìm thấy lợi ích sống còn liên quan đến việc tiếp tục điều trị bằng BB trong giai đoạn cấp tính của nhiễm trùng huyết nặng và sốc nhiễm trùng trong một phân tích thứ cấp hồi cứu của một nghiên cứu đơn trung tâm.173 Liệu pháp BB tiếp tục có liên quan đến việc giảm tỷ lệ tử vong bệnh viện (P = 0,03), tỷ lệ tử vong trong 28 ngày (P = 0.04) và 90 ngày (40,7% so với 52,7%; P = 0.046).173 Một nghiên cứu quan sát đa trung tâm (Số định danh ClinicalTrials.gov: NCT03190408) 174 đã được hoàn thành để kiểm tra điều trị cao huyết áp và ảnh hưởng đến kết cục ở bệnh nhân sốc nhiễm trùng, và kết quả đang chờ được báo cáo. Dữ liệu có thể bị nhầm lẫn vì sự tiếp tục BB trong nhiễm trùng huyết và sốc nhiễm trùng có thể là dấu hiệu đại diện cho những bệnh nhân có huyết áp ổn định hơn, hạn chế khả năng áp dụng những dữ liệu này trong trường hợp không có đánh giá tiến cứu.
Trong HF cấp tính mất bù, ngưng sử dụng BB có liên quan đến tăng tỷ lệ tử vong tại bệnh viện và tử vong ngắn hạn.175 Ngoài ra, ngừng sử dụng BB có liên quan đến tỷ lệ tử vong cao hơn đáng kể ở những bệnh nhân HF cấp được điều trị bằng milrinone.176 Cần thận trọng khi giải thích những phát hiện này vì nó chưa được biết rõ, nếu lợi ích là do tiếp tục BB trong giai đoạn cấp tính hoặc do tỷ lệ tiếp tục khi xuất viện cao hơn. Một thử nghiệm lâm sàng cho thấy không có sự khác biệt về kết quả an toàn khi tiếp tục so với ngừng BB ở bệnh nhân HF cấp tính mất bù với EF trung bình là 32% nhưng thiết kế nghiên cứu này không đủ độ mạnh để phát hiện sự khác biệt về tỷ lệ tử vong.177 Kết quả này có thể khuyến khích tiếp tục cho chẹn beta do thiếu các tác dụng phụ và lợi ích quan sát thấy trong các nghiên cứu khác. Tóm lại, với những lợi ích được đề xuất của việc tiếp tục dùng thuốc chẹn BB trong nhiễm trùng huyết và HF cấp tính mất bù, việc tiếp tục dùng thuốc ức chế BB mãn tính trong trường hợp nhiễm trùng huyết và HF cần được xem xét.
Các thuốc ức chế Angiotensin.
Dữ liệu hạn chế tồn tại về các tác động của việc quản lý điều trị ACE-Is, ARB và ARNi trước đó. Demott và cộng sự đã chứng minh rằng ACE-I trước khi nhập viện có liên quan đến thời gian dùng thuốc vận mạch ngắn nhất (19 giờ) so với BB (24 giờ), BB, ACE-I (30 giờ) và không điều trị (30 giờ).172 Một hồi cứu Nghiên cứu trên 50.000 bệnh nhân bị nhiễm trùng huyết cho thấy sử dụng ACE-I/ ARBs trước đó có liên quan đến giảm tỷ lệ tử vong trong 30 và 90 ngày, trong khi sử dụng các BB trước đó thì không.178 Tương tự, một đánh giá cơ sở dữ liệu lớn khác trên
30.000 bệnh nhân nhập viện nhiễm trùng huyết được tiết lộ rằng ACE-I và ARB có liên quan đến tỷ lệ tử vong tại bệnh viện thấp hơn (OR hiệu chỉnh: 0,93; KTC 95%: 0,88-0,98 và OR điều chỉnh: 0,85; KTC 95%: 0,81-0,90, tương ứng).179 Tính chất hồi cứu của các báo cáo này giới hạn kết luận do thiết kế quan sát và không được chuẩn hóa và thiếu các đặc điểm lâm sàng. Không có khả năng phát hiện tử vong liên quan đến nhiễm trùng huyết ngăn cản sự phân biệt tác dụng bảo vệ của ACE-Is và ARB đối với bệnh tim mạch (ví dụ, nhồi máu cơ tim).
Cả ACE-Is và ARB đều có thể làm tăng nồng độ kali huyết thanh, 10 và tăng kali máu có liên quan đến tử vong ở những bệnh nhân bị bệnh nặng.180 Ngoài ra, nhiễm trùng huyết thường gây rối loạn chức năng thận dẫn đến tăng nồng độ kali.181 Những lo ngại này có thể khiến bạn phải ngừng sử dụng ACE-Is và ARB trong tình trạng nhiễm trùng huyết có HF và sẽ khởi động lại khi chức năng thận ổn định. Không có dữ liệu lâm sàng nào về tác dụng của thuốc ức chế neprilysin làm hạn chế thảo luận về việc tiếp tục điều trị ARNi. Điều thú vị là neprilysin có tác dụng bảo vệ trong mô hình chuột bị sốc nhiễm trùng, 182 và tác động của neprilysin bị ức chế trong nhiễm trùng huyết ở người có thể cần được nghiên cứu.
Tóm lại, ACE-Is và ARBs thường được cảnh báo ngừng do huyết áp không ổn định và rối loạn chức năng thận trong nhiễm trùng huyết, và dữ liệu hỗ trợ việc tiếp tục sử dụng chúng bị hạn chế so với BB. Tuy nhiên, sử dụng ACE-I và ARB trước đây dường như cung cấp khả năng bảo vệ trong nhiễm trùng huyết và chúng nên được khởi động lại càng sớm càng tốt sau khi ổn định để tiếp tục quản lý HF dựa trên bằng chứng.
Quản lý điều trị rung nhĩ (af)
Suy tim, suy giảm LVEF và nhiễm trùng huyết có liên quan độc lập và cộng gộp với tỷ lệ rối loạn nhịp tim cao hơn, cụ thể là AF.183-186 AF khởi phát cấp tính đại diện cho 70% loạn nhịp trên thất trong nhiễm trùng huyết, 187.188 và các cân nhắc xử trí với HF có từ trước được giới hạn khi áp dụng dữ liệu từ các nghiên cứu HF dài hạn và các bệnh cảnh bán cấp. 89,190 Hậu quả huyết động của thuốc chống loạn nhịp là mối quan tâm phổ biến trong bệnh nhân nhiễm trùng huyết và sốc nhiễm trùng, và theo đúng hướng dẫn AF khuyến cáo chỉ chuyển nhịp bằng điện ở những bệnh nhân không ổn định về huyết động.190 Ngay cả sau khi ổn định huyết động cấp tính, cần tránh thay đổi huyết áp do thuốc và cân nhắc kỹ ảnh hưởng đến huyết động của các liệu pháp điều trị bằng thuốc. Sau khi ổn định, kiểm soát tần số thất có thể được ưu tiên hơn ở bệnh nhân ICU vì đa số sẽ chuyển sang nhịp xoang bình thường sau khi giải quyết bệnh cấp tính.191 Thật vậy, một nghiên cứu trên những bệnh nhân bị bệnh nặng với AF cho thấy 81% trở lại nhịp xoang bình thường khi được điều trị bằng kiểm soát tần số. Tuy nhiên, Gillinov và cộng sự không tìm thấy lợi ích lâm sàng nào ủng hộ kiểm soát tần số hoặc kiểm soát nhịp ở bệnh nhân ICU sau phẫu thuật tim, 193 và việc không khôi phục nhịp xoang ở bệnh nhân nhiễm trùng huyết có thể liên quan đến tỷ lệ tử vong trong bệnh viện cao hơn.194 Trương lực giao cảm quá cáo ở nhiễm trùng huyết có thể thúc đẩy sự dẫn truyền xung động AF trong thất không đều làm xấu đi CO và huyết động một cách độc lập.195 Sự khôn ngoan thông thường có thể hướng các bác sĩ lâm sàng về các tác nhân được coi là thuận lợi về mặt huyết động (ví dụ, amiodarone và digoxin) so với các tác nhân gây tác động co bóp cơ tim âm tính (ví dụ, BBs và thuốc chẹn kênh canxi [CCB] ); tuy nhiên, bằng chứng hiện tại có vẻ ủng hộ BBs trong quản lý điều trị AF ở những bệnh nhân ổn định huyết động bị nhiễm trùng huyết có HF từ trước.
b-Blockers.
Bằng chứng cho việc quản lý AF với kiểm soát tần số thông qua BBs hỗ trợ sử dụng chúng như một lựa chọn hàng đầu. Sự ủng hộ mạnh mẽ nhất đến từ Walkey và cộng sự, cho thấy BBs có liên quan đến tỷ lệ tử vong tại bệnh viện thấp nhất khi điều trị AF IV ban đầu trong một đoàn hệ gồm 39.693 bệnh nhân nhiễm trùng huyết với AF.196 B-Blockers có liên quan đến tỷ lệ tử vong thấp hơn so với CCB, digoxin, và amiodarone (RR: 0,92, 0,79, 0,64, tương ứng; P 196 Tuy nhiên, nghiên cứu này bị hạn chế do sử dụng mã Phân loại bệnh quốc tế (ICD) – 9 và dữ liệu hành chính thiếu thông tin về mức độ nghiêm trọng của bệnh và các đặc điểm lâm sàng cụ thể. Ngoài ra, điều trị AF IV ban đầu được đưa vào nếu được thực hiện trong 14 ngày đầu tiên kể từ khi nhập viện nhiễm trùng huyết, ngăn chặn việc áp dụng dữ liệu vào trong bệnh cảnh hồi sức cấp cứu. Mặc dù các bệnh nhân được kết hợp tốt thông qua điểm số xu hướng, việc thiếu dữ liệu chi tiết và cửa sổ dùng thuốc rộng hạn chế khả năng áp dụng, vì các bác sĩ lâm sàng có thể đã tránh dùng BB ở những bệnh nhân bị tụt huyết áp trầm trọng hơn, và quyết định sử dụng các thuốc khác (ví dụ, amiodarone hoặc digoxin). Những mối quan tâm này cảnh báo thận trọng trong việc giải thích việc giảm tỷ lệ tử vong và vạch ra nhu cầu đánh giá tiến cứu. Tuy nhiên, nghiên cứu này cung cấp hỗ trợ mạnh mẽ rằng BB có thể là tác nhân thích hợp nhất ở bệnh nhân HF để kiểm soát AF trong thời gian nhập viện vì nhiễm trùng huyết. Một đánh giá hệ thống gần đây về BBs sớm trong nhiễm trùng huyết cho thấy lợi ích về tỷ lệ tử vong, với 2/3 trong số 14 thử nghiệm bao gồm (13 tiến cứu, 1 thử nghiệm hồi cứu) báo cáo giảm tỷ lệ tử vong.197 Esmolol được sử dụng làm can thiệp trong 12 trong số 14 thử nghiệm. Tuy nhiên, gần như tất cả các thử nghiệm đều có tiêu chí loại trừ liên quan đến rối loạn chức năng tim và suy tim nặng (ví dụ, LVEF 197
Mối quan tâm đối với việc sử dụng BB trong nhiễm trùng huyết chủ yếu là tác động co bóp âm tính ở những bệnh nhân không ổn định về huyết động, nhưng BB có thể có tác dụng trung tính về huyết động sau khi hồi sức nhiễm trùng huyết ban đầu mặc dù đã giảm CO. 155,197-200 Gore và Wolf cho thấy rằng bệnh nhân nhiễm trùng huyết nhận được esmolol truyền duy trì được dòng máu ngoại biên và mức oxi hóa máu mặc dù giảm 20% CO.198 Balik và cộng sự cho thấy esmolol làm giảm nhịp tim nhanh sau khi điều chỉnh tiền tải trong sốc nhiễm trùng không ảnh hưởng xấu đến huyết động; tuy nhiên, nghiên cứu bao gồm những bệnh nhân có EF khoảng 60% và chức năng tim bình thường.199 Du và cộng sự đã đánh giá esmolol ở những bệnh nhân nhiễm trùng huyết mà không có LVD và quan sát thấy SV tăng, nhịp tim giảm, lactate thấp hơn và không ảnh hưởng đến MAP.200 Esmolol được chứng minh là giảm HA tâm thu chỉ 5 mm Hg ở bệnh nhân có EF suy giảm nghiêm trọng (# 27%). 201 Đã xảy ra tình trạng giảm CO và EF phụ thuộc vào liều lượng, cho thấy mức giảm nhẹ với 4 và 8 mg/ phút và giảm nhiều hơn với 16 mg/ phút . Sau khi ngừng truyền, tất cả các thông số trở lại bình thường trong vòng 10 đến 30 phút. Morelli và cộng sự nhận thấy truyền esmolol được chuẩn độ để hạ nhịp tim 24 giờ sau khi ổn định huyết động ở bệnh nhân nhiễm trùng huyết có liên quan đến giảm tỷ lệ tử vong và ít sử dụng NE hơn mà không làm tăng các tác dụng phụ. 202 Liều esmolol cao nhất trong nghiên cứu này là 6,7 mg/ phút với liều trung bình là 3,3 mg/ phút, 202 cho thấy các liều có tác dụng tối thiểu ở bệnh nhân có EF thấp là liều được sử dụng hiệu quả trong nhiễm trùng huyết (tức là 8 mg/ phút ).201 Nhóm nghiên cứu tương tự đã kiểm tra tác dụng cụ thể trên tim của việc truyền esmolol bắt đầu 24 giờ sau khi hồi sức đầy đủ trong sốc nhiễm trùng và nhận thấy SV tăng, CO và LVEF không thay đổi, và giảm nhu cầu NE.203 Tác dụng trung tính của CO được giả thuyết là từ việc giảm độ cứng động mạch và sau đó làm tăng SV của thất trái, ngay cả khi có tác động giảm sức co bóp từ BBs. Tuy nhiên, các kết quả này nên được áp dụng một cách thận trọng và dựa trên chức năng tim của từng cá nhân vì EF không tiết lộ chức năng tim phổ rộng. Dữ liệu ngoài esmolol còn hạn chế, nhưng metoprolol đường uống kết hợp với milrinone đã cải thiện an toàn các thông số huyết động ở bệnh nhân nhiễm trùng huyết, nhưng nghiên cứu đã loại trừ những người có HF.155 Quan trọng nhất trong cuộc thảo luận về an toàn huyết động, một đánh giá có hệ thống của 14 nghiên cứu (13 thử nghiệm lâm sàng ) báo cáo không có thay đổi thống kê về huyết áp do sử dụng BB trong nhiễm trùng huyết trong số tất cả các nghiên cứu.197
Tóm lại, bằng chứng BB bị hạn chế bởi chỉ có được các suy luận có bởi phép ngoại suy từ các nghiên cứu lâm sàng liên quan, nhưng lợi ích tử vong được đề xuất ở bệnh nhân nhiễm trùng huyết, an toàn huyết động ở cả nhiễm trùng huyết và HF, và lợi ích độc lập có thể có trong bệnh lý nhiễm trùng huyết khiến chúng, cụ thể là esmolol tác dụng nhanh, là thuốc đầu tay cho AF ở bệnh nhân HF bị nhiễm trùng huyết sau khi ổn định huyết động cấp tính. Việc giảm nhịp tim nhanh do BBs có thể ngăn cản sự phát triển của AF mới khởi phát vì nhịp tim nhanh gây ra rút ngắn thời gian trơ hiệu quả của tâm nhĩ thúc đẩy sự phát triển AF, điều này có ý nghĩa quan trọng đối với sự ổn định huyết động tổng thể.204 Các nghiên cứu trong tương lai nên đánh giá khả năng của cả hai tác dụng ngắn (esmolol) và liệu pháp BB dài hạn mãn tính để ngăn chặn sự phát triển của AF.
Các thuốc ức chế Calci.
Việc sử dụng CCB rất phức tạp do khuyến cáo tránh sử dụng chúng trong HFrEF205; tuy nhiên, những khuyến cáo này không hoàn toàn mở rộng cho bệnh nhân HFpEF và dựa trên dữ liệu theo dõi lâu dài và sử dụng lâu dài. Điều thú vị là Lee và cộng sự đã chỉ ra rằng sử dụng CCBs trước khi nhập viện nhiễm trùng huyết có liên quan đến giảm nhẹ tỷ lệ tử vong.206 Tuy nhiên, như đã nói trước đây, CCBs cho thấy tỷ lệ tử vong cao hơn BB ở bệnh nhân sốc nhiễm trùng có AF và tiền sử HF.196 Diltiazem tác dụng chậm hơn esmolol để đạt được nhịp xoang sau 2 giờ so với esmolol ở bệnh nhân hậu phẫu không liên quan tim, trong đó 80% có AF (33% so với 59%; P 207 Diltiazem làm giảm tần số thất nhiều hơn so với metoprolol về mặt ổn định huyết động tại khoa cấp cứu ở bệnh nhân AF mà không gây hạ huyết áp.208 Tuy nhiên, bệnh nhân HF nặng bị loại khỏi thử nghiệm.208 Một thử nghiệm tương tự tại khoa cấp cứu đã chứng minh mục tiêu tần số thất cao hơn với diltiazem so với metoprolol trong 30 phút và diltiazem không làm tăng hạ huyết áp.209 Trong cấp tính đợt cấp của HFrEF, diltiazem đạt được sự kiểm soát AF nhanh chóng với nhịp thất nhanh nhưng không chuyển sang nhịp xoang và có liên quan đến việc giảm thoáng qua cấp tính huyết áp tâm thu (-17 mm Hg) và huyết áp tâm trương (12 mm Hg ).210 Hirschy và cộng sự trong 1hồi cứu cho thấy không có sự khác biệt giữa diltiazem và metoprolol trong việc kiểm soát nhịp tim, nhịp tim chậm hoặc hạ huyết áp trong HFrEF với AF và nhanh nhịp thất.211 Những nghiên cứu này hầu như không áp dụng cho trường hợp nhập viện vì nhiễm trùng, nhưng chúng cho thấy việc kiểm soát tần số cấp tính ngắn hạn với CCB trên BBs là một lựa chọn hợp lý với điều kiện ổn định huyết động. Diltiazem có thể là lựa chọn hàng đầu để kiểm soát tần số thất trong quản lý AF ở bệnh nhân HFpEF bị nhiễm trùng huyết có chống chỉ định với BBs.
Bằng chứng so sánh CCB với các thuốc khác trong tình trạng AF cấp tính chỉ giới hạn ở các thử nghiệm nhỏ thiếu mô tả về rối loạn chức năng tim. Siu và cộng sự đã so sánh diltiazem với amiodarone hoặc digoxin ở những bệnh nhân nhập viện không phải ICU với AF và đáp ứng thất nhanh và cho thấy diltiazem vượt trội hơn về thời gian và đạt được nhịp tim 212 Trong một thử nghiệm tiền cứu trên 60 bệnh nhân bị bệnh nặng với loạn nhịp nhĩ (95% AF), tiêm bolus diltiazem sau đó là truyền liên tục diltiazem được so sánh với amiodarone bolus hoặc amiodarone bolus cộng với truyền. Diltiazem và 2 chiến lược amiodarone được so sánh về hiệu quả kiểm soát tần số thất trong vòng 4 giờ, but cho thấy diltiazem kiểm soát tần số thất tót hơn trong 24 giờ. Tuy nhiên, diltiazem gây hạ huyết áp nhiều hơn đáng kể so với amiodaron.213 Lưu ý, truyền diltiazem có thể làm phức tạp việc đưa bệnh nhân rời khoa cấp cứu, và tiêm tĩnh mạch diltiazem sau đó dùng diltiazem phóng thích tức thời bằng đường uống có liên quan đến nhịp tim thấp hơn và thất bại điều trị so với tiêm tĩnh mạch và sau đó là truyền tĩnh mạch.214 Với các khuyến cáo để tránh dùng CCB trong HFrEF và thiếu bằng chứng mạnh mẽ hỗ trợ việc sử dụng nó so với BB trong nhiễm trùng huyết có HF từ trước, việc sử dụng CCB cấp tính nên được dành riêng cho bệnh nhân HFpEF có chống chỉ định với BB và được sử dụng chủ yếu dưới dạng tiêm tĩnh mạch sau đó là uống với điều kiện tình trạng lâm sàng cho phép điều trị bằng đường uống. Một số dữ liệu đã chứng minh hiệu quả và độ an toàn của diltiazem trong HFrEF, nhưng cần có các nghiên cứu lớn hơn để đánh giá đầy đủ các rủi ro ở nhóm đối tượng này.
Amiodarone.
Amiodarone có thể đạt được cả việc kiểm soát tần số và thường được sử dụng ở bệnh nhân nhiễm trùng huyết vì tác dụng trung tính của nó đối với huyết động học,186,195 và bệnh nhân AF có HFrEF thường được quản lý bằng amiodarone.215 Một nghiên cứu về amiodarone IV ở những bệnh nhân bị bệnh nặng có Efs giảm vừa phải ( 40% + 16%) kháng trị với chuyển nhịp bằng điện và thuốc chứng minh tính an toàn về huyết động nói chung khi bằng chứng là nhịp tim thấp hơn và huyết áp tâm thu cao hơn ngay sau khi bắt đầu sử dụng amiodarone.216 Ngoài ra, amiodaron bolus có tỷ lệ thành công cao hơn và nhanh hơn so với digoxin bolus trong việc kiểm soát tần số cấp tính ở những bệnh nhân AF có chống chỉ định với BBs và CCBs.217
Amiodarone có khả năng gây chuyển nhịp tim do thuốc và do đó có lo ngại về các biến cố thuyên tắc tim mạch.218 Các chiến lược chống đông máu đã được nghiên cứu như một liệu pháp điều trị độc lập với nhiễm trùng huyết, đông máu nội mạch lan tỏa có thể làm tăng tỷ lệ tử vong, 219 nhưng phần lớn không cho thấy lợi ích với việc gia tăng chảy máu.220-222 Tuy nhiên , một lợi ích có thể có ở những người bị bệnh nặng nhất và những người bị rối loạn đông máu do nhiễm trùng huyết.223 Đáng chú ý, bệnh nhân AF trong nhiễm trùng huyết nặng có nguy cơ đột quỵ vào viện gấp đôi.188 Trong một nghiên cứu quốc gia kiểm tra nguy cơ đột quỵ và chảy máu liên quan với thuốc chống đông máu trong nhiễm trùng huyết có AF, Walkey và cộng sự nhận thấy 35% bệnh nhân được dùng kháng đông đường tiêm mà không ảnh hưởng đến tỷ lệ đột quỵ do thiếu máu cục bộ tại bệnh viện.224 Tuy nhiên, chống đông có liên quan đến việc tăng chảy máu đáng kể về mặt lâm sàng.224 Do thiếu hướng dẫn về chống đông máu cho AF trong thời gian nhiễm trùng huyết, có thể phải thận trọng sử dụng kháng đông khi không có kế hoạch chuyển nhịp tim trong giai đoạn cấp tính và bán cấp tính của xử trí nhiễm trùng huyết.
Digoxin.
Hiệu ứng chronotropic (tính dẫn truyền) âm tính và inotropic dương tính của Digoxin rất hấp dẫn để giảm thiểu tình trạng hạ huyết áp trong quá trình điều trị AF trong nhiễm trùng huyết. Các nghiên cứu ban đầu về nhiễm trùng huyết cho thấy tác dụng co bóp có thể cải thiện chức năng LV.225 Trên thực tế, các hướng dẫn của Hiệp hội Tim mạch Hoa Kỳ/ Trường Cao đẳng Tim mạch Hoa Kỳ / Hiệp hội Nhịp tim (AHA / ACC / HRS) khuyến nghị digoxin như một tác nhân thứ hai trong điều trị cấp tính AF giữa rối loạn chức năng tim trong HF hoặc hội chứng mạch vành cấp, đặc biệt ở những người có LVD nặng và huyết động không ổn định.215 Tuy nhiên, nồng độ digoxin > 1 đến 1,2 ng/ mL có liên quan đến tăng tỷ lệ tử vong ở bệnh nhân HF từ trước, và khoảng tối ưu cho bệnh nhân với HF và LVEF 226,227 Một phân tích hậu kiểm về Apixaban để giảm đột quỵ và các biến cố huyết khối khác trong bệnh rung nhĩ (ARISTOTLE), thử nghiệm chỉ thấy nồng độ digoxin trong huyết thanh 228 Ngoài ra, digoxin có thời gian bán hủy dài, không thể đoán trước (# 36 giờ) và bị thay đổi do suy thận, làm phức tạp thêm việc sử dụng ở bệnh nhân nhiễm trùng huyết.229 Tổn thương thận do nhiễm trùng huyết có thể kết hợp với digoxin để hiệp đồng nâng cao nồng độ kali huyết thanh, làm tăng nguy cơ loạn nhịp tim.230,231 Hiệu quả của Digoxin có thể bị nhầm lẫn trong nhiễm trùng huyết, vì hoạt động giao cảm cao được cho là làm giảm hiệu quả của digoxin.232 Digoxin kém hiệu quả hơn amiodaron trong một nghiên cứu nhỏ trên những bệnh nhân bị bệnh nặng có rối loạn chức năng tim, nhưng 2 trong số 26 bệnh nhân trong nhóm amiodarone phát triển nhịp tim chậm nghiêm trọng hoặc HF trầm trọng hơn, khiến các tác giả khuyến cáo digoxin như là thuốc đầu tay ở những bệnh nhân không ổn định về huyết động có AF.233 Một nghiên cứu hồi cứu gần đây trong số 180 bệnh nhân bị nhiễm trùng huyết (86% với AF) được dùng digoxin trong vòng 24 giờ sau khi nhập ICU nhận thấy sự cải thiện các thông số huyết động trong 24 giờ sau khi dùng digoxin mà không có các tác dụng phụ đáng kể.234 Nghiên cứu chỉ xác định được 180 bệnh nhân trong thời gian 10 năm có nghĩa là rất thưa thớt sử dụng digoxin ở nhóm bệnh nhân này, nhưng kết quả hỗ trợ về yếu điểm huyết động không đáng kể ở bệnh nhân nhiễm trùng huyết với AF. Tuy nhiên, quy mô mẫu nhỏ và thời gian 10 năm khiến những phát hiện này khó áp dụng. Trong khi digoxin cho thấy tác dụng tích cực về huyết động, chỉ số điều trị hẹp cho bệnh nhân HF, cần theo dõi và thiếu dữ liệu về kết cục rõ ràng khiến digoxin trở thành lựa chọn hàng thứ hai hoặc thứ ba ở những bệnh nhân BBs và / hoặc amiodarone không thể kiểm soát AF.
Xem xét các chăm sóc hỗ trợ
Chăm sóc hỗ trợ thường cung cấp nền tảng của quản lý điều trị ở ICU vì thiếu bằng chứng mạnh mẽ trên nhiều khía cạnh. Hỗ trợ thông khí áp lực dương (PPVS) và liệu pháp thay thế thận (RRT) là nền tảng để chăm sóc bệnh nhân nặng và ảnh hưởng của chúng đối với chức năng tim và tình trạng dịch đáng được thảo luận.
Hỗ trợ thông khí áp lực dương.
Kết quả lâm sàng liên quan đến ảnh hưởng lẫn nhau của HF với PPVS ở bệnh nhân nhiễm trùng huyết vẫn chưa được biết, và việc quản lý PPVS phụ thuộc vào chuyên môn lâm sàng sâu rộng, nhưng một số dữ liệu phù hợp để thảo luận. Hướng dẫn HF năm 2016 của Hiệp hội Tim mạch Châu Âu (ESC) khuyến nghị duy trì độ bão hòa oxy (SpO2) > 90% và hỗ trợ PPVS ở những bệnh nhân có huyết động không ổn định như đã thấy trong nhiễm trùng huyết. 39 Hướng dẫn SSC về PPVS chỉ nếu ra khuyến cáo ở nhóm bệnh nhân phát triển hội chứng nguy ngập hô hấp cấp (ARDS), ủng hộ các chiến lược thể tích thông khí thấp.9 Trong một đánh giá hồi cứu PPVS ở bệnh nhân nhiễm trùng huyết, rối loạn chức năng tim không liên quan đến việc tiến triển thành ARDS hoặc kết cục xấu hơn ở ARDS.235 Thay đổi áp lực trong lồng ngực, đặc biệt là thông qua áp lực dương cuối kỳ thở ra (PEEP), tác động đến chức năng tâm thất. Trong thì thở vào bình thường, áp lực trong lồng ngực giảm hơn so với áp lực mở rộng trong lòng động mạch chủ, do đó làm tăng hậu tải LV. Với việc áp dụng PPVS, hiệu ứng này được đảo ngược và có thể thấy sự gia tăng CO.236 Tuy nhiên, sự gia tăng bình thường của áp lực trong lồng ngực sẽ làm giảm lượng CO từ RV và do đó giảm tiền tải trong LV. Việc giảm tiền tải này có thể làm giảm CO ở những bệnh nhân có chức năng LV bình thường. Tuy nhiên, vì bệnh nhân HF có tăng thể tích mạn tính, ảnh hưởng của giảm tiền tải đối với CO có thể không đáng kể và tăng CO có thể được cải thiện bằng cách giảm hậu tải LV thông qua PPVS.236.237 Áp lực cuối kỳ thở ra dương (bình thường là 5-10 mmHg) là ứng dụng chìa khóa vì nó có thể làm tăng CO trong HF thông qua giảm hậu tải của LV, giãn nở LV và nhu cầu oxy của cơ tim.236 Mối liên quan về PEEP rộng rãi trong rối loạn chức năng tim đã gợi ý rằng sự gia tăng áp lực bề mặt tim do PEEP có thể làm giảm lưu lượng máu mạch vành. 238 Tuy nhiên, trong tình trạng suy tim phụ thuộc vào hậu tải, giảm hậu tải do PEEP tạo ra có thể có lợi ích lớn hơn là tác động tiêu cực đến tiền tải LV, 239 làm cho PEEP trở thành yếu tố có thể kiểm soát để cải thiện chức năng tim ở bệnh nhân HF nhiễm trùng với LVD. Liên quan đến thảo luận trước đó về CVP, vì PPVS làm tăng áp lực trong khoang ngực, nó có thể làm phức tạp khi sử dụng áp lực làm đầy tim để đánh giá tình trạng dịch (ví dụ, CVP), làm giảm hiệu quả vốn đã hạn chế của thông số này ở những bệnh nhân này.
Tóm lại, PPVS, và cụ thể là PEEP, nên được đưa vào đánh giá huyết động chung của bệnh nhân HF có nhiễm trùng huyết. Các nghiên cứu trong tương lai đánh giá vai trò của PPVS trong nhóm bệnh nhân duy nhất này có thể được hướng đến.
Điều trị thay thế thận.
Chăm sóc hỗ trợ với RRT cho những người đang lọc máu mãn tính và tổn thương thận cấp mới để kiểm soát rối loạn dịch và điện giải liên quan là thực hành phổ biến trong ICU, tác động của RRT đối với tình trạng dịch ở bệnh nhân HF bị nhiễm trùng huyết cần được xem xét. Gần đây, Barbar và cộng sự đã chứng minh không có sự khác biệt về kết quả giữa RRT sớm (trong vòng 12 giờ sau suy thận) và RRT muộn (sau 48 giờ nếu vẫn được chỉ định) ở những bệnh nhân bị tổn thương thận cấp trong sốc nhiễm trùng sớm.241 Ngoài ra, một phân tích tổng hợp trong số 11 thử nghiệm đối chứng ngẫu nhiên đánh giá RRT sớm và muộn ở bệnh nặng không tìm thấy sự khác biệt về tỷ lệ tử vong nhưng cho thấy tỷ lệ nhiễm trùng liên quan đến catheter và giảm phosphate huyết cao hơn ở nhóm RRT sớm. 242 Trong một phân tích gộp khác về RRT sớm và muộn trong ICU sau phẫu thuật tim gợi ý lợi ích với RRT sớm; tuy nhiên, các nghiên cứu có mức độ không đồng nhất cao (I2 # 56%), và các tác giả trích dẫn cụ thể việc không có sinh lý bệnh sốc nhiễm trùng như một lời giải thích tiềm năng cho lợi ích ở những bệnh nhân này.243 Tổng hợp lại, những dữ liệu này không hỗ trợ RRT sớm ở bệnh nhân nhiễm trùng huyết.
Trong HF, RRT hoạt động như một cơ chế loại bỏ nước mạnh mẽ, thông thường thông qua siêu lọc. Thử nghiệm siêu lọc so với thuốc lợi tiểu qua đường tĩnh mạch cho bệnh nhân nhập viện vì suy tim sung huyết cấp mất bù (UNLOAD – Ultrafiltration versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Congestive Heart Failure) cho thấy tính ưu việt của RRT siêu lọc so với thuốc lợi tiểu trong 48 giờ khi bắt đầu trong vòng 24 giờ sau khi nhập viện.244 Nghiên cứu Hội chứng tim – thận trong suy tim cấp mất bù (CARRESS-HF – Cardiorenal Rescue Study in Acute Decompensated Heart Failure) cho thấy siêu lọc không tốt hơn liệu pháp lợi tiểu nhưng làm suy giảm chức năng thận ở những bệnh nhân nhập viện vì HF với hội chứng tim-thận.245 Những kết quả này khó có thể khái quát được vì bệnh nhân nhiễm trùng huyết, huyết động không ổn định và sử dụng thuốc vận mạchbị loại trừ. Suy tim thúc đẩy các mối quan tâm về huyết động học vì sự hiện diện của rối loạn chức năng tim có liên quan chặt chẽ với hạ huyết áp trong lúc thận.246 Hạ huyết áp trong lúc lọc máu xảy ra do thất bại trong việc tạo ra sự gia tăng bù đắp cả CO và sức cản mạch hệ thống, và vì 2 thông số này được điều chỉnh rộng rãi hoặc cần phải tăng cường dược lý trong thời gian nhiễm trùng huyết, 247 gây lo ngại về tụt huyết áp gia tăng. Ngoài ra, LVD có liên quan trực tiếp đến tỷ lệ cao hơn của hạ huyết áp trong lúc thẩm tách.
Tóm lại, RRT sớm trong nhiễm trùng huyết đã được đánh giá rõ ràng và không cho thấy lợi ích so với các chiến lược trì hoãn và không nên được sử dụng đặc biệt trong nhiễm trùng huyết có HF từ trước. Liệu pháp thay thế thận trong nhiễm trùng huyết có HF từ trước có thể được sử dụng như chăm sóc hỗ trợ liên quan đến tổn thương thận do nhiễm trùng huyết nhưng không được sử dụng để kiểm soát tình trạng dịch HF. Nguy cơ hạ huyết áp trong lúc RRT có thể tăng lên ở những bệnh nhân HF bị nhiễm trùng huyết, đặc biệt với HFrEF, và vì vậy, nên áp dụng RRT cẩn thận ở những bệnh nhân này.
Kết luận
Nhiễm trùng huyết và HF là những biến chứng thường gặp ở những bệnh nhân nặng và tạo ra một trạng thái bệnh lý phức tạp thêm. Các bác sĩ lâm sàng có thể ngần ngại thực hiện liệu pháp hướng dẫn theo hướng dẫn, đặc biệt liên quan đến hồi sức truyền dịch. Tuy nhiên, sự sai lệch so với cách xử trí nhiễm trùng huyết truyền thống chỉ dựa trên HF đã có từ trước gây ra kết quả lâm sàng tồi tệ hơn và hiện không có dữ liệu nào hỗ trợ thực hành này ở những bệnh nhân HF bị nhiễm trùng huyết. Các khuyến cáo về dịch truyền và thuốc vận mạch theo hướng dẫn là an toàn và có khả năng mang lại lợi ích cho bệnh nhân HF giống như đối với bệnh nhân không mắc bệnh HF, và việc không thực hiện chúng có thể làm xấu đi kết quả. Ngoài việc quản lý nhiễm trùng huyết đầu tiên, dobutamine có thể mang lại lợi ích bổ sung ở bệnh nhân HF nhiễm trùng huyết thông qua điều chỉnh CO. Nói chung, các inotrope có liên quan đến kết quả kém hơn, nhưng các ứng dụng thích hợp có thể tồn tại. Ngoài ra, tiếp tục điều trị bằng BB tại nhà trong thời gian nhiễm trùng huyết có thể cải thiện kết quả, nhưng tình trạng huyết động không ổn định có thể cảnh báo phải ngừng thuốc và khởi động lại sau đó. Sử dụng BB tác dụng ngắn trong thời gian nhiễm trùng huyết để giảm nhịp tim nhanh và/ hoặc điều trị AF đã liên tục được chứng minh là một chiến lược đầy hứa hẹn và đảm bảo cho các thử nghiệm lâm sàng lớn. Cả PPVS và RRT đều có tác động rõ rệt hơn ở bệnh nhân HF bị nhiễm trùng huyết. Về sau, việc kiểm tra mức độ nghiêm trọng của HF trong nhiễm trùng huyết thông qua báo cáo cụ thể về nhân khẩu học của bệnh nhân là rất quan trọng, cho dù thông qua phép đo EF hay biện pháp phân loại HF khác (ví dụ, phân loại của Hiệp hội Tim mạch Hoa Kỳ). Cho đến khi nghiên cứu cho thấy khác, việc tuân thủ điều trị nhiễm trùng huyết theo hướng dẫn vẫn là tiêu chuẩn cho nhiễm trùng huyết với HF đã có từ trước.
Declaration of Conflicting Interests
The author(s) declared no potential conflicts of interest with respect to the research, authorship, and/or publication of this article.
Funding
The author(s) received no financial support for the research, authorship, and/or publication of this article.
ORCID iDs
Timothy W. Jones, PharmD https://orcid.org/0000-0003-0651-4304 Susan E. Smith, PharmD, BCPS, BCCCP https://orcid.org/0000 -0002-5171-8405 Joseph S. Van Tuyl, PharmD, BCPS, BCCP https://orcid.org/0000-0001-8232-1884
Tài liệu tham khảo
Bloom MW, Greenberg B, Jaarsma T, et al. Heart failure with reduced ejection fraction. Nat Rev Dis Primers. 2017;3:17058.
Singer M, Deutschman CS, Seymour CW, et al. The Third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016;315(8):801-810.
Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations. Am J Respir Crit Care Med. 2016; 193(3):259-272.
Vincent J-L, Jones G, David S, Olariu E, Cadwell KK. Frequency and mortality of septic shock in Europe and North America: a systematic review and meta-analysis. Critical Care. 2019; 23(1):196.
Roger VL. Epidemiology of heart failure. Circ Res. 2013;113(6): 646-659.
Hajj J, Blaine N, Salavaci J, Jacoby D. The “centrality of sepsis”: a review on incidence, mortality, and cost of care. Healthcare (Basel). 2018;6(3):7.
Walker AMN, Drozd M, Hall M, et al. Prevalence and predictors of sepsis death in patients with chronic heart failure and reduced left ventricular ejection fraction. J Am Heart Assoc. 2018;7(20): e009684.
Vaduganathan M, Patel RB, Michel A, et al. Mode of death in heart failure with preserved ejection fraction. J Am Coll Cardiol. 2017;69(5):556-569.
Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304-377.
Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol. 2013; 62(16):e147-239.
Abou Dagher G, Hajjar K, Khoury C, et al. Outcomes of patients with systolic heart failure presenting with sepsis to the emergency department of a tertiary hospital: a retrospective chart review study from Lebanon. BMJ Open. 2018;8(7):e022185.
Ishak Gabra N, Kim B, Iyengar R, et al. Outcomes of patients with chronic heart failure and septic shock. Chest. 2017;152(4):A377.
Alon D, Stein GY, Korenfeld R, Fuchs S. Predictors and outcomes of infection-related hospital admissions of heart failure patients. PLoS One. 2013;8(8):e72476.
Prabhu MM, Yalakala SK, Shetty R, Thakkar A, Sitapara T. Prognosis of left ventricular systolic dysfunction in septic shock patients. J Clin Diagn Res. 2015;9(3):OC05-OC08.
Alkhalaf M, Abd-Aziz N, Arabi Y, Tangiisuran B. Impact of congestive heart failure on severe sepsis and septic shock survivors: outcomes and performance status after 1-year hospital discharge. Critical Care. 2012;16(suppl 1):P400- P400.
Karlsson S, Varpula M, Ruokonen E, et al. Incidence, treatment, and outcome of severe sepsis in ICU-treated adults in Finland: the Finnsepsis Study. Intensive Care Med. 2007;33(3):435-443.
Prescott HC, Langa KM, Liu V, Escobar GJ, Iwashyna TJ. Increased 1-year healthcare use in survivors of severe sepsis. Am J Respir Crit Care Med. 2014;190(1):62-69.
Linder A, Guh D, Boyd JH, Walley KR, Anis AH, Russell JA. Long-term (10-year) mortality of younger previously healthy patients with severe sepsis/septic shock is worse than that of patients with nonseptic critical illness and of the general population. Crit Care Med. 2014;42(10):2211- 2218.
Ouellette DR, Shah SZ. Comparison of outcomes from sepsis between patients with and without pre-existing left ventricular dysfunction: a case-control analysis. Critical Care. 2014; 18(2):R79.
Jessup M, Brozena S. Heart failure. N Engl J Med. 2003;348(20): 2007-2018.
Ellison GM, Torella D, Karakikes I, et al. Acute beta-adrenergic overload produces myocyte damage through calcium leakage from the ryanodine receptor 2 but spares cardiac stem cells. J Biol Chem. 2007;282(15):11397-11409.
Chaney E, Shaw A. Pathophysiology of fluid retention in heart failure. Contrib Nephrol. 2010;164:46-53.
Delgado RM 3rd, Willerson JT. Pathophysiology of heart failure: a look at the future. Tex Heart Inst J. 1999;26(1):28-33.
Miller WL.Fluid volume overload and congestion in heart failure: time to reconsider pathophysiology and how volume is assessed. Circ Heart Fail. 2016;9(8):e002922.
Fallick C, Sobotka PA, Dunlap ME. Sympathetically mediated changes in capacitance: redistribution of the venous reservoir as a cause of decompensation. Circ Heart Fail. 2011;4(5):669-675.
Bouchard J, Soroko SB, Chertow GM, et al. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int. 2009;76(4):422-427.
Murphy CV, Schramm GE, Doherty JA, et al. The importance of fluid management in acute lung injury secondary to septic shock. Chest. 2009;136(1):102-109.
Koonrangsesomboon W, Khwannimit B. Impact of positive fluid balance on mortality and length of stay in septic shock patients. Indian J Crit Care Med. 2015;19(12):708-713.
Shen Y, Huang X, Zhang W. Association between fluid intake and mortality in critically ill patients with negative fluid balance: a retrospective cohort study. Critical Care. 2017;21(1):104.
Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Rev Esp Cardiol (Engl Ed). 2016;69(12):1167.
Yancy CW, Jessup M, Bozkurt B, et al. 2017 ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. J Card Fail. 2017;23(8):628-651.
Beurton A, Ducrocq N, Auchet T, et al. Beneficial effects of norepinephrine alone on cardiovascular function and tissue oxygenation in a pig model of cardiogenic shock. Shock. 2016;46(2): 214-218.
Squara P, Hollenberg S, Payen D.Reconsidering vasopressors for cardiogenic shock: everything should be made as simple as possible, but not simpler. Chest. 2019;156(2):392-401.
Bellumkonda L, Gul B, Masri SC. Evolving concepts in diagnosis and management of cardiogenic shock. Am J Cardiol. 2018; 122(6):1104-1110.
James JH, Wagner KR, King JK, et al. Stimulation of both aerobic glycolysis and Na(þ)- K(þ)-ATPase activity in skeletal muscle by epinephrine or amylin. Am J Physiol. 1999;277(1): E176-186.
Levy B, Desebbe O, Montemont C, Gibot S. Increased aerobic glycolysis through beta2 stimulation is a common mechanism involved in lactate formation during shock states. Shock. 2008; 30(4):417-421.
Adamo L, Nassif ME, Novak E, LaRue SJ, Mann DL. Prevalence of lactic acidaemia in patients with advanced heart failure and depressed cardiac output. Eur J Heart Fail. 2017;19(8): 1027-1033.
Hernandez G, Ospina-Tascon GA, Damiani LP, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: the ANDROMEDA-SHOCK randomized clinical trial. JAMA. 2019;321(7):654-664.
van Beuningen A, Metkus T, Schulman S. 138: Bedside assessment of peripheral perfusion in cardiogenic shock. Critical Care Med. 2016;44(12):112.
Scott WA, Iannaccone ST. Intensive care management, including cardiorespiratory care. In: Darras BT, Jones HR, Ryan MM, De Vivo DC, eds. Neuromuscular Disorders of Infancy, Childhood, and Adolescence (Second Edition). Academic Press; 2015: 904-912. Chap 44.
Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 update. Intensive Care Med. 2018;44(6):925- 928.
Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001;345(19):1368-1377.
Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637.
Protti A, Masson S, Latini R, et al. Persistence of central venous oxygen desaturation during early sepsis is associated with higher mortality: a retrospective analysis of the ALBIOS trial. Chest. 2018;154(6):1291- 1300.
Boulain T, Garot D, Vignon P, et al. Prevalence of low central venous oxygen saturation in the first hours of intensive care unit admission and associated mortality in septic shock patients: a prospective multicentre study. Crit Care. 2014;18(6):609.
Gallet R, Lellouche N, Mitchell-Heggs L, et al. Prognosis value of central venous oxygen saturation in acute decompensated heart failure. Arch Cardiovasc Dis. 2012;105(1):5-12.
Nebout S, Pirracchio R. Should we monitor ScVO(2) in critically Ill patients? Cardiol Res Pract. 2012;2012:370697.
Vincent JL, De Backer D. Circulatory shock. N Engl J Med. 2013; 369(18):1726-1734.
Velissaris D, Pierrakos C, Scolletta S, De Backer D, Vincent JL. High mixed venous oxygen saturation levels do not exclude fluid responsiveness in critically ill septic patients. Crit Care. 2011; 15(4):R177.
van Beest P, Wietasch G, Scheeren T, Spronk P, Kuiper M. Clinical review: use of venous oxygen saturations as a goal—a yet unfinished puzzle. Crit Care. 2011;15(5):232.
Schlichtig R, Cowden WL, Chaitman BR. Tolerance of unusually low mixed venous oxygen saturation. Adaptations in the chronic low cardiac output syndrome. Am J Med. 1986;80(5):813-818.
Michard F, Teboul JL. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence. Chest. 2002;121(6): 2000-2008.
Biais M, Ehrmann S, Mari A, et al. Clinical relevance of pulse pressure variations for predicting fluid responsiveness in mechanically ventilated intensive care unit patients: the grey zone approach. Crit Care. 2014;18(6):587. 18 Journal of Intensive Care Medicine XX(X)
Rathore A, Singh S, Lamsal R, Taank P, Paul D. Validity of pulse pressure variation (PPV)
compared with stroke volume variation (SVV) in predicting fluid responsiveness. Turk J Anaesthesiol Reanim. 2017;45(4):210-217.
He HW, Liu DW. The pitfall of pulse pressure variation in the cardiac dysfunction condition. Crit Care. 2015;19:242.
Michard F. Changes in arterial pressure during mechanical ventilation. Anesthesiology. 2005;103(2):419-428; quiz 449-415.
Wyler von Ballmoos M, Takala J, Roeck M, et al. Pulse-pressure variation and hemodynamic response in patients with elevated pulmonary artery pressure: a clinical study. Crit Care. 2010; 14(3): R111.
Osman D, Ridel C, Ray P, et al. Cardiac filling pressures are not appropriate to predict hemodynamic response to volume challenge. Crit Care Med. 2007;35(1):64-68.
Boyd JH, Forbes J, Nakada TA, Walley KR, Russell JA. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med. 2011;39(2):259-265.
Marik PE, Baram M, Vahid B. Does central venous pressure predict fluid responsiveness? A systematic review of the literature and the tale of seven mares. Chest. 2008;134(1):172-178.
Raper R, Sibbald WJ. Misled by the wedge? The Swan-Ganz catheter and left ventricular preload. Chest. 1986;89(3):427-434.
Forrester JS, Diamond G, McHugh TJ, Swan HJ. Filling pressures in the right and left sides of the heart in acute myocardial infarction. A reappraisal of central-venous-pressure monitoring. N Engl J Med. 1971;285(4):190-193.
Berlin DA, Bakker J. Starling curves and central venous pressure. Crit Care. 2015;19:55.
Sasai T, Tokioka H, Fukushima T, et al. Reliability of central venous pressure to assess left ventricular preload for fluid resuscitation in patients with septic shock. J Intensive Care. 2014; 2(1):58.
Sekiguchi H, Harada Y, Villarraga HR, Mankad SV, Gajic O. Focused cardiac ultrasound in the early resuscitation of severe sepsis and septic shock: a prospective pilot study. J Anesth. 2017;31(4):487-493.
Mosier JM, Stolz U, Milligan R, et al. Impact of point-of-care ultrasound in the emergency department on care processes and outcomes in critically ill nontraumatic patients. Critical Care Explorations. 2019;1(6):e0019.
Pro CI, Yealy DM, Kellum JA, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014; 370(18):1683- 1693.
ARISE Investigators, ANZICS Clinical Trials Group, Peake SL, Delaney A, Bailey M, et al. Goal-directed resuscitation for patients with early septic shock. N Engl J Med. 2014;371(16): 1496-1506.
Mouncey PR, Osborn TM, Power GS, et al. Trial of early, goaldirected resuscitation for septic shock. N Engl J Med. 2015; 372(14):1301- 1311.
Investigators P, Rowan KM, Angus DC, et al. Early, goal-directed therapy for septic shock—a patient-level meta-analysis. N Engl J Med. 2017;376(23):2223-2234.
Singh H, Iskandir M, Sachdev S, Simmons B, Rabines A, Hassen GW. The effect of initial volume resuscitation for sepsis in patients with congestive heart failure: is it associated with higher mortality. J Cardiac Failure. 2016;22(8): S54-S55.
Khan RA, Khan NA, Bauer SR, et al. Association between volume of fluid resuscitation and intubation in high-risk patients with sepsis, heart failure, end-stage renal disease, and cirrhosis. Chest. 2020;157(2):286- 292.
Truong TN, Dunn AS, McCardle K, et al. Adherence to fluid resuscitation guidelines and outcomes in patients with septic shock: reassessing the “one-size-fits-all” approach. J Crit Care. 2019;51:94-98.
Duttuluri M, Rose K, Shapiro J, et al. Fluid Resuscitation Dilemma in Patients with Congestive Heart Failure Presenting with Severe Sepsis/Septic Shock. D45. Critical Care: Circulatory Hemodymanics, Shock, Cardiovascular Disease, and Fluid Management. American Thoracic Society; 2016: A7048-A7048.
Leisman DE, Doerfler ME, Schneider SM, Masick KD, D’Amore JA, D’Angelo JK. Predictors, prevalence, and outcomes of early crystalloid responsiveness among initially hypotensive patients with sepsis and septic shock. Crit Care Med. 2018;46(2):189-198.
Leisman DE, Doerfler ME, Ward MF, et al. Survival benefit and cost savings from compliance with a simplified 3-hour sepsis bundle in a series of prospective, multisite, observational cohorts. Crit Care Med. 2017;45(3):395-406.
Liu VX, Morehouse JW, Marelich GP, et al. Multicenter implementation of a treatment bundle for patients with sepsis and intermediate lactate values. Am J Respir Crit Care Med. 2016;193(11): 1264-1270.
Seymour CW, Gesten F, Prescott HC, et al. Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med. 2017;376(23):2235-2244.
Kelm DJ, Perrin JT, Cartin-Ceba R, Gajic O, Schenck L, Kennedy CC. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid- related medical interventions and hospital death. Shock. 2015;43(1):68-73.
Akhter M, Hallare M, Roontiva A, Stowell J. 154 fluid resuscitation of septic patients at risk for fluid overload. Ann Emerg Med. 2017;70(4): S61-S62.
Kuttab HI, Lykins JD, Hughes MD, et al. Evaluation and predictors of fluid resuscitation in patients with severe sepsis and septic shock. Crit Care Med. 2019;47(11):1582-1590.
Leisman DE, Goldman C, Doerfler ME, et al. Patterns and outcomes associated with timeliness of initial crystalloid resuscitation in a prospective sepsis and septic shock cohort. Crit Care Med. 2017;45(10):1596-1606.
Shah S, Ouellette DR. Early goal-directed therapy for sepsis in patients with preexisting left ventricular dysfunction: a retrospective comparison of outcomes based upon protocol adherence. Chest. 2010;138(4):897A.
Wardi G, Villar J, Gross E, et al. 122 Analysis of a multi-center survey to assess fluid resuscitation practice in patients with sepsis and heart failure. Ann Emerg Med. 2017;70(4):S50. Jones et al 19
Malbrain M, Van Regenmortel N, Saugel B, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8(1):66.
Corl KA, Prodromou M, Merchant RC, et al. The Restrictive IV Fluid Trial in Severe Sepsis and Septic Shock (RIFTS): a randomized pilot study. Crit Care Med. 2019;47(7):951-959.
Hjortrup PB, Haase N, Bundgaard H, et al. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the classic randomised, parallelgroup, multicentre feasibility trial. Intensive Care Med. 2016;42(11):1695-1705.
Micek ST, McEvoy C, McKenzie M, Hampton N, Doherty JA, Kollef MH. Fluid balance and cardiac function in septic shock as predictors of hospital mortality. Crit Care. 2013;17(5): R246.
Aliti GB, Rabelo ER, Clausell N, Rohde LE, Biolo A, Beck-daSilva L. Aggressive fluid and sodium restriction in acute decompensated heart failure: a randomized clinical trial. JAMA Intern Med. 2013;173(12):1058-1064.
Travers B, O’Loughlin C, Murphy NF, et al. Fluid restriction in the management of decompensated heart failure: no impact on time to clinical stability. J Card Fail. 2007;13(2):128- 132.
Silversides JA, Major E, Ferguson AJ, et al. Conservative fluid management or deresuscitation for patients with sepsis or acute respiratory distress syndrome following the resuscitation phase of critical illness: a systematic review and meta-analysis. Intensive Care Med. 2017;43(2):155-170.
Stratton L, Berlin DA, Arbo JE. Vasopressors and inotropes in sepsis. Emerg Med Clin North Am. 2017;35(1):75-91.
Sun D, Huang A, Mital S, et al. Norepinephrine elicits beta2- receptor-mediated dilation of isolated human coronary arterioles. Circulation. 2002;106(5):550-555.
De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010;362(9):779-789.
Avni T, Lador A, Lev S, Leibovici L, Paul M, Grossman A. Vasopressors for the treatment of septic shock: systematic review and meta- analysis. PLoS One. 2015;10(8): e0129305
Rui Q, Jiang Y, Chen M, Zhang N, Yang H, Zhou Y. Dopamine versus norepinephrine in the treatment of cardiogenic shock: a PRISMA- compliant meta-analysis. Medicine (Baltimore). 2017; 96(43): e8402.
Levy B, Clere-Jehl R, Legras A, et al. Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol. 2018;72(2):173- 182.
Monnet X, Jabot J, Maizel J, Richard C, Teboul JL. Norepinephrine increases cardiac preload and reduces preload dependency assessed by passive leg raising in septic shock patients. Crit Care Med. 2011;39(4):689-694.
Maas JJ, Pinsky MR, de Wilde RB, de Jonge E, Jansen JR. Cardiac output response to norepinephrine in postoperative cardiac surgery patients: interpretation with venous return and cardiac function curves. Crit Care Med. 2013;41(1): 143-150.
Little RC, Little WC. Cardiac preload, afterload, and heart failure. Arch Intern Med. 1982;142(4):819-822.
Perner A, De Backer D. Understanding hypovolaemia. Intensive Care Med. 2014;40(4):613-615.
Hamzaoui O, Georger JF, Monnet X, et al. Early administration of norepinephrine increases cardiac preload and cardiac output in septic patients with life-threatening hypotension. Crit Care. 2010;14(4): R142.
Hamzaoui O, Jozwiak M, Geffriaud T, et al. Norepinephrine exerts an inotropic effect during the early phase of human septic shock. Br J Anaesth. 2018;120(3):517-524.
Self WH, Semler MW, Bellomo R, et al. Liberal versus restrictive intravenous fluid therapy for early septic shock: rationale for a randomized trial. Ann Emerg Med. 2018;72(4): 457-466.
Szatalowicz VL, Arnold PE, Chaimovitz C, Bichet D, Berl T, Schrier RW. Radioimmunoassay of plasma arginine vasopressin in hyponatremic patients with congestive heart failure. N Engl J Med. 1981;305(5):263-266.
Landry DW, Levin HR, Gallant EM, et al. Vasopressin deficiency contributes to the vasodilation of septic shock. Circulation. 1997;95(5):1122-1125.
Sharshar T, Blanchard A, Paillard M, Raphael JC, Gajdos P, Annane D. Circulating vasopressin levels in septic shock. Crit Care Med. 2003;31(6):1752-1758.
Maturi MF, Martin SE, Markle D, et al. Coronary vasoconstriction induced by vasopressin. Production of myocardial ischemia in dogs by constriction of nondiseased small vessels. Circulation. 1991;83(6):2111-2121.
Walker BR, Childs ME, Adams EM. Direct cardiac effects of vasopressin: role of V1- and V2-vasopressinergic receptors. Am J Physiol. 1988;255(2 Pt 2): H261-265.
Dunser MW, Mayr AJ, Ulmer H, et al. The effects of vasopressin on systemic hemodynamics in catecholamine-resistant septic and postcardiotomy shock: a retrospective analysis. Anesth Analg. 2001;93(1):7-13.
Sacha GL, Bauer SR, Lat I. Vasoactive agent use in septic shock: beyond first-line recommendations. Pharmacotherapy. 2019;39(3):369-381.
Gordon AC, Wang N, Walley KR, Ashby D, Russell JA. The cardiopulmonary effects of vasopressin compared with norepinephrine in septic shock. Chest. 2012;142(3):593-605.
Dunser MW, Mayr AJ, Ulmer H, et al. Arginine vasopressin in advanced vasodilatory shock: a prospective, randomized, controlled study. Circulation. 2003;107(18):2313-2319.
Torgersen C, Dunser MW, Wenzel V, et al. Comparing two different arginine vasopressin doses in advanced vasodilatory shock: a randomized, controlled, open-label trial. Intensive Care Med. 2010;36(1):57-65.
Russell JA, Walley KR, Singer J, et al. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008;358(9):877-887.
Harper D, Chandler B. Splanchnic circulation. BJA Education. 2015;16(2):66-71.
Morici N, Sacco A, Oliva F, et al. Epinephrine for acute decompensated heart failure and low output state: friend or foe? Int J Cardiol. 2011;149(3):384-385.
Stratton JR, Pfeifer MA, Ritchie JL, Halter JB. Hemodynamic effects of epinephrine: concentration-effect study in humans. J Appl Physiol (1985). 1985;58(4):1199-1206.
Levy B, Bollaert PE, Charpentier C, et al. Comparison of norepinephrine and dobutamine to epinephrine for hemodynamics, lactate metabolism, and gastric tonometric variables in septic shock: a prospective, randomized study. Intensive Care Med. 1997;23(3):282-287.
Annane D, Vignon P, Renault A, et al. Norepinephrine plus dobutamine versus epinephrine alone for management of septic shock: a randomised trial. Lancet. 2007;370(9588):676-684.
Mahmoud KM, Ammar AS. Norepinephrine supplemented with dobutamine or epinephrine for the cardiovascular support of patients with septic shock. Indian J Crit Care Med. 2012; 16(2):75-80.
Sato R, Ariyoshi N, Hasegawa D, et al. Effects of inotropes on the mortality in patients with septic shock. J Intensive Care Med. 2019:885066619892218.
Myburgh JA, Higgins A, Jovanovska A, et al. A comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med. 2008;34(12):2226-2234.
Levy B, Perez P, Perny J, Thivilier C, Gerard A. Comparison of norepinephrine- dobutamine to epinephrine for hemodynamics, lactate metabolism, and organ function variables in cardiogenic shock. A prospective, randomized pilot study. Crit Care Med. 2011;39(3):450-455.
Nalos M, Leverve X, Huang S, et al. Half- molar sodium lactate infusion improves cardiac performance in acute heart failure: a pilot randomised controlled clinical trial. Crit Care. 2014; 18(2): R48.
Wutrich Y, Barraud D, Conrad M, et al. Early increase in arterial lactate concentration under epinephrine infusion is associated with a better prognosis during shock. Shock. 2010;34(1):4-9.
Omar S, Burchard AT, Lundgren AC, Mathivha LR, Dulhunty JM. The relationship between blood lactate and survival following the use of adrenaline in the treatment of septic shock. Anaesth Intensive Care. 2011;39(3):449- 455.
De Backer D, Aldecoa C, Njimi H, Vincent JL. Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis. Crit Care Med. 2012;40(3):725-730.
Reynolds HR, Hochman JS. Cardiogenic shock: current concepts and improving outcomes. Circulation. 2008;117(5): 686-697.
Giamouzis G, Butler J, Starling RC, et al. Impact of dopamine infusion on renal function in hospitalized heart failure patients: results of the dopamine in acute decompensated heart failure (DAD-HF) Trial. J Card Fail. 2010;16(12):922- 930.
Triposkiadis FK, Butler J, Karayannis G, et al. Efficacy and safety of high dose versus low dose furosemide with or without dopamine infusion: the Dopamine in Acute Decompensated Heart Failure II (DAD-HF II) trial. Int J Cardiol. 2014;172(1): 115-121.
Mebazaa A, Motiejunaite J, Gayat E, et al. Long-term safety of intravenous cardiovascular agents in acute heart failure: results from the European Society of Cardiology Heart Failure LongTerm Registry. Eur J Heart Fail. 2018;20(2):332-341.
Hiemstra B, Koster G, Wetterslev J, et al. Dopamine in critically ill patients with cardiac dysfunction: a systematic review with meta- analysis and trial sequential analysis. Acta Anaesthesiol Scand. 2019;63(4):424-437.
De Backer D, Moraine JJ, Berre J, Kahn RJ, Vincent JL. Effects of dobutamine on oxygen consumption in septic patients. Direct versus indirect determinations. Am J Respir Crit Care Med. 1994;150(1):95-100.
Guarracino F, Bertini P, Pinsky MR. Cardiovascular determinants of resuscitation from sepsis and septic shock. Critical Care. 2019;23(1):118.
Hernandez G, Bruhn A, Luengo C, et al. Effects of dobutamine on systemic, regional and microcirculatory perfusion parameters in septic shock: a randomized, placebo-controlled, double-blind, crossover study. Intensive Care Med. 2013;39(8):1435-1443.
Hayes MA, Timmins AC, Yau EH, et al. Elevation of systemic oxygen delivery in the treatment of critically ill patients. N Engl J Med. 1994;330(24):1717-1722.
Wang XC, Zhu DM, Shan YX. Dobutamine therapy is associated with worse clinical outcomes compared with nesiritide therapy for acute decompensated heart failure: a systematic review and meta-analysis. Am J Cardiovasc Drugs. 2015;15(6):429-437.
Cheng L, Yan J, Han S, et al. Comparative efficacy of vasoactive medications in patients with septic shock: a network metaanalysis of randomized controlled trials. Crit Care. 2019; 23(1):168.
Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multipletreatment meta- analysis: an overview and tutorial. J Clin Epidemiol. 2011;64(2):163-171.
Mbuagbaw L, Rochwerg B, Jaeschke R, et al. Approaches to interpreting and choosing the best treatments in network metaanalyses. Syst Rev. 2017;6(1):79.
Colucci WS, Wright RF, Jaski BE, Fifer MA, Braunwald E. Milrinone and dobutamine in severe heart failure: differing hemodynamic effects and individual patient responsiveness. Circulation. 1986;73(3 Pt 2):III175-III183.
Mellor A. Use of milrinone in non- hyperdynamic sepsis. Critical Care. 1999;2(1):1362.
Nunez S, Maisel A. Comparison between mixed venous oxygen saturation and thermodilution cardiac output in monitoring patients with severe heart failure treated with milrinone and dobutamine. Am Heart J. 1998;135(3):383-388.
Cuffe MS, Califf RM, Adams KF Jr, et al. Short-term intravenous milrinone for acute exacerbation of chronic heart failure: a randomized controlled trial. JAMA. 2002;287(12):1541-1547.
Schmittinger CA, Dunser MW, Haller M, et al. Combined milrinone and enteral metoprolol therapy in patients with septic myocardial depression. Crit Care. 2008;12(4): R99.
Wang Z, Wu Q, Nie X, Guo J, Yang C. Combination therapy with milrinone and esmolol for heart protection in patients with severe sepsis: a prospective, randomized trial. Clin Drug Investig. 2015;35(11):707-716.
Lowes BD, Tsvetkova T, Eichhorn EJ, Gilbert EM, Bristow MR. Milrinone versus dobutamine in heart failure subjects treated Jones et al 21 chronically with carvedilol. Int J Cardiol. 2001;81(2-3): 141-149.
Fonarow GC, Hernandez AF, Solomon SD, Yancy CW. Potential mortality reduction with optimal implementation of angiotensin receptor neprilysin inhibitor therapy in heart failure. JAMA Cardiology. 2016;1(6):714-717.
Suzuki T, Suzuki Y, Okuda J, et al. Sepsis- induced cardiac dysfunction and beta- adrenergic blockade therapy for sepsis. J Intensive Care. 2017;5:22.
de Montmollin E, Aboab J, Mansart A, Annane D. Bench-tobedside review: beta- adrenergic modulation in sepsis. Crit Care. 2009;13(5):230.
Ackland GL, Yao ST, Rudiger A, et al. Cardioprotection, attenuated systemic inflammation, and survival benefit of beta1- adrenoceptor blockade in severe sepsis in rats. Crit Care Med. 2010;38(2):388-394.
Hagiwara S, Iwasaka H, Matumoto S, Hidaka S, Noguchi T. Effects of an angiotensin- converting enzyme inhibitor on the inflammatory response in in vivo and in vitro models. Crit Care Med. 2009;37(2):626-633.
Haeusler G. Pharmacology of beta- blockers: classical aspects and recent developments. J Cardiovasc Pharmacol. 1990; 16(suppl 5):S1-S9.
Gilbert EM, Abraham WT, Olsen S, et al. Comparative hemodynamic, left ventricular functional, and antiadrenergic effects of chronic treatment with metoprolol versus carvedilol in the failing heart. Circulation. 1996;94(11):2817- 2825.
Gilbert EM, Olsen SL, Renlund DG, Bristow MR. betaadrenergic receptor regulation and left ventricular function in idiopathic dilated cardiomyopathy. Am J Cardiol. 1993;71(9): 23C- 29C.
Metra M, Nodari S, D’Aloia A, et al. Beta- blocker therapy influences the hemodynamic response to inotropic agents in patients with heart failure: a randomized comparison of dobutamine and enoximone before and after chronic treatment with metoprolol or carvedilol. J Am Coll Cardiol. 2002;40(7):1248-1258.
Asano K, Zisman LS, Yoshikawa T, Headley V, Bristow MR, Port JD. Bucindolol, a nonselective beta 1- and beta 2-adrenergic receptor antagonist, decreases beta-adrenergic receptor density in cultured embryonic chick cardiac myocyte membranes. J Cardiovasc Pharmacol. 2001;37(6):678-691.
Tisdale JE, Patel R, Webb CR, Borzak S, Zarowitz BJ. Electrophysiologic and proarrhythmic effects of intravenous inotropic agents. Prog Cardiovasc Dis. 1995;38(2):167- 180.
Mert KU, Mert GO, Morrad B, Tahmazov S, Mutlu F, Cavusoglu Y. Effects of ivabradine and beta-blocker therapy on dobutamine-induced ventricular arrhythmias. Kardiol Pol. 2017;75(8):786-793.
Macchia A, Romero M, Comignani PD, et al. Previous prescription of beta-blockers is associated with reduced mortality among patients hospitalized in intensive care units for sepsis. Crit Care Med. 2012;40(10):2768-2772.
Contenti J, Occelli C, Corraze H, Lemoel F, Levraut J. Longterm beta-blocker therapy decreases blood lactate concentration in severely septic patients. Crit Care Med. 2015;43(12): 2616-2622.
DeMott JM, Patel G, Lat I. Effects of chronic antihypertensives on vasopressor dosing in septic shock. Ann Pharmacother. 2018; 52(1):40-47.
Fuchs C, Wauschkuhn S, Scheer C, et al. Continuing chronic beta-blockade in the acute phase of severe sepsis and septic shock is associated with decreased mortality rates up to 90 days. Br J Anaesth. 2017;119(4):616-625.
US National Institutes of Health. ClinicalTrials.gov. 2017. Accessed July 22, 2019. https://ClinicalTrials.gov/show/ NCT03190408.
Prins KW, Neill JM, Tyler JO, Eckman PM, Duval S. Effects of beta-blocker withdrawal in acute decompensated heart failure: a systematic review and meta-analysis. JACC Heart Fail. 2015; 3(8):647-653.
Bohm M, Link A, Cai D, et al. Beneficial association of betablocker therapy on recovery from severe acute heart failure treatment: data from the survival of patients with acute heart failure in need of intravenous inotropic support trial. Crit Care Med. 2011;39(5):940-944.
Jondeau G, Neuder Y, Eicher JC, et al. B- convinced: betablocker continuation vs. interruption in patients with congestive heart failure hospitalized for a decompensation episode. Eur Heart J. 2009;30(18):2186-2192.
Hsu WT, Galm BP, Schrank G, et al. Effect of renin-angiotensinaldosterone system inhibitors on short-term mortality after sepsis: a population-based cohort study. Hypertension. 2020;75(2): 483-491.
Hsieh MS, How CK, Hsieh VC, Chen PC. Preadmission antihypertensive drug use and sepsis outcome: impact of angiotensin- converting enzyme inhibitors (ACEIs) and angiotensin receptor blockers (ARBs). Shock. 2020;53(4):407-415.
Hessels L, Hoekstra M, Mijzen LJ, et al. The relationship between serum potassium, potassium variability and inhospital mortality in critically ill patients and a before-after analysis on the impact of computer-assisted potassium control. Crit Care. 2015;19:4.
Jorres A. Acute kidney injury in sepsis: transient or intrinsic? Crit Care. 2013;17(6):1014.
Lu B, Gerard NP, Kolakowski LF Jr., et al. Neutral endopeptidase modulation of septic shock. J Exp Med. 1995;181(6): 2271-2275.
Shahreyar M, Fahhoum R, Akinseye O, Bhandari S, Dang G, Khouzam RN. Severe sepsis and cardiac arrhythmias. Ann Transl Med. 2018;6(1):6.
Seguin P, Signouret T, Laviolle B, Branger B, Malledant Y. Incidence and risk factors of atrial fibrillation in a surgical intensive care unit. Crit Care Med. 2004;32(3):722-726.
Makrygiannis SS, Margariti A, Rizikou D, et al. Incidence and predictors of new-onset atrial fibrillation in noncardiac intensive care unit patients. J Crit Care. 2014;29(4):697. e691- e695.
Salman S, Bajwa A, Gajic O, Afessa B. Paroxysmal atrial fibrillation in critically ill patients with sepsis. J Intensive Care Med. 2008;23(3):178-183.
Balik M, Kolnikova I, Maly M, Waldauf P, Tavazzi G, Kristof J. Propafenone for supraventricular arrhythmias in septic shock—22 Journal of Intensive Care Medicine XX(X) comparison to amiodarone and metoprolol. J Crit Care. 2017; 41:16-23.
Walkey AJ, Wiener RS, Ghobrial JM, Curtis LH, Benjamin EJ. Incident stroke and mortality associated with new-onset atrial fibrillation in patients hospitalized with severe sepsis. JAMA. 2011;306(20):2248-2254.
Masarone D, Limongelli G, Rubino M, et al. Management of arrhythmias in heart failure. J Cardiovasc Dev Dis. 2017;4(1):8.
January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2014;64(21):e1-76.
Sibley S, Muscedere J. New-onset atrial fibrillation in critically ill patients. Can Respir J. 2015;22(3):179-182.
Kanji S, Williamson DR, Yaghchi BM, Albert M, McIntyre LCanadian Critical Care Trials Group. Epidemiology and management of atrial fibrillation in medical and noncardiac surgical adult intensive care unit patients. J Crit Care. 2012;27(3):326. e321-e328.
Gillinov AM, Bagiella E, Moskowitz AJ, et al. Rate control versus rhythm control for atrial fibrillation after cardiac surgery. N Engl J Med. 2016;374(20):1911-1921.
Liu WC, Lin WY, Lin CS, et al. Prognostic impact of restored sinus rhythm in patients with sepsis and new-onset atrial fibrillation. Crit Care. 2016;20(1):373.
Clark DM, Plumb VJ, Epstein AE, Kay GN. Hemodynamic effects of an irregular sequence of ventricular cycle lengths during atrial fibrillation. J Am Coll Cardiol. 1997;30(4):1039- 1045.
Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice patterns and outcomes of treatments for atrial fibrillation during sepsis: a propensity-matched cohort study. Chest. 2016;149(1): 74-83.
Lee YR, Seth MS, Soney D, Dai H. Benefits of beta-blockade in sepsis and septic shock: a systematic review. Clin Drug Investig. 2019;39(5):429-440.
Gore DC, Wolfe RR. Hemodynamic and metabolic effects of selective beta1 adrenergic blockade during sepsis. Surgery. 2006;139(5):686-694.
Balik M, Rulisek J, Leden P, et al. Concomitant use of beta-1 adrenoreceptor blocker and norepinephrine in patients with septic shock. Wien Klin Wochenschr. 2012;124(15-16):552-556.
Du W, Wang XT, Long Y, Liu DW. Efficacy and safety of esmolol in treatment of patients with septic shock. Chin Med J (Engl). 2016;129(14):1658-1665.
Iskandrian AS, Bemis CE, Hakki AH, et al. Effects of esmolol on patients with left ventricular dysfunction. J Am Coll Cardiol. 1986;8(1):225- 231.
Morelli A, Ertmer C, Westphal M, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. JAMA. 2013;310(16):1683-1691.
Morelli A, Singer M, Ranieri VM, et al. Heart rate reduction with esmolol is associated with improved arterial elastance in patients with septic shock: a prospective observational study. Intensive Care Med. 2016;42(10):1528-1534.
Schwartz A, Brotfain E, Koyfman L, Klein M. Cardiac arrhythmias in a septic ICU population: a review. J Crit Care Med (Targu Mures). 2015;1(4):140-146.
American College of Cardiology Foundation, American Heart Association Task Force on Practice Guidelines, Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;128(16): e240-327.
Lee CC, Lee MG, Lee WC, et al. Preadmission use of calcium channel blocking agents is associated with improved outcomes in patients with sepsis: a population-based propensity score-matched cohort study. Crit Care Med. 2017;45(9): 1500-1508.
Balser JR, Martinez EA, Winters BD, et al. Beta-adrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias. Anesthesiology. 1998;89(5):1052-1059.
Demircan C, Cikriklar HI, Engindeniz Z, et al. Comparison of the effectiveness of intravenous diltiazem and metoprolol in the management of rapid ventricular rate in atrial fibrillation. Emerg Med J. 2005;22(6):411-414.
Fromm C, Suau SJ, Cohen V, et al. Diltiazem vs. metoprolol in the management of atrial fibrillation or flutter with rapid ventricular rate in the emergency department. J Emerg Med. 2015; 49(2):175-182.
Goldenberg IF, Lewis WR, Dias VC, Heywood JT, Pedersen WR. Intravenous diltiazem for the treatment of patients with atrial fibrillation or flutter and moderate to severe congestive heart failure. Am J Cardiol. 1994;74(9):884-889.
Hirschy R, Ackerbauer KA, Peksa GD, O’Donnell EP, DeMott JM. Metoprolol vs. diltiazem in the acute management of atrial fibrillation in patients with heart failure with reduced ejection fraction. Am J Emerg Med. 2019;37(1):80-84.
Siu CW, Lau CP, Lee WL, Lam KF, Tse HF. Intravenous diltiazem is superior to intravenous amiodarone or digoxin for achieving ventricular rate control in patients with acute uncomplicated atrial fibrillation. Crit Care Med. 2009;37(7):2174-2179; quiz 2180.
Delle Karth G, Geppert A, Neunteufl T, et al. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med. 2001;29(6):1149-1153.
Means KN, Gentry AE, Nguyen TT. Intravenous continuous infusion vs. oral immediate-release diltiazem for acute heart rate control. West J Emerg Med. 2018;19(2):417- 422.
January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. Circulation. 2014; 130(23):2071-2104.
Clemo HF, Wood MA, Gilligan DM, Ellenbogen KA. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol. 1998;81(5): 594-598. Jones et al 23
Shojaee M, Feizi B, Miri R, Etemadi J, Feizi AH. Intravenous amiodarone versus digoxin in atrial fibrillation rate control: a clinical trial. Emerg (Tehran). 2017;5(1):e29.
Khan IA, Mehta NJ, Gowda RM. Amiodarone for pharmacological cardioversion of recent-onset atrial fibrillation. Int J Cardiol. 2003;89(2-3):239-248.
Scarlatescu E, Tomescu D, Arama SS. Anticoagulant therapy in sepsis. The importance of timing. J Crit Care Med (Targu Mures). 2017;3(2):63-69.
Marti-Carvajal AJ, Sola I, Gluud C, Lathyris D, Cardona AF. Human recombinant protein C for severe sepsis and septic shock in adult and paediatric patients. Cochrane Database Syst Rev. 2012;12:CD004388.
Warren BL, Eid A, Singer P, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA. 2001;286(15):1869-1878.
Abraham E, Reinhart K, Opal S, et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA. 2003;290(2):238-247.
Yamakawa K, Umemura Y, Hayakawa M, et al. Benefit profile of anticoagulant therapy in sepsis: a nationwide multicentre registry in Japan. Crit Care. 2016;20(1):229.
Walkey AJ, Quinn EK, Winter MR, McManus DD, Benjamin EJ. Practice patterns and outcomes associated with use of anticoagulation among patients with atrial fibrillation during sepsis. JAMA Cardiol. 2016;1(6):682-690.
Nasraway SA, Rackow EC, Astiz ME, Karras G, Weil MH. Inotropic response to digoxin and dopamine in patients with severe sepsis, cardiac failure, and systemic hypoperfusion. Chest. 1989;95(3):612-615.
Rathore SS, Curtis JP, Wang Y, Bristow MR, Krumholz HM. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA. 2003;289(7):871-878.
Ahmed A, Gambassi G, Weaver MT, Young JB, Wehrmacher WH, Rich MW. Effects of discontinuation of digoxin versus continuation at low serum digoxin concentrations in chronic heart failure. Am J Cardiol. 2007;100(2):280- 284.
Lopes RD, Rordorf R, De Ferrari GM, et al. Digoxin and mortality in patients with atrial fibrillation. J Am Coll Cardiol. 2018;71(10):1063- 1074.
MacLeod-Glover N, Mink M, Yarema M, Chuang R.Digoxin toxicity: case for retiring its use in elderly patients? Can Fam Physician. 2016;62(3):223-228.
Papadakis MA, Wexman MP, Fraser C, Sedlacek SM. Hyperkalemia complicating digoxin toxicity in a patient with renal failure. Am J Kidney Dis. 1985;5(1):64-66.
Gomez H, Kellum JA. Sepsis-induced acute kidney injury. Curr Opin Crit Care. 2016;22(6):546-553.
Eichhorn EJ, Gheorghiade M. Digoxin. Prog Cardiovasc Dis. 2002;44(4):251-266.
Hou ZY, Chang MS, Chen CY, et al. Acute treatment of recentonset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone. a randomized, digoxin- controlled study. Eur Heart J. 1995;16(4):521- 528.
Herasevich S, Bennett CE, Schwegman AR, Subat YW, Gajic O, Jayaprakash N. Hemodynamic profiles following digoxin use in patients with sepsis in the ICU. J Crit Care. 2019;54:175-179.
Fuller BM, Mohr NM, Graetz TJ, et al. The impact of cardiac dysfunction on acute respiratory distress syndrome and mortality in mechanically ventilated patients with severe sepsis and septic shock: an observational study. J Crit Care. 2015;30(1):65-70.
Alviar CL, Miller PE, McAreavey D, et al. Positive pressure ventilation in the cardiac intensive care unit. J Am Coll Cardiol. 2018;72(13):1532-1553.
Feihl F, Broccard AF. Interactions between respiration and systemic hemodynamics. Part I: basic concepts. Intensive Care Med. 2009;35(1):45-54.
Luecke T, Pelosi P. Clinical review: positive end-expiratory pressure and cardiac output. Crit Care. 2005;9(6):607-621.
Wiesen J, Ornstein M, Tonelli AR, Menon V, Ashton RW. State of the evidence: mechanical ventilation with PEEP in patients with cardiogenic shock. Heart. 2013;99(24):1812-1817.
De Backer D, Vincent JL. Should we measure the central venous pressure to guide fluid management? Ten answers to 10 questions. Crit Care. 2018;22(1):43.
Barbar SD, Clere-Jehl R, Bourredjem A, et al. Timing of renalreplacement therapy in patients with acute kidney injury and sepsis. N Engl J Med. 2018;379(15):1431-1442.
Lin WT, Lai CC, Chang SP, Wang JJ. Effects of early dialysis on the outcomes of critically ill patients with acute kidney injury: a systematic review and meta-analysis of randomized controlled trials. Scientific Reports. 2019;9(1):18283.
Liu Y, Davari-Farid S, Arora P, Porhomayon J, Nader ND. Early versus late initiation of renal replacement therapy in critically ill patients with acute kidney injury after cardiac surgery: a systematic review and meta-analysis. J Cardiothorac Vasc Anesth. 2014;28(3):557-563.
Costanzo MR, Guglin ME, Saltzberg MT, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol. 2007;49(6): 675- 683.
Bart BA, Goldsmith SR, Lee KL, et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med. 2012;367(24):2296-2304.
van der Sande FM, Mulder AW, Hoorntje SJ, et al. The hemodynamic effect of different ultrafiltration rates in patients with cardiac failure and patients without cardiac failure: comparison between isolated ultrafiltration and ultrafiltration with dialysis. Clin Nephrol. 1998;50(5):301-308.
Daugirdas JT. Pathophysiology of dialysis hypotension: an update. Am J Kidney Dis. 2001;38(4 suppl 4):S11-S17.
Chou JA, Kalantar-Zadeh K, Mathew AT. A brief review of intradialytic hypotension with a focus on survival. Semin Dial. 2017;30(6):473- 480.