Miguel Ángel López Zúñiga, Data curation, Formal analysis, Investigation, Methodology, Validation, Writing – original draft,
Aida Moreno-Moral, Formal analysis, Writing – original draft, Writing – review & editing,
Ana Ocaña-Granados, Data curation, Investigation,
Francisco Andrés Padilla-Moreno, Data curation, Investigation,
Alba María Castillo-Fernández, Data curation, Investigation, Dionisio GuillamónFernández, Data curation,
Carolina Ramírez-Sánchez, Data curation,
María Sanchez-Palop, Data curation,
Justo Martínez-Colmenero, Data curation, Investigation,
María Amparo Pimentel-Villar, Data curation,
Sara Blázquez-Roselló, Data curation,
José Juan Moreno-Sánchez, Data curation,
María López-Vílchez, Data curation,
Inmaculada Prior-Sánchez, Data curation,
Rosario Jódar-Moreno, Data curation, and Miguel Ángel López Ruz
PLoS One. 2021; 16(1): e0243964.
Published online 2021 Jan 28. doi: 10.1371/journal.pone.0243964
Dịch bởi: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Mục tiêu
Kiểm tra xem liệu pháp xung corticosteroid liều cao (HDCPT, high dose corticosteroid pulse therapy) với methylprednisolone hoặc dexamethasone có liên quan đến việc tăng khả năng sống sót ở bệnh nhân COVID-19 có nguy cơ phản ứng tăng viêm hay không. Cung cấp một số tiêu chuẩn chẩn đoán ban đầu bằng cách sử dụng các điểm đánh dấu trong phòng thí nghiệm để phân tầng những bệnh nhân này.
Phương pháp
Đây là một nghiên cứu quan sát tiềm năng, 318 đáp ứng các tiêu chí đưa vào. 64 bệnh nhân (20,1%) được điều trị HDCPT bằng cách sử dụng ít nhất 1,5mg/kg/24h methylprednisolone hoặc dexamethasone tương đương. Một hồi quy Cox đa biến (kiểm soát các bệnh đồng mắc và các liệu pháp khác) được thực hiện để xác định xem HDCPT (trong số các biện pháp can thiệp khác) có liên quan đến giảm tỷ lệ tử vong hay không. Chúng tôi cũng thực hiện phân tích quá trình bệnh trong thời gian 30 ngày về các dấu hiệu trong phòng thí nghiệm giữa những người sống sót và không sống sót, để xác định các dấu hiệu tiềm năng để phân tầng bệnh nhân.
Kết quả
HDCPT cho thấy tỷ lệ tử vong giảm có ý nghĩa thống kê (HR = 0,087 [CI 95% 0,021–0,36]; P = 40 pg/ml, và/hoặc hai trong số sau: Protein phản ứng C> = 100 mg/L, D-dimer> = 1000 ng/ml, ferritin> = 500 ng/ml và lactate dehydrogenase> = 300 U/L).
Kết luận
HDCPT có thể là một can thiệp hiệu quả để tăng tỷ lệ sống sót COVID-19 ở những bệnh nhân có nguy cơ phát triển đáp ứng tăng viêm COVID-19, các xét nghiệm dấu hiệu trong phòng thí nghiệm có thể được sử dụng để phân tầng những bệnh nhân này nên được dùng HDCPT. Nghiên cứu này không phải là một thử nghiệm lâm sàng ngẫu nhiên (RCT). Các RCT trong tương lai nên được thực hiện để xác nhận hiệu quả của HDCPT để tăng tỷ lệ sống sót của COVID-19.
Giới thiệu
COVID-19 là một căn bệnh do SARS-CoV-2 gây ra, được mô tả ban đầu ở Vũ Hán, Trung Quốc, vào tháng 12 năm 2019. Người ta cho rằng 80% dân số nhiễm bệnh không có triệu chứng hoặc triệu chứng nhẹ, trong khi 20% phải nhập viện, với 5% cần chăm sóc đặc biệt, với tỷ lệ tử vong là 50% trong những trường hợp này [1–3]. Diễn biến của bệnh được chia thành ba giai đoạn: giai đoạn đầu đặc trưng bởi nhiễm vi rút ở đường hô hấp; giai đoạn phổi thứ phát được đặc trưng bởi tình trạng nhiễm trùng phổi với giai đoạn không thiếu oxy (giai đoạn IIA) và dẫn đến giai đoạn thiếu oxy (giai đoạn IIB); và giai đoạn tăng viêm thứ ba [4]. Kinh nghiệm lâm sàng cho thấy, tùy theo độ tuổi của đối tượng, các giai đoạn khác biệt của COVID-19 có thể biểu hiện độc lực nhiều hơn hoặc ít hơn: trong khi khả năng chịu đựng của giai đoạn độc lực đầu tiên giảm theo tuổi, giai đoạn tăng viêm cuối cùng có thể đe dọa cuộc sống ở bệnh nhân trẻ hơn.
Giai đoạn tăng viêm có tỷ lệ tử vong cao nhất, do những gì được mô tả là “đáp ứng tăng viêm”. Đáp ứng tăng viêm này được đặc trưng bởi sản xuất quá mức các cytokine tiền viêm đáp ứng sớm có thể dẫn đến suy đa cơ quan và tử vong [5-7]. Do tính cấp bách của đại dịch này, nhiều biện pháp can thiệp đã được thử với mục đích chống lại đáp ứng tăng viêm này [8–10]. Một số biện pháp can thiệp này bao gồm thuốc ngăn chặn IL-6 (chẳng hạn như Tozilizumab [11, 12]), IL-1 (Anakinra) hoặc corticosteroid ở các liều lượng khác nhau. Tuy nhiên, việc sử dụng cái sau đã gây tranh cãi và tiếp tục là một chủ đề tranh luận.
Trong nghiên cứu này, chúng tôi xem xét liệu có mối liên quan giữa liệu pháp xung corticosteroid liều cao (HDCPT) và giảm nguy cơ tử vong ở bệnh nhân COVID-19 có mức độ viêm cao hay không, cùng với các biện pháp can thiệp khác. Để khám phá một số tiêu chuẩn chẩn đoán có thể được sử dụng để quyết định bệnh nhân nào có thể được hưởng lợi nhiều nhất từ HDCPT, chúng tôi cũng phân tích sự khác biệt về các dấu hiệu trong phòng thí nghiệm giữa những người sống sót và không sống sót trong suốt quá trình điều trị COVID-19.
Phương pháp
Tiêu chí lựa chọn
Chúng tôi đưa vào tất cả các bệnh nhân nhập viện Complejo Hospitalario de Jaén (Bệnh viện Jaén, Tây Ban Nha) với COVID-19 được xác nhận hoặc nghi ngờ từ ngày 4 tháng 2 năm 2020 đến ngày 30 tháng 4 năm 2020 và trên 18 tuổi. 318 đáp ứng các tiêu chí đưa vào phát hiện SARS-CoV-2 bằng PCR hoặc huyết thanh học (n = 272, 71,2%) hoặc có nghi ngờ lâm sàng cao (n = 46, 16,9%), được xác định là có thâm nhiễm phổi hai bên hoặc giảm lympho bào với một Hồ sơ lâm sàng phù hợp. Tất cả bệnh nhân đều là người gốc Tây Âu. Nghiên cứu này đã được phê duyệt bởi Ủy ban Đạo đức của Bệnh viện Complejo de Jaén (Bệnh viện Jaén), Tây Ban Nha (0946-N-20). Theo các quy định của ủy ban đạo đức địa phương, sự đồng ý bằng lời nói đã nhận được từ những bệnh nhân tham gia nghiên cứu và được ghi lại trong hồ sơ bệnh án của mỗi bệnh nhân.
Các biến đo lường và thiết kế nghiên cứu
Chúng tôi đã thực hiện một nghiên cứu quan sát tiền cứu trong đó dữ liệu lâm sàng được thu thập từ tất cả các bệnh nhân đáp ứng các tiêu chí đưa vào và so sánh hồi cứu những người sống sót và những người không sống sót. Khi đến bệnh viện, chúng tôi đã đăng ký những thông tin sau: tuổi, giới tính, ngày bắt đầu xuất hiện các triệu chứng COVID-19 và sự hiện diện của: khó thở, ho, sốt, suy nhược, thiếu máu và mức độ bão hòa oxy. Các chi tiết sau đây của bệnh sử cũng được đăng ký: tăng huyết áp, tiền sử hút thuốc, bệnh phổi tắc nghẽn mãn tính (COPD), hen suyễn, bệnh tim mãn tính (CHD), rung nhĩ, đái tháo đường và liệu bệnh nhân có đang điều trị corticosteroid đường uống hoặc hít tại thời điểm nhập viện (bất kể thời gian), có khối u hoặc bị suy giảm miễn dịch (tức là bệnh nhân đang dùng thuốc ức chế miễn dịch, có vi rút suy giảm miễn dịch ở người (HIV) hoặc bị ức chế miễn dịch do điều trị lâu dài bằng corticosteroid dạng uống hoặc hít). Ngoài ra, chúng tôi đã đăng ký xem bệnh nhân có đang sử dụng thuốc ức chế men chuyển (ACE)/thuốc chẹn thụ thể angiotensin (ARB) hay không. Ở mỗi bệnh nhân này, xét nghiệm SARSCoV-2 PCR và/hoặc huyết thanh học (IgM và IgG) được thực hiện.
Chúng tôi thu thập kết quả của tất cả các xét nghiệm được thực hiện từ khi bắt đầu nhập viện cho đến khi kết thúc trường hợp tử vong hoặc xuất viện. Tất cả các bệnh nhân nằm trong phòng chăm sóc đặc biệt (ICU) đều được làm các xét nghiệm cận lâm sàng mỗi 24 giờ. Bệnh nhân bên ngoài ICU được kiểm tra trong phòng thí nghiệm cứ sau 48 giờ trừ khi có các triệu chứng xấu đi (trong những trường hợp này, họ được kiểm tra sau mỗi 24 giờ). Trong các xét nghiệm trong phòng thí nghiệm này, mức độ của bốn mươi lăm dấu hiệu được đo bao gồm huyết đồ, mức lọc cầu thận, creatinin kinase, triglycerid, lactate dehydrogenase, interleukin 6 (IL-6), ferritin, huyết thanh học HIV, globulin miễn dịch và vitamin D, tỷ lệ chuẩn hóa quốc tế (INR), D-dimer, thời gian prothrombin và thời gian thromboplastin một phần (xem danh sách đầy đủ trong Bảng S1). Khi đến bệnh viện, chúng tôi cũng đã chụp X-quang phổi và tính toán đánh giá nhanh tình trạng suy cơ quan liên quan nhiễm trùng huyết (qSOFA) [13].
Trong thời gian họ nằm viện, chúng tôi đã đánh giá nhu cầu: bổ sung oxy và lưu lượng oxy tối đa cần thiết (chúng tôi đã xem xét lượng oxy yêu cầu cao hơn 10L/phút); thông khí hỗ trợ cơ học (xâm nhập hoặc không xâm nhập); và yêu cầu chăm sóc đặc biệt. Chúng tôi cũng đăng ký tất cả các loại thuốc đã dùng trong thời gian nằm viện của họ: hydroxychloroquine, lopinavir/ritonavir, liệu pháp immunoglobulin, tozilizumab, anakinra, azytromycin, bổ sung vitamin D, chống đông máu và liệu pháp corticosteroid. Đối với liệu pháp chống đông máu, chúng tôi sử dụng heparin trọng lượng phân tử thấp (LMWH) hoặc thuốc chống đông đường uống tác dụng trực tiếp (DOAC) với ba liều lượng khác nhau: dự phòng 3.500–4000 IU/ngày; trung gian 5.000–6.000 IU/ngày; hoặc đầy đủ 115– 150 IU/kg/ngày (trong mọi trường hợp, thuốc này được duy trì trong suốt thời gian nằm viện).
Trong liệu pháp corticosteroid, chúng tôi phân biệt giữa xung corticosteroid liều cao và liệu pháp corticosteroid liều thấp. Liệu pháp xung corticosteroid liều cao được định nghĩa là liều methylprednisolone hoặc dexamethasone tương đương hàng ngày ít nhất 1,5mg/kg/24h. Thời gian điều trị xung corticosteroid liều cao tiêu chuẩn là 3 ngày. Ở một số bệnh nhân không cải thiện sau 3 ngày, việc điều trị được kéo dài đến 5 ngày. Ở hai bệnh nhân, việc điều trị được rút ngắn xuống còn 2 ngày do quan sát thấy sự hồi phục đáng kể. Xung corticosteroid liều cao được cung cấp cho bệnh nhân theo các tiêu chuẩn được đề xuất trước đó từ các quan sát thực nghiệm và các hướng dẫn được sử dụng cho hội chứng hoạt hóa đại thực bào [14]: IL6 ít nhất 40 pg/ml và/hoặc hai trong số này: ferritin, triglycerid và D-dimer lần lượt là ít nhất 300 ng/ml, 300 mg/L và 1000 ng/ml. HDCPT được sử dụng ngay sau khi phát hiện các mức chỉ điểm này một cách độc lập với việc bệnh nhân có được chăm sóc đặc biệt hay không. Không phải tất cả các bệnh nhân đáp ứng các tiêu chuẩn này đều nhận được xung corticosteroid liều cao: trong số 158 bệnh nhân, 48 bệnh nhân được điều trị xung corticosteroid liều cao. Cũng có 16 bệnh nhân được điều trị xung corticosteroid liều cao do tình trạng lâm sàng nguy kịch, mặc dù họ không đáp ứng các tiêu chí về tình trạng viêm nhiễm cao này. 16 bệnh nhân này được điều trị xung corticosteroid liều cao vì họ bị suy hô hấp nặng và không đáp ứng với thực hành lâm sàng COVID-19 tiêu chuẩn tại thời điểm đó, bao gồm cả thuốc (hydroxychloroquine, azithromycin và lopinavir-ritonavir) và các can thiệp vật lý (tức là thay đổi tư thế). Liệu pháp corticosteroid liều thấp được định nghĩa là thấp hơn 1,5mg/kg/24h của methylprednisolone hoặc dexamethasone tương đương và nó được sử dụng cho những bệnh nhân đã bị co thắt phế quản, theo các hướng dẫn lâm sàng tiêu chuẩn.
Phân tích thống kê
Để kiểm tra mối liên quan giữa kết quả và nhân khẩu học và các biến lâm sàng khi nhập cảnh, các test t Student hoặc kiểm tra Fisher được thực hiện cho các biến và biến phân loại tương ứng (Bảng 1).
Để đánh giá hiệu quả điều trị, mô hình hồi quy cox đa biến phù hợp với toàn bộ thuần tập sử dụng các biến sau: tuổi, giới tính, tăng huyết áp, bệnh phổi tắc nghẽn mãn tính, hen suyễn, bệnh tim mãn tính, rung nhĩ, béo phì, khối u, thuốc ức chế men chuyển/ARB, bệnh nhân có đang dùng corticosteroid tại thời điểm nhập viện hay không, bệnh nhân có bị ức chế miễn dịch hay không, bệnh nhân có được cung cấp lượng oxy cao (> 10L) hay không, bệnh tiểu đường, qSOFA, hydroxychloroquine, Azithromycin, Lopinavir/ Ritonavir, interferon, corticosteroid liều thấp, HDCPT, Tozilizumab, bổ sung vitamin D và điều trị chống đông máu (ở liều trung gian, liều đầy đủ hoặc liều dự phòng). Sử dụng mô hình Cox đa biến này, các tỷ số nguy cơ (HR) và khoảng tin cậy (CI) 95% đã được tính toán.
Sự khác biệt về các dấu hiệu trong phòng thí nghiệm giữa những người sống sót và không sống sót trong tháng đầu tiên của bệnh được tính toán bằng cách phù hợp với xu hướng thời gian bằng cách sử dụng spline hồi quy. Sau đó, một F-test vừa phải về thông số tương tác thời gian: sống sót/không sống sót được thực hiện để đánh giá mức độ ý nghĩa giữa hai nhóm sử dụng hàm ns, lmFit và eBayes từ các gói R splines và limma [15]. Giá trị P được hiệu chỉnh cho nhiều lần thử nghiệm và tỷ lệ phát hiện sai, FDR được tính bằng cách sử dụng phương pháp Benjamini & Hochberg (R function p.adjust). Mức ý nghĩa được xem xét trong tất cả các phân tích là 0,05. Tất cả các phân tích thống kê được thực hiện bằng R (phiên bản 3.6.0).
|
|
Total (n = 318) |
Survivors (n = 271) |
Non-survivors (n = 47) |
P value |
|
Age |
64.9 (14.1) |
63.3 (13.6) |
73.9 (13.7) |
|
|
Sex |
|
|
|
|
|
Women |
132 (41.5%) |
112 (41.3%) |
20 (42.6%) |
0.874 |
|
Man |
186 (58.5%) |
159 (58.7%) |
27 (57.4%) |
0.874 |
|
Days with disease before hospitalization |
7.79 (5.48) |
8 (5.53) |
6.55 (5.04) |
0.078 |
|
qSOFA |
0.433 (0.83) |
0.331 (0.78) |
1.08 (0.859) |
|
|
Results chest x-ray |
|
|
|
|
|
Both lungs affected |
217 (68.2%) |
183 (67.5%) |
34 (72.3%) |
0.612 |
|
One lung affected |
59 (18.6%) |
49 (18.1%) |
10 (21.3%) |
0.684 |
|
None |
42 (13.2%) |
39 (14.4%) |
3 (6.38%) |
0.165 |
|
NIH Clinical Presentation |
|
|
|
|
|
Mild |
0 (0%) |
0 (0%) |
0 (0%) |
|
|
Moderate |
19 (6%) |
19 (6%) |
0 (0%) |
|
|
Severe & Critical |
299 (94%) |
252 (92,9%) |
47 (100%) |
|
|
Fever |
241 (76%) |
210 (77.5%) |
31 (67.4%) |
0.14 |
|
Dyspnoea |
164 (51.6%) |
136 (50.2%) |
28 (59.6%) |
0.27 |
|
Cough |
200 (63.3%) |
177 (65.6%) |
23 (50%) |
0.048 |
|
Asthenia |
158 (49.8%) |
130 (48.1%) |
28 (59.6%) |
0.158 |
|
Anosmia |
18 (5.66%) |
17 (6.27%) |
1 (2.13%) |
0.49 |
|
Ageusia |
22 (6.92%) |
20 (7.38%) |
2 (4.26%) |
0.754 |
|
Obesity |
48 (15.2%) |
40 (14.9%) |
8 (17%) |
0.664 |
|
Smoking |
|
|
|
|
|
Ex-smoker |
20 (6.29%) |
17 (6.27%) |
3 (6.38%) |
1 |
|
Yes |
39 (12.3%) |
30 (11.1%) |
9 (19.1%) |
0.146 |
|
COPD |
24 (7.55%) |
17 (6.27%) |
7 (14.9%) |
0.065 |
|
Asthma |
26 (8.18%) |
23 (8.49%) |
3 (6.38%) |
0.779 |
|
Hypertension |
164 (51.6%) |
141 (52%) |
23 (48.9%) |
0.753 |
|
Chronic Heart Disease |
28 (8.81%) |
22 (8.12%) |
6 (12.8%) |
0.275 |
|
Atrial fibrillation |
36 (11.3%) |
28 (10.3%) |
8 (17%) |
0.21 |
|
Immunosuppression |
13 (3.77%) |
8 (2.95%) |
4 (8.51%) |
0.084 |
|
Tumour |
35 (11%) |
26 (9.59%) |
9 (19.1%) |
0.073 |
|
ACE inhibitors/ARBs |
131 (41.2%) |
115 (42.4%) |
16 (34%) |
0.336 |
|
Pre-hospitalization corticosteroids* |
19 (5.97%) |
14 (5.17%) |
5 (10.6%) |
0.175 |
|
Diabetes |
75 (23.6%) |
61 (22.5%) |
14 (29.8%) |
0.27 |
|
Vitamin D Levels |
17.6 (33.7) |
18.1 (35.3) |
12.5 (10.9) |
0.173 |
|
SARS-CoV-2 PCR Positive |
244 (76.7%) |
204 (75.3%) |
40 (85.1%) |
0.19 |
|
SARS-CoV-2 Serology Positive |
43 (13.5%) |
40 (14.8%) |
3 (6.38%) |
0.165 |
Bảng 1 Nhân khẩu học bệnh nhân và đặc điểm lâm sàng.
Các biến số được trình bày dưới dạng giá trị trung bình (độ lệch chuẩn). Các biến phân loại được trình bày dưới dạng tổng số với tỷ lệ phần trăm. Các giá trị P được tính toán bằng phép thử t Student (biến số) hoặc phép thử chính xác của Fisher (biến phân loại). qSOFA (Đánh giá Thất bại Nội tạng Tuần tự nhanh chóng). Xem Phương pháp để có mô tả đầy đủ về tất cả các biến này. COPD (Bệnh phổi tắc nghẽn mãn tính). Thuốc ức chế men chuyển/ARB, thuốc ức chế men chuyển/thuốc chẹn thụ thể angiotensin.
* Corticosteroid trước khi nhập viện đề cập đến việc bệnh nhân có đang điều trị bất kỳ liệu pháp corticosteroid đường uống hoặc hít nào tại thời điểm nhập viện hay không.
Kết quả
Đặc điểm của nhóm thuần tập
Chúng tôi thu nhận tất cả bệnh nhân người lớn nhập viện Complejo Hospitalario de Jaén (Bệnh viện Jaén, Tây Ban Nha) từ ngày 4 tháng 2 năm 2020 đến ngày 30 tháng 4 năm 2020 có nghi ngờ cao về COVID-19, tổng cộng 318 bệnh nhân, như được nêu trong các phương pháp. Theo hướng dẫn của NIH [16], trong số 318 bệnh nhân được đưa vào nghiên cứu của chúng tôi, 20 bệnh nhân ở mức trung bình (6,3%). Các bệnh nhân còn lại đều nặng hoặc nguy kịch (n = 238, 93,4%). Thật không may, chúng tôi không thể phân biệt giữa bệnh nhân nặng và bệnh nhân nguy kịch, vì chúng tôi không có dữ liệu về suy hô hấp hoặc suy đa cơ quan, và không phải tất cả bệnh nhân nguy kịch đều được đưa vào chăm sóc đặc biệt do quá tải vào thời điểm cao điểm của đại dịch. Các bệnh nhân nhập viện trung bình 7,79 ngày sau lần đầu tiên xuất hiện các triệu chứng COVID-19. Tuổi trung bình là 64,9 (SD 14,1), dao động từ 19 đến 96 tuổi. 186 nam (58,5%) và 132 nữ (41,5%). Tất cả bệnh nhân đều là người gốc Tây Âu. Tăng huyết áp và đái tháo đường lần lượt xuất hiện ở 51,6% và 23,6% bệnh nhân. Các tình trạng bệnh đi kèm khác không thường xuyên (dưới 10%) và không cho thấy bất kỳ sự khác biệt có ý nghĩa thống kê nào giữa những người sống sót và không sống sót (Bảng 1). Như đã báo cáo trước đây [17, 18], nồng độ vitamin D khác biệt đáng kể giữa những người sống sót và không sống sót (p = 0,025). Không có liệu pháp nào trước khi nhập viện (tức là corticosteroid và thuốc ức chế men chuyển/ARB) cho thấy sự khác biệt có ý nghĩa thống kê giữa những người sống sót và không sống sót.
Kết cục nghiên cứu
Chúng tôi nhằm mục đích điều tra các yếu tố và biện pháp can thiệp nào có liên quan đến việc gia tăng tỷ lệ sống sót bằng cách phân tích hồi quy Cox đa biến. Trong số 318 bệnh nhân được đưa vào nghiên cứu, 47 người tử vong (14,8%). Bảng 2 cho thấy danh sách đầy đủ các can thiệp điều trị và nhu cầu oxy của bệnh nhân.
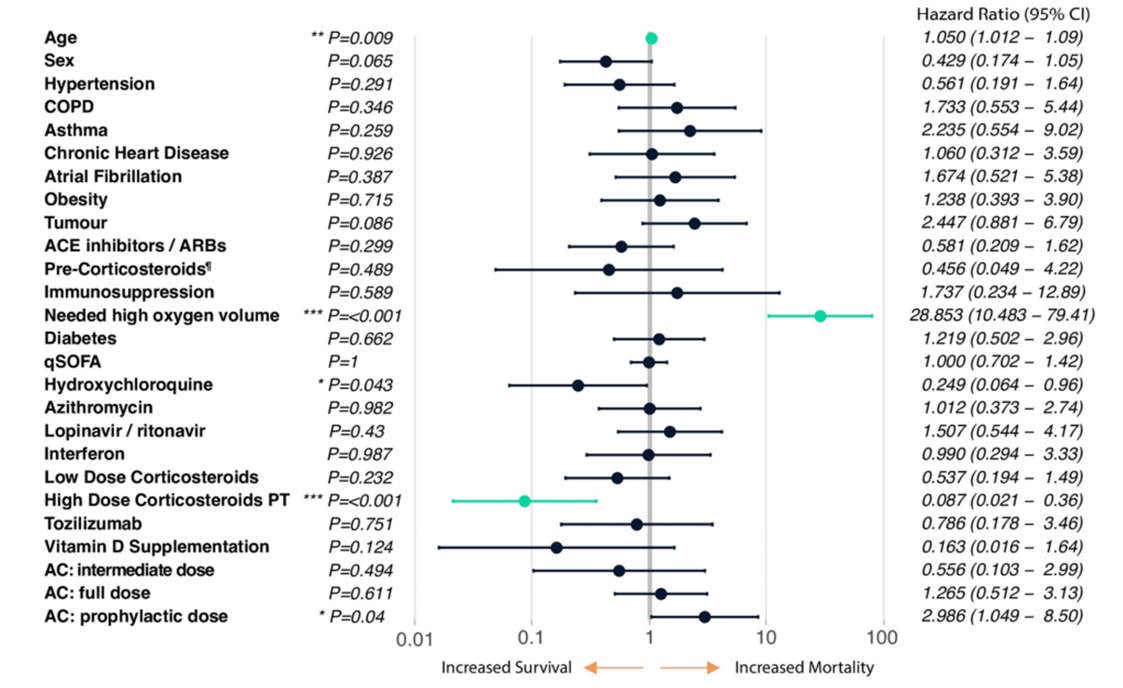
Hồi quy Cox đa biến kiểm soát các hiệp biến lâm sàng cũng như tất cả các phương pháp điều trị mà bệnh nhân nhận được (Hình 1, xem Phương pháp), cho thấy nguy cơ tử vong tăng có ý nghĩa thống kê theo tuổi (HR 1,05 [95% CI 1,01–1,09]; P = 0,009) và nhu cầu oxy lưu lượng cao (> 10L, HR 28,85 [95% CI 10,48–79,41]; P
Bảng 2 Các phương pháp điều trị được quản lý và nhu cầu điều trị.
|
|
Total (n = 318) |
Survivors (n = 271) |
Non-survivors (n = 47) |
P value |
|
Need for oxygen supplementation |
259 (81.4%) |
215 (79.3%) |
44 (93.6%) |
0.024 |
|
Needed high oxygen volume |
74 (23.9%) |
38 (14.4%) |
36 (78.3%) |
|
|
Mechanical Assisted Ventilation (non-invasive) |
|
|
|
|
|
CPAP |
3 (0.943%) |
2 (0.743%) |
1 (2.22%) |
0.372 |
|
High flux Oxygen |
27 (8.49%) |
18 (6.69%) |
9 (20%) |
0.007 |
|
Entered Intensive Care |
37 (11.8%) |
24 (8.96%) |
13 (28.3%) |
0.001 |
|
Mechanical Assisted Ventilation (invasive) |
25 (7.91%) |
12 (4.44%) |
13 (28.3%) |
|
|
Hydroxychloroquine |
297 (93.4%) |
257 (94.8%) |
40 (85.1%) |
0.022 |
|
Azithromycin |
281 (88.6%) |
244 (90.4%) |
37 (78.7%) |
0.042 |
|
Lopinavir/Ritonavir |
209 (65.7%) |
180 (66.4%) |
29 (61.7%) |
0.618 |
|
Interferon |
37 (11.7%) |
27 (10%) |
10 (21.3%) |
0.045 |
|
High Dose Corticosteroids PT |
64 (20.1%) |
60 (22.1%) |
4 (8.51%) |
0.031 |
|
Low Dose Corticosteroids |
68 (21.4%) |
57 (21%) |
11 (23.4%) |
0.702 |
|
Tozilizumab |
24 (7.59%) |
17 (6.32%) |
7 (14.9%) |
0.066 |
|
Immunoglobulins |
3 (0.943%) |
3 (1.11%) |
0 (0%) |
1 |
|
Anakinra |
2 (0.629%) |
2 (0.738%) |
0 (0%) |
1 |
|
Vitamin D Supplementation |
37 (11.6%) |
36 (13.3%) |
1 (2.13%) |
0.025 |
|
Anticoagulants: prophylactic dose |
233 (73.3%) |
200 (74.6%) |
33 (70.2%) |
0.589 |
|
Anticoagulants: intermediate dose |
24 (7.55%) |
22 (8.18%) |
2 (4.26%) |
0.551 |
|
Anticoagulants: full dose |
|
|
|
|
|
DOACs |
5 (1.57%) |
5 (1.86%) |
0 (0%) |
1 |
|
LMWH |
83 (26.1%) |
61 (22.7%) |
22 (46.8%) |
0.001 |
CPAP, continuous positive airway pressure. High Dose Corticosteroids PT, high dose corticosteroids pulse therapy. DOACs, direct-acting oral anticoagulants. LMWH, low-molecular-weight-heparin. Numerical variables are presented as mean (standard deviation). Categorical variables are presented as total number with percentages. P values were computed with a Student t-test (numerical variables) or Fisher’s exact test (categorical variables).
Hình 1 Phân tích hồi quy Cox đa biến, n = 318.
Pre-Corticosteroids¶ refers to whether the patient was under any oral or inhaled corticosteroid therapy upon entering the hospital. COPD (Chronic Obstructive Pulmonary Disease). ACE inhibitors / ARBs, angiotensinconverting enzyme inhibitors / angiotensin receptor blockers. qSOFA (quick Sequential Organ Failure Assessment). High Dose Corticosteroids PT, high-dose corticosteroids pulse therapy. AC, anticoagulation therapy. See Methods for a full description of all of these variables. Highlighted in green are the interventions with p-value
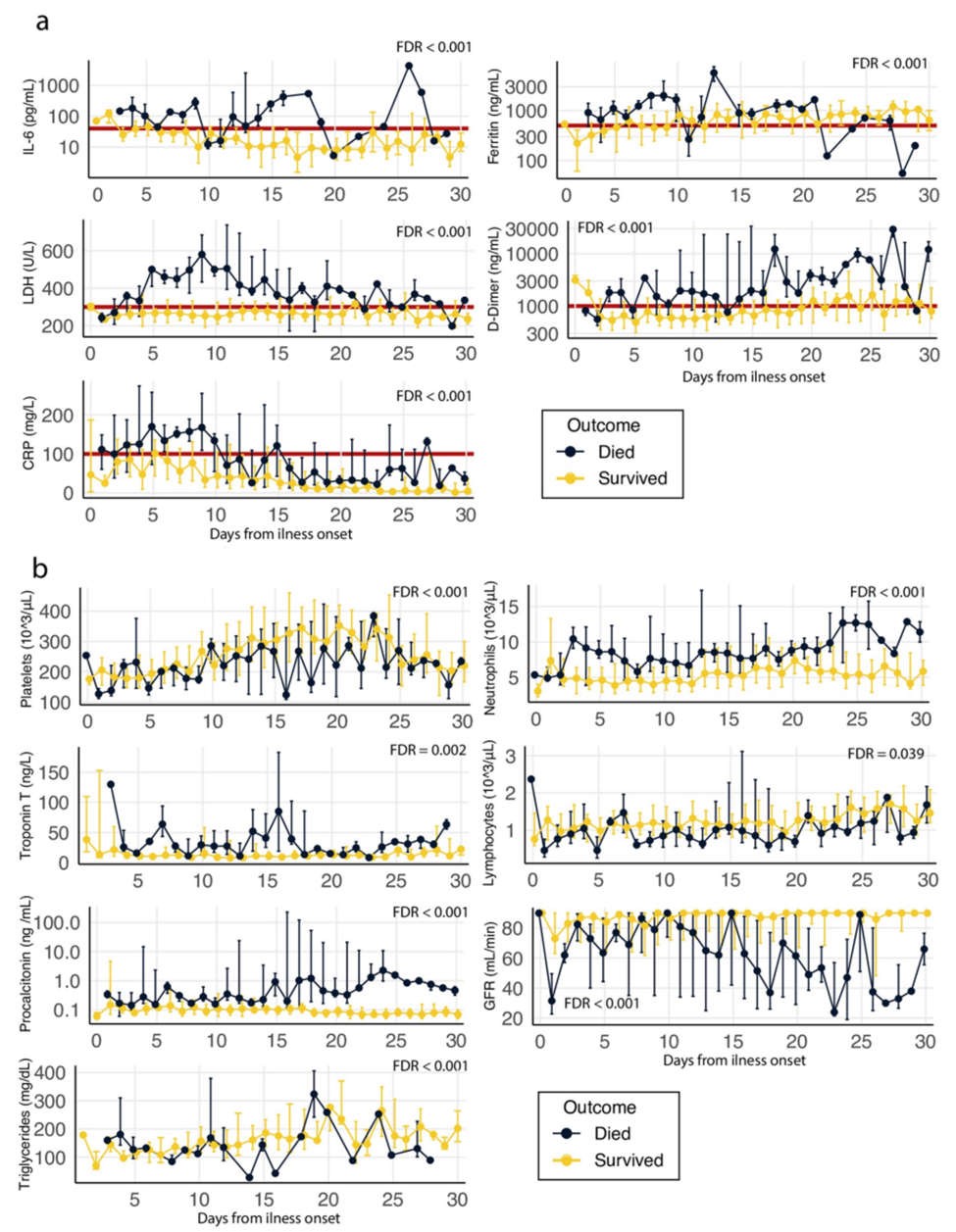
Phân tích diễn tiến lâm sàng của các điểm đánh dấu trong phòng thí nghiệm
Chúng tôi đã thực hiện phân tích quá trình thời gian của 45 dấu hiệu phòng thí nghiệm khác nhau trong tháng đầu tiên kể từ khi bệnh khởi phát để phân biệt giữa những người sống sót COVID-19 và những người không sống sót, n = 318 (xem Phương pháp và Bảng S1). Mức có ý nghĩa thống kê (FDR
Hình 2 Phân tích quá trình thời gian của những người sống sót/không sống sót tất cả các xét nghiệm trong phòng thí nghiệm được thực hiện trong tháng đầu tiên kể từ khi bệnh COVID-19 khởi phát.
Phạm vi trung vị và khoảng cách giữa các phần được trình bày trong mỗi mốc thời gian. Dữ liệu được hiển thị trong thang đo tuyến tính ngoại trừ trường hợp IL-6, ferritin, D-dimer và procalcitonin, được hiển thị trong thang đo Log10 (xem Bảng S1 để biết đơn vị đo lường của tất cả các điểm đánh dấu và các phân tích còn lại của khóa học thời gian). Tỷ lệ phát hiện sai (FDR) của các chênh lệch thời gian tổng thể được hiển thị cho từng điểm đánh dấu (xem kết quả của tất cả các thử nghiệm được thực hiện trong Bảng S1). a. Dấu hiệu viêm: IL-6, Ferritin, Lactate dehydrogenase (LDH), D-dimer và protein phản ứng C (CRP). Đánh dấu bằng đường màu đỏ là giới hạn gợi ý có thể được sử dụng để chọn bệnh nhân có nguy cơ phát triển phản ứng tăng viêm IL-6> = 40 pg/ml, protein phản ứng C> = 100 mg/L, D- dimer> = 1000 ng/ml, ferritin> = 500 ng/ml và lactate dehydrogenase> = 300 U/L). b. Các dấu hiệu lâm sàng khác có liên quan: tiểu cầu, tổng số bạch cầu trung tính, troponin T, tổng số tế bào lympho, procalcitonin, mức lọc cầu thận (GFR) và chất béo trung tính.
Bằng cách theo dõi phân tích theo thời gian này về các dấu hiệu chống viêm giữa những người sống sót và không sống sót, chúng tôi có thể đề xuất tiêu chí cụ thể COVID-19 ban đầu để chẩn đoán sự phát triển của đáp ứng tăng viêm COVID-19 như sau: bệnh nhân có IL-6> = 40 pg/ml và/hoặc hai trong số sau: Protein phản ứng C> = 100 mg/L, D-dimer> = 1000 ng/ml, ferritin> = 500 ng/ml và lactate dehydrogenase> = 300 U/L (Hình 2a, được đánh dấu bằng một đường màu đỏ).
Thảo luận
Trong nghiên cứu này, chúng tôi chỉ ra rằng ở những bệnh nhân bị nhiễm SARS-CoV-2, việc sử dụng xung corticosteroid có thể làm tăng khả năng sống sót. Một số nghiên cứu đã báo cáo rằng việc sử dụng corticosteroid có thể không có lợi trong các bệnh do coronavirus khác gây ra (như SARS-CoV-1 và MERS-CoV) [8, 10]. Ngược lại, ngay cả khi không có bằng chứng khoa học được công bố [19], các tác giả khác [20–23] đã khuyến cáo việc sử dụng chúng để ngăn chặn phản ứng tăng viêm sau giai đoạn tăng viêm được quan sát và những điểm tương đồng của nó với các giai đoạn viêm được quan sát thấy trong các bệnh khác như hội chứng thực bào hoặc hội chứng hoạt hóa đại thực bào [24]. Callejas và cộng sự [14] khuyến cáo sử dụng xung corticosteroid liều cao để giảm nhu cầu thông khí hỗ trợ và tử vong. Không có giá trị gì khi trong nghiên cứu này, chúng tôi định nghĩa xung corticosteroid liều cao là liều ít nhất 125 mg methylprednisolone hoặc dexamethasone tương đương. Các nghiên cứu trước đây ở bệnh nhân COVID-19 không tìm thấy sự khác biệt lâm sàng giữa liều methylprednisolone trên 125 mg [14, 25, 26]. Chúng tôi cũng thử nghiệm liều corticosteroid thấp và không tìm thấy sự khác biệt có ý nghĩa thống kê về kết quả. Tuy nhiên, chúng được dùng nhiều nhất là năm ngày, vì vậy không thể loại trừ rằng chúng có thể có hiệu quả với một đợt điều trị dài hơn.
Để xác định bệnh nhân nào có khả năng phát triển phản ứng tăng viêm, và do đó quyết định bệnh nhân nào nên được dùng HDCPT, chúng tôi chủ yếu tuân theo các tiêu chí được đề xuất trước đây từ các quan sát thực nghiệm và các hướng dẫn được sử dụng cho hội chứng hoạt hóa đại thực bào (IL-6> = 40 pg/ml, và/hoặc hai trong số sau: D-dimer> = 1000 ng/ml, ferritin> = 300 ng/ml và triglycerid> = 300 mg/dL) [14]. Tuy nhiên, mặc dù có những điểm tương đồng giữa phản ứng viêm được quan sát thấy trong bệnh này và COVID-19, phân tích theo thời gian của chúng tôi về các dấu hiệu tiền viêm giữa những người sống sót và không sống sót cho thấy một số khác biệt rõ rệt, từ đó chúng tôi có thể lấy các tiêu chí cụ thể để chẩn đoán sự phát triển của đáp ứng tăng viêm COVID-19. Tham khảo lại các tiêu chí được đề xuất bởi Callejas và cộng sự [14], chúng tôi sẽ giữ nguyên mức giới hạn đối với IL-6 (IL-6> = 40 pg/ml) và D-dimer (D-dimer> = 1000 ng/ml) và sẽ nâng giới hạn ferritin lên 500ng/ml, vì cả những người sống sót và không sống sót đều có mức ferritin trung bình trên 300ng/ml. Chúng tôi không quan sát thấy sự khác biệt rõ ràng có thể phân biệt giữa những người sống sót và không sống sót về mức chất béo trung tính, do đó, chúng tôi đã loại bỏ dấu hiệu này và thay vào đó, chúng tôi đề xuất bao gồm protein phản ứng C và lactate dehydrogenase làm dấu hiệu gián tiếp của tình trạng viêm ở> = 100 mg/L và> = 300 U/L tương ứng.
Các bệnh nhân trong nghiên cứu này cũng đang dùng các loại thuốc khác bao gồm thuốc chống viêm tozilizumab (được sử dụng ở 15 bệnh nhân có mức IL-6 cao hơn 40 pg/ml). Mặc dù chúng tôi đã quan sát thấy tỷ lệ sống sót là 73,1% ở những bệnh nhân dùng tozilizumab, nhưng kết quả chung không có ý nghĩa thống kê (có thể do cỡ mẫu thấp). Tuy nhiên, xu hướng tăng khả năng sống sót được quan sát là phù hợp với những gì được công bố bởi Lou et al [12] và Campins et al [27]. Trong nghiên cứu của mình, họ nhận thấy tỷ lệ sống sót của tozilizumab tăng lên ở những bệnh nhân được can thiệp sớm và dùng nhiều liều.
Vai trò của hydroxycholoquine trong COVID-19 vẫn còn tranh cãi. Trong nghiên cứu của mình, chúng tôi chỉ tìm thấy mối liên hệ biên giữa việc sử dụng hydroxycholoquine và sự gia tăng tỷ lệ sống sót. Mặc dù nghiên cứu này không được thiết kế để đánh giá vai trò của hydroxycholoquine đối với tỷ lệ sống sót, nhưng mối liên hệ biên này có thể phù hợp với những gì đã được báo cáo trong các nghiên cứu trước đó, trong đó họ phát hiện ra rằng hydroxychloroquine có hiệu quả trong việc ức chế SARS-CoV-2 in vitro [28]. Ngược lại, các thử nghiệm lâm sàng ngẫu nhiên như RECOVERY [29] và thử nghiệm được thực hiện bởi Cavalcanti và cộng sự [30] không tìm thấy sự gia tăng tỷ lệ sống sót ở bệnh nhân COVID-19. Tuy nhiên, nghiên cứu lâm sàng do Cavalcanti thực hiện chỉ xem xét những bệnh nhân COVID-19 nhẹ và/hoặc trung bình và nghiên cứu PHỤC HỒI không nghiên cứu những bệnh nhân nặng nhập viện. Cho đến nay, không có đủ bằng chứng cho thấy hydroxycholoquine có hiệu quả làm tăng thời gian sống sót của bệnh nhân COVID-19 và cần có thêm các nghiên cứu để phân tích tác dụng của hydroxycholoquine trong COVID-19. Liên quan đến các liệu pháp kháng vi-rút khác, mặc dù một số tác dụng có lợi tiềm năng đã được mô tả đối với azithromycin [31], lopinavir/ritonavir [32] và interferon [33], chúng tôi không tìm thấy bất kỳ sự gia tăng tỷ lệ sống sót nào có ý nghĩa thống kê với bất kỳ thuốc nào trong số này hoặc kết hợp của họ.
Đông máu trên diện rộng cũng đã được quan sát thấy trong COVID-19 [34–36], có thể bằng chứng là cần thiết phải điều trị bằng thuốc chống huyết khối ở tất cả những bệnh nhân có nồng độ D-dimer cao hoặc có dấu hiệu đông máu nội mạch lan tỏa ban đầu [37]. Tuy nhiên, đây vẫn còn là vấn đề tranh luận và các nghiên cứu gần đây cũng đã đặt câu hỏi về sự cần thiết của một liều kháng đông đầy đủ trừ khi có thêm bằng chứng lâm sàng hỗ trợ cho nhu cầu này. Trong nghiên cứu của chúng tôi, mặc dù chúng tôi tìm thấy mối liên quan có ý nghĩa thống kê giữa kháng đông dự phòng và tỷ lệ tử vong, nhưng các phân tích của chúng tôi không được thiết kế để đặt câu hỏi này mà thay vào đó xem xét các biện pháp can thiệp ảnh hưởng đến tình trạng viêm tổng thể liên quan đến tử vong. Do đó, chúng tôi không kết luận rằng liều dự phòng làm tăng nguy cơ tử vong. Để trả lời câu hỏi này, chúng tôi sẽ phải phân tầng cụ thể các bệnh nhân dựa trên mức D-dimer. Các nghiên cứu sâu hơn nên đánh giá các loại kháng đông khác nhau và mối liên quan của chúng với kết quả bệnh.
Các nghiên cứu khác cho thấy liệu pháp corticosteroid không ảnh hưởng đến thời gian thanh thải của virus [38]. Thật không may, trong nghiên cứu của chúng tôi, chúng tôi đã không thực hiện theo dõi định lượng độ thanh thải của virus. Sẽ rất thú vị nếu đánh giá liệu HDCPT có tác động đến thời gian loại bỏ virus hay không và chúng tôi hy vọng rằng các nghiên cứu trong tương lai có thể làm sáng tỏ chủ đề này.
Nghiên cứu này có một số hạn chế lớn bao gồm tất cả các bệnh nhân đến từ một trung tâm và một nhóm dân tộc duy nhất. Hơn nữa, mặc dù chúng tôi đã thực hiện các phân tích đa biến để tính đến bất kỳ tác động gây nhiễu nào có thể xảy ra, nhưng sự mất cân bằng khác nhau có thể tồn tại giữa các nhóm bệnh nhân. Nghiên cứu này không phải là một thử nghiệm lâm sàng ngẫu nhiên và do đó không thể suy ra quan hệ nhân quả. Tuy nhiên, có một hiệu quả đầy hứa hẹn đối với liệu pháp xung corticosteroid liều cao trong việc cải thiện sự tiến triển của bệnh COVID-19 nặng/nguy kịch và tăng tỷ lệ sống sót của những bệnh nhân có nguy cơ phát triển phản ứng tăng viêm. Chúng tôi cũng đề xuất một số tiêu chí ban đầu sử dụng các dấu hiệu tiền viêm để chẩn đoán những bệnh nhân này. Các thử nghiệm lâm sàng ngẫu nhiên đa trung tâm trong tương lai nên được thực hiện để xác nhận hiệu quả của liệu pháp xung corticosteroid xung cao để tăng tỷ lệ sống sót của COVID-19.
References
The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19)—China, 2020[J]. China CDC Weekly, 2020, 2(8): 113– 122. 10.46234/ccdcw2020.032 [CrossRef] [Google Scholar]
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020. February 15;395(10223):497–506. 10.1016/S0140-6736(20)30183-5 Epub 2020 Jan 24. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Bhatraju PK, Ghassemieh BJ, Nichols M, Kim R, Jerome KR, Nalla AK. Covid-19 in Critically Ill Patients in the Seattle Region—Case Series. N Engl J Med. 2020. March 30 10.1056/NEJMoa2004500 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Siddiqi Hasan K. MD, MSCR, Mehra Mandeep R. MD, MSc, COVID-19 Illness in Native and Immunosuppressed States: A Clinical-Therapeutic Staging Proposal, Journal of Heart and Lung Transplantation (2020), 10.1016/j.healun.2020.03.012 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033–34. 10.1016/S0140-6736(20)30628-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
McGonagle D, Sharif K, O’Regan A, Bridgewood C. Interleukin-6 use in COVID-19 pneumonia related macrophage activation syndrome. Autoimmun Rev. 2020:102537. [PMC free article] [PubMed] [Google Scholar]
Henderson LA, Canna SW, Schulert GS, et al. On the Alert for Cytokine Storm: Immunopathology in COVID-19. Arthritis Rheumatol. 2020;72(7):1059–1063. 10.1002/art.41285 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Zhang W, Zhao Y, Zhang F, Wang Q, Li T, Liu Z, et al. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The perspectives of clinical immunologists from China. Clin Immunol. 2020;214:108393 10.1016/j.clim.2020.108393 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. Lancet 2020; 395: 473–5. 10.1016/S0140-6736(20)30317-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical characteristics of 138 hospitalized patients with 2019 Novel Coronavirus–Infected pneumonia in Wuhan, China. JAMA. 2020;323(11):1061–9. 10.1001/jama.2020.1585 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Zhang W, Zhao Y, Zhang F, Wang Q, Li T, Liu Z, et al. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The perspectives of clinical immunologists from China. Clin Immunol. 2020;214:108393 10.1016/j.clim.2020.108393 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Luo P, Liu Y, Qiu L, Liu X, Liu D, Li J. Tocilizumab treatment in COVID-19: A single center experience. J Med Virol. 2020;92(7):814–818. 10.1002/jmv.25801 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Singer M., Deutschman C. S., Seymour C. W., Shankar-Hari M., Annane D., Bauer M. et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–810. 10.1001/jama.2016.0287 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Callejas Rubio JL, D Luna del Castillo J, de la Hera Fernández Javier, Guirao Arrabal E, Colmenero Ruiz M Ortego Centeno N, Eficacia de los pulsos de corticoides en los pacientes con síndrome de liberación de citoquinas inducido por infección por SARS-CoV-2 Med Clin (Barc). 2020. May 27 In press. 10.1016/j.medcli.2020.04.018 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ritchie M.E., Phipson B., Wu D., Hu Y., Law C.W., Shi W., and Smyth G.K. (2015). limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Research 43(7), e47 10.1093/nar/gkv007 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
NIH. October 9, 2020. Clinical Presentation of People with SARS-CoV-2 Infection. https://www.covid19treatmentguidelines.nih.gov/overview/clinical-presentation/ [Consulted 2020-11-07]
Weir EK, Thenappan T, Bhargava M, Chen Y. Does vitamin D deficiency increase the severity of COVID-19? [published online ahead of print, 2020 Jun 5]. Clin Med (Lond). 2020;clinmed.2020-0301. 10.7861/clinmed.2020-0301 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Martín Giménez VM, Inserra F, Tajer CD, et al. Lungs as target of COVID-19 infection: Protective common molecular mechanisms of vitamin D and melatonin as a new potential synergistic treatment [published online ahead of print, 2020 May 15]. Life Sci. 2020;254:117808 10.1016/j.lfs.2020.117808 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Alunno A, Carubbi F, Rodríguez-Carrio J. Storm, typhoon, cyclone or hurricane in patients with COVID-19? Beware of the same storm that has a different origin. RMD Open 2020;6:e001295 10.1136/rmdopen-2020-001295 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020. February 15;395(10223):507–513. 10.1016/S0140-6736(20)30211-7 Epub 2020 Jan 30. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk factors associated with acute respiratory distress ayndrome and death in patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. Intern Med. 2020. 10.1001/jamainternmed.2020.0994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Yang SS, Lipes J. Corticosteroids for critically ill COVID-19 patients with cytokine release syndrome: a limited case series [published online ahead of print, 2020 May 11]. Can J Anaesth. 2020;1–3. 10.1007/s12630-020-01700-w [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Fadel R, Morrison AR, Vahia A, et al. Early Short Course Corticosteroids in Hospitalized Patients with COVID-19 [published online ahead of print, 2020 May 19]. Clin Infect Dis. 2020;ciaa601. 10.1093/cid/ciaa601 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Lerkvaleekul B, Vilaiyuk S. Macrophage activation syndrome: early diagnosis is key. Open Access Rheumatol 2018;10:117–28. 10.2147/OARRR.S151013 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ruiz-Irastorza G, Pijoan JI, Bereciartua E, Dunder S, Dominguez J, Garcia-Escudero P, et al.; Cruces COVID Study Group. Second week methyl-prednisolone pulses improve prognosis in patients with severe coronavirus disease 2019 pneumonia: An observational comparative study using routine care data. PLoS One. 2020. September 22;15(9):e0239401 10.1371/journal.pone.0239401 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Liu F, Ji C, Luo J, Wu W, Zhang J, Zhong Z, et al. Clinical characteristics and corticosteroids application of different clinical types in patients with corona virus disease 2019. Sci Rep. 2020;10(1):13689 Published 2020 Aug 13.
10.1038/s41598-020-70387-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Campins L, Boixeda R, Perez-Cordon L, Aranega R, Lopera C, Force L. Early tocilizumab treatment could improve survival among COVID-19 patients. Clin Exp Rheumatol. 2020;38(3):578 [PubMed] [Google Scholar]
Yao X, Ye F, Zhang M, Cheng Cui, Baoying Huang, Peihua Niu et al. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) [published online ahead of print, 2020 Mar 9]. Clin Infect Dis. 2020;ciaa237. [PMC free article] [PubMed] [Google Scholar]
RECOVERY Collaborative Group, Horby P, Mafham M, et al. Effect of Hydroxychloroquine in Hospitalized Patients with Covid-19 [published online ahead of print, 2020 Oct 8]. N Engl J Med. 2020;NEJMoa2022926. 10.1056/NEJMoa2022926 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Cavalcanti AB, Zampieri FG, Rosa RG, et al. Hydroxychloroquine with or with- out azithromycin in mild-to-moderate Covid-19. N Engl J Med. [Google Scholar]
Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial [published online ahead of print, 2020 Mar 20]. Int J Antimicrob Agents. 2020;105949. 10.1016/j.ijantimicag.2020.105949 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Yao TT, Qian JD, Zhu WY, Wang Y, Wang GQ. A systematic review of lopinavir therapy for SARS coronavirus and MERS coronavirus-A possible reference for coronavirus disease-19 treatment option [published online ahead of print, 2020 Feb 27]. J Med Virol. 2020;92(6):556–563. 10.1002/jmv.25729 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Dastan F, Nadji SA, Saffaei A, Marjani M, Moniri A, Jamaati H, et al. Subcutaneous administration of interferon beta1a for COVID-19: A non-controlled prospective trial [published online ahead of print, 2020 Jun 7]. Int Immunopharmacol. 2020;85:106688 10.1016/j.intimp.2020.106688 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507–513. 10.1016/S0140- 6736(20)30211-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844–847. 10.1111/jth.14768 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720. 10.1056/NEJMoa2002032 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18(5):1094–1099. 10.1111/jth.14817 [PubMed] [CrossRef] [Google Scholar]
Liu F., Ji C., Luo J, Wu W, Zhang J, Zhong Z. et al. Clinical characteristics and corticosteroids application of different clinical types in patients with corona virus disease 2019. Sci Rep 10, 13689 (2020). 10.1038/s41598-020-70387-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]