Dịch và tóm tắt: BS Đặng Thanh Tuấn (BV Nhi Đồng 1)
Giới thiệu
Chúng tôi là một nhóm chuyên gia quốc tế và dựa trên những gì đã được công bố bởi người Trung Quốc, Ý và Tây Ban Nha, chúng tôi tin rằng cần phải phát triển một tiêu chí hành động thống nhất để tối ưu hóa các nguồn lực và áp dụng các liệu pháp hiệu quả nhất cho bệnh nhân mắc COVID -19.
Ở nhiều bệnh nhân, loại suy hô hấp do thiếu oxy do COVID-19 có thể khác với các dạng Hội chứng suy hô hấp cấp tính (ARDS) cổ điển hơn (1). Mặc dù nhiều bệnh nhân bị giảm đáng kể thể tích phổi cuối thì thở ra, độ giãn nở thường được bảo tồn tương đối với mức độ cao của khoảng chết phế nang, cho thấy có thể thay đổi phản xạ co mạch phổi do thiếu oxy (HPV) (2), hoặc các cơ chế khác chưa được tìm thấy.
Liên quan đến vấn đề trên, chúng tôi khuyến cáo rằng ở những bệnh nhân bị suy hô hấp liên quan đến COVID-19:
Mức độ suy giảm oxy
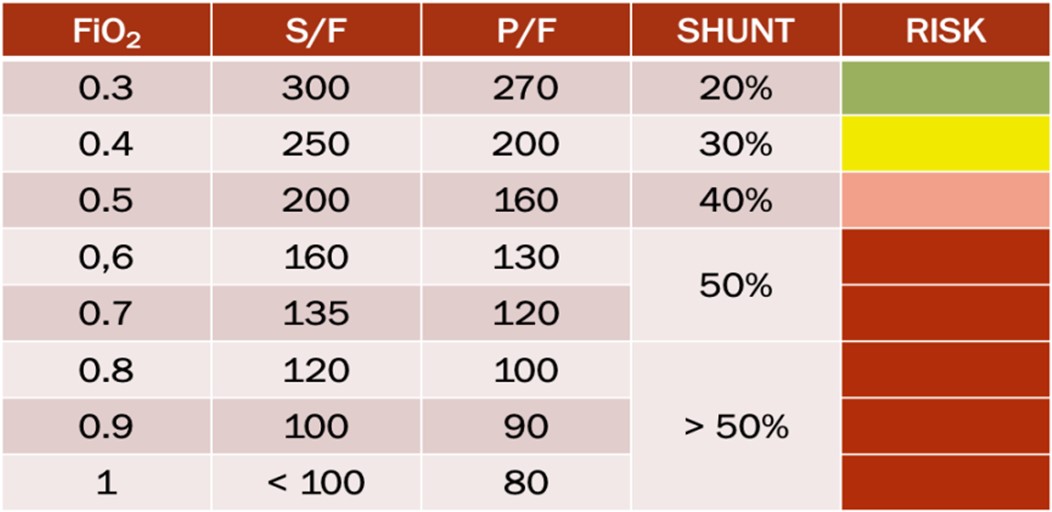
Nên được đo thường xuyên bằng cách sử dụng tỷ lệ độ bão hòa oxy/ nồng độ oxy khí hít vào (SpO2/FiO2) (3-5). S/F được khuyến nghị để đánh giá sự tiến triển của bệnh nhân và đây là biện pháp không xâm lấn, có thể áp dụng cho tất cả bệnh nhân. Do số lượng lớn bệnh nhân được điều trị, S/F sẽ rất hữu ích vì nó không xâm lấn. Tỷ lệ PaO2/FiO2 (P/F) là tiêu chuẩn vàng (3,6) để đo mức độ suy giảm oxy nhưng nó có thể được dành riêng cho những bệnh nhân mắc bệnh nặng hơn, mất ổn định huyết động (cần theo dõi huyết áp xâm lấn) hoặc để xác nhận S/F. Điều quan trọng là hướng dẫn nhân viên y tế trong việc đo S/F thích hợp, bao gồm chuẩn độ FiO2 để đạt được độ bão hòa trong khoảng 88 – 97%.
[Hình 1: Chuẩn độ FiO2 để SpO2 đạt 95% tương ứng PaO2 = 89%]
Ở bệnh nhân nhi Chỉ số oxy (OI, Oxygen Index) và Chỉ số bão hòa oxy (OSI, Oxygen Saturation Index) có thể được sử dụng để hướng dẫn phương pháp điều trị. (7)
Liệu pháp oxy lưu lượng cao (hfnc).
Liệu pháp oxy lưu lượng cao (HFNC) có thể được xem xét cho những bệnh nhân không bị thiếu oxy nặng, đặc biệt nếu khả năng cung ứng máy thở bị hạn chế. Tuy nhiên, HFNC có thể làm tăng nguy cơ cho quá trình tạo khí dung virus. Đáp ứng với HFNC phải được đánh giá trong vòng 30 – 60 phút kể từ khi bắt đầu và những bệnh nhân không cải thiện đáng kể không nên duy trì trên HFNC. Điều quan trọng cần nhớ là HFNC không tạo ra sự huy động phổi đáng kể. (8-10) Nếu một bệnh nhân mắc bệnh HFNC duy trì tình trạng thiếu oxy trung bình nặng (S/F 0,4 cho SpO2 > 92 %) leo thang đến một hình thức hỗ trợ hô hấp khác (NIV hoặc đặt nội khí quản) nên được xem xét mạnh mẽ, tùy thuộc vào nguồn lực sẵn có.
Liệu pháp oxy với mặt nạ + túi dự trữ. Do đặc điểm của bệnh lý đặc biệt này, loại thiết bị này không nên được sử dụng vì nó không tạo ra sự huy động của phổi. Hơn nữa, sử dụng oxy 100% sẽ gây ra sự gia tăng PaO2 và SpO2 mà không cải thiện tỷ lệ P/F (do shunt trong phổi, không huy động phổi), điều này có thể dẫn đến sự chậm trễ trong việc điều trị một liệu pháp huy động đầy đủ. Do đó, nó không thể là một sự thay thế cho CPAP.
Cpap/blpap (bl = bi level) sớm.
Nên xem xét nếu bệnh nhân có nhu cầu oxy đáng kể (cần FiO2 cao) hoặc công thở cao. Đáp ứng với CPAP/BLPAP phải được đánh giá trong vòng 30 phút kể từ khi bắt đầu và những người không cải thiện đáng kể nên được đặt nội khí quản. Nếu bệnh nhân sử dụng NIV bị thiếu oxy trung bình/nặng (S/F 0,4), nên đặt nội khí quản mạnh, tùy thuộc vào nguồn lực sẵn có. Mũ bảo hiểm (helmet) (11) được khuyến nghị là giao diện dòng đầu tiên được sử dụng, nếu có sẵn.
Trong trường hợp không có mũ bảo hiểm, lựa chọn tốt thứ hai sẽ là mặt nạ toàn mặt, mặc dù các biện pháp tự bảo vệ phải được sử dụng vì sự gia tăng của khí dung.
Tổng hợp.
Nếu có sẵn tài nguyên, bệnh nhân nên được đặt nội khí quản nếu họ duy trì P/F hoặc S/F ≤ 200 (FiO2 > 0,4) sau khi bắt đầu điều trị không xâm lấn. Nếu bệnh nhân được điều trị bằng NIV hoặc HFNC và có nhịp thở cao (WOB tăng) ngay cả khi P/F hoặc S/F > 200 (FiO2 92%), họ nên được đặt nội khí quản. Một dấu hiệu thay thế có thể được sử dụng để hướng dẫn về công hô hấp là chỉ số ROX [(S/F)/RR] (12). Nếu bệnh nhân có chỉ số ROX ≤ 5, nên đặt nội khí quản. X-quang phổi hoặc siêu âm phổi hoặc CT ngực nên được thực hiện để đánh giá các hình ảnh hình kính mờ và sự phân bố của các hình kính mờ phổi. Độ giãn nở tĩnh phổi (static compliance) (13) cũng nên được đánh giá sau khi đặt nội khí quản, ở bệnh nhân không có thở tự nhiên (lưu lượng bằng không).
Cài đặt ban đầu.
Thông khí bảo vệ. Vì nhiều bệnh nhân trong số này có C bình thường hoặc cao, nên được khuyến cáo (14):
a.Thuốc an thần tiêu chuẩn (được kiểm soát bởi SAS/RASS) + Thuốc ức chế thần kinh cơ. Ức chế thần kinh cơ liên tục nên được xem xét trong 24 – 48 giờ đầu sau khi đặt nội khí quản. (15)
b.PEEP ban đầu: 10 cmH2O. (16-17)
c.VT: 6 ml/kg IBW. (18-19)
d.Áp lực đẩy (driving pressure):
e.Áp lực cao nguyên (Pplat):
f.FiO2 để bão hòa oxy đạt được từ 88-97%
Không cải thiện.
Nếu tỷ lệ PF vẫn
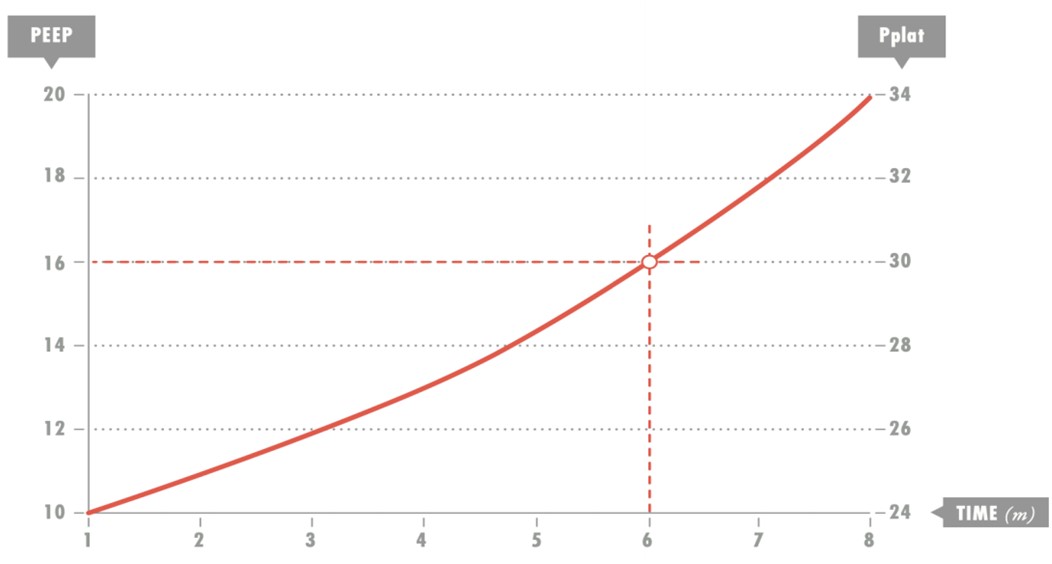
A.Nếu P/F trong khoảng 151 – 200 hoặc S/F 176 – 200 (FiO2 0,4 – 0,5), thực hiện chuẩn độ nhanh PEEP (24-27) [Hình 2]:
a.PEEP ban đầu: 10 cmH2O. (28)
b.Tăng PEEP 2 cmH2O, cứ sau 2 phút. Đo áp lực cao nguyên và theo dõi đáp ứng oxy hóa (tỷ lệ S/F)
c.Đặt PEEP cao nhất duy trì hoặc cải thiện tỷ lệ S/F và cho phép Pplat ≤ 30 cmH2O.
Hình 2: Chiến lược sử dụng PEEP cao của ExPress
B.Nếu P/F ≤ 150 hoặc S/F 175 (FiO2 > 0,5). Các lựa chọn điều trị sau đây sẽ được khuyến nghị:
a.TƯ THẾ NẰM SẤP. (29-32) Nên được coi là phương thức điều trị đầu tiên nếu có sẵn các nguồn lực trong ICU. Bằng chứng cho thấy nó hữu ích nhất cho bệnh nhân với P/F ≤ 150, và không được khuyến nghị nếu P/F ở mức cao hơn. Phương pháp đề xuất (2 tùy chọn):
Đặt ở tư thế nằm sấp và đánh giá đáp ứng: Nếu cải thiện tỷ lệ PF/SF khi đặt nằm sấp, hãy duy trì ở tư thế nằm sấp trong ít nhất 16 giờ/ngày và cho đến khi tỷ lệ P/F hoặc S/F > 200 trong ít nhất 4 giờ. Xoay nằm ngửa. Nếu bệnh nhân có thể duy trì P/F > 150 hoặc S/F > 175 trong ít nhất 4 giờ vẫn nằm ngửa. Nếu không thì nằm sấp trở lại trong ít nhất 16 giờ và đánh giá lại.
Nếu tài nguyên có sẵn, xoay vòng giữa tư thế nằm sấp và nằm ngửa nên được xem xét theo các khuyến nghị ở trên, với thời gian nằm sấp dao động từ 16-20 giờ một ngày.
b.THỦ THUẬT HUY ĐỘNG. (33-36) Có thể được xem xét trước khi thông khí nằm sấp hạn chế nếu nguồn lực bị hạn chế. Nó cũng có thể được xem xét cho những bệnh nhân đang nằm sấp nhưng vẫn có P/F
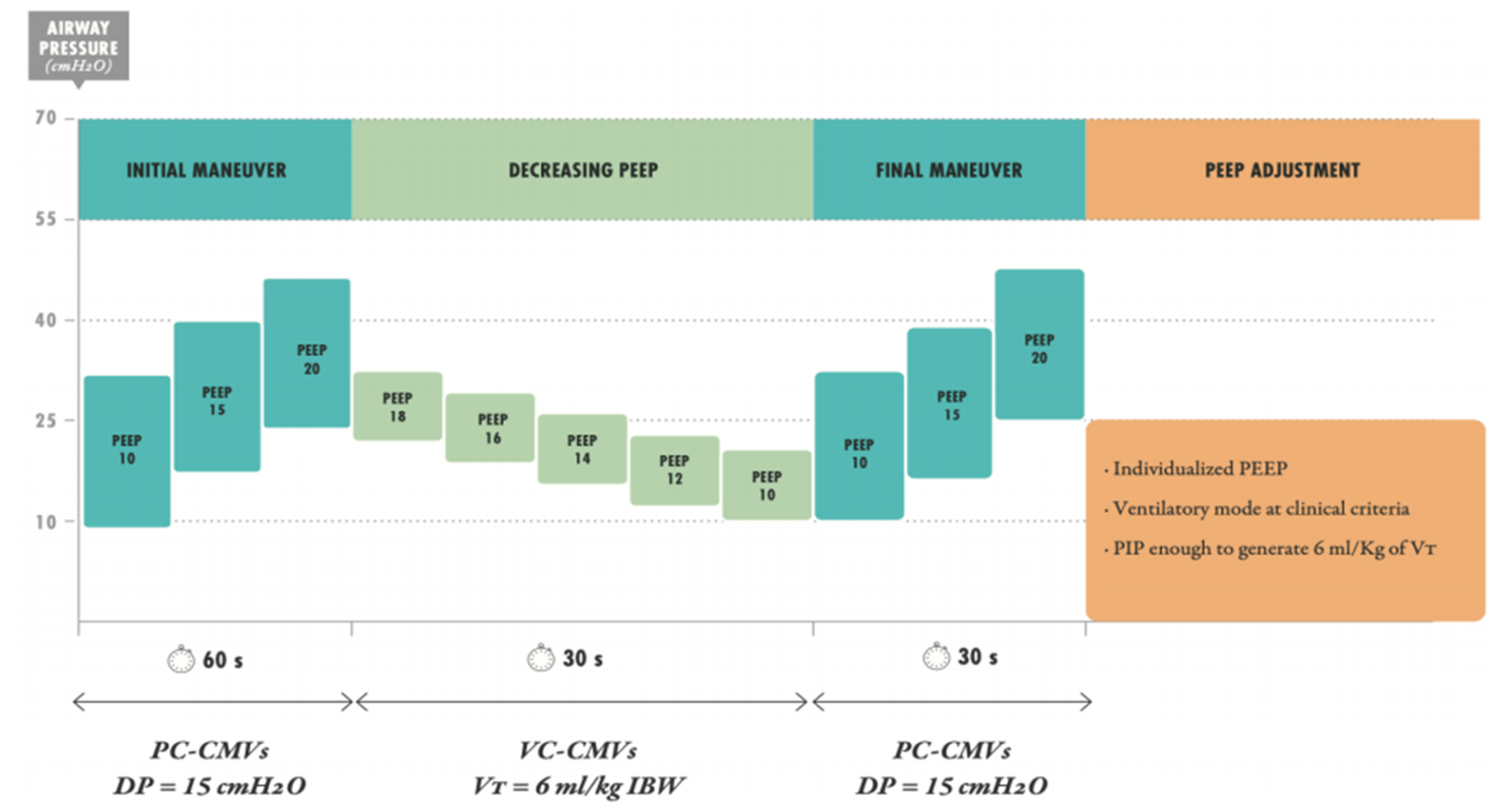
Chúng tôi khuyên bạn nên tăng PEEP ban đầu 10, sau đó 15 và cuối cùng lên tới 20 cmH2O trong tổng cộng 60 giây, ở chế độ PCV. Sau đó chuẩn độ PEEP giảm dần theo Áp lực đẩy thấp nhất. Một tùy chọn sẽ là theo thuật toán Amato đã sửa đổi [Hình 3].
Hình 3: Chuẩn độ PEEP theo phương pháp giảm dần theo giao thức của GS. Amato (có điều chỉnh)
Các phương pháp huy động khác nhau có thể được thử theo thông lệ địa phương thông thường, nhưng không có phương pháp duy nhất nào có thể được đề xuất dựa trên bằng chứng hiện tại. An toàn của bệnh nhân phải được đảm bảo trong bất kỳ RM (33). RM nên được sử dụng hết sức thận trọng ở những bệnh nhân mắc bệnh tim hoặc mất ổn định huyết động.
Nếu thiếu oxy là kháng trị (P/F
ARDS với ưu thế do ảnh hưởng của co thắt mạch máu phổi do thiếu oxy (HPV, hypoxic pulmonary vasoconstriction) (37,38). Khả năng này nên được xem xét ở một bệnh nhân có ít thâm nhiễm phế nang (“Black X-ray”) và đáp ứng kém với các kỹ thuật huy động (tăng PEEP, nằm sấp và thủ thuật huy động phế nang). Trong trường hợp này, nên cân nhắc sử dụng iNO + thuốc co mạch hệ thống (39-40), đặc biệt nếu có dấu hiệu tăng áp phổi trên siêu âm.
X-quang ngực thường không tiết lộ mức độ của vấn đề. Trong nhiều trường hợp, X quang ngực tương đối bình thường, nhưng CT rất thay đổi. Siêu âm phổi được khuyến cáo để chẩn đoán và hướng dẫn phương pháp điều trị. (41)
Việc sử dụng ECMO như một chiến lược điều trị ban đầu không được khuyến nghị; điều này nên được để lại cho đánh giá của nhân viên y tế trong từng trường hợp.
ARDS cổ điển. X-quang ngực với mô hình thâm nhiễm phế nang hai bên rõ ràng và độ giãn nở tĩnh thấp (42-43) Cần xem xét chiến lược PEEP cao hơn và thể tích khí lưu thông thấp hơn:
PEEP = 12 – 24 cmH2O. (44)
VT = 4 – 6 ml/kg IBW.
Áp lực đẩy:
Pplat:
Theo dự đoán, bệnh nhân đáp ứng với sự gia tăng PEEP có thể được coi là những người có mức tăng > 25 điểm trong P/F. Nếu sự cải thiện tỷ lệ P/F này không được quan sát thấy sau khi tăng mức PEEP, thì nên duy trì mức PEEP trước đó. (45)
Authors:
Aurio Fajardo C; MD. Medicina Interna. Unidad de Paciente Crítico. MsC en Ventilación Mecánica, Universitat de València. MsC en Medicina Intensiva. Grupo Ventilación Mecánica Chile – Drive Flow Org. Viña del Mar. Chile.
Alberto Medina V; PhD. MD. UCIP. Hospital Universitario Central de Asturias. Oviedo. España
Angelo Roncalli; PT. MsC. Hospital Escola Helvio Auto Maceió. Brasil
Enrique Monares Zepeda; Médico Intensivista. Ciudad de México.
Federico Gordo-Vidal; MD. Hospital Universitario del Henares. Coslada-Madrid. Grupo de Investigación en Patología Crítica. Francisco de Vitoria, Madrid. España.
Vicent Modesto A; MD. Jefe Clínico UCIP Hospital Universitari I Politècnic La Fe. València, España.
Rodrigo Adasme J; MsC, Pt, CRT. Terapia Respiratoria Hospital Clínico Red de Salud UCChristus. UNAB. Santiago, Chile.
Reviewers:
DR. ROBINDER KHEMANI, MD, MsCI. Children´s Hospital Los Angeles, University of Southern California; United States Of America
DR. DANIELE DE LUCA, Service de Pédiatrie et Rénimation Néonatale, Hospital Antoine Béclère. Paris, France
DR. MARTÍ PONS, Pediatric Intensive Care and Intermediate Care Department, Sant Joan de Déu University Hospital, Universitat de Barcelona, Esplungues de Llobregat, Spain. Critical Care Research Group, Institut de Recerca San Joan de Déu, Santa Rosa 39-57, 08950 Esplungues de Llobregat, Spain.
DRA. MIREIA GARCIA CUSCÓ MD, FRCPCH, FFICM. PICU. Bristol Royal Hospital for Children. UK
DR. GUILLERMO CHIAPPERO RICARDO, Especialista en Terapia Intensiva, Neumología y Medicina Interna. Director del Departamento de Docencia, Sociedad Argentina de Terapia Intensiva (SATI) Jefe de la Unidad de Ventilación Prolongada. Clínica AlterGarten. Buenos Aires. Editor Libro SATI: ¨Ventilación Mecánica¨
DR. MARTIN C.J KNEYBER MD. PhD. FCCM, Chief, Division of Critical Care Medicine. Chair Scientific Affairs, European Society for Paediatric and Neonatal Intensive Care Departament of Paedriatics, division of Paediatric Critical Care Medicine. Beatrix Children´s Hospital. University Medical Center, Groningen. Holland
DR. RAUL CARRILLO SPEARE Academia Nacional de Medicina. Director de Areas Críticas Instituto Nacional de Rehabilitación. México
DR. VINKO TOMICIC FLORES, MD. Medicina Interna – Terapia Intensiva. Jefe Técnico Unidad De Cuidados Intensivos Hospital Regional de Antofagasta. Chile.
WILLIAM CRISTANCHO GÓMEZ, Fisioterapeuta Universidad Nacional de Colombia. Especialista en Docencia Universitaria Universidad El Bosque, Bogotá, Colombia
T.R.C JUAN CARLOS PÉREZ Instituto Mexicano del Seguro Social. Fundador Asociación Federal de Terapeutas Respiratorios A.C (AFTR) Presidente Federación Latinoamericana de Terapia Respiratoria (FELATERE). TRC The Latin American Board for Professional Certification in Respiratory Therapy
DR. KEVIN K. CHUNG, MD, FCCM, FACP, COL, MC, USA Profesor of Medicine and Surgery Chair, Department of Medicine (MED). F. Edward Hebert School of Medicine- ¨America´s Medical School¨ Uniformed Services University. Bethesda, Maryland
DRA. YOLANDA M. LOPEZ FERNANDEZ MD. UCIP. Cruces University Hospital, Bar-akaldo, Spain.
DRA. CRISTINA CAMILO MD, Pediatric Intensive Care Unit, Department of Pediatrics, Hospital Santa Maria (CHLN) Lisbon Academic Medical Center, Lisbon, Portugal.
References.
Gattinoni L. Preliminary Observations on the Respiratory Behavior. 2020;02(March):0–4.
Ryan D, Frohlich S, McLoughlin P. Pulmonary vascular dysfunction in ARDS. Ann Intensive Care. 2014;4(1):1–11.
Bilan N, Dastranji A, Ghalehgolab Behbahani A. Comparison of the Spo 2 /Fio 2 Ratio and the Pao 2 /Fio 2 Ratio in Patients With Acute Lung Injury or Acute Respiratory Distress Syndrome . J Cardiovasc Thorac Res. 2015;7(1):28–31.
Khemani RG, Thomas NJ, Venkatachalam V, Scimeme JP, Berutti T, Schneider JB, et al. Comparison of SpO 2 to PaO 2 based markers of lung disease severity for children with acute lung injury. Crit Care Med. 2012;40(4):1309–16.
Khemani RG, Patel NR, Bart RD, et al. Comparision of the Pulse Oximetric Saturation/Fraction of Inpired Oxygen Ratio and the PaO2/Fraction of Inspired Oxygen Ratio in Children. . Original research. Chest 2009; 135: 662-668.
Brown SM, Grissom CK, Moss M, Rice TW, Schoenfeld D, Hou PC, et al. Nonlinear Imputation of PaO2/FIO2 From SpO2/FIO2 Among Patients With Acute Respiratory Distress Syndrome. Chest. 2016;150(2):307–13.
Kneyber MCJ, de Luca D, Calderini E, Jarreau PH, Javouhey E, Lopez-Herce J, et al. Recommendations for mechanical ventilation of critically ill children from the Paediatric Mechanical Ventilation Consensus Conference (PEMVECC). Intensive Care Med. 2017;43(12):1764–80.
Modesto I Alapont V, Khemani RG, Medina A, Del Villar Guerra P, Molina Cambra A. Bayes to the Rescue: Continuous Positive Airway Pressure Has Less Mortality Than High-Flow Oxygen. Pediatr Crit Care Med. 2017;18(2):e92–9.
Correspondence Respiratory support for. 2020;2600(20):30110.
Murthy S, Gomersall CD, Fowler RA. Care for Critically Ill Patients with COVID-19. JAMA – J Am Med Assoc. 2020;1–2.
Patel BK, Wolfe KS, Pohlman AS, Hall JB, Kress JP. Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome a randomized clinical trial. JAMA – J Am Med Assoc. 2016;315(22):2435– 41.
Rodriguez M, Thille AW, Boissier F, Veinstein A, Chatellier D, Robert R, et al. Predictors of successful separation from high-flow nasal oxygen therapy in patients with acute respiratory failure: a retrospective monocenter study. Ann Intensive Care. 2019;9(1).
Beitler JR. Lung protection in acute respiratory distress syndrome: What should we target? Curr Opin Crit Care. 2020;26(1):26–34.
Tusman G, Gogniat E, Madorno M, Otero P, Dianti J, Ceballos IF, et al. Effect of PEEP on dead space in an experimental model of ARDS. Respir Care. 2020;65(1):11–20.
Moss M, Huang DT, Brower RG, Ferguson ND, Ginde AA, Gong MN, et al. Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med. 2019;380(21):1997–2008.
Papazian L, Aubron C, Brochard L, Chiche JD, Combes A, Dreyfuss D, et al. Formal guidelines: management of acute respiratory distress syndrome. Ann Intensive Care. 2019;9(1).
Villar J, Kacmarek RM, Pérez-Méndez L, AguirreJaime A. A high positive end-expiratory pressure, low tidal volume ventilatory strategy improves outcome in persistent acute respiratory distress syndrome: A randomized, controlled trial. Crit Care Med. 2006;34(5):1311–8.
Pelosi P, Rocco PRM, Gama de Abreu M. Close down the lungs and keep them resting to minimize ventilator-induced lung injury. Crit Care. 2018;22(1).
Gattinoni L, Pesenti A. The concept of “baby lung.” Intensive Care Med. 2005;31(6):776–84.
Amato MBP, Meade MO, Slutsky AS, Brochard L, Costa ELV, Schoenfeld DA, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2014;372(8):747–55.
Samary CS, Santos RS, Santos CL, Felix NS, Bentes M, Barboza T, et al. Biological impact of transpulmonary driving pressure in experimental acute respiratory distress syndrome. Anesthesiology. 2015;123(2):423– 33.
Bellani G, Laffey JG, Pham T, Fan E. The LUNG SAFE study: A presentation of the prevalence of ARDS according to the Berlin Definition! Crit Care. 2016;20(1):268.
Briel M, Meade M, Mercat A, Brower RG, Talmor D, Walter SD, et al. Higher vs lower positive endexpiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: Systematic review and meta-analysis. JAMA – J Am Med Assoc. 2010;303(9):865–73.
Mercat A, Richard JCM, Vielle B, Jaber S, Osman D, Diehl JL, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: A randomized controlled trial. JAMA – J Am Med Assoc. 2008;299(6):646–55.
Bergez M, Fritsch N, Tran-Van D, Saghi T, Bounkim T, Gentile A, et al. PEEP titration in moderate to severe ARDS: plateau versus transpulmonary pressure. Ann Intensive Care [Internet]. 2019;9(1):81. Available from: https://doi.org/10.1186/s13613-019-0554-3
Sahetya SK, Hager DN, Stephens RS, Needham DM, Brower RG. PEEP Titration to Minimize Driving Pressure in Subjects With ARDS: A Prospective Physiological Study. Respir Care. 2019;(C):respcare.07102.
Cavalcanti AB, Suzumura ÉA, Laranjeira LN, De Moraes Paisani D, Damiani LP, Guimarães HP, et al. Effect of lung recruitment and titrated Positive EndExpiratory Pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome – A randomized clinical trial. JAMA – J Am Med Assoc. 2017;318(14):1335–45.
Chu EK, Whitehead T, Slutsky AS. Effects of cyclic opening and closing at low- and high-volume ventilation on bronchoalveolar lavage cytokines. Crit Care Med. 2004;32(1):168–74.
Munshi L, Del Sorbo L, Adhikari NKJ, Hodgson CL, Wunsch H, Meade MO, et al. Prone position for acute respiratory distress syndrome: A systematic review and meta-analysis. Ann Am Thorac Soc. 2017;14(October):S280–8.
Pugliese F, Babetto C, Alessandri F, Ranieri VM. Prone Positioning for ARDS: Still misunderstood and misused. J Thorac Dis. 2018;10(Suppl 17):S2079–82. 31. Guérin C, Reignier J, Richard JC, Beuret P, Gacouin A, Boulain T, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368(23):2159–68.
Sud S, Friedrich JO, Taccone P, Polli F, Adhikari NKJ, Latini R, et al. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: Systematic review and meta-analysis. Intensive Care Med. 2010;36(4):585–99.
Hodgson CL, Tuxen D V., Davies AR, Bailey MJ, Higgins AM, Holland AE, et al. A randomised controlled trial of an open lung strategy with staircase recruitment, titrated PEEP and targeted low airway pressures in patients with acute respiratory distress syndrome. Crit Care. 2011;15(3):1–9.
Meade MO, Cook DJ, Guyatt GH, Slutsky AS, Arabi YM, Cooper DJ, et al. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: A randomized controlled trial. JAMA – J Am Med Assoc. 2008;299(6):637–45.
Medoff BD, Harris RS, Kesselman H, Venegas J, Amato MBP, Hess D. Use of recruitment maneuvers and high positive end-expiratory pressure in a patient with acute respiratory distress syndrome. Crit Care Med. 2000;28(4):1210–6.
Walkey AJ, Del Sorbo L, Hodgson CL, Adhikari NKJ, Wunsch H, Meade MO, et al. Higher PEEP versus lower PEEP strategies for patients with acute respiratory distress syndrome: A systematic review and meta-analysis. Ann Am Thorac Soc. 2017;14:S297–303.
Nanchal RS, Truwit JD. Recent advances in understanding and treating acute respiratory distress syndrome [version 1; referees: 2 approved]. F1000Research 2019, 8(F1000 Faculty Rev):1959 .Last updated: 22 NOV 2019
Guérin C, Matthay MA. Acute cor pulmonale and the acute respiratory distress syndrome. Intensive Care Med. 2016;42(5):934–6.
Papazian L, Bregeon F, Gaillat F, Thirion X, Roch A, Cortes E, et al. Inhaled NO and almitrine bismesylate in patients with acute respiratory distress syndrome: Effect of noradrenalin. Eur Respir J. 1999;14(6):1283–9.
Bazin JE, Mansoor O. Thierry GiUart MD, Jean E. Bazin. Combined nitric oxide inhalation, prone positioning and almitrine infusion improve oxygenation en severe ARDS. Canadian Journal of Anaesthesia 1998; 45(5): 402-409.
Singh Y, Tissot C, Fraga M V., Yousef N, Cortes RG, Lopez J, et al. International evidence-based guidelines on Point of Care Ultrasound (POCUS) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Paediatric and Neonatal Intensive Care (ESPNIC). Crit Care. 2020;24(1):1–16.
Pintado M-C, de Pablo R, Trascasa M, Milicua J-M, Sánchez-García M. Compliance-guided versus FiO 2 -driven positive-end expiratory pressure in patients with moderate or severe acute respiratory distress syndrome according to the Berlin definition. Med Intensiva (English Ed. 2017;41(5):277–84.
Griffiths M, Fan E, Baudouin S V. New UK guidelines for the management of adult patients with ARDS. Thorax 2019; 74(10):931-933.
Brochard L, Hedenstierna G. Ten physiologic advances that improved treatment for ARDS. Intensive Care Med. 2016;42(5):814–6.
Goligher EC, Kavanagh BP, Rubenfeld GD, Ferguson ND. Physiologic responsiveness should guide entry into randomized controlled trials. Am J Respir Crit Care Med. 2015;192(12):1416–9.