Pedro Leme Silva, Patricia R.M.Rocco
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Thông khí cơ học là một hệ thống hỗ trợ sự sống được sử dụng để duy trì chức năng phổi đầy đủ ở những bệnh nhân bị bệnh nặng hoặc đang được gây mê toàn thân. Lợi ích và tác hại của thở máy không chỉ phụ thuộc vào cách cài đặt của người vận hành máy (đầu vào), mà còn vào cách giải thích của họ về các thông số có nguồn gốc từ máy thở (đầu ra), sẽ hướng dẫn các chiến lược thở máy. Sau khi các đầu vào — thể tích khí lưu thông (VT), áp lực dương cuối kỳ thở ra (PEEP), tần số thở (RR) và lưu lượng khí hít vào (V’) – đã được điều chỉnh, các đầu ra sau sẽ được đo: PEEP nội tại, áp lực đỉnh (Ppeak) và áp lực bình nguyên (Pplat), áp lực truyền động (ΔP), áp lực xuyên phổi (PL), năng lượng cơ học, công suất cơ học và cường độ. Trong quá trình thở máy có hỗ trợ, ngoài các thông số này, áp lực tạo ra 100 ms sau khi bắt đầu nỗ lực hít vào (P0.1) và tích số áp lực-thời gian mỗi phút (PTP/phút) cũng phải được đánh giá. Các thông số nói trên nên được xem như một tập hợp các kết quả đầu ra, tất cả đều cần được theo dõi nghiêm ngặt tại giường bệnh để phát triển thở máy cá nhân hóa theo từng trường hợp cụ thể. Ngoài ra, cần có thêm nghiên cứu lâm sàng để đánh giá ngưỡng an toàn của từng thông số ở phổi bị tổn thương và không bị tổn thương.
Giới thiệu
Thông khí cơ học là một hệ thống hỗ trợ sự sống được sử dụng để duy trì chức năng phổi đầy đủ ở những bệnh nhân bị bệnh nặng hoặc đang được gây mê toàn thân (1,2); tuy nhiên, nó có thể gây tổn thương phổi. Lợi ích và tác hại của thở máy không chỉ phụ thuộc vào việc điều chỉnh các thông số của máy thở mà còn phụ thuộc vào việc giải thích các thông số có nguồn gốc từ máy thở, những thông số này cần được sử dụng để hướng dẫn các chiến lược thở máy. Cơ sở của quá trình này dựa vào sự tương tác giữa các lực vật lý tác động lên cấu trúc phổi trong quá trình thở máy do người điều khiển điều chỉnh và cơ học phổi và thành ngực của bệnh nhân (3). Sau khi các yếu tố đầu vào — thể tích khí lưu thông (VT), áp lực dương cuối kỳ thở ra (PEEP), tần số thở (RR) và lưu lượng khí hít vào (V’) – đã được điều chỉnh, thông tin thu được từ máy thở cơ học (đầu ra hoặc tham số dẫn xuất từ máy thở) có thể được kiểm tra. Bất kể chế độ máy thở là gì, các thông số có nguồn gốc từ máy thở sau đây cần được đo để giảm thiểu các tác động có hại (2,4): PEEP nội tại (PEEPi), áp lực đỉnh (Ppeak) và áp lực bình nguyên (Pplat), áp lực truyền động (ΔP) áp lực xuyên phổi (PL). Trong quá trình thở máy có hỗ trợ, ngoài các thông số này, áp lực tạo ra 100 ms sau khi bắt đầu nỗ lực hít vào (P0.1) và tích số áp lực-thời gian mỗi phút (PTP/phút) cũng cần được đánh giá.
Trong bài tổng quan này, chúng ta sẽ thảo luận về các thông số máy thở được điều chỉnh bởi người vận hành (đầu vào) và các thông số máy thở thu được sau khi tương tác với các cấu trúc hệ hô hấp trong quá trình thở máy (đầu ra). Hơn nữa, các thông số mới có nguồn gốc từ máy thở, chẳng hạn như năng lượng cơ học, công suất cơ học và cường độ, sẽ được thảo luận dựa trên các bằng chứng gần đây (5-7).
Đầu vào: thông số máy thở do người vận hành thiết lập
Thể tích khí lưu thông (vt)
Ở cả phổi không bị tổn thương và phổi bị tổn thương, việc sử dụng VT thấp được ưu tiên hơn VT cao.
Ở những bệnh nhân được gây mê toàn thân, không có mối liên quan nào giữa VT và các biến chứng phổi sau phẫu thuật (PPCs) (8). Ngoài ra, thông khí kiểm soát áp lực (PCV) đã được so sánh với thông khí kiểm soát thể tích (VCV), tập trung vào các PPC; Sự so sánh này rất quan trọng để phân biệt vai trò tiềm tàng của việc kiểm soát chặt chẽ VT trong VCV. Tần suất của PPCs ở PCV cao hơn ở VCV. Điều này có thể là do khó kiểm soát VT trong quá trình PCV, do đó làm nổi bật tầm quan trọng của VT.
Tại khoa cấp cứu, những bệnh nhân được thở máy với phổi bị tổn thương và không bị tổn thương cũng có thể được hưởng lợi từ việc sử dụng VTs thấp (9).
Trong đơn vị chăm sóc đặc biệt (ICU), mặc dù hai phân tích tổng hợp cho thấy rằng bệnh nhân phổi không bị tổn thương có thể được thông khí với VT thấp (10,11), một nghiên cứu tiền cứu báo cáo không có mối liên quan giữa VT và kết cục (12), điều này có thể được cho là do VT trong nghiên cứu này thấp hơn nhiều so với các phân tích tổng hợp đã nói ở trên (10,11). Khi ngừng tim ngoài bệnh viện, giảm VT có liên quan đến kết quả nhận thức thần kinh thuận lợi và những ngày không thở máy nhiều hơn (13). Tóm lại, lợi ích của việc giảm VT ở bệnh nhân ICU với phổi không bị tổn thương vẫn chưa rõ ràng. Hai thử nghiệm lâm sàng ngẫu nhiên đang diễn ra, Thông khí bảo vệ ở bệnh nhân không có ARDS khi bắt đầu thở máy (PReVENT) (14) và Chiến lược dự phòng trong Hội chứng suy hô hấp cấp (EPALI) (Số đăng ký Clinicaltrials.org: NCT02070666), có thể làm sáng tỏ vấn đề này.
Ở những bệnh nhân có hội chứng suy hô hấp cấp (ARDS), trọng lượng cơ thể dự đoán (PBW), có tính đến cả giới tính và chiều cao, đã được sử dụng để đặt VT (15-17). Các phương trình PBW sau đây đã được sử dụng: nam giới, 50,0 + 0,905 × (chiều cao tính bằng cm) −152,4; nữ: 45,5 + 0,905 × (chiều cao tính bằng cm) −152,4. Để giảm thiểu nguy cơ tổn thương phổi do máy thở (VILI) ở bệnh nhân ARDS, giao thức Mạng lưới ARDS của Viện Y tế Quốc gia đề xuất sử dụng VT = 6 mL/kg PBW và Pplat giới hạn ở 30 cmH2O. Nếu Pplat vượt quá 30 cmH2O với VT là 6 mL/kg PBW, quy trình khuyến nghị giảm VT (xuống 4–5 mL/kg PBW) nếu pHa > 7.15. Vì phổi ARDS có sự thay đổi lớn do phù nề, xẹp phổi và đông đặc, nên VT có lẽ nên được cài đặt theo thể tích phổi được thông khí, ví dụ, dung tích cặn chức năng (FRC) hoặc tổng dung tích phổi (TLC) (18-20).
Tuy nhiên, cần có các nghiên cứu sâu hơn để đánh giá giới hạn an toàn của FRC và TLC khi được sử dụng để đặt VT. Trong dòng này, ở những bệnh nhân bị ARDS nặng và mức độ giãn nở của phổi rất thấp, ngay cả khi đặt VT dưới 6 mL/kg PBW cũng có thể dẫn đến strain cao (VT/FRC) (19). Kịch bản này có thể được coi là không an toàn; do đó, các liệu pháp giải cứu là cần thiết, chẳng hạn như hỗ trợ ngoài cơ thể (21).
Ngoài ra, VT nên được đặt theo ΔP [PplatPEEP hoặc VT/Crs (độ giãn nở hệ thống hô hấp)]. Vì Crs liên quan trực tiếp đến kích thước phổi, ΔP phản ánh mức độ VT liên quan đến thể tích phổi được thông khí. Tuy nhiên, khi có giảm cơ học thành ngực, ΔP không phản ánh VT. Trong dòng này, xét cùng một ΔP, bệnh nhân có thành ngực cứng có ít căng chướng quá mức phổi hơn bệnh nhân có thành ngực bình thường (22). Do đó, nên đánh giá áp lực vận động xuyên phổi (ΔPL, sự chênh lệch áp lực xuyên phổi giữa cuối thì thở ra và cuối hít vào) (23), và VT có thể được giới hạn để giữ ΔPL trong phạm vi an toàn (19,24).
Áp lực dương cuối thở ra (peep)
PEEP là áp lực phế nang cao hơn áp lực khí quyển khi thở ra. PEEP được áp dụng thông qua thông khí cơ học (tức là PEEP bên ngoài) cho phép cung cấp áp lực dương vào cuối thời gian thở ra để ngăn chặn các đơn vị phổi không ổn định bị xẹp. Mức PEEP thấp (3 đến 5 cmH2O) thường được sử dụng ở bệnh nhân thở máy. Thực hành này rất quan trọng để: (I) giữ cho phổi mở khi thở ra, do đó thúc đẩy sự ổn định của phế nang (25); (II) ngăn chặn việc mở và đóng các đường thở và các đơn vị phế nang nhỏ ở xa (26); và (III) làm tăng lưu lượng bạch huyết qua ống ngực, có thể tạo điều kiện dẫn lưu phù phổi (27). Tuy nhiên, mức PEEP cao hơn có thể gây ra hiện tượng quá căng vùng và làm suy giảm hoạt động của tim (28). Ưu và nhược điểm của PEEP phụ thuộc vào mức độ tổn thương phổi (29).
Ở những bệnh nhân được gây mê toàn thân, thở máy trong khi mổ với VT = 8 mL/kg và PEEP cao (12 cmH2O), khi so sánh với PEEP thấp (2 cmH2O), không ngăn cản PPC, như thể hiện trong Thông khí bảo vệ sử dụng thử nghiệm áp lực dương cuối kỳ thở ra Cao so với Thấp (PROVHILO) (30). Cần phải nghiên cứu thêm để đánh giá mức PEEP vừa phải (5–8 cmH2O).
Trong khoa cấp cứu, việc sử dụng mứ PEEP cao hơn có liên quan đến việc cải thiện thời gian thở máy và những ngày không nằm viện ở bệnh nhân ARDS (9) và phổi không bị tổn thương (31).
Ở những bệnh nhân ICU với phổi không bị tổn thương, một phân tích tổng hợp báo cáo rằng lợi ích từ PEEP là không có về thời gian thở máy và tỷ lệ tử vong (32). Ở những bệnh nhân ICU có nguy cơ mắc ARDS, mức PEEP được yêu cầu cao hơn so với những bệnh nhân không có nguy cơ ARDS (12). Gần đây hơn, bệnh nhân ICU sau khi phẫu thuật tim được phát hiện có ít biến chứng phổi hơn với PEEP cao (33). Chắc chắn, các nghiên cứu sâu hơn là cần thiết để so sánh mức PEEP thấp và cao ở bệnh nhân ICU không có ARDS.
Ba nghiên cứu chính đã đánh giá mức PEEP cao so với thấp kết hợp với VT thấp ở bệnh nhân ARDS (16,17,34). Trong thử nghiệm ALVEOLI (34), tỷ lệ tử vong không khác biệt giữa mức PEEP thấp và cao. PEEP cao dẫn đến cải thiện quá trình oxygen hóa (17) cũng như những ngày không thở máy nhiều hơn và những ngày không suy cơ quan (16); tuy nhiên, tỷ lệ tử vong không khác nhau giữa các nhóm PEEP. Một phân tích tổng hợp sử dụng dữ liệu từ ba thử nghiệm nói trên cho thấy rằng mức PEEP cao hơn có liên quan đến việc cải thiện tỷ lệ sống sót trong ARDS nặng (35). Trong ARDS trung bình, PEEP thấp hơn (2O), so với PEEP cao hơn, có liên quan đến nguy cơ tử vong tại bệnh viện cao hơn (26%) (36). Trong một thử nghiệm lâm sàng ngẫu nhiên gần đây so sánh chuẩn độ PEEP cá nhân sau khi thủ thuật huy động (RM) so với PEEP thấp không có RM ở bệnh nhân ARDS từ trung bình đến nặng, đã quan sát thấy sự gia tăng tỷ lệ tử vong trong 28 ngày ở nhóm được huy động (37).
Một số chiến lược đã được sử dụng để xác định PEEP tối ưu, chẳng hạn như: (I) đánh giá điểm uốn dưới của đường cong áp lực-thể tích, phản ánh sự chuyển đổi từ mức độ giãn nở thấp sang mức độ giãn nở cao, và áp dụng PEEP lớn hơn 2 cmH2O so với điểm này; (II) việc sử dụng các thuật toán kết hợp PEEP và nồng độ oxy hít vào (FiO2); và (III) đo áp lực xuyên phổi bằng ống thông thực quản (38). Chắc chắn, cách tiếp cận tốt nhất là cá nhân hóa PEEP cho từng bệnh nhân.
Tần số thở
Tần số thở phải được điều chỉnh trong quá trình thở máy để duy trì thể tích phút phù hợp với nhu cầu chuyển hóa của bệnh nhân. Mặc dù RR cao hơn thường cần thiết để duy trì nồng độ CO2 trong phạm vi an toàn (39), nhưng nó có thể làm thay đổi tỷ lệ hít vào:thở ra, do đó dẫn đến PEEP nội tại do thời gian thở ra ngắn. Trong bối cảnh này, VieillardBaron et al. so sánh hai mức RR — 15 nhịp thở mỗi phút (bpm) so với 30 bpm — trong khi duy trì Pplat thấp hơn (2O). Không có sự khác biệt về PaCO2 do PEEP nội tại tăng hoặc thông khí không gian chết được quan sát thấy giữa các nhóm (40). Tăng RR cũng có thể gây tổn thương phổi do huy động/bỏ huy động theo chu kỳ.
Lưu lượng khí hít vào
Lưu lượng khí hít vào phải được điều chỉnh trong quá trình thở máy, vì nó cũng có thể gây tổn thương phổi (41-43). Cơ chế theo đó lưu lượng khí hít vào góp phần gây tổn thương phổi dường như bị ảnh hưởng bởi các đặc tính đàn hồi của mô phổi. Lưu lượng khí hít vào cao làm tăng tổn thương nhu mô phổi đàn hồi không có thời gian để tiêu tán lực gây tổn hại khi bơm phồng xảy ra nhanh chóng. Loại cơ chế tổn thương này thường xảy ra ở phổi không đối xứng.
Lưu lượng khí hít vào cao là một yếu tố quan trọng quyết định stress phổi, vì nó tăng cường truyền động năng đến các cấu trúc phổi, làm tăng ứng suất cắt (shear stress) song song với bề mặt của đường thở và thành phế nang, dẫn đến biến dạng nhu mô phổi và tế bào biểu mô phế quản, và giải phóng các chất trung gian tiền sinh sợi (43) và tiền viêm (44). Do đó, kiểm soát lưu lượng khí hít vào có thể cung cấp khả năng bảo vệ phổi bổ sung (43,44).
Kết quả đầu ra: các thông số máy thở thu được do tương tác giữa máy thở cơ học và hệ thống hô hấp
Trong quá trình thở máy, cần theo dõi một số thông số dẫn xuất từ máy thở: PEEPi, Ppeak, Pplat, ΔP, PL, P0.1, PTP/phút, năng lượng cơ học, công suất cơ học và cường độ.
Peep nội tại
PEEP bên trong (PEEPi) phản ánh áp lực còn lại khi giai đoạn thở ra có thể không được hoàn thành đến khi thở ra hoàn toàn. Áp lực dư này cao hơn điểm cân bằng của các đặc tính đàn hồi của hệ hô hấp (45). Một hình thức dễ dàng để phát hiện sự hiện diện của nó là thực hiện tạm dừng thở ra và kiểm tra áp lực cuối kỳ thở ra. PEEPi thường liên quan đến các bệnh tắc nghẽn (46), nhưng có thể xuất hiện trong các tình trạng khác; do đó, nó được coi là một thông số quan trọng có nguồn gốc từ máy thở để theo dõi. Ví dụ, bệnh nhân béo phì được thở máy dễ bị PEEPi, chủ yếu ở tư thế nằm ngửa. Cả ứng dụng PEEP bên ngoài và việc thay đổi vị trí đều có thể thay đổi PEEPi (47).
Áp lực đỉnh
Áp lực đỉnh là áp lực tối đa đo được tại thời điểm cuối thì hít vào. Ppeak bao gồm các thành phần đàn hồi và sức cản (đường thở, mô phổi và thiết bị, ví dụ, ống nội khí quản). Tại giường bệnh, có thể dễ dàng hình dung sự khác biệt giữa Ppeak và Pplat trong thời gian tạm dừng hít vào trong việc thở máy kiểm soát với lưu lượng khí hằng định. Ngay sau khi ngừng hít vào, áp lực đường thở nhanh chóng giảm xuống, thể hiện áp lực tiêu hao để vượt qua sức cản của đường thở, được quan sát thấy. Sự khác biệt giữa Ppeak và Pplat được chia cho lưu lượng khí là sức cản của đường thở. Ở những người bình thường, giá trị sức cản đường thở không vượt quá 15–20 cmH2O/L/s khi thở máy kiểm soát (48). Một số yếu tố có thể làm thay đổi Ppeak, chẳng hạn như đường kính ống nội khí quản (49,50), lưu lượng khí, nút nhày hoặc co thắt phế quản.
Trong quá trình thở máy kiểm soát, Ppeak phụ thuộc vào VT, RR và lưu lượng khí, trong khi trong quá trình thở máy hỗ trợ, nỗ lực của bệnh nhân cũng góp phần vào Ppeak.
Trong một nghiên cứu đoàn hệ tiến cứu, đa trung tâm trên 2.377 bệnh nhân suy hô hấp nặng, được thực hiện ở 459 ICU từ 50 quốc gia trên khắp năm châu lục (36), các tác giả đã báo cáo tầm quan trọng của việc theo dõi Ppeak bên cạnh các thông số máy thở khác. Ppeak cao hơn, đặc biệt là trên 40 cmH2O, có liên quan đến tỷ lệ tử vong tăng lên (51).
Áp lực bình nguyên
Áp lực bình nguyên có thể được đo trong thời gian ngừng hít vào khi các cơ hô hấp được thư giãn và bằng với áp lực phế nang khi lưu lượng khí bằng không. Pplat có thể bị ảnh hưởng bởi những thay đổi về VT và Crs, nhưng không bị ảnh hưởng bởi những thay đổi về lưu lượng khí và sức cản của đường thở (52).
Ở những bệnh nhân ICU không ARDS, giá trị Pplat thấp hơn liên quan đến VT ≤7 mL/kg PBW dẫn đến giảm PPCs và có xu hướng tăng thời gian sống thêm (P = 0,052) (11). Ở bệnh nhân ARDS, Pplat 2O có liên quan đến tỷ lệ tử vong thấp hơn (15). Một nghiên cứu quan sát với bệnh nhân ARDS cho thấy Pplat 2O có lợi hơn ở những người có tỷ lệ lớn mô phổi không được thông khí (53). Gần đây hơn, ở những bệnh nhân mắ ARDS nặng, nghiên cứu LUNG SAFE (36) báo cáo rằng Pplat 2O không liên quan đến việc giảm nguy cơ tử vong tại bệnh viện. Tuy nhiên, những bệnh nhân có Pplat trung bình ≥23 cmH2O vào ngày đầu tiên của chẩn đoán ARDS có tỷ lệ tử vong cao hơn.
Áp lực truyền động
Áp lực truyền động được định nghĩa là Pplat-PEEP hoặc VT được chuẩn hóa với Crs (23,54,55). Trong thông khí trong phòng mổ, ΔP dường như là một thông số quan trọng để tối ưu hóa thở máy (8,12).
Ở bệnh nhân ICU thở máy không có ARDS (55), ΔP không liên quan đến tử vong tại bệnh viện. Các tác giả cho rằng kết quả này là do Crs không phải là yếu tố nguy cơ chính gây tử vong ở những bệnh nhân không có ARDS. Ngược lại, Tejerina et al. (56) cho thấy rằng, ở những bệnh nhân bị chấn thương sọ não nhưng phổi không bị tổn thương, ΔP thấp cho kết quả tốt hơn.
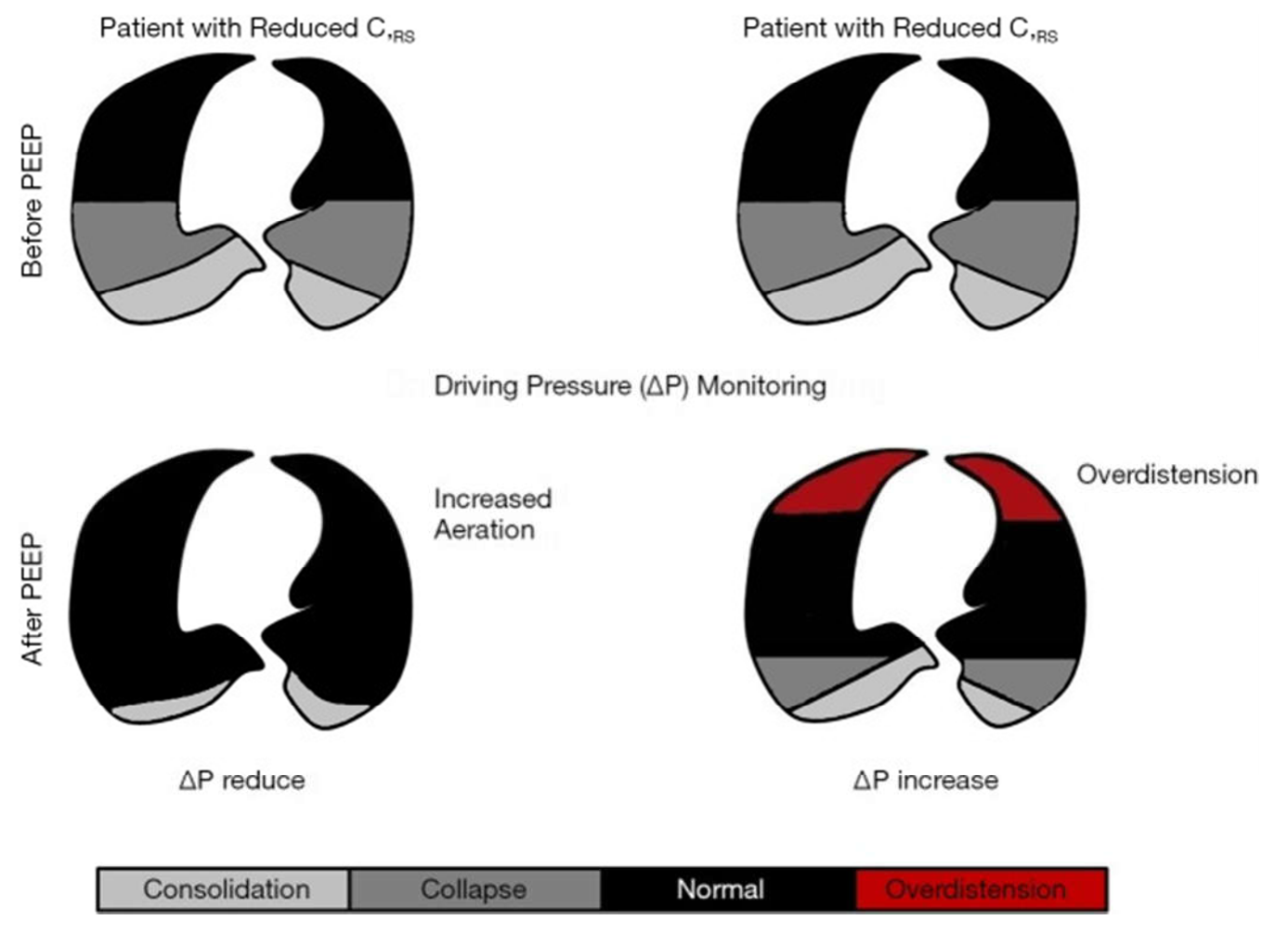
Trong một nghiên cứu về bệnh nhân ARDS, ΔP được coi là biến số liên quan chặt chẽ nhất đến khả năng sống sót, trái ngược với VT và PEEP (54). Các tác giả quan sát thấy rằng việc tăng mức PEEP trong một thời gian ngắn có thể dẫn đến những thay đổi khác nhau trong ΔP. Nếu mức PEEP tăng dẫn đến tăng thông khí của mô phổi thông qua quá trình huy động, thì ΔP dự kiến sẽ giảm. Mặt khác, nếu PEEP tăng và không huy động mô phổi, phổi có thể bị giãn nở quá mức, và ΔP có thể không thay đổi hoặc thậm chí tăng theo thời gian (Hình 1).
Nghiên cứu LUNG SAFE (36) cho thấy ΔP 2O liên quan đến giảm nguy cơ tử vong tại bệnh viện ở bệnh nhân ARDS từ trung bình đến nặng.
Hình 1 Hình vẽ sơ đồ cho thấy hai bệnh nhân có mức độ giãn nở hệ hô hấp (CRS) bình thường và giảm trước và sau khi tăng PEEP. Như đã giải thích trong văn bản chính, sự gia tăng mức PEEP có thể dẫn đến các đáp ứng khác nhau có thể dễ dàng đánh giá tại giường thông qua việc giải thích các giá trị ΔP.
Áp lực xuyên phổi
Áp lực xuyên phổi (PL), theo định nghĩa, là sự khác biệt giữa áp lực đường thở (Paw) và áp lực màng phổi (Ppl). Trong bối cảnh lâm sàng, áp kế thực quản là phương pháp duy nhất có sẵn trên lâm sàng để tách áp lực đường thở áp dụng cho hệ hô hấp ra 2 thành phần: thành ngực (tức là Ppl) và phổi (PL) (57-59). Phép đo PL đã được đề xuất vì nó có thể xác định áp lực cần thiết để giữ cho phổi mở (38,60,61) và nó có thể đánh giá nỗ lực hít vào (62,63). Trong ARDS liên kết với cúm A (H1N1), Grasso et al. (61) quan sát thấy áp lực tác động lên đường thở không truyền đến nhu mô phổi mà tản ra dựa vào thành ngực cứng, cung cấp thêm bằng chứng về tầm quan trọng của việc đo PL.
Trong quá trình thở máy hỗ trợ, ống thông thực quản có thể không bao phủ toàn bộ độ chênh lệch dọc trong khi có hoạt động của cơ hô hấp. Trong bối cảnh này, Yoshida et al. (64) cho thấy rằng sự thay đổi áp lực thực quản đánh giá thấp đáng kể sự thay đổi áp lực màng phổi ở các vùng phụ thuộc. Ngoài ra, dao động áp lực màng phổi đo được trực tiếp (-14,9) ở phổi phụ thuộc lớn hơn đáng kể so với dao động ở Pes (-7,1). Áp lực thực quản có thể đánh giá thấp áp lực màng phổi cục bộ, đặc biệt là ở những vùng gần cơ hoành có mức độ PL cao hơn.
Áp lực truyền động xuyên phổi (δpl)
Áp lực truyền động xuyên phổi (ΔPL) được định nghĩa là sự khác biệt giữa PL khi kết thúc hít vào (PLend-insp) và PL khi kết thúc thở ra (PLend-exp). Nó phản ánh áp lực căng phồng do phổi thực hiện khi VT được sinh ra. Việc sử dụng ΔPL mang lại một số lợi thế. Đầu tiên, ΔPL loại bỏ stress do PEEP gây ra, điều này không nhất thiết góp phần vào tổn thương phổi và đôi khi có thể giảm nhẹ nó (65). Thứ hai, ΔPL loại bỏ áp lực căng do thành ngực gây ra (66). Do đó, có vẻ như ΔPL có thể thay thế tốt hơn cho stress phổi và thậm chí có thể là một yếu tố dự đoán kết quả lâm sàng tốt hơn ΔP (67). ΔPL được tính như sau:
ΔPL = (PPLAT – PESO,end-insp) – (PEEPTOT – PESO,end-exp) [1]
Trong ARDS thực nghiệm, PL thấp không làm tăng viêm phổi, mặc dù dẫn đến xẹp phế nang. Mức độ trung gian của ΔPL làm giảm sự xẹp phế nang, tăng mức độ quá căng và dẫn đến sự mất ổn định của phế nang. Ở mức PL cao, siêu bơm phồng phế nang được phát hiện, nhưng không quan sát thấy thêm tình trạng viêm phổi (23). Ở mức PL cao, siêu bơm phồng phế nang được phát hiện, nhưng không quan sát thấy thêm tình trạng viêm phổi (23). Nghiên cứu này nhấn mạnh tầm quan trọng của xẹp phổi cho phép để bảo vệ tổn thương phổi, như đã được công bố gần đây (68) và được thảo luận trong hai bài xã luận (69,70).
PL cũng là một thông số thở máy quan trọng cần được theo dõi trong quá trình thở máy hỗ trợ. Bellani và cộng sự. đã kiểm tra giả thuyết rằng, đối với một thể tích và lưu lượng được hít vào nhất định, và đối với các đặc tính cơ học giống nhau (tứ là sự độ giãn nở và sức đề kháng) của phổi, ΔPL trong quá trình thở máy hỗ trợ và kiểm soát không được khác nhau trong cùng một bệnh nhân (71). Họ không tìm thấy sự khác biệt về ΔPL ở các thể tích và lưu lượng tương đương. Tuy nhiên, các tác giả chỉ ra rằng, nếu hơi thở được hỗ trợ góp phần gây tổn thương phổi, thì điều này sẽ không chỉ do ΔPL; gradient thẳng đứng dẫn đến các áp lực màng phổi cục bộ khác nhau và cuối cùng, các khoảng ΔPL cục bộ cũng nên được thừa nhận (64,72).
Áp lực thực quản tạo ra 100 ms sau khi bắt đầu gắng sức hít vào (p0.1)
Áp lực thực quản được tạo ra 100 ms sau khi bắt đầu nỗ lực hít vào bị tắc nghẽn (P0.1) đã được sử dụng như một phép đo trung khu hô hấp (73), và nó có thể được sử dụng để tối ưu hóa mức độ hỗ trợ áp lực ở từng bệnh nhân (74). Trong một nghiên cứu sinh lý học bắt chéo, ngẫu nhiên, tiền cứu gần đây, P0.1 đã được đánh giá khi có các mức độ nỗ lực thở khác nhau ở những bệnh nhân đang hồi phục sau suy hô hấp cấp (75). Nỗ lực hít vào được phát hiện có mối tương quan chặt chẽ với P0.1. Do đó, thông số này có thể vẫn chưa được công nhận tầm quan trọng như một dấu hiệu của trung khu hô hấp trong quá trình thở máy, và cần phải nỗ lực để nâng cao nhận thức về tiện ích tiềm năng của nó (76).
Tích số áp lực-thời gian trên phút
Tích số áp lực-thời gian là thước đo công cơ học của hơi thở. Bằng cách tích hợp áp lực do các cơ hô hấp phát triển trong suốt thời gian co lại (tức là áp lực giật đàn hồi của thành ngực), có thể thu được PTP hô hấp. Field et al. (77) nhận thấy rằng mức tiêu thụ oxy của cơ hô hấp chỉ tương quan yếu với công thở cơ học (tích ΔP·ΔV), trong khi nó được PTP phản ánh tốt. PTP có tính đến giai đoạn đẳng áp của co cơ, do đó đại diện cho một chỉ số tốt về tiêu hao năng lượng (78). Một cách phổ biến để thể hiện PTP là thông qua việc chuẩn hóa theo chu kỳ mẫu của chu kỳ hô hấp (TTOT).
Các thông số mới có nguồn gốc từ máy thở: các dấu hiệu của sự tương tác giữa bệnh nhân và máy thở
Năng lượng cơ học
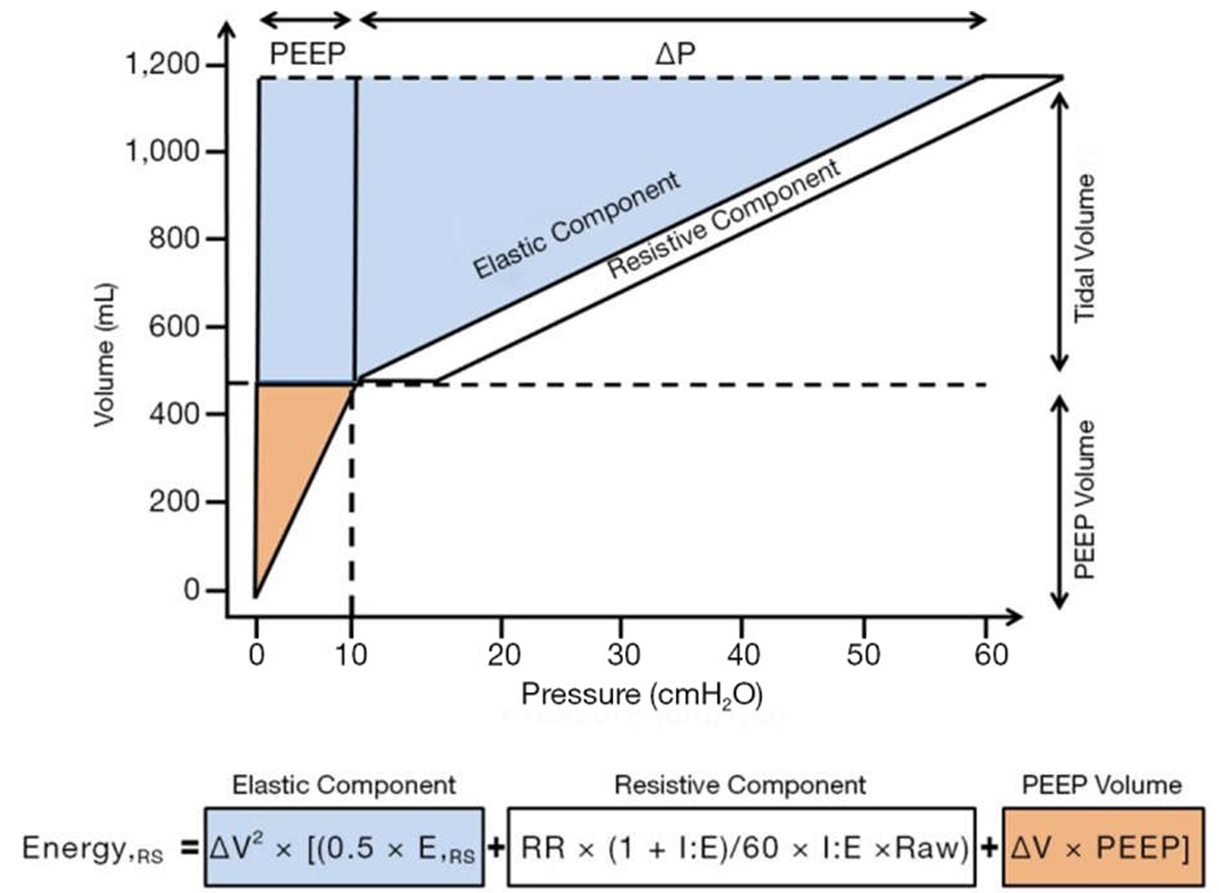
Năng lượng được cung cấp trong mỗi lần thở đến đường thở và phổi được định nghĩa là diện tích giữa nhánh thở của áp lực (x) so với trục thể tích (y), được đo bằng jun (J) (79) (Hình 2).
Hai phương trình đã được đề xuất để tính năng lượng cơ học: một phương trình đơn giản (80) và một phương trình khác phức tạp hơn (7). Nếu được điều chỉnh thích hợp, cả hai sẽ mang lại kết quả tương tự. Tuy nhiên, cần giải quyết một số khác biệt về kỹ thuật giữa cả hai.
Hình 2 Đường cong áp lực-thể tích của hệ thống hô hấp, mô tả tất cả các thành phần cần thiết để tính năng lượng cơ học được truyền từ máy thở cơ học đến hệ thống hô hấp. Vùng màu xanh lam mô tả đặc tính đàn hồi của hệ hô hấp với phần tương ứng trong công thức năng lượng [ΔV2 × (0,5 × ERS)]. Vùng màu trắng đại diện cho đặc tính sức cản của hệ hô hấp, được liên kết với phần tương ứng trong công thức năng lượng [RR × (1+ I: E)/60 × I: E × Raw]. Vùng màu cam biểu thị thể tích PEEP, được mô tả trong công thức năng lượng bằng ΔV × PEEP. Được sửa đổi từ Tonetti et al. (79).
Phương trình đơn giản: Năng lượngL = ΔPL2/EL [2] trong đó ΔPL là áp lực truyền động xuyên phổi và EL là độ đàn hồi của phổi.
Phương trình phức tạp:
Năng lượngL = ΔV2 × [(0,5 × ERS + RR × (1+ I: E)/60 × I: E × Raw) + ΔV × PEEP] [3]
trong đó ΔV là sự thay đổi của thể tích khí lưu thông, ERS là độ đàn hồi của hệ thống hô hấp, I:E là tỷ lệ hít vào: thở ra và Raw là sức cản của đường thở.
Phương trình đơn giản có thể được sử dụng dễ dàng trong môi trường lâm sàng (5,80,81). Phương trình này tính thành phần quan trọng nhất (công suất cơ dẫn động), không tính đến đặc tính sức cản hoặc PEEP đóng góp, không giống như phương trình được đề xuất bởi Gattinoni et al. (7). Tuy nhiên, khó có thể liên kết trực tiếp năng lượng cơ học tiêu tán trong đường thở gần với tổn thương phế nang. Việc bổ sung PEEP vào phương trình phức tạp có tính đến sự đóng góp của biến dạng tĩnh, có liên quan đến việc tích trữ năng lượng tiềm năng trong các mô đàn hồi của hệ hô hấp (81).
Công suất và cường độ cơ học
Công suất cơ thể hiện năng lượng cơ học nhân với RR. Trong một nghiên cứu trước đây (6), các giá trị công suất cơ học khác nhau đã được áp dụng cho hệ hô hấp ở lợn khỏe mạnh bằng cách thay đổi RR trong khi giữ VT và PL không đổi, nhằm xác định ngưỡng công suất cơ học đối với tổn thương phổi. Các tác giả báo cáo sự phát triển của phù chỉ khi công suất cơ học qua phổi vượt quá 12,1 J/phút. Khi có tổn thương phổi, diện tích phổi được thông khí bị giảm, do đó cần áp lực truyền động và lưu lượng khí lớn hơn. Điều này, đến lượt nó, làm tăng công suất cơ học được cung cấp mà không thay đổi VT.
Cái gọi là cường độ (tức là công suất cơ học được chuẩn hóa cho mô phổi) cũng cần được xem xét. Tùy thuộc vào sức mạnh cơ học, cường độ có thể được so sánh giữa volutrauma và atelectrauma (5). Nếu công suất tăng lên mà không thay đổi diện tích bề mặt phổi thì cường độ sẽ cao hơn; mặt khác, nếu cả công suất và diện tích bề mặt phổi đều tăng (ví dụ, do phổi được huy động), cường độ có thể giảm hoặc không đổi.
Kết luận
Lợi ích và tác hại của thở máy ở những bệnh nhân nặng với phổi không bị tổn thương hoặc bị tổn thương, cũng như ở những bệnh nhân được gây mê toàn thân, không chỉ phụ thuộc vào các thiết lập máy thở, mà còn phụ thuộc vào việc giải thích các thông số có nguồn gốc từ máy thở. Cả hai thông số được điều chỉnh bởi người vận hành (VT, PEEP, RR và V’) và các thông số dẫn xuất từ máy thở (PEEPi, Ppeak, Pplat, ΔP, PL, năng lượng cơ học, công suất cơ học, cường độ, P0.1 và PTP) cần được theo dõi nghiêm ngặt tại giường bệnh, để xây dựng phương pháp thở máy theo từng trường hợp cụ thể. Hơn nữa, các nghiên cứu lâm sàng bổ sung được yêu cầu để xác định ngưỡng an toàn của từng thông số này ở phổi bị tổn thương và không bị tổn thương.
Tài liệu tham khảo
Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med 2013;369:2126-36. 10.1056/NEJMra1208707 [PubMed] [CrossRef] [Google Scholar]
Silva PL, Pelosi P, Rocco PR. Optimal mechanical ventilation strategies to minimize ventilator-induced lung injury in non-injured and injured lungs. Expert Rev Respir Med 2016;10:1243-5. 10.1080/17476348.2016.1251842 [PubMed] [CrossRef] [Google Scholar]
Plataki M, Hubmayr RD. The physical basis of ventilator-induced lung injury. Expert Rev Respir Med 2010;4:373-85. 10.1586/ers.10.28 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Silva PL, Negrini D, Rocco PR. Mechanisms of ventilator-induced lung injury in healthy lungs. Best Pract Res Clin Anaesthesiol 2015;29:301-13. 10.1016/j.bpa.2015.08.004 [PubMed] [CrossRef] [Google Scholar]
Samary CS, Silva PL, Gama de Abreu M, et al. Ventilator-induced Lung Injury: Power to the Mechanical Power. Anesthesiology 2016;125:1070-1. 10.1097/ALN.0000000000001297 [PubMed] [CrossRef] [Google Scholar]
Cressoni M, Gotti M, Chiurazzi C, et al. Mechanical Power and Development of Ventilator-induced Lung Injury. Anesthesiology 2016;124:1100-8. 10.1097/ALN.0000000000001056 [PubMed] [CrossRef] [Google Scholar]
Gattinoni L, Tonetti T, Cressoni M, et al. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 2016;42:1567-75. 10.1007/s00134-016-4505-2 [PubMed] [CrossRef] [Google Scholar]
Epidemiology, practice of ventilation and outcome for patients at increased risk of postoperative pulmonary complications: LAS VEGAS – an observational study in 29 countries. Eur J Anaesthesiol 2017;34:492-507. 10.1097/EJA.0000000000000646 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Fuller BM, Ferguson IT, Mohr NM, et al. A Quasi-Experimental, Before-After Trial Examining the Impact of an Emergency Department Mechanical Ventilator Protocol on Clinical Outcomes and Lung-Protective Ventilation in Acute Respiratory Distress Syndrome. Crit Care Med 2017;45:645-52. 10.1097/CCM.0000000000002268 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Serpa Neto A, Simonis FD, Barbas CS, et al. Association between tidal volume size, duration of ventilation, and sedation needs in patients without acute respiratory distress syndrome: an individual patient data metaanalysis. Intensive Care Med 2014;40:950-7. 10.1007/s00134-014-3318-4 [PubMed] [CrossRef] [Google Scholar]
Neto AS, Simonis FD, Barbas CS, et al. Lung-Protective Ventilation With Low Tidal Volumes and the Occurrence of Pulmonary Complications in Patients Without Acute Respiratory Distress Syndrome: A Systematic Review and Individual Patient Data Analysis. Crit Care Med 2015;43:2155-63. 10.1097/CCM.0000000000001189 [PubMed] [CrossRef] [Google Scholar]
Neto AS, Barbas CSV, Simonis FD, et al. Epidemiological characteristics, practice of ventilation, and clinical outcome in patients at risk of acute respiratory distress syndrome in intensive care units from 16 countries (PRoVENT): an international, multicentre, prospective study. Lancet Respir Med 2016;4:882-93. 10.1016/S2213-2600(16)30305-8 [PubMed] [CrossRef] [Google Scholar]
Beitler JR, Ghafouri TB, Jinadasa SP, et al. Favorable Neurocognitive Outcome with Low Tidal Volume Ventilation after Cardiac Arrest. Am J Respir Crit Care Med 2017;195:1198-206. 10.1164/rccm.2016091771OC [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Simonis FD, Binnekade JM, Braber A, et al. PReVENT–protective ventilation in patients without ARDS at start of ventilation: study protocol for a randomized controlled trial. Trials 2015;16:226. 10.1186/s13063-0150759-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med 2000;342:1301-8. 10.1056/NEJM200005043421801 [PubMed] [CrossRef] [Google Scholar]
Mercat A, Richard JC, Vielle B, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 2008;299:646-55. 10.1001/jama.299.6.646 [PubMed] [CrossRef] [Google Scholar]
Meade MO, Cook DJ, Guyatt GH, et al. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 2008;299:637-45. 10.1001/jama.299.6.637 [PubMed] [CrossRef] [Google Scholar]
Gattinoni L, Marini JJ, Pesenti A, et al. The “baby lung” became an adult. Intensive Care Med 2016;42:663-73. 10.1007/s00134-015-4200-8 [PubMed] [CrossRef] [Google Scholar]
Chiumello D, Carlesso E, Cadringher P, et al. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med 2008;178:346-55. 10.1164/rccm.200710-1589OC [PubMed] [CrossRef] [Google Scholar]
Brower RG, Hubmayr RD, Slutsky AS. Lung stress and strain in acute respiratory distress syndrome: good ideas for clinical management? Am J Respir Crit Care Med 2008;178:323-4. 10.1164/rccm.200805-733ED [PubMed] [CrossRef] [Google Scholar]
Kopp R, Dembinski R, Kuhlen R. Role of extracorporeal lung assist in the treatment of acute respiratory failure. Minerva Anestesiol 2006;72:587-95. [PubMed] [Google Scholar]
Sahetya SK, Mancebo J, Brower RG. Fifty Years of Research in ARDS. Vt Selection in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med 2017;196:1519-25. 10.1164/rccm.201708-1629CI [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Samary CS, Santos RS, Santos CL, et al. Biological Impact of Transpulmonary Driving Pressure in Experimental Acute Respiratory Distress Syndrome. Anesthesiology 2015;123:423-33. 10.1097/ALN.0000000000000716 [PubMed] [CrossRef] [Google Scholar]
Protti A, Cressoni M, Santini A, et al. Lung stress and strain during mechanical ventilation: any safe threshold? Am J Respir Crit Care Med 2011;183:1354-62. 10.1164/rccm.201010-1757OC [PubMed] [CrossRef] [Google Scholar]
Albert RK. The role of ventilation-induced surfactant dysfunction and atelectasis in causing acute respiratory distress syndrome. Am J Respir Crit Care Med 2012;185:702-8. 10.1164/rccm.201109-1667PP [PubMed] [CrossRef] [Google Scholar]
Slutsky AS, Villar J, Pesenti A. Happy 50th birthday ARDS! Intensive Care Med 2016;42:637-9. 10.1007/s00134-016-4284-9 [PubMed] [CrossRef] [Google Scholar]
Fernandez Mondejar E, Vazquez Mata G, Cardenas A, et al. Ventilation with positive end-expiratory pressure reduces extravascular lung water and increases lymphatic flow in hydrostatic pulmonary edema. Crit Care Med 1996;24:1562-7. 10.1097/00003246-199609000-00022 [PubMed] [CrossRef] [Google Scholar]
Retamal J, Borges JB, Bruhn A, et al. Open lung approach ventilation abolishes the negative effects of respiratory rate in experimental lung injury. Acta Anaesthesiol Scand 2016;60:1131-41. 10.1111/aas.12735 [PubMed] [CrossRef] [Google Scholar]
Passaro CP, Silva PL, Rzezinski AF, et al. Pulmonary lesion induced by low and high positive endexpiratory pressure levels during protective ventilation in experimental acute lung injury. Crit Care Med 2009;37:1011-7. 10.1097/CCM.0b013e3181962d85 [PubMed] [CrossRef] [Google Scholar]
Hemmes SN, Gama de Abreu M, Pelosi P, et al. High versus low positive end-expiratory pressure during general anaesthesia for open abdominal surgery (PROVHILO trial): a multicentre randomised controlled trial. Lancet 2014;384:495-503. 10.1016/S0140-6736(14)60416-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Fuller BM, Ferguson IT, Mohr NM, et al. Lung-Protective Ventilation Initiated in the Emergency Department (LOV-ED): A Quasi-Experimental, Before-After Trial. Ann Emerg Med 2017;70:406-18.e4. 10.1016/j.annemergmed.2017.01.013 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Serpa Neto A, Filho RR, Cherpanath T, et al. Associations between positive end-expiratory pressure and outcome of patients without ARDS at onset of ventilation: a systematic review and meta-analysis of randomized controlled trials. Ann Intensive Care 2016;6:109. 10.1186/s13613-016-0208-7 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Costa Leme A, Hajjar LA, Volpe MS, et al. Effect of Intensive vs Moderate Alveolar Recruitment Strategies Added to Lung-Protective Ventilation on Postoperative Pulmonary Complications: A Randomized Clinical Trial. JAMA 2017;317:1422-32. 10.1001/jama.2017.2297 [PubMed] [CrossRef] [Google Scholar]
Brower RG, Lanken PN, MacIntyre N, et al. Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med 2004;351:327-36. 10.1056/NEJMoa032193 [PubMed] [CrossRef] [Google Scholar]
Briel M, Meade M, Mercat A, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis. JAMA 2010;303:865-73. 10.1001/jama.2010.218 [PubMed] [CrossRef] [Google Scholar]
Laffey JG, Bellani G, Pham T, et al. Potentially modifiable factors contributing to outcome from acute respiratory distress syndrome: the LUNG SAFE study. Intensive Care Med 2016;42:1865-76. 10.1007/s00134016-4571-5 [PubMed] [CrossRef] [Google Scholar]
Writing Group for the Alveolar Recruitment for Acute Respiratory Distress Syndrome Trial I , Cavalcanti AB, Suzumura EA, et al. Effect of Lung Recruitment and Titrated Positive End-Expiratory Pressure (PEEP) vs Low PEEP on Mortality in Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. JAMA 2017;318:1335-45. 10.1001/jama.2017.14171 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Talmor D, Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med 2008;359:2095-104. 10.1056/NEJMoa0708638 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Wiedemann HP, Arroliga AC. Acute respiratory distress syndrome: low-stretch ventilation improves survival. Cleve Clin J Med 2000;67:435-40. 10.3949/ccjm.67.6.435 [PubMed] [CrossRef] [Google Scholar]
Vieillard-Baron A, Prin S, Augarde R, et al. Increasing respiratory rate to improve CO2 clearance during mechanical ventilation is not a panacea in acute respiratory failure. Crit Care Med 2002;30:1407-12. 10.1097/00003246-200207000-00001 [PubMed] [CrossRef] [Google Scholar]
Rich PB, Reickert CA, Sawada S, et al. Effect of rate and inspiratory flow on ventilator-induced lung injury. J Trauma 2000;49:903-11. 10.1097/00005373-200011000-00019 [PubMed] [CrossRef] [Google Scholar]
Maeda Y, Fujino Y, Uchiyama A, et al. Effects of peak inspiratory flow on development of ventilatorinduced lung injury in rabbits. Anesthesiology 2004;101:722-8. 10.1097/00000542-200409000-00021 [PubMed] [CrossRef] [Google Scholar]
Garcia CS, Abreu SC, Soares RM, et al. Pulmonary morphofunctional effects of mechanical ventilation with high inspiratory air flow. Crit Care Med 2008;36:232-9. 10.1097/01.CCM.0000295309.69123.AE [PubMed] [CrossRef] [Google Scholar]
Kotani M, Kotani T, Li Z, et al. Reduced inspiratory flow attenuates IL-8 release and MAPK activation of lung overstretch. Eur Respir J 2004;24:238-46. 10.1183/09031936.04.00128703 [PubMed] [CrossRef] [Google Scholar]
Marini JJ. Dynamic hyperinflation and auto-positive end-expiratory pressure: lessons learned over 30 years. Am J Respir Crit Care Med 2011;184:756-62. 10.1164/rccm.201102-0226PP [PubMed] [CrossRef] [Google Scholar]
Caramez MP, Borges JB, Tucci MR, et al. Paradoxical responses to positive end-expiratory pressure in patients with airway obstruction during controlled ventilation. Crit Care Med 2005;33:1519-28. 10.1097/01.CCM.0000168044.98844.30 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Lemyze M, Mallat J, Duhamel A, et al. Effects of sitting position and applied positive end-expiratory pressure on respiratory mechanics of critically ill obese patients receiving mechanical ventilation. Crit Care Med 2013;41:2592-9. 10.1097/CCM.0b013e318298637f [PubMed] [CrossRef] [Google Scholar]
MacIntyre NR, Cook DJ, Ely EW, Jr, et al. Evidence-based guidelines for weaning and discontinuing ventilatory support: a collective task force facilitated by the American College of Chest Physicians; the American Association for Respiratory Care; and the American College of Crit Care Med. Chest 2001;120:375S95S. 10.1378/chest.120.6_suppl.375S [PubMed] [CrossRef] [Google Scholar]
Bock KR, Silver P, Rom M, et al. Reduction in tracheal lumen due to endotracheal intubation and its calculated clinical significance. Chest 2000;118:468-72. 10.1378/chest.118.2.468 [PubMed] [CrossRef] [Google Scholar]
Rocco PR, Zin WA. Modelling the mechanical effects of tracheal tubes in normal subjects. Eur Respir J 1995;8:121-6. 10.1183/09031936.95.08010121 [PubMed] [CrossRef] [Google Scholar]
Kregenow DA, Rubenfeld GD, Hudson LD, et al. Hypercapnic acidosis and mortality in acute lung injury. Crit Care Med 2006;34:1-7. 10.1097/01.CCM.0000194533.75481.03 [PubMed] [CrossRef] [Google Scholar]
Lucangelo U, Bernabe F, Blanch L. Lung mechanics at the bedside: make it simple. Curr Opin Crit Care 2007;13:64-72. 10.1097/MCC.0b013e32801162df [PubMed] [CrossRef] [Google Scholar]
Terragni PP, Rosboch G, Tealdi A, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med 2007;175:160-6. 10.1164/rccm.200607-915OC [PubMed] [CrossRef] [Google Scholar]
Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015;372:747-55. 10.1056/NEJMsa1410639 [PubMed] [CrossRef] [Google Scholar]
Schmidt MFS, Amaral A, Fan E, et al. Driving Pressure and Hospital Mortality in Patients Without ARDS: A Cohort Study. Chest 2018;153:46-54. 10.1016/j.chest.2017.10.004 [PubMed] [CrossRef] [Google Scholar]
Tejerina E, Pelosi P, Muriel A, et al. Association between ventilatory settings and development of acute respiratory distress syndrome in mechanically ventilated patients due to brain injury. J Crit Care 2017;38:341-5. 10.1016/j.jcrc.2016.11.010 [PubMed] [CrossRef] [Google Scholar]
Staffieri F, Stripoli T, De Monte V, et al. Physiological effects of an open lung ventilatory strategy titrated on elastance-derived end-inspiratory transpulmonary pressure: study in a pig model*. Crit Care Med 2012;40:2124-31. 10.1097/CCM.0b013e31824e1b65 [PubMed] [CrossRef] [Google Scholar]
Fumagalli J, Berra L, Zhang C, et al. Transpulmonary Pressure Describes Lung Morphology During Decremental Positive End-Expiratory Pressure Trials in Obesity. Crit Care Med 2017;45:1374-81. 10.1097/CCM.0000000000002460 [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Amato MBP, Grieco DL, et al. Esophageal Manometry and Regional Transpulmonary Pressure in Lung Injury. Am J Respir Crit Care Med 2018;197:1018-26. 10.1164/rccm.201709-1806OC [PubMed] [CrossRef] [Google Scholar]
Loring SH, Pecchiari M, Della Valle P, et al. Maintaining end-expiratory transpulmonary pressure prevents worsening of ventilator-induced lung injury caused by chest wall constriction in surfactant-depleted rats. Crit Care Med 2010;38:2358-64. 10.1097/CCM.0b013e3181fa02b8 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Grasso S, Terragni P, Birocco A, et al. ECMO criteria for influenza A (H1N1)-associated ARDS: role of transpulmonary pressure. Intensive Care Med 2012;38:395-403. 10.1007/s00134-012-2490-7 [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Uchiyama A, Matsuura N, et al. Spontaneous breathing during lung-protective ventilation in an experimental acute lung injury model: high transpulmonary pressure associated with strong spontaneous breathing effort may worsen lung injury. Crit Care Med 2012;40:1578-85. 10.1097/CCM.0b013e3182451c40 [PubMed] [CrossRef] [Google Scholar]
Grieco DL, Chen L, Brochard L. Transpulmonary pressure: importance and limits. Ann Transl Med 2017;5:285. 10.21037/atm.2017.07.22 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Torsani V, Gomes S, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med 2013;188:1420-7. 10.1164/rccm.201303-0539OC [PubMed] [CrossRef] [Google Scholar]
Protti A, Andreis DT, Monti M, et al. Lung stress and strain during mechanical ventilation: any difference between statics and dynamics? Crit Care Med 2013;41:1046-55. 10.1097/CCM.0b013e31827417a6 [PubMed] [CrossRef] [Google Scholar]
Cortes-Puentes GA, Keenan JC, Adams AB, et al. Impact of Chest Wall Modifications and Lung Injury on the Correspondence Between Airway and Transpulmonary Driving Pressures. Crit Care Med 2015;43:e287-95. 10.1097/CCM.0000000000001036 [PubMed] [CrossRef] [Google Scholar]
Baedorf Kassis E, Loring SH, Talmor D. Mortality and pulmonary mechanics in relation to respiratory system and transpulmonary driving pressures in ARDS. Intensive Care Med 2016;42:1206-13. 10.1007/s00134016-4403-7 [PubMed] [CrossRef] [Google Scholar]
Guldner A, Braune A, Ball L, et al. The authors reply. Crit Care Med 2017;45:e328-9. 10.1097/CCM.0000000000002225 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Sahetya SK, Brower RG. Lung Recruitment and Titrated PEEP in Moderate to Severe ARDS: Is the Door Closing on the Open Lung? JAMA 2017;318:1327-9. 10.1001/jama.2017.13695 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Villar J, Suarez-Sipmann F, Kacmarek RM. Should the ART trial change our practice? J Thorac Dis 2017;9:4871-7. 10.21037/jtd.2017.11.01 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Bellani G, Grasselli G, Teggia-Droghi M, et al. Do spontaneous and mechanical breathing have similar effects on average transpulmonary and alveolar pressure? A clinical crossover study. Crit Care 2016;20:142. 10.1186/s13054-016-1290-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Yoshida T, Brochard L. Ten tips to facilitate understanding and clinical use of esophageal pressure manometry. Intensive Care Med 2018;44:220-2. 10.1007/s00134-017-4906-x [PubMed] [CrossRef] [Google Scholar]
Elliott MW, Mulvey DA, Green M, et al. An evaluation of P0.1 measured in mouth and oesophagus, during carbon dioxide rebreathing in COPD. Eur Respir J 1993;6:1055-9. [PubMed] [Google Scholar]
Alberti A, Gallo F, Fongaro A, et al. P0.1 is a useful parameter in setting the level of pressure support ventilation. Intensive Care Med 1995;21:547-53. 10.1007/BF01700158 [PubMed] [CrossRef] [Google Scholar]
Rittayamai N, Beloncle F, Goligher EC, et al. Effect of inspiratory synchronization during pressurecontrolled ventilation on lung distension and inspiratory effort. Ann Intensive Care 2017;7:100. 10.1186/s13613-017-0324-z [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Telias I, Damiani F, Brochard L. The airway occlusion pressure (P0.1) to monitor respiratory drive during mechanical ventilation: increasing awareness of a not-so-new problem. Intensive Care Med 2018;44:1532-5. 10.1007/s00134-018-5045-8 [PubMed] [CrossRef] [Google Scholar]
Field S, Sanci S, Grassino A. Respiratory muscle oxygen consumption estimated by the diaphragm pressure-time index. J Appl Physiol Respir Environ Exerc Physiol 1984;57:44-51. [PubMed] [Google Scholar]
Sassoon CS, Mahutte CK. Work of breathing during mechanical ventilation. In: Marini JJ SA, editor. Physiological Basis of Ventilatory Support. New York: Marcel Dekker; 1998, p. 261-310. [Google Scholar]
Tonetti T, Vasques F, Rapetti F, et al. Driving pressure and mechanical power: new targets for VILI prevention. Ann Transl Med 2017;5:286. 10.21037/atm.2017.07.08 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Guerin C, Papazian L, Reignier J, et al. Effect of driving pressure on mortality in ARDS patients during lung protective mechanical ventilation in two randomized controlled trials. Critical Care 2016;20:384. 10.1186/s13054-016-1556-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Marini JJ, Jaber S. Dynamic predictors of VILI risk: beyond the driving pressure. Intensive Care Med 2016;42:1597-600. 10.1007/s00134-016-4534-x [PubMed] [CrossRef] [Google Scholar]