Luca Salvatore Menga, Luca Delle Cese, Filippo Bongiovanni, Gianmarco Lombardi, Teresa Michi, Filippo Luciani, Marta Cicetti, Jacopo Timpano, Maria Cristina Ferrante, Melania Cesarano, Gian Marco Anzellotti, Tommaso Rosà, Daniele Natalini, Eloisa S Tanzarella, Salvatore Lucio Cutuli, Gabriele Pintaudi, Gennaro De Pascale, Antonio M Dell’Anna, Giuseppe Bello, Mariano Alberto Pennisi, Salvatore Maurizio Maggiore, Riccardo Maviglia, Domenico Luca Grieco and Massimo Antonelli
Respiratory Care May 2021, 66 (5) 705-714; DOI: https://doi.org/10.4187/respcare.08622
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
BỐI CẢNH: Hiệu quả của chiến lược oxygen hóa không xâm lấn (noninvasive oxygenation strategies, NIOS) trong điều trị bệnh COVID-19 vẫn chưa được biết. Chúng tôi đã tiến hành một nghiên cứu quan sát tiền cứu để đánh giá tỷ lệ thất bại NIOS ở các đối tượng được điều trị tại ICU vì suy hô hấp giảm oxy máu do COVID-19.
PHƯƠNG PHÁP: Những bệnh nhân được điều trị đầu tay NIOS vì suy hô hấp giảm oxy máu do COVID-19 tại ICU của một bệnh viện đại học được đưa vào nghiên cứu này; dữ liệu xét nghiệm được thu thập khi nhập viện, và kết quả 28 ngày được ghi lại. Sau khi đối sánh điểm xu hướng dựa trên điểm Sinh lý học cấp tính đơn giản (SAPS) II, tuổi, PaO2/FiO2 và PaCO2 khi nhập viện, tỷ lệ thất bại NIOS ở những đối tượng có COVID-19 được so sánh với một nhóm thuần tập đã được công bố trước đó nhận NIOS trong tình trạng suy hô hấp giảm oxy máu do đến các nguyên nhân khác.
KẾT QUẢ: Tổng số 85 đối tượng được điều trị đầu tay với NIOS. Các phương pháp được sử dụng thường xuyên nhất là thông khí không xâm lấn bằng mũ trùm đầu (helmet) và ống thông mũi có lưu lượng cao (HFNC); trong số này, 52 đối tượng (61%) yêu cầu đặt nội khí quản. Các yếu tố độc lập liên quan đến thất bại NIOS là điểm SAPS II (P = 0,009) và lactate dehydrogenase huyết thanh lúc nhập viện (P = 0,02); Sự kết hợp của điểm SAPS II ≥ 33 với lactate dehydrogenase huyết thanh ≥ 405 đơn vị/L lúc nhập viện ICU có độ đặc hiệu 91% trong dự đoán cần đặt nội khí quản. Trong các nhóm nghiên cứu phù hợp với xu hướng (54 cặp), đối tượng có COVID-19 cho thấy nguy cơ thất bại NIOS cao hơn so với những người có các nguyên nhân khác gây suy hô hấp giảm oxy máu (59% so với 35%, P = 0,02), với tỷ lệ nguy cơ được điều chỉnh là 2 (KTC 95% 1,1–3,6, P = 0,01).
KẾT LUẬN: So với suy hô hấp giảm oxy máu do các nguyên nhân khác, các đối tượng mắc COVID19 được điều trị bằng NIOS trong ICU có nguy cơ thất bại cao hơn gấp 2 lần. Đối tượng có điểm SAPS II ≥ 33 và lactate dehydrogenase huyết thanh ≥ 405 đơn vị/L đại diện cho quần thể có nguy cơ cao nhất.
Quick look
Kiến thức hiện tại
Các chiến lược oxygen hóa không xâm lấn được sử dụng rộng rãi để điều trị suy hô hấp giảm oxy máu cấp tính do COVID-19 và các căn nguyên khác. Mặc dù có khả năng có lợi, nhưng các chiến lược này có nguy cơ chậm đặt nội khí quản và tổn thương phổi do bệnh nhân tự gây ra, và cần phải thận trọng.
Bài báo này đóng góp gì cho kiến thức của chúng ta
Những đối tượng có COVID-19 được sử dụng chiến lược oxy không xâm lấn trong ICU do suy hô hấp cấp giảm oxy máu có nguy cơ đặt nội khí quản cao gấp 2 lần so với những đối tượng bị suy hô hấp giảm oxy máu có nguồn gốc khác. Trong bệnh COVID-19, sự cải thiện oxy do NIOS gây ra không thể dự đoán thành công điều trị; tuy nhiên, điểm SAPS II cao hơn và lactate dehydrogenase huyết thanh có liên quan độc lập với thất bại điều trị.
Giới thiệu
Mặc dù các hướng dẫn quốc tế đã không thể đưa ra các khuyến nghị về việc sử dụng các chiến lược oxygen hóa không xâm lấn (NIOS) để điều trị sớm suy hô hấp giảm oxy máu cấp tính,1–3 nhưng NIOS đã được sử dụng rộng rãi trong đại dịch COVID-19, cả vì hạn chế về nguồn lực và sự tin tưởng của bác sĩ lâm sàng vào công cụ này.4
Cần thận trọng khi sử dụng NIOS, bao gồm ống thông mũi có lưu lượng cao (HFNC), CPAP và thông khí không xâm lấn (NIV), để điều trị suy hô hấp giảm oxy máu.5 Duy trì nhịp thở tự phát trong suy hô hấp giảm oxy máu có thể cho thấy một số lợi ích,6–12 nhưng nó mang lại nguy cơ vốn có của tổn thương phổi tự gây ra,12–17 đặt nội khí quản chậm và tăng tỷ lệ tử vong.18,19 Những cân nhắc này giúp lựa chọn bệnh nhân cẩn thận và phân tích các yếu tố nguy cơ để hạn chế tỷ lệ thất bại điều trị và đặt nội khí quản chậm trễ.20,21
Tỷ lệ thất bại NIOS thay đổi đã được báo cáo trong các đại dịch virus khác,22-26 nhưng ít dữ liệu làm sáng tỏ việc sử dụng NIOS trong suy hô hấp giảm oxy máu cấp tính do COVID-19 trong ICU.27,28 Chúng tôi đã tiến hành một nghiên cứu quan sát, tiền cứu để mô tả kết quả của những đối tượng bị bệnh nặng với giảm oxy máu do COVID-19 đã được điều trị NIOS đầu tay, để xác định các yếu tố dự báo sớm có thể xảy ra thất bại điều trị, và so sánh tỷ lệ đặt nội khí quản của đối tượng có COVID-19 với tỷ lệ của đối tượng đối chứng phù hợp trước đây bị ảnh hưởng bởi các nguyên nhân khác gây suy hô hấp cấp giảm oxy máu.
Phương pháp
Thiết kế nghiên cứu
Nghiên cứu quan sát, tiềm năng này được thực hiện tại Fondazione Policlinico Universitario A. Gemelli IRCCS ở Ý. Sự phê duyệt đã được cấp bởi hội đồng đánh giá thể chế địa phương, và sự đồng ý được thông báo theo các khuyến nghị của ủy ban.
Tất cả bệnh nhân người lớn liên tiếp nhập viện ICU trong khoảng thời gian từ ngày 12 tháng 3 đến ngày 20 tháng 4 do suy hô hấp giảm oxy máu với chẩn đoán vi sinh được xác nhận là COVID-19 (được định nghĩa là PCR-RT dương tính đối với RNA vi rút được thực hiện trên mẫu bệnh phẩm đường hô hấp trên hoặc dưới) những người được thở oxy không xâm lấn (tức là NIV hoặc ống thông mũi có lưu lượng cao) như là phương pháp điều trị đầu tiên cho suy hô hấp giảm oxy máu được đưa vào phân tích. Suy hô hấp giảm oxy máu được định nghĩa là các triệu chứng khởi phát cấp tính và PaO2/FiO2 29 COPD nặng, bệnh hô hấp mãn tính cần điều trị oxy trước khi nhập viện và các chỉ định không đặt nội khí quản là những tiêu chí loại trừ chính.
Đối tượng nhận được NIOS theo sự lựa chọn của bác sĩ tham gia: các thiết bị có sẵn trong ICU của chúng tôi là NIV qua mũ trùm đầu, NIV qua mặt nạ và ống thông mũi lưu lượng cao. Giao diện cho NIOS, thời gian điều trị, cũng như mọi quyết định lâm sàng khác đều do bác sĩ phụ trách lâm sàng đưa ra.
Dữ liệu nhân khẩu học, lâm sàng và xét nghiệm sau đây được thu thập khi nhập viện: tuổi, giới tính, Điểm sinh lý cấp tính đơn giản (SAPS) II, các bệnh cơ bản, D-dimer, nitơ urê máu, bilirubin toàn phần, ferritin, protein phản ứng C, lactate dehydrogenase (LDH) và số lượng tế bào bạch huyết. Phân tích khí máu động mạch được thực hiện khi đến ICU, 1 giờ và 6 giờ sau khi bắt đầu NIOS, và sau đó trên cơ sở 24 giờ cho đến khi xuất khỏi ICU. Thời gian điều trị NIOS, thất bại điều trị (tức là cần đặt nội khí quản) trong vòng 28 ngày, và kết quả lâm sàng 28 ngày được thu thập tiền cứu.
Các đối tượng tham gia với COVID-19 được so sánh với nhóm đối chứng của các đối tượng bị suy hô hấp giảm oxy máu và thâm nhiễm hai bên do các nguyên nhân khác, những người đã nhận NIOS trong một nghiên cứu quan sát trước đây được thực hiện trong cùng bối cảnh lâm sàng với cách tiếp cận tương tự.30 Một-đối-một đối tượng khớp điểm xu hướng giữa các đối tượng có COVID-19 và các đối tượng kiểm soát lịch sử đã được thực hiện. Ba nhà điều tra (DLG, SMM và MA) đã chọn ưu tiên các biến để so khớp: PaO2/FiO2 và PaCO2 khi đăng ký, điểm SAPS II và tuổi. Những yếu tố này đại diện cho các yếu tố được thừa nhận rộng rãi liên quan đến nhu cầu đặt nội khí quản ở các đối tượng trải qua NIV vì suy hô hấp giảm oxy máu.18–20,30 Các đối tượng có điểm số xu hướng tương tự trong 2 nhóm được đối sánh (đối sánh 1:1 mà không cần thay thế), sử dụng thước cặp của độ lệch chuẩn 0,15 của logit của điểm xu hướng. Để phù hợp, các đối tượng có COVID-19 được dùng ống thông mũi có lưu lượng cao một mình đã bị loại trừ. Sự lựa chọn này được thúc đẩy bởi sự vắng mặt của các đối tượng được điều trị bằng ống thông mũi có lưu lượng cao trong nhóm thuần tập lịch sử.
Điểm kết thúc
Mục tiêu chính của nghiên cứu này là mô tả tỷ lệ đặt nội khí quản của bệnh nhân giảm oxy máu được điều trị NIOS trong ICU do COVID-19. Mục tiêu phụ là xác định các yếu tố sớm liên quan đến nhu cầu đặt nội khí quản và báo cáo bất kỳ sự khác biệt nào về kết quả với nhóm thuần tập lịch sử.
Cuối cùng, chúng tôi tách các đối tượng có COVID19 được đặt nội khí quản sau NIOS thành 2 nhóm theo thời gian trung bình từ khi bắt đầu điều trị và thất bại, và so sánh kết quả lâm sàng 28 ngày trong 2 nhóm này. Trong cả nhóm thuần tập COVID-19 và nhóm thuần tập lịch sử, quyết định đặt nội khí quản và bất kỳ quyết định lâm sàng nào khác đều do bác sĩ phụ trách lâm sàng đưa ra, độc lập với các quy trình nghiên cứu.
Phân tích thống kê
Tại thời điểm thiết kế nghiên cứu, thiếu dữ liệu có hệ thống về NIOS ở các đối tượng có COVID-19. Do đó, để cung cấp báo cáo kịp thời, chúng tôi quyết định đánh giá các bệnh nhân ghi danh đã được điều trị tại ICU của chúng tôi cho đến ngày 20 tháng 4 năm 2020.
Dữ liệu được báo cáo dưới dạng trung vị (phạm vi liên phần tư [IQR]) hoặc tỷ lệ, nếu thích hợp. Kiểm tra t Student, kiểm tra tổng hạng Wilcoxon, kiểm tra Kruskal-Wallis, kiểm tra chi bình phương, và kiểm tra Fisher được sử dụng để so sánh đơn biến, nếu thích hợp. Các phân tích bổ sung được thực hiện để tách biệt các phân tích về tỷ lệ sống sót liên quan đến thời gian điều trị thất bại và thời gian tử vong cho đến ngày 28 bằng cách sử dụng bài kiểm tra xếp hạng nhật ký; Các đường cong Kaplan-Meier được hiển thị cho hầu hết các kết quả quan trọng. Hồi quy cox được sử dụng để điều tra mối quan hệ giữa các hiệp biến tiềm năng và kết quả (ví dụ: thất bại NIOS, tử vong 28 ngày). Tất cả các biến có P ≤ 0,05 trong phân tích đơn biến đều được đưa vào phân tích đa biến. Đối với tất cả các thử nghiệm, P 2 mặt ≤ 0,05 được coi là có ý nghĩa. Phân tích thống kê được thực hiện với SPSS 26.0 (IBM, Armonk, New York) và MATLAB (MathWorks, Natick, Massachusetts). Các số liệu bản thảo được chuẩn bị bằng GraphPad Prism (La Jolla, California).
Các kết quả
Đặc điểm đối tượng nghiên cứu
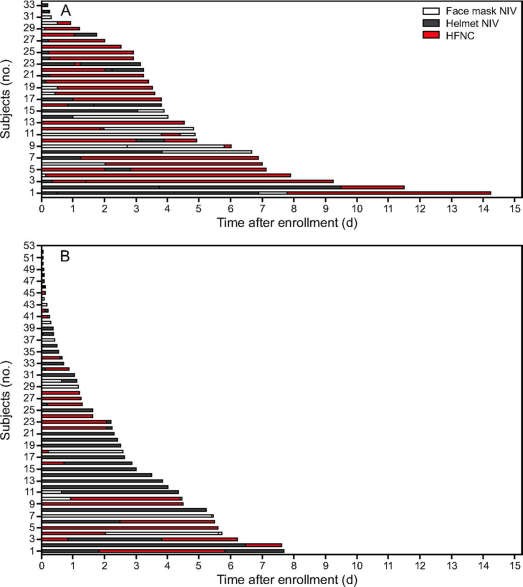
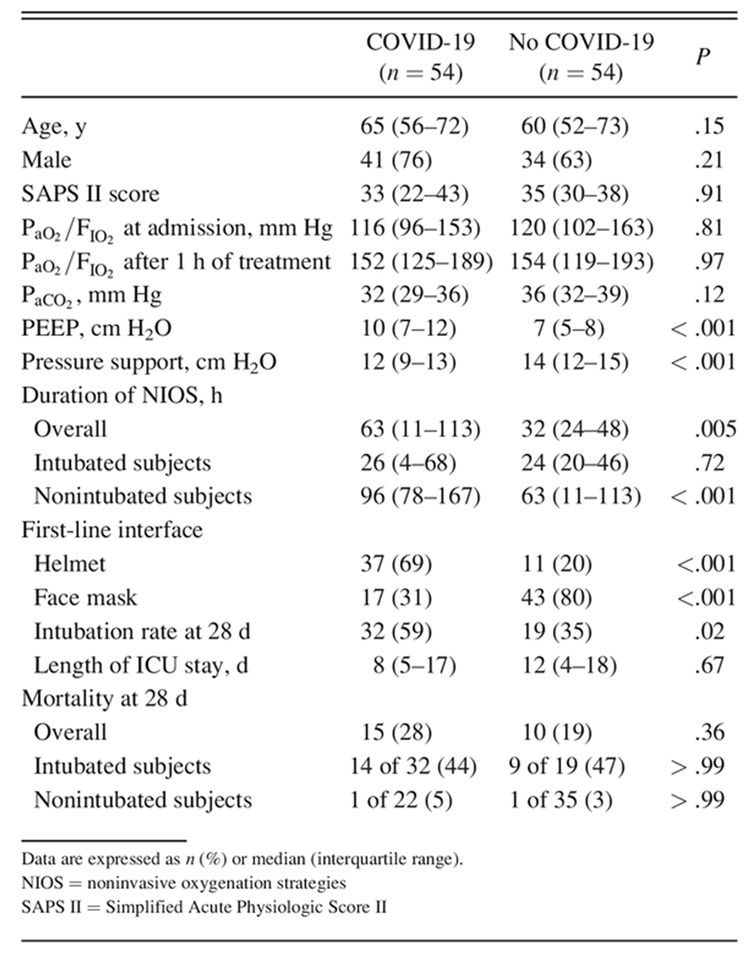
Tính đến ngày 20 tháng 4 năm 2020, 120 bệnh nhân mắc COVID-19 đã được nhận vào ICU của cơ sở chúng tôi. 85 đối tượng được điều trị đầu tiên với NIOS (Hình 1) do suy hô hấp cấp giảm oxy máu. Đặc điểm lâm sàng của các đối tượng được hiển thị trong Bảng 1. Giao diện được sử dụng nhiều nhất là NIV mũ trùm đầu, tiếp theo là ống thông mũi lưu lượng cao và NIV qua mặt nạ (Bảng 1). Ở các đối tượng được điều trị bằng NIV, PEEP trung bình là 10 cm H2O (IQR 7–12), và hỗ trợ áp lực là 12 cm H2O (IQR 10–14). Trong khi thông mũi với lưu lượng cao, lưu lượng 50-60 L/phút ban đầu được áp dụng cho tất cả các đối tượng được điều trị. NIOS được sử dụng trong thời gian trung bình là 66 giờ (IQR 21–109); nhóm tránh đặt nội khí quản được NIOS trong thời gian lâu hơn (thời gian trung bình, 91 giờ (IQR 71–153) (Hình 2, Bảng 1).
Hình 1. Sơ đồ nghiên cứu (xin xem bản gốc).
Điều trị thất bại
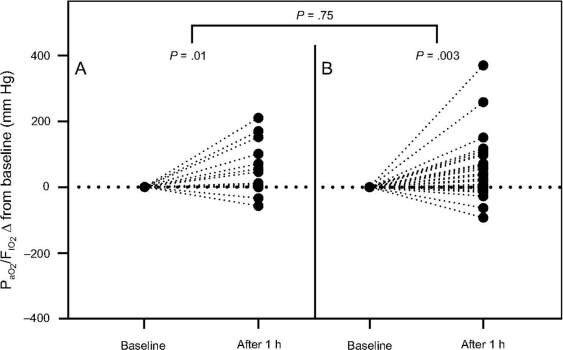
Năm mươi hai (61%) đối tượng cần đặt nội khí quản. Tất cả các đối tượng được đặt nội khí quản do thiếu oxy và khó thở không cải thiện, trong khi không có đối tượng nào phát triển chứng tăng CO2 máu trong NIOS. Khi nhập viện, PaO2/FiO2 thấp hơn một chút ở những đối tượng sau đó cần đặt nội khí quản (Bảng 1). Tuy nhiên, sau 1 giờ NIOS, PaO2/FiO2 tăng lên ở cả những đối tượng được đặt nội khí quản sau đó và những người không được đặt nội khí quản (Hình 3). PaCO2 không khác biệt giữa các nhóm và không thay đổi sau 1 giờ điều trị.
Hình 2. Quản lý đối tượng sau khi khi đưa vào nghiên cứu. A: Đối tượng thành công trong quá trình oxygen hóa không xâm lấn, và B: đối tượng thất bại trong quá trình oxygen hóa không xâm lấn (tức là đã đặt nội khí quản). Mỗi thanh đại diện cho một đối tượng duy nhất được điều trị theo thời gian. NIV = thông khí không xâm lấn; HFNC = ống thông mũi có lưu lượng cao.
Bảng 1. Đặc điểm và kết quả lâm sàng của các đối tượng nhận NIOS
Hình 3. Các đối tượng được điều trị bằng chiến lược oxygen hóa không xâm lấn đã cải thiện PaO2/FiO2 bất kể nhu cầu đặt nội khí quản sau đó. Sự thay đổi PaO2/FiO2 gây ra bởi các chiến lược oxygen hóa không xâm lấn không khác biệt đáng kể giữa những đối tượng tránh được đặt NKQ (A) hoặc những người cần (B) đặt nội khí quản trong vòng 28 ngày kể từ ngày bắt đầu điều trị.
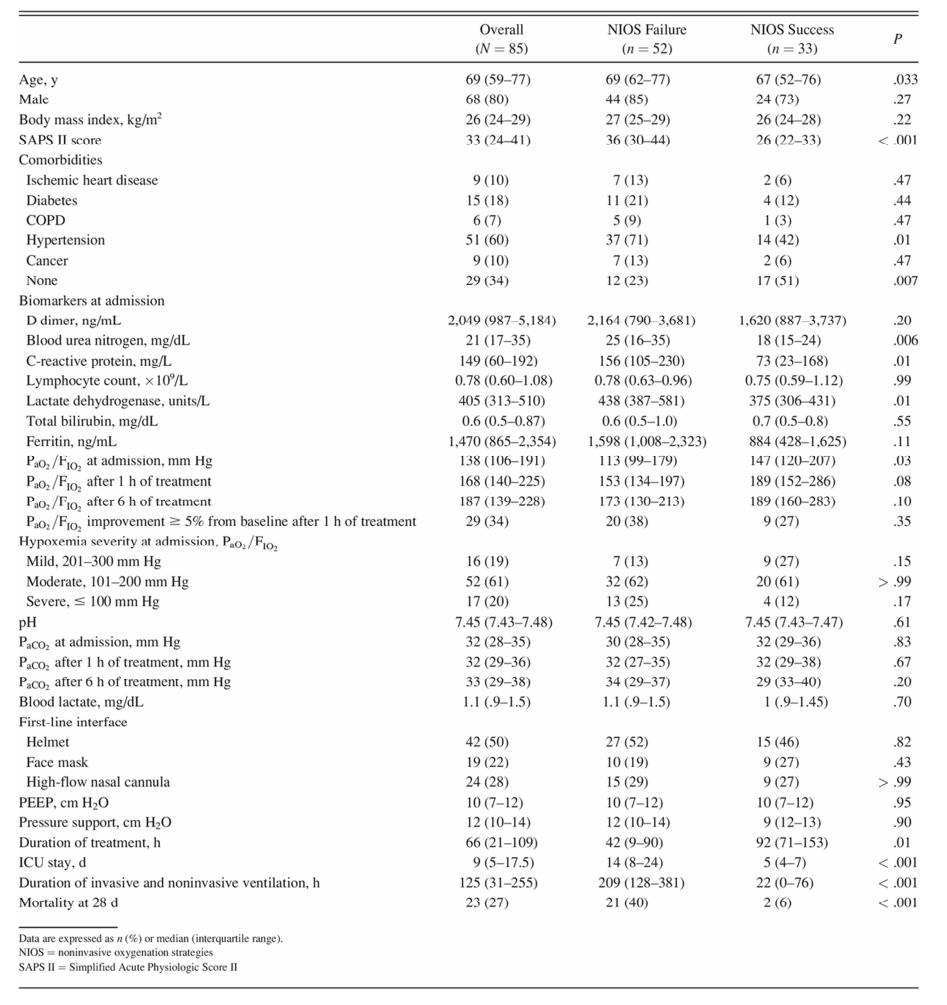
Trong phân tích đơn biến, các đối tượng yêu cầu đặt nội khí quản lớn tuổi hơn (tỷ lệ chênh lệch chưa điều chỉnh cho độ tuổi 1,04 [95% CI 1,01–1,08]), có điểm SAPS II cao hơn (tỷ số chênh 1,10 [95% CI 1,04–1,16]), nhiều hơn thường bị ảnh hưởng bởi tăng huyết áp (tỷ số chênh 3,3 [95% CI 1,3–8,4]), có nitơ urê máu cao hơn (tỷ số chênh 1,073 [95% CI 1,024–1,13]), và LDH huyết thanh (tỷ số chênh 1,005 [95% CI 1,001– 1,009]).
Trong phân tích hồi quy Cox, các yếu tố độc lập liên quan đến thất bại NIOS là điểm SAPS II (tỷ lệ nguy cơ được điều chỉnh trên mỗi đơn vị tăng 1,039 [95% CI 1,018–1,061], P
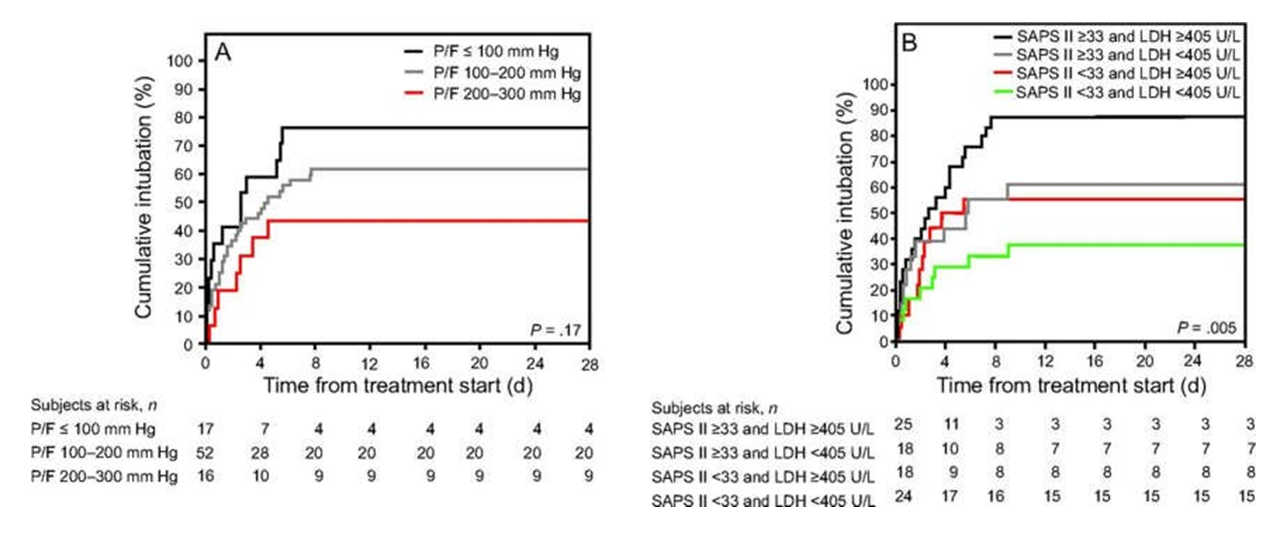
Hình 4. Đường cong Kaplan-Meier của tỷ lệ tích lũy của đặt nội khí quản theo mức độ nghiêm trọng của tình trạng giảm oxy máu khi bắt đầu điều trị (A) và theo điểm số SAPS II và lactate dehydrogenase huyết thanh (LDH) khi nhập viện (B), là các yếu tố liên quan độc lập với thất bại điều trị.
Chúng tôi phân tách các đối tượng theo điểm SAPS II và mức LDH trung bình (giá trị trung bình lần lượt là 33 và 405 đơn vị/L). Tỷ lệ đặt nội khí quản cao hơn ở đối tượng có điểm SAPS II ≥ 33 và LDH ≥ 405 đơn vị/L (88% [95% CI 74–99]; độ nhạy và độ đặc hiệu của đặt nội khí quản lần lượt là 43% và 91%) giá trị dự đoán dương tính 88% và giá trị dự đoán âm 50%) và thấp hơn ở những đối tượng có cả điểm SAPS II
Chúng tôi phân tầng các đối tượng theo thời gian điều trị trung bình trước khi đặt nội khí quản và phân loại đối tượng là “thất bại sớm” và “thất bại muộn” (tức là ≤ 42 và> 42 h, tương ứng). Các nhóm này không cho thấy sự khác biệt đáng kể về các đặc điểm cơ bản và có tỷ lệ tử vong 28 ngày tương tự (42% so với 38%, P> 0,99) (xem tài liệu bổ sung tại http://www.rcjournal.com). Sự khác biệt không đáng kể về tỷ lệ tử vong giữa 2 nhóm này đã được xác nhận sau khi điều chỉnh theo tuổi, điểm SAPS II và PaO2/FiO2 khi nhập viện, với tỷ lệ nguy cơ đối với nhóm thất bại muộn/sớm là 1,3 (KTC 95% 0,5– 3,3) (P = .54).
Suy hô hấp giảm oxy máu và covid-19
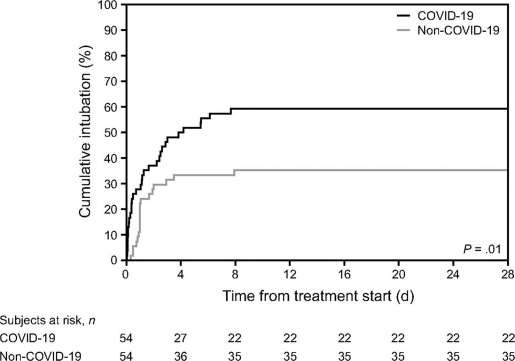
54 đối tượng với COVID-19 được kết hợp với 54 đối tượng bị suy hô hấp giảm oxy máu do các nguyên nhân khác. Nhân khẩu học của các nhóm đối sánh này được trình bày chi tiết trong Bảng 2. Các đối tượng mắc COVID-19 chủ yếu được điều trị bằng NIV mũ trùm đầu, trong khi các đối tượng bị suy hô hấp giảm oxy máu do các nguyên nhân khác chủ yếu trải qua NIV qua mặt nạ với PEEP thấp hơn và hỗ trợ áp lực cao hơn. Tỷ lệ đặt nội khí quản cao hơn ở những đối tượng có COVID-19 (59% so với 35%, P = 0,02). Sự khác biệt này vẫn có ý nghĩa sau khi điều chỉnh độ tuổi, điểm SAPS II và PaO2/FiO2 khi đưa vào nghiên cứu, với tỷ lệ nguy cơ đối với các đối tượng có COVID-19 là 2,0 (KTC 95% 1,1–3,6) (Hình 5).
Thảo luận
Kết quả của nghiên cứu này về việc sử dụng NIOS để điều trị các đối tượng mắc COVID-19 có thể được tóm tắt như sau. Đầu tiên, việc sử dụng NIOS như một phương pháp điều trị đầu tiên đối với bệnh COVID-19 đã phổ biến trong ICU của chúng tôi; 61% đối tượng được NIOS yêu cầu thở máy xâm nhập trong vòng 28 ngày kể từ khi bắt đầu điều trị. Thứ hai, những thay đổi do NIOS gây ra trong PaO2/FiO2 sau 1 giờ điều trị không dự đoán được thành công của việc điều trị. Thứ ba, chỉ số SAPS II và LDH huyết thanh là những yếu tố có khả năng tiên lượng nhu cầu đặt nội khí quản. Cuối cùng, so với một nhóm thuần tập lịch sử phù hợp với xu hướng của các đối tượng bị suy hô hấp cấp giảm oxy máu do các nguyên nhân khác, các đối tượng có COVID-19 cho thấy nguy cơ thất bại NIOS cao hơn.
Hình 5. Sau khi đối sánh điểm xu hướng với một nhóm thuần tập lịch sử, các đối tượng có COVID19 được điều trị bằng chiến lược oxygen hóa không xâm lấn có tỷ lệ đặt nội khí quản cao hơn so với các đối tượng bị suy hô hấp cấp giảm oxy máu do các nguyên nhân khác. Sự khác biệt này vẫn có ý nghĩa sau khi điều chỉnh độ tuổi, SAPS II, và Hình ảnh nhúng khi đưa vào nghiên cứu, với tỷ lệ nguy cơ là 2,0 (95% CI 1,1–3,6) đối với các đối tượng có COVID-19.
NIOS thường được sử dụng để điều trị suy hô hấp cấp giảm oxy máu, nhưng tính an toàn và hiệu quả của nó còn đang được tranh cãi.6 Đại dịch COVID19 đang gây căng thẳng cho các nguồn lực chăm sóc quan trọng và việc sử dụng NIOS là phổ biến trong các cơ sở lâm sàng không đồng nhất.3 Tuy nhiên, liệu bệnh nhân COVID-19 có thể hưởng lợi từ NIOS ở mức độ nào và ở mức độ nào thì vẫn chưa được biết. Trong một số báo cáo sơ bộ, ống thông mũi có lưu lượng cao đã được sử dụng để điều trị bệnh nhân mắc bệnh COVID-19; trong khi nó có vẻ hiệu quả ở những đối tượng bị giảm oxy máu nhẹ (ví dụ: PaO2/FiO2 > 200 mm Hg), nó có tỷ lệ thất bại cao ở những đối tượng bị giảm oxy máu nặng hơn.31,32 Theo hiểu biết của chúng tôi, đây là nghiên cứu đầu tiên được thiết kế đặc biệt để đánh giá tỷ lệ và các yếu tố dự báo suy NIOS ở các đối tượng được điều trị COVID-19 trong cơ sở ICU, và để xác định xem có sự khác biệt nào tồn tại với suy hô hấp cấp giảm oxy máu do các nguyên nhân khác hay không.
Bảng 2. Đặc điểm và kết quả lâm sàng của các đối tượng nhận NIOS có hoặc không có COVID-19
Tỷ lệ thất bại nios
Chúng tôi báo cáo tỷ lệ thất bại NIOS cao (61%); trong suy hô hấp giảm oxy huyết cấp tính do các nguyên nhân khác, thất bại NIOS có thể ảnh hưởng bất lợi đến kết quả lâm sàng bằng cách trì hoãn đặt nội khí quản và tự gây tổn thương phổi trong khi điều trị.13,33,34 Trong khi điều này chưa được chứng minh ở bệnh nhân COVID-19, mức cao tỷ lệ thất bại được quan sát trong nhóm thuần tập của chúng tôi nhắc nhở việc phát hiện các yếu tố dự báo dễ sử dụng có thể dự đoán nhu cầu đặt nội khí quản trong bệnh COVID-19. Trong suy hô hấp giảm oxy máu do các nguyên nhân khác, việc không cải thiện PaO2/FiO2 sau 1 giờ NIOS có liên quan đến thất bại NIOS. 20,30,35 Ngược lại, các đối tượng có COVID19 đã cải thiện các giá trị PaO2/FiO2 bất kể nhu cầu đặt nội khí quản sau đó. Điều này có thể đại diện cho một đặc điểm cụ thể của bệnh và phù hợp với các báo cáo trước đây cho thấy sự cải thiện đáng kể do PEEP gây ra trong quá trình oxygen hóa trong giai đoạn đầu của suy hô hấp COVID-19.36,37 Trong kết quả của chúng tôi, 97% đối tượng được thở máy xâm nhập đã cải thiện quá trình oxygen hóa với PEEP cao hơn, bất kể khả năng huy động.38 Những kết quả này đảm bảo việc theo dõi cẩn thận các đối tượng mắc COVID-19 được điều trị bằng NIOS, do không có khả năng dự đoán kết quả từ đáp ứng với oxy ban đầu.
Điểm SAPS II và LDH huyết thanh là các yếu tố độc lập liên quan đến thất bại NIOS ở những đối tượng có COVID-19. Các thông số này có thể được đánh giá dễ dàng trong hầu hết các tình huống lâm sàng. Điểm số SAPS II bao gồm tuổi tác, mức độ suy giảm oxy, rối loạn chức năng cơ quan và các bệnh đi kèm có liên quan nhất; kết quả này dường như phù hợp với dữ liệu từ các đối tượng bị suy hô hấp cấp giảm oxy máu do các nguyên nhân khác, trong đó điểm SAPS II > 34 đại diện cho một yếu tố nguy cơ độc lập đối với thất bại điều trị. 20,30 LDH huyết thanh là một enzym tế bào chất chứa trong tất cả các hệ thống cơ quan. Sự xuất hiện của nó trong huyết thanh phản ánh sự tổn thương tế bào. Mặc dù có độ nhạy cao, LDH huyết thanh kém đặc hiệu với tổn thương phổi.39 Tuy nhiên, trong giai đoạn đầu của bệnh, bệnh nhân COVID-19 thường phát triển tổn thương phổi riêng biệt, điều này có thể làm tăng tính đặc hiệu của enzym này trong việc phân tầng mức độ nghiêm trọng của tổn thương phổi. trong giai đoạn đầu của bệnh COVID-19.
Trong nhóm thuần tập của chúng tôi, những đối tượng có điểm SAPS II cao và giá trị LDH huyết thanh cao cho thấy khả năng đặt nội khí quản gần 90%, trong khi những đối tượng có LDH thấp và điểm SAPS II thấp được điều trị thành công bằng NIOS trong > 70% trường hợp. Để tránh việc đặt nội khí quản bị trì hoãn, điều trị NIOS đầu tay chỉ nên dành riêng cho những bệnh nhân có khả năng thành công cao trong điều trị; từ quan điểm kết quả của chúng tôi, có vẻ khôn ngoan khi đề xuất rằng điều trị đầu tay với NIOS nên tránh ở những bệnh nhân có điểm SAPS II và giá trị LDH huyết thanh cao.
Kết quả lâm sàng
Đối tượng được điều trị bằng NIOS có tỷ lệ tử vong 28% ở 28 ngày, phù hợp với dữ liệu hiện có về tỷ lệ tử vong do COVID-19 trong ICU.4 Tỷ lệ tử vong của đối tượng cần đặt nội khí quản là 42%, trong khi tỷ lệ này ở nhóm là 6% NIOS đã thành công.
Sau khi phân tầng các đối tượng cần đặt nội khí quản theo thời gian điều trị NIOS, chúng tôi ghi nhận tỷ lệ tử vong tương tự ở các đối tượng được đặt nội khí quản sớm hơn hoặc muộn hơn, tức là 2 nhóm tương tự nhau về bệnh đi kèm và mức độ nghiêm trọng của giảm oxy máu. Các đối tượng tham gia vào nghiên cứu của chúng tôi được điều trị bằng các phương pháp NIOS khác nhau, nhưng chủ yếu là với NIV qua mũ trùm đầu PEEP cao. PEEP cao trong quá trình thở tự phát làm giảm nỗ lực thở và tăng cường tính đồng nhất của phổi, hạn chế nguy cơ tự gây tổn thương phổi.40–42 Việc lựa chọn giao diện mũ trùm đầu có thể góp phần hạn chế nguy cơ tiến triển tổn thương phổi trong quá trình điều trị, có thể giảm thiểu bất kỳ ảnh hưởng bất lợi của việc đặt nội khí quản chậm trễ trên kết quả lâm sàng. Tuy nhiên, do cỡ mẫu tương đối nhỏ, nên không đưa ra kết luận về tính an toàn của các phương pháp điều trị NIOS kéo dài mà theo hiểu biết của chúng tôi là nên tránh.43
Tác động của covid-19
Sau khi đối sánh 1:1 về mức độ bệnh và độ tuổi, chúng tôi so sánh tỷ lệ thất bại NIOS ở những bệnh nhân bị COVID-19 và suy hô hấp cấp giảm oxy máu với những đối tượng bị suy hô hấp cấp giảm oxy máu do các nguyên nhân khác. Tỷ lệ đặt nội khí quản cao hơn đáng kể ở những đối tượng có COVID-19 (59% so với 35%). Đặt nội khí quản là một quyết định lâm sàng; trong khi các tiêu chí đặt nội khí quản được xác định trước trong nhóm đối chứng đã có sẵn,30 điều này không xảy ra đối với các đối tượng có COVID-19 và có thể tạo thành một giới hạn so sánh. Tuy nhiên, trong khi điều này không được xác định bởi một giao thức của tổ chức, trong tổ chức của chúng tôi, một thử nghiệm NIOS ≥ 1 giờ đã được phép; nếu một đối tượng không cải thiện đáng kể theo bác sĩ điều trị (ví dụ, khó thở dai dẳng, thở nhanh, kích hoạt các cơ hô hấp phụ, không có khả năng bảo vệ đường thở, nhiều dịch tiết khí quản, huyết động không ổn định), họ được đặt nội khí quản kịp thời để tránh tự gây tổn thương phổi.
Có thể các đặc điểm không phải thông khí (ví dụ, liên quan đến vi mạch của bệnh và không có phương pháp điều trị căn nguyên) đóng một vai trò quan trọng trong việc xác định kết quả điều trị NIOS trong bệnh COVID-19. Sự so sánh này củng cố thông điệp chung của nghiên cứu này, trong đó đề cập đến sự thận trọng trong việc sử dụng NIOS trong bệnh COVID-19.
Trong nghiên cứu của chúng tôi, các đối tượng mắc COVID-19 được điều trị chủ yếu bằng NIV qua mũ trùm đầu, mức PEEP cao hơn và hỗ trợ áp lực thấp hơn, trong khi các đối tượng kiểm soát được điều trị chủ yếu bằng NIV qua mặt nạ. Chúng tôi cố ý loại trừ các đối tượng mắc COVID-19 được dùng ống thông mũi có lưu lượng cao một mình khỏi so sánh vì phương pháp điều trị này không khả dụng khi nghiên cứu thuần tập lịch sử. Sự khác biệt trong các giao diện và cài đặt được sử dụng phản ánh sự phát triển của hỗ trợ hô hấp NIOS trong suy hô hấp cấp giảm oxy máu13; điều này không làm thay đổi, và thậm chí có thể củng cố ý nghĩa của cuộc điều tra này, vì mũ trùm đầu có thể làm giảm nhu cầu đặt nội khí quản so với NIV mặt nạ và PEEP cao trong quá trình thở tự phát có tác dụng bảo vệ phổi cho bệnh nhân với COVID-19 lẽ ra đã được bảo vệ khỏi thất bại điều trị bằng PEEP cao và hỗ trợ áp lực thấp hơn, nhưng điều này đã không xảy ra.
Hạn chế
Kết quả nghiên cứu này có một số hạn chế. Đầu tiên, báo cáo đơn trung tâm của chúng tôi liên quan đến các đối tượng được điều trị trong ICU và kết quả của chúng tôi có thể không khái quát được đối với các bối cảnh lâm sàng ngoài cơ sở chăm sóc tích cực (tức là khoa Cấp cứu, khoa Nội). Thứ hai, chúng tôi đã không sử dụng các tiêu chí chuẩn hóa để đặt nội khí quản; tuy nhiên, những kết quả này phản ánh hiệu quả của việc sử dụng NIOS trong một tình huống thực tế tại một trung tâm có chuyên môn về NIOS. Thứ ba, tại thời điểm nghiên cứu không có bằng chứng về tác dụng có lợi của steroid đối với suy hô hấp giảm oxy máu cấp do COVID- 19, và đối tượng của chúng tôi được điều trị mà không có dexamethasone. Mặc dù điều này có thể ảnh hưởng đến tỷ lệ tử vong nói chung và tỷ lệ đặt nội khí quản, nhưng điều này không làm thay đổi thông điệp chung của nghiên cứu một cách quan trọng về mặt lâm sàng. Cuối cùng, trong khi so sánh theo xu hướng với nhóm thuần tập lịch sử của các đối tượng bị ảnh hưởng bởi suy hô hấp do các nguyên nhân khác có một số điểm mạnh, chúng ta không thể loại trừ rằng các yếu tố không kiểm soát khác đã ảnh hưởng đến kết quả điều trị.
Kết luận
Đối tượng giảm oxy máu với COVID-19 được NIOS trong ICU có nguy cơ cao cần đặt nội khí quản. Nguy cơ này cao hơn gấp 2 lần so với những đối tượng bị suy hô hấp cấp giảm oxy máu có nguồn gốc khác. Khác với những gì đã được báo cáo trước đây về các nguyên nhân khác gây suy hô hấp cấp giảm oxy máu, sự cải thiện oxy do NIOS gây ra không dự đoán thành công điều trị ở bệnh COVID-19, trong khi điểm SAPS II cao hơn và giá trị LDH huyết thanh có liên quan độc lập với thất bại điều trị. Để tránh bất kỳ sự chậm trễ nào trong việc đặt nội khí quản, điều trị suy hô hấp giảm oxy máu do COVID-19 với NIOS cần hết sức thận trọng và theo dõi lâm sàng cẩn thận, đặc biệt ở những bệnh nhân bị giảm oxy máu nặng (điểm SAPS II ≥ 33) với LDH huyết thanh ≥ 405 đơn vị/L.
References
1.↵Rochwerg B, Brochard L, Elliott MW, Hess D, Hill NS, Nava S, et al. Official ERS/ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur Respir J 2017;50(2):1602426.Abstract/FREE Full TextGoogle Scholar
2.Demoule A, Girou E, Richard J-C, Taille S, Brochard L. Benefits and risks of success or failure of noninvasive ventilation. Intensive Care Med 2006;32(11):1756–1765.CrossRefPubMedGoogle Scholar
3.↵Sivaloganathan AA, Nasim-Mohi M, Brown MM, Abdul N, Jackson A, Fletcher SV, et al. Noninvasive ventilation for COVID-19-associated acute hypoxaemic respiratory failure: experience from a single centre. Br J Anaesth 2020;125(4):e368–e371.Google Scholar
4.↵Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region, Italy. JAMA 2020;323(16):1574.CrossRefPubMedGoogle Scholar
5.↵Frat J-P, Thille AW, Mercat A, Girault C, Ragot S, Perbet S, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med 2015;372(23):2185–2196.CrossRefPubMedGoogle Scholar
6.↵Ferreyro BL, Angriman F, Munshi L, Del Sorbo L, Ferguson ND, Rochwerg B, et al. Association of noninvasive oxygenation strategies with all-cause mortality in adults with acute hypoxemic respiratory failure: a systematic review and meta-analysis. JAMA 2020;324(1):57–67.Google Scholar
7.Levine S, Nguyen T, Taylor N, Friscia ME, Budak MT, Rothenberg P, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Eng J Med 2008;358:331–341.CrossRefPubMedGoogle Scholar
8.Sassoon CSH, Zhu E, Caiozzo VJ. Assist-control mechanical ventilation attenuates ventilator-induced diaphragmatic dysfunction. Am J Respir Crit Care Med 2004;170(6):626–632.CrossRefPubMedGoogle Scholar
9.Wrigge H, Zinserling J, Neumann P, Defosse J, Magnusson A, Putensen C, et al. Spontaneous breathing improves lung aeration in oleic acid-induced lung injury. Anesthesiology 2003;99(2):376–384.CrossRefPubMedGoogle Scholar
10.Neumann P, Wrigge H, Zinserling J, Hinz J, Maripuu E, Andersson LG, et al. Spontaneous breathing affects the spatial ventilation and perfusion distribution during mechanical ventilatory support. Crit Care Med 2005;33:1090– 1095.CrossRefPubMedGoogle Scholar
11.Marini JJ. Spontaneously regulated vs. controlled ventilation of acute lung injury/acute respiratory distress syndrome. Curr Opin Crit Care 2011;17(1):24–29.CrossRefPubMedGoogle Scholar
12.↵Yoshida T, Uchiyama A, Matsuura N, Mashimo T, Fujino Y. The comparison of spontaneous breathing and muscle paralysis in two different severities of experimental lung injury. Crit Care Med 2013;41(2):536–545.PubMedGoogle Scholar
13.↵Grieco DL, Menga LS, Eleuteri D, Antonelli M. Patient self-inflicted lung injury: implications for acute hypoxemic respiratory failure and ARDS patients on non-invasive support. Minerva Anestesiol 2019;85(9)Google Scholar
14.Yoshida T, Torsani V, Gomes S, De Santis RR, Beraldo MA, Costa EV, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med 2013;188(12):1420–1427.CrossRefPubMedGoogle Scholar
15.Kallet RH, Alonso JA, Luce JM, Matthay MA. Exacerbation of acute pulmonary edema during assisted mechanical ventilation using a low-tidal volume, lung-protective ventilator strategy. Chest 1999;116(6):1826– 1832.CrossRefPubMedGoogle Scholar
16.Goligher EC, Brochard LJ, Reid WD, Fan E, Saarela O, Slutsky AS, et al. Diaphragmatic myotrauma: a mediator of prolonged ventilation and poor patient outcomes in acute respiratory failure. Lancet Respir Med 2019;7(1):90–98.Google Scholar
17.↵Goligher EC, Dres M, Patel BK, Sahetya SK, Beitler JR, Telias I, et al. Lung and diaphragm-protective ventilation. Am J Respir Crit Care Med 2020;202(7):950–961.Google Scholar
18.↵Demoule A, Chevret S, Carlucci A, Kouatchet A, Jaber S, Meziani F, et al. Changing use of noninvasive ventilation in critically ill patients: trends over 15 years in francophone countries. Intensive Care Med 2016;42(1):82–92.Google
Scholar
19.↵Bellani G, Laffey JG, Pham T, Madotto F, Fan E, Brochard L, et al. Noninvasive ventilation of patients with acute respiratory distress syndrome: insights from the LUNG SAFE study. Am J Respir Crit Care Med 2017;195(1):67– 77.CrossRefPubMedGoogle Scholar
20.↵Antonelli M, Conti G, Moro ML, Esquinas A, Gonzalez-Diaz G, Confalonieri M, et al. Predictors of failure of noninvasive positive pressure ventilation in patients with acute hypoxemic respiratory failure: a multi-center study. Intensive Care Med 2001;27(11):1718–1728.CrossRefPubMedGoogle Scholar
21.↵Ozyilmaz E, Ugurlu AO, Nava S. Timing of noninvasive ventilation failure: causes, risk factors, and potential remedies. BMC Pulm Med 2014;14(1)Google Scholar
22.↵Alraddadi BM, Qushmaq I, Al-Hameed FM, Mandourah Y, Almekhlafi GA, Jose J, et al. Noninvasive ventilation in critically ill patients with the middle east respiratory syndrome. Influenza Other Respi Viruses 2019;13(4):382– 390.Google Scholar
23.Arabi YM, Arifi AA, Balkhy HH, Najm H, Aldawood AS, Ghabashi A, et al. Clinical course and outcomes of critically ill patients with Middle East respiratory syndrome coronavirus infection. Ann Intern Med 2014;160(6):389– 397.CrossRefPubMedGoogle Scholar
24.Belenguer-Muncharaz A, Reig-Valero R, Altaba-Tena S, Casero-Roig P, Ferrándiz-Sellés A. Noninvasive mechanical ventilation in severe pneumonia due to H1N1 virus. Med Intensiva 2011;35(8):470–477.CrossRefPubMedGoogle Scholar
25.Estenssoro E, Ríos FG, Apezteguía C, Reina R, Neira J, Ceraso DH, et al. Pandemic 2009 influenza A in Argentina: a study of 337 patients on mechanical ventilation. Am J Respir Crit Care Med 2010;182(1):41–48.CrossRefPubMedGoogle Scholar
26.↵Masclans JR, Pérez M, Almirall J, Lorente L, Marqués A, Socias L, et al. Early non-invasive ventilation treatment for severe influenza pneumonia. Clin Microbiol Infect 2013;19(3):249–256.CrossRefPubMedGoogle Scholar
27.↵World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected: interim guidance. Mar 13, 2020. Available at: https://www.who.int/docs/defaultsource/coronaviruse/clinical-management-of-novel-cov.pdf?sfvrsn=bc7da517_2. Accessed October 29, 2020.Google Scholar
28.↵Alhazzani W, Møller MH, Arabi YM, Loeb M, Gong MN, Fan E, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19). Intensive Care Med 2020;46(5):854– 887.CrossRefPubMedGoogle Scholar
29.↵Vestbo J, Hurd SS, Agustí AG, Jones PW, Vogelmeier C, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med 2013;187(4):347–365.CrossRefPubMedGoogle Scholar
30.↵Antonelli M, Conti G, Esquinas A, Montini L, Maggiore SM, Bello G, et al. A multiple-center survey on the use in clinical practice of noninvasive ventilation as a first-line intervention for acute respiratory distress syndrome. Crit Care Med 2007;35:18–25.CrossRefPubMedGoogle Scholar
31.↵Wang K, Zhao W, Li J, Shu W, Duan J. The experience of high-flow nasal cannula in hospitalized patients with 2019 novel coronavirus-infected pneumonia in two hospitals of Chongqing. Ann Intensive Care 2020;10(1):37.PubMedGoogle Scholar
32.↵Zucman N, Mullaert J, Roux D, Roca O, Ricard J-D. Prediction of outcome of nasal high flow use during COVID-19related acute hypoxemic respiratory failure. Intensive Care Med 2020;46(10):1924–1926.CrossRefPubMedGoogle Scholar
33.↵Carrillo A, Gonzalez-Diaz G, Ferrer M, Martinez-Quintana ME, Lopez-Martinez A, Llamas N, et al. Non-invasive ventilation in community-acquired pneumonia and severe acute respiratory failure. Intensive Care Med 2012;38(3):458– 466.CrossRefPubMedGoogle Scholar
34.↵Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med 2017;195(4):438–442.PubMedGoogle Scholar
35.↵Duan J, Han X, Bai L, Zhou L, Huang S. Assessment of heart rate, acidosis, consciousness, oxygenation, and respiratory rate to predict noninvasive ventilation failure in hypoxemic patients. Intensive Care Med 2017;43(2):192– 199.Google Scholar
36.↵Liu X, Liu X, Xu Y, Xu Z, Huang Y, Chen S, et al. Ventilatory ratio in hypercapnic mechanically ventilated patients with covid-19-associated acute respiratory distress syndrome. Am J Respir Crit Care Med 2020;201(10):1297– 1299.CrossRefGoogle Scholar
37.↵Ziehr DR, Alladina J, Petri CR, Maley JH, Moskowitz A, Medoff BD, et al. Respiratory pathophysiology of mechanically ventilated patients with COVID-19: a cohort study. Am J Respir Crit Care Med 2020;201(12):1560– 1564.CrossRefPubMedGoogle Scholar
38.↵Grieco DL, Bongiovanni F, Chen L, Menga LS, Cutuli SL, Pintaudi G, et al. Respiratory physiology of COVID-19induced respiratory failure compared to ARDS of other etiologies. Crit Care 2020;24(1):529.CrossRefPubMedGoogle Scholar
39.↵Drent M, Cobben NAM, Henderson RF, Wouters EFM, van Dieijen-Visser M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J 1996;9(8):1736–1742.Abstract/FREE Full TextGoogle Scholar
40.↵Morais CCA, Koyama Y, Yoshida T, Plens GM, Gomes S, Lima CAS, et al. High positive end-expiratory pressure renders spontaneous effort noninjurious. Am J Respir Crit Care Med 2018;197(10):1285–1296.PubMedGoogle Scholar
41.Grieco DL, Menga LS, Raggi V, Bongiovanni F, Anzellotti GM, Tanzarella ES, et al. Physiological comparison of high-flow nasal cannula and helmet noninvasive ventilation in acute hypoxemic respiratory failure. Am J Respir Crit Care Med 2020;201(3):303–312.PubMedGoogle Scholar
42.↵Yoshida T, Grieco DL, Brochard L, Fujino Y. Patient self-inflicted lung injury and positive end-expiratory pressure for safe spontaneous breathing. Curr Opin Crit Care 2020;26(1):59–65.CrossRefGoogle Scholar
43.↵Hernandez-Romieu AC, Adelman MW, Hockstein MA, Robichaux CJ, Edwards JA, Fazio JC, et al. Timing of intubation and mortality among critically ill coronavirus disease 2019 patients: a single-center cohort study. Crit Care Med 2020;48(11):e1045–e1053.CrossRefPubMedGoogle Scholar
44.↵Patel BK, Wolfe KS, Pohlman AS, Hall JB, Kress JP. Effect of noninvasive ventilation delivered by helmet vs face mask on the rate of endotracheal intubation in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 2016;315(22):2435–2441.CrossRefPubMedGoogle Scholar