Tính tự miễn
Những năm của thập niên vừa qua đã mang lại cho chúng ta nhiều hiểu biết về sự điều hòa hệ thống miễn dịch ở người bình thường. Thế nhưng những hiểu biết trong lĩnh vực tự miễn thì tỏ ra rất chậm, phần nào là do vấn đề của trung tâm điều hòa miễn dịch chưa được giải đáp đầy đủ: sự dung nạp của hệ thống miễn dịch đối với kháng nguyên bản thân đã được xác lập và duy trì thế nào?
Trong lúc chờ đợi câu trả lời chính xác cho vấn đề này, chúng ta có thể đặt thêm những câu hỏi khác. Một cách tóm tắt, vấn đề tự miễn hiện nay bao gồm ba vấn đề sau:
(1)Có phải tự miễn nhằm vào cơ chế bình thường của điều hòa miễn dịch không?
(2)Đáp ứng tự miễn có phải xảy ra qua trung gian của các tiểu quần thể tế bào T hoặc tế bào B đặc biệt không?
(3)Tính tự miễn có phụ thuộc kháng nguyên không?
Chúng ta hãy lần lượt xem xét các vấn đề này.
Có phải phản ứng tự miễn nhằm vào cơ chế bình thường của điều hòa miễn dịch?
Sự hình thành một đáp ứng kháng thể bình thường đối với đa số kháng nguyên protein đòi hỏi sự tham gia của 3 loại tế bào: B, T, và tế bào trình diện kháng nguyên (Hình 1). Việc sản xuất tự kháng thể cũng vậy, nó đòi hỏi không chỉ tế bào B mà cả tế bào T. Ta có thể thấy bằng chứng về điều này qua thí nghiệm của David Wofsy (1985) và Seaman (1987). Chuột NZB/NZW là nơi thể hiện của mô hình luput ban đỏ hệ thống ở người. Bằng cách xử lý chúng với kháng thể đơn clôn chống tế bào T CD4+ thì các chuột này sẽ mất tế bào T giúp đỡ. Nếu ta cho xử lý sớm khi chuột còn rất non thì có thể phòng được phản ứng tự miễn. Còn nếu xử lý sau khi đã có phản ứng tự miễn thì cũng có thể giúp ngăn chặn sự phát triển thêm của bệnh. Cateron và cộng sự đã chứng minh rằng chỉ cần tiêm cho chuột NZB/NZW những mảnh F(ab’)2 của kháng thể kháng CD4 là có thể ngăn ngừa được bệnh tự miễn cho nó. Người ta thấy ở chuột được tiêm kháng thể này các tế bào T lưu động được bọc bởi F(ab’)2 của anti-CD4 nhưng các tế bào này không bị loại bỏ. Như vậy, tác dụng của anti-CD4 trong miễn dịch không phụ thuộc vào sự loại bỏ tế bào T CD4+. Điều trị kiểu này đã được chứng minh là có thể tạo ra những hiệu quả có lợi cho chuột mắc các bệnh tự miễn khác nhau trong đó có đái đường typ I, viêm khớp do collagen, viêm não tủy tự miễn thực nghiệm và nhược cơ nặng.
Về vai trò của tế bào T, sự hoạt hóa tế bào T có đòi hỏi những điều kiện giống nhau trong đáp ứng tự miễn và đáp ứng miễn dịch bình thường không? Hình 2 cho ta thấy hình ảnh của sự tương tác giữa các phân tử với nhau khi xảy ra sự hoạt hóa tế bào T CD4+. Trên bề mặt của tế bào trình diện kháng nguyên, kháng nguyên lạ được gắn với kháng nguyên hòa hợp mô chủ yếu (MHC). Đối với t ế bào T CD4+, loại MHC cần cho sự tương tác là MHC lớp II như HLA-DP, -DQ, -DR. Phức hợp gồm kháng nguyên lạ và MHC được nhận diện bởi thụ thể kháng nguyên của tế bào T (T cell receptor, TCR) để tạo ra một phản ứng tương tác. Phản ứng tương tác này phát ra một tín hiệu để khởi phát sự hoạt hóa t ế bào T. Sự hoạt hóa tế bào T còn cần đến một tương tác bổ sung khác, đó là liên kết giữa phân tử CD4 với MHC.
Như đã trình bày ở trên, F(ab’)2 của kháng thể anti-CD4 có thể ức chế sự xuất hiện của bệnh tự miễn, điều này chứng tỏ rằng phân tử CD4 đã tham gia vào đ áp ứng của tế bào T trong phản ứng tự miễn giống như trong đáp ứng bình thường.
Qua các nghiên cứu về sinh học phân tử, sự liên quan của các bệnh tự miễn với các allel đặc hiệu của MHC lớp II (ví dụ liên quan của viêm khớp dạng thấp với HLA-DR4) nói lên rằng sự hoạt hóa t ế bào T tự miễn có thể phải cần đến các tiểu lớp của MHC lớp II. Tuy nhiên vai trò của MHC lớp II trong phản ứng trình diện kháng nguyên vẫn chưa hoàn toàn được sáng tỏ.
Có phải đáp ứng tự miễn xảy ra qua trung gian của các tiểu quần thể t hoặc b đặc biệt không?
Nếu đáp ứng tự miễn xảy ra qua trung gian của các tiểu quần thể tế bào T hoặc B, và nếu các tế bào này khác với tế bào tham gia vào đáp ứng miễn dịch đối với kháng nguyên lạ thì có lẽ chúng ta có thể ức chế chọn lọc phản ứng tự miễn mà không làm giảm đáp ứng miễn dịch bình thường.
Chúng ta biết rằng tế bào T CD4+ cần cho đáp ứng tạo kháng thể đối với kháng nguyên lạ. Còn miễn dịch tế bào thì có thể tồn tại mà không cần chức năng hỗ trợ của tế bào T CD4+ dù có bị yếu đi phần nào. Phản ứng tự miễn xảy ra có qua trung gian của tiểu quần thể tế bào T CD4+ không? Các tiểu quần thể tế bào T CD4+ được xác định dựa vào chức năng, phenotyp bề mặt và nhờ vào việc sử dụng có chọn lọc các gen của TCR trên bề mặt tế bào T.
Về mặt chức năng, Mossan và cộng sự đã chứng minh rằng các dòng tế bào T CD4+ thường được chia làm 2 nhóm: một nhóm sản xuất chủ yếu là interferon gamma (IFN gamma) và interleukin 2 (IL-2), còn nhóm kia sản xuất chủ yếu là IL-4, IL-5 và IL-6. Người ta vẫn chưa xác định được rằng những khác biệt về chức năng in vitro này có đặc trưng cho tế bào T in vivo không. Người ta còn ghi nhận rằng nếu ta ức chế một chức năng nào đó (tất nhiên là in vitro) thì chức năng kia không bị bất ho ạt. Điều này đặc biệt quan trọng khi ứng dụng để điều trị bệnh tự miễn. Thật tiện lợi biết bao nếu ta có thể b ảo tồn được một chức năng nào đó của tế bào T trong khi có thể tiến hành ức chế chức năng kia. Tuy nhiên chúng tôi cũng muốn lưu ý rằng những suy nghĩ cố gắng ức chế phản ứng tự miễn thông qua con đường chức năng tế bào T cũng có thể không phù hợp hoặc đi sai hướng.
Về phenotyp, người ta đã dựa vào các dấu ấn bề mặt để phân biệt các tiểu quần thể tế bào T. Các dấu ấn này hình như có liên quan đến cả tình trạng hoạt hóa của tế bào. Ví dụ, ta biết rằng tất cả các tiểu quần thể của tế bào T đều có mang những dạng đồng phân của kháng nguyên CD45 (tức T200). Trong số đó, những tế bào chưa chín mang những đồng phân có trọng lượng phân tử 205 – 220 kilodalton (kD) gọi là CD45R. Những tế bào CD4+ khi tiếp xúc với kháng nguyên và thực hiện chức năng giúp đỡ tế bào B thì trên tế bào T này có sự chuyển mạch (switch) để tạo ra đồng phân 180 kD gọi là CD45RO, dấu ấn này được nhận diện bởi kháng thể đơn clôn UCHL1. Các tế bào T tập trung trong màng khớp của bệnh nhân thấp mang chủ yếu kháng nguyên CD45RO. Người ta đã từng xem đây là đích tấn công của một số liệu pháp miễn dịch. Tuy nhiên các liệu pháp miễn dịch này gây thương tổn cả phản ứng miễn dịch bình thường lẫn phản ứng tự miễn, đồng thời nó tác động lên không những tế bào CD4+ mà cả tế bào CD8+ có mang đồng phân của CD45 nên việc ứng dụng vẫn đang còn rất hạn chế.
Bên cạnh kháng nguyên CD45, sự hoạt hóa tế bào T còn dẫn đến bộc lộ thành phần T55 của thụ thể IL-2 (còn gọi là IL-2R hoặc kháng nguyên Tac). Thành phần này cũng đã được xem là một đích thứ hai của liệu pháp ức chế miễn dịch. Nhưng, người ta cũng đã lưu ý rằng, tế bào trong màng khớp bệnh nhân thấp chỉ có một số rất ít mang kháng nguyên này.
Quay sang tế bào B, tế bào này cùng với hoạt động của gen vùng biến đổi tạo ra việc sản xuất kháng thể chống lại nhiều tự kháng nguyên giống nhau hoặc chống lại các quyết định kháng nguyên khác nhau khi kháng nguyên có cấu trúc phức tạp. Ví dụ, ở người bệnh luput ban đỏ hệ thống và ở chuột NZB/NZW kháng thể DNA bao gồm nhiều loại khác nhau.
Người ta thấy rằng ở chuột NZB là chuột bố mẹ của NZB/NZW sự xuất hiện của kháng thể được khởi động trước tiên chỉ ở một nhóm tế bào B mang dấu ấn CD5, là một dấu ấn thường gặp ở tế bào T. Đây là một điều đang còn nhiều bàn cãi. Kháng thể thuộc lớp IgG tức lớp kháng thể thường gặp nhất trong tất cả các bệnh tự miễn nặng không thể do tế bào B CD5+ sản xuất được vì tế bào này chỉ sản xuất IgM. Cũng có thể tế bào B CD5+ là tiền thân (precursor) của những tế bào sản xuất IgG, nhưng điều này chưa được xác minh.
Một tỉ lệ đáng kể tế bào B CD5+ hình như còn có vai trò trong việc sản xuất yếu tố thấp IgM bởi vì trong thực tế người ta thấy rằng trên bệnh nhân mắc bệnh bạch cầu dòng lymphô mạn tính hầu như tất cả các tế bào B đều có mang CD5 và phần lớn chúng sản xuất yếu tố thấp IgM. Chúng ta cần nhớ rằng yếu tố thấp IgM dù là do tế bào thường hay tế bào ung thư sản xuất đều được mã hóa bởi gen Ig dòng mầm, có nghĩa là chúng không bị đột biến thân. Điều này không phải do không có kích thích mà vì ở tế bào B bình thường người ta thấy chúng vẫn có thể sản xuất yếu tố thấp, và sự sản xuất này tăng lên trong quá trình nhiễm trùng. Tóm lại, những quan sát trên đây nói lên tính chất điều hòa tự nhiên của cơ thể đối với phản ứng tự miễn là luôn luôn ngăn ngừa đột biến để khỏi tạo ra yếu tố thấp với lượng lớn và bất thường. Tuy nhiên, trong trường hợp viêm khớp dạng thấp thì hiện tượng điều hòa bị mất, yếu tố thấp được sản xuất nhiều với tính chất đa clôn đồng thời yếu tố thấp IgG xuất hiện.
Đáp ứng tự miễn có phụ thuộc kháng nguyên không?
Rõ ràng là đáp ứng tự miễn cũng đòi hỏi nhiều yếu tố như trong đáp ứng miễn dịch bình thường và nó cũng bị khống chế bởi nhiều quy luật như trong miễn dịch bình thường. Do đó, ta có thể quan niệm rằng phản ứng tự miễn có thể được tạo ra nhằm đáp ứng kích thích của một kháng nguyên đặc hiệu. Ngoài ra, bệnh tự miễn còn có thể được khởi phát bởi những nhiễm trùng đặc hiệu như viêm họng do liên cầu, nhiễm trùng đường ruột do Shigella, Salmonella, Yersinia hoặc Campylobacter.
Các kích thích không đặc hiệu cũng có thể dẫn đến phản ứng tự miễn, như trong trường hợp tế bào B được hoạt hóa do tế bào T cùng loài trong phản ứng ghép chống chủ. Đối với chuộ t NZB/NZW, Steinberg và cộng sự cho rằng đáp ứng tự miễn của tế bào T ban đầu có thể là không đặc hiệu. Tuy nhiên, trong cả phản ứng ghép chống chủ trên người lẫn trên chuột NZB/NZW phản ứng tự miễn cần những điều kiện rất chặt chẽ. Trên chuột NZB/NZW,vào thời điểm mà bệnh đang tiến triển, Steinberg và cộng sự nhận thấy rằng bệnh đã trở nên cần sự hướng dẫn của kháng nguyên vì đáp ứng tự miễn đã xảy ra sau khi truyền tế bào lymphô.
Bằng chứng về tính chất gây bệnh của phản ứng tự miễn:
Phản ứng tự miễn thực nghiệm
Người ta cho rằng nếu phản ứng tự miễn có thể gây ra những tổn thương bệnh lý nào đó cho người thì trên động vật thí nghiệm chúng ta cũng có thể tạo ra mô hình tổn thương tự miễn tương đương. Thực vậy, người ta đã có thể kích thích để tạo ra bệnh tự miễn đặc hiệu cho một cơ quan nào đó trên động vật bằng cách tiêm kháng nguyên cùng với tá chất Freud hoàn toàn. Ví dụ, dùng thyroglobulin có thể gây bệnh viêm tuyến giáp, dùng protein cơ bản của myelin có thể gây viêm não tủy thực nghiệm. Tính chất đặc hiệu cơ quan này hoàn toàn không phải bàn cãi vì người ta đã tìm thấy kháng nguyên ngay tại các vị trí tổn thương. Trong trường hợp động vật được tiêm thyroglobulin, người ta không những chỉ thấy kháng thể kháng giáp xuất hiện mà còn thấy tuyến bị thâm nhiễm bởi tế bào đơn nhân, thấy cấu trúc nang tuyến bị phá hủy dưới ảnh hưởng của tự kháng nguyên. Mặc dù không giống với bệnh Hashimoto, viêm tuyến giáp ở đây cũng có những tương đồng quan trọng so với bệnh ở người.
Tính cảm thụ dòng (strain susceptibility) đối với bệnh tự miễn
Chúng ta có thể gây được bệnh tự miễn hay không là tùy thuộc vào dòng động vật được dùng. Ví dụ, người ta thấy rằng tính cảm thụ của chuột đối với bệnh viêm não tủy do protein cơ bản của myelin phụ thuộc vào một số locus gen nhất định, trong đó quan trọng nhất là các gen của phức hệ hòa hợp mô chủ yếu (MHC) lớp II. Khi có được dòng động vật cảm thụ thích hợp rồi, ta còn có thể gây bệnh thụ động bằng cách truyền tế bào T mẫn cảm (ví dụ mẫn cảm với protein cơ bản của myelin) cho con vật khác. Những tế bào này, về mặt phenotyp là những tế bào CD4+, dựa vào tính chất này người ta đã dùng kháng thể kháng CD4+ để khống chế bệnh và đã thu được kết quả tốt trên động vật thực nghiệm. Người ta cũng đã thu được những kết quả tương tự với bệnh viêm tuyến giáp tự dị ứng thực nghiệm (experimental autoallergic thyroiditis) do thyroglobulin gây ra. Những kết quả nói trên chứng tỏ rằng các tế bào T tự phản ứng (autoreactive T cell) hoạt động với điều kiện rất chặt chẽ của MHC, và điều kiện này rất quan trọng trong việc tạo ra các bệnh cảnh thực nghiệm.
Bệnh qua trung gian kháng thể (antibody mediated diseases)
Trong một số mô hình thực nghiệm, kháng thể là yếu tố chính gây bệnh chứ không phải là tế bào T. Ví dụ, kháng thể kháng thụ thể acetylcholin gây ra tính chất yếu cơ của bệnh nhược cơ thực nghiệm; kháng thể màng đáy cầu thận được tìm thấy trong bệnh Goodpasture thực nghiệm có thể tạo ra bằng cách tiêm kháng nguyên (chất chiết xuất từ màng đáy cầu thận) kèm với tá chất Freud cho con vật.
Bệnh tự miễn tự nhiên (spontaneous autoimmune diseases)
Chúng ta có thể học được nhiều điều qua nghiên cứu những trường hợp bệnh tự miễn tự nhiên của động vật.
Bệnh tuyến giáp ở gà Obese: Trên gà thuộc dòng Obese, người ta đã tìm thấy kháng thể kháng giáp xuất hiện một cách tự nhiên, và tuyến giáp bị thoái hóa dần cùng với tổn thương viêm mạn tính. Huyết thanh của các con vật này chứa kháng thể kháng thyroglobulin. Ngoài ra, khoảng 15% số mẫu huyết thanh cho phản ứng với proventriculus (dạ dày) của gà bình thường. Kháng thể này tương tự như kháng thể kháng tế bào thành dạ dày người của bệnh nhân thiếu máu ác tính. Như vậy, mô hình động vật ở đây coi như tương đương với bệnh tuyến giáp tự miễn ngẫu phát ở người xét về mặt tổn thương tuyến, sản xuất tự kháng thể chống những thành phần khác nhau của tuyến giáp đi kèm với phản ứng tự miễn đối với dạ dày. Nếu ta làm thay đổi tình trạng miễn dịch của con vật thì biểu hiện bệnh cũng thay đổi theo: khi ta cắt bỏ tuyến Fabricius, thì phản ứng viêm tuyến giáp giảm rõ, điều này chứng tỏ kháng thể có vai trò quan trọng trong bệnh nguyên của bệnh. Ngược lại, nếu cắt bỏ tuyến ức từ lúc mới sinh thì hình như bệnh có biểu hiện nặng hơn.
Bệnh luput ban đỏ hệ thống của chuột: Người ta đã chú ý đến một mô hình thực nghiệm khác trên thế hệ lai F1 của hai loài chuột NZB và NZW. Các chuột lai này cho ta bệnh cảnh tự phát của luput ban đỏ hệ thống với viêm cầu thận do phức hợp miễn dịch và trong máu xuất hiện nhiều loại tự kháng thể mà quan trọng nhất là kháng thể kháng nhân với nhiều tính đặc hiệu. Trên các động vật này, những chất ức chế miễn dịch như cyclophosphamid, cyclosporin A, v.v. Có tác dụng ức chế sự xuất hiện bệnh và kéo dài thời gian sống còn của con vật.
Sự sắp xếp các bệnh tự miễn thường gặp ở người
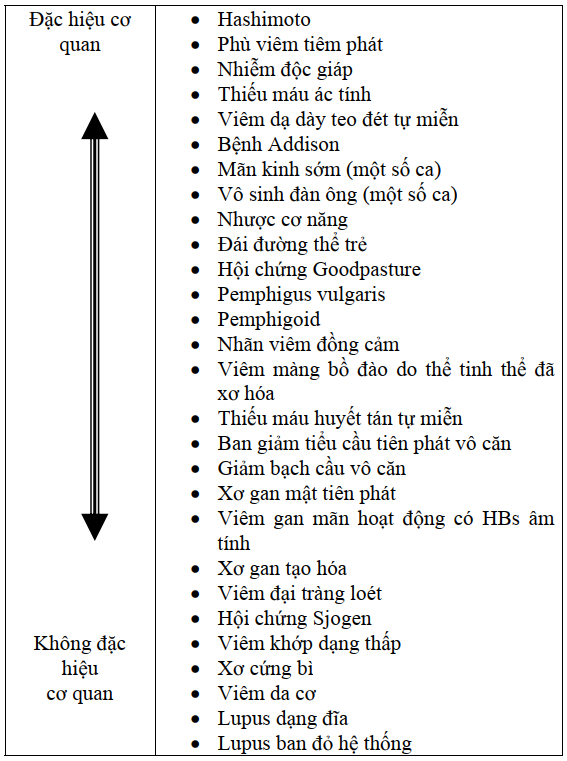
Các bệnh có liên quan đến hiện tượng tự miễn thường được bố trí thành một danh mục gồm có hai cực mà người ta thường gọi là phổ bệnh tự miễn (Hình 11.1). Cuối một cực là bệnh viêm tuyến giáp Hashimoto và một số bệnh mà trong đó tự kháng thể và tổn thương chỉ xảy ra đối với một cơ quan của cơ thể và được gọi là bệnh tự miễn đặc hiệu cơ quan (organ-specific autoimmune diseases). Cuối cực kia người ta xếp luput ban đỏ hệ thống là một bệnh tự miễn hệ thống điển hình. Trong luput và các bệnh ở cực này, tự kháng thể cho phản ứng với nhiều loại kháng nguyên nằm rải rác khắp nơi trong cơ thể và tổn thương đặc trưng cũng xảy ra ở nhiều cơ quan nên được gọi là bệnh tự miễn không đặc hiệu cơ quan (non-organ-specific autoimmune diseases)
Những cơ quan đích thường gặp trong bệnh đặc hiệu cơ quan là tuyến giáp, tuyến thượng thận, dạ dày và tuyến tụy; trong khi đó ở bệnh không đặc hiệu cơ quan trong đó gồm cả các bệnh thấp thì tổn thương có thể gặp ở da, thận, khớp và cơ.
Có một điều cần lưu ý là tại mỗi đầu của bảng danh mục các bệnh được xếp nằm kề nhau thường có hiện tượng trùng lặp (overlap) về cả triệu chứng cận lâm sàng lẫn lâm sàng. Ví dụ, kháng thể tuyến giáp xuất hiện với tần suất cao trên bệnh nhân thiếu máu ác tính là người có hiện tượng tự miễn ở dạ dày. Đồng thời, những bệnh nhân này có tần suất mắc bệnh tự miễn giáp cao hơn người bình thường. Tương tự, trong số bệnh nhân tự miễn tuyến giáp có một tỷ lệ cao bất thường những người mang tự kháng thể tế bào thành dạ dày, có người có cả triệu chứng của thiếu máu ác tính. Đặc biệt, nếu ta xét riêng quần thể các bệnh thấp nằm ở phía bệnh không đặc hiệu cơ quan thì giữa các bệnh trong nhóm đó hiện tượng trùng lặp rất phổ biến. Ví dụ, các triệu chứng của bệnh viêm khớp dạng thấp thường xảy ra kèm với các triệu chứng của SLE. Phức hợp miễn dịch giữa tự kháng nguyên và tự kháng thể có xu hướng lắng đọng khắp nơi trong cơ thể mà nhất là ở thận, khớp và da gây nên các triệu chứng ở các cơ quan này trong những bệnh có phức hợp miễn dịch này. Tuy nhiên, cần nhớ rằng bệnh càng nằm xa nhau về hai đầu thì xu hướng trùng lặp càng hiếm gặp, ví dụ sự xảy ra đồng thời của viêm tuyến giáp và SLE là điều cực kỳ bất thường.
Cơ chế miễn dịch bệnh lý trong bệnh tự miễn thay đổi tùy theo vị trí sắp xếp của bệnh trên bảng danh mục. Nếu bệnh nằm ở cực đặc hiệu cơ quan thì cơ chế quan trọng nhất là quá mẫn typ II và đáp ứng miễn dịch qua trung gian tế bào. Còn cơ chế đặc hiệu trong các bệnh không đặc hiệu cơ quan thì luôn luôn liên quan đến vị trí lắng đọng của phức hợp miễn dịch. Chúng ta có thể thấy các biểu hiện của bệnh đặc hiệu cơ quan và không đặc hiệu cơ quan được tóm tắt ở Bảng 11.1.
Hình 11.1. Phổ bệnh tự miễn
Bảng 11.1. Các rối loạn đặc hiệu cơ quan và không đặc hiệu cơ quan
|
|
Đặc hiệu cơ quan |
Không đặc hiệu cơ quan |
|
Kháng nguyên |
Khu trú ở một cơ quan nào đó |
Ở khắp nơi trong cơ thể |
|
Tổn thương |
Kháng nguyên ở cơ quan là đích của các phản ứng miễn dịch |
Phức hợp miễn dịch lắng đọng trên toàn thân, nhất là ở thận, khớp và da |
|
Trùng lặp |
Với các kháng thể và các bệnh đặc hiệu cơ quan khác |
Với các kháng thể và các bệnh đặc hiệu cơ quan khác |
Tính di truyền của bệnh tự miễn
Tính chất gia đình của bệnh tự miễn là điều hoàn toàn được khẳng định. Tính chất gia đình này chủ yếu là do di truyền hơn là do môi trường và điều này đã được chứng minh bằng các nghiên cứu di truyền học các cặp sinh đôi, nghiên cứu sự phối hợp giữa tự kháng thể và sự bất thường nhiễm sắc thể.
Khi có hiện tượng xuất hiện cùng một lúc triệu chứng của một số bệnh đặc hiệu cơ quan trên một cá thể nào đó thì xu hướng xuất hiện tính tự miễn trong gia đình anh ta cũng nghiêng về phía tự miễn đặc hiệu cơ quan. Đồng thời, lúc đó các y ếu tố kiểm soát di truyền sẽ nghiêng về cơ quan bị tác động mạnh nhất. Thật thú vị khi thấy rằng họ hàng của những người mắc bệnh Hashimoto có tần suất mang tự kháng thể tuyến giáp cao h ơn và hiệu giá của tự kháng thể này cũng cao hơn so với những người khác. Trong bệnh thiếu máu ác tính cũng có hiện tượng như vậy.
Các bằng chứng khác về hoạt động của yếu tố di truyền là xu hướng phối hợp của bệnh tự miễn đối với các tính đặc hiệu HLA. Haplotyp B8, DR3 xuất hiện với tần suất cao ở những bệnh đặc hiệu cơ quan. Đối với bệnh viêm khớp dạng thấp, trước đây khi chỉ khảo sát các locus A và B thì thấy không có liên quan gì, nhưng đến nay thì đã biết là có phối hợp với HLA-Dw4 và DR4. Những cá thể mang HLA này thì có xu hướng dễ mắc bệnh viêm khớp này hơn. Trong bệnh đái đường phụ thuộc insulin, dị hợp tử đối với DR3 và DR4 rất thường gặp. Điều này hỗ trợ cho quan niệm cho rằng các yếu tố di truyền tham gia vào sự xuất hiện của bệnh tự miễn gồm có hai loại, một loại là các y ếu tố làm tiền đề cho sự xuất hiện tính tự miễn và loại kia là các yếu tố xác định tự kháng nguyên nào tham gia vào phản ứng tự miễn.
Bệnh nguyên
Nếu chúng ta tìm thấy tự kháng thể trong một bệnh nào đó thì có thể có ba cách giải thích về nguồn gốc của bệnh.
Phản ứng tự miễn xảy ra trước và chịu trách nhiệm về việc tạo ra những tổn thương đặc trưng của bệnh.
Bệnh xảy ra trước, sau đó các tổn thương tổ chức do bệnh gây ra dẫn đến sự sản xuất tự kháng thể.
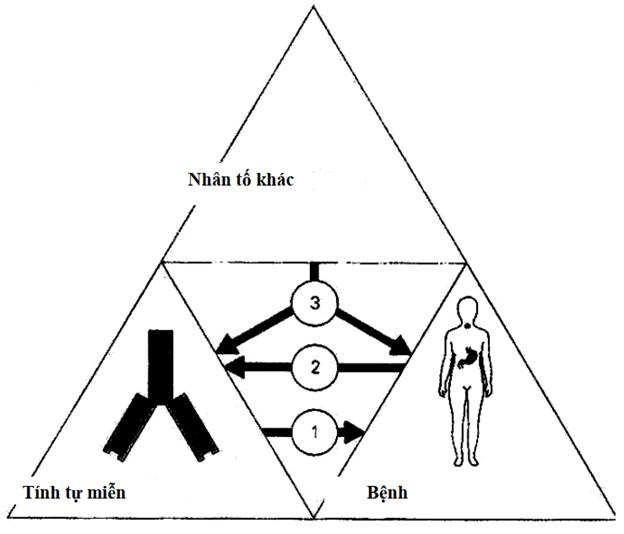
Có thể có một yếu tố riêng biệt nào đó đồng thời gây ra cả tổn thương của bệnh lẫn phản ứng tự miễn. (Hình 11.2)
Tự kháng thể xuất hiện sau tổn thương có thể gặp trong những trường hợp như tự kháng thể cơ tim xuất hiện sau nhồi máu cơ tim. Tuy nhiên, trong đa số trường hợp sự sản xuất tự kháng thể không xuất phát từ sự giải phóng tự kháng nguyên sau một chấn thương đơn giản. Nhìn chung người ta có cho rằng trong số những bệnh có mang tự kháng thể thì đa số là các bệnh gây ra do cơ chế tự miễn.
Hình 11.2. Giả thuyết về sự phối hợp giữa bệnh tự miễn với phản ứng tự miễn
Ba kiểu phối hợp có thể xả y ra: (1) Phản ứng tự miễn có thể tạ o ra bệnh; (2) Bệnh chịu trách nhiệm tạo ra phản ứng tự miễn; hoặc (3) Một yếu tố thứ ba tạo ra cả phản ứng tự miễn lẫn bệnh tự miễn.
Bằng chứng trực tiếp nhất về giả thuyết cho rằng phản ứng tự miễn đã gây ra bệnh tự miễn là chúng ta có thể tạo mô hình của bệnh đó trên con vật bằng cách gây phản ứng tự miễn thực nghiệm cho chúng. Thực vậy, người ta đã thực hiện được nhiều bệnh tự miễn trên động vật thực nghiệm bằng cách tiêm kháng nguyên có trộn với tá chất Freund. Ví dụ, tiêm thyroglobulin có thể gây bệnh viêm tuyến giáp, và tiêm protein cơ bản của myelin có thể gây viêm não thực nghiệm. Trong trường hợp tiêm thyroglobulin không những kháng thể kháng giáp được sản xuất mà tuyến giáp còn bị thâm nhiễm bởi tế bào đơn nhân và cấu trúc tuyến bị biến đổi. Viêm tuyến giáp thực nghiệm này nhìn chung rất giống với bệnh cảnh viêm tuyến giáp ở những người mặc dù không giống hệt Hashimoto.
Có những mô hình bệnh tự miễn ngẫu nhiên trên động vật rất có ích cho chúng ta nghiên cứu. Đầu tiên là bệnh tuyến giáp tự miễn trên gà trống Obese (OS). Bệnh xuất hiện tự nhiên với tổn thương viêm tuyến giáp mạn tính và xuất hiện kháng thể kháng giáp. Nếu chúng ta khảo sát huyết thanh của những con vật này thì ngoài kháng thể thyroglobulin ra, còn có kháng thể dạ dày trên 15% trường hợp. Như vậy, trên con vật đã tồn tại đồng thời hai quá trình tự miễn đối với tuyến giáp và tuyến tiêu hóa ở dạ dày, gi ống như vẫn thường gặp trên người. Nếu ta làm biến đổi tình trạng miễn dịch của con vật thì bệnh cảnh cũng thay đổi theo. Ví dụ, nếu cắt bỏ tuyến Fabricius thì độ trầm trọng của viêm tuyến giáp giảm hẳn chứng tỏ vai trò của tự kháng thể trong bệnh này rất quan trọng. Ngược lại nếu ta cắt bỏ tuyến ức có vai trò trong việc khống chế bớt sự phát sinh bệnh.
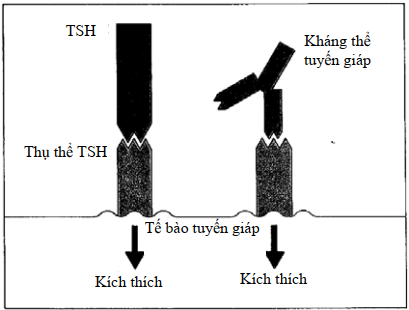
Hình 11.3. Phản ứng tự miễn đối với thụ thể màng tế bào
Tế bào tuyến giáp được kích thích khi thụ thể TSH liên kết với TSH. Kháng thể chống TSH trong huyết thanh bệnh nhân Basedow có thể tạo ra kích thích tương tự và làm cho tế bào
Trên người, rõ ràng là không thể làm thí nghiệm trực tiếp, nhưng đã có khá nhiều bằng chứng cho thấy tự kháng thể là một yếu tố gây bệnh quan trọng. Trong một số bệnh người ta đã phát hiện rằng các tự kháng thể chống thụ thể hormon đã gây phản ứng kích thích thụ thể như tác dụng của hormon (Hình 11.3) vì thế mà gây ra bệnh cảnh như tăng hoạt hormon thật sự. Nhiễm độc giáp có lẽ là rối loạn đầu tiên của kiểu này được biết đến, trong đó kháng thể kháng thụ thể TSH đã được công nhận là nguyên nhân. Đồng thời, bệnh nhiễm cảnh nhiễm độc giáp cũng có khi xảy ra ở trẻ sơ sinh nói lên tính chất di truyền thụ động của kháng thể từ máu mẹ sang và kháng thể thụ động này cũng có thể gây bệnh.
Một ví dụ khác của bệnh tự miễn là bệnh vô sinh đàn ông, trong đó tự kháng thể kháng tinh trùng làm cho tinh trùng dính lại với nhau. Và, khi đó, rõ ràng là chúng khó có thể bơi đến tiếp cận với trứng được như bình thường.
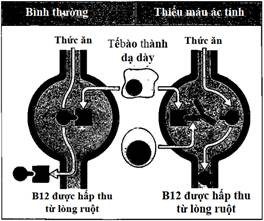
Trong bệnh thiếu máu ác tính có xuất hiện một tự kháng thể ngăn cản sự hấp thụ vitamine B12 theo đường ăn uống. Chúng ta biết rằng B12 không thể hấp thu dưới dạng tự do được, mà cần phải được gắn vào một protein do dạ dày tiết ra gọi là yếu tố nội, và chỉ có phức hợp B12 – yếu tố nội mới có thể hấp thụ qua niêm mạc ruột. Trong bệnh nhân thiếu máu ác tính người ta đã tìm thấy một kháng thể có khả năng phong bế tác dụng của yếu tố nội. Kháng thể này được tiết ra bởi các tương bào có mặt trong niêm mạc dạ dày và phong bế yếu tố nội dẫn đến ngăn cản hấp thu B12 và bệnh thiếu máu ác tính hình thành (Hình 11.4).
Hình 11.4. Mất hấp thu vitamin B12 trong bệnh thiếu máu ác tính
Bình thường vitamin B12 được hấp thu qua niêm mạc ruột dưới dạng một phức hợp với yếu tố nội (IF). Trong bệnh thiếu máu ác tính tự kháng thể chống yếu tố nội trong dịch dạ dày đã kết hợp với yếu tố nội làm cho
Các ví dụ khác về nguyên nhân gây bệnh của tự kháng thể là trường hợp hội chứng Goodpasture, kháng thể kháng màng đáy cầu thận. Trong SLE, sự lắng đọng của phức hợp kháng nguyên – kháng thể tại cầu thận là nguyên nhân của tổn thương thận; mà trong thành phần của phức hợp có rất nhiều loại tự kháng thể tham gia; kháng thể kháng nhân, kháng thể kháng DNA, kháng thể kháng cardiolipin,.v.v.
Tóm lại, chúng ta có thể xem phản ứng tự miễn đóng vai trò chủ yếu trong nguyên nhân của hầu hết các bệnh tự miễn.
Cơ chế bệnh sinh
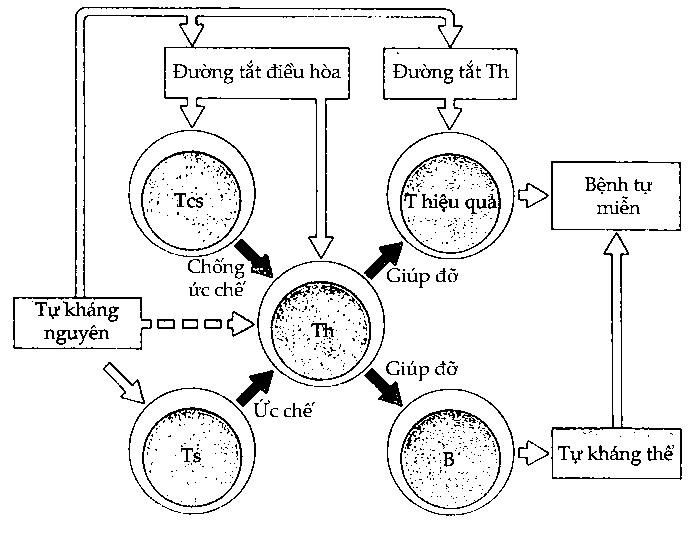
Cho đến nay, người ta đã hoàn toàn công nhận rằng có tồn tại trong cơ thể các tế bào lymphô tự phản ứng. Còn các tự kháng nguyên phản ứng với các tế bào này như thyroglobulin chẳng hạn, trước đây được coi như ẩn núp trong tuyến giáp không tiếp xúc v ới hệ miễn dịch thì đến nay được biết là cũng có mặt trong hệ tuần hoàn cùng với các lymphô. Do đó tự kháng nguyên lẫn tế bào lymphô tự phản ứng đều có điều kiện tiếp xúc với nhau ở người bình thường. Điều này có nghĩa rằng, ở người bình thường đã có một cơ chế ngăn cản phản ứng tự miễn. Và tế bào T ức chế được xem như có vai trò quan trọng trong việc ức chế tính tự phản này. Hình 11.5 mô tả một cơ chế mà trong đó sự kiểm soát bình thường đối với tính tự miễn bỏ qua, người ta gọi đó là cơ chế đường tắt (bypass). Hoạt động kiểm soát bình thường trong cơ thể được đảm trách bởi nhiều loại tế bào ức chế tạo nên một phức hợp ức chế do tế bào T phụ trách. Tuy nhiên, khi có sai sót xảy ra cho tế bào T ức chế thì phản ứng tự miễn có thể xuất hiện.
Điều thú vị là trên lâm sàng người ta đã tìm thấy những người có quan hệ họ hàng với bệnh nhân SLE có sai sót ở các tế bào T ức chế . Điều này nói lên rằng: một là, sự sai sót ở tế bào T ức chế không phải là hậu quả của bệnh, và hai là, tình trạng sai sót này không thể tự nó gây ra bệnh SLE. Điều này cùng với những điều đã đề cập trên đây chứng tỏ rằng có nhiều yếu tố đã tham gia gây bệnh tự miễn. Đồng thời,cũng từ đó, có thể suy thêm ra rằng, những bất thường của tế bào T điều hòa đặc hiệu kháng nguyên hoặc đặc hiệu idioptyp cũng đã tham gia vào cơ chế gây nên.
Trên một số thí nghiệm người ta phát hiện rằng một số phân tử thụ thể trên bề mặt t ế bào bình thường có tính chất “im lặng” miễn dịch vì màng những tế bào này không có kháng nguyên MHC lớp II; nhưng khi được kích thích một cách thích hợp thì có thể xuất hiện sản phẩm MHC lớp II. Ví dụ tế bào tuyến giáp có thể tạo phân tử HLA-D khi được kích thích bằng các lectin thực vật và các phân tử này cùng với các thụ thể b ề mặt đã kích thích các tế bào T tự phản ứng tạo ra phản ứng tự miễn đối với thụ thể tế bào tuyến giáp.
Người ta cũng đã đưa ra nhiều cơ chế khác về sự hình thành bệnh tự miễn. Các cơ chế đó được minh họa ở các hình 11.6, 11.7, và 11.8.
Hình 11.5. Bệnh tự miễn do mất kiểm soát phản ứng tự miễn
Tế bào B tự phản ứng, tế bào T hiệu quả và tự kháng nguyên bình thường vẫn có mặt trong cơ thể nhưng không được khởi động nhờ sự ức chế của tế bào Ts đối với tế bào Th tương ứng. Khi có một nguyên nhân gì đó hoạt hóa tế bào Th này hoặc có tế bào chống Ts (Tcs) xuất hiện thì phản ứng tự miễn không còn bị kiểm soát nữa và bệnh tự miễn xảy ra.
Đặc biệt, Hình 11.7 minh họa một ví dụ thú vị là mạng idioptyp có thể tham gia gây bệnh tự miễn bằng cách tác động vào tế bào T hoặc tế bào B tự phản ứng có mang idioptyp chung phản ứng chéo với idioptyp trên một kháng thể được tạo thành do kích thích của vi sinh vật hoặc phản ứng chéo với cấu trúc kháng nguyên trên vi sinh vật. Nhưng, ngay cả trong trường hợp này, phản ứng tự miễn cũng vẫn không xảy ra nếu không có sai sót ở mức tế bào T ức chế và điều này lại một lần nữa nhấn mạnh vai trò đa yếu tố trong việc thiết lập một phản ứng tự miễn kéo dài.
Chẩn đoán và tiên lượng
Dù cho quan hệ giữa kháng thể và quá trình bệnh có thế nào đi nữa, thì sự hiện diện của kháng thể rõ ràng là đã cung cấp những dấu hiệu có giá trị để chẩn đoán bệnh. Một ví dụ điển hình là người ta đã tìm kháng thể kháng ty lạp thể để chẩn đoán xác định xơ gan mật tiên phát. Điều này giúp cho các nhà lâm sàng khỏi phải mở bụng thăm dò như thời kỳ trước đây có thể gây nhiều nguy hiểm cho bệnh nhân.
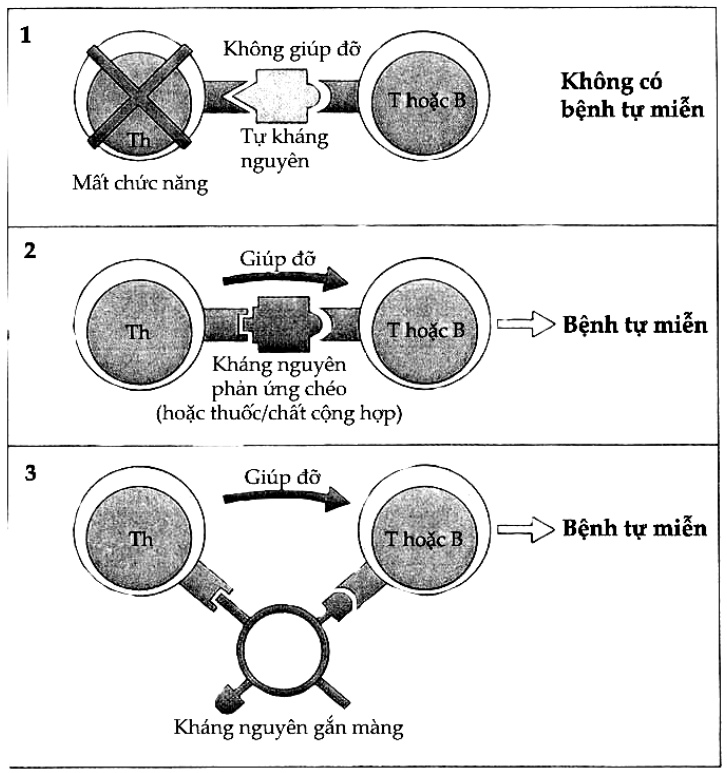
Hình 11.6. Khởi động phản ứng tự miễn qua đường tắt 1 đối với tế bào T
(1)Bình thường phản ứng tự miễn không xảy ra vì tế bào T tự phản ứng và tự kháng nguyên bị ức chế hoặc loại bỏ. (2) Khi có kháng nguyên phản ứng chéo xuất hiện, một quần thể Th mới sẽ tạo ra phản ứng giúp đỡ. (3) Cũng có khi một phân tử màng lại có tác dụng như tự kháng nguyên để tạo hiệu ứng giúp đỡ tạo ra bệnh tự miễn.
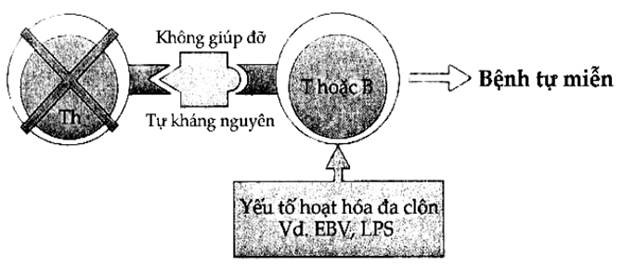
Hình 11.7. Khởi động phản ứng tự miễn bằng đường tắt 2 đối với tế bào T
Các tế bào tự phản ứng có thể được kích thích bởi các chất hoạt hóa đa clôn như virus Epstein-Barr hoặc lipopolysaccharid vi khuẩn.
Tự kháng thể còn có giá trị tiên lượng. Ví dụ trường hợp một đứa trẻ có anh chị em mắc bệnh đái đường phụ thuộc insulin, nó có chung HLA với anh chị, đồng thời trong huyết thanh có cả khảng thể khảng tế bào đảo tụy. Sau 3 năm nghiên cứu, thì thấy ở đứa trẻ cũng xuất hiện bệnh đái tháo đường nặng, điều này chứng tỏ giá trị tiên lượng của các tự kháng thể này, và kháng thể đã xuất hiện khá lâu trước khi bệnh xuất hiện.
Điều trị
Một cách kinh điển, trong các bệnh tự miễn đặc hiệu cơ quan, tổn thương thường điều chỉnh được nhờ kiểm soát chuyển hóa. Ví dụ, trong suy giáp, thiếu hormon tuyến giáp có thể khống chế được bằng cách cho thyronxin còn nhiễm độc giáp thì thuốc kháng giáp thường có thể cho tác dụng tốt. Trong thiếu máu ác tính, điều chỉnh chuyển hóa có thể thực hiện được bằng cách cho tiêm vitamin B12 bổ sung, và trong nhược cơ năng thì dùng các chất ức chế cholinesterase. Nếu chức năng tuyến hoàn toàn mất và không thể bù được bằng hormon như trong trường hợp viêm thận lupus hoặc viêm khớp dạng thấp mạn tính thì cần phải tiến hành ghép mô hoặc thay cơ quan giả.
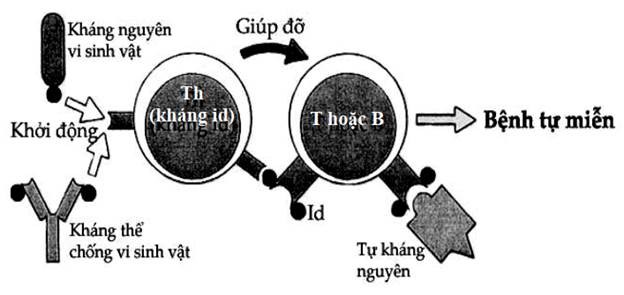
Hình 11.8. Khởi động phản ứng tự miễn bằng con đường idiotyp
Phản ứng tự miễn cũng có thể xảy ra nếu tế bào T hoặc B tự phản ứng mang một idiotyp phổ biến có phản ứng chéo với idiotyp trên kháng thể hoặc với cấu trúc trên vi khuẩn.
Các liệu pháp ức chế miễn dịch kinh điển dùng thuốc chống phân bào có thể dùng để giảm phản ứng miễn dịch nhưng do những phản ứng phụ của thuốc mà các thuốc này chỉ dùng trong trường hợp bệnh quá nặng như SLE, viêm da cơ. Tất nhiên, các thuốc chống viêm có thể dùng cho các bệnh thấp.
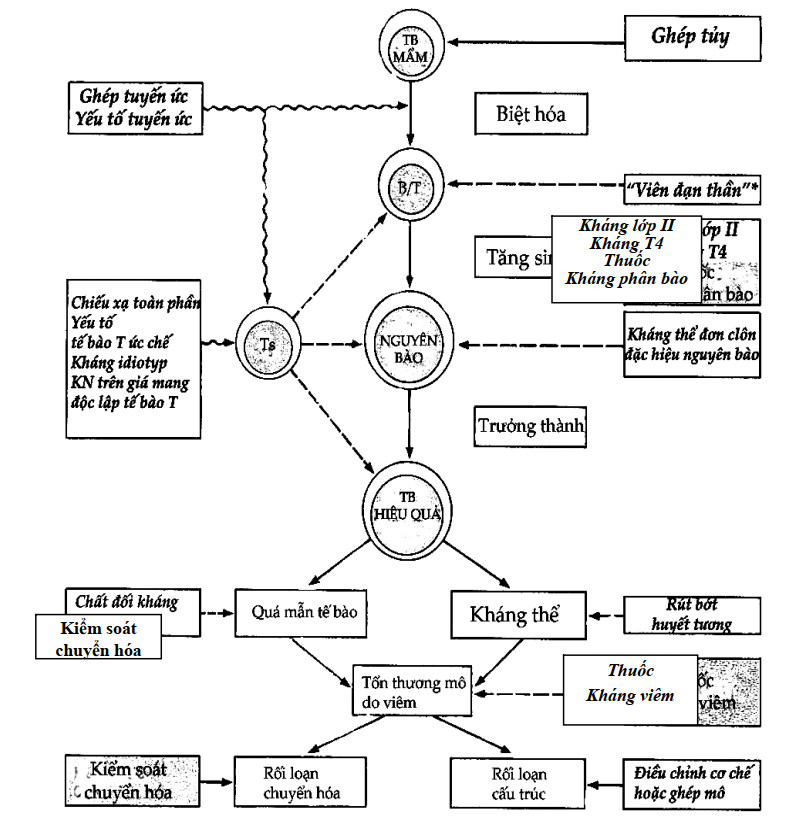
Bởi vì chúng ta đã biết quá nhiều về cơ chế bệnh sinh nên tùy theo từng khâu của cơ chế bệnh mà ta có thể dùng những phương tiện khác để khống chế bệnh tự miễn (Hình 11.9). Đặc biệt việc khai thác mạng idioptyp để ức chế các idioptyp trên tế bào T khỏi động và T hiệu quả đang là một hứa hẹn khả quan.
Hình 11.9. Điều trị bệnh tự miễn
Trên sơ đồ, các phương tiện điều trị kinh điển hiện nay được in bằng chữ thường trên nền xám. Còn các biện pháp mới được in nghiêng đậm.
Một số hiệu quả thuận lợi của phản ứng tự miễn
Cũng có khi việc gây phản ứng tự miễn cho một cơ thể lại tỏ ra có lợi cho cơ thể đó (Bảng 11.2). Mặc dù đây là những việc làm có thể thực hiện được, vấn đề chính (nhưng không phải là duy nhất) đối với bệnh nhân là làm thế nào để nhận diện chính xác các epitop cần gây phản ứng tự miễn mà không gây phản ứng chéo với các tự kháng nguyên khác; và ngoài ra là chúng ta phải làm thế nào để tìm được những chất tải (carrier) hiệu quả nhất cũng như các tá chất thích hợp để có thể gây phản ứng ở mức độ mong muốn.
Bảng 11.2. Các hiệu quả có lợi của phản ứng tự miễn
|
Đích tác động |
Nhằm mục đích |
|
Human chorionic gonadotropin |
Chống thụ tinh |
|
LHRH |
Giả thiến (đối với bò thịt) |
|
Ung thư |
Điều trị bằng miễn dịch |
|
Idioptyp |
Điều chỉnh đáp ứng miễn dịch |