Bình thường, khoảng một phần ba sắt dự trữ (ferritin và hemosiderin) trong cơ thể được tìm thấy ở gan. Khoảng 98% sắt trong gan được tìm thấy ở các tế bào gan, hình thành nên 80% khối lượng gan toàn bộ, 1,5 – 2% còn lại ở các tế bào lưới võng nội mô, tế bào nội mô, tế bào ống dẫn mật và nguyên bào sợi. Sắt vào tế bào quá mức cần thiết thì sẽ được tích lũy thành những dạng dự trữ chính gồm ferritin và hemosiderin. Tích lũy sắt dự trữ tăng dần có liên quan đến nhiễm độc tế bào dù cơ chế sinh lý bệnh đặc hiệu cho tổn thương tế bào gan và xơ gan chưa được hiểu trọn vẹn. Những cơ chế này bao gồm quá trình peroxydase hóa chất lipid tại màng bào quan, làm cho các tiêu thể trở nên không bền vững và giảm quá trình oxy hóa tại các ty thể. Sắt cũng tác động trực tiếp đến sự tổng hợp và thoái hóa collagen cùng với sự biến đổi men trong các vi thể.
Gan đóng vai trò quan trọng trong sự hằng định nội môi sắt. Ngoài việc sắt được phóng thích từ các tế bào hồng cầu do truyền máu, một tỉ lệ hấp thu sắt đáng kể qua đường tiêu hóa đã được ghi nhận. Chất sắt dư thừa ban đầu được bắt giữ ở tế bào Kuffer nhưng khi do nhu cầu truyền máu gây ra quá tải sắt nghiêm trọng, nhanh chóng tràn vào các tế bào nhu mô gan, nguy cơ diễn tiến đến xơ gan sau này. Đối với bệnh nhân β-thalassemia, nếu không có các yếu tố nguy cơ khác kèm theo, nồng độ ngưỡng sắt trong gan diễn tiến đến tạo xơ là 16mg/g trọng lượng gan khô (Angelucci, 2002). Những nghiên cứu lâm sàng ghi nhận mối liên hệ giữa nồng độ sắt trong gan với quá trình nhiễm độc tế bào gan do sắt.
Nồng độ sắt trong gan (HIC) là tiêu chuẩn vàng để đo lượng sắt quá tải trong cơ thể. (HIC tính bằng mg/g trọng lượng khô x 10,6 = lượng sắt dự trữ toàn bộ trong cơ thể tính bằng mg/kg) (theo Angelucci, 2000). Các kỹ thuật không xâm lấn để đánh giá nồng độ sắt trong gan gồm chụp cắt lớp điện toán, đo độ cảm từ sinh học của gan (SQUID) và chụp cộng hưởng từ (MRI). Trong số đó, chụp MRI đánh giá đo tốc độ hồi phục từ là chính xác và có triển vọng nhất (Wood, 2005).
Lượng sắt dự trữ trong gan liên quan mật thiết với lượng sắt tích lũy do truyền máu và là chất chỉ điểm cho thấy hiệu quả của điều trị thải sắt và tiên lượng. Sắt trong gan tăng dẫn đến tăng nguy cơ rối loạn dung nạp glucose, bệnh tiểu đường, bệnh tim và tử vong.
Viêm gan virus c
Virus RNA này được mô tả đầu tiên vào năm 1989, với tên gọi trước đây là virus viêm gan không A không B. Cho đến nay, phần lớn virus HCV qua các nghiên cứu phân lập được chia thành 6 nhóm chính, với các kiểu gen được xác định từ 1 đến 6, mỗi kiểu gen có những phân nhóm nhỏ hơn (a, b, c,…) Những kháng thể hiện diện sau lây nhiễm không có tính bảo vệ nhưng cho thấy sự lây nhiễm trong quá khứ hoặc hiện tại. Sự hiện diện RNA vòng của virus HCV trong máu cho chẩn đoán bệnh đang hoạt động (Sahara, 1996).
Các biện pháp phòng ngừa giảm thiểu nguy cơ viêm gan C sau truyền máu bao gồm sự chọn lựa cẩn thận những người tự nguyện và xét nghiệm sàng lọc những người hiến máu.
Diễn tiến bệnh và biến chứng của quá trình lây nhiễm
Nhiễm trùng cấp: thường lành tính, với >80% không triệu chứng. Viêm gan thể không vàng da tối cấp là rất hiếm.
Nhiễm trùng mạn: chiếm 70-80% trường hợp, dẫn đến bệnh gan mạn tính. Tuy nhiên, kết quả lâu dài về mặt lâm sàng rất thay đổi vì những lý do mà cho đến nay vẫn chưa rõ. Những yếu tố quyết định độ nặng hay mạn tính của bệnh cũng như sự đáp ứng điều trị gồm tuổi mắc phải, cơ địa người nhiễm (ví dụ như hệ miễn dịch), yếu tố đặc hiệu cho virus (ví dụ như kiểu gen) và quan trọng nhất là các bệnh kết hợp.
Xơ gan: chiếm một tỉ lệ phần trăm khác nhau giữa những bệnh nhân nhiễm HCV, dao động từ
Khả năng hồi phục: Đã có báo cáo ghi nhận rằng ở các bệnh nhân thalassemia thì bệnh lý gan tiến triển xơ hóa hay xơ gan giai đoạn sớm (trường hợp xơ gan còn bù ở trẻ em mức độ Child A — hay xơ gan còn bù tốt) có khả năng phục hồi khi giải quyết được tình trạng bệnh nền của tổn thương gan (gan ứ sắt hay viêm gan virus C). (Muretto, 2002).
Bệnh gan giai đoạn cuối: nên tiến đến xem xét việc cấy ghép gan. Viêm gan C hiện tại là nguyên nhân được chỉ định ghép gan thường gặp nhất trên toàn thế giới. Viêm gan C tái phát xảy ra trên 90% trường hợp sau cấy ghép nhưng thường nhẹ. Sự sống kéo dài sau ghép gan của bệnh viêm gan virus C giống với các chẩn đoán khác, trung bình 65% sau 5 năm (Gane, 1996).
Ung thư biểu mô tế bào gan: hiện diện trong 1-5% người nhiễm sau 20 năm, đặc biệt sau giai đoạn tiến triển đến xơ gan thì nguy cơ ung thư sau đó mỗi năm tăng 1-4% (Colombo, 1991). Phòng chống và phát hiện sớm ung thư biểu mô tế bào gan thì hiệu quả hơn việc cố gắng điều trị. Bệnh nhân xơ gan nên trải qua chương trình tầm soát thường xuyên mỗi 6 tháng, gồm siêu âm gan và kiểm tra alpha-fetoprotein, để phát hiện sớm ung thư biểu mô tế bào gan.
Biểu hiện ngoài gan của nhiễm HCV gồm rối loạn chuyển hóa porphyrin biểu hiện muộn trên da, tăng hỗn hợp cryoglobulin nguyên phát trong máu, viêm vi cầu thận cấp, viêm tuyến giáp tự miễn và viêm mạch máu (Sharara, 1996).
* Xơ gan được chia thành 3 giai đoạn theo điểm số Child-Pugh, Điểm 5-6 (Điểm A) được mô tả như sau: không báng bụng, Bilirubin 3,5 g/dl, INR
Những đặc điểm đặc trưng của viêm gan c trong bệnh thalassemia thể nặng
Bệnh nhân thalassemia bị nhiễm viêm gan virus C thì thường nặng vì sự ứ sắt kèm theo, còn nhiễm đồng thời các virus khác (HBV, HIV) và nhiễm phối hợp những kiểu gen viêm gan C khác nhau. Sắt và HCV đã được xem là các yếu tố độc lập, tuy nhiên khi cùng nhiễm trên bệnh nhân sẽ tương tác lẫn nhau diễn tiến đến mô gan hóa sợi và xơ gan, với tác động tăng cấp số nhân (Angelucci, 2002). Do đó, những bệnh nhân thalassemia không thải sắt tốt sẽ tăng nguy cơ diễn tiến đến xơ gan.
Chẩn đoán và theo dõi
Xét nghiệm kháng thể
Đây là xét nghiệm có giá trị nhất trong việc sàng lọc máu và các chế phẩm máu và cũng là xét nghiệm ban đầu cho bệnh nhân có nồng độ transaminase huyết thanh cao kéo dài không giải thích được hay nghi ngờ có bệnh gan mạn tính. Phản ứng PCR phát hiện HCV RNA là tiêu chuẩn hiện nay để xác định nhiễm virus. Việc xác định kiểu gen và số lượng RNA HCV trong huyết thanh chỉ có ích trong việc quyết định cách và thời gian điều trị (xem bên dưới).
Sinh thiết gan trong thalassemia thể nặng
Sinh thiết gan trước khi điều trị là hữu ích trong việc xác định mức độ tổn thương gan và hướng dẫn quyết định cách điều trị và dự đoán các biến chứng.
Điều trị
Đây là một lĩnh vực mà kiến thức thay đổi rất nhanh chóng do đó việc điều trị viêm gan cho bệnh nhân thalassemia cần được phối hợp chặt chẽ với một chuyên gia về bệnh gan.
Tương tự như bệnh nhân không phải thalassemia, điều trị viêm gan C ở bệnh nhân thalassemia nhằm mục đích diệt trừ virus, cải thiện cấu trúc mô học gan, giảm nguy cơ xơ gan và ung thư biểu mô tế bào gan.
Lựa chọn bệnh nhân để điều trị
Những bệnh nhân được chẩn đoán nhiễm HCV cấp và HCV RNA huyết thanh dương tính liên tục sau 12 tuần phơi nhiễm hoặc chẩn đoán nên được điều trị (Sharara, 2006).
Bắt đầu điều trị viêm gan C thông thường dựa vào một hay nhiều yếu tố sau đây:
Hiện diện HCV-RNA kéo dài.
Nồng độ ALT huyết thanh từ trung bình đến cao.
Cấu trúc mô học gan bất thường.
Những kết quả đáng khích lệ của việc điều trị HCV trong thalassemia cùng với những nguy cơ làm bệnh viêm gan mạn nặng hơn đã đề cập ở trên đối với những bệnh nhân này, nói lên rằng sự hiện diện của một mình HCV-RNA trong huyết thanh là đủ để xem xét việc điều trị bệnh nhân thalassemia, khi người bệnh không có chống chỉ định hay bệnh kết hợp gợi ý nào khác.
Đáp ứng điều trị
Tùy thuộc kiểu gen HCV và lượng virus, 40-80% bệnh nhân viêm gan mạn tính sẽ đáp ứng điều trị với pegylated interferon và ribavirin theo tiêu chuẩn hiện hành. Đáp ứng điều trị được định nghĩa là khi xét nghiệm định tính HCV-RNA siêu nhạy bằng PCR âm tính sau 24 tuần ngưng điều trị.
Sự đáp ứng của bệnh nhân được phân loại như sau:
Đáp ứng virus sớm: được xác định khi không phát hiện HCV-RNA hay giảm lượng virus > 2 log sau 12 tuần điều trị.
Đáp ứng lúc kết thúc điều trị: được xác định khi không có HCV-RNA lúc kết thúc điều trị.
Đáp ứng virus dài hạn: không có HCV-RNA trên 6 tháng sau khi chấm dứt điều trị. Trên thực tế, điều này tương đương với sự tiệt trừ sạch virus HCV.
Không đáp ứng: không thấy giảm đáng kể HCV-RNA (được định nghĩa là giảm > 2 log so với ngưỡng) sau 12 tuần điều trị.
Tái phát: sự xuất hiện lại HCV-RNA sau một đợt điều trị đầy đủ có đáp ứng.
Theo dõi đáp ứng
Tùy thuộc kiểu gen HCV, khuyến cáo hiện nay là đánh giá đáp ứng về mặt sinh hóa (ALT huyết thanh) và virus học (HCV-RNA) sau 4 – 12 tuần điều trị và tiếp tục điều trị thêm 12 – 24 tuần đối với bệnh nhân không phát hiện thấy HCV-RNA. Do ALT huyết thanh có thể cao trong những nguyên nhân khác trên bệnh nhân thalassemia (ứ sắt, nhiễm trùng kèm theo), theo dõi đáp ứng phải dựa trên RNA của HCV.
Tiên lượng kém đáp ứng
Các yếu tố tiên lượng xấu đối với tất cả bệnh nhân viêm gan C là:
Mức ngưỡng HCV-RNA cao và không bị phân hủy sớm (4-12 tuần) khi bắt đầu điều trị.
Kiểu gen HCV 1 hay 4.
Hiện diện sự xơ hóa bắc cầu hay xơ gan.
Sự tồn tại đồng thời của virus khác (HBV, HIV)
Vai trò của ứ sắt trong vấn đề cụ thể này còn đang tranh cãi.
Vì không có yếu tố cơ sở nào để tiên lượng điều trị là thành công hay thất bại nên từ chối điều trị dựa vào những yếu tố gợi ý đáp ứng kém thì không xác đáng. Do ứ sắt có thể làm giảm khả năng điều trị thành công bệnh viêm gan C và vì những lý do lâm sàng phổ biến nói chung, liệu pháp thải sắt hiệu quả cần được xem xét thực hiện trước khi bắt đầu điều trị kháng virus đối với bệnh nhân kiểm soát kém lượng sắt do truyền máu.
Chế độ điều trị
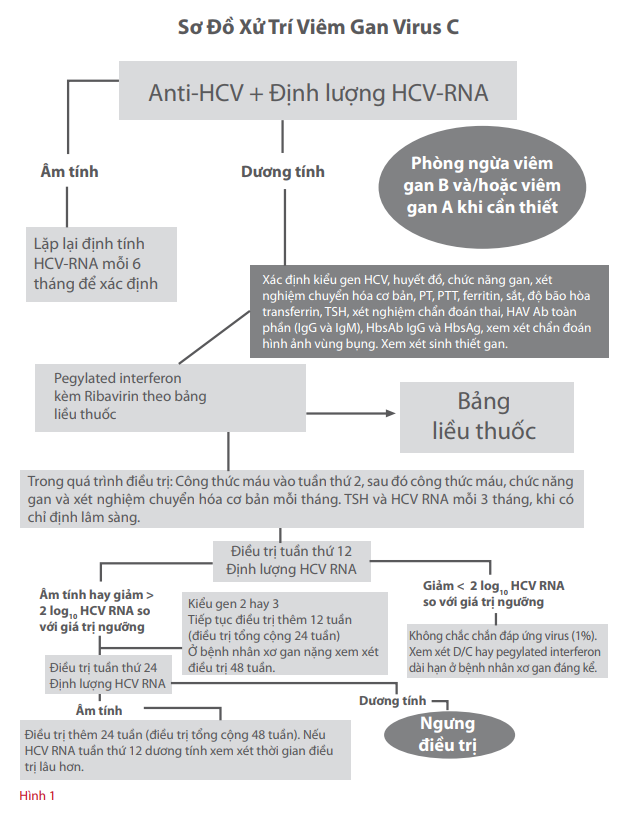
Tiêu chuẩn vàng là điều trị phối hợp pegylated interferon và ribavirin. Hình 1 trình bày một ví dụ về sơ đồ điều trị viêm gan C.
Loại interferon: Pegylated interferon a-2α hay a-2β tiêm dưới da một tuần một lần.
Thời gian: 24 đến 48 tuần, phụ thuộc kiểu gen.
Tác dụng phụ: Các tác dụng phụ điển hình ở đa số bệnh nhân là triệu chứng giống cúm, mất ngủ, thay đổi nhận thức và tính tình, đặc biệt trong 2 tuần đầu điều trị interferon. Giảm bạch cầu đa nhân trung tính và giảm tiểu cầu tùy thuộc liều thường xảy ra trong điều trị với interferon. Biến chứng này cần chú ý đặc biệt ở bệnh nhân thalassemia có cường lách. Vì cả hai deferiprone và interferon có thể gây giảm bạch cầu hạt, theo lí thuyết có những nguy cơ liên quan đến cách sử dụng phối hợp hai thuốc trên, sự kết hợp này cần phải thận trọng và giám sát cẩn thận. Suy giáp là một biến chứng quan trọng của việc điều trị với interferon.
Một số bệnh nhân có các phản ứng quá mức tại vị trí truyền desferriorxamine trong khi điều trị với interferon. Một vài bệnh nhân thalassemia điều trị với interferon được ghi nhận có suy tim, do đó cần phải chú ý đặc biệt khi kê toa interferon cho bệnh nhân có bệnh tim trước đó.
Theo dõi các tác dụng phụ: Suy giáp phải được theo dõi chặt chẽ trên bệnh nhân điều trị với interferon và xét nghiệm chức năng tuyến giáp cùng với sự hiện diện kháng thể kháng giáp nên làm trước khi bắt đầu điều trị. Theo dõi thường xuyên công thức máu cũng cần thiết để nhận biết giảm bạch cầu đa nhân trung tính và giảm tiểu cầu. Xem xét ngừng điều trị nếu số lượng tuyệt đối bạch cầu đa nhân trung tính giảm dưới 1.000.
Ribavirin: là một chất đồng đẳng với nucleoside, hấp thu tốt qua đường uống, thường dùng liều 800-1200 mg/ngày. Hoạt động kháng virus rất hạn chế khi điều trị đơn độc ribavirin trong viêm gan C, nhưng khi điều trị phối hợp với interferon lại tăng đáng kể tỉ lệ đáp ứng kéo dài so với điều trị interferon đơn độc.
Tác dụng phụ: Tán huyết với việc giảm hemoglobine 10-20% so với giá trị bình thường xảy ra ở hầu hết bệnh nhân không phải thalassemia.
Trong bệnh thalassemia thể nặng, tác dụng phụ tán huyết do Ribavirin có thể tăng thêm nhiều và tăng nhu cầu truyền máu lên 30%, điều này đòi hỏi điều chỉnh cẩn thận khoảng thời gian truyền máu và tăng cường liệu pháp thải sắt (Li, 2002; Inati, 2005).
Điều quan trọng cần lưu ý là giảm liều ribavirin liên quan với đáp ứng virus dài hạn kém và do đó để bù cho tán huyết liên quan đến ribavirin nên điều chỉnh cách điều trị thải sắt hơn là thay đổi liều ribavirin đề nghị (Inati 2005).
Thời gian điều trị và theo dõi nồng độ virus: phụ thuộc chủ yếu vào kiểu gen
HCV. Đối với kiểu gen 1 hay 4, tiến hành điều trị trong 48 tuần cho dù có đáp ứng virus sớm sau 12 tuần. Trong trường hợp không có đáp ứng virus sớm, ngưng điều trị và xem xét các lựa chọn điều trị cao hơn.
Cách tiếp cận này có hiệu lực trên bệnh nhân thalassemia nhiễm HCV có kiểu gen 1 hay 4 với đáp ứng virus dài hạn 64% và những bệnh nhân không phát hiện HCV – RNA trong 12 tuần điều trị (Inati, 2005). Đối với kiểu gen 2 hay 3, việc điều trị được giới hạn trong 24 tuần. Xác định nồng độ virus sau 12 tuần thường không cần thiết đối với kiểu gen 2 hay 3 vì có tỉ lệ đáp ứng virus dài hạn cao, khoảng 80%.
Lựa chọn điều trị cho người không đáp ứng
Những lựa chọn này hiện tại chưa được thử nghiệm và xác minh vững chắc. Những bệnh nhân xơ gan nặng trên sinh thiết gan cần được xem xét xúc tiến lựa chọn điều trị thứ hai.
Quản lý dân số bệnh nhân đặc biệt
Việc tham khảo ý kiến với một bác sĩ giàu kinh nghiệm trong quản lý bệnh gan thì đặc biệt quan trọng trong việc quản lý lâm sàng những bệnh nhân sau đây:
Trẻ em
Bệnh nhân xơ gan
Bệnh nhân suy giảm miễn dịch
Phụ nữ mang thai
Bệnh nhân viêm gan C cấp
Phòng ngừa
Hiện tại không có vaccine hay globulin miễn dịch nào phòng ngừa được bệnh viêm gan C. Những khuyến cáo sau đây được đưa ra để giảm nguy cơ lây truyền không phải qua đường tiêm chích:
Nguy cơ lây truyền qua đường tình dục nói chung là rất thấp. Tuy nhiên, những dữ liệu hiện có lại không đầy đủ để đề nghị những thay đổi các khuyến cáo hiện nay. Những bệnh nhân này nên khuyến khích bạn tình kiểm tra bệnh viêm gan C và quan hệ tình dục an toàn.
Những biện pháp chung như tránh dùng chung bàn chải đánh răng, dao cạo râu,… được khuyên để tránh lây truyền cho các thành viên trong gia đình. Tuy nhiên, nguy cơ lây truyền thấp và các biện pháp cách ly đặc biệt như không dùng chung khăm tắm và đồ dùng ăn uống có thể không cần thiết.
Virus viêm gan b
Tỉ lệ mới mắc hàng năm
Chiến lược tiêm phòng, tầm soát HbsAg ở những người hiến máu và các biện pháp y tế khác đã làm giảm đáng kể tỉ lệ lây nhiễm viêm gan B ở đa số các nước châu Âu và Bắc Mỹ cũng như các nơi khác trên thế giới. Tuy nhiên, viêm gan B vẫn còn là một vấn đề y khoa đáng lo ngại, chủ yếu ở các nước đang phát triển.
Tỉ lệ HbsAg dương tính hiện nay trong bệnh thalassemia thể nặng dao động từ 20% và lây nhiễm viêm gan B vẫn còn là một nguyên nhân gây bệnh gan mạn và ung thư biểu mô tế bào gan trên bệnh nhân thalassemia ở nhiều nước đang phát triển trên thế giới.
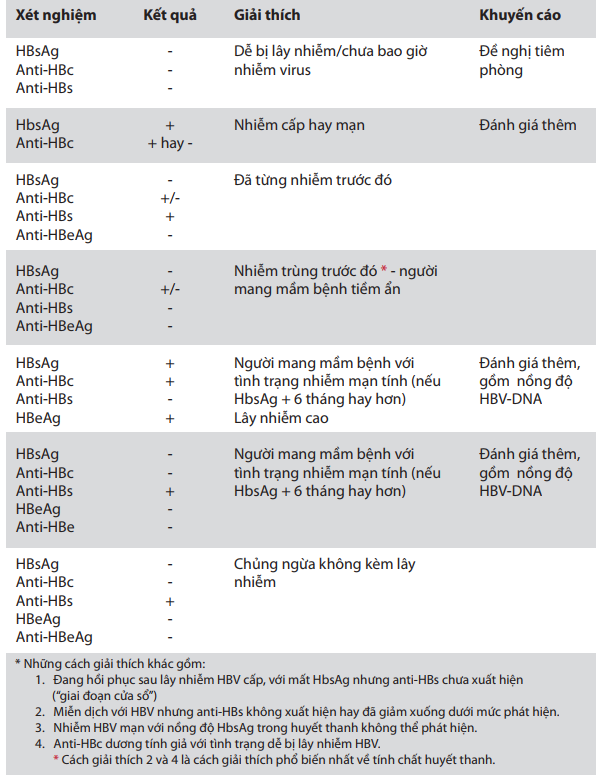
Tầm quan trọng trên lâm sàng của các chất chỉ điểm HBV Mặc dù đã có các xét nghiệm tầm soát viêm gan B tốt, việc giải thích kết quả có thể khó khăn hoặc gây hiểu nhầm.
Nhiễm trùng cấp: HbsAg là một chất chỉ điểm đáng tin cậy (có thể hiện diện trong 4-5 tháng). HbeAg cũng hiện diện thoáng qua (1-3 tháng). Anti-Hbc IgM là xét nghiệm chẩn đoán nhiễm HBV cấp tin cậy nhất.
Nhiễm trùng mạn: (người mang mầm bệnh) được đặc trưng bởi sự hiện diện HbsAg và anti-HBc trong máu (thường kèm với HbeAg hay anti HBe). Theo đúng định nghĩa quốc tế, người mang mầm bệnh được phân loại như sau:
Những người mang mầm bệnh thể hoạt động: được xác định bởi sự hiện diện của HbeAg hay kháng thể AntiHbe và nồng độ virus ≥5 log10 bản sao/ ml (mặc dù những người khác trích dẫn con số ≥4 log10 bản sao/ml) theo các tiêu chuẩn gần đây nhất. Đa số các trường hợp mang mầm bệnh thể hoạt động có liên quan đến sự hiện diện của bệnh gan.
Người mang mầm bệnh thể không hoạt động: được đặc trưng bởi nồng độ transaminase bình thường liên tục ở các đối tượng anti-Hbe dương tính, kết hợp với nồng độ virus dưới ngưỡng (10) và cuối cùng là IgM anti-HBc
Nhiễm trùng trước đây: sự hiện diện của kháng thể anti-HBc ± anti-HBs biểu hiện nhiễm trùng đã qua. Trong những trường hợp đặc biệt, như suy giảm miễn dịch nặng (ví dụ như cấy ghép tế bào gốc tạo máu), HBV tái kích hoạt sau một thời gian nhiễm trùng trước đây đã được ghi nhận. Do đó, loại bệnh nhân này cũng được gọi là người mang mầm bệnh tiềm ẩn (Marzano, 2007).
Tiêm phòng: sự hiện diện kháng thể đối với HbsAg (nếu anti-HBc không có mặt) cho biết đã tiêm phòng.
Bệnh nhân thalassemia cần tầm soát tất cả các dấu hiệu chỉ điểm viêm gan B trong huyết thanh và phân loại theo Bảng 1 và đưa ra danh sách các diễn giải có thể về các kết quả sàng lọc.
Diễn tiến bệnh
Viêm gan cấp: đây là dạng phổ biến nhất với thời gian ủ bệnh 4-20 tuần. Độ nặng thay đổi thường xuyên, các dấu hiệu tiền triệu như đau khớp và nổi mề đay thường xảy ra trước thời kỳ vàng da. Hiếm khi diễn tiến đến suy tế bào gan tối cấp (≤ 1%). Quản lý viêm gan B cấp thường là các biện pháp hỗ trợ đơn thuần.
Diễn tiến đến viêm gan mạn: xảy ra từ 5-10% ở trẻ khỏe mạnh và 90% ở trẻ sơ sinh. Viêm gan cấp thể vàng da ở người lớn hiếm khi chuyển sang thể mạn tính, thường xảy ra
Xơ gan: xảy ra với tỉ lệ 1-2,2% mỗi năm. Ứ sắt trong thalassemia có thể làm tăng nguy cơ xơ gan vì có thể nhiễm đồng thời HCV.
Ung thư biểu mô tế bào gan: là một biến chứng đã được công nhận của nhiễm viêm gan B mạn.
Bảng 1: Những cách giải thích có thể về kết quả tầm soát viêm gan B mạn
Phòng ngừa:
Chủng ngừa: Tất cả bệnh nhân mới chẩn đoán bệnh β-thalassemia cần tiêm ngừa viêm gan B. 95% người bình thường cần 3 mũi tiêm phòng (lúc 0,1 và 6 tháng) để tạo được đáp ứng miễn dịch. Vaccin này không hiệu quả đối với những người đã từng phơi nhiễm viêm gan B.
Globulin tăng miễn dịch có thể hạn chế nguy cơ nhiễm trùng cấp tính trên những người tiếp xúc cấp với máu đã xác minh là có nhiễm bệnh.
Phòng ngừa lây truyền từ mẹ sang con: Lây truyền virus viêm gan B từ mẹ sang con xảy ra trong thời kì chu sinh. Nguy cơ lây truyền là 26-40% nếu người mẹ có HBeAg dương tính. Những người mẹ viêm gan B cấp trong khi mang thai lây virus sang bé trên 70% nếu xảy ra trong 3 tháng cuối và trên 90% nếu xảy ra trong vòng 8 ngày sau sanh.
Các biện pháp phòng ngừa lây truyền từ mẹ sang con gồm chủng ngừa viêm gan B và globulin miễn dịch viêm gan B (HBIG) cho những trẻ sơ sinh có mẹ mang mầm bệnh trong vòng 12 giờ sau sanh. Điều này làm giảm >90% nguy cơ lây truyền.
Không như viêm gan C, viêm gan B lây qua đường tình dục và quan hệ cá nhân gần gũi rất cao. Các thành viên thân thiết trong gia đình và những bạn tình của bệnh nhân cần được tư vấn tỉ mỉ và chủng ngừa.
Tổng quan điều trị hbv năm 2007
(Hepatitis Annual Update 2007
website: http://clinicaloptions.com/Hepatitis/AnnualUpdates)
Mục đích chủ yếu điều trị viêm gan B mạn là ngăn chặn lâu dài HBV-DNA huyết thanh và do đó có khả năng làm giảm quá trình diễn tiến đến xơ gan, suy gan và ung thư tế bào gan.
Điểm mấu chốt quan trọng trong xác định hiệu quả điều trị gồm ức chế HBV-DNA huyết thanh đến mức thấp và tốt hơn cả là không phát hiện được, nồng độ ALT bình thường, cải thiện mô học, chuyển đổi kết quả huyết thanh HbeAg trên bệnh nhân HbeAg dương tính, còn trường hợp chuyển đổi kết quả huyết thanh HbsAg thì tương đối hiếm.
Thông tin cung cấp dưới đây bắt nguồn từ phác đồ điều trị Hoa Kỳ, những hướng dẫn của AASLD*, EASL** và APASL***, theo đó, lựa chọn đơn trị liệu ban đầu ưa thích gồm Adefovir, Entecavir và Pegylated Interferon, và hầu như thay thế hoàn toàn interferon alfa-2b chuẩn.
Vì tỉ lệ kháng thuốc cao, Lamivudine và Telbivudine không phải là thuốc ban đầu ưa thích trong đa số người bệnh.
Xu hướng gần đây là điều trị bệnh nhân có bất kỳ sự gia tăng nào của nồng độ HBVDNA và xơ gan còn bù hay mất bù. Điều trị phối hợp với chất đồng đẳng nucleoside cũng được dùng rộng rãi ở bệnh nhân xơ gan cũng như bệnh nhân nhiễm đồng thời HBV và HIV hay những bệnh nhân đã trải qua ghép tủy sau nhiễm HBV.
*AASL: Hiệp hội nghiên cứu bệnh gan Châu Mỹ
**EASL: Hiệp hội nghiên cứu bệnh gan Châu Âu
***APASL: Hiệp hội nghiên cứu bệnh gan Châu Á Thái Bình Dương
Tóm tắt: kiến nghị về quản lý bệnh nhân viêm gan b
Những khuyến cáo quan trọng dựa vào các hướng dẫn mới về điều trị viêm gan B mạn sau đây:
Bệnh nhân viêm gan B mạn có Hbe-Ag dương tính cần được điều trị khi nồng độ HBV DNA ≥ 20.000 IU/ml và nồng độ ALT tăng, nhất là khi tăng gấp đôi.
Bệnh nhân viêm gan B mạn có Hbe-Ag âm tính cần được điều trị khi nồng độ HBV DNA ≥ 2.000 IU/ml và nồng độ ALT tăng.
Kiểm tra kiểu gen cần được sử dụng rộng rãi hơn. Hiểu biết về kiểu gen có thể hữu ích trong dự đoán diễn tiến tự nhiên. Ví dụ, HBV kiểu gen C gây bệnh nặng hơn và có tỉ lệ ung thư biểu mô tế bào gan cao hơn kiểu gen B ở người châu Á. Đối với bệnh nhân điều trị với pegylated interferon, kiểugen hữu ích trong dự đoán đáp ứng điều trị: HBV kiểu gen A đáp ứng tốt hơn kiểu gen D (kiểu gen thường gặp ở người da trắng) và kiểu gen B đáp ứng hơi tốt hơn kiểu gen C (kiểu gen phổ biến ở người Châu Á).
Tất cả bệnh nhân viêm gan B mạn và xơ gan có nồng độ HBV DNA ≥ 2.000 IU/ml cần được điều trị. Hơn nữa, các bệnh nhân xơ gan và có sự hiện diện của virus trong máu bất kể nồng độ HBV DNA bao nhiêu, đặc biệt là khi nồng độ ALT cao cũng thích hợp để điều trị. Các bằng chứng ban đầu cũng ủng hộ việc dùng phối hợp các chất nucleotides ở những bệnh nhân này và việc điều trị nên tiếp tục lâu dài, ngay cả sau khi có kết quả chuyển đổi huyết thanh HbeAg ở những bệnh nhân HbeAg dương tính.
Tỉ lệ kháng thuốc về mặt di truyền cao khi điều trị lâu dài với lamivudine (70% vào năm thứ 4-5), hơi thấp hơn khi điều trị với telbivudine (21,6% ở bệnh nhân Hbe-Ag dương tính và 8,6% ở bệnh nhân Hbe-Ag âm tính vào năm thứ 2), trung bình khi điều trị với adefovir (30% vào năm thứ 5 ở bệnh nhân Hbe-Ag âm tính) và thấp khi điều trị với entecavir ở bệnh nhân nhạy nucleoside (
Tiềm năng điều trị viêm gan B mạn trong tương lai bao gồm pegylated inteferon và chất đồng đẳng nucleotide khác, đặc biệt là tenofovir đang trong giai đoạn kết thúc nghiên cứu, hứa hẹn khả năng hiệu lực cao và tỉ lệ kháng thuốc thấp. Vai trò trong điều trị phối hợp đang nâng cao dần, chủ yếu giảm tỉ lệ kháng thuốc khi điều trị lâu dài.
Các mô hình điều trị cho những nhóm nhiễm HBVgồm:
|
Điều Trị Bệnh Nhân Xơ Gan có HbeAg Dương Tính hoặc Âm Tính theo Chiến Lược Điều Trị của Hoa Kỳ HBV DNA Có thể chọn điều trị hay theo dõi Ưu tiên adefovir hay entecavir, pegylated interferon alfa-2a có thể lựa chọn sớm trong xơ gan còn bù tốt HBV DNA ≥ 2.000 IU/ml và xơ gan còn bù Điều trị, sử dụng adefovir hay entecavir có thể được chọn ban đầu Yêu cầu điều trị lâu dài và có thể ưu tiên phối hợp điều trị (adefovir hay tenofovir cộng với lamivudine, telbivudine hay entecavir) HBV DNA Ưu tiên phối hợp điều trị (adefovir hay tenofovir kèm lamivudine, telbivudine hay entecavir) Yêu cầu điều trị lâu dài Lên danh sách chờ cấy ghép gan Tham khảo: Hepatitis Annual Update 2007 website:http://clinicaloptions.com/Hepatitis/AnnualUpdates Điều Trị Bệnh Nhân Viêm Gan B Mạn có Xơ Gan Còn Bù theo AASLD 2007 Đối tượng cần điều trị Bệnh nhân có HbeAg dương tính hay âm tính Bệnh nhân có HBV DNA > 2.000 IU/ml, không cần xác định ALT Xem xét điều trị cho bệnh nhân có HBV DNA Theo dõi trên bệnh nhân HBV DNA âm tính Lựa chọn thuốc Ưu tiên Adefovir hay entecavir Tham khảo: : Hepatitis Annual Update 2007 website:http://clinicaloptions.com/Hepatitis/AnnualUpdates Điều Trị Bệnh Nhân Viêm Gan B Mạn có Xơ Gan Mất Bù theo AASLD 2007 Đối tượng cần điều trị: HbeAg dương tính hay âm tính ở bất kỳ nồng độ HBV DNA nào. Lựa chọn thuốc: Ưu tiên phối hợp lamivudine hay telbivudine cộng với adefovir hay điều trị đơn liệu với entecavir (chống chỉ định interferon). Thời gian điều trị: Lâu dài. Các khuyến cáo khác: Ưu tiên cấy ghép gan. Tham khảo: Hepatitis Annual Update 2007 website:http://clinicaloptions.com/Hepatitis/AnnualUpdates |
|
Khả Năng Điều Trị Viêm Gan B Kháng Thuốc Chống Virus |
|
|
Phân loại kháng thuốc |
Chiến lược |
|
Lamivudine |
Tiếp tục lamivudine và thêm adefovir (ưu tiên hơn so với cách chuyển sang adefovir) hoặc tenofovir Chuyển sang emtricitabine/tenofovir * |
|
Adefovir |
Tiếp tục adefovir và thêm lamivudine hoặc telbivudine (ưu tiên hơn so với cách chuyển sang lamivudine hoặc telbivudine) Chuyển sang hay thêm entecavir (nếu không kháng lamivudine trước đó) Chuyển sang emtriticabine/tenofovir* |
|
Entecavir |
Chuyển sang hay thêm adefovir hay tenofovir * |
|
Telbivudine |
Tiếp tục telbivudine và thêm adefovir hay tenofovir * Chuyển sang emtriticabine/tenofovir. * |
|
* Chưa được cơ quan FDA chấp thuận trong điều trị viêm gan B Tham khảo: Hepatitis Annual Update 2007 website:http://clinicaloptions.com/Hepatitis/AnnualUpdates |
|
|
Những thuận lợi và bất lợi của các biện pháp điều trị viêm gan B mạn hiện nay |
||
|
Thuốc |
Thuận lợi |
Bất lợi |
|
Inteferon alfa-2b |
Tỉ lệ giảm HbsAg cao Thời gian điều trị ngắn Không kháng thuốc |
Không phải thuốc uống Tác dụng phụ thường xuyên |
|
Lamivudine |
Thuốc uống Chịu được thuốc tốt Dùng trong bệnh gan giai đoạn cuối Dùng khi thất bại adefovir |
Thường kháng thuốc (khoảng 20% mỗi năm và lên đến 70% sau khi điều trị 4-5 năm) |
|
Adefovir |
Thuốc uống Chịu được thuốc tốt. Dùng trong bệnh gan giai đoạn cuối Dùng khi thất bại lamivudine |
Đáp ứng HBV 24-48 tuần kém hiệu quả hơn entecavir hay telbivudine. Chậm kháng thuốc và ít kháng hơn so với lamivudine nhưng kháng nhiều hơn so với entecavir khi điều trị kéo dài (0% lúc 1 năm, 3% lúc năm 2, 11% vào năm 3, 19% vào năm 4 và 30% vào năm 5 khi điều trị trên bệnh nhân HbeAg âm tính) |
|
Entecavir |
Thuốc uống Chịu được thuốc tốt Hiệu quả giảm nồng độ HBV DNA cao Dùng khi thất bại adefovir |
Kháng thuốc: hiếm xảy ra ở bệnh nhân nhạy nucleoside (khoảng |
|
Pegylated interferon |
Sạch HbsAg. Thời gian điều trị ổn định Không kháng thuốc. |
Không phải thuốc uống Tác dụng phụ thường xuyên nhưng ít hơn interferon tái tổ hợp thông thường |
|
Telbivudine |
Thuốc uống Chịu được thuốc tốt Hiệu quả giảm nồng độ HBV DNA cao |
Kháng thuốc: tỉ lệ kháng thuốc trung bình ở bệnh nhân nhạy với điều trị (5% vào năm 1, 21,6% vào năm 2 ở bệnh nhân HbeAg dương tính và 8,6% vào năm 2 ở bệnh nhân HbeAg âm tính) |
|
Tham khảo: Hepatitis Annual Update 2007 – Emmet B. Keeffe, website http://clinicaloptions.com/Hepatitis/AnnualUpdates |
||
Tác giả của quyển sách này đã cố gắng hết sức để cung cấp cho người đọc thông tin cần thiết trong điều trị ung thư biểu mô tế bào gan và viêm gan B mạn. Tuy nhiên, điều trị những bệnh nhân này cần được hướng dẫn và giám sát của chuyên gia về gan học.