Bảng danh mục các chữ viết tắt
|
AJCC |
American Joint Committee on Cancer (Hiệp hội Ung thư Mỹ) |
|
ADT |
Liệu pháp ức chế androgen (Androgen deprivation therapy) |
|
CHT |
Cộng hưởng từ |
|
CLVT |
Chụp cắt lớp vi tính (CT scanner) |
|
CTV |
Thể tích đích lâm sàng (Clinical target volume) |
|
GPBL |
Giải phẫu bệnh lý |
|
GTV |
Thể tích khối u thô (Gross tumor volume) |
|
FDA |
Cục quản lý thực phẩm và dược phẩm Hoa Kỳ (Food and Drug Administration) |
|
IARC |
Cơ quan nghiên cứu ung thư thế giới (International Agency for Research on Cancer) |
|
NB |
Người bệnh |
|
MBH |
Mô bệnh học |
|
MRI |
Magnetic Resonance Imaging (Chụp cộng hưởng từ) |
|
UTTTL |
Ung thư tuyến tiền liệt |
|
UT |
Ung thư |
|
PSA |
Kháng nguyên đặc hiệu tuyến tiền liệt (Prostate-Specific Antigen) |
|
PET/CT |
Ghi hình cắt lớp positron (Positron Emission Tomography and Computed Tomography) |
|
PTV |
Thể tích đích theo kế hoạch (Planning target volume) |
|
TT |
Trực tràng |
|
TTL |
Tuyến tiền liệt |
|
XN |
Xét nghiệm |
Đại cương
Ung thư tuyến tiền liệt (UTTTL) là một trong những loại ung thư thường gặp nhất ở nam giới với khoảng 1,1 triệu ca trên toàn thế giới trong năm 2012, chiếm khoảng15% trong số tất cả các loại ung thư ở nam giới (UT). Năm 2018, toàn thế giới có 1.276.106 ca mắc mới, chiếm 13,5% các loại UT ở nam giới. Tại Việt Nam năm 2012, theo số liệu ghi nhận ung thư quần thể của Cơ quan Nghiên cứu Ung thư Thế giới (IARC), ung thư tuyến tiền liệt có tỷ lệ mắc và tử vong chuẩn theo tuổi lần lượt là 3,4 và 2,5/100000 dân. Bệnh thường gặp hàng thứ 10 trong các ung thư ở hai giới cũng như riêng cho giới nam với 1.275 trường hợp mắc mới và 872 trường hợp tử vong ước tính mỗi năm trên cả nước. Năm 2018, ung thư tuyến tiền liệt đứng hàng thứ 6 trong các ung thư ở nam giới với 301.174 ca mới mắc và 120.300 ca tử vong. Tỷ lệ tử vong do UTTTL đã giảm trong những năm gần đây do những tiến bộ trong chẩn đoán và điều trị, và cũng một phần là do những hiểu biết của người dân về bệnh ngày càng tăng lên.
Nguyên nhân bệnh UTTTL chưa được xác định rõ. Các yếu tố dinh dưỡng như ăn nhiều thịt, chất béo, hay thói quen uống rượu, hút thuốc không liên quan rõ rệt đến mắc UTTTL. Vai trò phòng ngừa của các acid béo có thành phần omega 3 cũng không được minh chứng rõ ràng. Sự liên quan đến các yếu tố chuyển hóa, nội tiết… không được khẳng định qua nhiều nghiên cứu khác nhau. Cho đến hiện nay người ta vẫn chưa tìm thấy các gen có ý nghĩa sinh ung thư dù nhiều quan sát lâm sàng ghi nhận có vai trò của yếu tố gia đình trong UTTTL.
Với sự hữu hiệu của xét nghiệm định lượng PSA và kỹ thuật sinh thiết tuyến tiền liệt, ngày càng có nhiều trường hợp UTTTL được chẩn đoán sớm. Tuy nhiên, việc tầm soát UTTTL có thể gây nên những điều trị quá mức, không cần thiết, dẫn đến ảnh hưởng chất lượng sống của người bệnh (NB), và tăng chi phí cho chăm sóc sức khoẻ.
Điều trị UTTTL là một chiến lược tổng thể phối hợp đa mô thức bao gồm các biện pháp điều trị đặc hiệu tại chỗ hoặc toàn thân và các biện pháp chăm sóc giảm nhẹ.
Phát hiện sớm, chẩn đoán
Phát hiện sớm
Nên tiến hành khám và xét nghiệm ở nam giới trên 50 tuổi – một độ tuổi có suất độ cao hoặc trên 45 tuổi nếu có tiền sử gia đình UTTTL; chủ yếu là thăm khám trực tràng và làm xét nghiệm PSA toàn phần. Chỉ định sinh thiết tuyến tiền liệt khi phát hiện có nhân cứng, còn khi chỉ có PSA lớn hơn 4ng/ml thì cần giải thích rõ ích lợi và nguy cơ của việc sinh thiết cho người NB.
Chẩn đoán
Lâm sàng
Triệu chứng cơ năng
Rất nhiều trường hợp UTTTL ở thể ẩn, không có triệu chứng lâm sàng. Người bệnh được phát hiện bệnh tình cờ, hoặc giải phẫu tử thi sau khi tử vong do những nguyên nhân khác.
Có 2 lý do làm cho người bệnh phải đi khám bệnh:
Rối loạn tiểu tiện.
Các dấu hiệu về u lan toả hoặc đã có di căn.
Các triệu chứng tiết niệu thường gặp là:
Đái khó, tia đái nhỏ.
Đái nhiều lần mức độ khác nhau, tuỳ theo sự kích thích, cảm giác đái không hết do có nước tiểu dư trong bàng quang.
Đái không tự chủ.
Bí đái cấp.
Ở giai đoạn muộn, khối u thường nhiều ổ, lan toả xâm lấn bao xơ và di căn, có thể gây ra những rối loạn toàn thân trầm trọng, thể trạng người bệnh suy sụp, kết thúc cuối cùng là tử vong.
Các dấu hiệu tiến triển lan tràn thường gặp là:
Đau xương
Đau tầng sinh môn
Phù nề chi dưới
Xuất tinh ra máu
Các dấu hiệu toàn thân khác: NB có thể đến viện trong tình trạng suy thận, với các biểu hiện gầy sút, phù nề, xanh nhợt, thiếu máu. Các di căn khác ở phổi, gan ít khi là dấu hiệu đầu tiên, di căn não cũng hiếm gặp.
Triệu chứng thực thể
Thăm khám TTL qua trực tràng: Đây là cách thức đơn giản, rẻ tiền và hữu hiệu phát hiện UTTTL. Hầu hết UTTTL xuất hiện ở vùng ngoại vi của TTL và có thể phát hiện qua thăm trực tràng. Bằng việc phối hợp với nồng độ PSA, thăm khám TTL qua trực tràng đã góp phần chẩn đoán đa số các UTTTL.
Khám toàn thân phát hiện di căn hạch, một số ít trường hợp phát hiện di căn xa.
Cận lâm sàng
Nồng độ PSA:
Hiện nay nồng độ PSA để chẩn đoán UTTTL vẫn đang còn được bàn cãi. Tuy nhiên người ta thấy rằng nồng độ PSA càng cao thì khả năng tồn tại UTTTL càng lớn. Tuy nhiên, ngay cả khi nồng độ PSA 4ng/mL.
Tỉ lệ PSA tự do/toàn phần là thông số được sử dụng rộng rãi trong lâm sàng để phân biệt giữa tăng sinh lành tính và UTTTL. Tỉ lệ này được sử dụng trong trường hợp nồng độ PSA từ 4 đến 10 ng/mL và thăm khám trực tràng không có dấu hiệu nghi ngờ UTTTL. Thông thường lấy mức PSA tự do/ PSA toàn phần có ý nghĩa là
Siêu âm
Siêu âm qua trực tràng: Không phải lúc nào cũng có thể thấy được hình ảnh kinh điển của một vùng giảm âm ở ngoại vi của tuyến tiền liệt qua siêu âm. Siêu âm qua trực tràng không thể phát hiện vùng UTTTL với độ tin cậy đầy đủ. Do đó, sinh thiết các vùng nghi ngờ không thể sử dụng như là một phương pháp thường quy để chẩn đoán. Tuy nhiên, có thể có ích khi sinh thiết thêm các khu vực nghi ngờ.
Siêu âm ổ bụng: có giá trị định hướng chẩn đoán, đánh giá di căn trong ổ bụng
Chụp cộng hưởng từ (CHT) tiểu khung:
Chụp CHT tiểu khung có giá trị góp phần vào chẩn đoán, định hướng cho việc sinh thiết TTL. Ngoài ra còn giúp cho chẩn đoán mức độ xâm lấn của khối u vào tổ chức xung quanh và hạch vùng.
Chụp cắt lớp vi tính:
Chụp cắt lớp vi tính vừa cho phép chẩn đoán mức độ xâm lấn tại chỗ của khối u (T), đồng thời cho phép chẩn đoán di căn, đặc biệt là di căn hạch chậu. Giá trị chẩn đoán của chụp cắt lớp vi tính ngày càng được nâng cao nhờ vào các kỹ thuật chụp mới.
Chụp xạ hình xương và chụp PET/CT:
Chụp xạ hình xương với MDP-Tc99m: Phát hiện những tổn thương di căn vào xương: Xương cột sống, xương sườn, xương cánh chậu, xương sọ…
Chụp PET/CT: Với F18-FDG ít có giá trị phát hiện u nguyên phát, nhưng giúp phát hiện chính xác di căn, tái phát, đánh giá hiệu quả các phương pháp điều trị, mô phỏng lập kế hoạch xạ trị. Có thể chụp PET/CT với C11-Acetate cho hình ảnh u nguyên phát rõ nét hơn.
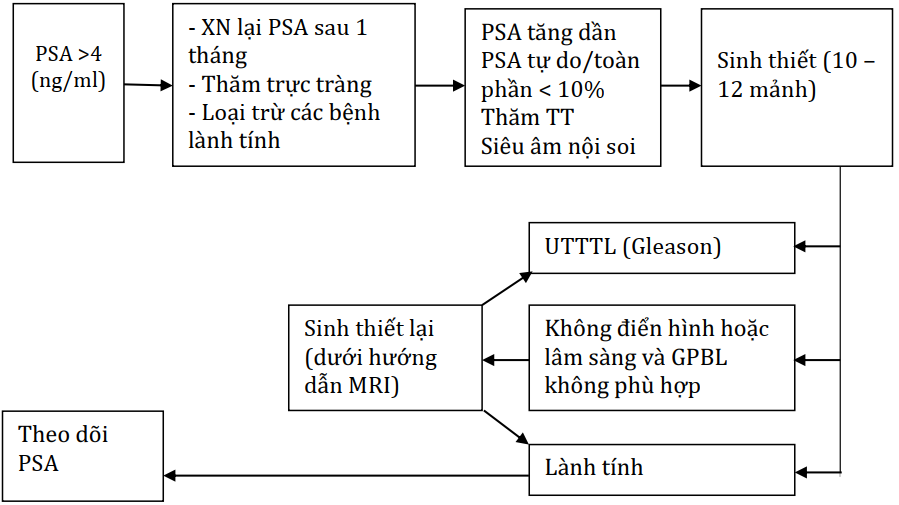
Sinh thiết tuyến tiền liệt
Sinh thiết lần đầu
Chỉ định sinh thiết tuyến tiền liệt dựa trên cơ sở nồng độ PSA và/hoặc có nghi ngờ khi thăm khám trực tràng. Cũng cần phải xem xét đến các yếu tố tuổi, bệnh kèm theo và hậu quả điều trị nếu chẩn đoán quá mức.
Người bệnh chỉ có nồng độ PSA cao lần xét nghiệm đầu tiên không nên chỉ định sinh thiết ngay lập tức. Cần xét nghiệm lại PSA sau một tháng trong các điều kiện tiêu chuẩn (không xuất tinh và không làm các thủ thuật như đặt thông niệu đạo bàng quang, soi bàng quang hoặc cắt đốt nội soi qua niệu đạo, không thăm trực tràng trước đó và không có nhiễm trùng đường tiết niệu) ở cùng một nơi xét nghiệm và cùng phương pháp đã tiến hành lần trước.
Sinh thiết qua trực tràng là phương pháp được đề nghị trong hầu hết các trường hợp nghi ngờ UTTTL. Số mẫu sinh thiết lý tưởng là 10-12 mẫu.
Sinh thiết lặp lại
Chỉ định cho sinh thiết lặp lại là: (1) PSA tăng và/hoặc cao liên tục, (2) Thăm khám tuyến tiền liệt có nghi ngờ; (3) tăng sinh dạng nang nhỏ không điển hình (atypical small acinar proliferation), và (4) tân sinh trong biểu mô tuyến lan tỏa (extensive prostatic intraepithelial neoplasia – PIN).
Sinh thiết lần thứ ba hoặc nhiều lần hơn không được khuyến cáo, cần phải xem xét trên từng cá thể riêng biệt.
Sơ đồ 2.1. Sinh thiết TTL dưới hướng dẫn của siêu âm nội trực tràng
Mô bệnh học
Phân độ mô học theo hệ thống thang điểm Gleason hiện nay được sử dụng rộng rãi trong chẩn đoán UTTTL nhằm phục vụ cho điều trị, theo dõi, tiên lượng.
Điểm Gleason là tổng của độ mô học Gleason chiếm ưu thế nhất và nhì. Nếu chỉ có một độ mô học, thì điểm được tính bằng cách nhân đôi độ mô học đó. Nếu một độ mô học
Hệ thống phân loại mô bệnh học mới nhất của UTTTL dựa trên hội nghị đồng thuận của Hiệp hội quốc tế về bệnh học tiết niệu 2014 (International Society of Urological Pathology – ISUP). Hệ thống này chia ra 5 độ dựa trên điểm Gleason như sau:
Độ I: ≤ 6 điểm
Độ 2: 3+4 = 7 điểm
Độ 3: 4+3 = 7 điểm
Độ 4: 8 điểm
Độ 5: 9-10 điểm
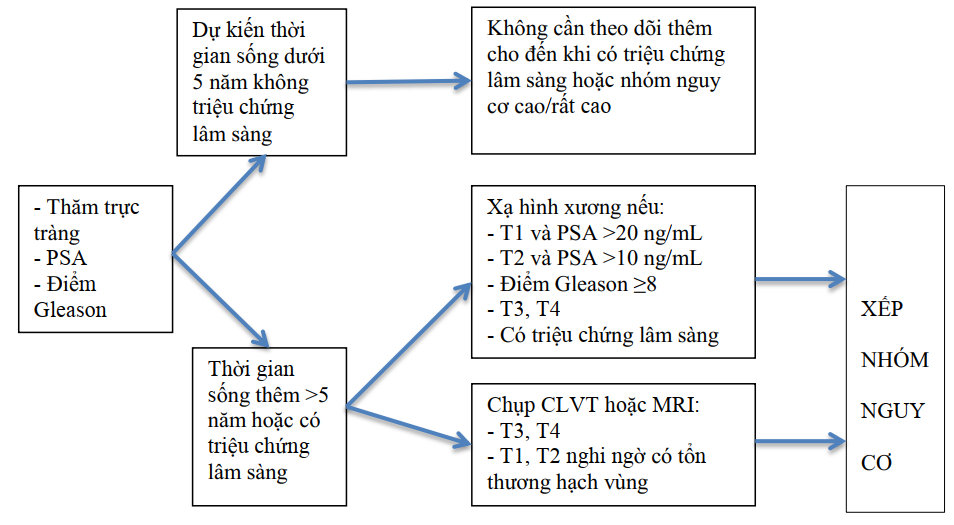
Chẩn đoán giai đoạn
Chỉ định các xét nghiệm (XN) đánh giá trước điều trị:
Đánh giá mức độ lan rộng của khối u (T): Dựa vào siêu âm, CLVT, hoặc MRI
Đánh giá di căn hạch (N): thực hiện khi có kế hoạch điều trị triệt căn. Người bệnh giai đoạn T2 hoặc ít hơn, PSA
Đánh giá di căn (M) xương: xạ hình xương bằng máy SPECT, SPECT/CT, PET/CT…
Trong trường hợp khó đánh giá, có thể chỉ định PET/CT (C-11choline PET/CT hoặc F-18 fluciclovine hoặc sodium PET/CT), hoặc chụp PET/CT với 18FDG để đánh giá các tổn thương di căn ở hệ thống hạch, ở các tạng, xương, …
Sơ đồ 2.2. Đánh giá trước điều trị
Đánh giá giai đoạn theo AJCC lần thứ 8 – 2017
|
T |
|
|
|
Giai đoạn T theo lâm sàng (cT) |
||
|
cTx |
Không đánh giá được u nguyên phát |
|
|
cT0 |
Không có bằng chứng của u nguyên phát |
|
|
cT1 |
U nguyên phát không rõ ràng trên lâm sàng, không sờ thấy |
|
|
cT1a |
U xác định bằng mô bệnh học ≤5% trong tổ chức lấy được |
|
|
cT1b |
U xác định bằng mô bệnh học >5% trong tổ chức lấy được |
|
|
cT1c |
U xác định bằng sinh thiết kim ở một bên hoặc cả hai bên nhưng u không sờ thấy |
|
|
cT2 |
Khối u sờ thấy và khu trú ở tuyến tiền liệt. |
|
|
cT2a |
U ở ≤ một nửa của một thùy |
|
|
cT2b |
U nhiều hơn một nửa thùy nhưng không ở cả 2 thùy |
|
|
cT2c |
U ở cả hai thùy |
|
|
cT3 |
U xâm lấn qua bao tuyến tiền liệt nhưng chưa cố định, chưa xâm lấn cấu trúc xung quanh. |
|
|
cT3a |
Xâm lấn vỏ bao 1 hoặc 2 bên. |
|
|
cT3b |
Xâm lấn túi tinh. |
|
|
cT4 |
U cố định hay xâm lấn cơ quan lân cận ngoài túi tinh: bàng quang, cơ vòng hậu môn, trực tràng, thành chậu. |
|
|
Giai đoạn T theo mô bệnh học (pT) |
||
|
pT2 |
U khu trú trong tuyến tiền liệt |
|
|
pT3 |
U xâm lấn qua bao tuyến tiền liệt. |
|
|
pT3a |
Xâm lấn vỏ bao 1 hoặc 2 bên, hoặc xâm lấn cổ bàng quang trên vi thể |
|
|
pT3b |
Xâm lấn túi tinh. |
|
|
pT4 |
U cố định hay xâm lấn cơ quan lân cận ngoài túi tinh: bàng quang, cơ vòng hậu môn, trực tràng, cơ thắt ngoài, thành chậu |
|
|
N |
|
|
|
Nx: |
Không thể đánh giá được hạch vùng |
|
|
N0: |
Không có di căn hạch vùng |
|
|
N1: |
Di căn hạch vùng |
|
|
M |
|
|
|
M0: |
Chưa có di căn xa |
|
|
M1: |
Có di căn xa |
|
|
M1a: |
Di căn hạch lympho ngoài hạch vùng |
|
|
M1b: |
Di căn xương |
|
|
M1c: |
Di căn tạng khác có/không kèm di căn xương |
|
Bảng 2.2. Phân loại giai đoạn theo AJCC 8th, 2017
|
Giai đoạn |
T |
N |
M |
PSA (ng/ml) |
Độ MBH |
|
I |
cT1a-c |
N0 |
M0 |
PSA |
1
|
|
cT2a |
N0 |
M0 |
PSA |
1
|
|
|
pT2 |
N0 |
M0 |
PSA |
1 |
|
|
II A |
cT1a-c |
N0 |
M0 |
10 ≤PSA |
1 |
|
cT2a |
N0 |
M0 |
10 ≤PSA |
1 |
|
|
cT2b |
N0 |
M0 |
PSA |
1 |
|
|
cT2c |
N0 |
M0 |
PSA |
1 |
|
|
IIB |
T1-2 |
N0 |
M0 |
PSA |
2 |
|
IIC |
T1-2 |
N0 |
M0 |
PSA |
3-4 |
|
IIIA |
T1-2 |
N0 |
M0 |
PSA ≥ 20 |
1-4 |
|
IIIB |
T3-4 |
N0 |
M0 |
Mọi PSA |
1-4 |
|
IIIC |
Mọi T |
N0 |
M0 |
Mọi PSA |
5 |
|
IVA |
Mọi T |
N1 |
M0 |
Mọi PSA |
Mọi Gleason |
|
IVB |
Mọi T |
Mọi N |
M1 |
Mọi PSA |
Mọi Gleason |
Xếp nhóm nguy cơ:
Nguy cơ rất thấp: T1c và điểm Gleason ≤ 6 và PSA
Nguy cơ thấp: (T1 hay T2a) và (điểm Gleason ≤6) và (PSA
Nguy cơ trung bình: (T2b hay T2c) hay (điểm số Gleason = 7) hay (PSA trong khoảng 10-20 ng/ml.
Nguy cơ cao: T3a hay điểm số Gleason từ 8 – 10 hay PSA>20ng/ml.
Nguy cơ rất cao: T3b-4 hay độ MBH 5.
Di căn hạch
Di căn xa
Điều trị
Nguyên tắc điều trị
Điều trị UTTTL cần dựa trên những yếu tố sau:
Chẩn đoán, đánh giá trước điều trị
Ước tính thời gian sống thêm
Phân nhóm nguy cơ
Xác định mục tiêu, kế hoạch điều trị
Các phương pháp điều trị
Phẫu thuật
Nguyên tắc phẫu thuật trong ung thư tuyến tiền liệt
Cắt toàn bộ tuyến tiền liệt, túi tinh và bóng của ống dẫn tinh
Nạo hạch chậu từ hạch chậu bịt đến vùng chia đôi động mạch chậu chung.
Nạo hạch mở rộng: đến chỗ chia đôi động mạch chủ bụng.
Bảo tồn bó mạch – thần kinh cương tối đa có thể. b. Các phương pháp phẫu thuật
Tên phẫu thuật: cắt tuyến tiền liệt triệt căn.
Phẫu thuật này có nhiều loại và tên gọi: theo mổ mở hay mổ nội soi; theo đường tiếp cận tuyến tiền liệt qua phúc mạc, sau phúc mạc hay qua đường đáy chậu là: – Phẫu thuật (mở) cắt tuyến tiền liệt triệt căn (Radical prostatectomy – RP).
Phẫu thuật cắt tuyến tiền liệt triệt căn qua đường đáy chậu (Perineal radical prostatectomy – PRP).
Phẫu thuật nội soi cắt tuyến tiền liệt triệt căn qua phúc mạc (Transperitoneal laparoscopicradical prostatectomy – TLRP).
Phẫu thuật nội soi cắt tuyến tiền liệt triệt căn qua đường sau phúc mạc (Retroperitoneal laparoscopicradical prostatectomy – RLRP).
Phẫu thuật cắt tuyến tiền liệt triệt căn có hỗ trợ của rô–bốt (Robotic Radical Prostatectomy – RRP).
Chỉ định can thiệp phẫu thuật
Chỉ định phẫu thuật theo loại kỹ thuật và đường tiếp cận tuyến tiền liệt
Phẫu thuật mở hay nội soi có cùng chỉ định như nhau, việc quyết định phương pháp nào là tùy thuộc sự lựa chọn và kinh nghiệm của phẫu thuật viên.
Riêng với đường mổ qua vùng đáy chậu nên được khuyến khích cho ung thư giai đoạn khu trú, vì cho kết quả tốt và đảm bảo thẩm mỹ. Tuy nhiên, khi lựa chọn đường mổ này cần phải xác định là: không có di căn hạch, với các tiêu chuẩn kèm theo là PSA
Chỉ định theo bệnh lý
Căn cứ vào giai đoạn bệnh
Theo độ mô bệnh học.
Theo thời gian kỳ vọng sống thêm.
Theo tình trạng của các bệnh kèm theo của người cao tuổi như: bệnh tim mạch, bệnh đái tháo đường, di chứng tai biến mạch máu, bệnh của hệ thần kinh…
Xạ trị
Nguyên tắc xạ trị
Chỉ định xạ trị phụ thuộc vào:
Nguy cơ tái phát.
Thời gian kỳ vọng sống thêm.
Mục đích là điều trị triệt căn hay điều trị giảm nhẹ – Không đủ điều kiện sức khỏe để phẫu thuật – Nguyện vọng của người bệnh.
Kỹ thuật xạ trị
Kỹ thuật: 3 D-CRT, IMRT (Intensity Modulated Radiation Therapy- xạ trị điều biến liều), VMAT (xạ trị điều biến thể tích), IGRT (xạ trị dưới hướng dẫn hình ảnh)
Thiết bị: máy gia tốc tuyến tính
Liều lượng:
Nguy cơ thấp: 70Gy-75Gy trong 36-41 buổi vào tuyến tiền liệt ± túi tinh. Không xạ trị tiểu khung
Nguy cơ trung bình: 75- 80Gy. Phân liều 1,8-2,0Gy/lần, có thể xạ trị hạch chậu.
Nguy cơ cao: xạ trị hạch chậu
Có thể kết hợp xạ trị chiếu ngoài với xạ trị áp sát suất liều cao nạp nguồn sau.
Xạ trị chiếu ngoài vào vùng chậu
Chỉ định:
U giai đoạn T4.
Di căn hạch chậu.
Túi tinh bị xâm lấn.
Người bệnh thuộc nhóm nguy cơ cao.
Nguy cơ di căn hạch > 15%, tính theo công thức Roach:
Nguy cơ di căn hạch = (2/3) × PSA + [(GS – 6) × 10]
Hai trường chiếu trước-sau và sau-trước:
Giới hạn trên: khe giữa L5-S1.
Nếu hạch chậu (+): khe giữa L4-L5.
Giới hạn dưới: dưới hai ụ ngồi.
Giới hạn hai bên: 1-1,5 cm phía ngoài của khung chậu bé (che chắn đầu xương đùi và cánh chậu).
Trường chiếu hai bên:
Giới hạn trên và dưới: giống như của trường chiếu trước-sau.
Giới hạn trước: phía trước của khớp mu.
Giới hạn sau: đi qua khe S2-S3.
Xạ trị khu trú vào tuyến tiền liệt
Chỉ định:
U giai đoạn sớm (T1, T2).
Hạch chậu (-).
Túi tinh không bị xâm lấn.
Nguy cơ di căn hạch
Người bệnh thuộc nhóm nguy cơ thấp đến trung bình.
Người bệnh thuộc nhóm nguy cơ cao, kèm điều trị nội tiết dài hạn.
Phối hợp liệu pháp ức chế androgen (ADT) ở ung thư tuyến tiền liệt di căn còn nhạy nội tiết nhóm nguy cơ thấp (di căn xương dưới 4 tổn thương, không di căn tạng)
Để xạ trị khu trú vào tuyến tiền liệt, có thể sử dụng các kỹ thuật xạ trị phù hợp:
Xạ trị chiếu ngoài (EBRT): kỹ thuật xạ trị 3D CRT (3D Conformal Radiotherapy); Xạ trị điều biến liều (IMRT), Xạ trị điều biến liều thể tích (VMAT), xạ dưới hướng dẫn hình ảnh (IGRT).
Xạ trị mô phỏng PET/CT hoặc CT
Xạ trị áp sát liều cao (HDR), cấy hạt phóng xạ vào mô tuyến tiền liệt để điều trị triệt căn UTTTL giai đoạn khu trú hoặc để nâng liều xạ sau xạ trị từ ngoài (xạ trị chiếu ngoài).
Tư thế nằm của người bệnh khi mô phỏng và xạ trị:
Người bệnh thường nằm ngửa, kê gối dưới khoeo chân. Đây là tư thế nằm thoải mái nhất.
Cũng có thể cho người bệnh nằm sấp để ruột non được đẩy lên trên, ra ngoài vùng chiếu xạ.
Nên cho người bệnh uống nước nhiều trước khi mô phỏng và xạ trị để làm căng bàng quang.
Khi mô phỏng nên tiêm tĩnh mạch một lượng nhỏ chất cản quang (40-50ml) để thấy rõ bàng quang và dễ phân biệt đáy tuyến tiền liệt với cổ bàng quang.
Xác định các thể tích xạ khi dùng kỹ thuật xạ trị phù hợp mô đích:
GTV (Gross tumor volume – Thể tích u thô): thường không sử dụng trong xạ trị
UTTTL, vì khó nhìn thấy nhân ung thư trong mô tuyến trên CLVT. Thể tích thường dùng là CTV.
CTV (Clinical target volume – Thể tích đích lâm sàng): toàn bộ tuyến tiền liệt (thường bao gồm 1/3 thể tích túi tinh) ± túi tinh (nếu túi tinh bị xâm lấn). – BTV (biologic target volume) là thể tích đích sinh học ảnh thu được từ chụp PET/CT mô phỏng để xác định thể tích
PTV (Planning target volume – Thể tích đích theo kế hoạch): CTV + 1cm về mọi hướng ngoại trừ hướng ra phía sau chỉ là 8 mm.
Liều xạ tối đa trên các cơ quan quan trọng:
Trực tràng:
Dưới 5-10% xảy ra độc tính độ III-IV trên trực tràng nếu
V50 (thể tích trực tràng nhận liều > 50 Gy) là 60-65%
V60 (thể tích trực tràng nhận liều > 60 Gy) là 45-50%
V70 (thể tích trực tràng nhận liều > 70 Gy) là 25-30%
Bàng quang:
Toàn bộ bàng quang:
Một phần nhỏ bàng quang: 75-80 Gy. Không quá 3% thể tích bàng quang nhận liều > 78 Gy.
Đầu xương đùi: liều trung bình
Liều xạ và mức năng lượng chùm tia
Phân liều mỗi ngày: 1,8 – 2Gy.
Chọn năng lượng chùm tia tùy vào độ dày của bụng người bệnh. Thường dùng tia X mức năng lượng 6-18 MV của máy xạ trị gia tốc thẳng.
Xạ vào vùng chậu (khi có chỉ định): 45-50 Gy.
Sau đó xạ khu trú vào tuyến tiền liệt (± túi tinh) cho đến 70-76Gy.
Xạ triệt để khu trú vào tuyến tiền liệt: 70-76 Gy.
Xạ vào nền tuyến tiền liệt sau phẫu thuật cắt tuyến tiền liệt tận gốc:
64-66 Gy nếu còn sót u vi thể.
≥ 70 Gy nếu còn sót u đại thể.
Với các kỹ thuật xạ trị mới như IMRT (Intensity modulated radiotherapy – Xạ trị điều biến liều), IGRT (Image guided radiotherapy – Xạ trị dưới hướng dẫn hình ảnh) có thể cho phép nâng liều xạ tại tuyến tiền liệt lên đến 80 Gy.
Xạ trị áp sát: có thể dùng kỹ thuật nạp nguồn sau suất liều cao (High dose rate afterloading brachytherapy) hoặc kỹ thuật cấy lưu các hạt iod phóng xạ (Iodine 125) vào tuyến tiền liệt.
Cấy hạt phóng xạ điều trị áp sát
Chỉ định
Nguy cơ thấp: cấy hạt phóng xạ điều trị áp sát đơn thuần
Nguy cơ trung bình: cấy hạt phóng xạ điều trị áp sát + xạ trị chiếu ngoài (40-50Gy) ± nội tiết (4-6 tháng).
Liều xạ trị:
Cấy hạt phóng xạ với I-125 liều 145Gy nếu với Pd-103 liều 125Gy.
Cấy hạt phóng xạ sau khi xạ trị chiếu ngoài 40-50Gy: với I-125 liều 110Gy và Pd-103 liều 100Gy.
Kỹ thuật cấy hạt phóng xạ vào khối u để điều trị ung thư tuyến tiền liệt, là sự cải tiến của xạ trị áp sát kết hợp với xạ trị chiếu trong đã được nhiều nước trên thế giới nghiên cứu áp dụng và đem lại nhiều lợi ích to lớn cho bệnh nhân. Hiện nay tại các nước phát triển như Hoa Kỳ, Đức, Nhật Bản, áp dụng cho ung thư tuyến tiền liệt giai đoạn sớm, khu trú.
Cấy hạt phóng xạ điều trị UTTTL là phương pháp xạ trị đưa các hạt phóng xạ I-125 kích thước nhỏ 4,5×0,8 mm phát tia gamma năng lượng thấp (35 keV), vào trong tổ chức khối u, có tác dụng tiêu diệt tế bào ung thư tại chỗ mà không hoặc ảnh hưởng rất ít tới mô lành xung quanh. Bức xạ gamma mềm của I-125 chỉ phát huy hiệu quả điều trị trong phạm vi vài milimet (mm) của các mô bệnh và không hoặc rất ít gây tổn thương các mô lành xung quanh. Ưu điểm nổi bật của kỹ thuật này là tạo ra liều hấp thụ bức xạ cao tại khối u, trong khi cơ quan và tế bào lành chỉ phải chịu liều bức xạ rất thấp. Các hạt phóng xạ có thời gian bán rã không quá ngắn và không quá dài (chẳng hạn với I-125 là 60 ngày) nên có thể để lại các hạt phóng xạ trong lòng tuyến tiền liệt mà không cần lấy ra sau khi cấy hạt phóng xạ vào. Dưới hướng dẫn của hình ảnh siêu âm, các kim chứa hạt phóng xạ này sẽ được đâm xuyên qua da ở vùng tầng sinh môn để đưa thẳng vào trong lòng của tuyến tiền liệt. Các hạt I-125 sẽ được lưu lại trong lòng tuyến tiền liệt sau khi kim được rút ra.
Ưu điểm của phương pháp cấy hạt phóng xạ là kiểm soát u tại chỗ cao, thời gian và liệu trình điều trị ngắn, ít biến chứng, chức năng sinh lý của nam giới (liệt dương) ít hoặc không bị ảnh hưởng, tăng chất lượng cuộc sống
Cấy hạt phóng xạ là một phương pháp điều trị an toàn, hiệu quả, tăng thời gian sống thêm, tăng chất lượng cuộc sống cho bệnh nhân ung thư tuyến tiền liệt giai đoạn sớm
Điều trị thuốc phóng xạ 177Lu-PSMA:
PSMA (prostate-specific membrane antigen) là protein xuyên màng, hay gặp ở màng tế bào ung thư tuyến tiền liệt. Đồng vị phóng xạ Lutetium-177 gắn với PSMA phát tia beta (E=490keV) và quãng chạy trong mô tuyến 177Lu-PSMA sau khi đưa vào cơ thể sẽ tập trung tại các tế bào ung thư tuyến tiền liệt và phát tia bức xạ tiêu diệt khối u. Trước điều trị người bệnh được chụp 68Ga-PSMA PET/CT để đánh giá các tổn thương di căn và dự báo đáp ứng điều trị. Liều thuốc 177Lu-PSMA: 3,5-8GBq, tiêm tĩnh mạch chậm, 4-6 chu kỳ, mỗi chu kỳ 6 tuần.
Liệu pháp ức chế Androgen
Điều trị giai đoạn di căn
Liệu pháp ức chế Androgen (Androgen deprivation therapy – ADT) đóng vai trò cơ bản trong điều trị UTTTL di căn.
Cắt tinh hoàn ngoại khoa hay cắt tinh hoàn nội khoa bằng các thuốc đồng vận thụ thể GnRH (Gosereline, Triptoreline, Leuprorelin acetate) hoặc đối vận (Degarelix) cho hiệu quả tương đương.
Thuốc đối vận thụ thể GnRH làm giảm nhanh Testosterone trong máu ở những tuần đầu, không gây cơn cường phát bệnh, được ưu tiên cho các trường hợp di căn xương có chèn ép tủy, và các trường có triệu chứng rầm rộ cần kiểm soát nhanh.
Một số phác đồ điều trị nội tiết hiện có:
|
Phác đồ |
Thuốc / liều lượng |
|
Goserelin acetate (Đồng vận GnRH) |
Goserelin acetate 3,6 mg/lọ, tiêm dưới da bụng mỗi 4 tuần Hoặc Goserelin acetate 10,8 mg/lọ, tiêm dưới da bụng mỗi 12 tuần |
|
Triptoreline (Đồng vận GnRH) |
Triptoreline 3,75 mg, tiêm bắp, chu kỳ mỗi 4 tuần Triptoreline 11,25 mg, tiêm bắp, chu kỳ mỗi 12 tuần |
|
Leuprorelin Acetate (Đồng vận GnRH) |
Leuprorelin Acetate tiêm dưới da 7,5mg mỗi tháng hoặc 22,5mg mỗi 3 tháng |
|
Degarelix (Đối vận GnRH)
|
Degarelix: Tấn công: 2 mũi 120mg tiêm 2 vị trí dưới da bụng Duy trì: 80mg tiêm dưới da dụng mỗi 4 tuần. |
Liệu pháp nội tiết kết hợp bao gồm cắt tinh hoàn (nội hoặc ngoại khoa) và thuốc kháng Androgen (Antiandrogen) cho hiệu quả không hoặc ít cải thiện so với cắt tinh hoàn đơn thuần nên cân nhắc khi sử dụng thường quy.
Những trường hợp có nguy cơ bùng phát mạnh các triệu chứng khi sử dụng đồng vận GnRH cần phải được điều trị trước bằng kháng Androgen ít nhất 7 ngày.
Điều trị ngắt quãng không thể kết luận được rằng cho kết quả về sống còn toàn bộ không kém hơn điều trị liên tục ở người bệnh UTTTL di căn. Chính vì vậy không khuyến cáo điều trị ngắt quãng cho UTTTL di căn, trừ trường hợp có nhiều tác dụng không mong muốn và PSA đạt gần triệt tiêu với ADT. Những trường hợp điều trị ngắt quãng cần phải giải thích kỹ với người bệnh.
Hiệu quả của hóa trị Docetaxel kết hợp với ADT trong điều trị ngay từ đầu UTTTL di căn được chỉ ra trong hai thử nghiệm lâm sàng pha 3. Kết quả cho thấy nhóm điều trị kết hợp có cải thiện sống thêm so với ADT. Khác biệt rõ rệt ở nhóm người bệnh có nguy cơ cao, được xác định là có di căn tạng hoặc có ít nhất 4 tổn thương xương và trong đó có ít nhất 1 tổn thương ngoài khung chậu, cột sống. Do vậy, điều trị kết hợp Docetaxel – ADT nên được cân nhắc ngay từ đầu cho những trường hợp UTTTL di căn có nguy cơ cao và thể trạng cho phép.
Kết hợp Abiraterone acetate với ADT cải thiện sống còn toàn bộ và sống không bệnh tiến triển trên hình ảnh so với ADT ở nhóm người bệnh có nguy cơ cao (có 2 trong 3 yếu tố sau: điểm gleason ≥ 8, ít nhất 3 ổ tổn thương xương, di căn tạng). Tháng 2/2018, chỉ định điều trị phối hợp abiraterone acetate với ADT cho UTTTL còn nhạy với điều trị cắt tinh hoàn được chấp thuận bởi Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (Food and Drug Administration – FDA). Liều khuyến cáo là Abiraterone acetate 4 viên/ngày kết hợp với prednisolon 5mg/ngày.
Điều trị phối hợp
Điều trị bổ trợ trước cho phẫu thuật triệt căn không có nhiều lợi ích, là chỉ định chưa rõ ràng.
Trong một thử nghiệm ngẫu nhiên, ở người bệnh di căn hạch sau phẫu thuật cắt TTL triệt căn, điều trị ADT sớm và liên tục cải thiện sống thêm so với nhóm trì hoãn ADT.
Điều trị bổ trợ trước, đồng thời hoặc bổ trợ cho xạ trị triệt căn cải thiện thời gian sống thêm.
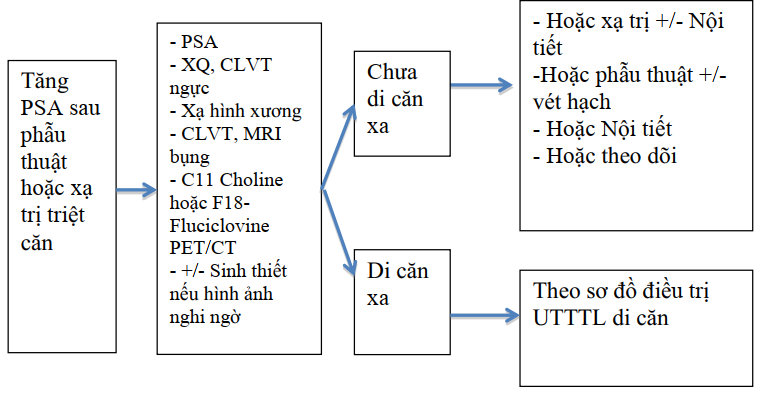
Tiến triển sinh học
Người bệnh tăng PSA đơn thuần sau phẫu thuật hoặc xạ trị triệt căn được gọi là tiến triển sinh học
Chỉ định điều trị ADT tuỳ trường hợp cụ thể
Nếu thời gian tăng gấp đôi của PSA dưới 12 tháng, sống thêm ước tính trên 15 năm, nên điều trị ADT sớm.
Nếu thời gian tăng gấp đôi PSA dài trên 12 tháng, người bệnh tuổi cao, nhiều bệnh lý phối hợp thì nên theo dõi.
Nếu quyết định điều trị ADT thì điều trị ngắt quãng để giảm tác dụng không mong muốn của điều trị.
Các điều trị nội tiết khác
Kháng androgen
Kháng Androgen loại Steroid:
Cyproterone acetate, Megesterone acetate, Medroxyprogesterone acetate. Tác dụng phụ cần chú ý trên hệ tim mạch và chức năng gan. Ngày nay ít được sử dụng do vì không có hiệu quả khi điều trị kết hợp với liệu pháp cắt tinh hoàn.
Kháng Androgen không steroid:
Bicalutamide: 1 lần trong ngày, 50 mg/ngày
Các thuốc kháng androgen khác như: Flutamide, nilutamide.
Ức chế tổng hợp nội tiết nam
Aminoglutethimide: liều 1000mg/ngày; ức chế tổng hợp testosterone qua ức chế chuyển hóa cholesterol thành pregnenolone; hiện chỉ được sử dụng trong ung thư giai đoạn kháng cắt tinh hoàn, chỉ định ngày càng hạn chế.
Ketoconazol: liều 300 mg, 3 lần mỗi ngày; ức chế tổng hợp testosterone và cả steroid thượng thận; tương tự như đối với aminoglutethimide, hiện chỉ được sử dụng trong ung thư giai đoạn kháng cắt tinh hoàn.
Các tác nhân nội tiết mới
Abiraterone Acetate
Thuốc ức chế không đảo ngược protein tổng hợp bởi gen CYP17 (bao gồm 17, 20lyase và 17-alpha-hydroxylase) qua đó ngăn cản sự tổng hợp androgen tại chính tế bào ung thư tuyến tiền liệt, tinh hoàn và thượng thận. Thuốc được dùng kết hợp với prednisone/prednisolone để giảm tác dụng không mong muốn. Thuốc được chỉ định chủ yếu ở giai đoạn kháng cắt tinh hoàn, liều khuyến cáo là uống 4 viên kết hợp với prednisolone 10mg/ngày và ADT. Hai nghiên cứu pha III cho thấy phối hợp abiraterone/prednisone có hiệu quả tăng thời gian sống còn và cải thiện triệu chứng lâm sàng ở người bệnh đã hoặc chưa hóa trị trước với docetaxel.
Enzalutamide
Tác động trên nhiều vị trí của đường tổng hợp androgen: ngăn cản kết hợp androgen và thụ thể, ức chế chuyển vị và ngăn kết hợp với DNA của thụ thể androgen tại nhân tế bào. Thuốc có hiệu quả ở UTTTL kháng cắt tinh hoàn đã hoặc chưa hóa trị và/hoặc sử dụng phối hợp với ADT trong ung thư tuyến tiền liệt di căn còn nhạy với cắt tinh hoàn. Thuốc chống chỉ định cho người bệnh có tiền căn co giật dù tác dụng phụ này rất hiểm xảy ra (0,6%). Liều lượng enzalutamide 40mg x 4 viên/ngày.
Các thuốc khác như apalutamide, darolutamide đã được nghiên cứu chứng minh hiệu quả với ung thư tuyến tiền liệt kháng cắt tinh hoàn.
Hoá trị
Docetaxel:
Nghiên cứu pha III TAX 327 ghi nhận docetaxel 75mg/m2 mỗi 3 tuần phối hợp với prednisone 10mg/ngày có hiệu quả cải thiện thời gian sống còn hơn so với mitoxantrone/prednisone. Theo kết quả này, docetaxel/prednisone đã trở thành phối hợp tiêu chuẩn điều trị bước một UTTTL kháng cắt tinh hoàn.
Mitoxantrone:
Thuốc gây độc tế bào đầu tiên được chấp thuận cho UTTTL di căn với hiệu quả cải thiện triệu chứng lâm sàng. Hiện chỉ định thu hẹp cho những người bệnh có chỉ định hóa trị nhưng không dung nạp được taxane hoặc tiến triển sau taxan.
Cabazitaxel:
Một dẫn xuất taxane tổng hợp mới cho thấy có hiệu quả tăng thời gian sống còn khi phối hợp với prednisone điều trị người bệnh tiến triển sau docetaxel. Trong một nghiên cứu pha III, phối hợp cabazitaxel 25mg/m2 và prednisone cải thiện thời gian sống còn toàn bộ hơn 2,4 tháng so với mitoxantrone/prednisone. Tác dụng phụ chính là phản ứng tiêm truyền và độc tính tủy.
|
Phác đồ |
Thuốc/ Liều lượng |
|
Mitoxantrone + Prednisone |
Mitoxantrone 12mg/m², truyền tĩnh mạch ngày 1 Presnisone 5 mg, uống ngày 2 lần Chu kỳ 3 tuần |
|
Docetaxel + Presnisone |
Docetaxel 75 mg/m², truyền tĩnh mạch ngày 1 Presnisone 5 mg, uống ngày 2 lần Chu kỳ 3 tuần |
|
Cabazitaxel + Prednisone |
Cabazitaxel 25 mg/m² (hoặc 20mg/m²), truyền tĩnh mạch ngày 1 Presnisone 5 mg, uống ngày 2 lần Chu kỳ 3 tuần |
Thuốc chống hủy xương
Thuốc thuộc nhóm bisphosphonate, pamidronate, zoledrome acid có hiệu quả giảm triệu chứng và tần suất các biến cố liên quan di căn xương.
Denosumab: một kháng thể đơn dòng người có tác dụng ức chế chất kết nối RANK, qua đó ức chế hoạt động hủy cốt bào.
Điều trị miễn dịch
Thuốc ức chế chốt kiểm soát miễn dịch PD-1 như Pembrolizumab cũng bước đầu cho thấy có hiệu quả ở một nhóm người bệnh UTTTL di căn kháng cắt tinh hoàn và thất bại sau điều trị ít nhất một phương pháp và được FDA chấp thuận điều trị trên bệnh nhân có biểu hiện MSI-H hoặc dMMR sau khi thất bại với ít nhất một liệu pháp toàn thân trước đó.
Sipuleucel-T là vaccin cấu tạo bởi các tế bào có nhánh tạo ra từ các bạch cầu đơn nhân chiết xuất từ máu ngoại biên được gây đáp ứng miễn dịch với PAP (prostatic acid phosphatase) đã được chứng minh hiệu quả ở bệnh nhân UTTTL kháng cắt tinh hoàn sau điều trị Docetaxel.
Các thuốc ức chế PARP (Poly ADP ribose polymerase):
Olaparib: được chỉ định cho bệnh nhân ung thư tuyến tiền liệt kháng cắt tinh hoàn di căn có đột biến gen sửa chữa tái tổ hợp tương đồng dạng gây bệnh hoặc nghi ngờ gây bệnh tiến triển sau điều trị abiraterone acetate hoặc enzalutamide.
Dược chất phóng xạ:
Radium-223 là một dược chất phóng xạ phát ra bức xạ alpha. Radium có ái lực mạnh với mô xương bị tổn thương. Tại đây hiện tượng phân rã phóng xạ tạo ra các bức xạ năng lượng cao trong phạm vi ngắn hơn rất nhiều so với các đồng vị phát bức xạ beta. Điều này giúp tránh độc tính trên tủy xương và các cơ quan lân cận. Một nghiên cứu pha III cho thấy radium 223 có tính dung nạp cao, cải thiện thời gian sống còn toàn bộ và làm chậm thời gian xuất hiện các biến chứng liên quan di căn xương (nhu cầu xạ trị giảm đau, gẫy xương bệnh lý, chèn ép tủy, phẫu thuật chỉnh hình…). Chỉ định chủ yếu điều trị triệu chứng cho người bệnh UTTTL di căn xương không có các tổn thương nội tạng quan trọng.
Chăm sóc giảm nhẹ
Nguyên tắc điều trị giảm nhẹ cho UTTTL giai đoạn tiến xa là phối hợp đa mô thức gồm phẫu thuật giải phóng chèn ép, xạ trị giảm đau, xạ trị chống chèn ép, điều trị di căn, điều trị giảm đau, chăm sóc tâm lý…
Phẫu thuật
Phẫu thuật giải phóng chèn ép do khối u, hoặc do tổn thương di căn xa; phẫu thuật đưa niệu quản qua da, phẫu thuật dẫn lưu bàng quang
Xạ trị chiếu ngoài (EBRT)
Thiết bị: máy xạ trị gia tốc hoặc máy Cobalt-60.
Liều xạ trị: tùy theo vị trí di căn.
Di căn xương: xạ trị vào vị trí xương bị di căn liều 40Gy/20 buổi hoặc 30Gy/10 buổi hoặc 20Gy/5 buổi một số ít trường hợp xạ 1 liều 8Gy/1 buổi.
Di căn chèn ép tủy sống: xạ trị liều 30Gy/10 buổi.
Di căn gây chảy máu: xạ trị cầm máu khi các phương pháp nội khoa không hiệu quả liều 30Gy/10 buổi.
Di căn não: xạ toàn não hoặc xạ phẫu tùy trường hợp.
Điều trị nội khoa ung thư nhằm giảm nhẹ triệu chứng
Điều trị nội khoa ung thư giúp kéo dài thời gian sống thêm và giảm nhẹ triệu chứng cho người bệnh.
Lựa chọn đặc hiệu bao gồm điều trị nội tiết hoặc hóa trị.
Giảm đau: theo bậc thang của Tổ chức Y tế thế giới
Chăm sóc tâm lý
Người bệnh UTTTL giai đoạn cuối cũng như các bệnh ung thư khác cần được chăm sóc nâng đỡ tâm lý phù hợp. Hầu hết các người bệnh ý thức được tiến trình bất khả kháng của bệnh tật ở giai đoạn cuối, dù có được giải thích hay không. Vì vậy việc hỗ trợ và động viên tinh thần cho người bệnh để người bệnh có giảm giác nhẹ nhàng hơn, giúp người bệnh vượt qua các lo lắng sợ hãi. Nếu cần thiết có thể phải gửi khám tâm thần và điều trị tâm thần hỗ trợ.
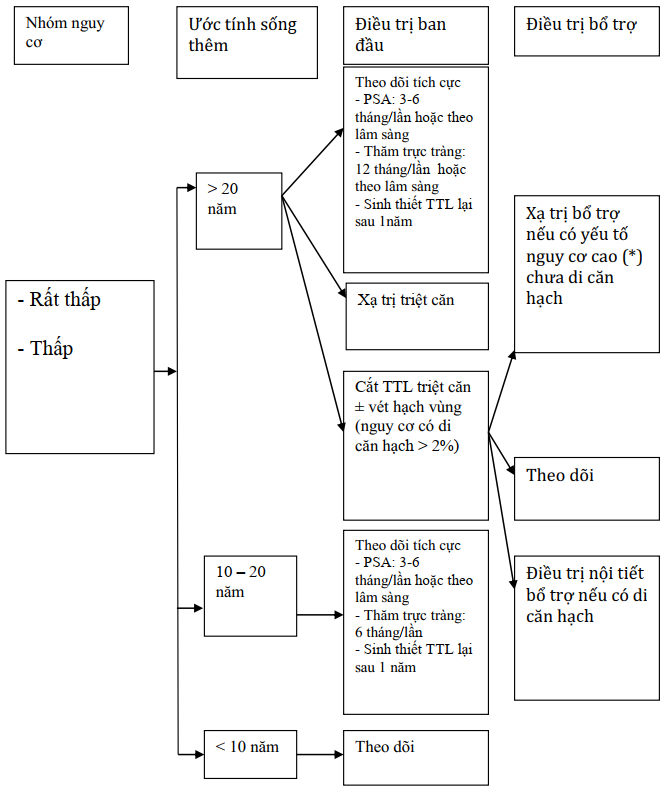
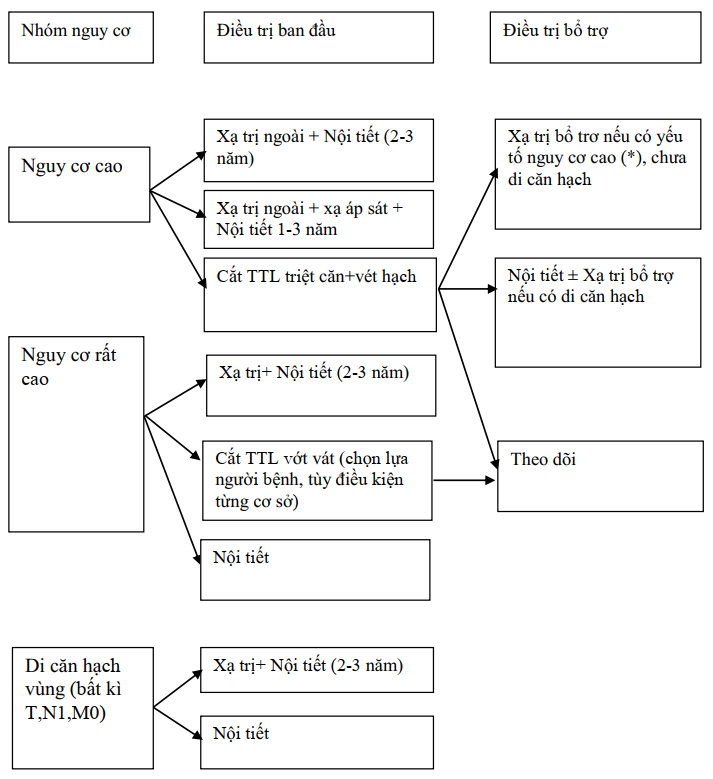
Sơ đồ điều trị utttl theo nhóm nguy cơ
Nguy cơ rất thấp và thấp
(*): diện cắt (+), thâm nhiễm túi tinh, xâm lấn vỏ, PSA cao sau phẫu thuật, di căn hạch
Sơ đồ 3.1. Điều trị UTTTL nguy cơ thấp và rất thấp
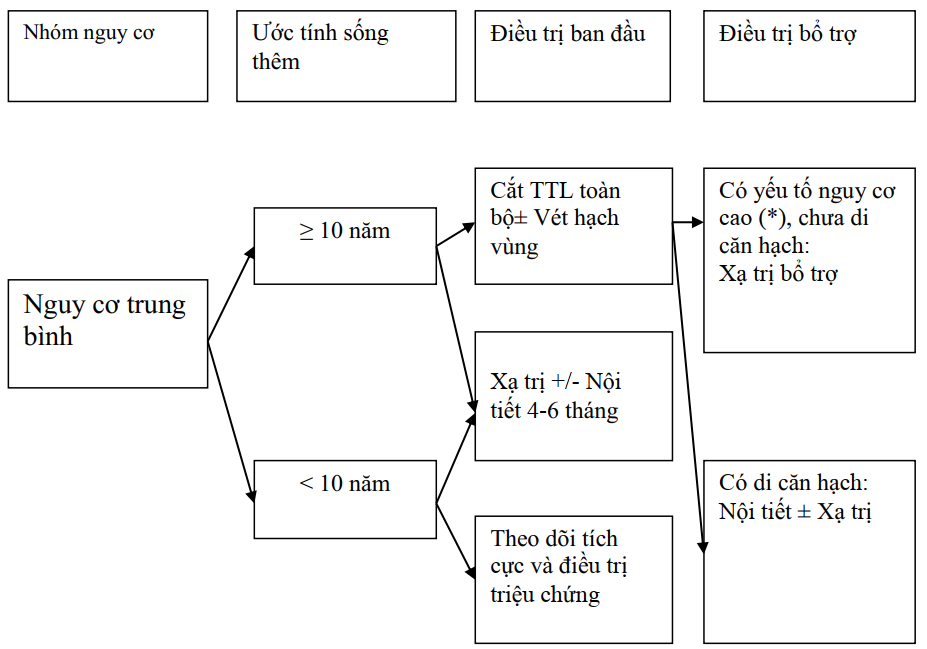
Nguy cơ trung bình
(*): diện cắt (+), thâm nhiễm túi tinh, xâm lấn vỏ, PSA cao sau phẫu thuật
Sơ đồ 3.2. Điều trị UTTTL nguy cơ trung bình
Nguy cơ cao, rất cao
(*): diện cắt (+), thâm nhiễm túi tinh, xâm lấn vỏ, PSA cao sau phẫu thuật
Sơ đồ 3.3. Điều trị UTTTL nguy cơ cao và rất cao
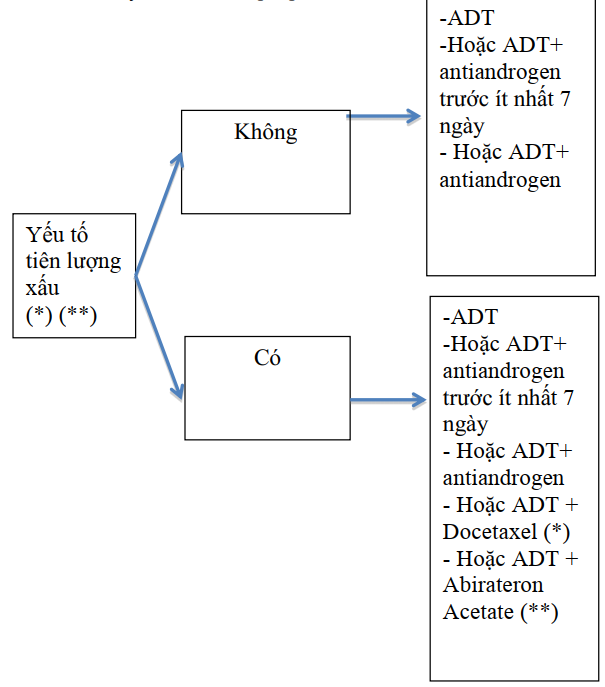
Sơ đồ điều trị utttl di căn
UTTTL di căn nhạy cảm với liệu pháp cắt tinh hoàn
(*): Di căn tạng, nhiều hơn 3 tổn thương di căn xương trong đó có ít nhất 1 tổn thương ngoài cột sống
(**): có 2 trong 3 yếu tố sau: điểm gleason ≥ 8, ít nhất 3 ổ tổn thương xương, di căn tạng
Sơ đồ 3.4. Điều trị UTTTL di căn
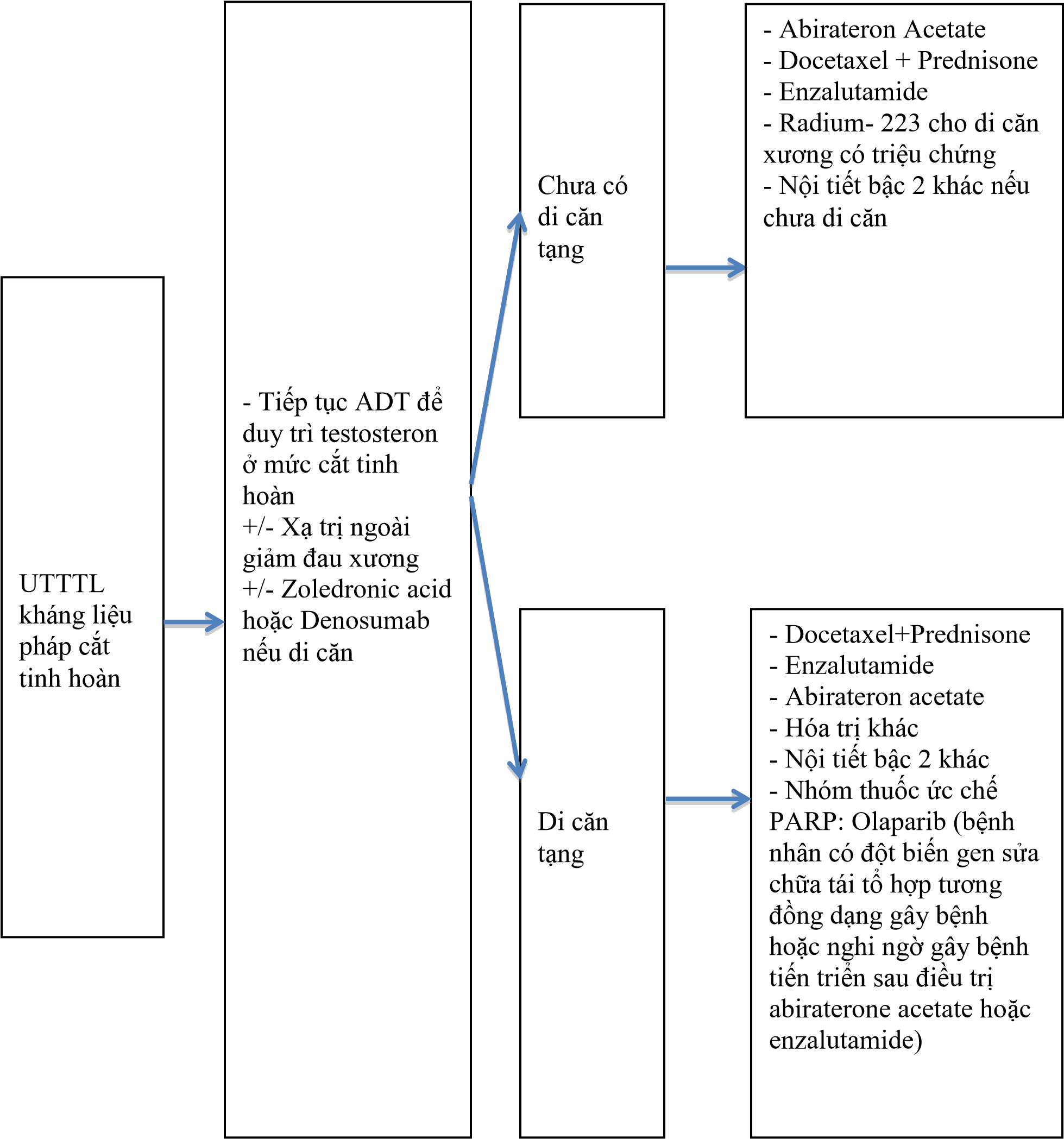
Kháng cắt tinh hoàn
Định nghĩa kháng cắt tinh hoàn:
Testosterone huyết thanh ở ngưỡng cắt tinh hoàn: dưới 50ng/dL hoặc dưới 1,7 nmol/L và kèm theo ít nhất một trong hai tiêu chuẩn:
Tiến triển sinh học: PSA tăng ở 3 lần thử liên tiếp cách nhau mỗi tuần, ít nhất hai lần tăng trên 50% so với mức thấp nhất (nadir), và một lần PSA tăng trên 2ng/mL.
Tiến triển hình ảnh: Xuất hiện từ hai tổn thương xương mới trên xạ hình trở lên hoặc tiến triển các tổn thương không phải xương theo tiêu chuẩn RECIST.
Sơ đồ 3.5. Điều trị UTTTL kháng cắt tinh hoàn
Tăng psa sau phẫu thuật hoặc tia xạ triệt căn
Sơ đồ 3.6. Xử lý tăng PSA đơn thuần sau phẫu thuật hoặc xạ trị triệt căn
Theo dõi sau điều trị
Sau phẫu thuật hoặc xạ trị triệt căn
Xét nghiệm PSA mỗi 3-6 tháng trong 5 năm, sau đó mỗi 6 tháng – 1 năm – Thăm trực tràng hằng năm; có thể không cần nếu PSA bình thường.
Nếu có di căn hạch; hoặc sau phẫu thuật có nguy cơ cao: Khám lâm sàng, PSA mỗi 1-3 tháng; xạ hình xương mỗi 6-12 tháng hoặc khi có triệu chứng.
Điều trị ức chế androgen
Khám lâm sàng, xét nghiệm PSA 1-3 tháng một lần
Định lượng testosterone 3-6 tháng một lần
Xạ hình xương mỗi 6-12 tháng hoặc khi có triệu chứng
Các người bệnh nên được sàng lọc đái tháo đường và rối loạn mỡ máu, cũng như nên định kỳ kiểm tra và bổ sung vitamin D và canxi.
Phụ lục 1 -đánh giá tuổi thọ dự kiến của người bệnh ung thư tuyến tiền liệt cao tuổi (≥ 70 tuổi) (theo hướng dẫn của hội niệu khoa châu âu – eau 2008)
Hướng điều trị dựa theo tình trạng sức khỏe người bệnh
|
Phân nhóm người bệnh theo tình trạng sức khỏe |
||||||||||
|
Nhóm 1 (Khỏe mạnh) |
Nhóm 2 (Trung bình, bệnh tật có thể hồi phục) |
Nhóm 3 (Yếu, bệnh tật không thể hồi phục) |
Nhóm 4 (Bệnh nặng, giai đoạn cuối) |
|||||||
|
Bệnh đi kèm: độ 0, 1 hoặc 2 Sinh hoạt bình thường, không cần trợ giúp (IADL*=0) Không suy dinh dưỡng |
Bệnh đi kèm: có ít nhất một bệnh độ 3 Sinh hoạt hàng ngày cần trợ giúp (≥ 1 IADL= 1) Có nguy cơ suy dinh dưỡng |
Bệnh đi kèm: nhiều bệnh độ 3 hoặc ít nhất một bệnh độ 4 Chăm sóc bản thân: cần sự giúp đỡ ít nhất trong một việc (ADL*) Suy dinh dưỡng nặng Tri giác không tỉnh táo, tiếp xúc chậm |
Ung thư giai đoạn cuối Nằm liệt giường Nhiều bệnh đi kèm rất nặng Tri giác lờ đờ, không tiếp xúc được
|
|||||||
|
|
|
|
|
|
||||||
|
Điều trị tiêu chuẩn |
Điều trị tiêu chuẩn
|
Điều trị triệu chứng
|
Chỉ điều trị nâng đỡ
|
|||||||
|
|
|
|||||||||
|
|
Nếu bệnh lý đi kèm hồi phục, NB có thể chuyển sang nhóm 1 |
|
||||||||
Chỉ số IADL (Instrumental Activities of Daily Living): đánh giá khả năng sinh hoạt hàng ngày của người bệnh, gồm 4 câu hỏi căn bản:
|
Điểm số |
0 |
1 |
2 |
|
NB có tự lấy thuốc và uống thuốc được không? |
Không cần trợ giúp: uống đúng liều và đúng lúc |
Cần người soạn thuốc và nhắc uống thuốc |
Hoàn toàn không thể tự uống thuốc |
|
NB có tự quản lý tiền bạc của mình được không? |
Không cần ai giúp |
Cần giúp đôi chút
|
Không thể tự giữ tiền |
|
NB có tự sử dụng điện thoại được không? |
Không cần ai giúp |
Cần giúp đôi chút |
Không thể sử dụng |
|
NB có thể tự di chuyển hoặc đi chơi xa (xa hơn việc đi bộ quanh nhà) được không? |
Không cần ai giúp |
Cần giúp đôi chút |
Không thể di chuyển, trừ khi có sự chuẩn bị đặc biệt |
Chỉ số ADL (Activities of Daily Living): đánh giá khả năng tự chăm sóc trong sinh hoạt cơ bản cá nhân của người bệnh, gồm 6 việc sau đây:
|
Điểm số |
0 |
1 |
|
Tắm rửa |
Không cần trợ giúp |
Cần trợ giúp |
|
Mặc quần áo |
Không cần trợ giúp |
Cần trợ giúp |
|
Đi vệ sinh |
Không cần trợ giúp |
Cần trợ giúp |
|
Đi đứng di chuyển |
Không cần trợ giúp |
Cần trợ giúp |
|
Ăn uống |
Không cần trợ giúp |
Cần trợ giúp |
|
Tiểu tiện tự chủ |
Tự kiểm soát được |
Không tự kiểm soát được |
Đánh giá độ nặng của các bệnh đi kèm
|
Các loại bệnh đi kèm |
Điểm số độ nặng |
|
Bệnh tim Bệnh mạch máu Bệnh hệ tạo huyết Bệnh hô hấp Bệnh mắt/ tai/ mũi/ họng/ thanh quản Bệnh đường tiêu hóa trên Bệnh dạ dày/ ruột Bệnh gan |
|
|
Bệnh thận Bệnh đường tiết niệu/ sinh dục Bệnh hệ cơ/ xương khớp/ da lông Bệnh hệ thần kinh Bệnh hệ nội tiết/ chuyển hóa/ tuyến vú Bệnh tâm thần |
|
|
Tổng số loại bệnh NB mắc phải Số loại bệnh nặng độ 3 Số loại bệnh nặng độ 4 |
|
Quy định về điểm số độ nặng các loại bệnh:
0: không bị bệnh.
1: bệnh nhẹ hoặc bệnh nặng nhưng đã khỏi.
2: bệnh trung bình hoặc có biến chứng nhẹ, cần điều trị bước 1.
3: bệnh nặng kéo dài và không kiểm soát được.
4: bệnh rất nặng, cần điều trị khẩn cấp, suy chức năng cơ quan tận cùng.
Tuổi thọ dự kiến của người bệnh cao tuổi Số năm dự kiến sống thêm
|
Tuổi |
70 |
75 |
80 |
85 |
90 |
95 |
|
Nhóm 1 (mạnh khỏe) |
18 |
14,2 |
10,8 |
7,9 |
5,8 |
4,3 |
|
Nhóm 2 (trung bình) |
12,4 |
9,3 |
6,7 |
4,7 |
3,2 |
2,3 |
|
Nhóm 3 (yếu) |
6,7 |
4,9 |
3,3 |
2,2 |
1,5 |
1,0 |
Phụ lục 2 -toán đồ tiên lượng giai đoạn bệnh utttl dựa trên giai đoạn lâm sàng, nồng độ psa và điểm gleason (partin’s tables)
|
PSA (ng/ml) |
Giai đoạn bệnh |
Điểm Gleason |
||||
|
6 |
3 + 4 = 7 |
4 + 3 = 7 |
8 |
9 – 10 |
||
|
Giai đoạn lâm sàng T1c (u chỉ phát hiện được qua sinh thiết do PSA tăng) |
||||||
|
0 – 2,5 |
Khu trú trong tuyến |
93 (91–95) |
83(78–87) |
80 (74–85) |
79 (72–85) |
74 (61–83) |
|
Xâm lấn ra ngoài bao tuyến |
7 (5–8) |
15(11–20) |
17 (12–22) |
18 (12–24) |
20 (12–29) |
|
|
Xâm lấn túi tinh |
0 (0–1) |
2 (0–3) |
3 (1–6) |
3 (1–6) |
5 (1–12) |
|
|
Di căn hạch |
0 (0–0) |
0 (0–1) |
0 (0–2) |
0 (0–2) |
2 (0–6) |
|
|
2,6 – 4 |
Khu trú trong tuyến |
87 (85–89) |
71(67–75) |
66 (60–71) |
65 (57–72) |
56 (44–67) |
|
Xâm lấn ra ngoài bao tuyến |
12 (10–14) |
25(22–29) |
27 (22–32) |
28 (22–34) |
29 (20–40) |
|
|
Xâm lấn túi tinh |
0 (0–1) |
2 (1–4) |
4 (2–7) |
4 (2–8) |
7 (3–12) |
|
|
Di căn hạch |
0 (0–0) |
1 (0–2) |
3 (1–5) |
3 (1–6) |
8 (3–16) |
|
|
4,1 – 6 |
Khu trú trong tuyến |
84 (83–86) |
66(63–69) |
60 (55–65) |
59 (51–66) |
50 (38–60) |
|
Xâm lấn ra ngoài bao tuyến |
15 (13–16) |
29(26–33) |
31 (26–36) |
32 (25–38) |
32 (23–42) |
|
|
Xâm lấn túi tinh |
1 (0–1) |
4 (2–5) |
6 (4–9) |
6 (4–10) |
10 (5–16) |
|
|
Di căn hạch |
0 (0–0) |
1 (0–2) |
3 (2–5) |
3 (1–6) |
8 (4–15) |
|
|
6,1 – 10 |
Khu trú trong tuyến |
80 (78–82) |
59(55–63) |
53 (47–58) |
52 (44–59) |
42 (31–52) |
|
Xâm lấn ra ngoài bao tuyến |
18 (16–20) |
34(30–38) |
35 (30–40) |
36 (29–43) |
36 (26–46) |
|
|
Xâm lấn túi tinh |
1 (1–2) |
6 (4–8) |
9 (6–13) |
9 (5–14) |
14 (8–21) |
|
|
Di căn hạch |
0 (0–0) |
1 (0–2) |
3 (1–5) |
3 (1–6) |
8 (4–14) |
|
|
> 10 |
Khu trú trong tuyến |
69 (64–74) |
42(36–48) |
34 (28–40) |
33 (26–40) |
23 (15–32) |
|
Xâm lấn ra ngoài bao tuyến |
27 (22–31) |
42(36–47) |
28 (32–45) |
39 (31–47) |
33 (24–44) |
|
|
Xâm lấn túi tinh |
3 (2–5) |
13 (9–18) |
20 (14–27) |
20 (12–28) |
25 (15–36) |
|
|
Di căn hạch |
0 (0–1) |
3 (1–5) |
8 (4–14) |
8 (3–14) |
18 (9–30) |
|
|
Giai đoạn lâm sàng T2a (thăm trực tràng (+) ở 1 thuỳ, u |
||||||
|
0 – 2,5 |
Khu trú trong tuyến |
90 (87–92) |
76 (70–81) |
72 (65–79) |
71 (62–79) |
65 (51–76) |
|
Xâm lấn ra ngoài bao tuyến |
10 (7–13) |
22 (17–28) |
24 (17–30) |
24 (18–33) |
27 (18–39) |
|
|
Xâm lấn túi tinh |
0 (0–1) |
2 (0–4) |
3 (1–7) |
3 (1–7) |
6 (1–13) |
|
|
Di căn hạch |
0 (0–0) |
0 (0–1) |
1 (0–4) |
1 (0–3) |
2 (0–9) |
|
|
2,6 – 4 |
Khu trú trong tuyến |
82 (78–84) |
61 (56–66) |
56 (48–62) |
54 (46–63) |
45 (33–56) |
|
Xâm lấn ra ngoài bao tuyến |
18 (15–21) |
34 (29–39) |
35 (29–42) |
36 (29–44) |
36 (26–49) |
|
|
Xâm lấn túi tinh |
1 (0–1) |
3 (1–5) |
5 (2–8) |
5 (2–9) |
7 (3–14) |
|
|
Di căn hạch |
0 (0–0) |
1 (0–3) |
4 (1–8) |
4 (1–10) |
11 (4–23) |
|
|
4,1 – 6 |
Khu trú trong tuyến |
78 (74–81) |
56 (51–60) |
49 (43–56) |
48 (40–56) |
39 (28–50) |
|
Xâm lấn ra ngoài bao tuyến |
21 (18–24) |
38 (34–43) |
39 (33–46) |
40 (32–48) |
39 (28–50) |
|
|
Xâm lấn túi tinh |
1 (1–1) |
4 (3–6) |
7 (4–10) |
7 (4–11) |
10 (5–16) |
|
|
Di căn hạch |
0 (0–0) |
2 (1–3) |
4 (2–7) |
4 (2–8) |
11 (4–21) |
|
|
6,1 – 10 |
Khu trú trong tuyến |
73 (68–77) |
48 (43–54) |
42 (36–49) |
41 (33–50) |
32 (23–43) |
|
Xâm lấn ra ngoài bao tuyến |
26 (22–30) |
44 (39–49) |
44 (37–50) |
45 (36–52) |
43 (31–54) |
|
|
Xâm lấn túi tinh |
1 (1–2) |
6 (4–9) |
10 (6–15) |
10 (5–16) |
14 (7–22) |
|
|
Di căn hạch |
0 (0–0) |
1 (1–3) |
4 (2–7) |
4 (1–8) |
10 (4–20) |
|
|
> 10 |
Khu trú trong tuyến |
60 (53–66) |
32 (26–39) |
25 (20–31) |
24 (18–32) |
16 (10–24) |
|
Xâm lấn ra ngoài bao tuyến |
36 (30–42) |
50 (43–56) |
44 (36–53) |
45 (35–55) |
37 (25–49) |
|
|
Xâm lấn túi tinh |
4 (2–6) |
14 (8–20) |
20 (12–29) |
20 (11–30) |
24 (13–38) |
|
|
Di căn hạch |
1 (0–2) |
4 (2–7) |
10 (4–18) |
10 (4–20) |
22 (10–37) |
|
|
Giai đoạn lâm sàng T2b (thăm trực tràng (+), u > ½ khối lượng của 1 thuỳ, khu trú trong 1 thuỳ), hoặc T2c (thăm trực tràng (+) ở cả 2 thuỳ tuyến). |
||||||
|
0 – 2,5 |
Khu trú trong tuyến |
82 (76–87) |
61 (52–70) |
55 (45–66) |
54 (44–66) |
45 (32–60) |
|
Xâm lấn ra ngoài bao tuyến |
17 (12–23) |
33 (25–42) |
34 (25–44) |
35 (24–46) |
35 (23–48) |
|
|
Xâm lấn túi tinh |
1 (0–2) |
5 (1–10) |
8 (2–16) |
8 (2–16) |
13 (3–24) |
|
|
Di căn hạch |
0 (0–0) |
1 (0–3) |
2 (0–9) |
3 (0–9) |
7 (0–21) |
|
|
2,6 – 4 |
Khu trú trong tuyến |
70 (63–75) |
44 (37–51) |
36 (29–44) |
35 (27–44) |
24 (16–35) |
|
Xâm lấn ra ngoài bao tuyến |
28 (22–35) |
46 (39–53) |
43 (35–51) |
44 (34–53) |
37 (26–51) |
|
|
Xâm lấn túi tinh |
2 (1–3) |
6 (3–10) |
10 (5–16) |
10 (5–17) |
13 (6–23) |
|
|
Di căn hạch |
1 (0–2) |
4 (2–8) |
11 (5–20) |
11 (4–21) |
25 (12–42) |
|
|
4,1 – 6 |
Khu trú trong tuyến |
64 (58–70) |
38 (32–44) |
30 (24–37) |
30 (22–37) |
20 (13–29) |
|
Xâm lấn ra ngoài bao tuyến |
32 (27–39) |
49 (42–56) |
45 (38–52) |
46 (37–55) |
38 (26–51) |
|
|
Xâm lấn túi tinh |
2 (1–4) |
9 (6–13) |
14 (9–20) |
13 (8–21) |
17 (9–28) |
|
|
Di căn hạch |
1 (0–2) |
4 (2–8) |
11 (5–17) |
11 (5–19) |
24 (12–40) |
|
|
6,1 – 10 |
Khu trú trong tuyến |
58 (50–65) |
31 (25–37) |
24 (19–31) |
24 (18–31) |
16 (10–23) |
|
Xâm lấn ra ngoài bao tuyến |
38 (32–45) |
52 (46–59) |
47 (40–55) |
48 (39–57) |
40 (28–52) |
|
|
Xâm lấn túi tinh |
4 (2–6) |
12 (8–18) |
19 (12–25) |
18 (10–26) |
23 (12–34) |
|
|
Di căn hạch |
1 (0–2) |
4 (2–7) |
10 (5–16) |
10 (5–18) |
22 (10–35) |
|
|
> 10 |
Khu trú trong tuyến |
42 (34–50) |
17 (13–23) |
12 (8–16) |
11 (8–16) |
6 (4–11) |
|
Xâm lấn ra ngoài bao tuyến |
47 (39–55) |
50 (41–59) |
39 (30–49) |
40 (28–51) |
27 (18–40) |
|
|
Xâm lấn túi tinh |
9 (5–14) |
23 (15–33) |
30 (20–41) |
29 (18–42) |
30 (17–45) |
|
|
Di căn hạch |
2 (0–4) |
9 (4–16) |
20 (10–31) |
20 (9–32) |
36 (20–53) |
|
(Giá trị trong bảng là tỷ lệ % khả năng giai đoạn UTTTL, với độ tin cậy 95%)
Tài liệu tham khảo
Nguyễn Bá Đức, Trần Văn Thuấn, Nguyễn Tuyết Mai (2010). Điều trị nội khoa bệnh ung thư. Nhà xuất bản Y học.
Nguyễn Chấn Hùng (2004). Ung bướu học nội khoa. Nhà xuất bản Y học.
Vũ Lê Chuyên và cs (2018). Hướng dẫn chẩn đoán và điều trị ung thư tuyến tiền liệt; Hội tiết niệu thận học Việt Nam (VUNA).
Lương Ngọc Khuê, Mai Trọng Khoa – Hướng dẫn Chẩn đoán và Điều trị một số bệnh Ung bướu 2020 – Nhà xuất bản Y học.
Mai Trọng Khoa (2014). Hướng dẫn chẩn đoán và điều trị một số bệnh ung bướu. Nhà xuất bản Y học.
Trần Văn Thuấn, Lê Văn Quảng, Nguyễn Tiến Quang (2019). Hướng dẫn chẩn đoán điều trị bệnh ung thư thường gặp. Nhà xuất bản Y học. 7. Bùi Diệu và cs (2016). Hướng dẫn chẩn đoán và điều trị các bệnh ung thư thường gặp. Nhà xuất bản Y học.
Nguyễn Văn Hiếu (2010). Điều trị phẫu thuật bệnh ung thư. Nhà xuất bản Y học.
Mai Trọng Khoa (2016). Kháng thể đơn dòng và phân tử nhỏ trong điều trị ung thư. Nhà xuất bản Y học.
Mai Trọng Khoa, Nguyễn Xuân Kử (2012). Một số tiến bộ về kỹ thuật xạ trị ung thư và ứng dụng trong lâm sàng. Nhà xuất bản Y học.
Mai Trọng Khoa và cộng sự (2012). Y học hạt nhân (Sách dùng cho sau đại học). Nhà xuất bản Y học.
Hội tiết niệu-Thận học Việt Nam (2013). Phác đồ hướng dẫn chẩn đoán và điều trị ung thư tuyến tiền liệt.
Baxter Oncology (2005). Selected Schedules in the Therapy of Malignant Tumors. 431-434.
National Comprehensive Cancer Network (2020). Prostate Cancer. Version1.2020. NCCN Clinical Practice Guideline in Oncology.
Vincent T DeVita, Theodore S. Lawrence, Steven A. Rosenberg (2014), Cancer Principles and Practice of Oncology, 10th edition. Lippincott Ravell publishers. Philadelphia, United States.
Rhea LP, Gupta B, Aragon-Ching JB (2019). Enzalutamide: a new indication for nonmetastatic castration-resistant prostate cancer. Asian J Androl. 21(2):107-108.
Ferlay, J., et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer, 2015. 136(5): E359-86. https://www.ncbi.nlm.nih.gov/pubmed/25220842
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018, 68:7-30. https://www.ncbi.nlm.nih.gov/pubmed/29313949.
Park SY, Murphy SP, Wilkens LR, et al. (2007). Fat and meat intake and prostate cancer risk: the multiethnic cohort study. Int J Cancer 121: 1339-1345.
MacLean CH, Newberry SJ, Mojica WA, et al. (2006). Effects of omega-3 fatty acids on cancer risk: a systematic review. JAMA 295: 403-415.
EAU – ESTRO – ESUR – SIOG Guidelines on Prostate Cancer 2018
Epstein JI, Egevad L, Amin MB, et al. The 2014 International Society of Urological Pathology (ISUP) consensus conference on Gleason grading of prostatic carcinoma: definition of grading patterns and proposal for a new grading system. Am J Surg Pathol 2016;40:244- 252. https://www.ncbi.nlm.nih.gov/pubmed/26492179.
- Parker, S. Gillessen, A. Heidenreich et al. Cancer of the prostate: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26
(Supplement 5): v69–v77, 2015. https://www.esmo.org/Guidelines/GenitourinaryCancers/Cancer-of-the-Prostate
Amin MB, Greene FL, Edge S, et al., eds. AJCC Cancer Staging Manual (ed 8th Edition). New York: Springer; 2017.
Hussain M, Tangen CM, Higano CS et al. Intermittent (IAD) versus continuous androgen deprivation (CAD) in hormone sensitive metastatic prostate cancer (HSM1PC) patients (pts): results of S9346 (INT-0162), an international phase III trial. N Engl J Med 2013; 368: 1314–1325.
Sweeney C, Chen Y-H, Carducci M et al. Impact on overall survival (OS) with chemohormonal therapy versus hormonal therapy for hormone-sensitive newly metastatic prostate cancer (mPrCa): an ECOG-led phase III randomized trial. J Clin Oncol (ASCO Meeting Abstracts) 2014; 32 (18 suppl): LBA2.
James ND, Sydes MR, Mason MD et al. Docetaxel and/or zoledronic acid for hormone-naïve prostate cancer: first overall survival results from STAMPEDE (NCT00268476). J Clin Oncol 2015; 33 (suppl; abstract 5001)
Fizazi K, Tran N, Fein L, et al. Abiraterone plus prednisone in metastatic, castration- sensitive prostate cancer. N Engl J Med 2017;377:352-360. Available at: https://www.ncbi.nlm.nih.gov/pubmed/28578607.
de Bono JS, Logothetis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364:1995.
Ryan CJ, et al. Interim analysis (IA) results of COU-AA-302, a randomized, phase III study of abiraterone acetate (AA) in chemotherapy-naive patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 2012; (suppl: abstract LBA 4518).
Scher HI, Fizazi K, Saad F, et al. Effect of MDV3100, an androgen receptor signaling inhibitor (ARSI), on overall survival in patients with prostate cancer postdocetaxel: Results from the phase III AFFIRM study. J Clin Oncol 2012; 30.
Beer TM, Armstrong AJ, Rathkopf D, et al. Enzalutamide in men with chemotherapy-naive metastatic castration-resistant prostate cancer: extended analysis of the phase 3 PREVAIL study. Eur Urol 2017;71:151-154. Available at: https://www.ncbi.nlm.nih.gov/pubmed/27477525.
Vadim S. Koshkin et al. Apalutamide in the treatment of castrate-resistant prostate cancer: evidence from clinical trials. Ther Adv Urol 2018, Vol. 10(12) 445–454.
Basch EM, Somerfield MR, Beer TM, et al. American Society of Clinical Oncology endorsement of the Cancer Care Ontario Practice Guideline on nonhormonal therapy for men with metastatic hormone-refractory (castration-resistant) prostate cancer. J Clin Oncol 2007; 25:5313.
de Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376:1147.
Kantoff, P.W., et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer.NEnglJMed,2010.363:411.https://www.ncbi.nlm.nih.gov/pubmed/20818862
Parker C, et al. Overall survival benefit of radium-223 chloride (Alpharadin) in the treatment of patients with symptomatic bone metastases in castration-resistant prostate cancer: A phase III randomized trial (ALSYMPCA). Abstract 1LBA, European Multidisciplinary Congress, 2011
Eifler J.B., Feng Z., Lin B.M., et al. (2013). An updated prostate cancer staging nomogram (Partin tables) based on cases from 2006 to 2011. British Journal of Urology International, 111(1), 22-29.