Boris Jung1,2*, Mikaël Martinez3,4, Yann Erick Claessens5, Michaël Darmon6,7,8, Kada Klouche2,9, Alexandre Lautrette10,11, Jacques Levraut12,13, Eric Maury14,15,16, Mathieu Oberlin17, Nicolas Terzi18,19, Damien Viglino20,21, Youri Yordanov22,23,24, Pierre Géraud Claret25, Naïke Bigé14, for the Société de Réanimation de Langue Française (SRLF) and the Société Française de Médecine d’Urgence (SFMU)
Tóm tắt
Nhiễm toan chuyển hóa là một rối loạn thường gặp trong cấp cứu và hồi sức tích cực. Do có tài liệu đã được nghiên cứu với các dữ liệu mới liên quan đến việc quản lý nhiễm toan chuyển hóa, Hiệp hội Hồi sức tích cực Pháp (Société de Réanimation de Langue Française [SRLF]) và Hiệp hội Cấp cứu Pháp (SociétéFrançaise de Médecine d hèUrgence [SFMU]) đã phát triển các khuyến cáo chính thức từ các chuyên gia thông qua phương pháp GRADE. Các lĩnh vực của chiến lược chẩn đoán, đánh giá bệnh nhân, quản lý điều trị và điều trị đã đưa ra 29 khuyến cáo đã được đưa ra: 4 khuyến cáo mạnh (Lớp 1), 10 khuyến cáo yếu (Lớp 2) và 15 khuyến cáo là ý kiến chuyên gia. Một đồng thuận mạnh mẽ từ những người tham gia bỏ phiếu cho tất cả các khuyến nghị. Việc áp dụng các phương pháp của Henderson-Hasselbalch và Stewart để chẩn đoán cơ chế nhiễm toan chuyển hóa được thảo luận và một lượt đồ chẩn đoán được đề xuất. Việc sử dụng ketosis và lactate máu từ tĩnh mạch và mao mạch cũng được đề cập. Giá trị của pH, lactatemia và động học của nó đối với bệnh nhân ở các tình huống cấp cứu trước nhập viện và bệnh viện được xem xét. Cuối cùng, các phương thức điều trị bằng insulin trong điều trị nhiễm toan đái tháo đường, chỉ định truyền natri bicarbonate và lọc máu thận thay thế cũng như các phương thức thở máy trong quá trình nhiễm toan chuyển hóa nặng được đề cập trong quản lý điều trị.
Từ khóa: Nhiễm toan chuyển hóa, Phân tích khí máu, Khoảng trống anion, Tăng huyết áp, Ketoacidosis, Natri bicarbonate,Liệu pháp thay thế thận
Giới thiệu
Phương pháp Henderson-Hasselbalch định nghĩa nhiễm toan chuyển hóa bằng sự hiện diện của sự mất cân bằng axit liên quan đến nồng độ bicarbonate huyết tương dưới 20 mmol/L. Mối liên quan của sự mất cân bằng này với pH giảm được gọi là “toan máu”, thường được mô tả là nghiêm trọng khi độ pH bằng hoặc dưới 7,20. Nhiễm toan chuyển hóa là một biến cố thường gặp ở bệnh nhân được điều trị khẩn cấp hoặc chăm sóc tích cực. Các bác sĩ đã sử dụng nhiều xét nghiệm huyết tương và nước tiểu xác định các đặc tính của nhiễm toan chuyển hóa, xác định nguyên nhân của nó và điều trị bệnh nhân. Nhiễm toan chuyển hóa cấp tính có thể đi kèm với các bệnh khác nhau và có liên quan đến suy nội tạng, đặc biệt là hô hấp (tăng nhu cầu thông khí) và tim mạch (shock dãn mạch, giảm sức co bóp và cung lượng tim, rối loạn nhịp thất) [1, 3]. Vai trò của nhiễm toan chuyển hóa cấp tính trong những tình huống suy nội tạng này hầu hết được đề xuất bởi các nghiên cứu thực nghiệm trên động vật hoặc trong phòng thí nghiệm, vì rất ít nghiên cứu lâm sàng ở người có sẵn [1].
Hội nghị đồng thuận cuối cùng về việc điều chỉnh nhiễm toan chuyển hóa trong chăm sóc đặc biệt, đã được xuất bản năm 1999 bởi Société de Réanimation de Langue Française (SRLF), với sự tham gia của Société Française de Dinh dưỡng Entérale et Parentérale và Sociéte de Néphrologie. Kể từ đó, xét nghiệm chăm sóc tại giường đã phát triển và cho phép các bác sĩ lâm sàng thực hiện các phép đo khí máu rất nhanh, kể cả ở các cơ sở ngoại viện. Ngoài ra, dữ liệu mới về các công cụ chẩn đoán và tiên lượng và điều trị nhiễm toan chuyển hóa đã làm phong phú nguồn tài liệu y văn. Đây là lý do tại sao SRLF và Société Française de Médecine d hèUrgence (SFMU) đề xuất các hướng dẫn chính thức này về chẩn đoán và quản lý nhiễm toan chuyển hóa. Thông qua phân tích mức độ bằng chứng trong y văn, mục đích của các hướng dẫn này là chỉ định chiến lược chẩn đoán, điều trị bệnh nhân và quản lý trị liệu ở các cơ sở ngoại viện, trong phòng cấp cứu và chăm sóc đặc biệt.
Phương pháp
Các hướng dẫn đã được soạn thảo bởi một nhóm mười hai chuyên gia được triệu tập bởi SRLF và SFMU. Chương trình nghị sự nhóm đã được xác định trước. Ban tổ chức trước tiên xác định các câu hỏi sẽ được giải quyết với các điều phối viên và sau đó chỉ định các chuyên gia phụ trách từng câu hỏi. Các câu hỏi được xây dựng theo định dạng kết quả so sánh can thiệp của bệnh nhân (PICO) sau cuộc họp đầu tiên của nhóm chuyên gia. Tài liệu đã được phân tích và các hướng dẫn được xây dựng bằng phương pháp Đánh giá, Phát triển và Lượng giá (GRADE). Một mức độ bằng chứng đã được xác định cho mỗi tài liệu tham khảo thư mục được trích dẫn như chức năng của loại nghiên cứu và có thể được đánh giá lại về chất lượng phương pháp luận của nghiên cứu. Một mức độ bằng chứng tổng thể được xác định cho từng biến cố chính của nghiên cứu, có tính đến mức độ bằng chứng của từng tài liệu y văn tham chiếu, tính nhất quán giữa các nghiên cứu về kết quả, tính chất trực tiếp hoặc gián tiếp của kết quả và phân tích chi phí. Ba cấp độ chứng minh được sử dụng (Bảng 1):
Mức độ bằng chứng tổng thể cao cho phép xây dựng khuyến cáo “Mạnh” (nên được thực hiện.. LỚP 1+, không nên thực hiện LỚP 1−).
Mức độ bằng chứng tổng thể vừa phải, thấp hoặc rất thấp dẫn đến việc đưa ra khuyến cáo “tùy ý” (có lẽ nên được thực hiện…. GRADE 2+, có lẽ không nên thực hiện GRADE 2−).
Tài liệu y văn không có hoặc không đủ, câu hỏi có thể là chủ đề của một khuyến cáo dưới dạng ý kiến chuyên gia (các chuyên gia đề xuất….).
Các khuyến cáo đề xuất đã được trình bày và thảo luận từng cái một. Mục đích không cần thiết để đạt được một ý kiến duy nhất và hội tụ của các chuyên gia về tất cả các đề xuất, nhưng để xác định các điểm thỏa thuận và các điểm bất đồng hoặc không chắc chắn. Sau đó, mỗi chuyên gia đã xem xét và đánh giá từng đề xuất bằng cách sử dụng thang điểm từ 1 (hoàn toàn không đồng ý) đến 9 (hoàn toàn đồng ý). Xếp hạng tập thể đã được thực hiện bằng cách sử dụng GRADE. Để phê duyệt một khuyến nghị liên quan đến một tiêu chí, ít nhất 50% các chuyên gia đã phải đồng ý và ít hơn 20% bất đồng. Để một thỏa thuận trở nên mạnh mẽ, ít nhất 70% các chuyên gia đã phải đồng ý. Trong trường hợp không có thỏa thuận mạnh mẽ, các khuyến nghị đã được điều chỉnh và đánh giá lại, nhằm đạt được sự đồng thuận. Chỉ có ý kiến chuyên gia đạt được thỏa thuận mạnh mẽ được giữ.
Các khuyến cáo
Ba lĩnh vực đã được xác định: chiến lược chẩn đoán, giới thiệu bệnh nhân và quản lý trị liệu. Một tìm kiếm thư mục được thực hiện bằng cơ sở dữ liệu MEDLINE thông qua PubMed và cơ sở dữ liệu của Cochrane. Để đưa vào phân tích, các ấn phẩm phải được viết bằng tiếng Anh hoặc tiếng Pháp. Phân tích tập trung vào tất cả các dữ liệu tài liệu mà không áp đặt giới hạn ngày, theo một thứ tự thẩm định, từ phân tích tổng hợp đến các thử nghiệm ngẫu nhiên, nghiên cứu quan sát. Quy mô của quần thể nghiên cứu và mức độ phù hợp của nghiên cứu đã được xem xét cho từng nghiên cứu.
Bảng 1 Khuyến cáo theo phương pháp GRADE
|
|
Khuyến nghị theo phương pháp GRADE |
|
|
Mức độ bằng chứng cao |
Mức khuyến cáo mạnh “… nên làm…” |
Grade 1+ |
|
Mức độ bằng chứng trung bình |
Khuyến cáo tùy chọn “… có thể nên làm…” |
Grade 2+ |
|
Mức chứng cớ yếu |
Khuyến cáo dựa trên ý kiến chuyên gia “Các chuyên gia đề nghị…” |
Ý kiến chuyên gia |
|
Mức độ chứng có trung bình |
Khuyến cáo tùy chọn “… có thể nên làm…” |
Grade 2− |
|
Mức độ bằng chứng cao |
Mức khuyến cáo mạnh “… nên làm…” |
Grade 1− |
Tóm tắt kết quả
Tóm tắt các kết quả của các chuyên gia theo phương pháp GRADE đã dẫn đến việc đưa ra 29 hướng dẫn. Trong số các hướng dẫn này, 4 có mức độ bằng chứng cao (GRADE 1 ±) và 10 mức độ bằng chứng thấp (GRADE 2 ±). Phương pháp GRADE không thể áp dụng theo 15 hướng dẫn, dẫn đến ý kiến chuyên gia. Sau hai vòng đánh giá, một thỏa thuận mạnh mẽ đã đạt được cho tất cả các hướng dẫn. Bảng 2 cung cấp một bản tóm tắt các khuyến cáo.
Phần đầu: chiến lược chẩn đoán
Có nên thực hiện các phép đo khí máu động mạch ở những bệnh nhân bị giảm nồng độ bicarbonate huyết tương khi chẩn đoán mất cân bằng acid acid?
R1.1- Các chuyên gia khuyên rằng các phép đo khí máu động mạch nên được thực hiện ở những bệnh nhân bị giảm nồng độ bicarbonate huyết tương để loại trừ nhiễm kiềm hô hấp, xác nhận chẩn đoán nhiễm toan chuyển hóa và xét nghiệm nhiễm toan hỗn hợp (EXPERT OPINION).
Cơ sở lý luận: Nhiễm toan axit là một quá trình sinh lý bệnh có thể giải thích cho việc giảm pH máu và được gọi là nhiễm toan máu. Hai cơ chế chính có thể chịu trách nhiệm: giảm bicarbonate huyết tương, xác định đó là nhiễm toan chuyển hóa và tăng PaCO2, xác định đó là nhiễm toan hô hấp.
Trong trường hợp nhiễm toan chuyển hóa, việc giảm bicarbonate huyết tương hoặc phản ánh sự can thiệp của hệ thống đệm liên quan đến sự tích tụ của các axit không hô hấp, hoặc mất quá nhiều bicarbonate.
Độ pH có thể được giữ bình thường thông qua việc giảm PaCO2 đạt được bằng cách bù thông khí. Toan máu xảy ra khi bù hô hấp không đủ. Giá trị PaCO2 duy trì pH bình thường, được gọi là PaCO2 dự kiến, có thể được tính bằng công thức: PaCO2 dự kiến = 1,5 × [HCO3−] + 8 ± 2 mmHg [4, 5]. Các phép đo khí máu có thể được sử dụng để đánh giá bù hô hấp và do đó phát hiện nhiễm toan máu hỗn hợp: pH PaCO2 dự kiến.
Vì sự giảm bicarbonate huyết tương cũng có thể liên quan đến cơ chế bù của nhiễm kiềm hô hấp [6], các phép đo khí máu sẽ cho phép loại bỏ nhiễm kiềm hô hấp: pH> 7,42 và PaCO2
Tuy nhiên, sự tương đồng giữa các phép đo khí máu tĩnh mạch và động mạch kém hơn nhiều đối với PaCO2. Trong một phân tích tổng hợp các nghiên cứu so sánh giá trị P aCO2 động mạch và tĩnh mạch ở bệnh nhân trong phòng cấp cứu, sự khác biệt trung bình là 4,41 mmHg [95% CI 2.55, 6.27], với các giới hạn tương ứng trong khoảng từ – 20.4 đến 25,8 mmHg [7].
Có phải mức kiềm thiếu là một phép đo tốt hơn so với bicarbonate huyết tương trong chẩn đoán nhiễm toan chuyển hóa?
R1.2 Đo lường mức kiềm thiếu có lẽ không nên được ưu tiên so với bicarbonate huyết tương trong việc xác định bệnh nhân có nguy cơ nhiễm toan chuyển hóa (LỚP 2−, KHUYẾN CÁO MẠNH).
Cơ sở lý luận: Dữ liệu lâm sàng khan hiếm và hạn chế (nghiên cứu quan sát, hồi cứu) [12-14]. Hai nghiên cứu lớn nhất cho thấy, nếu nhóm đối chứng là bệnh nhân có lượng kiềm dư (BE) -5 mmol / L, tương ứng với mức kiềm thiếu 5 mmol / L, thì bicarbonate huyết tương dưới 20 mmol / L là một chỉ số chẩn đoán tốt nhiễm toan chuyển hóa [13, 14]. BE tương ứng với lượng axit mạnh (hoặc bazơ mạnh trong trường hợp nhiễm toan chuyển hóa) nên được thêm vào 1 L huyết tương để bình thường hóa pH đến 7,40, với PaCO2 là 40 mmHg và nhiệt độ 37 ° C. Có một số phương pháp tính BE, nhưng tất cả đều sử dụng bicarbonate huyết tương làm thành phần chính. Lượng kiềm dư chuẩn (SBE) được tính toán bằng công thức Van Slyke * có tính đến nồng độ hemoglobin là 5 g / dL, là nồng độ hemoglobin lý thuyết trong không gian ngoại bào của phân phối bicarbonate. Phương trình Van Slyke cho SBE được sử dụng nhiều nhất trên lâm sàng, nhưng không được sử dụng trong các nghiên cứu so sánh với bicarbonate huyết tương. Vì BE luôn được tính toán từ bicarbonate huyết tương, nên mối tương quan giữa bicarbonate huyết tương và BE (và do đó mức kiềm thiếu) là rất mạnh.
Phương trình Van Slyke:
Kiềm dư = (HCO3−–24.4) + (2.3 × Hb + 7.7) × (pH − 7.4) × (1 − 0.023 × Hb), với Hb đơn vị là g/dL.
Bảng 2 Tóm tắt các khuyến cáo
|
Khuyến cáo |
Mức độ chứng cứ |
|
|
Chiến lược chẩn cứ |
|
|
|
R1.1 |
Các chuyên gia khuyên rằng các phép đo khí máu động mạch nên được thực hiện ởnhững bệnh nhân bị giảm nồng độ bicarbonate huyết tương để loại trừ nhiễm kiềm hô hấp, xác nhận chẩn đoán nhiễm toan chuyển hóa và xét nghiệm nhiễm toan hỗn hợp |
Ý kiến chuyên gia |
|
R1.2 |
Đo lường mức kiềm thiếu có lẽ không nên được ưu tiên so với bicarbonate huyết tương trong việc xác định bệnh nhân có nguy cơ nhiễm toan chuyển hóa |
Grade 2− |
|
R1.3 |
Có thể nên sử dụng khoảng trống anion được điều theo albumin thay vì khoảng trống anion chưa được xử lý để phân biệt nhiễm toan liên quan đến quá tải axit và từ nhiễm toan liên quan đến thiếu hụt kiềm |
Grade 2+ |
|
R1.4 |
Các chuyên gia đề nghị trước tiên nên áp dụng phương pháp Henderson-Hasselbalch và sử dụng khoảng trống anion được hiệu chỉnh theo albumin để chẩn đoán cơ chế nhiễm toan chuyển hóa. Tuy nhiên, phương pháp Stewart cung cấp cái nhìn sâu sắc về các tình huống không giải thích được bằng phương pháp Henderson-Hasselbalch: mất cân base-axit thứ phát sau mất cân bằng natri và clorua máu và các rối loạn phức tạp |
Ý kiến chuyên gia |
|
R1.5 |
Các chuyên gia đề nghị sử dụng một lượt đồ để cải thiện chẩn đoán nguyên nhân của nhiễm toan chuyển hóa |
Ý kiến chuyên gia |
|
R1.6 |
Các chuyên gia khuyên rằng khoảng trống anion trong nước tiểu chỉ nên được tính toán trong nhiễm toan chuyển hóa mà không có anion không được đo lường hoặc nguyên nhân rõ ràng y |
Ý kiến chuyên gia |
|
R1.7 |
Các chuyên gia khuyên rằng nên hạn chế đo pH nước tiểu ở những bệnh nhân bị nhiễm toan chuyển hóa mà không có đo anion hoặc nguyên nhân không rõ ràng, và nghi ngờ lâm sàng mạnh mẽ về nhiễm toan ở ống thận |
Ý kiến chuyên gia |
|
R1.8 |
Các chuyên gia cho rằng một giá trị bình thường của lactate máu tĩnh mạch làm lờ đi tình trạng tăng lactate máu gia |
Ý kiến chuyên giá |
|
R1.9 |
Lactate máu động mạch nên được thực hiện để xác định tình trạng tăng thật sự trong trường hợp tăng lactate máu tĩnh mạch |
Grade 2+ |
|
R1.10
|
Không nên đo Lactate máu mao mạch để chẩn đoán tăng lactate máu
|
Grade 1− |
|
R1.11 |
Nên đo ketone máu mao mạch chứ không phải ketone trong nước tiểu khi chẩn đoán nhiễm toan ketone |
Grade 1+ |
|
Đánh giá bệnh nhân |
|
|
|
R2.1 |
Giá trị pH có lẽ không nên được sử dụng một mình để xác định bệnh nhân bị bệnh nặng |
Grade 2− |
|
R2.2 |
Tăng lactate máu, bất kể giá trị của nó, nên được coi là một dấu hiệu của mức độ nghiêm trọng trong điều trị ban đầu. Quản lý chẩn đoán và điều trị nên nhanh chóng và đa mô thức nếu cần |
Grade 1+ |
|
R2.3 |
Có thể theo dõi sự gia tăng lactate trong máu trong những giờ đầu tiên quản lý để đánh giá đáp ứng với điều trị |
Grade 2+ |
|
R2.4 |
Các chuyên gia đề nghị theo dõi chặt chẽ bệnh nhân bị nhiễm toan đái tháo đường, lý tưởng là ở khoa chăm sóc đặc biệt |
Ý kiến chuyên gia |
|
Quản lý điều trị |
|
|
|
R3.1 |
Insulin có lẽ nên được tiêm tĩnh mạch thay vì tiêm dưới da ở bệnh nhân nhiễm toan đái tháo đường |
Grade 2+ |
|
R3.2 |
Liều dùng insulin tiêm tĩnh mạch liên tục thấp có lẽ nên được dùng trong điều trị nhiễm toan đái tháo đường |
Grade 2− |
|
R3.3 |
Liều dùng insulin tiêm tĩnh mạch liên tục thấp có lẽ nên được dùng trong điều trị nhiễm toan đái tháo đường |
Grade 2+ |
|
R3.4 |
Các chuyên gia khuyên bạn nên sử dụng liều khởi đầu 0,1IU / kg / giờ mà không vượt quá 10IU/giờ và gia tăng liều trong trường hợp không bị hạ kali máu, nếu các mục tiêu điều chỉnh ketone máu (0,5 mmol/L/giờ ), tăng bicarbonate (3 mmol/L/h) và glucose máu mao mạch (3 mmol/L/h) không đạt được sau những giờ điều trị đầu tiên |
Ý kiến chuyên gia |
|
R3.5 |
Các chuyên gia khuyên bạn nên dùng sodium bicarbonate để bù cho tình trạng mất kiềm qua đường tiêu hóa hoặc suy thận trong trường hợp dung nạp lâm sàng kém |
Ý kiến chuyên gia |
|
R3.6 |
Natri bicarbonate có lẽ nên được dùng cho bệnh nhân chăm sóc đặc biệt bị nhiễm toan chuyển hóa nặng (pH ≤ 7,20, PaCO2 |
Grade 2+ |
|
R3.7 |
Natri bicarbonate không nên được sử dụng thường xuyên trong quản lý điều trị ngừng tuần hoàn, ngoài tăng kali máu trước đó hoặc ngộ độc nhằm ổn định màng tế bào |
Grade 1− |
|
R3.8 |
Natri bicarbonate có lẽ không nên dùng cho bệnh nhân nhiễm toan đái tháo đường |
Grade 2− |
|
R3.9 |
Các chuyên gia đề nghị sử dụng natri bicarbonate trong quản lý điều trị ngộ độc salicylate, bất kể giá trị pH |
Ý kiến chuyên gia |
|
R3.10 |
Trong trường hợp sốc và / hoặc suy thận cấp, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận nếu pH dưới hoặc bằng 7,15 trong trường hợp không bị nhiễm toan hô hấp nặng và mặc dù điều trị thích hợp |
Ý kiến chuyên gia |
|
R3.11 |
Trong trường hợp nhiễm toan lactic nghi ngờ do ngộ độc metformin, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận sớm khi có rối loạn chức năng nội tạng hoặc trong trường hợp không cải thiện trong những giờ đầu điều trị |
Ý kiến chuyên gia |
|
R3.12 |
Trong trường hợp ngộ độc methanol hoặc ethylene glycol, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận nếu khoảng cách anion trên 20 mEq/L hoặc nếu có suy thận hoặc suy giảm thị lực |
Ý kiến chuyên gia |
|
R3.13 |
Trong bệnh nhiễm toan chuyển hóa liên quan đến ngộ độc axit salicylic, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận khi có liên quan đến thần kinh và / hoặc nếu nồng độ axit salicylic trên 6,5 mmol / L (90 mg / dL) và / hoặc nếu độ pH nhỏ hơn hoặc bằng 7,20 |
Ý kiến chuyên gia |
|
R3.14 |
Các chuyên gia khuyên bạn nên bù đắp lượng axit bằng cách tăng tần số hô hấp mà không gây ra PEEP nội sinh, với tối đa 35 chu kỳ / phút và / hoặc thể tích Vt lên tới 8 mL / kg khối lượng cơ thể, và bằng cách theo dõi cao nguyên áp lực. Mục đích của thông khí là không bình thường hóa pH. Độ pH mục tiêu lớn hơn hoặc bằng 7,15 có vẻ hợp lý. Điều trị nhiễm toan chuyển hóa và nguyên nhân của nó nên được thực hiện đồng thời, vì bù thông khí chỉ có thể là điều trị triệu chứng và tạm thời |
Ý kiến chuyên gia |
Trong trường hợp nhiễm toan chuyển hóa, khoảng trống anion trong huyết tương có được điều theo albumin tốt hơn khoảng trống anion huyết tương không được điều chỉnh trong việc phân biệt dư thừa axit với thiếu hụt kiềm?
R1.3 Có thể nên sử dụng khoảng trống anion được điều theo albumin thay vì khoảng trống anion chưa được xử lý để phân biệt nhiễm toan liên quan đến quá tải axit và từ nhiễm toan liên quan đến thiếu hụt kiềm (GRADE 2+, ĐỒNG THUẬN MẠNH).
Cơ sở lý luận: Mặc dù hầu hết các dữ liệu lâm sàng là tiền cứu, chúng khan hiếm và chỉ là quan sát. So sánh giữa khoảng trống anion đã hiệu chỉnh *(cAG) và khoảng trống anion chưa được xử lý **(AG) cho thấy không có sự khác biệt [15, 16] hoặc ưu thế hơn của cAG [17-19]. Hầu hết các tác giả cho rằng ngưỡng bệnh lý là cAG hoặc AG > 12 mmol / L. AG sinh lý chủ yếu bao gồm phosphate và albuminate (anion yếu từ albumin máu). Do đó, giảm albumine máu dẫn đến giảm albuminate huyết tương và do đó làm giảm AG. Hậu quả là, một AG bình thường trong tình trạng giảm albumine máu tương ứng với sự hiện diện của axit trong huyết tương, thay thế albuminate để bình thường hóa AG. Việc tính toán mức độ albumin trong tính toán AG cho thấy axit hóa huyết tương khi có giảm albumine máu. Vì vậy, cAG lớn hơn AG, đặc biệt ở những bệnh nhân có nguy cơ giảm albumine máu cao, như trường hợp bệnh nhân được chăm sóc đặc biệt hoặc bệnh nhân bị suy dinh dưỡng, bệnh gan, viêm mạn tính hoặc mất albumin trong nước tiểu.
*cAG = AG + (40 − [albumin]) × 0.25, với albumin là g/L.
**AG= Na+− (Cl−+ HCO3−)= 12 ± 4 mmol/L (hoặc AG=(Na++ K+)−(Cl−+ HCO3−)= 16 ± 4 mmol/L).
Phương pháp stewart có tương đương với phương pháp henderson- hasselbalch sử dụng khoảng trống anion có hiệu chỉnh albumin để chẩn đoán cơ chế nhiễm toan chuyển hóa không?
R1.4 – Các chuyên gia đề nghị trước tiên nên áp dụng phương pháp Henderson-Hasselbalch và sử dụng khoảng trống anion được hiệu chỉnh theo albumin để chẩn đoán cơ chế nhiễm toan chuyển hóa. Tuy nhiên, phương pháp Stewart cung cấp cái nhìn sâu sắc về các tình huống không giải thích được bằng phương pháp Henderson-Hasselbalch: mất cân base-axit thứ phát sau mất cân bằng natri và clorua máu và các rối loạn phức tạp (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Cách tiếp cận của Henderson-Hasselbalch sử dụng khoảng trống anion được hiệu chỉnh theo albumin và phương pháp Stewart được đề xuất để xác định nguyên nhân gây mất cân bằng axit axit [17, 20-24]. Khoảng trống anion (AG) (hoặc các anion không đo lường được) chỉ cần một phép tính đơn giản và nhanh chóng *. Ở trạng thái cân bằng, AG không tính đến các cation ở mức độ thấp không được đo thường xuyên (Mg2 +, Ca2 +, H +) và được giải thích chủ yếu bằng các anion không được xác định bằng phép đo điện giải máu (về cơ bản là albuminate và phosphate). Sự gia tăng AG về mặt kinh điển cho thấy sự tích tụ của một axit mà anion không phải là clorua và về mặt lý thuyết tương ứng với sự tích lũy của một trong các chất sau: lactate, acetoacetate, hydroxybutyrate, oxalate, glycolate, formate, salicylate, sulfate. Tuy nhiên, lý do này ngụ ý rằng giá trị của các anion không được đo lường, về cơ bản là albuminate, và hiếm hơn là phosphate (Pi), là bình thường. Thật vậy, giảm albumin máu dẫn đến giảm các anion không đo lường và sẽ làm giảm khoảng cách anion [25].
Do đó, sự tích lũy của một anion như lactate hoặc acetoacetate có thể bị bỏ qua, vì AG là bình thường giả. Albumin-hiệu chỉnh AG (cAG) ** xác định hầu hết các tình huống trong đó có sự tích lũy của một anion khác với clorua và giảm albumin máu [26].
Phương pháp Stewart giả định rằng cân bằng bazơ axit dựa trên sự phân ly các phân tử nước phụ thuộc vào ba biến độc lập: PaCO2, sự khác biệt ion mạnh tương ứng với sự khác biệt giữa cation mạnh và anion mạnh (SID ưu thế (appSID) = Na + + K + + Ca2 + + Mg2 + – Cl−) và tổng số axit yếu không bay hơi có ở dạng phân ly hoặc không phân ly (Atot) được xác định bởi [albumin × (0.123 × pH− 0.631) + [Pi × (0.309 × pH− 0.469]. Sử dụng được tạo ra từ SID hiệu quả: eff SID + Pi− = HCO3− + Atot. Rối loạn base-axit đường hô hấp được xác định riêng bằng cách tăng PaCO2. Cách tiếp cận rối loạn base-axit chuyển hóa đòi hỏi phải tính toán khoảng cách ion mạnh ( SIG), tương đương với appSID – effSID. Trong mô hình Stewart, do tính trung lập điện phải được bảo toàn, sự thay đổi nồng độ bicarbonate là hậu quả của sự xáo trộn bazơ axit và không phải là nguyên nhân của nó không giống như giả thuyết của Henderson. Một SIG dương cho thấy sự hiện diện của các anion không đo lường được và do đó nhiễm toan chuyển hóa [27-29]. Cách tiếp cận Stewart xuất hiện ít nhất tương đương với cách tiếp cận của Henderson-Hasselbalch trong trường hợp tích tụ axit nội sinh hoặc ngoại sinh hoặc mất bicarbonate [17, 20, 22, 25]. Tuy nhiên, cách tiếp cận Stewart làm sáng tỏ các rối loạn chuyển hóa thứ phát sau rối loạn nồng độ natri và clorua trong máu, chẳng hạn như nhiễm toan máu do liên quan đến hồi sức nước muối sinh lý, mà phương pháp Henderson-Hasselbalch giải thích không dễ dàng hơn [23, 26] và về các rối loạn phức tạp (tăng lactate tại pH và BE bình thường) [30-32].
*AG= Na+− (Cl−+ HCO3−)= 12 ± 4 mmol/L (hoặc AG=(Na++ K+)−(Cl−+ HCO3−)= 16±4 mmol/L).
**cAG = AG + (40 − [albumin]) × 0.25, với albumin có đơn vị g/L
Việc sử dụng một lượt đồ chẩn đoán có cải thiện chẩn đoán nguyên nhân của nhiễm toan chuyển hóa không?
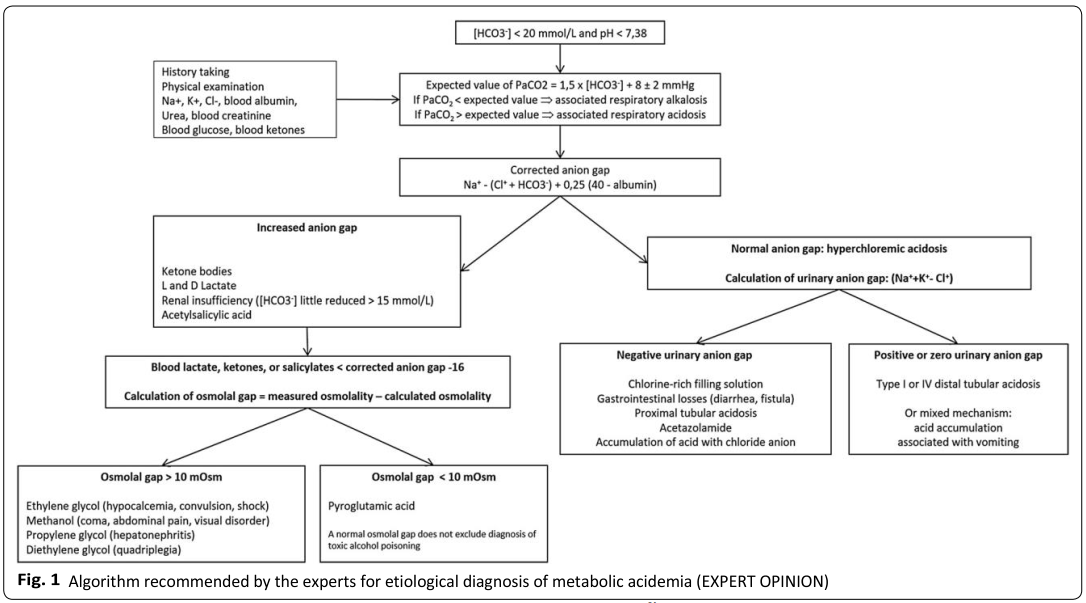
R1.5 Các chuyên gia đề nghị sử dụng một lượt đồ để cải thiện chẩn đoán nguyên nhân của nhiễm toan chuyển hóa (Ý KIẾN CHUYÊN GIA) (Hình 1).
Cơ sở lý luận: Một số nghiên cứu đã đánh giá tác động chẩn đoán của việc sử dụng lượt đồ trong nhiễm toan chuyển hóa, vì vậy rất khó để đưa ra một câu trả lời tốt cho câu hỏi. Luôn luôn cần thiết để thu thập dữ liệu bằng cách hỏi kỹ bệnh sử và tiền sử bệnh và thăm khám lâm sàng[33]. Ngoài các trường hợp ngoại lệ được đề cập dưới đây, việc sử dụng lượt đồ có thể được sử dụng để phát hiện các rối loạn toan chuyển hóa đơn giản[28]. Tuy nhiên, điều quan trọng là phải biết nếu có các yếu tố gây nhiễu [34] hoặc không điển hình [35], phức tạp [33] hoặc bệnh cảnh lâm sàng sai lệch[30, 36]. Nhiễm độc axit acetylsalicylic liên quan đến nhiễm kiềm hô hấp ban đầu với nhiễm toan chuyển hóa có tăng khoảng trống anion, điều này chỉ được giải thích một phần bởi sự tích tụ của axit acetylsalicylic [33]. Nhiễm toan có khoảng trống anion tăng trong ngộ độc ethylene glycol một phần là do sự tích tụ axit glycolic, một số máy phân tích trong phòng thí nghiệm xác định nhầm là lactate [34, 37]. Ketoacidosis do tiểu đường có thể đi kèm với nhiễm toan máu do tăng chlor máu lúc nhập viện hoặc vài giờ sau khi nhập viện [35]. Mối liên quan của việc sản xuất lactatae với nôn mửa có thể dẫn đến bệnh cảnh lâm sàng về nhiễm kiềm chuyển hóa [30]. Truyền dịch giàu clorua trong tình trạng suy tuần hoàn liên quan đến tăng lactete máu tạo ra nhiễm toan máu tăng [30, 38]. Điều quan trọng cần nhớ là sự bù trừ hô hấp quan sát thấy trong nhiễm toan chuyển hóa cấp tính có thể điều chỉnh giá trị pH vượt quá 7,40 (Hình 1). Các nguyên nhân chính gây tăng huyết áp được liệt kê trong Bảng 3.
Nếu không tìm thấy nguyên nhân, một rối loạn chuyển hóa di truyền có thể được xem xét
Có nên tính khoảng trống anion trong nước tiểu trong nhiễm toan chuyển hóa?
R1.6 Các chuyên gia khuyên rằng khoảng trống anion trong nước tiểu chỉ nên được tính toán trong nhiễm toan chuyển hóa mà không có anion không được đo lường hoặc nguyên nhân rõ ràng (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Khoảng trống anion trong nước tiểu, được tính bằng tổng số anion và cation đo được (Na + + K + + Cl−), được đề xuất để ước tính bài tiết nước tiểu của ammonium (NH4 +) [39 .41]. Trong nhiễm toan có khoảng trống anion bình thường, ammonium phân biệt giữa nhiễm toan liên quan đến mất bicarbonate đường tiêu hóa (khoảng trống anion nước tiểu âm tính), nhiễm toan liên quan đến nhiễm toan ở ống thận, hoặc giảm tiết renin máu (không hoặc tăng khoảng trống anion).
Tiện ích chẩn đoán của khoảng trống anion tiết niệu, đáng chú ý là trong phòng cấp cứu hoặc chăm sóc đặc biệt, tuy nhiên, vẫn còn là nghi vấn. Đầu tiên, bên ngoài phòng chăm sóc đặc biệt, giá trị của chỉ số này chỉ được xác nhận bởi các nghiên cứu, mức độ bằng chứng rất thấp [6, 40, 41]. Khoảng cách anion trong nước tiểu dường như tương quan với bài tiết NH4 + [28], nhưng mối tương quan là yếu, sự biến đổi được báo cáo là đáng kể và không có nghiên cứu nào có thể điều chỉnh các yếu tố gây nhiễu hoặc báo cáo giá trị chẩn đoán [6, 40, 41]. Thứ hai, đặc tính phân biệt và đóng góp cho chẩn đoán không được đánh giá. Cuối cùng, hầu hết các nghiên cứu được thực hiện trong phòng cấp cứu hoặc chăm sóc đặc biệt chưa đánh giá được thông số này [22, 23, 27].
Một nghiên cứu duy nhất cho thấy tỷ lệ cao nhiễm toan ống thận trong điều trị tích cực. Nó có mức độ bằng chứng thấp, vì thông số được sử dụng (khoảng trống anion nước tiểu) cũng là một tiêu chí chẩn đoán của bệnh cảnh lâm sàng dự kiến (nhiễm toan ở ống thận) [42].
Bảng 3 Các nguyên nhân chính gây tăng lactate được đề xuất bởi các chuyên gia (Ý KIẾN CHUYÊN GIA)
|
Type A Thiếu máu cục bộ nặng Nhiễm trùng huyết, xuất huyết, choáng tim Ngộ độc CO Thiếu máu cục bộ tạng Co giật Gắng sức quá mức Type B Phân nhóm B1—Bệnh nền cơ bản Ung thư và bệnh huyết học Tiểu đường mất bù HIV Suy gan cấp Nhiễm trùng huyết Sốt rét nặng Phân nhóm B2—Thuốc và độc chất Rượu Thuốc đồng vận Beta 2 Các hợp chất Cyanide Diethyl ether Fluorouracil (5‑ FU) Halothane Sắt Isoniazid Linezolid Metformin Nalidixic acid Niacin (vitamin B3 or nicotinic acid) Thuốc ức chế men sao chép ngược nucleoside Paracetamol Propofol Các thuốc kích thích: cocaine, amphetamines, cathinones Salicylates Strychnine Các loại đường: fructose, sorbitol, xylitol Sulfasalazine Dinh dưỡng tĩnh mạch toàn phần Valproic acid Thiếu hụt vitamin: thiamine (vitamin B1) và biotin (vitamin B8) Phân nhóm B3—Các rối loạn chuyển hóa sơ sinh Thiếu hụt men fructose‑ 1,6‑ diphosphatase Thiếu hụt men glucose‑ 6‑ phosphatase (bệnh von Gierke) Hội chứng Kearns–Sayre Hội chứng MELAS Hội chứng MERRF Thiếu máu Methylmalonic(thiếu hụt men methylmalonyl‑ CoA mutase) Hội chứng Pearson Thiếu hụt men Pyruvate carboxylase Thiếu hụt Pyruvate dehydrogenase |
Có nên đo ph nước tiểu trong nhiễm toan chuyển hóa?
R1.7 Các chuyên gia khuyên rằng nên hạn chế đo pH nước tiểu ở những bệnh nhân bị nhiễm toan chuyển hóa mà không có đo anion hoặc nguyên nhân không rõ ràng, và nghi ngờ lâm sàng mạnh mẽ về nhiễm toan ở ống thận (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Việc đo pH nước tiểu ít có giá trị hơn so với tính toán khoảng trống anion trong nước tiểu. Giá trị chẩn đoán của nó còn gây tranh cãi và dường như bị hạn chế hơn [28, 36, 39, 41].
Đo lactate tĩnh mạch kém hiệu quả hơn so với đo lactate động mạch trong chẩn đoán tăng huyết áp?
R1.8 Các chuyên gia cho rằng một giá trị bình thường của lactate máu tĩnh mạch làm lờ đi tình trạng tăng lactate máu (Ý KIẾN CHUYÊN GIA)
R1.9 Lactate máu động mạch nên được thực hiện để xác định tình trạng tăng thật sự trong trường hợp tăng lactate máu tĩnh mạch (LỚP 2, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Đo lactate động mạch là phương pháp tham khảo để xác định lactate máu. Máu tĩnh mạch dễ lấy mẫu hơn máu động mạch và ít gây đau đớn cho bệnh nhân. Một số nghiên cứu đã đánh giá sự tương đồng giữa các phép đo của lactate máu tĩnh mạch và động mạch. Một phân tích tổng hợp năm 2014 bao gồm ba trong số các nghiên cứu này [7]. Chúng là các nghiên cứu đoàn hệ tiền cứu hoặc hồi cứu có các yếu tố gây sai lệnh như cách lựa chọn bệnh nhân (bệnh nhân không liên tiếp), lượng máu trong máu hiếm khi trên 4 mmol / L, và các thiết bị đo và điều kiện lấy mẫu khác nhau giữa các nghiên cứu này. Độ lệch trung bình trong kết quả dao động từ – 0,016 đến 1,06 mmol / L. Giới hạn tương đồng Bland-Altman dao động trong khoảng từ – 1,51 đến 2,65 mmol / L. Những sai lệch và giới hạn này, được báo cáo cho các giá trị Lactate thông thường, cho thấy rằng đo lường Lactate tĩnh mạch là không đủ để chẩn đoán tăng lactate.
Đo Lactate tĩnh mạch cũng đã được đánh giá trong các nghiên cứu đoàn hệ tiên lượng ở những bệnh nhân bị chấn thương nặng, nghi ngờ sốc nhiễm trùng hoặc được đưa vào phòng cấp cứu [43-46]. Các quần thể nghiên cứu không phải là tất cả có thể so sánh và kết quả không phải là không tương đương, đặc biệt đối với các giá trị lactate tĩnh mạch dưới 4 mmol / L. Mặt khác, dường như giá trị Lactate tĩnh mạch trên 4 mmol / L có liên quan mạnh mẽ đến việc tăng nguy cơ tử vong.Tóm lại, trong khi việc đo Lactate tĩnh mạch có thể hữu ích trong việc xác định tiên lượng, dữ liệu tài liệu không hỗ trợ việc sử dụng nó trong chẩn đoán tăng lactate.
Việc đo lactate máu mao mạch máu có hiệu quả như việc đo lactate động mạch trong chẩn đoán tăng lactate máu?
R1.10 – Không nên đo Lactate máu mao mạch để chẩn đoán tăng lactate máu(GRADE 1−, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Việc đo lường lượng lactae máu mao mạch máu ít xâm lấn và nhanh hơn so với việc đo lactate động mạch. Một số nghiên cứu đoàn hệ đã so sánh hai phương pháp đo lường này. Độ lệch trung bình dao động từ – 0,99 đến 2,4 mmol / L. Các giới hạn tương đồng Altland Bland của dao động trong khoảng từ – 5,6 đến 5,4 mmol / L [47-51]. Những kết quả này rất khó để phân tích vì các thiết bị đo khác nhau được sử dụng và có sự không nhất quán giữa các kết quả [52]. Do đó, đo lường lượng máu mao mạch máu là không đủ hiệu quả và không cho phép xác định chính xác lượng lactate động mạch.
Đo lượng lactate mao mạch máu mao mạch đã được đề xuất như một công cụ tiên lượng. Hầu hết các nghiên cứu, được thực hiện trước khi nhập viện hoặc khi nhập cấp cứu, đã kết hợp một số kỹ thuật lấy mẫu (tĩnh mạch và mao mạch). Một số nghiên cứu đã phân tích đo lường lactate máu mao mạch như một công cụ tiên lượng cho bệnh nhân bị chấn thương nặng hoặc nghi ngờ sốc nhiễm trùng [44, 47, 53]. Những nghiên cứu này có mức độ bằng chứng thấp và không cho phép đưa ra kết luận liên quan đến giá trị tiên lượng của việc đo lượng lactate máu mao mạch.
Tăng lactatw máu xảy ra khi có sự mất cân bằng giữa sản xuất và giải phóng lactate[54]. Theo truyền thống, các nguyên nhân gây tăng lactate đã được chia thành hai nhóm: liên quan đến tình trạng thiếu oxy mô (loại A) và không có thiếu oxy mô (loại B) [55, 56]. Tuy nhiên, cơ chế có thể được trộn lẫn và cùng một nguyên nhân có thể được tìm thấy trong cả hai nhóm [57].
Đo lường ketone trong máu mao mạch có hiệu quả hơn so với đo ketone trong nước tiểu trong chẩn đoán nhiễm toan ketone?
R1.11- Nên đo ketone máu mao mạch chứ không phải ketone trong nước tiểu khi chẩn đoán nhiễm toan ketone (GRADE 1+, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Các nghiên cứu cơ sở so sánh ketone trong nước tiểu và ketone máu đều là nghiên cứu quan sát. Chỉ có một nghiên cứu tiền cứu ngẫu nhiên có đối chứng, nhưng nó đã đánh giá tỷ lệ nhập viện /nhập cấp cứu ở những bệnh nhân mắc bệnh tiểu đường type 1 tùy thuộc vào việc tự thử ketone máu hoặc ketone trong nước tiểu [58]. Hầu hết các nghiên cứu bao gồm những bệnh nhân đến phòng cấp cứu vì tình trạng tăng đường huyết (đường huyết nói chung> 2,5 g / L). Các tiêu chuẩn chẩn đoán của nhiễm toan đái tháo đường thay đổi từ nghiên cứu này sang nghiên cứu khác, khiến cho việc so sánh trở nên khó khăn. Dù chất lượng của chúng là gì, tất cả các nghiên cứu đều tìm thấy độ đặc hiệu cao hơn và kết quả chẩn đoán nhanh hơn với ketone máu mao mạch, cho độ nhạy tương đương. Ngoài ra, ketone trong nước tiểu có thể tồn tại trong trường hợp không có ketone máu đáng kể. Cuối cùng, đo ketone trong nước tiểu chỉ xác định acetoacetate, trong khi đo ketone trong máu chỉ xác định betahydroxybutyrate, là thể ketone chiếm ưu thế trong trường hợp nhiễm toan ketone tiểu đường. Tùy thuộc vào các mức cắt khác nhau được báo cáo, ketone máu trên 3 mmol/L liên quan đến tăng đường huyết là một tiêu chuẩn chẩn đoán tốt của nhiễm toan đái tháo đường [59,63].
Phần 2: đánh giá bệnh nhân
Trong trường hợp nhiễm toan chuyển hóa, giá trị ph có hữu ích để xác định bệnh nhân bị bệnh nặng không?
R2.1 Giá trị pH có lẽ không nên được sử dụng một mình để xác định bệnh nhân bị bệnh nặng (LỚP 2−, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Độ pH của máu là một thông số cận lâm sàng cơ bản. Giá trị của nó không chỉ phụ thuộc vào các biến đổi trao đổi chất hoặc hô hấp, mà còn phụ thuộc vào vị trí lấy mẫu máu động mạch, tĩnh mạch hoặc mao mạch. Các nghiên cứu lâm sàng về hiệu quả tiên lượng của pH máu trong cấp cứu sử dụng phân tích máu tĩnh mạch hoặc động mạch. Sự xuất hiện của các công cụ mới để đo pH tại giường đã mang lại những nghiên cứu được công bố gần đây về giá trị tiên lượng của nó trước khi nhập viện. Những nghiên cứu quan sát này chủ yếu về ngừng tim không do chấn thương và hầu hết không thể hiện được công dụng tiên lượng của mức pH đơn độc[64, 65]. Tuy nhiên, cần phải đánh giá pH kết hợp với các thông số lâm sàng và sinh hóa khác. Hầu hết các nghiên cứu trong bệnh viện là quan sát, bị giới hạn bởi số lượng nhỏ bệnh nhân và đánh giá các bệnh rất khác nhau (ngừng tim, chấn thương, viêm phổi, nhiễm toan đái tháo đường). Hầu hết trong số họ không thể hiện bất kỳ giá trị tiên lượng nào của mức pH [8, 66, 67]. Chỉ những nghiên cứu về viêm phổi mắc phải cộng đồng cấp tính mới nhấn mạnh sự tiện ích của việc đo pH máu, nhưng trong bối cảnh điểm số nghiêm trọng kết hợp với các thông số khác [68, 69].
Đo lactate máu có hữu ích để xác định bệnh nhân nguy kịch không?
R2.2 Tăng lactate máu, bất kể giá trị của nó, nên được coi là một dấu hiệu của mức độ nghiêm trọng trong điều trị ban đầu. Quản lý chẩn đoán và điều trị nên nhanh chóng và đa mô thức nếu cần (LỚP 1+, ĐỒNG Ý MẠNH).
R2.3 Có thể theo dõi sự gia tăng lactate trong máu trong những giờ đầu tiên quản lý để đánh giá đáp ứng với điều trị (LỚP 2+, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Nhiều nghiên cứu cho thấy mối liên quan giữa lactate máu ban đầu và tiên lượng của sốc nhiễm trùng và chấn thương. Họ chủ yếu là nghiên cứu đoàn hệ hồi cứu hoặc nghiên cứu quan sát trong tương lai. Phương pháp của họ thường là nghi vấn và mức độ bằng chứng hạn chế của họ. Tuy nhiên, tất cả các nghiên cứu đều đồng ý về công dụng đo sớm của lactate động mạch hoặc tĩnh mạch trong việc đánh giá mức độ nghiêm trọng của sốc nhiễm trùng và sự cần thiết phải hồi sức tích cực [70]. Tăng lactate máu là một chỉ số độc lập về mức độ nghiêm trọng của bệnh và mức độ lactate ban đầu trên 4 mmol / L trong sốc nhiễm trùng [71] và trên 2 mmol / L ở bệnh nhân chấn thương [72, 74] luôn có liên quan đến tiên lượng xấu hơn [71, 75].
Một số nghiên cứu báo cáo về tính hiệu quả tiên lượng bổ sung của mức giảm huyết tương (độ thanh thải). Điểm cắt tốt nhất dường như là thanh thải 30% lactate vào giờ thứ sáu điều trị trong sốc nhiễm trùng [76]. Tương tự như vậy, không giảm hoặc giảm ít hơn 20% trong 2 đến 4 giờ đầu tiên có liên quan đến tiên lượng xấu hơn ở bệnh nhân chấn thương [77].
Tăng lactate ban đầu cũng liên quan đến gánh nặng điều trị lớn hơn. Đo lường trước khi nhập viện của lactate giúp cải thiện việc nhận ra bệnh nhân nào cần chăm sóc tích cực [43].
Theo dõi chuyên sâu bệnh nhân nhiễm toan ketone đái tháo đường có cải thiện tiên lượng không?
R2.4 Các chuyên gia đề nghị theo dõi chặt chẽ bệnh nhân bị nhiễm toan đái tháo đường, lý tưởng là ở khoa chăm sóc đặc biệt(Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Chỉ định nhập viện chăm sóc tích cực là rõ ràng trong trường hợp suy tạng liên quan đến nhiễm toan keton. Tuy nhiên, trong vài thập kỷ, một số nghiên cứu đã cho rằng bệnh nhân bị nhiễm toan đái tháo đường không biến chứng có thể được quản lý bằng cách chăm sóc tại bệnh viện thông thường [78-80]. Một nghiên cứu đoàn hệ hồi cứu ở hơn 15.000 bệnh nhân tại 159 bệnh viện Mỹ cho thấy việc sử dụng chăm sóc đặc biệt cho bệnh nhân nhiễm toan đái tháo đường không liên quan đến sự khác biệt về tỷ lệ tử vong hoặc thời gian nằm viện [81]. Tuy nhiên, kết quả rất khó để giải thích và khái quát vì đây là nghiên cứu hồi cứu dựa trên dữ liệu mã hóa trong đó không có kết quả lâm sàng hoặc cận lâm sàng nào liên quan đến mức độ nghiêm trọng của nhiễm toan keton. Hơn nữa, các tiêu chí nhập viện để chăm sóc tích cực đã không được chỉ định. Vì liệu pháp insulin tiêm tĩnh mạch liên tục thường là cần thiết và có thể xuất hiện các biến chứng nghiêm trọng trong quá trình điều trị (hạ kali máu, hạ đường huyết, phù phổi, phù não), không thể thiếu theo dõi lâm sàng và cận lâm sàng. Vì việc theo dõi này có thể bị giảm cấp trong chăm sóc tại bệnh viện thông thường vì những khó khăn trong tổ chức, bệnh nhân bị nhiễm toan đái tháo đường nên được nhận vào chăm sóc tích cực để điều chỉnh và theo dõi các tác dụng phụ tiềm ẩn.
Phần ba: quản lý điều trị
Trong quá trình nhiễm toan ketone đái tháo đường, nên ưu tiên sử dụng insulin đường nào?
R3.1 Insulin có lẽ nên được tiêm tĩnh mạch thay vì tiêm dưới da ở bệnh nhân nhiễm toan đái tháo đường (GRADE 2+, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Hai tổng quan y văn đã xem xét con đường tối ưu để sử dụng insulin trong nhiễm toan đái tháo đường [82, 83]. Bốn thử nghiệm đối chứng và ngẫu nhiên so sánh insulin dưới da (SC) với insulin tiêm tĩnh mạch (IV) trong điều trị nhiễm toan đái tháo đường ở người lớn [83-87]. Tất cả đánh giá tốc độ điều chỉnh nhiễm toan hoặc bình thường hóa đường huyết. Ba nghiên cứu đánh giá thời gian nằm viện [85-87]. Việc thiếu độ chính xác trong các kết quả được báo cáo có nghĩa là một trong những nghiên cứu này [84] không thể được đưa vào phân tích tổng hợp về tốc độ điều chỉnh nhiễm toan hoặc bình thường hóa đường huyết. Thử nghiệm này đã mô tả sự điều chỉnh ketosis và giảm đường huyết nhanh hơn đáng kể vào lúc 2 giờ ở nhóm IV, nhưng kết quả không đáng kể ờ giờ 4, 6 và 8 sau khi bắt đầu điều trị. Một phân tích tổng hợp của hai thử nghiệm so sánh các loại insulins tương tự [85, 87] cho thấy không có sự khác biệt đáng kể về tốc độ điều chỉnh nhiễm toan hoặc bình thường hóa glucose trong máu (chênh lệch = 0,2 h; khoảng tin cậy 95% [- 1,7 – 2.1]; p = 0,81). Thử nghiệm cuối cùng [86] đã báo cáo kết quả tương tự (d = – 1 h [- 3.2 -1.2]; p = 0.36). Các phân tích tổng hợp cho thấy không có sự khác biệt đáng kể về ảnh hưởng của lộ trình điều trị trong thời gian nằm viện. Dữ liệu y văn không cho thấy rằng liệu pháp insulin IV thích hợp hơn so với liệu pháp insulin SC, về tỷ lệ điều chỉnh nhiễm toan, bình thường hóa đường huyết hoặc thời gian nằm viện. Tuy nhiên, rất ít bệnh nhân được đưa vào và họ biểu hiện nhiễm toan không biến chứng. Ngoài ra, việc tiêm insulin SC được thực hiện thường xuyên và tần suất tiêm có thể là một nguồn gây khó chịu hoặc thậm chí là đau.
Vì đường tĩnh mạch thường là cần thiết, đường IV liên tục có vẻ thích hợp hơn để tạo điều kiện phục hồi cân bằng điện giải nước, tránh tiêm SC lặp lại và giảm nguy cơ hạ đường huyết, đồng thời đảm bảo kiểm soát tốt hơn liều insulin.
Trong quá trình nhiễm toan ketone đái tháo đường, nên bolus insulin trước khi bắt đầu điều trị bằng insulin tiêm tĩnh mạch liên tục?
R3.2 Có thể không nên tiêm bolus trước khi bắt đầu điều trị bằng insulin tiêm tĩnh mạch liên tục ở bệnh nhân nhiễm toan đái tháo đường (GRADE 2−,ĐỒNG Ý MẠNH).
Cơ sở lý luận: Một tổng quan y văn về việc sử dụng bolus ban đầu trước khi bắt đầu điều trị bằng insulin tiêm tĩnh mạch liên tục được xác định chỉ là một thử nghiệm ngẫu nhiên có đối chứng [88] và một nghiên cứu quan sát [89]. Về sau, sự bình thường hóa đường huyết và thời gian nằm viện không khác biệt đáng kể giữa nhóm bolus và nhóm không bolus (thay đổi đường huyết 60,1 ± 38,2 so với 56,0 ± 45,4 mg / dL / h, tương ứng; p = 0,54 ; thời gian nằm viện 5,6 ± 5,3 so với 5,9 ± 6,9 ngày; p = 0,81). Các tác giả ghi nhận nhiều trường hợp hạ đường huyết trong nhóm bolus, nhưng sự khác biệt không có ý nghĩa thống kê (6 so với 1%; p = 0,12). Thử nghiệm ngẫu nhiên có đối chứng so sánh ba nhóm: bolus liều thấp sau đó dùng liều insulin thấp (0,07 IU/kg, sau đó 0,07 IU/kg/giờ), liều insulin thấp không có bolus ban đầu (0,07 IU/kg/giờ) và insulin liều gấp đôi (0,14IU/kg/giờ) mà không cần tiêm ban đầu. Tỷ lệ điều chỉnh nhiễm toan, bình thường hóa đường huyết và thời gian nằm viện không khác nhau giữa ba nhóm. Điều quan trọng cần lưu ý là nghiên cứu này không đánh giá liều insulin thường được sử dụng khi tiêm tĩnh mạch liên tục, tức là 0,1 IU/kg/giờ.
Trong quá trình nhiễm toan ketone đái tháo đường, nên dùng liều insulin tiêm tĩnh mạch liên tục cao hay thấp?
R3.3 – Liều dùng insulin tiêm tĩnh mạch liên tục thấp có lẽ nên được dùng trong điều trị nhiễm toan đái tháo đường (GRADE 2+, ĐỒNG Ý MẠNH).
R3.4 – Các chuyên gia khuyên bạn nên sử dụng liều khởi đầu 0,1IU / kg / giờ mà không vượt quá 10IU/giờ và gia tăng liều trong trường hợp không bị hạ kali máu, nếu các mục tiêu điều chỉnh ketone máu (0,5 mmol/L/giờ ), tăng bicarbonate (3 mmol/L/h) và glucose máu mao mạch (3 mmol/L/h) không đạt được sau những giờ điều trị đầu tiên (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Các dữ liệu tài liệu, về cơ bản từ những năm 1970, chỉ ra rằng liều insulin tiêm tĩnh mạch liên tục thấp có hiệu quả tương đương với liều cao hơn [90, 91]. Một nghiên cứu tài liệu cho thấy hai thử nghiệm (không có nhóm đối chứng) báo cáo sự giảm glucose trong máu tương tự đối với liều insulin thấp và cao. Nguy cơ hạ kali máu, hạ đường huyết hoặc phù não có thể liên quan đến liều cao và hiệu quả của liều thấp đã biện minh cho việc sử dụng chúng trong thực tế trong vài thập kỷ. Tuy nhiên, nếu không đạt được mục tiêu điều chỉnh ketone trong máu (0,5 mmol/L/h) hoặc không đạt được bicarbonate (3 mmol/L /h) và glucose máu (3 mmol/L/h), thì có thể dự kiến tăng liều, với điều kiện không có hạ kali máu.
Có nên sử dụng truyền natri bicarbonate trong nhiễm toan chuyển hóa nặng và nếu có thì trong tình huống nào?
R3.5 Các chuyên gia khuyên bạn nên dùng sodium bicarbonate để bù cho tình trạng mất kiềm qua đường tiêu hóa hoặc suy thận trong trường hợp dung nạp lâm sàng kém (Ý KIẾN CHUYÊN GIA). Cơ sở lý luận: Việc sử dụng sodium bicarbonate có thể hạn chế các ảnh hưởng nghiêm trọng đến tim mạch, hô hấp và năng lượng tế bào do mất bicarbonate [2]. Natri bicarbonate nên được sử dụng cẩn thận vì nó có liên quan đến nguy cơ hạ kali máu, tăng natri máu, hạ canxi máu, hiện tượng rebound kiềm máu và quá tải natri [2].
R3.6 Natri bicarbonate có lẽ nên được dùng cho bệnh nhân chăm sóc đặc biệt bị nhiễm toan chuyển hóa nặng (pH ≤ 7,20, PaCO2
Cơ sở lý luận: Nhiễm toan chuyển hóa kèm theo các trạng thái sốc thường là đa yếu tố, với tăng lactate máu và suy thận có liên quan trước hết và quan trọng nhất, cộng với khả năng mất bicarbonate đang tiếp diễn. Một số nghiên cứu hồi cứu, quan sát, đơn trung tâm [92-94] hoặc nghiên cứu đa trung tâm [95] không đủ để đưa ra kết luận về vai trò của natri bicarbonate. Hai nghiên cứu sinh lý ngẫu nhiên, tiến cứu, chéo, đơn trung tâm ở 10 [96] và 14 bệnh nhân [97] kết luận rằng sử dụng sodium bicarbonate không có tác dụng có lợi hơn so với dung dịch muối trên các thông số huyết động học được đo bằng catheter động mạch phổi ở bệnh nhân nhiễm toan lactic chuyển hóa (bicarbonate máu ≤ 22 hoặc 17 mmol / L và lactate máu động mạch> 2,5 mmol / L).
Một nghiên cứu đa trung tâm có đối chứng, ngẫu nhiên, tiến cứu ở 400 bệnh nhân (pH ≤ 7,20, bicarbonate máu 20 mmol / L và PaCO2 45 mmHg và lactate máu> 2 mmol / L hoặc điểm SOFA> 4) hiệu quả của việc sử dụng sodium bicarbonate (4.2% qs pH ≥ 7.30) so với không dùng như vậy trên các biến cố kết cuộc chính (tỷ lệ tử vong ngày 28 và / hoặc có ít nhất một cơ quan bị suy vào ngày 7, theo điểm số SOFA). Các tác giả báo cáo không có tác dụng kiềm hóa (71% bệnh nhân ở nhóm đối chứng và 66% bệnh nhân ở nhánh bicarbonate ; sự khác biệt tuyệt đối ước tính là – 5,5% ([95% CI – 15,2% đến 4,2%] , p = 0,24). Xác suất sống sót trong ngày 28 là 46% [95% CI – 40% đến 54%] trong nhóm đối chứng và 55% [95% CI 49% đến 63%]; p = 0,09 trong bicarbonate nhóm. Trong một phân tầng được xác định trước là suy thận cấp tính – AKIN 2-3, 74 (82%) trong số 90 bệnh nhân của nhóm đối chứng và 64 (70%) trong số 92 bệnh nhân của nhóm bicarbonate đạt được các biến cố kết cuộc chính (ước tính chênh lệch tuyệt đối: – 12,3%, KTC 95% – 26,0% đến – 0,1%; p = 0,0462). Xác suất sống sót vào ngày 28 là 46% [95% CI 35% đến 55%] trong nhóm đối chứng và 63% [95% CI 52% đến 72%] trong nhóm bicarbonate (p = 0,0283).
Những kết quả này đã được xác nhận trong phân tích đa biến. Trong dân số nói chung và phân tầng suy thận cấp tính, các bệnh nhân được phân ngẫu nhiên vào nhóm đối chứng được điều trị thay thế thận (RRT) thường xuyên hơn và lâu hơn so với bệnh nhân của nhóm bicarbonate (cần 52% RRT ở nhóm đối chứng 35% ở nhánh bicarbonate, p
R3.7 Natri bicarbonate không nên được sử dụng thường xuyên trong quản lý điều trị ngừng tuần hoàn, ngoài tăng kali máu trước đó hoặc ngộ độc nhằm ổn định màng tế bào (GRADE 1−, ĐỒNG Ý MẠNH).
Cơ sở lý luận: Kể từ hội nghị đồng thuận Pháp năm 1999, vai trò của kiềm hóa bicarbonate natri trong quản lý điều trị ngừng tim đã được đánh giá trong 5 nghiên cứu hồi cứu [99-103] và nghiên cứu đa trung tâm, mù đôi, có đối chứng [104] . Bốn nghiên cứu hồi cứu cho thấy sự gia tăng tần suất phục hồi hoạt động tuần hoàn tự phát ở những bệnh nhân được điều trị bằng sodium bicarbonate [99, 101-103] và một báo cáo giảm tỷ lệ sống sót ở bệnh nhân được điều trị bằng sodium bicarbonate [100]. Thử nghiệm lâm sàng ngẫu nhiên (792 bệnh nhân) cho thấy không có sự khác biệt về tỷ lệ sống giữa những bệnh nhân được điều trị bằng sodium bicarbonate (7,4%) và những người dùng giả dược (6,7%, p = 0,88). Việc sử dụng sodium bicarbonate ở bệnh nhân có thể được dành riêng cho tăng kali máu trước đó hoặc ngộ độc nhằm ổn định màng tế bào [105].
R3.8 Natri bicarbonate có lẽ không nên dùng cho bệnh nhân nhiễm toan đái tháo đường (GRADE 2−, ĐỒNG Y MẠNH).
Cơ sở lý luận: Việc sử dụng sodium bicarbonate thoáng qua làm tăng pH và có thể hạn chế các tác động có hại lên tim mạch và tế bào của toan máu. Tuy nhiên, việc sử dụng sodium bicarbonate có liên quan đến nguy cơ hạ kali máu, tăng natri máu, hạ canxi máu, hiện tượng rebound kiềm máu và quá tải natri [2]. Một nghiên cứu sinh lý bệnh học ở 39 bệnh nhân gần đây đã cho thấy sự thay đổi phản ứng nội mô mạch máu ở giai đoạn cấp tính của nhiễm toan đái tháo đường. Rối loạn chức năng nội mô này được đánh dấu nhiều hơn khi pH động mạch dưới 7,20 và phản ứng mạch máu được cải thiện sau 24 giờ điều trị. Tuy nhiên, việc sử dụng sodium bicarbonate đã không được thử nghiệm trong nghiên cứu quan sát này [106].Kể từ hội nghị đồng thuận của Pháp năm 1999, vai trò của kiềm hóa bicarbonate natri trong điều trị nhiễm toan keton được đánh giá lại trong một nghiên cứu đơn trung tâm hồi cứu [107] so sánh 44 bệnh nhân được điều trị bằng bicarbonate và 42 bệnh nhân không được điều trị. Các tác giả không tìm thấy tác dụng của sodium bicarbonate đối với tốc độ điều chỉnh toan máu, như trong các nghiên cứu trước đây, tất cả đều được tiến hành trong các quần thể nhỏ [108].
R3.9 Các chuyên gia đề nghị sử dụng natri bicarbonate trong quản lý điều trị ngộ độc salicylate, bất kể giá trị pH (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Nhiễm độc Salicylate là rất hiếm và có khả năng gây tử vong. Tham vấn các chuyên gia về độc tính là cần thiết để đảm bảo quản lý trị liệu tối ưu. Mục đích của sử dụng bicarbonate có 2 mục tiêu: gây ra nhiễm kiềm để hạn chế thẩm thấu salicylate vào hệ thần kinh trung ương và kiềm hóa nước tiểu để thúc đẩy bài tiết salicylate qua thận [109, 110]. Một nghiên cứu quan sát cũ ở một số ít bệnh nhân cho rằng kiềm hóa đơn giản dẫn đến bài tiết salicylate qua thận bằng hoặc thậm chí lớn hơn so với lợi tiểu cưỡng bức, lợi tiểu kiềm hoặc không [111]. Việc sử dụng sodium bicarbonate phải được theo dõi chặt chẽ vì nó có liên quan đến nguy cơ hạ kali máu, tăng natri máu, hạ canxi máu, giảm thông khí phế nang và quá tải dịch [2, 109]. Trong trường hợp ngộ độc nặng, các chuyên gia đề nghị điều trị thay thế thận (xem R3.13) và tiếp tục kiềm hóa giữa các đợt trị liệu thay thế thận cho đến khi loại bỏ hoàn toàn salicylate.
Có nên sử dụng liệu pháp thay thế thận trong nhiễm toan chuyển hóa nặng, và nếu vậy trong tình huống nào?
R3.10 Trong trường hợp sốc và / hoặc suy thận cấp, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận nếu pH dưới hoặc bằng 7,15 trong trường hợp không bị nhiễm toan hô hấp nặng và mặc dù điều trị thích hợp (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Không có nghiên cứu ngẫu nhiên có đối chứng với tỷ lệ tử vong là điểm cuối chính so sánh sự khởi đầu hay không của liệu pháp thay thế thận trong nhiễm toan chuyển hóa nặng. Các khuyến cáo được trình bày ở đây chủ yếu đến từ các nghiên cứu quan sát hồi cứu và báo cáo trường hợp.
Theo một bảng câu hỏi do Hiệp hội Hồi sức Châu Âu, 74% các bác sĩ chuyên khoa coi nhiễm toan chuyển hóa (không có dấu hiệu nghiêm trọng) là một tiêu chí để bắt đầu điều trị thay thế thận [112]. Có thể suy ra bicarbonate huyết tương hoặc điểm cắt pH cho phép điều trị thay thế thận bằng kết quả của các nghiên cứu ngẫu nhiên so sánh hiệu quả đối với tỷ lệ tử vong của điều trị thay thế thận sớm hoặc chậm trong điều trị suy thận cấp. Trong 101 bệnh nhân phẫu thuật, Wald et al. [113] không tìm thấy sự khác biệt về tỷ lệ tử vong thời điểm điều trị thay thế thận và bicarbonate huyết tương khi bắt đầu tương tự ở hai nhóm: 20,7 ± 4,3 so với 20,1 ± 4,4 mmol / L. Trong 231 bệnh nhân phẫu thuật bị suy thận cấp giai đoạn KDIGO- 2, Zarbock et al. [114] với bắt đầu điều trị thay thế thận và mức độ bicarbonate huyết tương tương tự nhau ở hai nhóm sớm và muộn: 20,9 ± 3,6 mmol / L so với 20,7 ± 3,7 mmol / L. Tỷ lệ tử vong thấp hơn đáng kể trong nhóm khởi đầu sớm.
Trong nghiên cứu AKIKI [115] ở 619 bệnh nhân bị suy thận cấp giai đoạn 3 của KDIGO, phân tích theo cố ý điều trị cho thấy pH và bicarbonate huyết tương thấp hơn đáng kể ở nhóm điều trị thay thế thận muộn (tiêu chí cứng cho điều trị thay thế thận, bao gồm pH ≤ 7,15, tỷ lệ điều trị thay thế thận: 50%) so với nhóm điều trị thay thế thận sớm (6 giờ sau khi đưa vào, tỷ lệ điều trị thay thế thận: 100%): bicarbonate 16,6 ± 5,6 so với 18,9 ± 4,9 mmol / L (p
Nghiên cứu ICU IDEAL [116] bao gồm 488 bệnh nhân sốc nhiễm trùng với RIFLE giai đoạn F suy thận cấp ngẫu nhiên thành 2 nhóm (điều trị thay thế thận bắt đầu trong vòng 12 giờ sau khi đưa vào, tỷ lệ thay thế thận 97% so với điều trị thay thế thận bắt đầu 48 giờ sau khi đưa vào trong trường hợp không giải quyết suy thận cấp, tỷ lệ điều trị thay thế thận: 62%). Không có sự khác biệt về tỷ lệ tử vong (58 so với 54%) và nghiên cứu đã bị dừng lại vì chăm sóc y tế được coi là vô ích. Độ pH ≤ 7,15 là một tiêu chí để bắt đầu điều trị thay thế thận. Trong số 41 bệnh nhân ở nhóm muộn, 20 bệnh nhân có độ pH 7,10.
Nghiên cứu BICAR-ICU [98] đã so sánh việc tiêm tĩnh mạch natri bicarbonate 4.2% (qs pH> 7.30) với một nhóm đối chứng mà không truyền bicarbonate ở bệnh nhân nhiễm toan chuyển hóa nặng (pH ≤ 7,20, bicarbonate
R3.11-Trong trường hợp nhiễm toan lactic nghi ngờ do ngộ độc metformin, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận sớm khi có rối loạn chức năng nội tạng hoặc trong trường hợp không cải thiện trong những giờ đầu điều trị (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Lý do nhiễm toan lactic liên quan đến Metformin được xác định bởi lactate động mạch trên 5 mmol / L và pH dưới 7,35 trong khi điều trị metformin. Tỷ lệ mắc bệnh thấp: từ 10 đến 12 / 100.000 [117, 118]. Một báo cáo y văn năm 2015 đã xác định 175 bài báo (không có thử nghiệm ngẫu nhiên) báo cáo tỷ lệ tử vong cao (30 đến 50%) [119].
Yeh H-C et al. [117] đối chiếu các báo cáo và nghiên cứu trường hợp từ năm 1977 đến 2014 (3 nghiên cứu, 142 báo cáo trường hợp) ở 253 bệnh nhân và tìm thấy tỷ lệ tử vong là 16,2%. Các yếu tố liên quan đến tỷ lệ tử vong là thông khí cơ học và mức lactate (17 so với 22 mmol / L, p
Một nghiên cứu hồi cứu được thực hiện ở Bắc Ý từ năm 2010 đến 2015 đã đối chiếu 117 trường hợp và báo cáo tỷ lệ sống sót là 78,3% [118]. Trung bình, khi bắt đầu điều trị thay thế thận, pH dưới 7,04 và lượng lactate máu trên 12 mmol / L.
Vì nồng độ metformin không phải lúc nào cũng có sẵn và giá trị tiên lượng của nó còn là một vấn đề tranh cãi [119], nên bắt đầu điều trị thay thế thận không chậm trễ khi có rối loạn chức năng nội tạng hoặc khi không cải thiện trong những giờ đầu điều trị. Liệu pháp thay thế thận nhằm điều chỉnh rối loạn toan kiềm và nước-điện giải và để đảm bảo độ thanh thải metformin [119].
R3.12 Trong trường hợp ngộ độc methanol hoặc ethylene glycol, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận nếu khoảng cách anion trên 20 mEq/L hoặc nếu có suy thận hoặc suy giảm thị lực (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: ngộ độc Methanol và ngộ độc ethylene glycol rất hiếm và có khả năng gây tử vong. Tham vấn chuyên gia là cần thiết để đảm bảo quản lý trị liệu tối ưu bao gồm, nếu cần thiết, thủ tục chăm sóc chuyên sâu cụ thể.
Trong ngộ độc rượu (methanol và ethylene glycol), độ pH khi nhập viện có tương quan với tiên lượng [120, 121]. Độ pH dưới 7,0 được dự đoán là tử vong [122], trong khi độ pH trên 7,22 có liên quan đến tỷ lệ sống [123]. Khoảng trống anion huyết tương (> 24 mEq / L hoặc> 20 mEq / L trong trường hợp mất ổn định huyết động) có tương quan với nồng độ của formate và với tiên lượng [124]. Methanol tuần hoàn được thận loại bỏ với độ thanh thải khoảng 5 đến 6 mL / phút, tương đương với khoảng 25 đến 50% loại bỏ toàn thân trước khi chuyển thành axit formic (chịu trách nhiệm về độc tính). Chuyển đổi này bị ức chế bằng cách tiêm tĩnh mạch ethanol hoặc fomepizole. Độ thanh thải của metanol đạt được bằng thẩm tách máu không liên tục trong khoảng từ 77 đến 400 mL/phút và từ 17 đến 48 mL/phút nếu điều trị thay thế thận liên tục [125, 126].
R3.13 Trong bệnh nhiễm toan chuyển hóa liên quan đến ngộ độc axit salicylic, các chuyên gia khuyên nên bắt đầu điều trị thay thế thận khi có liên quan đến thần kinh và / hoặc nếu nồng độ axit salicylic trên 6,5 mmol / L (90 mg / dL) và / hoặc nếu độ pH nhỏ hơn hoặc bằng 7,20 (TRẢI NGHIỆM HOẠT ĐỘNG).
Cơ sở lý luận: Nhiễm độc Salicylate rất hiếm và có khả năng gây tử vong. Tham vấn chuyên gia độc chất là cần thiết để đảm bảo quản lý trị liệu tối ưu bao gồm, nếu cần thiết, quy trình chăm sóc chuyên sâu cụ thể.Một tổng quan y văn năm 2015 của một nhóm các chuyên gia [110] đã tìm thấy 84 bài báo, 80 trong số đó liên quan đến các báo cáo trường hợp hoặc đoàn hệ bệnh nhân và một thử nghiệm ngẫu nhiên có đối chứng, và đối chiếu 143 bệnh nhân bị ngộ độc salicylate. Các tác giả kết luận rằng axit salicylic có khả năng thẩm tách cao và thẩm tách máu không liên tục là phương thức được ưa thích. Họ cũng kết luận rằng sự phát triển của nhiễm toan máu nên được coi là một dấu hiệu cảnh báo vì nó cho thấy sự khởi đầu của rối loạn chức năng nội tạng (nhiễm axit lactic, nhiễm toan keton, thận và / hoặc suy hô hấp). Ngoài ra, sự hiện diện của toan máu làm tăng sự xâm nhập của salicylate vào hệ thống thần kinh trung ương và nguy cơ phù não.Một nghiên cứu hồi cứu gần đây hơn [127] ở 56 bệnh nhân thở máy có salicylate máu trên 50 mg / dL báo cáo tỷ lệ tử vong 76%. Thất bại trong việc sử dụng liệu pháp thay thế thận có liên quan đến tăng tỷ lệ tử vong và tỷ lệ sống sót là 0 khi salicylate trong máu cao hơn 5,8 mmol/L, tức là, 80 mg/dL. Tuy nhiên, không có dữ liệu về ngộ độc mức độ nặng với các hợp chất khác hoặc về nguyên nhân tử vong.Với khối lượng và chất lượng hạn chế của dữ liệu, rất khó để xác định ngưỡng độc hại một cách chính xác. Tuy nhiên, dường như trên 6,5 mmol / L (90 mg / dL) nguy cơ tử vong cao, ngay cả khi không có dấu hiệu lâm sàng.
Có nên tăng thông khí phút ở bệnh nhân thở máy có nhiễm toan chuyển hóa?
R3.14 – Các chuyên gia khuyên bạn nên bù đắp lượng axit bằng cách tăng tần số hô hấp mà không gây ra PEEP nội sinh, với tối đa 35 chu kỳ / phút và / hoặc thể tích Vt lên tới 8 mL / kg khối lượng cơ thể, và bằng cách theo dõi cao nguyên áp lực. Mục đích của thông khí là không bình thường hóa pH. Độ pH mục tiêu lớn hơn hoặc bằng 7,15 có vẻ hợp lý. Điều trị nhiễm toan chuyển hóa và nguyên nhân của nó nên được thực hiện đồng thời, vì bù thông khí chỉ có thể là điều trị triệu chứng và tạm thời (Ý KIẾN CHUYÊN GIA).
Cơ sở lý luận: Việc kiểm soát nhịp thở từ ba cấu trúc liên kết với nhau: trung tâm điều khiển thường được gọi là trung tâm hô hấp trong hệ thống thần kinh trung ương; các thành phần vận động của hệ hô hấp bao gồm các cơ của đường hô hấp trên, lồng ngực và bụng; và các thụ thể (các thụ thể hóa học, cơ bắp, thụ thể đường thở và phổi) truyền các tín hiệu liên tục đến các trung tâm hô hấp (PCO2, pH, mức độ căng dãn phổi, mức độ hoạt động cơ hô hấp). Do đó, các trung tâm hô hấp nhận thông tin cảm giác và thể dịch cho phép cân bằng nội môi, đồng thời tối ưu hóa sự tiêu hao năng lượng của mỗi chu kỳ hô hấp. Các thụ thể hóa học trung tâm của não phản ứng nhanh chóng và mạnh mẽ với sự thay đổi tối thiểu về pH và PCO2 của dịch não tủy và máu. Các ion hydro dường như là một chất kích thích [128].
Trong nhiễm toan chuyển hóa, đáp ứng sinh lý là sự gia tăng thông khí phế nang [129] mà điều này không đổi, bất kể nguyên nhân và mức độ nghiêm trọng của nhiễm toan [130]. Sự kích thích của các chất hóa học trong nhiễm toan chuyển hóa là nguyên nhân làm tăng thể tích Vt hơn là thở nhanh [130, 131]. Hiệu quả của nó không chỉ phụ thuộc vào thông khí phế nang, mà còn phụ thuộc vào trạng thái huyết động và tính toàn vẹn của hệ hô hấp [129, 132].
Vẫn chưa có dữ liệu cụ thể liên quan đến quản lý thở máy của bệnh nhân được đặt nội khí quản bị nhiễm toan chuyển hóa. Mặc dù nhiễm toan thường có liên quan đến tiên lượng xấu [133], nhưng nó có khả năng bảo vệ. Ngoài mức độ nghiêm trọng của nhiễm toan, cơ chế của nó và cách nó phát sinh dường như là yếu tố tiên lượng cần được tính đến.
Việc điều chỉnh nhiễm toan chuyển hóa bằng cách tăng tần số hô hấp và / hoặc thể tích thông khí còn là nghi vấn. Dữ liệu hiện tại về thông khí bảo vệ rất phong phú và khuyên bạn nên giữ một Vt khoảng 6 mL / kg khối lượng cơ thể. Với các hiệu ứng huyết động của nhiễm toan chuyển hóa, có vẻ hợp lý khi điều chỉnh tần số hô hấp để đạt được độ pH lớn hơn hoặc bằng 7,15 [134 đùa136], không vượt quá 35 chu kỳ / phút, vì trong mô hình động vật cho thấy thông khí phút cao có tác dụng xấu [137, 138], mà được thể hiện rõ ràng hơn ở tổn thương phổi.
Abbreviations
BE: base excess; SBE: standard base excess; AG: anion gap; cAG: corrected anion gap; SID: strong ion difference; eff SID: effective strong ion difference; app SID: apparent strong ion difference; IV: intravenous; SC: subcutaneous; RRT : renal replacement therapy.
Acknowledgements
Not applicable.
Authors’ contributions
BJ and MM proposed the elaboration of this recommendation and manuscript in agreement with the “Société de Réanimation de Langue Française” and “Société Française de Médecine d’Urgence”; NB and PGC wrote the methodology section and gave the final version with the final presentation. DV, AL, EM, MD, MM, and JL contributed to elaborate recommendations and wrote the rationale of « Diagnostic strategy ». YEC, JL , and MO contributed to elaborate recommendations and to write the rationale of « Patient assessment and referral ». YY, BJ, KK , and NT contributed to elaborate recommendations and to write the rationale of « Therapeutic management ». All authors provided references. BJ, MM, PGC, and NB drafted the manuscript. All authors read and approved the final manuscript.
Funding
This work was financially supported by the Société de Réanimation de Langue Française (SRLF) and the Société Française de Médecine d’Urgence (SFMU).
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare the following competing interests: B. Jung: Sedana Medical, Medtronic; M. Martinez: Astra Zeneca, Actélion; YE Claessens: Roche diagnostics, BioMérieux, Sanofi, Pfizer; M. Darmon: Sanofi, Gilead Kite, Astute Medical, MSD, Astellas; A. Lautrette: Baxter, Frésénius; J. Levraut: LFB, NovaBiomedical; E. Maury: General Electric Healthcare, Doran International, Vygon, AstraZeneca; N. Terzi: Boehringer Ingelheim, Pfizer; D. Viglino: Astra Zeneca, Mundipharma; Y. Yordanov: Mundipharma, Sanofi; PG Claret: Aspen, AstraZeneca, Daiichi Sankyo, Roche Diagnostics, Sanofi, Thermo Fisher Scientific. The remaining authors declare that they have no competing interests.
Author details
1Département de Médecine Intensive et Réanimation, CHU Montpellier,34000 Montpellier, France. 2 INSERM U 1046, CNRS U 9234 (PhyMedExp),Université de Montpellier, Montpellier, France. 3 Pôle Urgence, CH du Forez, 42605 Montbrison, France. 4 Réseau d’urgence Ligérien Ardèche Nord (REULIAN), Centre Hospitalier Le Corbusier, 42700 Firminy, France. 5Département de Médecine d’urgence, Centre Hospitalier Princesse Grace, Avenue Pasteur, 98012 Monaco, France. 6 Unité de Médecine Intensive et Réanimation, Hôpital Universitaire Saint Louis, Assistance Publique– Hôpitaux de Paris, Avenue Claude Vellefaux, 75010 Paris, France. 7 Faculté de Médecine, Université Paris Diderot, Sorbonne–Paris Cité, Paris, France. 8 France Inserm, ECSTRA Team, UMR 1153, Centre d’Epidémiologie et de Biostatistique, CRESS, Biostatistics and Clinical Epidemiology, Sorbonne–ParisCité, Paris, France. 9 Département de Médecine Intensive–Réanimation, CHU Lapeyronie, 371, Avenue Doyen Gaston Giraud, 34295 Montpellier, France. 10 Réanimation, Centre JeanPerrin, CHU de ClermontFerrand, 63000 Clermont Ferrand, France. 11 LMGE, UMR CNRS 6023, Université Clermont Auvergne, Clermont Ferrand, France. 12 Département de Médecine d’urgence, CHU de Nice, Hôpital Pasteur II, 30, Avenue de la Voie Romaine, 06000 Nice, France. 13 UFR de Médecine, Université de Nice Côte d’Azur, Avenue de Vallombrose, 06000 Nice, France.14 Service de Médecine Intensive–Réanimation, Hôpital Saint Antoine,Assistance Publique–Hôpitaux de Paris, 184, Rue du Faubourg Saint Antoine, 75571 Paris Cedex 12 Paris, France. 15 Sorbonne Université, Université Pierre et Marie Curie Paris VI, Paris, France. 16Inserm U1136, 75012 Paris, France. 17 Structure des Urgences, Centre Hospitalier de Cahors, 335, Rue Wilson, 46000 Cahors, France. 18 Service de Médecine Intensive–Réanimation, Centre Hospitalier Universitaire de Grenoble, Université de Grenoble, Grenoble, France. 19 Inserm, U1042, Université Grenoble Alpes, HP2, 38000 Grenoble, France. 20 Service des Urgences Adultes, CS 10217, CHU GrenobleAlpes, 38043 Grenoble Cedex 09 Grenoble, France. 21 Inserm U1042, Laboratoire HP2 Hypoxie Physiopathologies, Université Grenoble Alpes, Grenoble, France. 22 Faculté de Médecine, Sorbonne Universités, 75013 Paris, France. 23 Inserm, U1153, Université Paris Descartes, 75006 Paris, France. 24 Service des Urgences, Hôpital Saint Antoine, Assistance Publique–Hôpitaux de Paris (AP–HP), 75012 Paris, France. 25 Pôle Anesthésie Réanimation Douleur Urgences, Centre Hospitalier Universitaire de Nîmes, 4, Rue du ProfesseurRobert Debré, 30029 Nîmes, France.
Received: 26 June 2019 Accepted: 30 July 2019
References
Kimmoun A, Novy E, Auchet T, Ducrocq N, Levy B. Hemodynamic consequences of severe lactic acidosis in shock states: from bench to bedside. Crit Care Lond Engl. 2015;19:175.
Kraut JA, Madias NE. Treatment of acute metabolic acidosis: a pathophysiologic approach. Nat Rev Nephrol. 2012;8(10):589–601.
Kraut JA, Madias NE. Metabolic acidosis: pathophysiology, diagnosis and management. Nat Rev Nephrol. 2010;6(5):274–85.
Asch MJ, Dell RB, Williams GS, Cohen M, Winters RW. Time course for development of respiratory compensation in metabolic acidosis. J Lab Clin Med. 1969;73(4):610–5.
Fulop M. A guide for predicting arterial CO2 tension in metabolic acidosis. Am J Nephrol. 1997;17(5):421–4.
Batlle D, Chin Theodorou J, Tucker BM. Metabolic acidosis or respiratory alkalosis? evaluation of a low plasma bicarbonate using the urine anion gap. Am J Kidney Dis Off J Natl Kidney Found. 2017;70(3):440–4.
Bloom BM, Grundlingh J, Bestwick JP, Harris T. The role of venous blood gas in the emergency department: a systematic review and metaanalysis. Eur J Emerg Med Off J Eur Soc Emerg Med. 2014;21(2):81–8.
Ma OJ, Rush MD, Godfrey MM, Gaddis G. Arterial blood gas results rarely influence emergency physician management of patients with suspected diabetic ketoacidosis. Acad Emerg Med Off J Soc Acad Emerg Med. 2003;10(8):836–41.
Arnold TDW, Miller M, van Wessem KP, Evans JA, Balogh ZJ. Base deficit from the first peripheral venous sample: a surrogate for arterial base deficit in the trauma bay. J Trauma. 2011;71(4):793–7 (discussion 797).
Zakrison T, McFarlan A, Wu YY, Keshet I, Nathens A. Venous and arterial base deficits: do these agree in occult shock and in the elderly? A Bland Altman analysis. J Trauma Acute Care Surg. 2013;74(3):936–9.
Herrington WG, Nye HJ, Hammersley MS, Watkinson PJ. Are arterial and venous samples clinically equivalent for the estimation of pH, serum bicarbonate and potassium concentration in critically ill patients? Diabet Med J Br Diabet Assoc. 2012;29(1):32–5.
Surbatovic M, Radakovic S, Jevtic M, Filipovic N, Romic P, Popovic N, et al. Predictive value of serum bicarbonate, arterial base deficit/ excess and SAPS III score in critically ill patients. Gen Physiol Biophys. 2009;28:271–6.
Martin MJ, FitzSullivan E, Salim A, Berne TV, Towfigh S. Use of serum bicarbonate measurement in place of arterial base deficit in the surgical intensive care unit. Arch Surg Chic Ill 1960. 2005;140(8):745– 51.
FitzSullivan E, Salim A, Demetriades D, Asensio J, Martin MJ. Serum bicarbonate may replace the arterial base deficit in the trauma intensive care unit. Am J Surg. 2005;190(6):941–6.
Chawla LS, Jagasia D, Abell LM, Seneff MG, Egan M, Danino N, et al. Anion gap, anion gap corrected for albumin, and base deficit fail to accurately diagnose clinically significant hyperlactatemia in critically ill patients. J Intensive Care Med. 2008;23(2):122–7.
Dinh CH, Ng R, Grandinetti A, Joffe A, Chow DC. Correcting the anion gap for hypoalbuminaemia does not improve detection of hyperlactataemia. Emerg Med J EMJ. 2006;23(8):627–9.
Moviat M, van Haren F, van der Hoeven H. Conventional or physicochemical approach in intensive care unit patients with metabolic acidosis. Crit Care Lond Engl. 2003;7(3):R41–5.
Mallat J, Michel D, Salaun P, Thevenin D, Tronchon L. Defining metabolic acidosis in patients with septic shock using Stewart approach. Am J Emerg Med. 2012;30(3):391–8.
Chawla LS, Shih S, Davison D, Junker C, Seneff MG. Anion gap, anion gap corrected for albumin, base deficit and unmeasured anions in critically ill patients: implications on the assessment of metabolic acidosis and the diagnosis of hyperlactatemia. BMC Emerg Med. 2008;8:18.
Dubin A, Menises MM, Masevicius FD, Moseinco MC, Kutscherauer DO, Ventrice E, et al. Comparison of three different methods of evaluation of metabolic acid–base disorders. Crit Care Med. 2007;35(5):1264–70.
Story DA, Poustie S, Bellomo R. Estimating unmeasured anions in critically ill patients: anion gap, base deficit, and strong ion gap. Anaesthesia. 2002;57(11):1109–14.
Balasubramanyan N, Havens PL, Hoffman GM. Unmeasured anions identified by the Fencl–Stewart method predict mortality better than base excess, anion gap, and lactate in patients in the pediatric intensive care unit. Crit Care Med. 1999;27(8):1577–81.
Lautrette A, Fejjal M, Aithssain A, Phan TN, Caillot N, Fogli A, et al. Comparison of three methods of diagnosis of plasma unmeasured anions in critically ill patients. Minerva Anestesiol. 2013;79(10):1164– 72.
Boniatti MM, Cardoso PRC, Castilho RK, Vieira SRR. Acid–base disorders evaluation in critically ill patients: we can improve our diagnostic ability. Intensive Care Med. 2009;35(8):1377–82.
Nanji AA, Campbell DJ, Pudek MR. Decreased anion gap associated with hypoalbuminemia and polyclonal gammopathy. JAMA. 1981;246(8):859–60.
Figge J, Jabor A, Kazda A, Fencl V. Anion gap and hypoalbuminemia. Crit Care Med. 1998;26(11):1807–10.
Fencl V, Jabor A, Kazda A, Figge J. Diagnosis of metabolic acid–base disturbances in critically ill patients. Am J Respir Crit Care Med. 2000;162(6):2246–51.
Kraut JA, Madias NE. Differential diagnosis of nongap metabolic acidosis: value of a systematic approach. Clin J Am Soc Nephrol CJASN. 2012;7(4):671–9.
Adrogué HJ, Madias NE. Assessing acid–base status: physiologic versus physicochemical approach. Am J Kidney Dis Off J Natl Kidney Found. 2016;68(5):793–802.
Tuhay G, Pein MC, Masevicius FD, Kutscherauer DO, Dubin A. Severe hyperlactatemia with normal base excess: a quantitative analysis using conventional and Stewart approaches. Crit Care Lond Engl. 2008;12(3):R66.
Guérin C, Nesme P, Leray V, Wallet F, Bourdin G, Bayle F, et al. Quantitative analysis of acid–base disorders in patients with chronic respiratory failure in stable or unstable respiratory condition. Respir Care. 2010;55(11):1453–63.
Magder S, Emami A. Practical approach to physical–chemical acid– base management Stewart at the bedside. Ann Am Thorac Soc. 2015;12(1):111–7.
Galbois A, Ait Oufella H, Baudel J L, Maury E, Offenstadt G. An adult can still die of salicylate poisoning in France in 2008. Intensive Care Med. 2009;35(11):1999.
Pernet P, Bénéteau Burnat B, Vaubourdolle M, Maury E, Offenstadt G. False elevation of blood lactate reveals ethylene glycol poisoning. Am J Emerg Med. 2009;27(1):132.e1–2.
Adrogué HJ, Wilson H, Boyd AE, Suki WN, Eknoyan G. Plasma acid– base patterns in diabetic ketoacidosis. N Engl J Med. 1982;307(26):1603–10.
Richardson RM, Halperin ML. The urine pH: a potentially misleading diagnostic test in patients with hyperchloremic metabolic acidosis. Am J Kidney Dis Off J Natl Kidney Found. 1987;10(2):140–3. 37. Kraut JA, Mullins ME. Toxic alcohols. N Engl J Med. 2018;378(3):270–80
Noritomi DT, Soriano FG, Kellum JA, Cappi SB, Biselli PJC, Libório AB, et al. Metabolic acidosis in patients with severe sepsis and septic shock: a longitudinal quantitative study. Crit Care Med. 2009;37(10):2733–9.
Rastegar M, Nagami GT. Non anion gap metabolic acidosis: a clinical approach to evaluation. Am J Kidney Dis Off J Natl Kidney Found. 2017;69(2):296–301.
Kim HY, Han JS, Jeon US, Joo KW, Earm JH, Ahn C, et al. Clinical significance of the fractional excretion of anions in metabolic acidosis. Clin Nephrol. 2001;55(6):448–52.
Batlle DC, Hizon M, Cohen E, Gutterman C, Gupta R. The use of the urinary anion gap in the diagnosis of hyperchloremic metabolic acidosis. N Engl J Med. 1988;318(10):594–9.
Brunner R, Drolz A, Scherzer T M, Staufer K, Fuhrmann V, Zauner C, et al. Renal tubular acidosis is highly prevalent in critically ill patients. Crit Care Lond Engl. 2015;19:148.
Guyette FX, Meier EN, Newgard C, McKnight B, Daya M, Bulger EM, et al. A comparison of prehospital lactate and systolic blood pressure for predicting the need for resuscitative care in trauma transported by ground. J Trauma Acute Care Surg. 2015;78(3):600–6.
Contenti J, Corraze H, Lemoël F, Levraut J. Effectiveness of arterial, venous, and capillary blood lactate as a sepsis triage tool in ED patients. Am J Emerg Med. 2015;33(2):167–72.
Musikatavorn K, Thepnimitra S, Komindr A, Puttaphaisan P, Rojanasarntikul D. Venous lactate in predicting the need for intensive care unit and mortality among nonelderly sepsis patients with stable hemodynamic. Am J Emerg Med. 2015;33(7):925–30.
Barfod C, Lundstrøm LH, Lauritzen MMP, Danker JK, Sölétormos G, Forberg JL, et al. Peripheral venous lactate at admission is associated with in hospital mortality, a prospective cohort study. Acta Anaesthesiol Scand. 2015;59(4):514–23.
Bouzat P, Schilte C, Vinclair M, Manhes P, Brun J, Bosson J L, et al. Capillary lactate concentration on admission of normotensive trauma patients: a prospective study. Scand J Trauma Resusc Emerg Med. 2016;24:82.
Gaieski DF, Drumheller BC, Goyal M, Fuchs BD, Shofer FS, Zogby K. Accuracy of handheld pointof care fingertip lactate measurement in the emergency department. West J Emerg Med. 2013;14(1):58–62.
Kim C, Kim H. Emergency medical technician performed point of care blood analysis using the capillary blood obtained from skin puncture. Am J Emerg Med. 2018;36(7):1215–21.
Collange O, Garcia V, Kindo M, Meyer N, Lavaux T, Mertes PM, et al. Comparison of capillary and arterial lactate levels in patients with shock. Anaesth Crit Care Pain Med. 2017;36(3):157–62.
Seoane L, Papasidero M, De Sanctis P, PosadasMartínez LM, Soler S, Rodríguez M. Capillary lactic acid validation in an ED. Am J Emerg Med. 2013;31(9):1365–7.
Tanner RK, Fuller KL, Ross MLR. Evaluation of three portable blood lactate analysers: lactate pro, lactate scout and lactate plus. Eur J Appl Physiol. 2010;109(3):551–9.
Manzon C, Barrot L, Besch G, Barbot O, Desmettre T, Capellier G, et al. Capillary lactate as a tool for the triage nurse among patients with SIRS at emergency department presentation: a preliminary report. Ann Intensive Care. 2015;5:7.
Kraut JA, Madias NE. Lactic acidosis. N Engl J Med. 2014;371(24):2309–19.
Vernon C, Letourneau JL. Lactic acidosis: recognition, kinetics, and associated prognosis. Crit Care Clin. 2010;26(2):255–83.
Blohm E, Lai J, Neavyn M. Druginduced hyperlactatemia. Clin Toxicol Phila Pa. 2017;55(8):869–78.
Suetrong B, Walley KR. Lactic acidosis in sepsis: it’s not all anaerobic: implications for diagnosis and management. Chest. 2016;149(1):252– 61.
Laffel LMB, Wentzell K, Loughlin C, Tovar A, Moltz K, Brink S. Sick day management using blood 3 hydroxybutyrate (3 OHB) compared with urine ketone monitoring reduces hospital visits in young people with T1DM: a randomized clinical trial. Diabet Med J Br Diabet Assoc. 2006;23(3):278–84.
Taboulet P, Deconinck N, Thurel A, Haas L, Manamani J, Porcher R, et al. Correlation between urine ketones (acetoacetate) and capillary blood ketones (3 beta hydroxybutyrate) in hyperglycaemic patients. Diabetes Metab. 2007;33(2):135–9.
Voulgari C, Tentolouris N. The performance of a glucose ketone meter in the diagnosis of diabetic ketoacidosis in patients with type 2 diabetes in the emergency room. Diabetes Technol Ther. 2010;12(7):529–35.
Arora S, Henderson SO, Long T, Menchine M. Diagnostic accuracy of point of care testing for diabetic ketoacidosis at emergencydepartment triage: {beta}hydroxybutyrate versus the urine dipstick. Diabetes Care. 2011;34(4):852–4.
Charles RA, Bee YM, Eng PHK, Goh SY. Point of care blood ketone testing: screening for diabetic ketoacidosis at the emergency department. Singapore Med J. 2007;48(11):986–9.
Kuru B, Sever M, Aksay E, Dogan T, Yalcin N, Eren ES, et al. Comparing finger stick β hydroxybutyrate with dipstick urine tests in the detection of ketone bodies. Turk J Emerg Med. 2014;14(2):47–52.
Shin J, Lim YS, Kim K, Lee HJ, Lee SJ, Jung E, et al. Initial blood pH during cardiopulmonary resuscitation in out of hospital cardiac arrest patients: a multicenter observational registry based study. Crit Care Lond Engl. 2017;21(1):322.
Spindelboeck W, Gemes G, Strasser C, Toescher K, Kores B, Metnitz P, et al. Arterial blood gases during and their dynamic changes after cardiopulmonary resuscitation: a prospective clinical study. Resuscitation. 2016;106:24–9.
Denton R, Thomas AN. Cardiopulmonary resuscitation: a retrospective review. Anaesthesia. 1997;52(4):324–7.
Kaplan LJ, Kellum JA. Initial pH, base deficit, lactate, anion gap, strong ion difference, and strong ion gap predict outcome from major vascular injury. Crit Care Med. 2004;32(5):1120–4.
Auble TE, Yealy DM, Hanusa BH, Weissfeld LA, Singer DE, et al. A prediction rule to identify lowrisk patients with community acquired pneumonia. N Engl J Med. 1997;336(4):243–50.
Renaud B, Labarère J, Coma E, Santin A, Hayon J, Gurgui M, et al. Risk stratification of early admission to the intensive care unit of patients with no major criteria of severe community acquired pneumonia: development of an international prediction rule. Crit Care Lond Engl. 2009;13(2):R54.
Shapiro NI, Howell MD, Talmor D, Nathanson LA, Lisbon A, Wolfe RE, et al. Serum lactate as a predictor of mortality in emergency department patients with infection. Ann Emerg Med. 2005;45(5):524– 8.
Casserly B, Phillips GS, Schorr C, Dellinger RP, Townsend SR, Osborn TM, et al. Lactate measurements in sepsis induced tissue hypoperfusion: results from the Surviving Sepsis Campaign database. Crit Care Med. 2015;43(3):567–73.
Park YJ, Kim DH, Kim SC, Kim TY, Kang C, Lee SH, et al. Serum lactate upon emergency department arrival as a predictor of 30 day in hospital mortality in an unselected population. PLoS ONE. 2018;13(1):e0190519.
Puskarich MA, Kline JA, Summers RL, Jones AE. Prognostic value of incremental lactate elevations in emergency department patients with suspected infection. Acad Emerg Med Off J Soc Acad Emerg Med. 2012;19(8):983–5.
Raux M, Le Manach Y, Gauss T, Baumgarten R, Hamada S, Harrois A, et al. Comparison of the prognostic significance of initial blood lactate and base deficit in trauma patients. Anesthesiology. 2017;126(3):522– 33.
Régnier MA, Raux M, Le Manach Y, Asencio Y, Gaillard J, Devilliers C, et al. Prognostic significance of blood lactate and lactate clearance in trauma patients. Anesthesiology. 2012;117(6):1276–88.
Ryoo SM, Lee J, Lee Y S, Lee JH, Lim KS, Huh JW, et al. Lactate level versus lactate clearance for predicting mortality in patients with septic shock defined by sepsis 3. Crit Care Med. 2018;46(6):e489–95.
Dezman ZDW, Comer AC, Smith GS, Narayan M, Scalea TM, Hirshon JM. Failure to clear elevated lactate predicts 24 hour mortality in trauma patients. J Trauma Acute Care Surg. 2015;79(4):580–5.
May ME, Young C, King J. Resource utilization in treatment of diabetic ketoacidosis in adults. Am J Med Sci. 1993;306(5):287–94.
Moss JM. Diabetic ketoacidosis: effective low cost treatment in a community hospital. South Med J. 1987;80(7):875–81.
Marinac JS, Mesa L. Using a severity of illness scoring system to assess intensive care unit admissions for diabetic ketoacidosis. Crit Care Med. 2000;28(7):2238–41.
MJ, Gershengorn HB, Iwashyna TJ, Cooke CR, Scales DC, Kahn JM, Wunsch H. Variation in use of intensive care for adults with diabetic ketoacidosis. Crit Care Med. 2012;40(7):2009–15.
Andrade Castellanos CA, Colunga Lozano LE, Delgado Figueroa N, Gonzalez Padilla DA. Subcutaneous rapid acting insulin analogues for diabetic ketoacidosis. Cochrane Database Syst Rev. 2016;1:CD011281.
Vincent M, Nobécourt E. Treatment of diabetic ketoacidosis with subcutaneous insulin lispro: a review of the current evidence from clinical studies. Diabetes Metab. 2013;39(4):299–305.
Fisher JN, Shahshahani MN, Kitabchi AE. Diabetic ketoacidosis: lowdose insulin therapy by various routes. N Engl J Med. 1977;297(5):238–41.
Umpierrez GE, Latif K, Stoever J, Cuervo R, Park L, Freire AX, et al. Efficacy of subcutaneous insulin lispro versus continuous intravenous regular insulin for the treatment of patients with diabetic ketoacidosis. Am J Med. 2004;117(5):291–6.
Umpierrez GE, Cuervo R, Karabell A, Latif K, Freire AX, Kitabchi AE. Treatment of diabetic ketoacidosis with subcutaneous insulin aspart. Diabetes Care. 2004;27(8):1873–8.
Karoli R, Fatima J, Salman T, Sandhu S, Shankar R. Managing diabetic ketoacidosis in nonintensive care unit setting: role of insulin analogs. Indian J Pharmacol. 2011;43(4):398–401.
Kitabchi AE, Murphy MB, Spencer J, Matteri R, Karas J. Is a priming dose of insulin necessary in a low dose insulin protocol for the treatment of diabetic ketoacidosis? Diabetes Care. 2008;31(11):2081– 5.
Goyal N, Miller JB, Sankey SS, Mossallam U. Utility of initial bolus insulin in the treatment of diabetic ketoacidosis. J Emerg Med. 2010;38(4):422–7.
Page MM, Alberti KG, Greenwood R, Gumaa KA, Hockaday TD, Lowy C, et al. Treatment of diabetic coma with continuous low dose infusion of insulin. Br Med J. 1974;2(5921):687–90.
Semple PF, White C, Manderson WG. Continuous intravenous infusion of small doses of insulin in treatment of diabetic ketoacidosis. Br Med J. 1974;2(5921):694–8.
El Solh AA, Abou Jaoude P, Porhomayon J. Bicarbonate therapy in the treatment of septic shock: a second look. Intern Emerg Med. 2010;5(4):341–7.
Kim HJ, Son YK, An WS. Effect of sodium bicarbonate administration on mortality in patients with lactic acidosis: a retrospective analysis. PLoS ONE. 2013;8(6):e65283.
Wilson RF, Spencer AR, Tyburski JG, Dolman H, Zimmerman LH. Bicarbonate therapy in severely acidotic trauma patients increases mortality. J Trauma Acute Care Surg. 2013;74(1):45–50 (discussion 50).
Jung B, Rimmele T, Le Goff C, Chanques G, Corne P, Jonquet O, et al. Severe metabolic or mixed acidemia on intensive care unit admission: incidence, prognosis and administration of buffer therapy. A prospective, multiple center study. Crit Care Lond Engl. 2011;15(5):R238.
Mathieu D, Neviere R, Billard V, Fleyfel M, Wattel F. Effects of bicarbonate therapy on hemodynamics and tissue oxygenation in patients with lactic acidosis: a prospective, controlled clinical study. Crit Care Med. 1991;19(11):1352–6.
Cooper DJ, Walley KR, Wiggs BR, Russell JA. Bicarbonate does not improve hemodynamics in critically ill patients who have lactic acidosis. A prospective, controlled clinical study. Ann Intern Med. 1990;112(7):492–8.
Jaber S, Paugam C, Futier E, Lefrant JY, Lasocki S, Lescot T, et al. Sodium bicarbonate therapy for patients with severe metabolic acidaemia in the intensive care unit (BICAR ICU): a multicentre, openlabel, randomised controlled, phase 3 trial. Lancet Lond Engl. 2018;392(10141):31–40.
Weng Y M, Wu S H, Li W C, Kuo C W, Chen S Y, Chen J C. The effects of sodium bicarbonate during prolonged cardiopulmonary resuscitation.Am J Emerg Med. 2013;31(3):562–5.
Kawano T, Grunau B, Scheuermeyer FX, Gibo K, Dick W, Fordyce CB, et al. Prehospital sodium bicarbonate use could worsen long term survival with favorable neurological recovery among patients with outofhospital cardiac arrest. Resuscitation. 2017;119:63–9.
Kim J, Kim K, Park J, Jo YH, Lee JH, Hwang JE, et al. Sodium bicarbonate administration during ongoing resuscitation is associated with increased return of spontaneous circulation. Am J Emerg Med. 2016;34(2):225–9.
Wang CH, Huang C H, Chang WT, Tsai M S, Yu P H, Wu YW, et al. The effects of calcium and sodium bicarbonate on severe hyperkalaemia during cardiopulmonary resuscitation: a retrospective cohort study of adult in hospital cardiac arrest. Resuscitation. 2016;98:105–11.
Bar Joseph G, Abramson NS, Kelsey SF, Mashiach T, Craig MT, Safar P, et al. Improved resuscitation outcome in emergency medical systems with increased usage of sodium bicarbonate during cardiopulmonary resuscitation. Acta Anaesthesiol Scand. 2005;49(1):6–15.
Vukmir RB, Katz L, Sodium Bicarbonate Study Group. Sodium bicarbonate improves outcome in prolonged prehospital cardiac arrest. Am J Emerg Med. 2006;24(2):156–61.
Monsieurs KG, Nolan JP, Bossaert LL, Greif R, Maconochie IK, Nikolaou NI, et al. European resuscitation council guidelines for resuscitation 2015: section 1. Executive summary. Resuscitation. 2015;95:1–80. 106. Joffre J, Bourcier S, Hariri G, Miailhe A F, Bigé N, Dumas G, et al. Reversible microvascular hyporeactivity to acetylcholine during diabetic ketoacidosis. Crit Care Med. 2018;46(8):e772–8.
Fine Duhon B, Attridge RL, FrancoMartinez AC, Maxwell PR, Hughes DW. Intravenous sodium bicarbonate therapy in severely acidotic diabetic ketoacidosis. Ann Pharmacother. 2013;47(7–8):970–5.
Viallon A, Zeni F, Lafond P, Venet C, Tardy B, Page Y, et al. Does bicarbonate therapy improve the management of severe diabetic ketoacidosis? Crit Care Med. 1999;27(12):2690–3.
Temple AR. Pathophysiology of aspirin overdosage toxicity, with implications for management. Pediatrics. 1978;62(5):873–6.
Juurlink DN, Gosselin S, Kielstein JT, Ghannoum M, Lavergne V, Nolin TD, et al. Extracorporeal treatment for salicylate poisoning: systematic review and recommendations from the EXTRIP Workgroup. Ann Emerg Med. 2015;66(2):165–81.
Prescott LF, Balali Mood M, Critchley JA, Johnstone AF, Proudfoot AT. Diuresis or urinary alkalinisation for salicylate poisoning? Br Med J Clin Res Ed. 1982;285(6352):1383–6.
Legrand M, Darmon M, Joannidis M, Payen D. Management of renal replacement therapy in ICU patients: an international survey. Intensive Care Med. 2013;39(1):101–8.
Wald R, McArthur E, Adhikari NKJ, Bagshaw SM, Burns KEA, Garg AX, et al. Changing incidence and outcomes following dialysisrequiring acute kidney injury among critically ill adults: a population based cohort study. Am J Kidney Dis. 2015;65(6):870–7.
Zarbock A, Kellum JA, Schmidt C, Aken HV, Wempe C, Pavenstädt H, et al. Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: the ELAIN randomized clinical trial. JAMA. 2016;315(20):2190–9.
Gaudry S, Hajage D, Schortgen F, Martin Lefevre L, Pons B, Boulet E, et al. Initiation strategies for renal replacement therapy in the intensive care unit. N Engl J Med. 2016;375(2):122–33.
Barbar SD, Clere Jehl R, Bourredjem A, Hernu R, Montini F, Bruyère R, et al. Timing of renal replacement therapy in patients with acute kidney injury and sepsis. N Engl J Med. 2018;379(15):1431–42.
Yeh H C, Ting IW, Tsai CW, Wu J Y, Kuo CC. Serum lactate level and mortality in metformin associated lactic acidosis requiring renal replacement therapy: a systematic review of case reports and case series. BMC Nephrol. 2017;18(1):229.
Mariano F, Pozzato M, Inguaggiato P, Guarena C, Turello E, Manes M, et al. Metformin associated lactic acidosis undergoing renal replacement therapy in intensive care units: a five million population based study in the North West of Italy. Blood Purif. 2017;44(3):198–205.
Calello DP, Liu KD, Wiegand TJ, Roberts DM, Lavergne V, Gosselin S, et al. Extracorporeal treatment for metformin poisoning: systematic review and recommendations from the extracorporeal treatments in poisoning workgroup. Crit Care Med. 2015;43(8):1716–30.
Hovda KE, Hunderi OH, Tafjord A B, Dunlop O, Rudberg N, Jacobsen D. Methanol outbreak in Norway 2002–2004: epidemiology, clinical features and prognostic signs. J Intern Med. 2005;258(2):181–90. 121. Kute VB, Godara SM, Shah PR, Gumber MR, Goplani KR, Vanikar AV, et al.
Hemodialysis for methyl alcohol poisoning: a single center experience. Saudi J Kidney Dis Transplant Off Publ Saudi Cent Organ Transplant Saudi Arab. 2012;23(1):37–43.
Liu JJ, Daya MR, Carrasquillo O, Kales SN. Prognostic factors in patients with methanol poisoning. J Toxicol Clin Toxicol. 1998;36(3):175–81. 123. Coulter CV, Farquhar SE, McSherry CM, Isbister GK, Duffull SB. Methanol and ethylene glycol acute poisonings—predictors of mortality. Clin Toxicol Phila Pa. 2011;49(10):900–6.
Brent J, McMartin K, Phillips S, Aaron C, Kulig K, Methylpyrazole for Toxic Alcohols Study Group. Fomepizole for the treatment of methanol poisoning. N Engl J Med. 2001;344(6):424–9.
Mégarbane B, Borron SW, Baud FJ. Current recommendations for treatment of severe toxic alcohol poisonings. Intensive Care Med. 2005;31(2):189–95.
Roberts DM, Yates C, Megarbane B, Winchester JF, Maclaren R, Gosselin S, et al. Recommendations for the role of extracorporeal treatments in the management of acute methanol poisoning: a systematic review and consensus statement. Crit Care Med. 2015;43(2):461–72.
McCabe DJ, Lu JJ. The association of hemodialysis and survival in intubated salicylate poisoned patients. Am J Emerg Med. 2017;35(6):899–903.
Dempsey JA, Smith CA. Pathophysiology of human ventilatory control. Eur Respir J. 2014;44(2):495–512.
Lumb A. Nunn’s applied respiratory physiology. 8th ed. New York: Elsevier; 2016.
Javaheri S, Corbett W, Wagner K, Adams JM. Quantitative cerebrospinal fluid acid–base balance in acute respiratory alkalosis. Am J Respir Crit Care Med. 1994;150(1):78–82.
Javaheri S, Herrera L, Kazemi H. Ventilatory drive in acute metabolic acidosis. J Appl Physiol. 1979;46(5):913–8.
Fulop M. Ventilatory response in patients with acute lactic acidosis. Crit Care Med. 1982;10(3):173–5.
Curley GF, Laffey JG. Acidosis in the critically ill—balancing risks and benefits to optimize outcome. Crit Care Lond Engl. 2014;18(2):129.
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;45:486–552. 135. Stengl M, Ledvinova L, Chvojka J, Benes J, Jarkovska D, Holas J, et al. Effects of clinically relevant acute hypercapnic and metabolic acidosis on the cardiovascular system: an experimental porcine study. Crit Care Lond Engl. 2013;17(6):R303.
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med. 2017;45(3):486–552.
Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017;195(4):438–42.
Mascheroni D, Kolobow T, Fumagalli R, Moretti MP, Chen V, Buckhold D. Acute respiratory failure following pharmacologically induced hyperventilation: an experimental animal study. Intensive Care Med. 1988;15(1):8–14.
Publisher’s note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.