Tóm tắt
Bối cảnh:
Thuốc vận mạch được dùng cho bệnh nhân bệnh nặng bị sốc giãn mạch không đáp ứng với hồi sức dịch, và ít gặp hơn trong sốc tim và sốc giảm thể tích.
Mục tiêu:
Mục tiêu là xem xét sự an toàn và hiệu quả của thuốc vận mạch, sinh lý bệnh, tác nhân làm giảm liều thuốc vận mạch, dấu ấn sinh học dự đoán, thuốc chẹn beta-1 và hướng nghiên cứu.
Phương pháp:
Chất lượng bằng chứng được đánh giá bằng cách sử dụng Phân loại, Đánh giá, Phát triển và Đánh giá (GRADE).
Kết quả:
Vasopressors liên kết adrenergic: α1, α2, beta1, 2; vasopressin: AVPR1a, AVPR1B, AVPR2; angiotensin II: AG1, AG2; và dopamine: thụ thể DA1, DA2 gây co mạch. Sự lựa chọn và liều lượng thuốc thay đổi do bệnh nhân và thực hành bác sĩ. Các tác dụng phụ bao gồm co mạch quá mức, thiếu máu cục bộ, tăng đường huyết, tăng lactate máu, nhịp tim nhanh và rối loạn nhịp nhanh. Không có thử nghiệm ngẫu nhiên có đối chứng thuốc vận mạch cho thấy sự khác biệt đáng kể về tỷ lệ tử vong trong 28 ngày. Norepinephrine là thuốc vận mạch được lựa chọn đầu tiên trong sốc dãn mạch sau khi hồi sức đủ thể tích. Một số chiến lược làm giảm liều norepinephrine (vasopressin, angiotensin II) không làm giảm tỷ lệ tử vong trong 28 ngày trong khi corticosteroid đã giảm đáng kể tỷ lệ tử vong trong 28 ngày ở một số (hai thử nghiệm lớn) nhưng không phải tất cả các thử nghiệm. Ở những bệnh nhân kháng trị norepinephrine, vasopressin hoặc epinephrine có thể được thêm vào. Một thuốc vận mạch mới, angiotensin II, có thể hữu ích ở những bệnh nhân hạ huyết áp sâu. Dobutamine có thể được thêm vào vì thuốc vận mạch có thể làm giảm sự co bóp của thất. Dopamine chỉ được khuyến cáo ở những bệnh nhân nhịp tim chậm. Có những thuốc vận mạch mạnh với bằng chứng hạn chế (ví dụ: xanh methylen, metaraminol) và thuốc vận mạch mới trong quá trình phát triển (selepressin).
Kết luận:
Norepinephrine là lựa chọn đầu tiên sau đó là vasopressin hoặc epinephrine. Angiotensin II và dopamine có chỉ định hạn chế. Trong tương lai, các dấu ấn sinh học dự đoán có thể hướng dẫn lựa chọn thuốc vận mạch và thuốc vận mạch mới có thể xuất hiện.
Từ khóa:
Thuốc vận mạch, Norepinephrine, Vasopressin, Angioensin II, Sốc nhiễm khuẩn, Esmolol
Giới thiệu và lý do
Lý do của tổng quan này là cần có hướng dẫn lâm sàng cho việc sử dụng thuốc vận mạch vì có vấn đề mới với thuốc vận mạch, thuốc vận mạch mới có sẵn trên lâm sàng và thuốc vận mạch mới trong các thử nghiệm quan trọng kể từ những đánh giá gần đây [1, 2].
Vấn đề
Mục tiêu là để xem xét các nhận xét lâm sàng chung về việc sử dụng thuốc vận mạch trong sốc, sinh lý bệnh, đặc điểm vận mạch cụ thể, an toàn và bằng chứng hiệu quả, các tác nhân làm giảm liều thuốc vận mạch, dấu ấn sinh học dự đoán, thuốc ức chế beta1 trong sốc nhiễm trùng, thuốc vận mạch trong choáng tim và giảm thể tích và tác động trực tiếp đến các nghiên cứu. Thuốc co mạch thường được dùng để điều trị sốc dãn mạch, đặc biệt là sốc nhiễm trùng, không đáp ứng với hồi sức thể tích. Các nguyên nhân gây sốc khác được sử dụng thuốc vận mạch bao gồm sốc mạch sau phẫu thuật tim mạch, choáng sau nhồi máu cơ tim cấp tính, sau phẫu thuật / phẫu thuật bụng / gây mê hoặc sau khi dùng thuốc nhất định cũng như sốc tim và giảm thể tích. Hầu hết các thử nghiệm ngẫu nhiên có đối chứng chất lượng cao (RCT) của thuốc vận mạch đều bị sốc nhiễm trùng.
Tóm tắt các chứng cứ
Bất chấp các hướng dẫn quốc tế [3], thuốc vận mạch chuyên biệt được chọn và liều thuốc vận mạch thay đổi rất nhiều trong thực hành lâm sàng do bệnh nhân và bác sĩ thực hành không đồng nhất [4]. Ví dụ, liều norepinephrine được sử dụng trong nhóm đối chứng trong các RCT về choáng rất khác nhau (trung bình 0,20 – 0,82 mcg / kg / phút ) [5]. Hơn nữa, việc sử dụng rất thay đổi của vasopressin lâm sàng và thực hành của các bác sĩ không đồng nhất. Một nghiên cứu đoàn hệ quan sát (n = 584.421 bệnh nhân; 535 bệnh viện) đã đánh giá việc sử dụng vasopressin trong sốc nhiễm trùng [6]. Những bệnh nhân ở bệnh viện “sử dụng vasopressin cao” có khả năng nhận vasopressin cao gấp 2,6 lần so với bệnh nhân ở bệnh viện “sử dụng vasopressin thấp”. Việc giải thích bị hạn chế do sự không đồng nhất của bệnh nhân từ nhiều bệnh viện lớn và cộng đồng.
Thuốc co mạch được chỉ định cho những bệnh nhân không đáp ứng với hồi sức truyền dịch đầy đủ [3] nhưng điều này có thể thay đổi rộng rãi và khó đo lường lâm sàng vì các bác sĩ lâm sàng đo các tình trạng thể tích tương đối không chính xác. Hơn nữa, sự tương tác của các loại dịch khác nhau, khối lượng tải của dịch và tác dụng vận mạch gây ra sự sai lệch rất mạnh mẽ và quan trọng vì thuốc vận mạch (không giống như dịch) tác động lên động mạch và tĩnh mạch. Có rất ít bằng chứng về thuốc vận mạch như là thuốc thay thế là thuốc vận mạch lựa chọn đầu tiên vì RCT của thuốc vận mạch bao gồm bệnh nhân dùng norepinephrine.
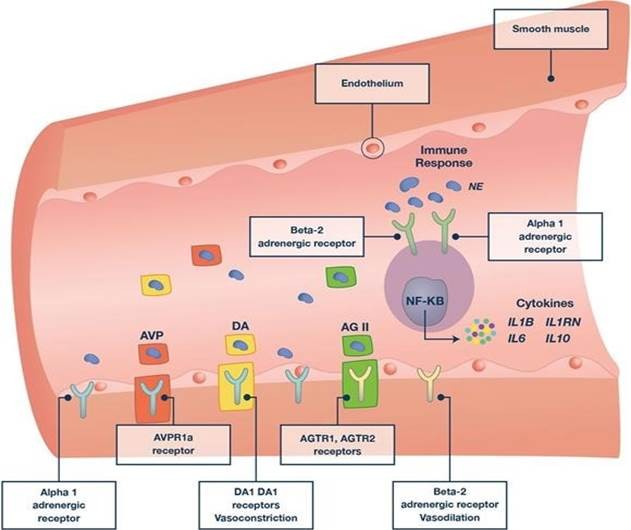
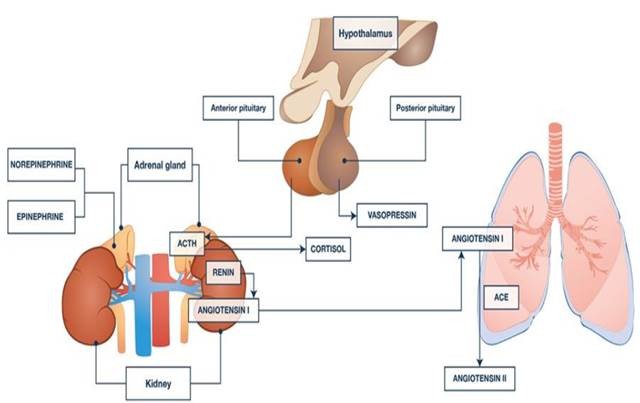
Thuốc co mạch là hóc-mon gây co mạch bằng cách kích hoạt thụ thể (norepinephrine / epinephrine: α1, 1, 2; vasopressin: AVPR1a, AVPR1b, AVPR2; angiotensin II: AGTR1, AGTR2; dopamine: DA1; DA2 (hình 1) có lẽ đang giới hạn cơ hội phát triển thuốc. Thuốc vận mạch mới là những sửa đổi của hormone tự nhiên (ví dụ: selepressin, một chất chủ vận AVPR1a đặc hiệu). Có sự trao đổi chéo phức tạp của các hệ thống hormone này (Hình 2) làm phức tạp thêm liệu pháp thuốc vận mạch.Tất cả các thuốc vận mạch thường có tác dụng phụ trong thực hành, đặc biệt là thiếu máu cục bộ/nhồi máu cơ quan, thay đổi chuyển hóa (tăng glucose máu do kích thích beta1; tăng lactate máu do β2, nhịp tim nhanh và rối loạn nhịp tim nhanh do beta1). Áp suất động mạch trung bình mục tiêu (MAP) trong khi sử dụng thuốc vận mạch là 65 mmHg [3] nhưng vẫn còn đang tranh luận; một RCT [8] không tìm thấy sự khác biệt về tỷ lệ tử vong giữa các loại thông thường (65 – 70 mmHg) so với MAP cao (80 – 85 mmHg). Tuy nhiên, một kết quả có liên quan đến lâm sàng đã xuất hiện mà chúng tôi sử dụng: ở những bệnh nhân bị tăng huyết áp mãn tính, mục tiêu MAP cao làm giảm tổn thương thận cấp tính.
|
Thông tin cốt lõi |
|
Thuốc co mạch được dùng cho bệnh nhân bị bệnh nặng với sốc vận mạch không đáp ứng với hồi sức thể tích, và ít gặp hơn là sốc tim và sốc giảm thể tích. Norepinephrine là lựa chọn đầu tay có thể được theo sau bởi vasopressin hoặc epinephrine. Angiotensin II và dopamine có chỉ định hạn chế. Trong tương lai, các dấu ấn sinh học dự đoán có thể hướng dẫn lựa chọn thuốc vận mạch và thuốc vận mạch mới có thể xuất hiện. |
Bệnh nhân dùng thuốc vận mạch thường gặp nhưng không phải lúc nào cũng yêu cầu đặt catheter động mạch để theo dõi áp lực động mạch (và áp lực tĩnh mạch trung tâm (CVP) (CVP> 8 – 12 cm H2O [3]). Một số bác sĩ lâm sàng sử dụng catheter động mạch phổi và theo dõi mao mạch phổi áp lực bít và cung lượng tim. Tuy nhiên, theo dõi tim mạch không xâm lấn đã thay thế theo dõi catheter PA ở nhiều bệnh nhân.
Quản lý thuốc co mạch là trọng tâm trong Trị liệu Mục tiêu sớm (EGDT), có hiệu quả trong RCT ban đầu [9] nhưng không phải trong RCT tiếp theo [10], vì vậy sử dụng EGDT không được khuyến cáo cho sử dụng lâm sàng.
Định nghĩa về sepsis 3.0 của Sốc nhiễm trùng được khuyến cáo trên lâm sàng, yêu cầu sử dụng cả thuốc vận mạch và lactate máu > 2 mmol / L [11] (sepsis 2.0 chỉ cần sử dụng thuốc vận mạch). Khi nhiễm trùng huyết 3.0 được áp dụng cho RCT vasopressin then chốt trước đó [12], vasopressin có hiệu quả nhất ở những bệnh nhân không đáp ứng định nghĩa nhiễm trùng huyết 3.0 (tức là sử dụng thuốc vận mạch và lactate máu ≤ 2 mmol / L) [13]. Tỷ lệ tử vong quan sát được cao hơn với nhiễm trùng huyết 3.0 so với định nghĩa nhiễm trùng huyết 2.0 của sốc nhiễm trùng [14]. Do đó, việc sử dụng sốc nhiễm trùng 3.0 sẽ thay đổi thực hành lâm sàng và RCT của sốc nhiễm trùng. Việc sử dụng sốc nhiễm trùng 3.0 cho RCT sẽ thắt chặt các tiêu chí thu nhận, giảm kích thước mẫu (giảm 50% trong phân tích hồi cứu của VASST RCT) và tăng tỷ lệ tử vong [13, 14].
Cuối cùng, không có RCT của thuốc vận mạch nào cho thấy sự khác biệt đáng kể về tỷ lệ tử vong trong 28 ngày. Một số chiến lược làm giảm liều norepinephrine (vasopressin [12, 15], angiotensin II [16]) đã không làm giảm tỷ lệ tử vong trong 28 ngày, trong khi một số khác (corticosteroid) đã giảm đáng kể tỷ lệ tử vong trong 28 ngày ở một số (hai thử nghiệm lớn [17, 18) ]) nhưng không phải tất cả các thử nghiệm [19, 20].
Đối với bác sĩ lâm sàng, lĩnh vực thuốc vận mạch đã phát triển [3]: norepinephrine vẫn là thuốc vận mạch đầu tiên, epinephrine hoặc vasopressin là thuốc lựa chọn thứ hai, dopamine chỉ được khuyên dùng ở bệnh nhân nhịp tim chậm được chọn lọc và một thuốc vận mạch mới, selepressin [21] đang được thử nghiệm.
Theo đó, chúng tôi xem xét sinh lý bệnh lý liên quan đến lâm sàng của sốc vận mạch, RCT thuốc vận mạch quan trọng, làm thế nào bác sĩ xác định thuốc vận mạch có được sử dụng và loại nào để quản lý, và dược học chuyên biệt, hướng dẫn khuyến cáo, tác động, các tác dụng phụ, liều, theo dõi, cai giảm thuốc và các kết quả. Chúng tôi thảo luận về các thuốc tăng co bóp để bổ sung thuốc vận mạch, dấu ấn sinh học dự đoán và thuốc vận mạch mới. Chúng tôi xem xét vai trò của thuốc chẹn beta1 trong sốc nhiễm trùng. Chúng tôi xem xét sốc dãn mạch sau phẫu, sau phẫu thuật tim mạch và sau nhồi máu cơ tim cấp, sốc tim và sốc giảm thể tích.
Hình 1. Norepinephrine (NE) liên kết với các thụ thể adrenergic alpha-1 của cơ trơn mạch máu để gây co mạch, liên kết với thụ thể beta-1 và beta-2 gây ra sự giãn mạch, và liên kết với các thụ thể alpha-1 và beta2 điều chỉnh khác nhau đáp ứng miễn dịch trong nhiễm trùng huyết. Tiếp xúc với NE cũng điều chỉnh giảm xuống mật độ thụ thể alpha-1 và beta-2 và điều đó có thể làm thay đổi độ nhạy cảm với NE, do đó dẫn đến tăng liều norepinephrine và nguy cơ các biến cố xấu mạch máu và miễn dịch nhiều hơn. Vasopressin (AVP) liên kết với thụ thể AVPR1a, dopamine (DA) liên kết với thụ thể DA1 và DA2, và angiotensin II (AG) liên kết với thụ thể angiotensin II (AGTR1, AGTR2), tất cả đều gây co mạch.
Sinh lý bệnh liên quan đến lâm sàng của sốc giãn mạch
Hình 2. Sự tương tác phức tạp của một số trục nội tiết quan trọng trong sốc nhiễm trùng bao gồm: (1) giải phóng norepinephrine và epinephrine từ tủy thượng thận, (2) giải phóng hormone tuyến thượng thận (ACTH) từ tuyến yên trước và cortisol từ vỏ thượng thận, (3) giải phóng vasopressin (AVP) từ tuyến yên sau và (4) giải phóng renin [để đáp ứng với hạ huyết áp) từ thận. Renin được chuyển đổi thành angiotensin I (ANG-1) bởi angiotensinogen (được giải phóng từ gan], và sau đó angiotensin I được chuyển đổi thành angiotensin II (ANG-2) bởi enzyme chuyển đổi angiotensin (ACE) trong phổi. Tổng hợp aldosterone và giải phóng từ vỏ thượng thận, và aldosterone làm tăng sự lưu giữ natri ở thận. Angiotensin II cũng làm tăng giải phóng vasopressin. Với sự cho phép từ Russell [7]
Sốc giãn mạch được đặc trưng bởi tình trạng giãn mạch (được xác định lâm sàng bằng da ấm), hạ huyết áp, nhịp tim nhanh và tưới máu không đầy đủ (suy giảm chức năng ý thức, thiểu niệu). Khi rối loạn chức năng tâm thất và giảm thể tích tuần hoàn đóng góp sẽ có các đặc điểm thay đổi (da lạnh, tăng áp lực tĩnh mạch cảnh (JVP) và CVP nếu có rối loạn chức năng tâm thất và JVP và CVP thấp nếu có giảm thể tích máu). Giãn cơ trơn mạch máu là cơ chế trung tâm của sốc giãn mạch [22]. Mặc dù không rõ ràng đối với bác sĩ lâm sàng, nhưng đằng sau hậu trường huyết động đó có một phản ứng nội tiết tố nhanh chóng, phức tạp đối với hạ huyết áp: bài tiết nhiều hoocmon
(norepinephrine, epinephrine, vasopressin, angiotensin II, aldosterone, adrenomedullin và cortis), có các tác dụng hiệp đồng cố gắng gia tăng trương lực vận mạch, nhịp tim và sức co bóp. Thông thường sự giãn mạch vẫn dai dẳng do β1, β2 và các thụ thể khác bị điều chỉnh xuống [23], sự khác biệt về kiểu gen giữa những bệnh nhân khác nhau [24, 25] và chuyển hóa biến đổi gen [26]. Khi các cơ chế đa hormone điều tiết này bị áp đảo, hạ huyết áp và sốc sẽ tồn tại dai dẵng.
Sự giãn mạch trong nhiễm trùng huyết bị tác động qua trung gian chủ yếu bởi oxit nitric (NO) và prostacyclin. Tổng hợp cảm ứng NO (iNOS) được gây ra bởi endotoxin và cytokine; một chất ức chế iNOS làm tăng tổng hợp NO và huyết áp, giảm nhu cầu thuốc vận mạch nhưng giảm tỷ lệ sống sót trong một RCT lớn, do đó không có sẵn trên lâm sàng và cũng không được khuyến cáo [27, 28]. Prostacyclin được giải phóng bởi các tế bào nội mô để đáp ứng với nội độc tố và các cytokine gây viêm. Một RCT then chốt về ibuprofen (chất ức chế tổng hợp prostacyclin) không có tác dụng đối với sự sống còn [29]. Adrenomedullin, một loại thuốc gây giãn mạch và ức chế tim, làm tăng sốc nhiễm trùng và liên quan đến tỷ lệ tử vong. Anti-adrenomedullin tăng khả năng sống sót, đáp ứng với norepinephrine và chức năng thận trong các mô nhiễm trùng huyết và là mục tiêu điều trị mới trong sốc nhiễm trùng [30].
Bảng 1 Các thuốc vận mạch, liên kết thụ thể của chúng, các tác động có lợi bổ sung, liều lượng và các dấu ấn sinh học liên quan
|
Thuốc |
Receptor |
Tác động bổ sung |
Liều |
Dấu ấn sinh học có thể tiên lượng |
|
Noradrenaline |
α-1 >β-1,2 |
Hoạt động MD |
5-100µg/p |
β2 receptor SNP [24] |
|
Epinephrine |
α-1>β-1,2 β-1 hơn NE |
Hoạt động MD |
5-69µg/kg/p |
β2 receptor SNP [24] |
|
Phenylephrine |
α-1 |
Hoạt động MD |
50-100µg bolus 0,1-1,5µg/kg/p |
|
|
Dopamine |
DA1, DA2 |
Hoạt động MD |
1-5/kg/p liều thấp 5-15µg/kg/p liều TB 20-50µg/kg/p liều cao |
|
|
Vasopressin |
AVPR1a, AVPR1b AVPR2 |
Hoạt động MD |
0,01-0,04U/p |
LNPEP SNP [26] Angiopoietin ½ [42] Vasopressin/copeptin |
|
Terlipressin |
AVPR1a (AVPR1b) > AVPR2 |
Hoạt động MD ? |
1.3 μg/kg hr 20–160 μg/hr bolus: 1 mg |
LNPEP [26] Vasopressin/copeptin |
|
Selepresin |
AVPR1a |
↓Angiopoietin-2 ↓ Thoát mạch |
1.25–2.5 ng/kg/p pha 2 1.25–5.0 ng/kg/p pha 3 |
LNPEP SNP [26] Angiopoietin 1/2 [42] Vasopressin/copeptin |
|
Angiotensin-II |
AGTR1, AGTR2 |
↑Vasopressin ↑ Erythropoietin |
5–200 ng/kg/p (3 h đầu; 1.25–40 ng/kg/p 7 ngày) |
AGTRAP SNP [25] |
|
Xanh methylen |
Ức chế thụ thể GABAA |
↓Thoát mạch |
Bolus (2 mg/kg) sau đó truyền leo thang- 0.25, 0.5, 1, 2 mg/kg/hr |
|
SNP single nucleotide polymorphism, LNPEP leucyl and cystinyl aminopeptidase, AGTRAP angiotensin II receptor associated protein,
AGTR1, AGTR2 angiotensin II receptors 1 and 2, GABAA gamma-aminobutyric acid
Đánh giá lâm sàng và sinh lý cho bác sĩ lâm sàng để xác định khi nào và dùng thuốc vận mạch nào để sử dụng
Đánh giá trong giai đoạn cấp cứu ưu tiên đường thở, hô hấp và hồi sức tim mạch dựa trên đánh giá lâm sàng về tình trạng thể tích và tưới máu, bổ sung bằng các xét nghiệm trong phòng thí nghiệm (khí máu động mạch, lactate máu, huyết học, chức năng thận và gan) (Hình 3). SOFA nhanh (qSOFA: nhịp hô hấp > hoặc = 22 / phút, thay đổi tri giác, huyết áp tâm thu
Bảng 2 Các RCT then chốt của thuốc vận mạch trong sốc nhiễm trùng
|
Tên RCT |
Thuốc |
Chứng (n) |
Tổng (n) |
TV nhóm CT |
TV nhóm chứng |
ARR(95%CI) p |
Kết cục phụ p |
|
SEPSIS-ACT [45] |
Selepressin (562) |
Placebo (266) |
828 |
40,6% |
39,4% |
NA |
Ngày khôngRRT, Ngày không ICU |
|
VASST [12] |
Norepinephrine (382 |
Vasopressin (396) |
778 |
35,4% |
39,3% |
3.9 (− 2.9 to 10.7) 0.26 |
DAF vận mạch, thở máy và RRT, p NS |
|
VANISH [15] |
Norepinephrine (204) |
Vasopressin (205) |
409 |
30,9% |
27,5% |
3.4 (− 5.4 to 12.3) |
Tỷ lệ RRT, thời gian, ngày không MOFs, Ngày nằm ICU/viện, p NS |
|
SOAP II [48] |
Norepinephrine (821) |
Dopamine (858) |
1679 |
48,5% |
52,5% |
1.17 (0.97 to 1.42) 0.10 |
DAF vận mạch, thở máy và RRT; Thời gian nằmICU/ viện |
|
ATHOS-3 [16] |
ANG II (163) |
Placebo (158) |
479 |
46% |
54% |
HR: 0.78c (0.57 to 1.07) 0.12 |
Thay đổi điểm SOFA; thay đổi liều norepinephrine |
|
CAT [37] |
Epinephrine (139) |
Norepinephrine (138) |
277 |
23% |
27% |
HRc: 0.87(0.48 to 1.58) 0.65 |
Kết cục chính: DAF vận mạch (thời gian đạt được MAP mục tiêu trong 24h |
|
CATS [47] |
Epinephrine (161) |
Norepinephrine + dobutamine (169) |
330 |
40% |
34% |
RRd: 0.86 (0.65 to 1.14) 0.31 |
Tử vong ICU, nội viện và 90 ngày; Huyết động; SOFA; thời gian không cần vận mạch trong 24h |
HR hazard ratio, RR relative risk, DAF ngày sống và không có sự can thiệp như thuốc vận mạch, thở máy và thay thế thận (RRT), NS không có ý nghĩa
akết cục tử vong ngày thứ 28 do mọi nguyên nhân; kết cục chính: ngày không thay thế thận
bChoáng do mọi nguyên nhân; tử vong ngày thứ 28
cHazard ratio
dRelative risk
Song song với hồi sức, sử dụng kiểm tra lâm sàng và đánh giá cận lâm sàng để chẩn đoán nguyên nhân gây sốc; sốt, và tăng bạch cầu, nghi ngờ sốc nhiễm trùng và nguồn nhiễm trùng huyết nên được điều tra. Tình trạng có bệnh cảnh “giả” Nhiễm trùng huyết bao gồm viêm tụy, hít sặc, Hội chứng suy hô hấp cấp tính (ARDS), phẫu thuật gần đây, sau nhồi máu cơ tim cấp tính, chấn thương và thuốc (gây mê và dị ứng thuốc / sốc phản vệ).
Không có bằng chứng cho thấy bất kỳ công cụ chẩn đoán nào có hiệu quả để hướng dẫn điều trị, ít nhất là liên quan đến tỷ lệ tử vong. Siêu âm tim tại giường hạn chế có thể có hiệu quả để hướng dẫn quản lý dịch và thuốc vận mạch. Chúng tôi thường sử dụng siêu âm tim tại giường hạn chế (siêu âm tim nhanh) vì một nghiên cứu kiểm soát trường hợp của siêu âm tim tại giường ở bệnh nhân ICU được hồi sức đang trong tình trạng sốc (1) tình trạng thể tích thường nhiều hơn là thiếu (2) hạn chế dịch được khuyến nghị (65% bệnh nhân) và (3 ) bắt đầu sử dụng dobutamine được khuyến cáo (25% bệnh nhân) [31]. Tỷ lệ tử vong thấp hơn ở nhóm siêu âm tim so với nhóm chứng [31]. Tuy nhiên, cơ chế mà siêu âm tim đầu giường dẫn đến việc dobutamine được sử dụng sau đó dẫn đến giảm tỷ lệ tử vong là không chắc chắn.
Phân loại tác động của thuốc vận mạch
Xem Bảng 1 về các thuốc vận mạch, thụ thể, tác động, liều lượng và dấu ấn sinh học. Các nghiên cứu về sử dụng kháng sinh sớm [32, 33] và Liệu pháp điều trị trực tiếp sớm (EGDT) [10, 33] đã dạy các bác sĩ lâm sàng tập trung việc nhận biết sớm và điều trị sốc nhiễm trùng trong vòng một giờ đầu (có thể so sánh với “giờ vàng” trong chấn thương) và phù hợp với nghiên cứu trí tuệ nhân tạo (AI). Trái ngược với thực hành lâm sàng trong một đoàn hệ lớn ở Anh, AI khuyến cáo bệnh nhân nhiễm trufmg huyết nên dùng thuốc vận mạch thường xuyên hơn (30% so với 17%) [34]. Tuy nhiên, các nghiên cứu quan sát không được kiểm soát khác cho thấy rằng thuốc vận mạch sớm có hại [35] đề nghị cần có sự “cân bằng” đối với việc sử dụng thuốc vận mạch sớm.
Bảng 3 Các tác dụng phụ của thuốc vận mạch dựa theo các thuốc vận mạch cụ thể, các cơ chế và bệnh tương tác với các tác nhân bất lợi cụ thể, nhấn mạnh vào sốc nhiễm trùng
|
Tác dụng phụ |
Cơ chế |
Các thuốc vận mạch gây ra các tác dụng phụ này |
Bệnh tương tác |
|
Thiếu máu cục bộ: tim, não, tạng, thận, đầu chi |
α1 AVPR1a AGTR1, AGTR2 |
Norepinephrine, epinephrine, dopamine, vasopressin, terlipressin, selepressina Angiotensin IIb |
DIC |
|
Tim nhanh, rối loạn nhịp nhanh |
β1 β1, DA1, DA2 β1 |
Epinephrine > norepinephrine > vasopressin Dopamine > norepinephrine Dobutaminec |
CHF, IHD |
|
Rung nhĩ |
? β1 |
? Epinephrine >norepinephrin |
CHF, IHD |
|
Tăng đường huyết |
β1 |
Epinephrine > norepinephrine |
DM, corticosteroid |
|
Tăng lactate máu |
β1 |
Epinephrine > norepinephrine |
|
|
Giảm cung lượng tim |
α1 AVPR1a |
Phenylephrine >norepinephrine, epinephrine, vasopressin, terlipressin, selepressina |
CHF, IHD |
|
Tổn thương thận cấp |
α1 AVPR1a |
Phenylephrine > norepinephrine, epinephrine, vasopressin, terlipressin, selepressina |
CKD, DM, hypertension, ACE |
|
Tác động miễn dịch |
α1, α2, β1, β2 AVPR1a |
Phenylephrine norepinephrine,Epinephrine Vasopressin, terlipressin, selepressin |
Corticosteroids, suy giảm miễn dịch |
Vasopressin có thể làm giảm tỷ lệ biến cố bất lợi và các tác dụng phụ đặc hiệu (sốc giãn mạch và rung nhĩ mới) [56]
DIC đông máu nội mạch lan tỏa, CHF suy tim sung huyết, IHD bệnh tim thiếu máu cục bộ, DM đái tháo đường, CRD bệnh thận mãn tính, ACE thuốc ức chế men chuyển ang angensensin
aChỉ ra rằng tỷ lệ biến cố bất lợi là tương tự trong RCT và nghiên cứu quan sát giữa các thuốc vận mạch được đề cập
bAngiotensin II RCT [16) đã sử dụng giả dược để đối chứng nên việc so sánh tỷ lệ biến cố bất lợi giữa các thuốc vận mạch có thể so sánh khác nhau
cDobutamine là một thuốc tăng co bóp, nhưng nó được tính đến bởi vì nó thường được dùng với thuốc vận mạch d Các tác động miễn dịch là phức tạp [36, 40] và cho đến nay ý nghĩa lâm sàng là không chắc chắn
Các nghiên cứu kinh điển về thuốc vận mạch
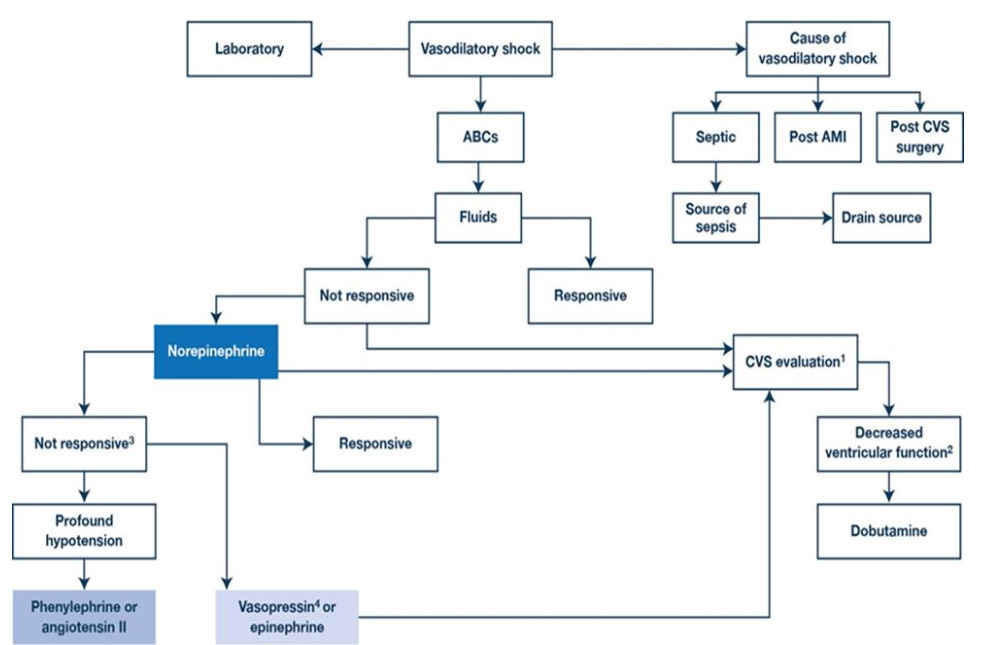
Hình 3. Lượt đồ để quản lý thuốc vận mạch. Ở những bệnh nhân bị sốc giãn mạch, ưu tiên hàng đầu là hồi sức đường thở, hô hấp và tuần hoàn (ABCs), trong khi thực hiện đánh giá cận lâm sàng song song (khí máu động mạch, lactate, huyết học, chức năng thận và gan) và đánh giá nguyên nhân gây sốc giãn mạch. Các dịch cho ban đầu (30 ml / kg khởi đầu và nhiều hơn khi cần thiết) phải là tinh thể. Ở những bệnh nhân không đáp ứng với hồi sức đầy đủ, norepinephrine được bắt đầu. Ở những bệnh nhân không đáp ứng với norepinephrine, vasopressin (terlipressin) hoặc epinephrine sẽ thêm vào. Ở những bệnh nhân bị hạ huyết áp sâu, phenylephrine hoặc angiotensin II có thể được xem xét. Đánh giá nguyên nhân gây sốc được thực hiện song song với hồi sức; sốt và tăng bạch cầu gợi ý sốc nhiễm trùng. Sốc nhiễm khuẩn đòi hỏi phải tìm kiếm nguồn nhiễm trùng huyết và dẫn lưu áp xe và viêm mủ màng phổi. Bệnh cảnh “giả” Nhiễm trùng huyết bao gồm nhồi máu cơ tim sau cấp tính (AMI), sau phẫu thuật tim mạch và các nguyên nhân khác (viêm tụy, hít sặc, Hội chứng suy hô hấp cấp tính (ARDS), sau phẫu thuật ổ bụng, chấn thương và thuốc (dị ứng và dị ứng thuốc).
1Trên bệnh nhân không đáp ứng với norepinephrine, vasopressin, epinephrine hoặc angiotensin II, đánh giá tim mạch là cần thiết.
2Đánh giá tim mạch nên tiến hành như siêu âm tim tại giường hạn chế, cung lượng tim không xâm lấn, áp lực tĩnh mạch trung tâm (CVP) hoặc áp lực mao mạch phổi bít (thông qua ống thông động mạch phổi). Nếu có chức năng tâm thất giảm (phân suất tống máu giảm), thì nên bổ sung dobutamine.
3Không đáp ứng với norepinephrine hoặc thuốc vận mạch khác không có định nghĩa rõ ràng nhưng thường có nghĩa là không đáp ứng với liều cao.
4Vasopressin có thể được thay thế bằng terlipressin nhưng các thử nghiệm ngẫu nhiên có đối chứng về terlipressin nhỏ hơn nhiều so với vasopressin. Selepressin (một chất chủ vận AVPR1a rất đặc hiệu) đang được phát triển
RCT then chốt của norepinephrine so với epinephrine [37], norepinephrine cộng với dobutamine so với epinephrine [47], vasopressin sớm [15] so với norepinephrine, và vasopressin so với norepinephrine trong sốc nhiễm trùng [12], và norepinephrine so với dopamine trong tất cả các loại sốc được xác nhận rằng norepinephrine đều vượt trội so với dopamine và tương đương với vasopressin và epinephrine (Bảng 2). Một số trong các RCT này chỉ có cỡ mẫu vừa phải. Trong khi hai RCT có hơn 700 bệnh nhân mỗi người (SOAP II [48] (dopamine so với norepinephrine n = 1679; VASST [12] (vasopressin so với norepinephrine n = 778)), ATHOS-3 [16] (angiotensin II so với giả dược n = 479), VANISH [15] (vasopressin so với norepinephrine, n = 409, CAT [37] (epinephrine so với norepinephrine, n = 330) và CATS [47] (epinephrine so với norepinephrine cộng với dobutamine n = 277).
Không có sự khác biệt về tỷ lệ tử vong giữa vasopressin và norepinephrine trong VASST [12] và VANISH [15], nhưng vasopressin có thể có hiệu quả hơn trong sốc ít nghiêm trọng hơn (norepinephrine cơ bản
Trong sốc nặng hơn, các bác sĩ lâm sàng thường điều trị kết hợp thuốc vận mạch nhưng sự kết hợp thuốc vận mạch tối ưu vẫn chưa được biết về tỷ lệ tử vong. Trong một phân tích tổng hợp mạng về RCT (43 RCT; 5767 bệnh nhân) thuốc vận mạch [51], hiệu quả cao nhất đối với norepinephrine cộng với dobutamine; tỷ lệ nhồi máu cơ tim cấp tính cao nhất với norepinephrine cộng với epinephrine; tỷ lệ rối loạn nhịp tim cao nhất với dopamine và thấp nhất với vasopressin. Nghiên cứu hồi cứu này phải được giải thích thận trọng và tạo ra giả thuyết.
Tác dụng phụ
Các tác dụng phụ nghiêm trọng phổ biến nhất của thuốc vận mạch là thiếu máu cục bộ đầu chi và cơ quan, nhịp tim nhanh và rung tâm nhĩ [52] (tăng nguy cơ đột quỵ [53]) (Bảng 3). Liều thuốc vận mạch tích lũy cao hơn có liên quan đến rối loạn chức năng nội tạng và tỷ lệ tử vong [54], nhưng các nghiên cứu kết hợp bị nhiều nhiễu loạn. Nhiều thuốc vận mạch có tác dụng miễn dịch có thể được chứng minh là quan trọng trong sốc nhiễm trùng ở người. Norepinephrine có tác dụng ức chế tăng trưởng miễn dịch và vi khuẩn vừa phải trong các mô hình tiền lâm sàng có thể làm tăng nguy cơ nhiễm trùng, nhưng nguy cơ miễn dịch của norepinephrine truyền là không chắc chắn [36]. Vasopressin thúc đẩy việc giảm cytokine thông thường nhiều hơn norepinephrine, đặc biệt là trong sốc nhiễm trùng ít nghiêm trọng [55].
Các tác dụng phụ nghiêm trọng của thuốc vận mạch là tương tự ở hầu hết các RCT nhưng khác biệt đáng kể giữa dopamine so với epinephrine trong SOAP 2 [48] [gấp đôi số lần loạn nhịp với dopamine (24,1%) so với norepinephrine (12,4%, p
Bảng 4 Các tác dụng phụ nghiêm trọng trong các RCT then chốt của thuốc vận mạch trong sốc nhiễm trùng
|
RCT |
SAE |
CT thuốc (n,%) p |
Nhóm chứng (n,%) p |
Biến cố |
CT thuốc (n,%) p |
Nhóm chứng (n,%) p |
Biến cố |
CT thuốc (n,%) p |
Nhóm chứng (n,%) p |
|
SEPSIS- ACT [45] |
|
SE (2054/562) 83.3%) |
Placebo (1086/266) 88.3%h |
TMCB |
SE (92/562) 14.4%h |
Placebo (36/266) 12%h |
RLN/CA |
SE (209/562) 27.9%h |
Placebo (87/266) 25.2%h |
|
VASST [12] |
|
NE (40/382) 10.5% |
VASO (41/396) 10.3% p = 1.0 |
TMCBa |
NE (23/382) 6.0% |
VASO (26/396) 6.6% |
RLN/CA |
NE (14/382) 3.7% |
VASO (11/396) 2.8% |
|
VANISH [15] |
|
NE (17/204) 8.3% |
VASO (22/05) 10.7% |
TMCBb |
NE (10/204) 5% |
VASO (23/205) 11.2% |
RLN/CAc |
NE (5/204) 2.4% |
VASO (2/205) 1% |
|
SOAP II [48] |
|
NE (800/821)g 97.4% |
DOPA (979/858)= 100%h |
TMCB |
NE (79/821) 9.6% |
DOPA (98/858) 11.4% |
RLN/CA |
NE (102/821) 12.4% |
DOPA (207/858) 24.1% p |
|
ATHOS- 3 [16] |
|
AnG II (99/163) 60.7% |
Placebo (106/158) 67.1% |
TMCBb |
AnG II (8/163) 4.9% |
Placebo (8/158) 5.0% |
RLN/CA |
AnG II (29/163) 17.8% |
Placebo (28/158) 17.7% |
|
CAT [37] |
SAEd |
EPI (18/139) 12.9% |
NE (4/138) 2.8% p = 0.002 |
|
|
|
|
|
|
|
CATS[47] |
SAEe |
EPI (33/161) 20.5% |
NE + DOBU (41/169) 24.3% |
TMCBf |
EPI (9/161) 5% |
NE + DOBU (11/169) 7% |
RLN/CA |
EPI (31/161) 19% |
NE + DOBU (30/169) 18% |
SAE biến cố bất lợi nghiêm trọng, NE Noradrenaline, SE selepressin, VASO vasopressin, EPI epinephrine, DOPA dopamine, DOBU dobutamin, TMCB thiếu máu cục bộ cơ tim, RLN/CA rối loạn nhịp/ngưng tim
aThiếu máu cục bộ = thiếu máu cơ tim cấ /nhồi máu, thiếu máu cục bộ mạc treo, thiếu máu cục bộ đầu chi, thiếu máu cục bộ não/nhồi máu não
bThiếu máu cục bộ = thiếu máu cơ tim cấ /nhồi máu, thiếu máu cục bộ mạc treo, thiếu máu cục bộ đầu chi c Rối loạn nhịp tim đe dọa tính mạng
dNgưng thuốc
eTrong quá trình truyền catecholamine
fThiếu máu cục bộ = thiếu máu cơ tim cấp/nhồi máu, thiếu máu cục bộ đầu chi, thiếu máu nã/nhồi máu não
gSAE bao gồm thiếu máu cục bộ, rối loạn nhịp tim và nhiễm trùng khởi phát mới chiếm phần lớn SAES (691/821 = 75,4% norepinephrine liên quan đến SEAs và 674/858 = 78,6% SAE liên quan đến dopamine). Không bao gồm nhiễm trùng khởi phát mới, tỷ lệ SAE đối với norepinephrine và dopamine lần lượt là 181/821 = 22,0% và 305/858 = 35,5%
hTổng số SAEs vượt quá số bệnh nhân cho thấy có hơn 1 SAE trên mỗi bệnh nhân
Theo dõi lâm sàng các thuốc vận mạch
Thuốc co mạch được bắt đầu, điều chỉnh và cai thuốc dựa theo MAP, các biện pháp lượng giá tình trạng tưới máu (trạng thái trí giác, lượng nước tiểu, lactate máu) và đánh giá tim mạch không xâm lấn (ví dụ như cung lượng tim không xâm lấn, đánh giá siêu âm tim cho chức năng tâm thất và tình trạng thể tích (sụp tĩnh mạch chủ dưới), vi tuần hoàn). Các biện pháp lượng giá lâm sàng (ví dụ: thời gian đổ đầy mao mạch) và các biện pháp cận lâm sàng (ví dụ: Lactate) liên quan tương đương với tỷ lệ tử vong để theo dõi hồi sức trong một RCT gần đây (n = 424) [57].
Cai thuốc vận mạch
Cai các thuốc vận mạch ít tiêu chuẩn hơn so với giai đoạn hồi sức và không có RCT về cai thuốc. Bệnh nhân được đánh giá là thích hợp cho việc giảm liều thuốc vận mạch dần dần khi được cho là ” ổn định chắc chắn”, (không có định nghĩa phổ quát), tức là tình trạng thể tích và tưới máu đầy đủ. Tình trạng xấu đi đòi hỏi phải điều chỉnh trở lại với liều cao hơn, sau đó, khi sự ổn định trở lại thì cai thuốc sẽ lặp lại. Thông tin y khoa tin học dự đoán chính xác cai thuốc vận mạch thành công sớm hơn và chính xác hơn so với bác sĩ lâm sàng [58].
Kết quả các rct về thuốc vận mạch
May mắn thay, có một số RCT chất lượng cao của thuốc vận mạch trong sốc nhiễm trùng. Kết cục chính thường gặp đối với các RCT về thuốc vận mạch trong sốc nhiễm trùng là tử vong ngắn hạn (ví dụ 28 ngày) nhưng tỷ lệ tử vong ngắn hạn đã giảm [59], vì vậy các RCT của thuốc vận mạch hiện nay tập trung vào cải thiện kết quả lâu dài và rối loạn chức năng cơ quan ngắn hạn mà nó phù hợp với kết quả lâu dài [60]. RCT then chốt của selepressin trong sốc nhiễm trùng là về số ngày không thuốc vận mạch và không thở máy [45]. Bác sĩ lâm sàng nên hiểu dược lý, hướng dẫn, tác động, tác dụng phụ và liều thuốc vận mạch (Bảng 1).
Norepinephrine
Trong hướng dẫn Chiến dịch Cải thiện sống còn Nhiễm trùng huyết (SSC), norepinephrine là thuốc vận mạch đầu tiên (bằng chứng vừa phải) [3]. Norepinephrine táccđộng mạnh từ các thụ thể α1, α2 và ít liên kết với thụ thể β1, β2 làm tăng nồng độ canxi nội bào cơ trơn và co mạch và một số tác động inotropic dương tính (tăng khả năng co bóp của tâm thất).
Làm thế nào các bác sĩ lâm sàng nên bắt đầu sớm norepinephrine trong sốc là không chắc chắn. Norepinephrine liều thấp sớm có thể hiệu quả hơn so với dùng norepinephrine dùng trễ hơn. Trong một bằng chứng gần đây về RCT [61] (n = 310) của norepinephrine liều thấp so với giả dược, kết quả chính (kiểm soát sốc: MAP> 65 mmHg cộng với lượng nước tiểu > 0,5 ml / kg / giờ hoặc giảm 10% lactate) đạt được thường xuyên hơn (76,1% so với 48,4%) và tỷ lệ tử vong thấp hơn (15,5% so với 21,9%, p = 0,15) ở nhóm norepinephrine sớm. Phù phổi do tim và rối loạn nhịp tim mới khởi phát đã giảm một nửa với nhóm dùng norepinephrine sớm. Norepinephrine sớm có thể có hiệu quả bằng cách giảm tổn thương cơ quan, liều norepinephrine và / hoặc hiệu quả miễn dịch của norepinephrine [36] (Hình 1). Cần thêm RCT của norepinephrine sớm. Tỷ lệ các tác dụng phụ của Norepinephrine (10 – 15%) ít hơn đáng kể so với dopamine [48] và tương tự như vasopressin [12, 15] cũng như epinephrine [37, 47].
Epinephrine
Epinephrine là một thuốc vận mạch được lựa chọn thứ hai trong sốc nhiễm trùng [3] (khuyến cáo yếu, bằng chứng thấp) [3, 37, 62] ở những bệnh nhân không đáp ứng với norepinephrine. Epinephrine có nhiều tác động đồng vận lên thụ thể beta-1 hơn norepinephrine. Mặc dù các RCT epinephrine có thể so sánh với norepinephrine [37], với norepinephrine cộng với dobutamine [47], và với norepinephrine kết hợp vasopressin [63], epinephrine không phải là thuốc vận mạch đầu tay vì tăng nguy cơ gây co mạch tạng, rối loạn nhịp nhanh, tăng lactate máu [37, 47]. Epinephrine có thể là thuốc vận mạch đầu tay ở các quốc gia nơi norepinephrine quá tốn kém [64], vì epinephrine ít tốn kém hơn và có hiệu quả tương đương trong phân tích tổng hợp [62].
Phenylephrine
Phenylephrine là một chất chủ vận α1 gần như tinh khiết thường được sử dụng ngắn hạn để điều trị hạ huyết áp sâu thoáng qua. Phenylephrine có thể gây nhịp tim chậm phản xạ qua trung gian baroreceptor (do co mạch do α1 gây ra) và thiếu máu cục bộ tạng do đó không được khuyến cáo để hồi sức sốc nhiễm trùng [3]. Phenylephrine có thể kém hiệu quả hơn trong thực tế so với norepinephrine dựa trên một thí nghiệm tự nhiên phát sinh từ sự thiếu hụt norepinephrine quốc gia gần đây của Hoa Kỳ [65]. Phenylephrine là thuốc vận mạch được sử dụng phổ biến nhất trong thời gian thiếu norepinephrine và sử dụng phenylephrine có liên quan đến tỷ lệ tử vong cao hơn so với sử dụng norepinephrine [65], nhưng đây là một thí nghiệm bằng chứng thấp không ngẫu nhiên, không mù.
Dopamine
Dopamine trước đây là thuốc vận mạch đầu tay trong sốc nhiễm trùng, nhưng dopamine, tỷ lệ biến cố bất lợi lớn hơn (nhịp tim cao hơn và rối loạn nhịp tim nhanh nhiều hơn) so với norepinephrine [48] cần thiết sử dụng ở những bệnh nhân nhịp tim chậm được lựa chọn cao [3]. Dopamine gắn với các thụ thể α1 và beta-1 và các thụ thể dopaminergic DA1 và DA2, sau đó gây ra sự giãn mạch thận và tạng ở liều thấp trong các thử nghiệm tiền lâm sàng và nhỏ (thử nghiệm dopamine thấp). Tuy nhiên, RCT bằng chứng mạnh mẽ trên bệnh nhân bị bệnh nặng không tìm thấy lợi ích của dopamine liều thấp so với giả dược về tỷ lệ thay thế thận, chức năng thận hoặc tử vong [48].
Vasopressin, terlipressin, and selepressin
Vasopressin được khuyên dùng [3] như một thuốc vận mạch thứ hai trong sốc nhiễm trùng. Vasopressin kích thích AVPR1a (gây co mạch), AVPR1b (kích thích giải phóng ACTH) và thụ thể AVPR2 (tác dụng chống lợi tiểu) và tăng tổng hợp NO [66], hạn chế co mạch và bảo tồn tưới máu thận [67], nhưng góp phần mạnh mẽ gây ức chế tim. Nồng độ vasopressin trong huyết tương thấp sớm trong sốc nhiễm trùng. Truyền Vasopressin làm giảm nhu cầu norepinephrine, duy trì huyết áp và tăng lượng nước tiểu trong các thử nghiệm nhỏ [68 – 70].
Một RCT lớn của vasopressin so với norepinephrine (VASST) không tìm thấy sự khác biệt về tỷ lệ tử vong trong sốc nhiễm trùng [71]. Phân tích tổng hợp mức độ cá nhân của bệnh nhân cho thấy không có sự khác biệt về chức năng thận (kết cuộc chính) hoặc tỷ lệ tử vong của vasopressin so với norepinephrine [72]. Một tương tác vasopressin / corticosteroid – Vasopressin kích thích AVPR1b gây tăng tiết ACTH có thể có lợi. Tuy nhiên, tương tác vasopressin / corticosteroid trong sốc nhiễm trùng [73] không được xác nhận là có lợi trong RCT then chốt (VANISH) [15]. Vasopressin cải thiện chức năng thận nhiều hơn norepinephrine trong VASST [74] và giảm đáng kể việc sử dụng liệu pháp thay thế thận (RRT) trong VANISH [15, 72].
Đối với bác sĩ lâm sàng, tác dụng phụ của vasopressin, tương tự như norepinephrine trong thực tế [75] như trong các RCT [15, 74]. Norepinephrine nên được giảm liều trước khi vasopressin vì giảm liều vasopressin trước làm tăng sự mất ổn định huyết động trong VASST [12)] và trong các nghiên cứu sau [76]. Terlipressin có hoạt tính AVPR1a nhiều hơn vasopressin, và các tác dụng tương tự và tỷ lệ tử vong tương tự trong các RCT gần đây [43, 44].Trong các nghiên cứu tiền lâm sàng, các thuốc đồng vận AVPR1a thuần túy đã làm giảm khả năng thấm của mao mạch trong sốc nhiễm trùng tốt hơn vasopressin và điều đó đã dẫn đến sự phát triển của thuốc selepressin. Selepressin giảm phù phổi và cân bằng chất dịch nhiều hơn vasopressin trong các mô hình viêm phúc mạc [77] và viêm phổi [78]. Trên lâm sàng có liên quan hơn, selepressin làm giảm sự cân bằng dịch ròng và một số dấu hiệu sớm của tổn thương nội tạng trong RCT giai đoạn 2 trong sốc nhiễm trùng [21]. RCT selepressin so với giả dược giai đoạn 2B / 3 trong sốc nhiễm trùng không tìm thấy sự khác biệt giữa các nhóm ở kết cuộc chính, ngày không thở máy và dùng thuốc vận mạch, không có sự khác biệt giữa các nhóm trong bất kỳ kết cuộc chính hoặc biến cố bất lợi nào vì vậy selepressin không có sẵn sàng sử dụng trên lâm sàng [45].
Angiotensin ii
Angiotensin II, hệ renin-angiotensin vận mạch, có sẵn trên lâm sàng để điều trị giãn mạch gây hạ huyết áp và có thể hữu ích cho hồi sức ban đầu của bệnh nhân tụt huyết áp sâu. Angiotensin II gắn với thụ thể angiotensin-1 và -2 (AGTR1, AGTR2) gây co mạch, tổng hợp aldosterone, và phóng thích vasopressin. AGTR1 được điều chỉnh xuống trong các mô hình nhiễm trùng huyết làm giảm sự không nhạy cảm của angiotensin II [16, 79]. Angiotensin II tăng nhanh MAP hơn 3 giờ trong RCT do ATHOS-3 đối chứng giả dược trong sốc giãn mạch kháng trị [80]. RCT lớn hơn lực mạnh hơn cho rối loạn chức năng nội tạng và tử vong hiện đang rất cần thiết. Tác dụng phụ nghiêm trọng của angiotensin II (Bảng 4) trong ATHOS 3 bao gồm thiếu máu cục bộ (đầu chi, đường ruột, cơ tim) và rối loạn nhịp tim [16].
Metaraminol
Metaraminol, chất chủ vận chủ yếu lên thụ thể α1 kích thích giải phóng norepinephrine, được sử dụng cho các biến chứng của gây mê nhưng hiếm khi được sử dụng trong sốc và có tác dụng huyết động tương tự như norepinephrine nhưng không có RCT nghiên cứu về metaraminol.
Methylene blue
Methylene blue, một chất ức chế GMP vòng, ức chế guanylate cyclase để ức chế sự thư giãn cơ trơn bằng NO và có thể làm giảm rò rỉ mạch máu phổi. Methylene xanh làm tăng MAP và giảm nhu cầu norepinephrine trong hạ huyết áp kháng trị sau phẫu thuật bắc cầu tim phổi và sốc nhiễm trùng. Không có RCT về methylen blue, giới hạn các khuyến cáo cho việc sử dụng nó trong sốc nhiễm trùng [81].
Corticosteroids
Corticosteroid liều thấp luôn làm giảm nhu cầu norepinephrine trong sốc nhiễm trùng ở RCT và được khuyến cáo ở những bệnh nhân không đáp ứng với norepinephrine [3]. Corticosteroid đảo ngược suy yếu tuyến thượng thận liên quan đến nhiễm trùng huyết và giảm nhẹ phản ứng viêm của sốc nhiễm trùng.
Tuy nhiên, corticosteroid vẫn còn gây tranh cãi vì kết quả mâu thuẫn của ít nhất bốn RCT lớn, hai lợi ích tìm thấy và hai không tìm thấy ảnh hưởng đến tỷ lệ tử vong. Hydrocortison cộng với fludrocortisone làm giảm đáng kể tỷ lệ tử vong (35,4% so với 41,0%, p = 0,04) trong một RCT gần đây [17] và RCT trước đó [18], nhưng không phải trong một RCT gần đây [20] (tỷ lệ tử vong: hydrocortisone 27,9% so với giả dược 28,8% %) hoặc RCT cũ hơn [19]. Sự khác biệt về corticosteroid được sử dụng và tiêu chí đầu vào có thể giải thích một phần cho hiện tượng “cân bằng” của các RCT này.
Các thuốc tăng co bóp để bổ sung thuốc vận mạch trong sốc nhiễm trùng
Rối loạn chức năng tâm thất do nhiễm trùng huyết là phổ biến trên lâm sàng và có thể bị trầm trọng hơn do thuốc vận mạch, do đó, thuốc tăng co bóp (dobutamine > milrinone) thường được thêm vào norepinephrine [47] và vasopressin [71, 82] để làm tăng cung lượng tim, nhứng với các tác dụng phụ: tăng nhịp tim, rối loạn nhịp, và tiêu thụ oxy cơ tim. Milrinone là một inotrope / thuốc giãn mạch không adrenergic và là một inotrope tương đương với dobutamine nhưng có tác dụng giãn mạch lớn hơn và do đó ít được khuyên dùng hơn dobutamine [3] nhưng có thể hiệu quả ở những bệnh nhân gần đây có sử dụng thuốc chẹn beta. Levosimendan, một thuốc tăng co bóp không adrenergic dương tính, không có hiệu quả trong RCT trong sốc nhiễm trùng [37, 47]. Nhiều bệnh nhân dùng levosimendan bị rối loạn nhịp tim và một số ít bệnh nhân dùng levosimendan được cai máy thành công khi thở máy [83]. Vì vậy, levosimendan không được khuyến cáo trong sốc nhiễm trùng.
Các dấu ấn sinh học giúp lựa chọn thuốc
Các dấu ấn sinh học dự đoán được sử dụng bởi các bác sĩ lâm sàng để xác định rõ hơn những người đáp ứng với thuốc (ví dụ: hóa trị liệu cho bệnh ung thư) và có khả năng lựa chọn thuốc vận mạch được cá nhân hóa. Một đa kiểu hình nucleotide đơn β2 (SNP) đánh dấu tỷ lệ tử vong tăng và có thể xác định đáp ứng với norepinephrine [24]. Các dấu ấn sinh học dự đoán vasopressin, terlipressin và selepressin là angiopoietin-2 huyết tương, một chất trung gian làm tăng tính thấm [42] (selepressin làm giảm angiopoietin-2 huyết tương), leucyl / cystinyl aminopeptase (là một enzyme xúc tác vasopressin) [26]. Kiểu gen của protein liên quan đến thụ thể angiotensin-II (AGTRAP) có liên quan đến tỷ lệ tử vong của sốc nhiễm trùng và có thể là dấu ấn sinh học cho angiotensin II [25].
Vai trò “mỉa mai” của thuốc chẹn β1 in trong sốc nhiễm trùng và giãn mạch
Các bác sĩ lâm sàng nên biết rằng có một số bệnh nhân bị sốc nhiễm trùng có thể được hưởng lợi tưởng chừng rất “trớ trêu” từ các thuốc chẹn beta-1. Các thuốc đồng vận beta-1 có hiệu lực chronotropic và inotropic khác nhau; dopamine và epinephrine là những tác nhân chronotropic lớn nhất (tăng nhịp tim 15% so với norepinephrine [47, 48, 84]); vasopressin làm giảm nhịp tim 10% [12]. Levosimendan, một chất nhạy cảm với canxi, làm tăng nhịp tim nhiều hơn 10% so với norepinephrine [83].
Bệnh nhân trẻ tuổi thường có nhịp tim nhanh lớn hơn trong sốc nhiễm trùng và nhịp tim nhanh lớn hơn trong giới hạn thời gian làm đầy tâm trương và khối lượng thể tích nhát bóp. Truyền Esmolol làm giảm nhịp tim (30%), cân bằng dịch, lactate, và tử vong, và cải thiện chức năng thận trong một RCT nhỏ (n = 154) mang tính bằng chứng nguyên tắc [85]. Mặc dù phân tích tổng hợp cho thấy hiệu quả dương tính của esmolol [86], esmolol yêu cầu một RCT đủ mạnh để xác định rõ hơn lựa chọn bệnh nhân, an toàn và hiệu quả.
Choáng tim và sốc dãn mạch sau phẫu thuật tim (cvs)
Norepinephrine được khuyên dùng đầu tiên trong sốc tim sau phẫu thuật tim, một số ít người bị sốc giãn mạch đặc trưng bởi hạ huyết áp và kháng trở mạch máu hệ thống thấp [41]. Sốc giãn mạch sau phẫu thuật tim mạch, thường bắt đầu hơn ở những bệnh nhân dùng thuốc chẹn beta hoặc thuốc ức chế men chuyển angiotensin trước khi phẫu thuật. Nếu hạ huyết áp vẫn tồn tại sau khi hồi sức đủ thể tích, thì norepinephrine được thêm vào, thường tăng MAP mà không bị suy giảm chức năng thận [87]. Nhắm mục tiêu MAP cao hơn (70 – 80 mmHg so với 40 – 50 mmHg) trong quá trình phẫu thuật bắc cầu tim phổi bằng cách truyền liều cao hơn norepinephrine không làm giảm tỷ lệ nhồi máu não trong RCT được thiết kế tốt [88].
Có một sự thiếu hụt tương đối vasopressin sau phẫu thuật tim mạch và lợi ích của việc truyền vasopressin. Tuy nhiên, các thử nghiệm trước đây của vasopressin so với norepinephrine sau phẫu thuật tim mạch đã được không đủ lực thống kê [89 – 94]. Trong một RCT ẩn đơn trung tâm về noradrenaline là nhóm chứng (VANCS n = 300) ở Brazil trong sốc giãn mạch sau phẫu thuật tim [41], vasopressin đã giảm kết cuộc chính (tử vong hoặc biến chứng nặng), tiết kiệm norepinephrine, trong khi rút ngắn thời gian nằm ICU, giảm tỷ lệ rung nhĩ, tổn thương thận cấp tính và RRT. Không có sự khác biệt trong tỷ lệ tử vong trong 28 ngày.
Vasopressin có lợi trong sốc dan mạch máu sau phẫu thuật tim mạch [95] nhưng không phải là sốc nhiễm trùng [15, 71] có lẽ vì các kết cục chính khác nhau: tử vong và biến chứng nặng nề [41] so với tử vong 28 ngày [71]. Tỷ lệ tử vong cao (15,9 và 15,4% sau 28 ngày norepinephrine so với vasopressin) trong VANCS [95] nhưng không được báo cáo trong RCT vasopressin trước đó trong sốc dãn mạch sau phẫu thuật tim mạch [89, 91, 92, 94].
Choáng tim và sốc dãn mạch sau nhồi máu cơ tim cấp (ami)
Norepinephrine cũng được khuyên dùng đầu tiên trong các hướng dẫn quốc tế sốc tim sau AMI [96, 97] bởi vì một RCT gần đây đã phát hiện ra rằng epinephrine dẫn đến sốc kháng trị nhiều hơn so với norepinephrine trong sốc tim thuần túy sau AMI [98]. Hạ huyết áp và sức cản mạch máu hệ thống thấp đặc trưng cho sốc dãn mạch sau AMI. Dopamine không được khuyến cáo trong sốc tim vì tác dụng chronotropic lớn hơn norepinephrine [48].
Choáng mất máu và giảm thể tích
Thuốc co mạch được khuyến cáo trong sốc mất máu đe dọa tính mạng nếu MAP và tưới máu không thể được duy trì bằng hồi sức truyền dịch [99]. Hướng dẫn chấn thương ở châu Âu khuyến cáo hạ huyết áp cho phép (MAP 50 – 60 mmHg) và truyền dịch hạn chế cho đến khi chảy máu lớn được kiểm soát [100] và thuốc vận mạch sẽ cho khi hạ huyết áp đe dọa tính mạng nếu hồi sức thể tích không đạt được MAP đích (mức độ chứng cứ 1C) [100]. Thuốc co mạch có thể hạn chế tình trạng quá tải dịch, phù não và ARDS trong sốc mất máu. Trong một RCT nhỏ mù (n = 78) trong chấn thương, vasopressin có liên quan đến cân bằng dịch thấp hơn và tỷ lệ tử vong thấp hơn (13% so với 25%, p = 0,19).
Các nghi vấn và hướng nghiên cứu trong tương lai
Các câu hỏi trên lâm sàng liên quan đến việc sử dụng thuốc vận mạch ngày nay trong sốc bao gồm liệu sử dụng một số thuốc vận mạch có gắn các thụ thể bổ sung an toàn và hiệu quả hơn so với một thuốc vận mạch, cách dự đoán đáp ứng như thế nào bằng cách sử dụng dấu ấn sinh học, khi nào và làm thế nào để hồi sức, cách lựa chọn bệnh nhân cho điều trị inotropic, và chọn ai cho việc sử dụng ức chế β1. Nghiên cứu trong tương lai cũng nên tập trung vào khám phá và xác nhận các dấu ấn sinh học dự đoán đáp ứng với thuốc vận mạch. Giai đoạn xuống thang hồi sức để hạn chế độc tính thuốc vận mạch tích lũy đáng được chú ý [101].
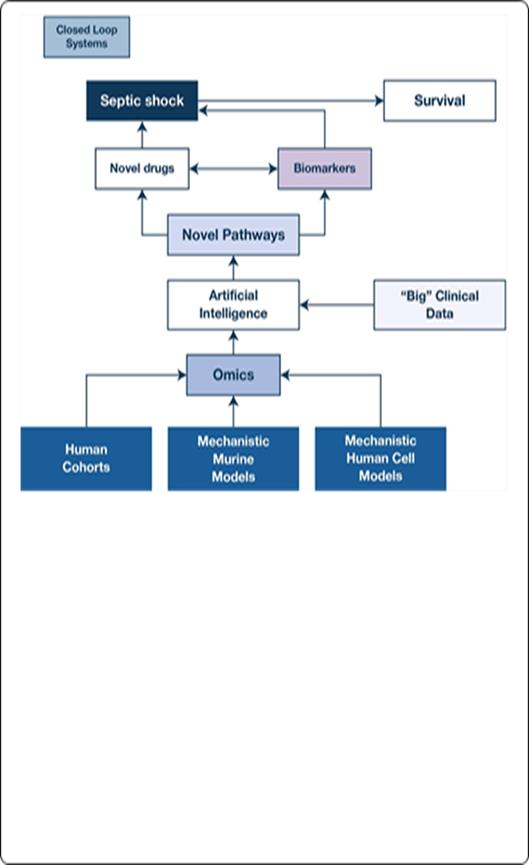 |
Hình 4 Một sự thay đổi mô hình trong nghiên cứu kết hợp các phương pháp sinh học và tính toán bổ sung sẽ là cần thiết để tiếp tục tăng tỷ lệ sống sót của nhiễm trùng và các loại sốc khác. Các đoàn hệ người, mô hình cơ chế trên chuột và mô hình tế bào người sẽ được sử dụng để đo lường và xác nhận đa omics (genomics, proteomics, chuyển hóa, lipidomics) sẽ được kết hợp với dữ liệu lâm sàng nhân tạo lớn trong hệ thống trí tuệ nhân tạo về nhiễm trùng máu và các hình thức sốc khác. Những con đường mới này sẽ được xem xét kỹ lưỡng để khám phá ra thuốc vận mạch mới và dấu ấn sinh học dự đoán để điều trị nhiễm trùng và các dạng sốc khác. Hệ thống vòng kín cũng sẽ được tối ưu hóa để theo dõi quá trình oxy hóa mô trong và sau khi hồi sức. Sự kết hợp giữa y học cá nhân, trí thông minh nhân tạo, dữ liệu lớn, hệ thống vòng kín và thuốc vận mạch mới có thể tạo điều kiện cho thuốc vận mạch hiệu quả hơn sử dụng tăng khả năng sống sót |
Kết luận và các khuyến cáo
Thuốc co mạch gắn với các thụ thể cụ thể gây co mạch nhưng thường có tác dụng phụ. Trong thực tế, chúng tôi khuyên dùng norepinephrine là thuốc vận mạch lựa chọn đầu tay trong sốc nhiễm trùng và giãn mạch sau khi hồi sức đủ thể tích. Ở những bệnh nhân kháng trịvới norepinephrine, vasopressin hoặc epinephrine có thể được thêm vào. Angiotensin II có thể hữu ích cho việc hồi sức sớm cho bệnh nhân hạ huyết áp sâu. Thuốc co mạch có thể làm giảm sự co bóp của tâm thất, do đó có thể thêm một thuốc tăng co bóp (dobutamine > milrinone). Esmolol có thể hữu ích ở những bệnh nhân trẻ tuổi được chọn lọc với nhịp tim nhanh đặc trưng. Hơn nữa, y học cá thể hóa sử dụng các dấu ấn sinh học có từ các ngành sinh học hệ thống, trí thông minh nhân tạo có nguồn gốc từ dữ liệu lớn, các hệ thống vòng kín theo dõi oxy hóa mô và thuốc vận mạch mới có thể tạo điều kiện cho thuốc vận mạch hiệu quả hơn giúp tăng tỷ lệ sống sót (Hình 4).
Electronic supplementary material
The online version of this article (https ://doi.org/10.1007/s0013 4-01905801 -z) contains supplementary material, which is available to authorized users.
Compliance with ethical standards
Conflicts of interest
Dr. Russell reports patents owned by the University of British Columbia (UBC) that are related to the use of PCSK9 inhibitor(s) in sepsis and related to the use of vasopressin in septic shock. Dr. Russell is an inventor on these patents. Dr. Russell was a founder, Director and shareholder in Cyon Therapeutics Inc. Dr. Russell is a shareholder in Molecular You Corp.Dr.
Russell reports receiving consulting fees in the past 3 years from: (1) Asahi Kesai Pharmaceuticals of America (AKPA) (developing recombinant thrombomodulin in sepsis). (2)
SIB Therapeutics LLC (developing a sepsis drug). (3) Ferring Pharmaceuticals (manufactures vasopressin and developing selepressin). No longer actively consulting for the following: (4) La Jolla Pharmaceuticals (developing angiotensin II; Dr. Russell chaired the DSMB of a trial of angiotensin II from 2015 to 2017)—no longer actively consulting. (5) Grifols (sells albumin)—no longer actively consulting. PAR Pharma (sells prepared bags of vasopressin)—no longer actively consulting.Dr. Russell reports having received an investigator-initiated grant from Grifols (entitled “Is HBP a mechanism of albumin’s efficacy in human septic shock?”) that was provided to and administered by UBC.
Publisher’s note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Received: 19 July 2019 Accepted: 24 September 2019
References
Annane D, Ouanes-Besbes L, de Backer D, Du B, Gordon AC, Hernandez G et al (2018) A global perspective on vasoactive agents in shock. Intensive Care Med 44(6):833–846
Perner A, Gordon AC, Angus DC, Lamontagne F, Machado F, Russell JA et al (2017) The intensive care medicine research agenda on septic shock. Intensive Care Med 43(9):1294–1305
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R et al (2017) Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit Care Med 45(3):486–552
de Grooth HJ, Postema J, Loer SA, Parienti JJ, Oudemans-van Straaten HM, Girbes AR (2018) Unexplained mortality differences between septic shock trials: a systematic analysis of population characteristics and control-group mortality rates. Intensive Care Med 44(3):311–322
Russell JA (2014) Is there a good MAP for septic shock? N Engl J Med 370(17):1649–1651
Vail EA, Gershengorn HB, Hua M, Walkey AJ, Wunsch H (2016) Epidemiology of vasopressin use for adults with septic shock. Ann Am Thorac Soc 13(10):1760–1767
Russell JA (2019) Shock syndromes related to sepsis. In: Chapter 100 in 26th edition Goldman-Cecil Textbook of Medicine (in press)
Asfar P, Teboul JL, Radermacher P (2014) High versus low bloodpressure target in septic shock. N Engl J Med 371(3):283–284
Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B et al (2001) Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 345(19):1368–1377
Angus DC (2017) Early, goal-directed therapy for septic shock—a patient-level meta-analysis. N Engl J Med 377(10):995
Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M et al (2016) The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA 315(8):801–810
Russell JA, Walley KR, Singer J, Gordon AC, Hebert PC, Cooper DJ et al (2008) Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 358(9):877–887
Russell JA, Lee T, Singer J, Boyd JH, Walley KR et al (2017) The septic shock 3.0 definition and trials: a vasopressin and septic shock trial experience. Crit Care Med 45(6):940–948
Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A et al (2016) Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (sepsis- 3). JAMA 315(8):762–774
Gordon AC, Mason AJ, Thirunavukkarasu N, Perkins GD, Cecconi M, Cepkova M et al (2016) Effect of early vasopressin vs norepinephrine on kidney failure in patients with septic shock: the VANISH randomized clinical trial. JAMA 316(5):509–518
Khanna A, English SW, Wang XS, Ham K, Tumlin J, Szerlip H et al (2017) Angiotensin II for the treatment of vasodilatory shock. N Engl J Med 377(5):419–430
Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot JP, Siami S et al (2018) Hydrocortisone plus fludrocortisone for adults with septic shock. N Engl J Med 378(9):809–818
Annane D, Sebille V, Charpentier C, Bollaert PE, Francois B, Korach JM et al (2002) Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA 288(7):862–871
Sprung CL, Annane D, Keh D, Moreno R, Singer M, Freivogel K et al (2008) Hydrocortisone therapy for patients with septic shock. N Engl J Med 358(2):111–124
Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R et al (2018) Adjunctive glucocorticoid therapy in patients with septic shock. N Engl J Med 378(9):797–808
Russell JA, Vincent JL, Kjolbye AL, Olsson H, Blemings A, Spapen H et al (2017) Selepressin, a novel selective vasopressin V1A agonist, is an effective substitute for norepinephrine in a phase IIa randomized, placebo-controlled trial in septic shock patients. Crit Care 21(1):213
Angus DC, van der Poll T (2013) Severe sepsis and septic shock. N Engl J Med 369(21):2063
Bucher M, Kees F, Taeger K, Kurtz A (2003) Cytokines down-regulate alpha1-adrenergic receptor expression during endotoxemia. Crit Care Med 31(2):566–571
Nakada TA, Russell JA, Boyd JH, Aguirre-Hernandez R, Thain KR, Thair SA et al (2010) Beta2-adrenergic receptor gene polymorphism is associated with mortality in septic shock. Am J Respir Crit Care Med 181(2):143–149
Nakada TA, Russell JA, Boyd JH, McLaughlin L, Nakada E, Thair SA et al (2011) Association of angiotensin II type 1 receptor-associated protein gene polymorphism with increased mortality in septic shock. Crit Care Med 39(7):1641–1648
Nakada TA, Russell JA, Wellman H, Boyd JH, Nakada E, Thain KR et al (2011) Leucyl/cystinyl aminopeptidase gene variants in septic shock. Chest 139(5):1042–1049
Lopez A, Lorente JA, Steingrub J, Bakker J, McLuckie A, Willatts S et al (2004) Multiple-center, randomized, placebo-controlled, doubleblind study of the nitric oxide synthase inhibitor 546C88: effect on survival in patients with septic shock. Crit Care Med 32(1):21–30
Moncada S, Higgs A (1993) The l-arginine-nitric oxide pathway. N Engl J Med 329(27):2002–2012
Bernard GR, Wheeler AP, Russell JA, Schein R, Summer WR, Steinberg KP et al (1997) The effects of ibuprofen on the physiology and survival of patients with sepsis. The ibuprofen in sepsis study group. N Engl J Med 336(13):912–918
Wagner K, Wachter U, Vogt JA, Scheuerle A, McCook O, Weber S et al (2013) Adrenomedullin binding improves catecholamine responsiveness and kidney function in resuscitated murine septic shock. Intensive Care Med Exp 1(1):21
Kanji HD, McCallum J, Sirounis D, MacRedmond R, Moss R, Boyd JH (2014) Limited echocardiography-guided therapy in subacute shock is associated with change in management and improved outcomes. J Crit Care 29(5):700–705
Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S et al (2006) Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 34(6):1589–1596
Seymour CW, Gesten F, Prescott HC, Friedrich ME, Iwashyna TJ, Phillips GS et al (2017) Time to treatment and mortality during mandated emergency care for sepsis. N Engl J Med 376(23):2235–2244
Komorowski M, Celi LA, Badawi O, Gordon AC, Faisal AA (2018) The artificial intelligence clinician learns optimal treatment strategies for sepsis in intensive care. Nat Med 24(11):1716–1720
Udy AA, Finnis M, Jones D, Delaney A, Macdonald S, Bellomo R et al (2018) Incidence, patient characteristics, mode of drug delivery, and outcomes of septic shock patients treated with vasopressors in the arise trial. Shock 52(4):400–407
Stolk RF, van der Poll T, Angus DC, van der Hoeven JG, Pickkers P, Kox M (2016) Potentially inadvertent immunomodulation: norepinephrine use in sepsis. Am J Respir Crit Care Med 194(5):550–558
Myburgh JA, Higgins A, Jovanovska A, Lipman J, Ramakrishnan N, Santamaria J et al (2008) A comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med 34(12):2226–2234
Van den Berghe G, de Zegher F (1996) Anterior pituitary function during critical illness and dopamine treatment. Crit Care Med 24(9):1580–1590
Matt SM, Gaskill PJ (2019) Where is dopamine and how do immune cells see it?: dopamine-mediated immune cell function in health and disease. J Neuroimmune Pharmacol. https ://doi.org/10.1007/s1148 1-019-09851 -4
Russell JA, Walley KR (2010) Vasopressin and its immune effects in septic shock. J Innate Immun 2(5):446–460
Hajjar LA, Vincent JL, Barbosa Gomes Galas FR, Rhodes A, Landoni G, Osawa EA et al (2017) Vasopressin versus norepinephrine in patients with vasoplegic shock after cardiac surgery: the VANCS randomized controlled trial. Anesthesiology 126(1):85–93
Fisher J, Douglas JJ, Linder A, Boyd JH, Walley KR, Russell JA (2016) Elevated plasma angiopoietin-2 levels are associated with fluid overload, organ dysfunction, and mortality in human septic shock. Crit Care Med 44(11):2018–2027
Morelli A, Ertmer C, Rehberg S, Lange M, Orecchioni A, Cecchini V et al (2009) Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): a randomized, controlled pilot study. Crit Care 13(4):R130
Liu ZM, Chen J, Kou Q, Lin Q, Huang X, Tang Z et al (2018) Terlipressin versus norepinephrine as infusion in patients with septic shock: a multicentre, randomised, double-blinded trial. Intensive Care Med 44(11):1816–1825
Laterre PF, Berry SM, Blemings A, Carlsen JE, Francois B, Graves T et al (2019) Effect of selepressin vs placebo on ventilator-and vasopressorfree days in patients with septic shock: The SEPSIS-ACT randomized clinical trial. JAMA. https ://doi.org/10.1001/jama.2019.14607
Kirov MY, Evgenov OV, Evgenov NV, Egorina EM, Sovershaev MA, Sveinbjornsson B et al (2001) Infusion of methylene blue in human septic shock: a pilot, randomized, controlled study. Crit Care Med 29(10):1860–1867
Annane D, Vignon P, Renault A, Bollaert PE, Charpentier C, Martin C et al (2007) Norepinephrine plus dobutamine versus epinephrine alone for management of septic shock: a randomised trial. Lancet 370(9588):676–684
De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C et al (2010) Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med 362(9):779–789
Russell JA, Wellman H, Walley KR (2018) Vasopressin versus norepinephrine in septic shock: a propensity score matched efficiency retrospective cohort study in the VASST coordinating center hospital. J Intensive Care 6:73
Hammond DA, Ficek OA, Painter JT, McCain K, Cullen J, Brotherton AL et al (2018) Prospective open-label trial of early concomitant vasopressin and norepinephrine therapy versus initial norepinephrine monotherapy in septic shock. Pharmacotherapy 38(5):531–538
Cheng L, Yan J, Han S, Chen Q, Chen M, Jiang H et al (2019) Comparative efficacy of vasoactive medications in patients with septic shock: a network meta-analysis of randomized controlled trials. Crit Care 23(1):168
Asfar P, Meziani F, Hamel JF, Grelon F, Megarbane B, Anguel N et al (2014) High versus low blood-pressure target in patients with septic shock. N Engl J Med 370(17):1583–1593
Walkey AJ, Wiener RS, Ghobrial JM, Curtis LH, Benjamin EJ (2011) Incident stroke and mortality associated with new-onset atrial fibrillation in patients hospitalized with severe sepsis. JAMA 306(20):2248–2254
Dargent A, Nguyen M, Fournel I, Bourredjem A, Charles PE, Quenot JP et al (2018) Vasopressor cumulative dose requirement and risk of early death during septic shock: an analysis from the EPISS cohort. Shock 49(6):625–630
Russell JA, Fjell C, Hsu JL, Lee T, Boyd J, Thair S et al (2013) Vasopressin compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med 188(3):356–364
Dunser MW, Bouvet O, Knotzer H, Arulkumaran N, Hajjar LA, Ulmer H et al (2018) Vasopressin in cardiac surgery: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth 32(5):2225–2232
Hernandez G, Ospina-Tascon GA, Damiani LP, Estenssoro E, Dubin A, Hurtado J et al (2019) Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: the ANDROMEDA-SHOCK randomized clinical trial. JAMA 321(7):654–664
Wu M, Ghassemi M, Feng M, Celi LA, Szolovits P, Doshi-Velez F (2017) Understanding vasopressor intervention and weaning: risk prediction in a public heterogeneous clinical time series database. J Am Med Inform Assoc 24(3):488–495
Kaukonen KM, Bailey M, Suzuki S, Pilcher D, Bellomo R (2014) Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000–2012. JAMA 311(13):1308–1316
Linder A, Lee T, Fisher J, Singer J, Boyd J, Walley KR et al (2016) Shortterm organ dysfunction is associated with long-term (10-year) mortality of septic shock. Crit Care Med 44(8):e728–e736
Permpikul C, Tongyoo S, Viarasilpa T, Trainarongsakul T, Chakorn T, Udompanturak S (2019) Early use of norepinephrine in septic shock resuscitation (CENSER). A randomized trial. Am J Respir Crit Care Med 199(9):1097–1105
Avni T, Lador A, Lev S, Leibovici L, Paul M, Grossman A (2015) Vasopressors for the treatment of septic shock: systematic review and metaanalysis. PLoS One 10(8):e0129305
Menich BE, Miano TA, Patel GP, Hammond DA (2019) Norepinephrine and vasopressin compared with norepinephrine and epinephrine in adults with septic shock. Ann Pharmacother. https ://doi. org/10.1177/10600 28019 84366 4
Dunser MW, Festic E, Dondorp A, Kissoon N, Ganbat T, Kwizera A et al (2012) Recommendations for sepsis management in resource-limited settings. Intensive Care Med 38(4):557–574
Vail E, Gershengorn HB, Hua M, Walkey AJ, Rubenfeld G, Wunsch H (2017) Association between US norepinephrine shortage and mortality among patients with septic shock. JAMA 317(14):1433–1442
Yamamoto K, Ikeda U, Okada K, Saito T, Kawahara Y, Okuda M et al (1997) Arginine vasopressin increases nitric oxide synthesis in cytokinestimulated rat cardiac myocytes. Hypertension 30(5):1112– 1120
Rudichenko VM, Beierwaltes WH (1995) Arginine vasopressin-induced renal vasodilation mediated by nitric oxide. J Vasc Res 32(2):100–105
Holmes CL, Walley KR, Chittock DR, Lehman T, Russell JA (2001) The effects of vasopressin on hemodynamics and renal function in severe septic shock: a case series. Intensive Care Med 27(8):1416–1421
Malay MB, Ashton RC Jr, Landry DW, Townsend RN (1999) Low-dose vasopressin in the treatment of vasodilatory septic shock. J Trauma 47(4):699–703 (discussion 5)
Patel BM, Chittock DR, Russell JA, Walley KR (2002) Beneficial effects of short-term vasopressin infusion during severe septic shock. Anesthesiology 96(3):576–582
Russell JA, Walley KR, Singer J, Gordon AC, Hebert PC, Cooper DJ et al (2008) Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 358(9):877–887
Nagendran M, Russell JA, Walley KR, Brett SJ, Perkins GD, Hajjar L et al (2019) Vasopressin in septic shock: an individual patient data metaanalysis of randomised controlled trials. Intensive Care Med 45(6):844–855
Russell JA, Walley KR, Gordon AC, Cooper DJ, Hebert PC, Singer J et al (2009) Interaction of vasopressin infusion, corticosteroid treatment, and mortality of septic shock. Crit Care Med 37(3):811–818
Gordon AC, Russell JA, Walley KR, Singer J, Ayers D, Storms MM et al (2010) The effects of vasopressin on acute kidney injury in septic shock. Intensive Care Med 36(1):83–91
Anantasit N, Boyd JH, Walley KR, Russell JA (2014) Serious adverse events associated with vasopressin and norepinephrine infusion in septic shock. Crit Care Med 42(8):1812–1820
Jeon K, Song JU, Chung CR, Yang JH, Suh GY (2018) Incidence of hypotension according to the discontinuation order of vasopressors in the management of septic shock: a prospective randomized trial (DOVSS). Crit Care 22(1):131
He X, Su F, Taccone FS, Laporte R, Kjolbye AL, Zhang J et al (2016) A selective V(1A) receptor agonist, selepressin, is superior to arginine vasopressin and to norepinephrine in ovine septic shock. Crit Care Med 44(1):23–31
Maybauer MO, Maybauer DM, Enkhbaatar P, Laporte R, Wisniewska H, Traber LD et al (2014) The selective vasopressin type 1a receptor agonist selepressin (FE 202158) blocks vascular leak in ovine severe sepsis*. Crit Care Med 42(7):e525–e533
Chawla LS, Busse L, Brasha-Mitchell E, Davison D, Honiq J, Alotaibi Z et al (2014) Intravenous angiotensin II for the treatment of high-output shock (ATHOS trial): a pilot study. Crit Care 18(5):534
Chawla LS, Russell JA, Bagshaw SM, Shaw AD, Goldstein SL, Fink MP et al (2017) Angiotensin II for the treatment of high-output shock 3 (ATHOS-3): protocol for a phase III, double-blind, randomised controlled trial. Crit Care Resusc 19(1):43–49
Paciullo CA, McMahon Horner D, Hatton KW, Flynn JD (2010) Methylene blue for the treatment of septic shock. Pharmacotherapy 30(7):702–715
Gordon AC, Wang N, Walley KR, Ashby D, Russell JA (2012) The cardiopulmonary effects of vasopressin compared with norepinephrine in septic shock. Chest 142(3):593–605
Gordon AC, Perkins GD, Singer M, McAuley DF, Orme RM, Santhakumaran S et al (2016) Levosimendan for the prevention of acute organ dysfunction in sepsis. N Engl J Med 375(17):1638–1648
De Backer D, Creteur J, Silva E, Vincent JL (2003) Effects of dopamine, norepinephrine, and epinephrine on the splanchnic circulation in septic shock: which is best? Crit Care Med 31(6):1659–1667
Morelli A, Ertmer C, Westphal M, Rehberg S, Kampmeier T, Ligges S et al (2013) Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. JAMA 310(16):1683–1691
Liu P, Wu Q, Tang Y, Zhou Z, Feng M (2018) The influence of esmolol on septic shock and sepsis: a meta-analysis of randomized controlled studies. Am J Emerg Med 36(3):470–474
Morimatsu H, Uchino S, Chung J, Bellomo R, Raman J, Buxton B (2003) Norepinephrine for hypotensive vasodilatation after cardiac surgery: impact on renal function. Intensive Care Med 29(7):1106–1112
Vedel AG, Holmgaard F, Rasmussen LS, Langkilde A, Paulson OB, Lange T et al (2018) High-target versus low-target blood pressure management during cardiopulmonary bypass to prevent cerebral injury in cardiac surgery patients: a randomized controlled trial. Circulation 137(17):1770–1780
Argenziano M, Chen JM, Choudhri AF, Cullinane S, Garfein E, Weinberg AD et al (1998) Management of vasodilatory shock after cardiac surgery: identification of predisposing factors and use of a novel pressor agent. J Thorac Cardiovasc Surg 116(6):973–980
Argenziano M, Chen JM, Cullinane S, Choudhri AF, Rose EA, Smith CR et al (1999) Arginine vasopressin in the management of vasodilatory hypotension after cardiac transplantation. J Heart Lung Transplant 18(8):814–817
Morales DL, Gregg D, Helman DN, Williams MR, Naka Y, Landry DW et al (2000) Arginine vasopressin in the treatment of 50 patients with postcardiotomy vasodilatory shock. Ann Thorac Surg 69(1):102–106
Morales DL, Garrido MJ, Madigan JD, Helman DN, Faber J, Williams MR et al (2003) A double-blind randomized trial: prophylactic vasopressin reduces hypotension after cardiopulmonary bypass. Ann Thorac Surg 75(3):926–930
Rosenzweig EB, Starc TJ, Chen JM, Cullinane S, Timchak DM, Gersony WM et al (1999) Intravenous arginine-vasopressin in children with vasodilatory shock after cardiac surgery. Circulation 100(19 Suppl):II182–II186
Yimin H, Xiaoyu L, Yuping H, Weiyan L, Ning L (2013) The effect of vasopressin on the hemodynamics in CABG patients. J Cardiothorac Surg 8:49
Hajjar AM, Vincent JL, Galas FRBG, Rhodes A, Landonni G, Osawa EA et al (2016) Vasopressin versus norepinephrine in patients with vasoplegic shock after cardiac surgery: the VANCSS randomized controlled trial. Anesthesiology 126(1):85–93
Moller MH, Granholm A, Junttila E, Haney M, Oscarsson-Tibblin A, Haavind A et al (2018) Scandinavian SSAI clinical practice guideline on choice of inotropic agent for patients with acute circulatory failure. Acta Anaesthesiol Scand 62(4):420–450
van Diepen S, Thiele H (2019) An overview of international cardiogenic shock guidelines and application in clinical practice. Curr Opin Crit Care 25:365–370
Levy B, Clere-Jehl R, Legras A, Morichau-Beauchant T, Leone M, Frederique G et al (2018) Epinephrine versus norepinephrine for cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 72(2):173–182
Russell JA, Rush B, Boyd J (2018) Pathophysiology of septic shock. Crit Care Clin 34(1):43–61
Silversides JA, Fitzgerald E, Manickavasagam US, Lapinsky SE, Nisen- baum R, Hemmings N et al (2018) Deresuscitation of patients with iatrogenic fluid overload is associated with reduced mortality in critical
Spahn, Bouillon B, Cerny V, Duranteau J, Filipescu D, Hunt BJ et al (2019)
The European guideline on management of major bleeding and illness.
Crit Care Med 46(10):1600–1607 coagulopathy following trauma: fifth edition.
Crit Care 23(1):98