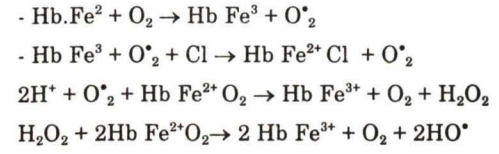Tác dụng có lợi của bạch cầu qua đường truyền máu
Cung cấp tế bào máu cho ghép tuỷ: các tế bào nguồn CD34 có thể thu hoạch được từ máu ngoại vi, từ tuỷ xương, từ máu cuống rốn thai nhi cung cấp cho ghép tuỷ đồng loại.
Có thể truyền bạch cầu trung tính điều trị cho bệnh nhân bị giảm bạch cầu kèm nhiễm trùng nặng, kháng với tất cả kháng sinh.
Hoạt hoá lympho với kháng nguyên ung thư – In – Situ sử dụng truyền lympho mẫn cảm để điều trị bệnh ung thư.
Sản xuất một số cytokin kích thích sinh máu gây viêm và dị ứng.
Tác dụng có hại của bạch cầu qua đường truyền máu
Bạch cầu là tế bào đích của một số virus
Bạch cầu, trước hết là lympho T4 (CD4), đại thực bào là những tế bào đích của HIV. Nếu người cho máu không được sàng lọc kỹ thì khả năng nhiễm HIV do truyền máu là rất cao. Người ta tính, một cá thể nào đó có 1/10000 tế bào bị nhiễm HIV nếu truyền máu này cho người bệnh thì khả năng lây nhiễm là 100%. Ngoài HIV, HTLV cũng là virus có tế bào đích là T lympho. Đây cũng là một đường lây truyền bệnh của HTLV. Các sản phẩm huyết tương cũng là nguồn truyền bệnh của nhiều virus như các virus gây viêm gan, CMV, EBV…
Bạch cầu gây ảnh hưởng xấu đến chất lượng máu bảo quản bởi các nguyên nhân sau đây:
bạch cầu hạt
Đời sống ngắn, trong máu bảo quản 48 – 72 giờ chúng chết và phân huỷ, giải phóng ra nhiều thành phần nội bào hoà tan vào huyết tương tác dụng lên màng hồng cầu làm giảm hiệu lực của hồng cầu nhất là các men của bạch cầu. Mặt khác chúng làm thay đổi pH máu, các chất hoá học trung gian như histamin, serotonin được giải phóng từ bạch cầu toan, tế bào mast có tác dụng gây dị ứng, gây sốc khi truyền máu. Theo dõi túi máu bảo quản đã lọc bạch cầu và không lọc bạch cầu thấy rất rõ các yếu tố này trong thành phần huyết tương.
bạch cầu mono và lympho trong máu bảo quản
Có thể sản xuất ra các cytokin tác hại đến chất lượng của hồng cầu bảo quản và khi truyền máu này cho bệnh nhân gây nhiều phản ứng như sốt, rét run, dị ứng sốc … Nhiều tài liệu nghiên cứu đã chứng minh rằng, đại thực bào và lympho trong máu bảo quản bị hoạt hoá bởi các chất mới sinh trong túi máu bảo quản. Khi được hoạt hoá, chúng sẽ sản xuất ra các cytokin như IL-1, IL-2, IL-6, TNF. Kết quả nghiên cứu của Muylle (1994) về sự có mặt của cytokin nói trên trong túi máu không lọc bạch cầu và túi máu có lọc bạch cầu đã chứng minh cho ý kiến nói trên.
gây phản ứng miễn dịch đồng loài:
Kháng nguyên bạch cầu hệ HLA có thể gây phản ứng dịch chống bạch cầu, làm giảm bạch cầu hạt, giảm tiểu cầu, giảm lympho sau truyền máu.
bạch cầu của đơn vị máu truyền có thể gây bệnh ghép chống chủ
(Graft – Versus – Host – Disease = GVHD).
Cytokin, các chất trung gian và men bạch cầu trong máu bảo quản
Máu bảo quản bao gồm: máu toàn phần, khối hồng cầu nghèo bạch cầu, khối tiểu cầu nghèo bạch cầu, huyết tương giàu tiểu cầu, huyết tương. Các tế bào máu có khả năng tạo cytokin: mono, lympho, bạch cầu trung tính, hoặc tạo ra chất trung gian có hoạt tính sinh lý: bạch cầu hạt trung tính, toan, kiềm, tiểu cầu.
Máu toàn phần, khôi hồng cầu bảo quản ở 4°c, khối tiểu cầu, huyết tương giàu tiểu cầu bảo quản ở 20-22° C lắc liên tục, huyết tương bảo quản ở 35°C hoặc 85°C.
Cytokin trong máu báo quán
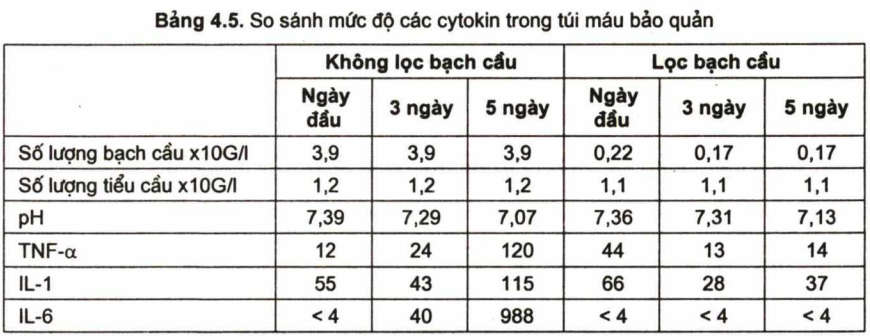
Khi nghiên cứu máu bảo quản, người ta thấy bạch cầu đóng vai trò quan trọng tạo ra các cytokin (2, 4, 11). Kết quả này được công bố đầu tiên bởi Muylle (1994). Tác giả đã tiến hành nghiên cứu so sánh trên hai mẫu: Máu toàn phần không loại bạch cầu, và mẫu máu có lọc bỏ bạch cầu, thấy rằng sau 3-5 ngày mẫu máu không lọc bạch cầu có các cytokin như: TNFa, IL-1, IL-6 tăng lên gấp nhiều lẩn so với mẫu có lọc bạch cầu (bảng 4.5). Sự xuất hiện các cytokin đi song song với giảm pH của máu bảo quản, từ 7,39 xuống tới 7,07, trong khi đó nhóm có lọc bạch cầu pH từ 7,36 xuống 7,12. Rõ ràng, nếu lọc bỏ bạch cầu pH của máu bảo quản được duy trì tốt hơn.
(Theo Muylle 1994)
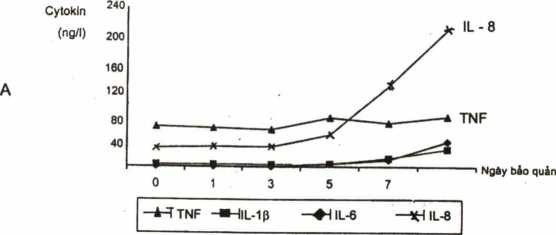
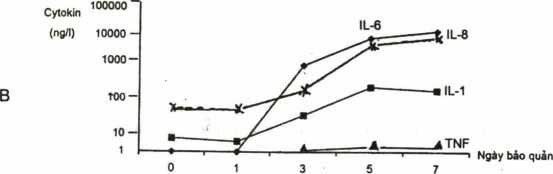
Các nghiên cứu gần đây về bạch cầu trong khối tiểu cầu và huyết tương giàu tiểu cầu bảo quản trong 7 ngày cho thấy các cytokin (TNFa, IL-1, IL-6, IL-8) tăng nhanh sau 2 ngày bảo quản. Mức độ tăng các cytokin phụ thuộc vào số lượng bạch cầu có trong khối tiểu cầu. Nếu số lượng gc 9 trong một đơn vị tiểu cầu thì lượng cytokin rất thấp (H4.3A) trừ IL-8, nếu bạch cầu còn > 6×109 thì các cytokin đểu tăng rất nhanh trong khối tiểu cầu bảo quản (H4.3B) (9, 10).
Hình 4.3. Hàm lượng các cytokin IL-1, IL-6, IL-8, TNF trong khối tiểu cầu bảo quản.
A: Khối tiểu cầu có 3×109 bạch cầu;
B: Khối tiểu cẩu có 6 x 109 bạch cầu;
các chất trung gian trong máu bảo quản
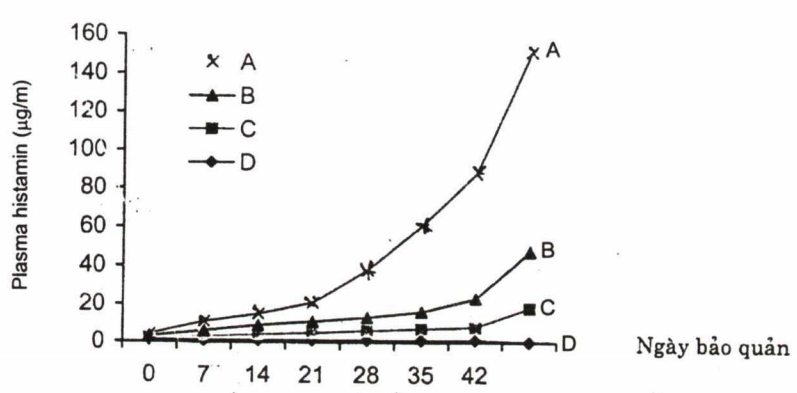
Bên cạnh sự có mặt của các cytokin, các kết quả nghiên cứu còn cho thấy các chất trung gian có hoạt tính sinh lý cũng có mặt trong huyết tương máu bảo quản, mức độ của các chất trung gian như histamin, serotonin phụ thuộc vào số lượng bạch cầu trong máu bảo quản. Nghiên cứu của Muylle (9), so sánh 4 mẫu máu bảo quản. Máu toàn phần (A), máu lọc bạch cầu sơ bộ bằng cách để lắng (B), lọc bạch cầu qua bông có thể loại được khoảng 60% bạch cầu (C), mẫu lọc bạch cầu bằng màng lọc, loại được 95% bạch cầu, cho thấy hàm lượng histamin cao nhất ở mẫu máu toàn phần, thấp nhất ở mẫu lọc bạch cầu bằng màng lọc (H4.4). Kết quả này càng chứng minh bạch cầu đóng vai trò rất quan trọng trong sự có mặt của các cytokin và các chất trung gian có hoạt tính sinh lý trong máu bảo quản (2,10,11,16,17)
Hình 4.4. So sánh sự có mặt của histamin trong máu bảo quản bằng các phương pháp lọc bach cầu khác nhau
A: Không lọc bạch cầu
B: Lọc bằng phương pháp để lắng hoặc ly tâm
C: Lọc bạch cẩu qua bông
D: Lọc bạch cầu qua màng lọc đặc hiệu, loại
Các men bạch cầu trong máu bảo quản
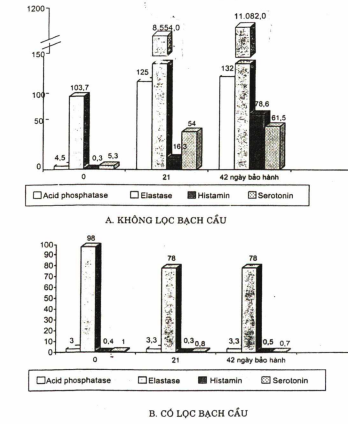
Nghiên cứu máu bảo quản bàng dung dịch CPD-A1 trong 42 ngày cho kết quả rất đáng lưu ý về các men bạch cầu trong máu bảo quản. Bạch cầu đặc biệt là bạch cầu hạt trung tính và mono/đại thực bào có rất nhiều men thuộc nhóm diệt khuẩn, tiêu đạm… do đời sống của bạch cầu trung tính rất ngắn (14 ngày) nên trong máu bảo quản ngay trong tuần đầu bạch cầu hạt đã chết, giải phóng các chết trung gian từ các hạt đặc biệt của bạch cầu vào huyết tương máu bảo quản. Mức độ của các chất này cũng tăng theo thời gian bảo quản, đặc biệt sau ngày 14 (H4.4 và 4.5).
Các kết quả nghiên cứu tại Viện Huyết học – Truyền máu và Bộ môn Hoá sinh Đại học Y Hà Nội cho kết quả tương tự.
Nghiên cứu của bác sĩ Trần Thị Liên về đặc điểm hoá sinh và tế bào máu ở máu bảo quản gồm: máu toàn phần, máu hồng cầu loại bạch cầu bằng ly tâm và khối hồng cầu loại bạch cầu bằng màng lọc cho thấy ở máu toàn phần các men bạch cầu (acid phosphatase, elastase, LDH) tăng rõ rệt sau 2 tuần bảo quản, trong khi khối hồng cầu lọc bạch cầu thì lượng men thấp hơn nhiều – pH duy trì tốt hơn so với mẫu máu toàn phần – các cytokin (TNF, IL-6) cũng thay đổi tương tự (15).
Nghiên cứu của bác sĩ Nguyễn Quang Hoà về phản ứng truyền máu tại lâm sàng cho thấy, truyền máu có giảm bạch cầu thì phản ứng sốt, rét run, mẩn ngứa, dị ứng mề đay giảm đi rất đáng kể, an toàn truyền máu được cải thiện rất rõ rệt (14).
Hình 4.5. So sánh mức độ giải phóng các men bạch cầu và các chất hoá học trung gian,
trong máu không lọc bạch cầu (A) và có lọc bạch cầu (B).
Các cytokin, các chất trung gian và các men bạch cầu xuất hiện trong máu bảo quản 42 ngày có ảnh hưởng gì đến chất lượng của máu bảo quản? Đây là một câu hỏi hết sức quan trọng, góp phần tìm giải pháp bảo đảm an toàn truyền máu tốt hơn.
Như chúng ta biết, các cytokin, các chất trung gian như serotonin, histamin các men bạch cầu như: protease, elastase, phosphatase có lượng rất thấp trong máu, nay trong máu bảo quản tăng lên gấp hàng chục lần, sự tăng này đã gây các tác hại sau đây cho chất lượng máu bảo quản.
Trước hết, do xuất hiện một số men bạch cầu làm pH máu bảo quản giảm pH giảm gầy nhiều bất lợi trong đó có một bất lợi đáng chú ý là tạo điều kiện hình thành các gốc tự do có nhiều tác hại.
Mặt khác men bạch cầu, nhất là protease, các gốc tự do, các cytokin (TNF) tác động lên màng hồng cầu làm thay đổi hình dạng và cấu trúc hoạt động, làm cho hiệu quả trao đổi oxy của hồng cầu sẽ bị ảnh hưởng, chất lượng máu truyền sẽ giảm sút.
Các chất trung gian như serotonin, histamin, prostaglandin…, các cytokin xuất hiện trong huyết tương bảo quản sẽ gây các phản ứng sốt, dị ứng khi truyền máu, nếu nhiều và ở các cá thể nhạy cảm có thể gây giảm huyết áp, sốc.
Ngoài ra, sự có mặt của bạch cầu còn gây nhiều tác hại khác như gây bệnh ghép chống chủ do truyền máu, gây phản ứng miễn dịch đồng loại làm giảm bạch cầu, tiểu cầu sau truyền máu, gây bệnh phổi cấp tính do kháng thể đặc hiệu bạch cầu làm kết dính bạch cầu vi mạch phổi. Sự có mặt của bạch cầu cũng có thể làm lây nhiễm HIV do truyền máu trong giai đoạn cửa sổ không sàng lọc được.
Vì các lý do trên vấn đề tách và chuẩn hoá các thành phần máu, truyền máu từng thành phần, vấn đề loại bỏ bạch cầu bằng ly tâm hoặc lọc bạch cầu là một vấn đề có tính chiến lược trong an toàn truyền máu (19).
Gốc tự do và an toàn truyền máu
Trong 2-3 thập kỷ gần đây, nhờ các tiến bộ về kỹ thuật và do nhu cầu về an toàn truyền máu nhiều nước tiên tiến đã tách được hầu hết các thành phần máu. Nhờ vậy truyền máu an toàn, tiết kiệm. Tuy nhiên một vấn đề lớn đặt ra là để có ngân hàng máu lớn phải bảo quản được dài ngày các sản phẩm máu, đặc biệt là các sản phẩm tế bào như hồng cầu, bạch cầu các loại, tiểu cầu, tế bào gốc sinh máu.
Khó khăn lớn cho việc bảo quản các tế bào máu là chúng đều sống, đều có nhu cầu năng lượng. Như hồng cầu cung cấp ATP cho hoạt động của bơm natri để duy trì nồng độ Na+ và K+ giữa trong và ngoài tế bào, nguồn năng lượng này lấy từ chuyển hoá glucose, hoặc bằng đường glycolyse hoặc bằng đường pentose phosphat. Còn đối với bạch cầu hạt và tiểu cầu, đời sống ngắn, trong thời gian bảo quản chúng cũng cần năng lượng, nhất là tiểu cầu, bạch cầu mono và lympho. Nguồn năng lượng này cũng lấy từ phân giải đường trong môi trường bảo quản. Trong quá trình chuyển hoá năng lượng xuất hiện nhiều chất bất lợi cho tế bào máu bảo quản, trong đó có các gốc tự do (Free Radicals). Vì vậy việc nghiên cứu các gốc tự do trong máu bảo quản để tìm phương pháp hạn chế tác dụng có hại của chúng, góp phần nâng cao chất lượng của máu bảo quản là một yêu cầu cấp thiết cho an toàn truyền máu.
Vậy gốc tự do là gỉ?
Gốc tự do là các nguyên tử hoặc nhóm nguyên tử hay phân tử mà lớp điện tử ngoài cùng của chúng có chứa điển tử không cặp đôi, chúng có thể mang điện tích dương hoặc âm hoặc không mang điện tích. Các gốc tự do thường gặp: O2, H202, HO, 1O2. Các gốc tự do này có hoạt tính hoá học rất mạnh, luôn có xu hướng lấy điện tử của phân tử bên cạnh để ghép đôi với điện tử đơn (cô độc) của nó. Phân tử mất điện tử lại trỏ thành gốc tự do, cứ như thế phản ứng lan truyền tạo thành chuỗi phản ứng.
Gốc tự do trong hoạt động sinh lý bình thường của cơ thể
Trong hoạt động sống của tế bào, hô hấp tế bào có thể tạo ra gốc tự do, gốc tự do đầu tiên được tạo ra là 0•2 do chuyển hoá Hb thành metHb, tiếp đó là một chuỗi phản ứng xảy ra (1,3,4,13).
Nếu pH càng giảm thì oxy hoá càng tăng, khả năng tạo gốc tự do càng lớn. Gốc tự do được tạo ra do tia xạ hoặc tia cực tím, hoặc bức xạ cao tần, bức xạ ion hoá đều có khả năng tạo gốc tự do. Như phân tử nước khi gặp bức xạ ion hoá ngay tức khắc có thể tạo ra gốc tự do H• và HO•. HO• theo công thức: H• + 02 →H0•2. H0•2 có tính acid nên ở điều kiện thuận lợi (pH trung tính) H0•2 lại phân thành H• và 0•2, 0•2 lại phản ứng với hydro tạo ra hydroperoxyd (H202).
Đó là hệ thống hoạt động có tính chất điểu hoà giữa hệ oxy hoá và chống oxy hoá (anti – oxydants).
Hoạt động sinh lý của cơ thể, luôn tạo ra các gốc tự do, các gốc tự do tác động lên protein, lipid, DNA và hủy hoại chúng. Tuy nhiên cơ thể vẫn tồn tại, các hoạt động sông vẫn tiếp diễn hàng ngày, hàng giò… lượng các gốc tự do vẫn sinh ra đều đặn nhưng chúng được duy trì ở mức rất thấp không có hại cho cơ thể.
Cơ chế duy trì hoạt động của gốc tự do (free radlcals)
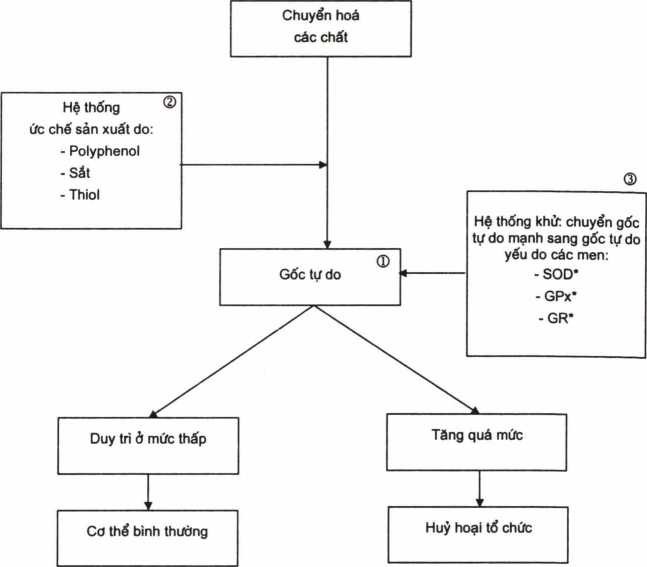
Sau nhiều nghiên cứu thực nghiệm và trên người, các nhà khoa học đã chứng minh rằng: bên cạnh quá trình chuyển hoá tạo ra các gốc tự do có hại cho cơ thể, cơ thể còn có hệ thống thứ hai chống lại quá trình này và chống lại các gốc tự do, chúng được gọi là chất chống oxy hoá (anti – oxydants). Trong cơ thể người và động vật, chất chông oxy hoá có hai loại: loại có bản chất enzym và loại không có bản chất enzym (13) (H.4.6).
Hình 4.6. Cơ chế hoạt động của các gốc tự do
Sơ đồ cho thấy gốc tự do sinh ra ®, nhưng chúng luôn bị huỷ bởi hai cơ chế: ức chế sản xuất © và khử ®.
SOD = Superoxyd dismutase; GPx = Glutathion Peroxydase; GR = Glutathion Reductase.
Các nghiên cứu về gốc tự do trong máu bảo quản
Trong máu bảo quản cũng có hai quá trình hoạt động đối kháng: quá trình oxy hoá và quá trình khử oxy hoá mà sản phẩm chung là các gốc tự do. Quá trình oxy hoá luôn tạo ra năng lượng và các gốc tự do. Trong máu bảo quản, kể cả các sản phẩm máu, các gốc tự do tăng do nguyên nhân sau:
Thiếu năng lượng làm cho hoạt động men chống oxy hoá như SOD, GPx, GR… giảm dần theo thời gian bảo quản.
Mặt khác trong điều kiện thiếu oxy, pH giảm các gốc tự do dễ dàng được sản xuất.
Hệ thống chống oxy hoá không phải men (hệ thống khử các chất tự do) cũng giảm nặng.
Tất cả ba nguyên nhân trên làm cho gốc tự do tăng trong máu bảo quản. GỐC tự do tăng tác động lên hồng cầu bảo quản, cùng với các cytokin, các chất trung gian hoà tan (serotonin, histamin, thromboxan…) làm biến đổi hình dạng và cấu túc của màng hồng cầu, dẫn đến tan hồng cầu. Kết quả này có nhiều tác giả chứng minh. Aslan ở Viện Truyền máu Budapest khi nghiên cứu hoạt tính men chông oxy hoá (anti – oxydants) trong máu bảo quản nhận thấy men này giảm rõ rệt theo thời gian bảo quản (1), giảm men chống oxy hoá liên quan đến sự hình thành các hoá chất trung gian và các thay đổi tế bào hồng cầu, bạch cầu, tiểu cầu trong máu bảo quản (theo đồ thị về môi tương quan ngược). Vacek và cộng tác đã chứng minh các gốc tự do gây tan máu trong máu toàn phần bảo quản (7). Tương tự như vậy, một số tác giả nhận thấy trong bệnh tan máu có vai trò của các gốc tự do (12). Gần đây Viện huyết học – Truyền máu phôi hợp với Bộ môn Hoá sinh trường Đại học Y Hà Nội, nghiên cứu một sô’ đặc điểm hoá sinh, trong đó có nghiên cứu về các men chông oxy hoá như SOD, GPx, GR các tác giả đã nhận thấy các men này đều giảm rõ theo thời gian bảo quản (15,16,20), đồng thời trong huyết tương máu bảo quản tăng một số chất như: K*, MDA, Hb tự do, sắt, các chất này do hồng cầu võ giải phóng ra (15,16,20). Các nghiên cứu khác về mối liên quan giữa sự giảm các men chông oxy hoá với hình thái hồng cầu, pH máu bảo quản cả ở máu toàn phần và khối hồng cầu bảo quản đều nhận thấy hình thái hồng cầu thay đổi khi quan sát bằng kính hiển vi ánh sáng thường (15) và kính hiển vi điện tử tia quét (20). Trẽn ảnh kính hiển vi diện tử tia quét nhận thấy bề mặt hồng cầu xuất hiện các “gai”, các “mụn nước”, hình tròn. Các hiện tượng tăng theo thời gian bảo quản và làm giảm chất lượng hồng cầu, hồng cầu dễ vô và khó khăn khi qua hệ mao mạch. Nghiên cứu gần đây của Phạm Quang Vinh (21) cho thấy sức bền hồng cầu trong khối hồng cầu bảo quản giảm rõ (P
Kết quả trên đây cho thấy các gốc tự do cùng với các cytokin, các chất trung gian đã làm cho chất lượng máu bảo quản giảm, thời gian sống của hồng cầu ngắn lại (do hiện tượng tan máu: hemolysis). Vì vậy việc nghiên cứu tìm một dung dịch bảo quản mới có khả năng hạn chế sự hình thành các cytokin, chống các gốc tự do và hạn chế giảm các men chống oxy hoá là cần thiết để duy trì chất lượng máu bảo quản.
Các biện pháp hạn chế tác dụng không có lợi của bạch cầu trong máu bảo quản
Chúng ta có thể hạn chế tác dụng có hại của bạch cầu bằng các biện pháp sau đây:
Truyền máu từng phần: như truyền khối hồng cầu giảm bạch cầu, truyền khối tiểu cầu nghèo bạch cầu, truyền huyết tương hoặc tủa lạnh yếu tố VIII, các thành phần này rất ít hoặc không có bạch cầu.
Lọc bạch cầu qua sàng lọc, phương pháp này có thể loại bỏ bạch cầu đạt hiệu quả trên 95% (H. 4.4)
Bất hoạt bạch cầu bằng tia xạ: phương pháp này hạn chế được bệnh ghép chông chủ nhưng không ngăn được cốc tác hại khác.
Bệnh ghép chống chủ do truyền máu
(Graft-Versus-Host-Disease = GVHD)
Vài nét về lịch sử phát triển
Từ năm 1916, Murphy đã nhận thấy khi thí nghiệm tiêm tế bào tuỷ hoặc tế bào lách của gà trưởng thành cho phôi gà thì thấy lách của phôi gà to lên và có các u hạt (nodules) nhưng ông không giải thích hiện tượng đã thấy. Sau này hiện tượng tương tự đã được mô tả nhờ thí nghiệm trên chuột. Nhiều công trình nghiên cứu tiếp theo đã đưa ra giả thiết rằng có thể có một khả năng miễn dịch nào đó gây nên hiện tượng này.
Năm 1959 Mathe lần đầu tiên đã mô tả bệnh ghép chống chủ trên người ở bệnh nhân lơxêmi cấp sau ghép tuỷ. Các điều kiện để các bệnh ghép chông chủ phát triển đó là tê bào đưa vào cơ thể có khả năng miễn dịch và cơ thể nhận đã bị suy giảm miễn dịch không có khả năng loại tê bào ghép. Từ đây người ta đã khẳng định vai trò của GVHD trong ghép tuỷ không thành công.
Năm 1991 nhiều tác giả đã mô tả bệnh ghép chống chủ do truyền máu. GVHD trong truyền máu cũng nhu trong ghép tuỷ, có thê gặp cả GVHD cấp tính và GVHD mạn tính, cũng gặp ở các bệnh nhân suy giảm miễn dịch mạnh.
Samon đã đưa ra ba điều kiện làm cho GVHD xuất hiện, đó là:
Tổ chức ghép phải có tế bào có khả năng miễn dịch.
Cơ thể nhận phải có kháng nguyên
Cơ thể nhận không có khả năng loại tổ chức ghép (suy giảm miễn dịch). Cũng trong thời gian này, Billingham đã nhận thấy về lâm sàng có hai thể cấp tính và mạn tính.
Bệnh sinh của bệnh ghép chống chủ
gvhd phụ thuộc vào số lượng lympho trong các thành phần tê bào máu truyền vào
Bằng phương pháp ly tâm, sử dụng túi kép đựng máu, sau khi tách ở điều kiện tốt nhất hiện nay, sôa lượng lympho còn trong các thành phần máu như sau (bảng 4.6).
Số lượng lympho trong túi máu có vai trò quan trọng trong sự xuất hiện GVHD. Hồng cầu đông lạnh với glycerol không gây bệnh ghép chống chủ,vì lympho trong phương pháp bảo quản này không tồn tại; Huyết tương đông lạnh, tủa lạnh yếu tố VIII cũng không gây bệnh ghép chống chủ.
thủ phạm gây gvhd
GVHD gây nên là do tế bào T-lympho độc đồng loại dị gen (Cytotoxic Allogengeous T-lymphocytes) của cá thể cho đưa vào cơ thể nhận mà cơ thể này đã bị suy giảm miễn dịch. Tế bào T-lympho độc được tạo ra từ hai nguồn sau đây:
Trong truyền máu có bạch cầu, trong các bạch cầu có một lượng rất ít (
Do chính các T-lympho đã trưởng thành từ máu người cho có khả năng miễn dịch, khi vào cơ thể được hoạt hoá trở thành các tế bào T độc làm huỷ diệt tế bào cơ thể, vì vậy khác với GVHD nói trên, ghép chống chủ trong trường hợp này thường xuất hiện sớm hơn và cấp tính. Hiện tượng này được chứng minh ở chuột, khi tiêm tế bào máu ngoại vi vào tĩnh mạch phổi 17 ngày tuổi thì 7 ngày sau đó thấy lách to, chuột suy mòn và chết.
cơ chế phá huỷ tổ chức trong gvhd
Cơ chế phá huỷ tổ chức tế bào trong GVHD có thể giải thích như sau:
Phố huỷ trực tiếp bởi tế bào T độc (Cytotoxic T Cells), T-CDe hoạt hoá (activated T-CDg). Tế bào này được hình thành do quá trình phát triển và hoạt hoá như đã mô tả ở phần trên, chúng có khả năng nhận biết kháng nguyên đặc hiệu (cơ thể nhận) nhờ vai trò của HL-A class I, chúng làm chết tế bào đích (tế bào cơ thể).
Trong quá trình quan hệ giữa bào ghép và cơ thể, tế bào trình diện kháng nguyên (APC) và tế bào T-CD4 với sự hỗ trợ của HLA-A DR (class II) chúng sản xuất ra các cytokin như IL-I, IL-2, TNF, INF, các cytokin này vừa có tác dụng khuyếch đại đáp ứng miễn dịch, vừa có tác dụng gây viêm, phá huỷ tổ chức cơ thể (TNF, INF).
những điếu kiện thuận lợi ở gvhd do truyền máu
Bệnh ghép chông chủ xuất hiện dễ dàng hơn khi cơ thể nhận bị suy giảm miễn dịch do:
Chiếu xạ
Điều trị hoá chất làm phá huỷ tế bào
Sử dụng cyclosporin A liều cao và kéo dài.
Cơ thể bị nhiễm CMV và EBV
Các yếu tố lâm sàng có nguy cơ gây GVHD:
Có nhiều yếu tố lâm sàng là nguy cơ gây bệnh ghép chống chủ do truyền máu như:
Các bệnh nhân bị suy giảm miễn dịch bẩm sinh/suy giảm miễn dịch hỗn hợp bệnh Wiskott- Aldrich, suy giảm tế bào T (bệnh teo tuyến ức bẩm sinh).
Tình trạng ức chế miễn dịch do điều trị hoá chất, tia xạ ở các bệnh nhân ung thư máu (lơxêmi, u lympho), ghép tuỷ đồng loài, ghép các cơ quan như thận, gan, các ung thư tổ chức đặc (solid tumors…).
Suy giảm miễn dịch do bệnh HIV/AIDS ở các bệnh nhân nói trên khi truyền máu dễ bị bệnh ghép chống chủ.
Truyền máu trẻ sơ sinh hoặc truyền máu trong tử cung (Inuterin Transíusion). về lý thuyết cũng có thể dễ hình thành bệnh ghép chống chủ nhưng trong thực hành lại ít gặp, có thể do hệ thống miễn dịch của cơ thể nhận chưa phát triển nên chưa có kiểm soát miễn dịch. Do đó có thể có tình trạng dung nạp miễn dịch (immuno tolerance) khi truyền máu cho đối tượng này.
chẩn đoán
lâm sàng
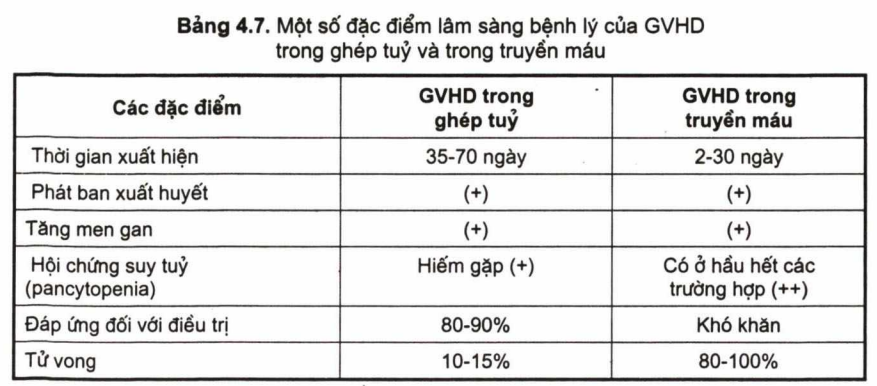
Sau truyền máu 1- 5 tuần bệnh nhân có các biểu hiện sau đây:
Bệnh da: u, cục ở da, viêm da.
Rối loạn tiêu hoá: ỉa chảy kéo dài, không tác dụng với kháng sinh.
Tăng men gan.
Có biểu hiện giảm sinh tuỷ hoặc suy tuỷ toàn bộ (pancytopenia).
Hạch to
các xét nghiệm labo
Sinh thiết da nơi có tổn thương thấy thâm nhiễm bạch cầu đơn nhân, có tê bào huỷ hoại (kết quả của lympho độc )
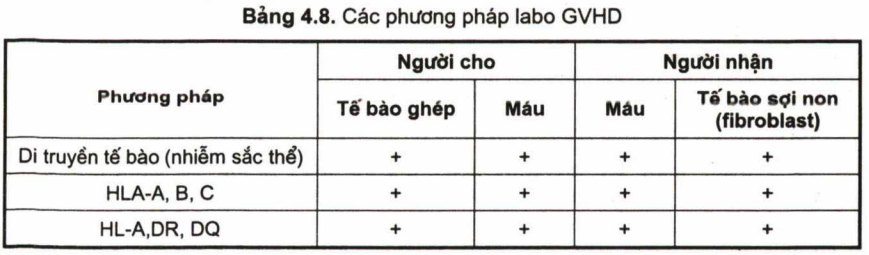
Xét nghiệm lympho ở máu của bệnh nhân (recipients) xác nhận sự có mặt của lympho của người cho (donor). Để xác định chẩn đoán GVHD cần làm các xét nghiệm sau. So sánh giữa tế bào người cho và người nhận (bảng 4.8).
Xét nghiệm HLA có thể dùng phương pháp huyết thanh gây độc tế bào để xác định HL-A ,B, c và xác định HL-A-DR, DQ, bằng PCR, tế bào thâm nhiễm ở da (nếu cần) xét nghiệm nhiễm sắc thể so sánh giữa bệnh nhân và người cho máu cũng có giá trị cao trong chẩn đoán thường thấy các dấu hiệu đa hình thái.
điều trị
Bệnh sinh của GVHD như đã mô tả ở trên là do tế bào T lympho của máu người cho gây nên phản ứng miễn dịch tế bào làm huỷ hoại tế bào và tổ chức người nhận biểu hiện ở tuỷ, da, nội hạch. Vì vậy, điều trị trong trường hợp này phải dùng các phương pháp ức chế miễn dịch như kháng huyết thanh chông T lympho (ATG) (cyclosporin A, corticoid).
Kết quả điều trị tốt đối với ghép tuỷ, còn GVHD do truyền máu thì khó khăn. Tỷ lệ lui bệnh rất thấp.
Dự phòng bệnh ghép chống chủ trong truyền máu
Như trên đã trình bày, thủ phạm chính ở đây là tế bào T lympho độc (Tc-CD8), tê bào Th-CD4 và tê bào NK. Vì vậy, đề dự phòng bệnh ghép chống chủ thì phương pháp duy nhất là loại các tế bào nói trên ra khỏi đơn vị máu truyền hoặc bất hoạt chúng.
Loại tế bào T lympho: có nhiều phương pháp loại tế bào T lympho:
Dùng màng lọc bạch cầu: màng lọc có thể giữ lại > 95 tế bào bạch cầu, trong đó có tê bào T.
Dùng kháng thể chông T- lympho (ATG) nhưng phương pháp này quá đắt tiền, không phù hợp với thực tế
Sử dụng hoá chất cyclosporin A. Phương pháp này phức tạp và không an toàn.
Bất hoạt lympho bằng tia xạ: máu trước khi truyền cho bệnh nhân, túi máu được chiếu xạ (tia gamma).