Bệnh nhân bệnh tim bẩm sinh người lớn nào cần kháng sinh dự phòng?
Chỉ định kháng sinh dự phòng Viêm nội tâm mạc đã thay đổi trong năm 2007 với các hướng dẫn mới của Hội Tim mạch Hoa Kỳ (American Heart Association). Kháng sinh phòng ngừa trong chăm sóc răng miệng ở bệnh tim bẩm sinh đã được khuyến cáo sử dụng ngày càng hạn chế. Hiện nay, dự phòng chỉ áp dụng trong một số trường hợp dưới đây:
- Bệnh tim bẩm sinh tím không sửa chữa
- Van tim nhân tạo
- Tổn thương tồn lưu sau phẫu thuật sửa chữa với vật liệu nhân tạo
- 6 tháng đầu sau phẫu thuật sửa chữa với dụng cụ nhân tạo
- Bệnh nhân có bệnh sử viêm nội tâm mạc nhiễm trùng trước đây
Hướng dẫn mới cũng đã giới hạn chỉ định phòng ngừa trong các thủ thuật niệu-sinh dục hay dạ dày-ruột. (Xem thêm Chương 35 về Viêm nội tâm mạc và phòng ngừa Viêm nội tâm mạc).
Ba tổn thương chính của thông liên nhĩ là gì, và những bất thường nào kèm theo?
Ba dạng tổn thương chính của thông liên nhĩ là lỗ thứ phát (70%), lỗ tiên phát (20%), và xoang tĩnh mạch (10%). Thông liên nhĩ lỗ thứ phát là tổn thương là tổn thương liên quan tới lỗ bầu dục của vách liên nhĩ. Bệnh thường biểu hiện như một bất thường đơn độc. Thông liên nhĩ lỗ nguyên phát là tổn thương tại phần thấp của vách liên nhĩ ngay sát van nhĩ thất. Bệnh là một phần của bệnh kênh nhĩ thất, và chẻ van 2 lá gần như luôn luôn hiện diện. Thông liên nhĩ xoang tĩnh mạch là tổn thương của phần sau vách liên nhĩ, thường nằm ở gần tĩnh mạch chủ trên. Phần lớn các trường hợp thông liên nhĩ xoang tĩnh mạch thường kèm theo với thông nối hoặc dẫn lưu bất thường ở tĩnh mạch phổi bên phải (Hình. 58-1).
Khi nào nên đóng Thông liên nhĩ? Thông liên nhĩ nào không thể đóng được bằng dụng cụ qua da?
Kích thước thông liên nhĩ thường rất thay đổi. Nếu thông liên nhĩ đủ lớn, luồng thông trái – phải sẽ gây quá tải thể tích tim phải và tăng tuần hoàn phổi. Quá tải thể tích tim phải kéo dài dẫn tới tăng áp phổi, rối loạn chức năng thất phải, hở van 3 lá, và dãn nhĩ phải. Bệnh nhân thông liên nhĩ cũng thường khởi phát loạn nhịp nhĩ. Thông liên nhĩ gây ảnh hưởng huyết động học có ý nghĩa thường lớn hơn hay bằng 10mm, tỉ lệ luồng thông lớn hơn 1.5, và kèm theo dãn thất phải trên hình ảnh học. Chỉ thông liên nhĩ nào gây ảnh hưởng huyết động học có ý nghĩa mới được khuyết cáo đóng. Khi có chỉ định đóng, một dụng cụ được đặt qua đường tiêm mạch máu dưới da. Thủ thuật này được thực hiện trong phòng thông tim, thường là dưới gây mê toàn thân và dưới hướng dẫn của siêu âm tim qua thực quản. Hầu hết các thông liên nhĩ lỗ thứ phát có thể đóng qua đường mạch máu tiêm qua da. Thông liên nhĩ lỗ nguyên phát và xoang tĩnh mạch không thể đóng qua thông tim và cần phải phẫu thuật.
Danh sách 4 dạng thông liên thất.
Nhiều phân loại thông liên thất khác nhau đã được sử dụng; Trong đó, phân loại thường được áp dụng là chia thông liên thất thành 4 thể:
- Thông liên thất phần màng và quanh màng có liên quan đến phần màng của vách liên thất, là phần khu trú nhỏ của vách liên thất cấu tạo bởi mô sợi. Đây là dạng thường gặp nhiều nhất của thông liên thất ở người lớn.
- Thông liên thất phần cơ liên quan tới phần cơ bè của vách liên thất.
- Thông liên thất buồng nhận bao gồm phần vách liên thất ngay sát với van 3 lá và van 2 lá. Thông liên thất buồng nhận thường đi kèm với kênh nhĩ thất.
- Thông liên thất buồng tống (hay còn gọi là supracristal thông liên thất) tổn thương phần vách liên thất ngay dưới van động mạch chủ và van động mạch phổi (Hình 58-2).
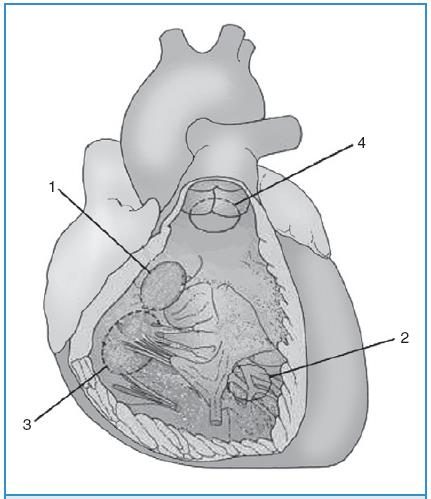
Hình 58-2. Thông liên thất: 1, phần màng; 2, phần cơ; 3, buồng nhận; 4, buồng tống.
(Trích theo Gatzoulis MA, Webb GD, Daubeney PEF, et al: Diagnosis and management of adult congenital heart disease, 2003, Edinburgh, Churchill Livingstone, p. 171)
Hậu quả lâu dài của thông liên thất lỗ nhỏ trên bệnh nhân người lớn là gì?
Ở người lớn, có 2 nhóm bệnh nhân không cần sửa chữa thông liên thất. Một nhóm nhỏ bệnh nhân có thông liên thất lỗ lớn dẫn tới biến chứng tăng áp động mạch phổi nặng (Hội chứng Eisenmenger). Tuy nhiên, phần lớn bệnh nhân trưởng thành có thông liên thất lỗ nhỏ không làm thay đổi huyết động học đáng kể (tức là không làm dãn thất trái hay tăng áp động mạch phổi). Thông thường, những bệnh nhân này có bệnh sử diễn tiến lành tính. Hiếm khi, một số bệnh nhân phát triển vài biến chứng như viêm nội tâm mạc, rối loạn nhịp nhĩ, hở van 3 lá, hở van động mạch chủ, và thất phải 2 buồng (double-chamber right ventricle).
Các biến chứng của bệnh van động mạch chủ 2 mảnh là gì?
Bệnh van động mạch chủ 2 mảnh chiếm 0.5% đến 2% dân số. Những biến chứng chính bao gồm hẹp van động mạch chủ tiến triển, hở van động mạch chủ hoặc phối hợp cả hai. Các biến chứng khác bao gồm viêm nội tâm mạc, và bệnh động mạch chủ. Mặc dù không thường xuyên, hẹp eo động mạch chủ cũng thường đi kèm và cần thiết phải được loại trừ ở những bệnh nhân này. Những bệnh nhân van động mạch chủ 2 mảnh có dấu hiệu thoái hoá van trên siêu âm tim có nguy cơ gia tăng các biến cố tim mạch và cần thiết phải dõi cẩn thận thường xuyên.
Làm thế nào đánh giá độ nặng huyết động học của hẹp eo động mạch chủ ở người lớn?
Trong hẹp eo động mạch chủ, thường hẹp điển hình ở đoạn gần của động mạch chủ xuống, ngay sau động mạch dưới đòn trái. Bệnh nhân người lớn thường được chia thành 2 nhóm: hẹp eo tự nhiên (tức là chưa sửa chữa) và sau sửa chữa (một số trong đó có hẹp tồn lưu). Một vài trường hợp hẹo eo nhẹ và không thay đổi huyết động học đáng kể. Những dấu nghi ngờ hẹp eo gây ảnh hưởng huyết động học bao gồm đường kính nhỏ (dưới 10mm hoặc nhỏ hơn 50% đường kính tham chiếu của động mạch chủ xuống tại vị trí cơ hoành), hiện diện của tuần hoàn bàng hệ, và tăng chênh áp (lớn hơn 20-30 mmHg trên lâm sàng, được đo bởi thông tim hoặc siêu âm tim). Chênh áp lâm sàng được đo bằng cách so sánh huyết áp tâm thu ở tay cao nhất và huyết áp tâm thu ở chân (thường đo bằng cách bắt mạch chân trong lúc xả băng quấn tay ở vị trí bắp chân). Bệnh nhân với hẹp eo có ảnh hưởng huyết động quan trọng có nguy cơ mắc nhiều biến chứng, bao gồm tăng huyết áp kháng trị, xơ vữa tiến triển, bệnh mạch máu não và bệnh lý động mạch chủ.
Trong hẹp eo động mạch chủ, khi nào can thiệp đặt stent qua da cần xem xét?
Hầu hết các bác sĩ nghĩ rằng hẹp eo động mạch chủ có ý nghĩa nên được xem xét can thiệp. Mặc dù phẫu thuật đã được áp dụng trong nhiều thập niên, nhưng can thiệp nong đặt stent qua da ngày càng phát triển như một điều trị thay thế. Ở bệnh nhân trưởng thành với hẹp tái phát sau phẫu thuật sửa chữa, thì đặt stent đã trở thành lựa chọn hàng đầu trong hầu hết các trung tâm. Đối với người lớn có hẹp eo bẩm sinh, đặt stent cũng trở thành lựa chọn đầu tiên ở nhiều trung tâm. Những bệnh nhân can thiệp đặt stent qua da phải có giải phẫu thích hợp (tức là không thiểu sản cung động mạch chủ nặng). Bệnh nhân trưởng thành cần phẫu thuật thường phải sử dụng một mảnh ghép thêm vào.
Bệnh nhân người lớn nào còn tồn tại ống động mạch cần phải thông tim đóng bằng dụng cụ qua da?
Tồn tại ống động mạch thông nối phần gần của động mạch phổi trái với phần gần của động mạch chủ xuống, ngay sau động mạch dưới đòn trái. Ống động mạch không cần điều trị ở người trưởng thành thường có đường kính nhỏ và luồng thông trái – phải không gây ảnh hưởng huyết động học. Tuy nhiên, trong một số bệnh nhân, ống động mạch có đường kính lớn và gây ra tăng áp động mạch phổi nặng (Hội chứng Eisenmenger). Thỉnh thoảng, vài bệnh nhân có ống động mạch kích thước trung bình có luồng thông không phải không đáng kể nhưng không đủ để gây tăng áp động mạch phổi nặng. Những bệnh nhân này, thất trái sẽ bị dãn và áp lực động mạch phổi có thể hơi tăng. Trên lâm sàng họ sẽ có âm thổi liên tục, mạch nảy rộng, và dấu hiệu của dãn thất trái. Nhóm bệnh nhân này nên được thông tim đóng qua da nhằm nỗ lực ngăn chặn những biến chứng về lâu dài. Mặc dù còn tranh cải, nhiều trung tâm chủ trương đóng thường quy ống động mạch lỗ nhỏ để phòng ngừa viêm nội tâm mạc.
Làm thế nào chẩn đoán Hội chứng Marfan?
Các tiêu chuẩn chẩn đoán Hội chứng Marfan đã được đưa ra từ nhiều năm. Sự phát hiện ra gen thủ phạm chính năm 1991 (FBN-1) đã dẫn đến thành lập một phân loại chẩn đoán chọn lọc hơn; tiêu chuẩn Ghent. Phân loại này đòi hỏi sự hiện diện của nhiều biểu hiện đặc trưng liên quan nhiều hệ thống cơ quan. Mặc dù xét nghiệm phân tử đã sẵn sàng sử dụng, tuy nhiên tại thời điểm hiện tại, chỉ có lâm sàng là hữu ích trong trường hợp lọc bệnh. Ngoài khám kiểm tra tim mạch, bệnh nhân nghi ngờ hội chứng Marfan nên được chuyển khám di truyền học.
Khi nào bệnh nhân Marfan có dãn động mạch chủ nên phẫu thuật?
Trong hội chứng Marfan, mặc dù bất cứ vị trí nào của động mạch chủ đều có khả năng tổn thương, nhưng gốc động mạch chủ thường bị ảnh hưởng nhiều nhất. Phẫu thuật (vì dãn gốc động mạch chủ) được thực hiện để phòng ngừa bóc tách hoặc vỡ động mạch chủ và thường được khuyến cáo khi đường kính động mạch chủ lớn hơn 50mm. Đối với những bệnh nhân có tiến triển bệnh nhanh (lớn hơn 5mm/năm) hoặc bệnh sử gia đình có người bị bóc tách, vài chuyên gia khuyến cáo nên can thiệp lúc 45mm. Trong phẫu thuật Bentall điều trị dãn gốc động mạch chủ, van động mạch chủ tự nhiên và gốc động mạch chủ được thay thế bằng composite conduit (ống ghép có gắn van nhân tạo). Một kỹ thuật phẫu thuật được giới thiệu gần đây là phẫu thuật giữ lại van, gốc động mạch chủ được thay bằng ống nhân tạo và van tự nhiên được giữ lại.
Tứ chứng Fallot là gì, và biến chứng nào thường gặp ở người lớn?
Tứ chứng Fallot bao gồm 4 biểu hiện: tắc nghẽn đường ra thất phải, thông liên thất lỗ lớn, động mạch chủ lên cưỡi ngựa, và phì đại thất phải. Tắc nghẽn đường ra thất phải là tổn thương lâm sàng quan trọng và có thể là tắc nghẽn dưới van, tại van, hoặc trên van hoặc nhiều chỗ. Sửa chữa bao gồm đóng thông liên thất và khai thông tắc nghẽn đường ra thất phải. Trong nhiều bệnh nhân, để giải phóng tắc nghẽn đường ra thất phải, mổ ở vòng van và lá van động mạch phổi là cần thiết và lâu dài thường gây biến chứng hở van động mạch phổi nặng. Theo thời gian, hở phổi nặng mạn tính dẫn đến rối loạn chức năng thất phải và giảm khả năng gắng sức; đối với những bệnh nhân này thay van động mạch phổi là cần thiết. Khi tiến hành thay van động mạch phổi, mô nhân tạo thường được sử dụng (mô nguồn gốc người hoặc heo/bò). Vấn đề là với những mô nhân tạo này, ở bệnh nhân trẻ cần phải thay lại mỗi 10-15 năm. Thông tim thay van động mạch phổi nhân tạo qua da hiện đã áp dụng trên nhiều nước, nhưng kinh nghiệm hiện nay còn hạn chế. Những biến chứng khác của tứ chứng Fallot bao gồm tắc nghẽn buồng tống thất phải tồn lưu, thông liên thất tồn lưu, rối loạn chức năng thất phải, dãn gốc động mạch chủ, và rối loạn nhịp.
Ba rối loạn của bất thường Ebstein là gì?
Bất thường Ebstein biểu hiện bằng van 3 lá đóng thấp về phía mỏm, làm biến dạng thất phải, có thể dẫn tới rối loạn chức năng thất phải. Việc đóng thấp này ảnh hưởng chủ yếu đến lá vách và lá sau của van. Các lá van này thường nhỏ và dính vào thành tâm thất. Đặc biệt, lá trước bị kéo dài không bình thường. Thất phải thường mỏng và có thể có rối loạn cả chức năng tâm thu và tâm trương. Một nửa số bệnh nhân có lỗ bầu dục thông nối giữa 2 nhĩ hoặc thông liên nhĩ. 15% bệnh nhân có dẫn truyền đường phụ, biểu hiện trên lâm sàng như hội chứng Wolff-Parkinson-White. Các biến chứng chính của bất thường Ebstein là hở van 3 lá và suy tim phải. Nếu các biến chứng này đủ nặng, thì thay van nhân tạo hoặc sửa van (nếu giải phẫu học van phù hợp) được chỉ định.
Thuốc điều trị nào hiện nay cần được cân nhắc sử dụng cho mọi bệnh nhân có hội chứng Eisenmenger?
Hội chứng Eisenmenger đề cập đến tình trạng tăng áp phổi đáng kể gây ra bởi luồng thông từ trái qua phải lâu dài giữa tuần hoàn phổi và hệ thống do các khuyết tật bẩm sinh. Ban đầu, luồng thông trái – phải dẫn đến tăng lưu lượng mạch máu phổi. Qua thời gian, gây ra những thay đổi trong mạch máu phổi làm tăng kháng lực mạch máu phổi. Khi kháng lực mạch máu phổi gần bằng hay vượt quá kháng lực mạch máu hệ thống, luồng thông sẽ đảo chiều. Hậu quả của luồng thông từ phải sang trái làm dẫn tới tình trạng giảm oxy và tím tái. Tổn thương thường gặp nhất gây ra hội chứng Eisenmenger là thông liên thất. Các nguyên nhân khác bao gồm tồn tại ống động mạch, kênh nhĩ thất và thông liên nhĩ. Thông thường, các bệnh nhân này được điều trị bằng các biện pháp hỗ trợ. Tuy nhiên, các dữ liệu gần đây hỗ trợ việc sử dụng thuốc dãn mạch phổi đường uống, bosentan (ức chế endothelin), và sildenafil (hoạt hóa nitric oxide). Những thuốc này làm giảm áp lực động mạch phổi và cải thiện cơ năng. Tuy nhiên, các thuốc này thường rất mắc và hiệu quả trên bệnh nhân chưa rõ ràng. Dữ liệu dài hạn, bao gồm hiệu quả cải thiện tử vong, hiện vẫn còn thiếu. Bất kể các yếu tố trên, tất cả bệnh nhân Eisenmenger nên được đánh giá bởi chuyên gia thích hợp về việc sử dụng thuốc dãn mạch phổi.
Khi nào bệnh nhân Eisenmenger cần trích máu?
Trong hội chứng Eisenmenger, giảm oxy máu do luồng thông phải- trái kích thích tủy tăng sinh hồng cầu và dẫn đến tình trạng tăng dung tích hồng cầu. Trước đây, Bệnh nhân Eisenmenger bị trích máu thường quy vì tăng dung tích hồng cầu được xem nguyên nhân dẫn tới huyết khối tương tự như những bệnh nhân có bệnh lý huyết học đa hồng cầu. Tuy nhiên trong những năm gần đây, nhiều thông tin đã cho thấy rằng trích máu phòng ngừa ở bệnh nhân Eisenmenger thì có thể có hại nhiều hơn có lợi (ví dụ: gây thiếu sắt, giảm khả năng gắng sức, có khả năng tăng nguy cơ đột quỵ). Như vậy, sử dụng trích máu trở nên hạn chế hơn và chỉ được cân nhắc trong (1) những bệnh nhân với triệu chứng tăng độ nhớt máu (nhức đầu, chóng mặt, mệt, đau nhức) có dung tích hồng cầu lớn hơn 65% mà không có bằng chứng thiếu sắt; và (2) trước mổ nhằm cải thiện cầm máu (mục tiêu dung tích hồng cầu thấp hơn 65%). Trong thực hành hiện nay, chỉ có một vài bệnh nhân Eisenmenger cần phải trích máu.
Trong thai kỳ, những bệnh tim bẩm sinh nào có hậu quả rất nặng nề?
Những bệnh tim bẩm sinh có nguy cơ rất cao bao gồm:
- Bệnh tim bẩm sinh tím chưa được phẫu thuật
- Hội chứng Eisenmenger
- Hẹp chủ nặng
- Hội chứng Marfan với dãn gốc động mạch chủ (lớn hơn 40 mm)
- Thay van nhân tạo cơ học
- Rối loạn chức năng tâm thu thất trái (Phân suất tống máu ≤40%).
Những bệnh nhân này phải được tư vấn thích hợp về nguy cơ cho mẹ cũng như hậu quả nặng nề cho con trong thai kỳ.
Hoán vị có 2 dạng nào?
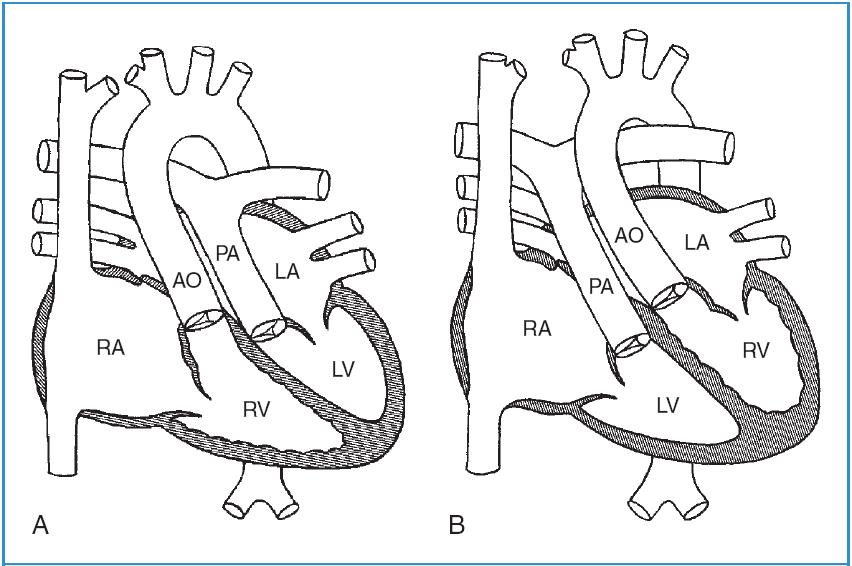
Hoán vị có thể chia thành 2 nhóm. Trong hoán vị đại động mạch hoàn toàn (D-TGA: hoán vị đại động mạch dạng D), bất thường này có thể được mô tả đơn giản như một sự đảo ngược của đại động mạch (Hình 58-3, A). Động mạch chủ đi ra từ thất phải, và động mạch phổi đi ra từ thất trái. Máu không bão hòa được bơm vào tuần hoàn hệ thống, trong khi máu oxy hóa được bơm vào tuần hoàn phổi. Nếu không can thiệp, bệnh này thường gây hậu quả rất xấu đối với trẻ nhỏ.
Hoán vị đại động mạch được sửa chữa bẩm sinh (L-TGA: Hoán vị đại động mạch dạng L) có thể mô tả như một sự đảo ngược của thất (Hình 58-3, B). Máu không bão hòa và máu oxy hóa đều được bơm vào những tuần hoàn động mạch thích đáng. Trong nhiều trường hợp, một số bất thường kèm theo như thông liên thất, hẹp phổi, bất thường van 3 lá, và bloc tim có thể hiện diện. Những bệnh nhân này có thể sống sót và xuất hiện bình thường ở người lớn mà không cần phẫu thuật can thiệp.
Hình 58-3: A, Hoán vị đại động mạch dạng D. B, Hoán vị đại động mạch dạng L
(Theo Mullins CE, Mayer DC: Congenital heart disease, a diagrammatic atlas, 1988, New York, Wiley-Liss, pp. 164, 182.)
Thất phải hệ thống hóa có nghĩa là gì?
Thất phải hệ thống (systemic right ventricle) đề cập tới bất thường của tim mà thất phải bơm máu vào động mạch chủ. Hình thái học của thất được xác định bởi những đặc điểm giải phẫu điển hình của từng thất. Ví dụ như, thất phải về hình thái học có van nhĩ thất 3 lá (gắn vào vách liên thất và nằm gần về phía mỏm hơn so với van 2 lá) và có dãy cơ bè to vùng mỏm. Hoán vị đại động mạch dạng L (xem Câu hỏi 17) là một khiếm khuyết tim bẩm sinh, trong đó có thất phải hệ thống. Trong vài thập niên đầu của cuộc sống, thất phải có khả năng vận dụng được để bơm máu vào tuần hoàn hệ thống vốn có áp lực cao; tuy nhiên, ở tuổi trưởng thành, chức năng thất phải bắt đầu xấu đi trong nhiều bệnh nhân. Điều này thường kèm theo hở van 3 lá và biểu hiện trên lâm sàng như suy tim.
Sự khác nhau giữa chuyển vị nhĩ và chuyển vị động mạch là gì?
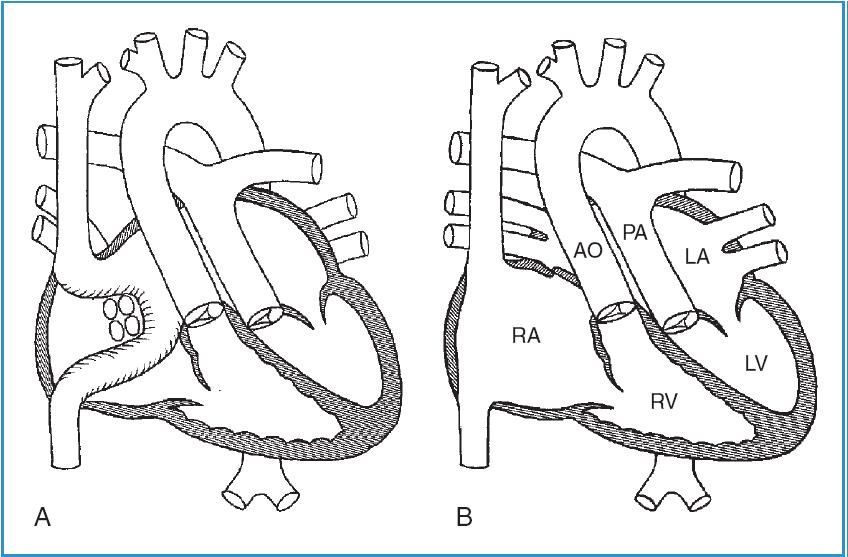
Chuyển vị nhĩ là một phẫu thuật mà trước đây được áp dụng cho những bệnh nhân sinh ra với với hoán vị đại động mạch dạng D (Hình 58-4, A). Phẫu thuật Mustard và Senning là 2 ví dụ về chuyển vị nhĩ và gồm thay đổi dòng máu tĩnh mạch hệ thống và tĩnh mạch phổi đổ về tương ứng thất phổi và thất hệ thống. Hiện nay, phẫu thuật này đã được thay thế bằng chuyển vị động mạch, gồm có chuyển vị đại động mạch và cắm lại mạch vành vào động mạch chủ mới (Hình 58-4, B). Chuyển vị động mạch được thực hiện trong vòng vài tuần đầu sau sinh và là điều trị chuẩn cho bệnh nhân hoán vị đại động mạch dạng D (D-TGA) trong hơn hai thập kỷ qua.
Hình 58-4: A, Chuyển vị nhĩ trong hoán vị đại động mạch dạng D (Phẫu thuật Mustard hoặc Senning)
(Trích theo Mullins CE, Mayer DC: Congenital heart disease, a diagrammatic atlas, 1988, New York, Wiley-Liss, 1988, p. 296.). B, Chuyển vị động mạch trong hoán vị đại động mạch dạng D
(Trích theo Mullins CE, Mayer DC: Congenital heart disease, a diagrammatic atlas, 1988, New York, Wiley-Liss, p.300).
Tài liệu tham khảo, tài liệu nên đọc và websites
- Nevil Thomas Adult Congenital Heart Library. http://www.achd-library.com
- Canadian Adult Congenital Heart (CACH) Network. http://www.cachnet.org
- The National Marfan Foundation. http://www.marfan.org
- Galie´ N, Beghetti M, Gatzoulis MA, et al: Bosentan therapy in patients with Eisenmenger Syndrome. A multicenter, double-blind, randomized, placebo-controlled study, Circulation 114:48-54, 2006.
- Gatzoulis MA, Webb GD, Daubeney PEF: Diagnosis and management of adult congenital heart disease, Philadelphia, Churchill Livingstone, 2003.
- Gersony WM, Rosenbaum MS: Congenital heart disease in the adult, New York, McGraw-Hill, 2002.
- Maron BJ, Zipes DP, Ackerman MJ, et al: Bethesda Conference report: 36th Bethesda Conference. Eligibility recommendations for competitive athletes with cardiovascular abnormalities, J Am Coll Cardiol 45:1312-1375,
- Michelena HI, Desjardins VA, Avierinos JF, et al: Natural history of asymptomatic patients with normally functioning or minimally dysfunctional bicuspid aortic valve in the community, Circulation 117:2776-2784,
- Siu SC, Colman JM, Sorensen S, et al: Adverse neonatal and cardiac outcomes are more common in pregnant women with cardiac disease, Circulation 105:2179-2184, 2002.
- Spence MS, Balaratnam MS, Gatzoulis MA: Clinical update: cyanotic adult congenital heart disease, Lancet 370:1530-1532, 2007.
- Therrien J, Dore A, Gersony W, et al: Canadian Cardiovascular Society Consensus Conference 2001 update: recommendations for the management of adults with congenital heart disease. Part I: review, Can J Cardiol 17(9):940-959, 2001.
- Therrien J, Gatzoulis M, Graham T, et al: Canadian Cardiovascular Society Consensus Conference 2001 update: Recommendations for the management of adults with congenital heart disease. Part II: review, Can J Cardiol 17(10):1029-1050, 2001.
- Therrien J, Warnes C, Daliento L, et al: Canadian Cardiovascular Society Consensus Conference 2001 update: recommendations for the management of adults with congenital heart disease. Part III: review, Can J Cardiol 17(11):1135-1158, 2001.
- The Task Force on the Management of Grown Up Congenital Heart Disease of the European Society of Cardiology: Management of grown up congenital heart disease, Eur Heart J 24(11):1035-1084, 2003.
- Wilson W, Taubert KA, Gewitz M, et al: AHA guideline: prevention of infective endocarditis. A guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group, Circulation 116:1736-1754, 2007.