Céline Monard a, b Thomas Rimmelé a, b Claudio Ronco c–e
aAnesthesiology and Intensive Care Medicine, Edouard Herriot Hospital, Lyon, France;
b EA 7426, PI3 (Pathophysiology of Injury Induced Immunosuppression), Claude Bernard University Lyon 1 Biomérieux Hospices Civils de Lyon, Lyon, France;
c Full Professor of Nephrology, Department of Medicine, University of Padova, Vicenza, Italy;
d Director of International Renal Research Institute of Vicenza (IRRIV), Vicenza, Italy;
e Director of Department of Nephrology Dialysis and Transplantation, San Bortolo Hospital, Vicenza, Italy
Từ khóa
Tổn thương thận cấp
Hấp phụ
Liệu pháp thanh lọc máu
Y học chính xác
Liệu pháp thay thế thận
Nhiễm khuẩn huyết
Tóm tắt
Thanh lọc máu với màng ngoài cơ thể được đề xuất như một liệu pháp bổ trợ cho nhiễm trùng huyết, nhằm mục đích kiểm soát rối loạn liên quan đến hệ thống miễn dịch, là nguyên nhân gây ra rối loạn chức năng cơ quan. Các phương pháp điều trị khác nhau đã được phát triển để giải quyết các bước nhất định của rối loạn miễn dịch. Hầu hết các thiết bị lọc máu có sẵn đều tập trung vào một mục tiêu đơn nhất, chẳng hạn như nội độc tố kích hoạt dòng thác miễn dịch hoặc cơn bão cytokine gây tổn thương cơ quan. Tuy nhiên, màng hấp phụ cao có tên oXiris® là một thiết bị 4 trong 1 độc nhất kết hợp các đặc tính loại bỏ cytokine và endotoxin, chức năng thay thế thận và đặc tính chống huyết khối. Gần đây, các phương pháp điều trị đầy hứa hẹn tập trung vào chính yếu tố tự gây bệnh hoặc các tế bào miễn dịch đã được phát hiện và đang được nghiên cứu gần đây. Trong đánh giá này, chúng tôi nhằm mục đích tóm tắt, theo mục tiêu của chúng, các kỹ thuật lọc máu ngoại bào khác nhau hiện có để sử dụng. Chúng tôi cũng sẽ giới thiệu ngắn gọn về các kỹ thuật gần đây nhất vẫn đang được phát triển. Do khả năng độc đáo của nó để loại bỏ cả nội độc tố và cytokine, chúng tôi sẽ đặc biệt thảo luận về màng oXiris® hấp phụ cao phủ heparin. Chúng tôi sẽ trình bày các tính chất, ưu điểm, cạm bẫy của nó, cũng như quan điểm trị liệu dựa trên dữ liệu thực nghiệm và lâm sàng.
Giới thiệu
Theo đề xuất của định nghĩa đồng thuận quốc tế lần thứ ba về nhiễm trùng huyết và sốc nhiễm trùng (Sepsis-3), nhiễm trùng huyết ngày nay được định nghĩa “là một rối loạn chức năng cơ quan đe dọa đến tính mạng do phản ứng của vật chủ bị rối loạn điều hòa đối với nhiễm trùng “[1]. Định nghĩa mới này phát sinh từ sự cải thiện hiểu biết về sinh lý bệnh nhiễm trùng huyết. Nó cũng nhấn mạnh vai trò quan trọng của phản ứng miễn dịch quá mức của vật chủ hoặc không cân bằng trong khi nhiễm trùng huyết [2]. Cùng với kháng sinh, quản lý các rối loạn chức năng cơ quan và điều trị phẫu thuật nếu cần thiết, các phương pháp điều trị lọc máu màng ngoài cơ thể khác nhau có thể được đề xuất như là phương pháp điều trị bổ trợ nhằm để điều chỉnh phản ứng viêm. Tuy nhiên, nhóm kỹ thuật này vẫn là một chủ đề gây tranh cãi do thiếu các thử nghiệm ngẫu nhiên đa trung tâm dương tính (RCTs) xác nhận sự phù hợp lâm sàng của chúng [3].
Mục đích của tổng quan này là để thảo luận về các kỹ thuật lọc máu màng ngoài cơ thể hiện có. Chúng tôi sẽ đặc biệt tập trung vào màng oXiris® hấp phụ cao vì nó cung cấp một sự kết hợp đặc tính độc đáo, cho phép hỗ trợ thận với màng ngoài cơ thể cũng như loại bỏ cả endotoxin và cytokine. Chúng tôi cũng sẽ giới thiệu các liệu pháp mới nhằm mục tiêu loại bỏ các tế bào (mầm bệnh hoặc tế bào miễn dịch) hiện đang được phát triển. Điều quan trọng, danh sách các thiết bị lọc máu được báo cáo trong tổng quan này không đầy đủ nhưng cũng đủ để minh họa cho tiến bộ về kỷ thuật và các mục tiêu điều trị khác nhau.
Sinh lý bệnh của đáp ứng miễn dịch trong nhiễm trùng huyết: từ sinh lý bệnh đến điều trị .
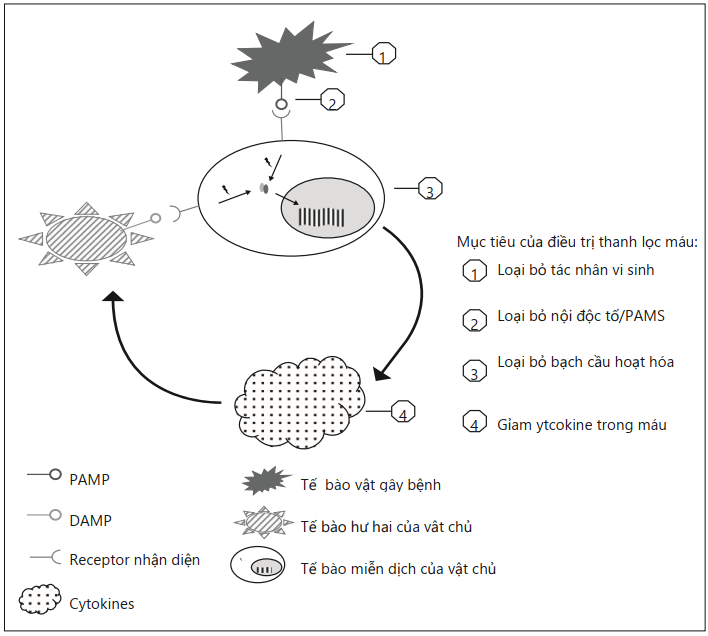
Bước đầu tiên của quá trình nhiễm trùng là sự nhận diện mầm bệnh bởi hệ thống miễn dịch. Tất cả các tác nhân gây bệnh biểu hiện trên các thành phần cụ thể bề mặt của chúng, được gọi là các mẫu phân tử liên quan đến tác nhân (PAMPs – pathogen-associated molecular patterns), chẳng hạn như các nội độc tố được biểu hiện bởi vi khuẩn gram âm. Trong quá trình lây nhiễm, PAMPs được nhận diện biết bởi thụ thể nhận dạng mẫu được biểu thị ở bề mặt của các tế bào miễn dịch [4]. Tín hiệu này kích hoạt bạch cầu và gây ra sự tổng hợp các cytokine tiền và chống viêm, bao gồm yếu tố hoại tử khối u, interleukin-1 (IL-1), IL-6, IL8 và IL-10. Sự giải phóng ồ ạt của các cytokine trong máu đã được mô tả như một “cơn bão cytokine”và được cho là nguyên nhân gây ra các rối loạn chức năng cơ quan chính [5, 6].
Các tế bào vật chủ bị thương biểu hiện trên các mẫu phân tử liên quan đến tổn thương bề mặt của chúng (DAMPs – damage-associated molecular patterns), chẳng hạn như protein “highmobility-group-box-1” (HMGB1). DAMPs có thể được giải phóng trong tuần hoàn và được nhận diện bởi thụ thể nhận dạng, do đó tăng cường kích hoạt bạch cầu và tổng hợp cytokine, thúc đẩy vòng luẩn quẩn của quá trình miễn dịch không kiểm soát được (Hình 1) [7]. Sau cơn bão cytokine ban đầu, tình trạng “liệt” miễn dịch xảy ra, góp phần vào hầu hết các trường hợp tử vong liên quan đến nhiễm trùng huyết gây ra do nhiễm trùng liên quan đến chăm sóc sức khỏe và tái hoạt hóa virus [8].
Giải quyết câu trả lời miễn dịch không cân bằng đối với nhiễm trùng là một thách thức điều trị trong nhiều năm. Tuy nhiên, sự hiểu biết tốt hơn về các cơ chế gây nhiễm trùng huyết đã cho phép phát triển các liệu pháp miễn dịch mới để điều chỉnh quá trình viêm. Kết quả đầy hứa hẹn đã thu được với các phân tử mới như IL-7 tái tổ hợp [9]. Một cách tiếp cận khác bao gồm loại bỏ một loạt không chọn lọc các chất trung gian gây viêm. Điều này bây giờ có thể, nhờ những tiến bộ công nghiệp và sự phát triển của các thiết bị lọc máu màng ngoài cơ thể [10]. Hầu hết các kỹ thuật màng ngoài cơ thể này can thiệp vào một bước cụ thể của quá trình miễn dịch phức tạp, nhưng một số trong số chúng có thể có 2 hoặc nhiều mục tiêu. Nhiều giả thuyết khác nhau đã được phát triển để giải thích tác dụng của chúng. Đầu tiên, họ có thể làm giảm nồng độ cytokine dưới “ngưỡng độc” để hạn chế các tác động gây hại cục bộ của cytokine [5]. Các tác giả khác đã đưa ra giả thuyết rằng do độ chênh nồng độ được phục hồi, việc giảm nồng độ cytokine trong máu có thể thúc đẩy quá trình hóa hướng động bạch cầu đối tới mô bị nhiễm trùng nơi nồng độ cytokine cao hơn [11]. Một mục tiêu khác của các kỹ thuật lọc máu là ức chế kích hoạt dòng thác miễn dịch. Do đó, mục tiêu là để loại bỏ mầm bệnh hoặc PAMPs như endotoxin trước khi chúng kích hoạt bạch cầu [12]. Cuối cùng, việc điều chỉnh quá trình miễn dịch có thể liên quan trực tiếp đến bạch cầu, thông qua việc loại bỏ trực tiếp hoặc thông qua việc lập trình lại tế bào miễn dịch (điều chỉnh biểu hiện bề mặt, cải thiện khả năng trình bày kháng nguyên hoặc điều chỉnh quá trình chết theo chương trình) [13, 14].
Thải nội độc tố
Một trong những liệu pháp loại bỏ nội độc tố được sử dụng rộng rãi nhất là hấp phụ bằng cột sợi cố định B-polymyxin (Toraymyxin®; Toray, Tokyo, Nhật Bản). Thiết bị lọc máu này được sử dụng thường xuyên ở Nhật Bản cho bệnh nhân bị nhiễm vi khuẩn gram âm, nhưng kết quả của các thử nghiệm lâm sàng gần đây vẫn không thuyết phục về tác động của Toraymyxin® đối với tỷ lệ tử vong [15]. Nhiều RCT so sánh sự hấp phụ polymyxin B với một điều trị tiêu chuẩn có kết quả mâu thuẫn, cho thấy rằng tác dụng tích cực của Toraymyxin® có thể lớn hơn ở các nhóm bệnh nhân cụ thể như bệnh nhân nặng, bệnh nhân có mức độ hoạt động nội độc tố (được đánh giá bằng xét nghiệm hoạt động nội độc tố) 0,6 và 0,9 hoặc những người có các đặc tính di truyền đặc biệt nào đó [16, 17].
Hình 1: Dòng thác miễn dịch và mục tiêu thanh lọc máu màng ngoài cơ thể. PAMP (Pathogen- associated molecular pattern), mô hình phân tử liên quan đến mầm bệnh; DAMP ( damage- associated molecular partern), mô hình phân tử liên quan đến thiệt hại.
Chất hấp phụ Alteco® LPS (Alteco Medical AB; Lund, Thụy Điển) có chứa một peptide tổng hợp được phát triển để hấp phụ nội độc tố. Peptide bao phủ bề mặt của chất nền polyetylen xốp được thiết kế để cung cấp bề mặt liên kết tối ưu. Một vài trường hợp ở người lớn bệnh nặng đã báo cáo giảm được nồng độ nội độc tố và cải thiện huyết động [18 – 20]. Tuy nhiên, trong nghiên cứu ASSET (sốc nhiễm trùng vùng bụng – điều trị hấp phụ endotoxin) RCT đa trung tâm đánh giá tính khả thi của chất hấp phụ Alteco® LPS đã bị chấm dứt sớm vì vấn đề tuyển dụng bệnh nhân [21].
Loại bỏ cytokine
Lọc máu thể tích cao (HVHF) là một liệu pháp thay thế thận liên tục (CRRT) với tốc độ siêu lọc cao (> 50 mL/kg/h) cung cấp loại bỏ các phân tử trọng lượng trung bình tan trong nước [22]. Sau các kết quả tích cực ở động vật, các nghiên cứu ở người cho thấy kết quả mâu thuẫn. Trong khi một số nghiên cứu cho thấy sự cải thiện các thông số huyết động và tỷ lệ tử vong thấp hơn dự kiến [23, 26], IVOIRE (high volume in intensive care: tích cao trong chăm sóc đặc biệt) đã không tìm thấy sự khác biệt đáng kể về tỷ lệ tử vong giữa nhóm thể tích cao (70 mL /kg/h) và nhóm thể tích tiêu chuẩn (35 ml/kg/h), nhưng cũng không thể tìm thấy sự cải thiện về kết quả thứ cấp như các thông số huyết động, điểm bệnh nặng và thời gian nằm viện [27] . Sự thiếu vắng của các hiệu ứng có lợi này đã được xác nhận bởi 2 phân tích tổng hợp gần đây [28, 29].
Để giải quyết các nhược điểm đáng kể của HVHF như mất các phân tử hoạt động nhỏ (chất dinh dưỡng, vitamin, nguyên tố vi lượng), lọc máu dạng tầng được phát triển. Hai bộ lọc máu với các mức cắt khác nhau được kết hợp trong một mạch màng ngoài cơ thể duy nhất duy nhất, cho phép loại bỏ độc quyền các phân tử trọng lượng trung bình [30]. Tuy nhiên, một nghiên cứu được thực hiện ở người đã không tìm thấy bất kỳ tác dụng có lợi nào của lọc máu theo tầng so với chăm sóc tiêu chuẩn [31].
Các màng có điểm cắt cao (lấy được các phân tử lớn) với lọc máu tĩnh mạch liên tục (CVVH) đã được chứng minh là cải thiện các thông số tim mạch ở bệnh nhân nhiễm trùng huyết nhưng phải trả giá cho rò rỉ albumin lớn [32, 33]. Những kết quả dương tính về các thông số huyết động không được xác nhận trong một RCT gần đây vì chưa tìm thấy bất kỳ sự giảm nào về nhu cầu norepinephrine trên bệnh nhân bệnh nặng có tổn thương thận cấp tính (AKI) được điều trị bằng CVVH và màng có điểm cắt cao so với CVVH và màng tiêu chuẩn [34]. Tuy nhiên, các màng này hiện đang được sử dụng với các phương pháp khuếch tán hoặc sau khi tối ưu hóa kết cấu của chúng để hạn chế mất albumin trong khi vẫn bảo tồn khả năng loại bỏ các phân tử trọng lượng phân tử trung bình [35, 36]. Các nghiên cứu quan sát bao gồm cả bệnh nhân bị sốc nhiễm trùng được điều trị bằng màng có điểm cắt cao và CRRT khuếch tán đã cho thấy loại bỏ hiệu quả các cytokine và giảm thời gian điều trị tích cực và tỷ lệ tử vong của đơn vị chăm sóc đặc biệt [37 – 39].
Kết hợp lọc và hấp phụ huyết tương (CPFA) là một kỹ thuật lọc máu, trong đó bộ lọc điểm cắt cao đầu tiên được đưa vào đầu mạch và tách huyết tương ra khỏi máu. Huyết tương từ từ chảy qua một vật liệu hấp phụ trước khi được đưa trở lại dây dẫn nơi tất cả máu sẽ trải qua quá trình lọc máu thông thường. Kết quả thú vị thu được trong thử nghiệm lâm sàng kết hợp lọc huyết tương và hấp thụ 1 (COMPACT 1), chủ yếu ở nhóm được điều trị liều cao nhất [40]. Thật không may, dường như thử nghiệm lâm sàng kết hợp giữa lọc huyết tương và hấp thụ 2 (COMPACT 2), đánh giá hiệu quả của liều cao, gần đây đã bị chấm dứt do các biến cố xấu liên quan đến CPFA (NCT01639664). Một bức thư đã được gửi đến tất cả người dùng CPFA trên toàn thế giới đề cập rằng CPFA không còn được chỉ định để điều trị sốc nhiễm trùng.
Kỹ thuật CytoSorb® (CytoSorbents, Monmouth Junction, NJ, USA) là 1 quả lọc máu chứa đầy các hạt polymer có thể hấp thụ các chất trung gian tiền viêm và chống viêm, nhưng không phải là nội độc tố [41]. Các thí nghiệm in vitro đã cho thấy tỷ lệ loại bỏ các cytokine > 90 – 95% [42]. Nó có thể loại bỏ không chỉ các cytokine phổ rộng mà còn cả myoglobin, bilirubin, axit mật, PAMPs và DAMPs [43]. Tuy nhiên, cho đến nay, các nghiên cứu lâm sàng vẫn còn hiếm hoi và thường giới hạn trong loạt ca báo cáo kết quả đáng khích lệ về các thông số huyết động và mức độ lactate máu [44, 45]. Một RCT gần đây đã so sánh điều trị tiêu chuẩn với lọc máu bằng CytoSorb® (6 giờ mỗi ngày trong 7 ngày) và không tìm thấy bất kỳ sự giảm nồng độ IL-6 huyết tương nào theo thời gian, mặc dù đã loại bỏ đáng kể trong các lần lọc [46]. Một số lo ngại đã được đưa ra liên quan đến liều tưới máu và hồ sơ miễn dịch ban đầu của bệnh nhân (nồng độ IL-6 huyết tương thấp ban đầu).
Máy lọc máu hấp phụ Cytokine được thiết kế chủ yếu cho RRT, nhưng vật liệu được sử dụng để xây dựng màng cũng có thể cung cấp các đặc tính hấp phụ có thể được sử dụng để lọc máu. Màng polymethylmethacrylate (PMMA) là màng polyme tổng hợp có cấu trúc vi mô đối xứng. Màng này không những có khả năng hấp phụ các phân tử trọng lượng phân tử nhỏ và trung bình như cytokine và beta-2microglobulin mà còn cả chuỗi nhẹ immunoglobulin [47]. Về đặc tính hấp phụ rất cao của nó, màng PMMA được đề xuất để lọc máu trong nhiễm trùng huyết. Lọc máu tĩnh mạch liên tục bằng lọc máu PMMA đã được báo cáo để cải thiện tỷ lệ sống sót sau 28 ngày ở bệnh nhân bị sốc nhiễm trùng [48]. Tuy nhiên, màng PMMA có tỷ lệ tắc nghẽn cao do sự hấp thụ protein không chọn lọc vào lỗ lọc, được đánh giá bằng sự gia tăng áp lực xuyên màng theo thời gian [49]. Tính gây huyết khối cao cũng được cho là do sự thay đổi cấu trúc của protein bị hấp phụ, gây ra sự kích hoạt tiểu cầu và độ bám dính trên bề mặt màng. Để giải quyết những vấn đề này, một màng dựa trên PMMA mới hạn chế sự thay đổi cấu trúc của protein hấp phụ gần đây đã được thiết kế, cho phép cải thiện tính thấm và tính chất hấp phụ được bảo tồn [50]. Điều này nên khuyến khích việc tiến hành các RCT lớn để xác nhận tính khả thi và hiệu quả của màng này
Loại bỏ cytokine và nội độc tố: màng oxiris®
Sự cải tiến của các quy trình công nghiệp đã dẫn đến sự phát triển của màng oXiris®, một màng phủ heparin được thiết kế đặc biệt để hấp thụ cytokine và endotoxin, cùng với RRT.
Từ an69 đến oxiris®
Màng AN69
Màng AN69 được phát triển ở Pháp và được đưa ra thị trường lần đầu tiên vào năm 1969. Nó bao gồm một chất trùng hợp kết hợp các phân tử acrylonitril và natri methallylsulfonate. Do các nhóm sulfonate, màng có điện tích âm cao và có khả năng hấp phụ các cytokine thông qua dư lượng cation của chúng. Màng này thể hiện một cấu trúc vi mô đối xứng với cấu trúc hydrogel. Loại thứ hai cho phép hấp phụ cytokine trong toàn bộ phần lớn của màng, tăng cường khả năng hấp phụ tổng thể. Trong một mô hình trên chó được gây sốc nội độc tố, CVVH với màng polyacrylonitrile đã cải thiện công cơ tim so với màng polysulfone (PS) không có đặc tính hấp phụ [51]. Tác dụng tích cực này được cho là do sự hấp phụ hiệu quả hơn các chất trung gian gây viêm. Một nghiên cứu trước đây được báo cáo bởi Kellum et al. [52] ủng hộ giả thuyết này khi họ báo cáo việc ngăn chặn mức tăng IL-6 dự kiến sau khi gây ra viêm phúc mạc ở động vật gặm nhấm được điều trị bằng màng AN69. Điều quan trọng là sự tiếp xúc giữa máu và bề mặt của màng có thể tạo ra bradykinin, có thể là nguyên nhân gây hạ huyết áp nặng, đặc biệt ở những bệnh nhân được điều trị bằng thuốc ức chế men chuyển angiotensin [53, 54].
Màng AN69 phủ heparin
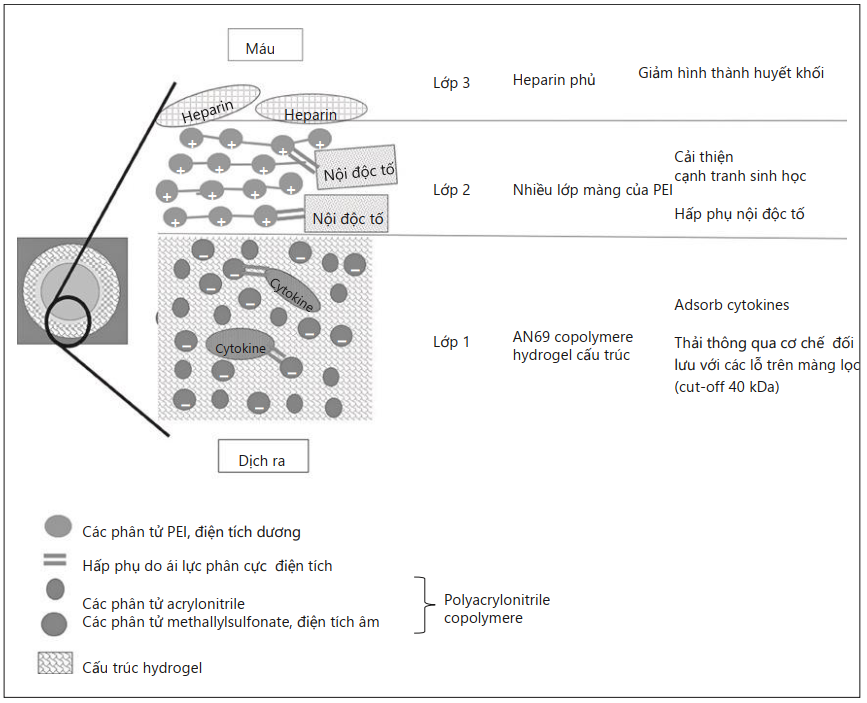
Để giải quyết cạm bẫy tương thích sinh học này, một phương pháp xử lý bề mặt cụ thể đã được thêm vào màng AN69. Xử lý bề mặt bao gồm một lớp phủ bằng polyethylen (PEI), một phân tử tích điện dương cho phép khả năng tương thích sinh học tốt hơn bằng cách giảm điện thế zeta của màng và do đó giảm sản xuất bradykinin. Lớp phủ PEI cũng mang lại cơ hội chống huyết khối vì quả lọc có thể được mồi bằng dung dịch heparin hóa (các điện tích dương tự do của polymer PEI cation có thể hấp phụ các phân tử heparin tích điện âm); heparin hấp phụ được cố định trên bề mặt màng nhưng vẫn hoạt động. Các nghiên cứu tiền cứu báo cáo đã giảm thành công liều heparin toàn thân trong điều trị thẩm tách máu ngắt quản mãn tính ở những bệnh nhân có nguy cơ chảy máu cao khi sử dụng màng AN69 phủ heparin (AN69ST) [55, 56].
Ưu điểm thứ hai của AN69ST là khả năng loại bỏ các cytokine được bảo tồn mặc dù điều trị bề mặt. Ví dụ, Yumoto et al. [49] đã báo cáo kết quả so sánh in vitro giữa 4 quả lọc máu khác nhau để loại bỏ HMGB1, một chất trung gian chính của viêm nhiễm do nhiễm trùng huyết. Trong nghiên cứu này, màng AN69ST thể hiện loại bỏ HMGB1 tốt hơn so với màng PMMA và loại bỏ tốt hơn nhiều so với màng polyarylethersulfone và PS [49]. Khả năng hấp phụ của AN69ST cũng được xác nhận lâm sàng ở những bệnh nhân cấp tính được điều trị bằng CRRT và màng AN69ST [57, 58].
Hình. 2. 3 lớp màng của oXiris®. PEI, polyethyleneimine.
Màng oXiris®
Qủa lọc máu oXiris® (Baxter, Meyzieu, Pháp) sau đó đã được phát triển để tăng cường các tính chất hấp phụ của màng AN69ST. So với AN69ST, màng oXiris® được phủ sẵn với trung bình 4.500 UI / m2 heparin trong khi sản xuất, trong khi AN69ST cần mồi với dung dịch heparin hóa để đạt được các đặc tính chống huyết khối. Cải tiến lớn thứ hai là với ghép PEI. Với số lượng nhóm amin tự do tích điện dương cao hơn nhiều, việc ghép PEI tuyến tính đặc biệt này cho thấy khả năng hấp thụ các phân tử tích điện âm lớn, chẳng hạn như nội độc tố. Do đó, màng oXiris® được tạo thành từ 3 lớp khác nhau và thiết kế độc đáo này cho phép kết hợp 4 tính chất trong 1 thiết bị: hỗ trợ thận, loại bỏ cytokine, loại bỏ nội độc tố và điều trị chống đông máu cục bộ (Hình 2).
Thải cytokine và nội độc tố
Tương tự như màng AN69 tự nhiên, sự hấp phụ cytokine vẫn có thể xảy ra ở phần lớn màng giữa nhóm axit amin điện tích dương của cytokine và nhóm sulfonate tích điện âm của copolyme màng. Hơn nữa, phương pháp điều trị PEI có thể hấp thụ các nội độc tố được cho là kích hoạt dòng thác miễn dịch.
Hai nghiên cứu thực nghiệm đã xác nhận những tính chất này.Trong một mô hình trên heo của sốc nhiễm trùng, HVHF với màng oXiris® được so sánh với HVHF với màng AN69 M100® (Gambro, Meyzieu, Pháp). Sáu giờ sau khi bắt đầu HVHF, nồng độ cytokine thấp hơn đáng kể đã được quan sát trong nhóm oXiris®, liên quan đến việc cải thiện các thông số huyết động, giảm thể tích dịch truyền và giảm nồng độ lactate trong máu. Nồng độ endotoxin thấp hơn đáng kể trong nhóm oXiris® sau khi bắt đầu HVHF [59].
Gần đây hơn, Malard et al. [42] đã tiến hành một thí nghiệm in vitro, so sánh sự hấp phụ endotoxin và cytokine với 3 thiết bị khác nhau: oXiris®, CytoSorb® và Toraymyxin®; oXiris® đã cho thấy để kết hợp khả năng hấp phụ endotoxin cao, tương tự như Toraymyxin®, với tỷ lệ loại bỏ các chất trung gian gây viêm tương đương với CytoSorb®.
Điều trị chống đông
Việc phủ trước với một lượng lớn heparin tạo ra lợi thế lớn cho những bệnh nhân có nguy cơ chảy máu cao hoặc những người có nguy cơ tích lũy citrate. Việc sử dụng màng lọc phủ trước heparine làm tăng tỷ lệ thành công các buổi chạy thận nhân tạo không liên tục không có heparin ở những bệnh nhân có nguy cơ chảy máu cao [60] và cho phép giảm liều heparin toàn thân, mà không ảnh hưởng đến cuộc lọc máu [61]. Tuy nhiên, không có nghiên cứu nào được công bố đánh giá cụ thể màng oXiris® về các đặc tính chống huyết khối của nó trong môi trường bệnh nhân nhiễm trùng cấp tính và CRRT. Do đó sử dụng thuốc chống đông là bắt buộc.
Đánh giá trong vivo
Mặc dù màng oXiris® đã có thể được sử dụng ở những bệnh nhân bị nhiễm trùng máu có AKI ở một số nước châu Âu và châu Á, nhưng các nghiên cứu lâm sàng liên quan đến bệnh nhân bệnh nặng vẫn còn khan hiếm và được báo cáo chủ yếu trong các cuộc thảo luận bằng miệng hoặc đại hội (Bảng 1). Shum và các cộng sự[62] đã báo cáo kết quả của 6 bệnh nhân bị nhiễm trùng huyết do vi khuẩn gram âm có AKI được điều trị bằng oXiris® và lọc máu tĩnh mạch liên tục (CVVH). Những bệnh nhân này được kết hợp với 24 đối chứng lịch sử được điều trị bằng CVVH và máy lọc máu lưu lượng cao PS. Điểm SOFA đã giảm đáng kể 37% sau 48 giờ sau khi bắt đầu ở nhóm oXiris® so với 3% ở nhóm kiểm soát [62].
Kết hợp với những phát hiện thực nghiệm được báo cáo trước đây, những nghiên cứu lâm sàng này cho thấy vai trò tích cực của quả lọc máu oXiris® trong quản lý nhiễm trùng huyết, có thể là do loại bỏ các chất trung gian gây viêm. Tuy nhiên, RCT là cần thiết để xác nhận thêm những kết quả này. Do đó, một số nghiên cứu gần đây đã được đưa ra và hiện đang được tiến hành. Kết quả từ một RCT tiềm năng được tiến hành ở Thụy Điển sẽ sớm được cung cấp. Thử nghiệm chéo này bao gồm những bệnh nhân bị nhiễm vi khuẩn gram âm được điều trị bằng oXiris® hoặc quả lọc máu ST-150 tiêu chuẩn. Biến số kết cuộc chính là thay đổi nồng độ endotoxin, nồng độ cytokine và thay đổi thông số huyết động (NCT 02600312). Một thử nghiệm đa trung tâm thứ hai đang trong giai đoạn tuyển chọn mẫu, loại bỏ nội độc tố và loại bỏ cytokine trong quá trình lọc máu liên tục với thử nghiệm oXiris® (ECRO), vừa mới bắt đầu. Nghiên cứu này chọn ngẫu nhiên bệnh nhân nhiễm trùng phúc mạc do viêm phúc mạc và AKI KDIGO giai đoạn 2 để nhận CVVH bằng quả lọc máu oXiris® hoặc bộ lọc tiêu chuẩn HF-1400 (NCT03426943). Một thử nghiệm thứ ba, nghiên cứu ENDoX (NCT 01948778) sẽ so sánh màng oXiris® với cột sợi cố định B-polymyxin B (Toramyxin®) trên mức hoạt động endotoxin 72 h sau khi bắt đầu điều trị ở bệnh nhân bị sốc nhiễm trùng và mức độ hoạt động của endotoxin.
Những ưu điểm và hạn chế
Tính đơn giản
Vì màng oXiris® kết hợp chức năng lọc máu và chức năng hỗ trợ thận trong một thiết bị duy nhất, nên việc sử dụng rất đơn giản và không cần huấn luyện y tá bổ sung. Hơn nữa, việc sử dụng màng này trong thực hành lâm sàng không làm tăng khối lượng công việc điều dưỡng, so với 1 cuộc CRRT tiêu chuẩn.
Dị ứng heparin
Do việc phủ heparin là chủ yếu, chống chỉ định chính của màng oXiris® liên quan đến bệnh nhân có tiền sử dị ứng heparin hoặc giảm tiểu cầu do heparin.
Loại bỏ không mong muốn các vi chất dinh dưỡng và các chất hoạt động
Sự thay đổi lớn và mức kháng sinh không đầy đủ trong CRRT đã được đề cập trước đây [63]. Điều quan trọng là phải xem xét rằng màng oXiris® có thể hấp thụ không chỉ các cytokine và nội độc tố mà cả các chất điều trị và hoạt động như vancomycin và amikacin [64, 65]. Theo hiểu biết tốt nhất của chúng tôi, không có nghiên cứu lâm sàng nào tập trung vào việc mất kháng sinh và vi chất dinh dưỡng với CRRT có sử dụng quả lọc máu hấp phụ cao. Một chiến lược theo dõi thuốc cẩn thận nên được khuyến cáo để đảm bảo nồng độ kháng sinh thích hợp trong bối cảnh cụ thể này [66].
Những câu hỏi chưa được trả lời
Tuổi thọ của quả lọc
Câu hỏi liên quan đến thời lượng sử dụng tối ưu vẫn chưa được giải quyết. Khả năng hấp phụ có thể giảm theo thời gian, do hiện tượng bão hòa và do đó làm giảm việc loại bỏ các cytokine và endotoxin theo thời gian. Để duy trì việc loại bỏ cytokine và endotoxin, De Vriese và các cộng sự [67] đề nghị thay đổi thường xuyên quả hấp phụ. Tuy nhiên, điều này phải được cân nhắc với sự gia tăng khối lượng công việc của y tá và sự gián đoạn điều trị cần thiết để thay đổi quả lọc máu. Ngoài ra, Yumoto và các cộng sự [49] không thể xác định hiệu ứng bão hòa của HMGB-1 trên AN69ST, cho thấy khả năng hấp phụ cực cao của màng, do cấu trúc vi mô đặc biệt của nó cho phép hấp phụ toàn bộ. Hướng dẫn sử dụng khuyên bạn nên thay đổi bộ lọc sau mỗi 24 giờ, nhưng nó có thể được sử dụng trong tối đa 72 giờ.
Thời gian bắt đầu
Nếu thời điểm bắt đầu RRT cho AKI là một câu hỏi chưa được trả lời và phần lớn được tranh luận, thì nó cũng cực kỳ quan trọng đối với các liệu pháp thanh lọc máu cho nhiễm trùng huyết. Màng oXiris®, với chức năng đặc biệt của nó trên cả endotoxin và cytokine, có lẽ có lợi hơn nếu được thực hiện sớm trong quá trình nhiễm trùng huyết, do đó hạn chế đáp ứng miễn dịch của vật chủ. Trong một nghiên cứu lâm sàng bao gồm 15 bệnh nhân bị nhiễm trùng nghiêm trọng trải qua CRRT với màng oXiris®, áp dụng sớm (trong vòng 3 giờ sau khi hồi sức đầy đủ) điều trị dường như cải thiện kết quả (giảm sử dụng thuốc vận mạch, điểm SOFA, cải thiện khả năng sống sót) so với bắt đầu trong một lựa chọn cuối cùng sau khi tổn thương cơ quan đã bắt đầu [68]. Vấn đề này phải được giải quyết bởi các RCT lớn.
Bệnh nhân
Vẫn chưa có câu trả lời nào cho bệnh nhân sẽ được hưởng lợi nhiều nhất từ việc điều trị bằng oXiris®. Hầu hết các nghiên cứu hoặc các trường hợp lâm sàng được báo cáo đã bao gồm bệnh nhân nhiễm trùng huyết do vi khuẩn gram âm vì nội độc tố là thành phần chính của các vi sinh vật đó, không giống như vi khuẩn Gram dương. Tuy nhiên, phương pháp điều trị này cũng có thể có lợi trong trường hợp sốc nhiễm trùng do vi khuẩn gram dương, vì việc giảm tưới máu đường ruột thường dẫn đến sự di chuyển của vi khuẩn gram âm từ lòng tiêu hóa vào máu. Mức độ nghiêm trọng của nhiễm trùng huyết và mức độ nội độc tố cũng có thể giúp bác sĩ lâm sàng lựa chọn những bệnh nhân sẽ được hưởng lợi nhiều nhất từ việc điều trị bằng oXiris®. Tương tự, gần đây người ta đã đề xuất rằng hấp thụ nội độc tố với polymyxin B có thể có lợi hơn ở nhóm bệnh nhân có xét nghiệm hoạt động nội độc tố ≥ 0.6 – 0,89 [16]. Vì màng oXiris® cũng cung cấp hỗ trợ thận cho AKI, hiện tại nó chủ yếu được sử dụng ở những bệnh nhân bị AKI và chỉ định điều trị RRT. Cho dù nó có thể có lợi ở những bệnh nhân không có AKI vẫn chưa được biết, nhưng các bác sĩ lâm sàng nên biết rằng một số nghiên cứu cho thấy tác động tiêu cực đáng kể của việc bắt đầu CRRT quá sớm ở bệnh nhân nhiễm khuẩn huyết [69].
Một số tác giả cho rằng việc sử dụng nó trong phẫu thuật bắc cầu tim phổi có thể làm giảm nồng độ chất trung gian gây viêm và do đó làm giảm rối loạn chức năng cơ quan và đặc biệt làm giảm tỷ lệ mắc AKI sau phẫu thuật tim. Các tác giả này đã tiến hành một RCT giải quyết giả thuyết này, nhưng kết quả vẫn chưa được công bố (NCT02398019).
Hoạt động ở mức độ tế bào
Trong thập kỷ qua, các nhà khoa học đã phát triển các phương pháp điều trị mới của rối loạn miễn dịch liên quan đến nhiễm trùng huyết nhắm vào tác nhân hoặc các tế bào miễn dịch của vật chủ. Việc loại bỏ hàng loạt tác nhân ra khỏi máu có thể tránh được sự khởi phát dòng thác miễn dịch, và trong tương lai, nó cũng có thể mang đến cơ hội điều trị trong trường hợp tác nhân kháng thuốc lan rộng. Các thiết bị khác nhau đã được phát triển với mục tiêu này. Bộ lọc máu ái lực Seraph® 100 Microbind® (ExThera Medical, Martinez, CA, USA) là một phương pháp điều trị thay huyết tương ái lực bằng cách sử dụng các cột heparin. Nó bao gồm các cột được đóng gói bằng hạt polyetylen mà trên đó heparin đã được cố định hóa trị. Nhiều tác nhân vi sinh sử dụng glycosaminoglycan, chẳng hạn như heparan sulfate, trên bề mặt tế bào người làm thụ thể. Bởi vì heparin có cấu trúc tương tự như heparan sulfate, nó cũng có thể liên kết các vi sinh vật này. Các nghiên cứu tiền lâm sàng đã xác nhận rằng Seraph® có khả năng liên kết các tác nhân vi sinh khác nhau như virut, cả vi khuẩn Gram âm và Gram dương, vi khuẩn kháng thuốc, và cả cytokine [70, 71]. Gần đây, một nghiên cứu an toàn đầu tiên ở người đã được hoàn thành ở Đức ở những bệnh nhân trải qua RRT; kết quả vẫn chưa được công bố (NCT02914132).
FcMBL (Opsonix, Wakefield, MA, USA) là một protein tái tổ hợp biến đổi gen có nguồn gốc từ thảo dược liên kết với opsonin mannose (MBL) và liên kết với nhánh Fc của một loại globulin miễn dịch ở người. Opsonin MBL có khả năng liên kết một cách tự nhiên các mẫu carbohydrate của tác nhân (PAMPs) được tìm thấy trên bề mặt của tất cả các mầm bệnh (vi khuẩn, vi rút, nấm, ký sinh trùng, độc tố) [72]. Một thiết bị hấp phụ ngoại bào được làm bằng máy lọc máu có chứa các sợi PS rỗng được phủ FcMBL do đó có thể loại bỏ mầm bệnh từ máu chảy qua mạch ngoại bào. Nghiên cứu trên động vật đầu tiên đánh giá thiết bị mới này đã cho thấy kết quả đầy hứa hẹn, có tác dụng hiệp đồng với kháng sinh. Didar et al. [73] quan sát thấy rằng điều trị bằng kháng sinh diệt khuẩn ở chuột bị nhiễm trùng máu dẫn đến sự gia tăng lớn của nồng độ PAMPs trong máu, nhưng những PAMP này đã được loại bỏ tích cực khỏi máu bằng thiết bị hấp phụ FcMBL; trên lâm sàng, họ cũng quan sát thấy các dấu hiệu sinh tồn ổn định hơn ở chuột bị nhiễm trùng máu được điều trị bằng kháng sinh và FcMBL-hemoadsoprtion so với chỉ dùng kháng sinh.
Hemopurifier® (Aethlon Medical, San Diego, CA, USA) là một thiết bị thay huyết tương ái lực có thể loại bỏ virus khỏi máu. Nó kết hợp bước đầu tiên của quá trình tách huyết tương bằng cách sử dụng plasmafilter và bước thứ hai để bắt virus thông qua các chất ái lực được cố định trong các khoảng trống mao mạch của plasmafilter. Tác nhân ái lực được sử dụng trong Hemopurifier® là một loại protein từ thảo dược (hoa tuyết điểm) (Galanthus Nivalis Agglutinin) có ái lực cao với glycoprotein có mặt khắp nơi trên bề mặt của virut bao bọc. Liệu pháp này đã được sử dụng thành công để điều trị một bệnh nhân mắc bệnh do vi rút Ebola nặng [74].
Cuối cùng, vì bạch cầu được kích hoạt là nhân tố chính gây bệnh nhiễm trùng huyết, nên một phương pháp khác bao gồm loại bỏ các tế bào miễn dịch được kích hoạt ra khỏi máu [13, 75, 76]. Pino và cộng sự. [75] đã phát triển một thiết bị tế bào chất chọn lọc (SCD) bao gồm một màng sinh học tổng hợp liên kết các bạch cầu hoạt hóa. Thiết bị này phải được bao gồm trong một mạch ngoại bào với chống đông máu citrate khu vực. Sau khi chảy qua bộ lọc máu CRRT, máu được chuyển qua màng ngoại bào của SCD nơi bạch cầu hoạt hóa (chủ yếu là bạch cầu trung tính) được hấp phụ [77]. Trong một nghiên cứu tiền lâm sàng trên lợn nhiễm khuẩn, SCD với citrate đã cải thiện đáng kể các thông số tim mạch và giảm bạch cầu hoạt hóa trong phổi so với các nhóm đối chứng (SCD với heparin hoặc không có SCD); nó cũng cải thiện chức năng thận và thời gian sống còn [78]. Một nghiên cứu tiền cứu, một trung tâm đã được thực hiện để đánh giá sự an toàn và hiệu quả của SCD trên bệnh nhân AKI cần điều trị RRT. Tỷ lệ tử vong trong nhóm điều trị SCD là 22%, trong khi đó là 78% đối với các đối chứng trường hợp (p = 0,027) [79]. Một RCT đa trung tâm bao gồm 134 bệnh nhân ICU bị AKI để nhận CRRT một mình hoặc CRRT cộng với SCD đã xác nhận sự an toàn của thiết bị nhưng không tìm thấy sự thay đổi về tỷ lệ tử vong. Tuy nhiên, tỷ lệ tử vong giảm không đáng kể đã được quan sát thấy ở nhóm phụ bệnh nhân điều trị SCD có canxi ion hóa trong mạch
Thật thú vị, người ta đã đề xuất rằng các thiết bị hấp thụ máu như CytoSorb® cũng có thể hấp thụ bạch cầu (chủ yếu là bạch cầu đơn nhân và bạch cầu trung tính) ngoài các mục tiêu được chỉ định của chúng (cytokine và / hoặc endotoxin), và do đó điều chỉnh phản ứng miễn dịch ở cấp độ tế bào [14 ]. Hơn nữa, Srisawat et al. [81] đã gợi ý rằng polymyxin B cũng có thể hoạt động ở cấp độ tế bào của điều chỉnh miễn dịch, bằng cách cải thiện biểu hiện của kháng nguyên bạch cầu đơn nhân ở bề mặt bạch cầu ở bệnh nhân ICU bị nhiễm trùng huyết. Những quan sát này cho thấy các kỹ thuật lọc máu vẫn chưa được hiểu đầy đủ và có thể hàm ý các cơ chế hoạt động khác nhau.
Chiến lược dung nạp và y học chính xác
Việc sử dụng các kỹ thuật lọc máu màng ngoài cơ thể vẫn còn gây tranh cãi vì các kết quả mâu thuẫn được quan sát thấy trong RCT. Chúng tôi đưa ra giả thuyết rằng, như trong các lĩnh vực chăm sóc đặc biệt khác, kết quả của âm tính trên quan sát được trong một số nghiên cứu có thể là do sự không đồng nhất của các bệnh nhân bao gồm và / hoặc thời gian, liều lượng hoặc thời gian điều trị không phù hợp. Do đó, điều quan trọng là phải lựa chọn cẩn thận các bệnh nhân tham gia vào các thử nghiệm trong tương lai để cung cấp cho mỗi bệnh nhân một liệu pháp tốt nhất theo cách cá nhân hóa điều trị. Một liệu pháp phù hợp lý tưởng nên được điều chỉnh phù hợp với quá trình nhiễm trùng huyết, mức độ nghiêm trọng của bệnh nhân, cũng như hồ sơ di truyền và miễn dịch [82]. Điều quan trọng, dấu ấn sinh học miễn dịch hiện không thực hiện thường qui. Do đó, các thử nghiệm liên tục mô tả hồ sơ miễn dịch của bệnh nhân nhiễm khuẩn huyết trong ICU có thể sẽ giúp các bác sĩ lâm sàng lựa chọn tốt hơn những bệnh nhân có thể hưởng lợi nhiều nhất từ việc lọc máu và chọn liệu pháp tốt nhất theo hồ sơ miễn dịch của họ [83, 84].
Kết luận
Một số liệu pháp thanh lọc máu với màng ngoài cơ thể hiện có thể sử dụng. Hầu hết các mục tiêu thanh lọc nội độc tố và / hoặc các cytokine và nhằm khôi phục phản ứng miễn dịch cân bằng. Cho đến nay, màng oXiris® hấp phụ cao là liệu pháp duy nhất kết hợp loại bỏ cả nội độc tố và cytokine, thay thế chức năng thận và cung cấp các đặc tính chống huyết khối. Mặc dù những phát hiện đáng khích lệ thu được từ loạt ca bệnh và đánh giá thực nghiệm, việc thiếu RCT lâm sàng hiện nay đã hạn chế sự chấp nhận lâm sàng của màng này bởi các bác sĩ lâm sàng. Cùng với các liệu pháp phù hợp với bệnh nhân, sự phát triển nghiên cứu trong tương lai cũng được dự kiến với các liệu pháp nhắm vào cấp độ tế bào của đáp ứng miễn dịch. Do đó, như đã đề cập trong SSC 2016, các liệu pháp lọc máu với màng ngoài cơ thể có thể được quan tâm trong cuộc chiến chống nhiễm trùng huyết, nhưng cần nghiên cứu thêm để làm rõ cơ chế hoạt động, chỉ định và lợi ích lâm sàng của họ [85].
Bảng 1. Các nghiên cứu đánh giá haemofilter oXiris® ở bệnh nhân người lớn được đưa vào các đơn vị chăm sóc tích cực (tóm tắt).
|
Tác giả, năm |
Dân số |
Số bệnh nhân |
Thiết kế nghiên cứu |
Mục tiêu chính |
Can thiệp |
So sánh |
Kết quả |
|
Adamik et al. [20], 2013 |
Shock nhiễm trùng có AKI đòi hỏi RRT Nội độc tố nghi ngờ do nhiễm trùngGNB |
7 |
POS |
Cải thiện HDN Thay đổi EA |
CRRT-oXiris® |
Trước/sau |
↘mức EA * ↘ nhu cầuNE* ↘điểm SOFA* ↘PCT ↗MAP* |
|
Broman et al. [86], 2018 |
Shock nhiễm trùng có AKI đòi hỏi RRT EA >0.03 EU/mL GNB |
16 |
RCT Bắt chéo Mù đôi |
Thay đổi EA Thay đổi mức cytokine (TNFα, interleukins, interferon-y và GM-CSF) |
CRRT-oXiris® 24 h |
CRRT-chuẩn 24 h |
↘giảm EA trong 8 h đầu Mức thay đổi cytokine tương tự |
|
Candidi et al. [87], 2012 |
Hậu phẫu nhiễm trùng máu do CPB Shock nhiễm trùng có AKI đòi hỏi RRT RRT EA >0.6 EU/mL |
25 |
POS |
Tính an toàn Đáp ứng về tim mạch Thay đổi IL-6 và PCT |
CVVHDF-oXiris® Dịch thay thế: 50 mL/kg/h |
Trước/sau |
↘ nhu cầuNE * ↘điểm SOFA* ↘PCT và IL-6* ↗MAP* ↗nước tiểu* |
||||||
|
Caravetta et al. [88], 2013 |
Nhiễm trùng huyết nặng Shock nhiễm trùng có AKI |
34 |
POS |
Cải thiệnHDN Thay đổi IL-6 và PCT |
CVVHDF-oXiris® Liều thay thế: 40 mL/kg/h |
Trước/sau |
↘điểm SOFA* ↗MAP* ↘nhu cầuNE* ↘PCT và IL-6 * ↗nước tiểu* |
||||||
|
Govil et al. [89] 2017 |
Nhiễm trùng huyết AKI |
10 |
ROS |
Thay đổi mức cytokine |
CRRT-oXiris® |
Trước/sau |
↘ IL-6, IL-10, NE ở 6/10 bệnh nhân ↗UO |
||||||
|
Govil et al. [89] 2017 |
Nhiễm trùng huyết có AKI |
15
|
ROS |
Tác động của thời điểm khởi đầu |
Nhóm sớm (n = 10): bắt đầu CRRT -oXiris® trong vòng 3 h sau khi hồi sức dịch đủ |
Nhóm trễ (n = 5): bắt đầu CRRT- oXiris® khi điều trị cuối cùng |
Nhóm sớm: ↘ nhu cầu NE và SOFA nhiều hơn ↗ MAP và UO nhiều hơn Sống còn: 7/10 vs. 1/5 |
||||||
|
Kelway et al. [90], 2017 |
CVVH |
93 |
ROS |
Thời gian, hiệu quả (URR), suy chức năng và giá cả giữa 2 loại quả lọc với hiệu quả chống đông. |
CRRT-oXiris® |
CRRT-AN69ST |
Không có sự khác biệt về thời gian,URR và suy chức năng. CVVH- oXiris® mắc hơn |
||||||
|
Lumlertgul et al. [91] 2018 |
Shosck nhiễm trùng có AKI đòi hỏi RRT, có suy chức năng >2 các cơ quan |
35 |
ROS |
Cải thiện HDN |
CRRT-oXiris® |
Trước/sau |
↘ nhu cầu NE ↘ lactate máu* ↘ kiềm dư * ↗MAP |
||||||
|
Martin et al. [92], 2009 |
AKI đòi hỏi RRT ± kháng đông hệ thống ± nguy cơ chảy máu (PT |
25 |
POS Đa trung tâm |
Tuổi thọ quả lọc không chống đông. |
CVVHF-oXiris® Liều dịch thay thế: 35 mL/kg/h |
2 phân nhóm: có/
|
OXiris thời gian trung
|
||||||
|
Mikolasevic et al. [93], 2015 |
AKI requiring CRRT GNB infection |
6
|
POS |
Safety, efficacy |
CVVHDF-oXiris® within 24–48 h of ICU admission Effluent dose: >25 mL/kg/h |
Before/after |
↘CRP ↘Leucocytes ↗MAP ↘NE requirements 3 patients survived |
||||||
|
Plata-Menchaca et al. [94], 2016 |
CPB |
20 |
Tiến cứu có đối chứng |
Tính an toàn và linh hoạt |
CPB + CRRT-oXiris® |
Chỉ CPB |
↘IL-1 và IL-6 ↗IL-4 và IL-10 Không tác dụng phụ |
||||||
|
Prato et al. [95], 2017 |
Shock nhiễm trùng có AKI |
17 |
ROS |
Cải thiện HDN Thay đổi các marker viêm |
CVVHDF-oXiris® |
Trước/sau |
↘ NE ↘PCT và CRP 7 bệnh nhân sống còn |
||||||
|
Tang et al. [96], 2018 |
Shock nhiễm trùng có AKI GNB hay GPB |
12 |
ROS |
So sánh bệnh nhân sống còn và không sống còn |
CRRT-oXiris® Sống còn (n = 4) |
CRRT-oXiris® không sống còn (n = 8) |
Bệnh sống còn có thời gian khởi đầu ngắn hơ (7.2 vs. 12.5 h)↘ vận mạch và lactate sớm hơn ở GPB so GNB: 24 vs. 72 h |
||||||
|
Tang et al. [97], 2016 |
Nhiễm khuẩn ổ bụng gây shock nhiễm trùng có AKI cần RRT |
8 |
|
Cải thiện HDN |
CVVHDF-oXiris® (n = 3) |
CVVHDF chuẩn(n = 5)
|
Tử vong oXiris®33 vs. 60% ↘giảm nhu cầuNE* không có khác biệt thời gian thở my và CRRT, nằm ICU |
||||||
|
Tang et al. [97], 2016 |
Shock nhiễm trùng |
|
|
Cải thiện HDN và tưới máu mô |
CVVHDF-oXiris® Trong vòng 24h nhập ICU |
Trước/sau |
↘NE * ↘ lactate máu ↘CRP 6 bệnh nhân sống |
||||||
|
Turani et al. [99], 2013 |
Nhiễm trùng huyết Shock nhiễm trùng có EA >0.6 EU/mL |
|
|
Tính an toàn Cải thiện HDN Thay đổi EA Thay đổi mức cytokine |
CVVHDF-oXiris® Liều: >50 mL/kg/h |
Trước/sau |
↗ UO ↘NE* ↘IL-6* ↘PCT * ↘EA |
||||||
|
Turani et al. [100], 2015 |
Nhiễm trùng huyết nặng |
24 |
POS |
(1)đánh giá có hay không huyết khối mạch để phát hiện tình trạng tăng đông (2)đánh giá thay đổi đông máu với oXiris® |
CPFA-heparin |
CPFA-Citrate CRRT-oXiris® |
oXiris® không đảo ngược tình trạng tăng đông do nhiễm trùng nhưng phục hồi khả năng tiêu sợi huyết |
||||||
|
Turani et al. [101], 2016 |
Nhiễm trùng huyết Shock nhiễm trùng AKI EA >0.6 |
53 |
POS |
Thay đổi EA Thay đổi IL-6 và PCT |
CRRT-oXiris® |
3 nhóm: EA >0.6 EA 0.4–0.59 EA |
↘ EA, Il-6 và PCT ở nhóm1 EA thấp hơn sau 48h ở nhóm sống còn (n = 33) so với nhóm không sống còn (n = 20) |
||||||
|
Turani et al. [102], 2018 |
Shock nhiễm trùng AKI |
73 |
Đoàn hệ |
Thay đổi mức cytokine và PCT Cải thiện tim-thận |
RRT-oXiris® (n = 50) |
RRT chuẩn (n = 23) |
Ở nhóm oXiris®: ↘IL-6, PCT, nhu cầu NE* ↗MAP, UO, PaO2/Fi02, Nhóm điều trị chuẩn: không cải thiện |
||||||
* p
RRT, thay thế thận; CRRT, thay thế thận liên tục; CVVH, siêu lọc máu liên tục tĩnh mạch-tĩnh mạch; CVVHDF, siêu lọc thẩm tách máu liên tục tĩnh mạch-tĩnh mạch; TMP, áp lực xuyên màng; AKI, tổn thương thận cấp; GNB, trực khuẩn gram âm; GPB, trực khuẩn gram dương; CPB, phẫu thuật bắc cầu tim phổi; HDN, huyết động; MAP, huyết áp trung bình; NE, norepinephrine; PCT, procalcitonin; EA, hoạt động nội độc tố; IL-6, interleukine-6; URR, giảm tỷ số ure; UO, nước tiểu; POS, nghiên cứu quan sát tiến cứu; ROS, nghiên cứu quan sát hồi cứu; ns, không có ý nghĩa.
Acknowledgement
The authors thanks Philip Robinson for helping in manuscript preparation.
Disclosure statement
C.M. has received speaker honoraria from Fresenius Medical Care. T.R. has received speaker and/or consulting honoraria from Astute, Fresenius Medical Care, Baxter Healthcare Corp., Biomérieux, Medtronic, Nikkiso, and B. Braun. He is the principal investigator of the ECRO trial, comparing the effects of the oXiris® membrane to a standard membrane on endotoxins and cytokines levels during peritonitis-induced septic shock (NCT 03426943). C.R. is consultant or has received speakers honoraria from Astute, Biomerieux, Baxter, Asahi, Medtronic, Estor, Toray, B. Braun, FMC, GE, Ortho.
Financial support
None.
Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016 Feb; 315(8): 801–10.
Shankar-Hari M, Deutschman CS, Singer M. Do we need a new definition of sepsis? Intensive Care Med. 2015 May; 41(5): 909– 11.
Ankawi G, Neri M, Zhang J, Breglia A, Ricci Z, Ronco C. Extracorporeal techniques for the treatment of critically ill patients with sepsis beyond conventional blood purification therapy: the promises and the pitfalls. Crit Care. 2018 Oct; 22(1): 262.
Prince LR, Whyte MK, Sabroe I, Parker LC. The role of TLRs in neutrophil activation. Curr Opin Pharmacol. 2011 Aug; 11(4): 397– 403.
Ronco C, Tetta C, Mariano F, Wratten ML, Bonello M, Bordoni V, et al. Interpreting the mechanisms of continuous renal replacement therapy in sepsis: the peak concentration hypothesis. Artif Organs. 2003 Sep; 27(9): 792– 801.
Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013 Aug; 369(9): 840–51.
Zarbock A, Gomez H, Kellum JA. Sepsisinduced acute kidney injury revisited: pathophysiology, prevention and future therapies. Curr Opin Crit Care. 2014 Dec; 20(6): 588– 95.
Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach. Lancet Infect Dis. 2013 Mar; 13(3): 260–8.
Francois B, Jeannet R, Daix T, Walton AH, Shotwell MS, Unsinger J, et al. Interleukin-7 restores lymphocytes in septic shock: the IRIS-7 randomized clinical trial. JCI Insight. 2018 Mar; 3(5): 98960.
Rimmelé T, Kellum JA. Clinical review: blood purification for sepsis. Crit Care. 2011; 15(1): 205.
Peng ZY, Wang HZ, Carter MJ, Dileo MV, Bishop JV, Zhou FH, et al. Acute removal of common sepsis mediators does not explain the effects of extracorporeal blood purification in experimental sepsis. Kidney Int. 2012 Feb; 81(4): 363–9.
Ronco C. Endotoxin removal: history of a mission. Blood Purif. 2014; 37(s1 Suppl 1): 5– 8.
Peng Z, Singbartl K, Simon P, Rimmelé T, Bishop J, Clermont G, et al. Blood purification in sepsis: a new paradigm. Contrib Nephrol. 2010; 165: 322–8.
Rimmelé T, Kaynar AM, McLaughlin JN, Bishop JV, Fedorchak MV, Chuasuwan A, et al. Leukocyte capture and modulation of cellmediated immunity during human sepsis: an ex vivo study. Crit Care. 2013 Mar; 17(2):R59.
Payen D. Haemoperfusion with polymyxin B membrane: recent results for an old debate! Anaesth Crit Care Pain Med. 2019 Feb; 38(1): 3–4.
Klein DJ, Foster D, Walker PM, Bagshaw SM, Mekonnen H, Antonelli M. Polymyxin B hemoperfusion in endotoxemic septic shock patients without extreme endotoxemia: a post hoc analysis of the EUPHRATES trial. Intensive Care Med. 2018 Dec; 44(12): 2205–12.
Chang T, Tu YK, Lee CT, Chao A, Huang CH, Wang MJ, et al. Effects of Polymyxin B Hemoperfusion on Mortality in Patients With Severe Sepsis and Septic Shock: A Systemic Review, Meta-Analysis Update, and Disease Severity Subgroup MetaAnalysis. Crit Care Med. 2017 Aug; 45(8):e858–64.
Ala-Kokko TI, Laurila J, Koskenkari J. A new endotoxin adsorber in septic shock: observational case series. Blood Purif. 2011; 32(4): 303–9.
Yaroustovsky M, Abramyan M, Popok Z, Nazarova E, Stupchenko O, Popov D, et al. Preliminary report regarding the use of selective sorbents in complex cardiac surgery patients with extensive sepsis and prolonged intensive care stay. Blood Purif. 2009; 28(3): 227–33.
Adamik B, Zielinski S, Smiechowicz J, Kübler A. Endotoxin Elimination in Patients with Septic Shock: An Observation Study. Arch Immunol Ther Exp (Warsz). 2015 Dec; 63(6): 475–83.
Lipcsey M, Tenhunen J, Sjölin J, Frithiof R, Bendel S, Flaatten H, et al. Abdominal Septic Shock – Endotoxin Adsorption Treatment (ASSET) – endotoxin removal in abdominal and urogenital septic shock with the Alteco® LPS Adsorber: study protocol for a doubleblinded, randomized placebocontrolled trial. Trials. 2016 Dec; 17(1): 587.
Kellum JA, Johnson JP, Kramer D, Palevsky P, Brady JJ, Pinsky MR. Diffusive vs. convective therapy: effects on mediators of inflammation in patient with severe systemic inflammatory response syndrome. Crit Care Med. 1998 Dec; 26(12): 1995– 2000.
Cole L, Bellomo R, Journois D, Davenport P, Baldwin I, Tipping P. High-volume haemofiltration in human septic shock. Intensive Care Med. 2001 Jun; 27(6): 978– 86.
Honore PM, Jamez J, Wauthier M, Lee PA, Dugernier T, Pirenne B, et al. Prospective evaluation of short-term, high-volume isovolemic hemofiltration on the hemodynamic course and outcome in patients with intractable circulatory failure resulting from septic shock. Crit Care Med. 2000 Nov; 28(11): 3581–7.
Tapia P, Chinchón E, Morales D, Stehberg J, Simon F. Effectiveness of short-term 6hour high-volume hemofiltration during refracto- ry severe septic shock. J Trauma Acute Care Surg. 2012 May; 72(5): 1228–37; discussion 1237-8.
Ratanarat R, Brendolan A, Piccinni P, Dan M, Salvatori G, Ricci Z, et al. Pulse highvolume haemofiltration for treatment of severe sepsis: effects on hemodynamics and survival. Crit Care. 2005 Aug; 9(4):R294– 302.
Joannes-Boyau O, Honoré PM, Perez P, Bagshaw SM, Grand H, Canivet JL, et al. Highvolume versus standard-volume haemofiltration for septic shock patients with acute kidney injury (IVOIRE study): a multicentre randomized controlled trial. Intensive Care Med. 2013 Sep; 39(9): 1535–46.
Borthwick EM, Hill CJ, Rabindranath KS, Maxwell AP, McAuley DF, Blackwood B. High-volume haemofiltration for sepsis in adults. Cochrane Database Syst Rev. 2017 Jan; 1:CD008075.
Clark E, Molnar AO, Joannes-Boyau O, Honoré PM, Sikora L, Bagshaw SM. Highvolume hemofiltration for septic acute kidney injury: a systematic review and meta-analysis. Crit Care. 2014 Jan; 18(1):R7.
Rimmelé T, Wey PF, Bernard N, Monchi M, Semenzato N, Benatir F, et al. Hemofiltration with the Cascade system in an experimental porcine model of septic shock. Ther Apher Dial. 2009 Feb; 13(1): 63–70.
Quenot JP, Binquet C, Vinsonneau C, Barbar SD, Vinault S, Deckert V, et al. Very high volume hemofiltration with the Cascade system in septic shock patients. Intensive Care Med. 2015 Dec; 41(12): 2111–20.
Morgera S, Haase M, Kuss T, Vargas-Hein O, Zuckermann-Becker H, Melzer C, et al. Pilot study on the effects of high cutoff hemofiltration on the need for norepinephrine in septic patients with acute renal failure. Crit Care Med. 2006 Aug; 34(8): 2099–104.
Morgera S, Rocktäschel J, Haase M, Lehmann C, von Heymann C, Ziemer S, et al. Intermittent high permeability hemofiltration in septic patients with acute renal failure. Intensive Care Med. 2003 Nov; 29(11): 1989–95.
Atan R, Peck L, Prowle J, Licari E, Eastwood GM, Storr M, et al. A DoubleBlind Randomized Controlled Trial of High Cutoff Versus Standard Hemofiltration in Critically Ill Patients With Acute Kidney Injury. Crit Care Med. 2018 Oct; 46(10):e988–94.
Haase M, Bellomo R, Baldwin I, HaaseFielitz A, Fealy N, Davenport P, et al. Hemodialysis membrane with a highmolecular-weight cutoff and cytokine levels in sepsis complicated by acute renal failure: a phase 1 randomized trial. Am J Kidney Dis. 2007 Aug; 50(2): 296– 304.
Siebeck M, Kindgen-Milles D. Super highflux CVVHD using regional citrate anticoagulation: long-term stability of middle molecule clearance. Crit Care. 2015; 19 Suppl 1:P301.
Kade G, Lubas A, Rzeszotarska A, Korsak J, Niemczyk S. Effectiveness of High Cut-Off Hemofilters in the Removal of Selected Cytokines in Patients During Septic Shock Accompanied by Acute Kidney Injury- Preliminary Study. Med Sci Monit. 2016 Nov; 22: 4338–44.
Villa G, Chelazzi C, Morettini E, Zamidei L, Valente S, Caldini AL, et al. Organ dysfunction during continuous venovenous high cut-off hemodialysis in patients with septic acute kidney injury: A prospective observational study. PLoS One. 2017 Feb; 12(2):e0172039.
Chelazzi C, Villa G, D’Alfonso MG, Mancinelli P, Consales G, Berardi M, et al. Hemodialysis with High Cut-Off Hemodialyzers in Patients with MultiDrug Resistant GramNegative Sepsis and Acute Kidney Injury: A Retrospective, Case-Control Study. Blood Purif. 2016; 42(3): 186–93.
Livigni S, Bertolini G, Rossi C, Ferrari F, Giardino M, Pozzato M, et al.; GiViTI: Gruppo Italiano per la Valutazione degli Interventi in Terapia Intensiva (Italian Group for the Evaluation of Interventions in Intensive Care Medicine) is an independent collaboration network of Italian Intensive Care units. Efficacy of coupled plasma filtration adsorption (CPFA) in patients with septic shock: a multicenter randomised controlled clinical trial. BMJ Open. 2014 Jan; 4(1):e003536.
Gruda MC, Ruggeberg KG, O’Sullivan P, Guliashvili T, Scheirer AR, Golobish TD, et al. Broad adsorption of sepsis-related PAMP and DAMP molecules, mycotoxins, and cytokines from whole blood using CytoSorb® sorbent porous polymer beads. PLoS One. 2018 Jan; 13(1):e0191676.
Malard B, Lambert C, Kellum JA. In vitro comparison of the adsorption of inflammatory mediators by blood purification devices. Intensive Care Med Exp. 2018 May; 6(1): 12. 43 Poli EC, Rimmelé T, Schneider AG. Hemoadsorption with CytoSorb®. Intensive Care Med. 2019 Feb; 45(2): 236– 9.
Houschyar KS, Pyles MN, Rein S, Nietzschmann I, Duscher D, Maan ZN, et al. Continuous hemoadsorption with a cytokine adsorber during sepsis – a review of the literature. Int J Artif Organs. 2017 May; 40(5): 205– 11.
Kogelmann K, Jarczak D, Scheller M, Drüner M. Hemoadsorption by CytoSorb in septic patients: a case series. Crit Care. 2017 Mar; 21(1): 74.
Schädler D, Pausch C, Heise D, MeierHellmann A, Brederlau J, Weiler N, et al. The effect of a novel extracorporeal cytokine hemoadsorption device on IL-6 elimination in septic patients: A randomized controlled trial. PLoS One. 2017 Oct; 12(10):e0187015.
Sakai Y. Polymethylmethacrylate membrane with a series of serendipity. Contrib Nephrol. 2011; 173: 137–47.
Nakada TA, Oda S, Matsuda K, Sadahiro T, Nakamura M, Abe R, et al. Continuous hemodiafiltration with PMMA Hemofilter in the treatment of patients with septic shock. Mol Med. 2008 May-Jun; 14(5-6): 257–63.
Yumoto M, Nishida O, Moriyama K, Shimomura Y, Nakamura T, Kuriyama N, et al. In vitro evaluation of high mobility group box 1 protein removal with various membranes for continuous hemofiltration. Ther Apher Dial. 2011 Aug; 15(4): 385–93.
Oshihara W, Fujieda H, Ueno Y. A New Poly(Methyl Methacrylate) Membrane Dialyzer, NF, with Adsorptive and Antithrombotic Properties. Contrib Nephrol. 2017; 189: 230–6.
Rogiers P, Zhang H, Pauwels D, Vincent JL. Comparison of polyacrylonitrile (AN69) and polysulphone membrane during hemofiltration in canine endotoxic shock. Crit Care Med. 2003 Apr; 31(4): 1219–25.
Kellum JA, Dishart MK. Effect of hemofiltration filter adsorption on circulating IL-6 levels in septic rats. Crit Care. 2002 Oct; 6(5): 429–33.
Renaux JL, Thomas M, Crost T, Loughraieb N, Vantard G. Activation of the kallikrein-kinin system in hemodialysis: role of membrane electronegativity, blood dilution, and pH. Kidney Int. 1999 Mar; 55(3): 1097–103.
Verresen L, Fink E, Lemke HD, Vanrenterghem Y. Bradykinin is a mediator of anaphylactoid reactions during hemodialysis with AN69 membranes. Kidney Int. 1994 May; 45(5): 1497–503.
Lavaud S, Canivet E, Wuillai A, Maheut H, Randoux C, Bonnet JM, et al. Optimal anticoagulation strategy in haemodialysis with heparin-coated polyacrylonitrile membrane. Nephrol Dial Transplant. 2003 Oct; 18(10): 2097–104.
Chanard J, Lavaud S, Maheut H, Kazes I, Vitry F, Rieu P. The clinical evaluation of lowdose heparin in haemodialysis: a prospective study using the heparin-coated AN69 ST membrane. Nephrol Dial Transplant. 2008 Jun; 23(6): 2003–9.
Shiga H, Hirasawa H, Nishida O, Oda S, Nakamura M, Mashiko K, et al. Continuous hemodiafiltration with a cytokine-adsorbing hemofilter in patients with septic shock: a preliminary report. Blood Purif. 2014; 38(3-4): 211–8.
Kobashi S, Maruhashi T, Nakamura T, Hatabayashi E, Kon A. The 28-day survival rates of two cytokine-adsorbing hemofilters for continuous renal replacement therapy: a singlecenter retrospective comparative study. Acute Med Surg. 2018 Dec; 6(1): 60–7. 59 Rimmelé T, Assadi A, Cattenoz M, Desebbe O, Lambert C, Boselli E, et al. High-volume haemofiltration with a new haemofiltration membrane having enhanced adsorption properties in septic pigs. Nephrol Dial Transplant. 2009 Feb; 24(2): 421–7.
Laville M, Dorval M, Fort Ros J, Fay R, Cridlig J, Nortier JL, et al. Results of the HepZero study comparing heparin-grafted membrane and standard care show that heparin-grafted dialyzer is safe and easy to use for heparin-free dialysis. Kidney Int. 2014 Dec; 86(6): 1260–7.
Kessler M, Gangemi C, Gutierrez Martones A, Lacombe JL, Krier-Coudert MJ, Galland R, et al. Heparin-grafted dialysis membrane allows minimal systemic anticoagulation in regular hemodialysis patients: a prospective proofof-concept study. Hemodial Int. 2013 Apr; 17(2): 282–93.
Shum HP, Chan KC, Kwan MC, Yan WW. Application of endotoxin and cytokine adsorption haemofilter in septic acute kidney injury due to Gram-negative bacterial infection. Hong Kong Med J. 2013 Dec; 19(6): 491–7.
Roberts DM, Liu X, Roberts JA, Nair P, Cole L, Roberts MS, et al.; RENAL Replacement Therapy Study Investigators. A multicenter study on the effect of continuous hemodiafiltration intensity on antibiotic pharmacokinetics. Crit Care. 2015 Mar; 19(1): 84.
Tian Q, Gomersall CD, Leung PP, Choi GY, Joynt GM, Tan PE, et al. The adsorption of vancomycin by polyacrylonitrile, polyamide, and polysulfone hemofilters. Artif Organs. 2008 Jan; 32(1): 81–4.
Tian Q, Gomersall CD, Ip M, Tan PE, Joynt GM, Choi GY. Adsorption of amikacin, a significant mechanism of elimination by hemofiltration. Antimicrob Agents Chemother. 2008 Mar; 52(3): 1009–13.
Veiga RP, Paiva JA. Pharmacokineticspharmacodynamics issues relevant for the clinical use of beta-lactam antibiotics in critically ill patients. Crit Care. 2018 Sep; 22(1): 233.
De Vriese AS, Colardyn FA, Philippé JJ, Vanholder RC, De Sutter JH, Lameire NH. Cytokine removal during continuous hemofiltration in septic patients. J Am Soc Nephrol. 1999 Apr; 10(4): 846–53.
Govil D, Gupta S, Srinivasan S, Patel SJ, Jagadeesh KN, Shafi M, et al. Cytokine adsorption in sepsis: correct timing can predict the favorable outcome. Kidney Int Rep. 2017; 2(4): S29.
Payen D, Mateo J, Cavaillon JM, Fraisse F, Floriot C, Vicaut E; Hemofiltration and Sepsis Group of the Collège National de Réanimation et de Médecine d’Urgence des Hôpitaux extra-Universitaires. Impact of continuous venovenous hemofiltration on organ failure during the early phase of severe sepsis: a randomized controlled trial. Crit Care Med. 2009 Mar; 37(3): 803– 10.
McCrea K, Ward R, LaRosa SP. Removal of Carbapenem-Resistant Enterobacteriaceae (CRE) from blood by heparin-functional hemoperfusion media. PLoS One. 2014 Dec; 9(12):e114242.
Mattsby-Baltzer I, Bergstrom T, McCrea K, Ward R, Adolfsson L, Larm O. Affinity apheresis for treatment of bacteremia caused by Staphylococcus aureus and/or methicillin-resistant S. aureus (MRSA). J Microbiol Biotechnol. 2011 Jun; 21(6): 659–64.
Kang JH, Super M, Yung CW, Cooper RM, Domansky K, Graveline AR, et al. An extracorporeal blood-cleansing device for sepsis therapy. Nat Med. 2014 Oct; 20(10): 1211–6.
Didar TF, Cartwright MJ, Rottman M, Graveline AR, Gamini N, Watters AL, et al. Improved treatment of systemic blood infections using antibiotics with extracorporeal opsonin hemoadsorption. Biomaterials. 2015 Oct; 67: 382–92.
Büttner S, Koch B, Dolnik O, Eickmann M, Freiwald T, Rudolf S, et al. Extracorporeal virus elimination for the treatment of severe Ebola virus disease— first experience with lectin affinity plasmapheresis. Blood Purif. 2014; 38(34): 286–91.
Pino CJ, Yevzlin AS, Tumlin J, Humes HD. Cell-based strategies for the treatment of kidney dysfunction: a review. Blood Purif. 2012; 34(2): 117–23.
Ma S, Xu Q, Deng B, Zheng Y, Tian H, Wang L, et al. Granulocyte and monocyte adsorptive apheresis ameliorates sepsis in rats. Intensive Care Med Exp. 2017 Dec; 5(1): 18.
Pino CJ, Yevzlin AS, Lee K, Westover AJ, Smith PL, Buffington DA, et al. Cell-based approaches for the treatment of systemic inflammation. Nephrol Dial Transplant. 2013 Feb; 28(2): 296–302.
Ding F, Song JH, Jung JY, Lou L, Wang M, Charles L, et al. A biomimetic membrane device that modulates the excessive inflammatory response to sepsis. PLoS One. 2011 Apr; 6(4):e18584.
Ding F, Yevzlin AS, Xu ZY, Zhou Y, Xie QH, Liu JF, et al. The effects of a novel therapeutic device on acute kidney injury outcomes in the intensive care unit: a pilot study. ASAIO J. 2011 Sep-Oct; 57(5): 426– 32.
Tumlin JA, Galphin CM, Tolwani AJ, Chan MR, Vijayan A, Finkel K, et al.; SCD Investigator Group. A Multi-Center, Randomized, Controlled, Pivotal Study to Assess the Safety and Efficacy of a Selective Cytopheretic Device in Patients with Acute Kidney Injury. PLoS One. 2015 Aug; 10(8):e0132482.
Srisawat N, Tungsanga S, Lumlertgul N, Komaenthammasophon C, Peerapornratana S, Thamrongsat N, et al. The effect of polymyxin B hemoperfusion on modulation of human leukocyte antigen DR in severe sepsis patients. Crit Care. 2018 Oct; 22(1): 279.
Venet F, Lukaszewicz AC, Payen D, Hotchkiss R, Monneret G. Monitoring the immune response in sepsis: a rational approach to administration of immunoadjuvant therapies. Curr Opin Immunol. 2013 Aug; 25(4): 477–83.
Rol ML, Venet F, Rimmele T, Moucadel V, Cortez P, Quemeneur L, et al.; REALISM study group. The REAnimation Low Immune Status Markers (REALISM) project: a protocol for broad characterisation and follow-up of injuryinduced immunosuppression in intensive care unit (ICU) critically ill patients. BMJ Open. 2017 Jun; 7(6):e015734.
Gossez M, Rimmelé T, Andrieu T, Debord S, Bayle F, Malcus C, et al. Proof of concept study of mass cytometry in septic shock patients reveals novel immune alterations. Sci Rep. 2018 Nov; 8(1): 17296.
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017 Mar; 43(3): 304–77.
Broman ME, Bodelsson M. Endotoxin and cytokin reduction function of the oXiris filter in a prospective double-blinded crossover setting in patients with critical Gramseptic shock and continuous renal replacement therapy requiring acute kidney injury. Intensive Care Med Exp. 2018; 6(Suppl 2): 0624.
Candidi F, Covotta M, Caravetta P, Vaccaro P, Belli A, Barchetta R, et al. Continuous renal replacement therapy with an adsorbent membrane in postoperative septic cardiac patients: A clinical experience. Paper presented at: 27th Annual Meeting of the European Association of Cardiothoracic Anaesthesiologists; 2012 May 23-25; Amsterdam, The Netherlands.
Caravetta P, Lappa L, Menichetti A, Barchetta R, Candidi F, Falco M, et al. Continous renal replacement therapy combined with endotoxins removal in septic patients: a pilot study. Abstract presented at : 18th International Conference on Continuous Renal Replacement Therapies; 2013 Feb 12–15; San Diego, CA, United States.
Govil D, Gupta S, Srinivasan S, Patel SJ, Jagadeesh KN, Shafi M, et al. Cytokine removal in sepsis: does their levels corelate with outcome. Kidney Int Rep. 2017; 2(4):S29.
Kelway C, Blasco V, Nafati C, Harti K, Reydellet L, Albanese J. Impact of the use of an oXiris filter versus an AN69ST filter on the duration of hemofiltration in intensive care. Ann Intensive Care. 2017; 7 Suppl 1: 7.
Lumlertgul N, Srisawat N. The hemodynamic effects of oXiris hemofilter in septic shock patients requiring renal support: a case series. Intensive Care Med Exp. 2018; 6 Suppl 1: 3.
Martin O, Allaouchiche B, Capellier G, Patry C. Une nouvelle membrane préhéparinée pour hemofiltration continue en reanimation [A new preheparanized membrane for continuous hemofiltration in ICU]. Paper presented at: Congrès de la Société Française d’Anesthésie- Réanimation, 2009 Sep; Paris, France.
Mikolasevic I, Orlic L, Devcic B, SladojeMartinovic B, Zupan Z, Anic K, et al. Application of oxiris membrane in septic acute kidney injury due to gram-negativ bacterial infection. Acta Med Croatica. 2014; 68 Supl.2: 149–55.
Plata-Menchaca EP, Sabater-Riera J, Estruch M, Boza E, Sbraga F, ToscanaFernandez J, et al. Pilot study to evaluate the use of an adsorption membrane (oXiris) duringcardiopulmonary bypass surgery. Intensive Care Med Exp. 2016; 4(Suppl 1).
Prato F, Tengattini M, Tasso G, Berto LM, Colageo U, Pissaia C, et al. Use of oXiris during continuous renal replacement therapy (CRRT) in patients with septic shock and AKI: a case series. Intensive Care Med Exp. 2017; 5(Suppl 2): 0858.
Tang GK, Ng P, Tsai P, To H, Leung Y, Chan W. oXiris in sepsis: A case series in Hong Kong. Poster presented at: 2nd Asia Pacific AKI CRRT; 2018 Sep 21-24; Taipei, Taiwan.
Tang KB, Chau CM, Lam KN. Effect of oXiris haemodiafiltration in shock reversal for intraabdominal sepsis and septic shock: a case control series. Intensive Care Med Exp. 2016; 4 Suppl 1:A381.
Tengattini M, Prato F, Colageao U, Pissaia C. Hemodynamic monitoring during continuous renal replacement therapy (CRRT) with oXirisfilter in septic shock patients. Intensive Care Medicine Experimental. 2018; 6(Suppl 2): 301.
Turani F, Candidi F, Barchetta R, Grilli E, Belli A, Papi E, et al. Continuous renal replacement therapy with the adsorbent membrane oXiris in septic patients : a clinical experience. Crit Care. 2013; 17(Suppl 2):P63.
Turani F, Busatti S, Barchetta R, Belli AB, Martini S, Falco M. Tromboelastography (TEG) may detect hypercoagulation in early sepsis and improve anticoagulation during extracorporeal treatments. Crit Care. 2015; 19(Suppl 1):P341.
Turani F, Belli AB, Martini S, Cotticelli VC, Mounajergi F, Barchetta R. Oxiris membrane decreases endotoxin during rrt in septic patients with basal EAA[{GT}]0,6. Crit Care. 2016; 20 Suppl 2: 196.
Turani F, Busatti S, Martini S, Falco M, Gargano F, Barchetta R, et al. Renal replacement therapy with the oXiris filter decreases inflammatory mediators and improves cardiorenal function in septic patients better than CVHDF. A cohort study and a propensity-matched analysis. Crit Care. 2018; 22 Suppl 1: 148.
Ty Wong E, Hl Ong V, Remani D, Wong WK, Haroon SW, Lau T, et al. Heparingrafted membrane for continuous renal replacement therapy in critically ill patients with bleeding risk- A randomized crossover study. Nephrol Dial Transplant. 2018; 33 Suppl 1:SP478.