Lan Yang, Xueru Xie, Zikun Tu, Jinrong Fu, Damo Xu, and Yufeng Zhou
Signal Transduction and Targeted Therapy (2021) 6:255 ; https://doi.org/10.1038/s41392-021-00679-0
Dịch bởi: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Đại dịch Coronavirus Disease 2019 (COVID-19) đã trở thành một cuộc khủng hoảng toàn cầu và có sức tàn phá khủng khiếp hơn bất kỳ bệnh truyền nhiễm nào khác trước đây. Nó đã ảnh hưởng đến một tỷ lệ đáng kể dân số toàn cầu cả về thể chất lẫn tinh thần, đồng thời phá hủy các doanh nghiệp và xã hội. Các bằng chứng hiện tại cho thấy bệnh học miễn dịch có thể là nguyên nhân gây bệnh sinh COVID-19, bao gồm giảm bạch cầu lympho, tăng bạch cầu đa nhân trung tính, rối loạn điều hòa bạch cầu đơn nhân và đại thực bào, giảm hoặc chậm đáp ứng với interferon loại I (IFN-I), tăng cường phụ thuộc vào kháng thể và đặc biệt là cơn bão cytokine (CS, cytokine storm). CS được đặc trưng bởi sự tăng sản của một loạt các cytokine tiền viêm và có liên quan chặt chẽ với tiên lượng xấu. Các cytokine tiền viêm được tiết ra quá mức này bắt đầu các con đường truyền tín hiệu viêm khác nhau thông qua các thụ
thể của chúng trên các tế bào miễn dịch và mô, dẫn đến các triệu chứng y tế phức tạp bao gồm sốt, hội chứng rò rỉ mao mạch, đông máu nội mạch lan tỏa, hội chứng suy hô hấp cấp và suy đa cơ quan, cuối cùng dẫn đến tử vong trong những trường hợp nghiêm trọng nhất. Do đó, điều quan trọng về mặt lâm sàng là hiểu các con đường khởi đầu và tín hiệu của CS để phát triển các chiến lược điều trị hiệu quả hơn đối với COVID-19. Ở đây, chúng tôi thảo luận về những phát triển mới nhất về các đặc điểm bệnh lý miễn dịch của COVID-19 và tập trung vào CS bao gồm tình trạng nghiên cứu hiện tại của các cytokine khác nhau có liên quan. Chúng tôi cũng thảo luận về cảm ứng, chức năng, tín hiệu xuôi dòng và các can thiệp hiện có và tiềm năng để nhắm mục tiêu các cytokine này hoặc các đường dẫn tín hiệu liên quan. Chúng tôi tin rằng sự hiểu biết toàn diện về CS trong COVID-19 sẽ giúp phát triển các chiến lược tốt hơn để kiểm soát hiệu quả bệnh lý miễn dịch trong bệnh này và các bệnh truyền nhiễm và viêm nhiễm khác.
Giới thiệu
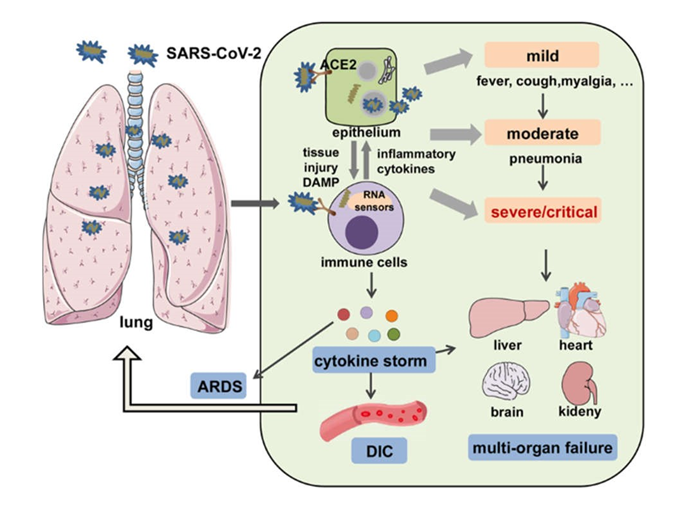
Bệnh Coronavirus 2019 (COVID-19) do coronavirus 2 (SARS-CoV-2) gây ra hội chứng hô hấp cấp tính nghiêm trọng nhanh chóng lây lan trên toàn thế giới và được tuyên bố là đại dịch vào đầu năm 2020. COVID-19 đã phá hủy sức khỏe tinh thần và thể chất của con người và làm chao đảo tăng trưởng kinh tế toàn cầu. Tính đến ngày 18 tháng 5 năm 2021, 163 triệu ca nhiễm trùng, trong đó có 3,38 triệu ca tử vong, đã được ghi nhận (nguồn: Tổ chức Y tế Thế giới). SARS-CoV-2 xâm nhập vào vật chủ nhờ thụ thể men chuyển 2 (ACE2) phân bố rộng rãi trên các mô và tế bào miễn dịch khác nhau.1-5 Vi rút có thể gây ra một loạt các biểu hiện lâm sàng từ nhẹ các dạng như sốt, ho và đau cơ đến dạng vừa phải nhập viện (viêm phổi và viêm khu trú) đến dạng nặng/nguy kịch với kết cục tử vong.6,7 Nhiễm trùng nặng hoặc nguy kịch thường biểu hiện như viêm phổi, 8,9 đông máu nội mạch lan tỏa (DIC), hội chứng suy hô hấp cấp tính (ARDS), huyết áp thấp và suy đa cơ quan (Hình 1).9,10,11
Hình 1 Một biểu hiện lâm sàng toàn thân của COVID-19. SARS-CoV-2 lây nhiễm các tế bào biểu mô đường thở hoặc tế bào miễn dịch thông qua liên kết với các thụ thể ACE2, gây tổn thương mô và giải phóng DAMP, cũng như sản xuất các cytokine gây viêm bởi các tế bào biểu mô và tế bào miễn dịch. Sau đó, sự tương tác giữa các tế bào biểu mô và tế bào miễn dịch dẫn đến một loạt các biểu hiện lâm sàng, từ các dạng nhẹ (ví dụ, sốt, ho và đau cơ); đến các dạng vừa phải nhập viện (viêm phổi và viêm khu trú); đến các dạng nặng/nguy kịch với hậu quả tử vong được biểu hiện như viêm phổi, ARDS, DIC, CS và suy đa cơ quan. Mô hình phân tử liên quan đến nguy hiểm DAMP, hội chứng suy hô hấp cấp ARDS, đông máu nội mạch lan tỏa DIC
Một số bằng chứng đã chỉ ra rằng tổn thương bệnh lý miễn dịch có thể là nguyên nhân dẫn đến sự biến chất của COVID-19. Đặc biệt, nhiều nghiên cứu đã báo cáo rằng mức độ cao của các cytokine tiền viêm được tạo ra trong quá trình tương tác giữa các tế bào biểu mô và các tế bào miễn dịch trong COVID-19, đã liên kết cơn bão cytokine (CS) với các biến chứng nghiêm trọng và kết quả xấu trong bệnh nhiễm trùng này.12-14
CS là một tình trạng lâm sàng phát triển nhanh, đe dọa đến tính mạng, trong đó sản xuất quá mức các cytokine gây viêm và kích hoạt quá mức các tế bào miễn dịch dẫn đến các hội chứng y khoa phức tạp từ sốt dai dẳng, đau cơ không đặc hiệu và hạ huyết áp, đến hội chứng rò rỉ mao mạch, DIC, ARDS, tăng bạch cầu lympho bào thực bào (HLH, hemophagocytic lymphohistiocytosis), suy đa cơ quan và tử vong nếu điều trị không đầy đủ.15 Do đó, thời điểm chẩn đoán và điều trị CS có thể cứu sống. Thuật ngữ CS được sử dụng lần đầu tiên vào năm 1993 trong bệnh ghép-vật chủ,16 và sau đó, trong nhiều bệnh viêm nhiễm như bệnh tự miễn, cấy ghép nội tạng, liệu pháp tế bào T thụ thể kháng nguyên chimeric (CAR, cancer chimeric antigen receptor) và gần đây nhất là trong COVID -19.17-23 Tuy nhiên, cấu hình và tác động gây bệnh của CS trong các điều kiện khác nhau có thể rất khác nhau. Cho đến nay, các hướng dẫn chẩn đoán và điều trị chính xác cho CS trong hầu hết các tình trạng đều thiếu. Hiểu được các thay đổi xác định và vai trò gây bệnh của các cytokine riêng lẻ liên quan đến CS liên quan đến COVID-19 (COVID-CS) do đó cực kỳ quan trọng đối với việc phát triển chẩn đoán chính xác và điều trị hiệu quả.
Mặc dù một số khía cạnh của chủ đề này đã được xem xét một phần trước đây, nhưng một cái nhìn toàn diện về COVID-CS để hỗ trợ chẩn đoán và điều trị vẫn còn thiếu với những nhu cầu lâm sàng chưa được đáp ứng. Trong tài liệu này, chúng tôi cung cấp kịch bản cập nhật và đầy đủ về COVIDCS từ nghiên cứu cơ bản đến chẩn đoán, điều trị và thử nghiệm lâm sàng. Ban đầu, chúng tôi thảo luận về các đặc điểm bệnh lý miễn dịch hiện đã được xác định của COVID-19, đặc biệt là CS; cơ chế hoạt động và sự khác biệt đối với CS trong các tình trạng bệnh khác; và các cytokine riêng lẻ liên quan đến COVID-CS bao gồm vai trò bệnh lý của chúng, tín hiệu truyền xuống và các biện pháp can thiệp hiện có. Ngoài ra, những thách thức và triển vọng trong chẩn đoán và điều trị COVID-CS cũng được thảo luận.
Bệnh học miễn dịch của covid-19
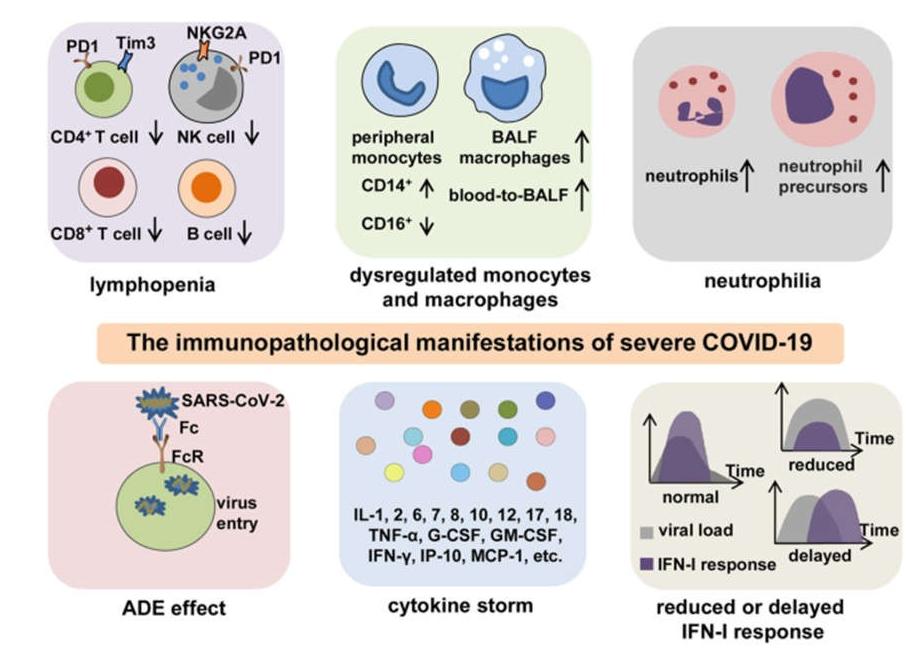
Nói chung, những bệnh nhân mắc COVID-19 có tình trạng miễn dịch bất thường, được đặc trưng bởi phản ứng miễn dịch bẩm sinh, viêm quá mức, và suy giảm phản ứng miễn dịch bảo vệ, thích ứng. Đây là nguyên nhân chính gây ra bệnh lý miễn dịch của COVID-19 nghiêm trọng. Cho đến nay, bằng chứng từ cả các thử nghiệm lâm sàng và nghiên cứu cơ bản đã tiết lộ một số đặc điểm chính của bệnh lý miễn dịch trong COVID-19 nghiêm trọng, bao gồm giảm bạch cầu lympho, tăng cường phụ thuộc vào kháng thể (ADE, antibody-dependent enhancement), tăng bạch cầu đa nhân trung tính, rối loạn điều hòa bạch cầu đơn nhân và đại thực bào, giảm hoặc trì hoãn interferon loại I ( IFN-I) phản hồi và CS (Hình 2).
Giảm bạch cầu lympho
Giảm bạch cầu lympho thường được tìm thấy ở bệnh nhân COVID-1910,11 và có tương quan chặt chẽ với mức độ bệnh.24,25 Kết quả phòng thí nghiệm cho thấy số lượng và tỷ lệ tế bào lympho bao gồm CD4 + T, CD8 + gây độc tế bào T,26,27 chất diệt tự nhiên (NK, natural killer),24 và tế bào B25 đều giảm ở bệnh nhân COVID-19.28-31 Bằng chứng từ giải trình tự tế bào đơn,32 dòng tế bào,33 và mô hình linh trưởng không phải người của COVID-1934 đã xác nhận sự liên quan của giảm bạch cầu lympho ở mức độ tối đa. Ngoài ra, các tế bào T biểu hiện kiểu hình kiệt sức với sự biểu hiện của các dấu hiệu kiệt sức cao hơn bao gồm protein chết tế bào được lập trình1 (PD-1) và immunoglobulin tế bào T và vùng mucin-3, cho thấy rằng các tế bào T này có thể có các hoạt động điều hòa.26,27 Các nghiên cứu khác cho thấy các tế bào NK dương tính với thành viên PD-1- hoặc NK nhóm 2 cũng tăng đáng kể trong máu ngoại vi của bệnh nhân COVID-19 so với nhóm chứng khỏe mạnh.35,36
Hình 2 Các bệnh lý miễn dịch quan trọng của COVID-19 nặng. Các biểu hiện bệnh lý miễn dịch của COVID19 bao gồm giảm bạch cầu lympho, rối loạn điều hòa bạch cầu đơn nhân và đại thực bào, tăng bạch cầu đa nhân trung tính, ADE, giảm hoặc chậm đáp ứng IFN-I và CS. Giảm bạch cầu lympho thường thấy ở COVID-19 nặng. Ngoài số lượng giảm, tế bào lympho thường biểu hiện kiểu hình kiệt sức với sự biểu hiện của các dấu hiệu kiệt sức PD-1, Tim-3 hoặc NKG2A ở mức độ cao hơn. Các tế bào đơn nhân ngoại vi biểu hiện sự thay đổi kiểu hình từ CD16 + sang CD14 +, và các đại thực bào BALF được tăng lên với quá trình chuyển đổi máu thành BALF. Số lượng bạch cầu đa nhân trung tính tăng lên khi có sự hiện diện của tiền chất bạch cầu đa nhân trung tính trong máu ngoại vi, đặc biệt ở những bệnh nhân bị COVID-19 nặng. Sự tồn tại có thể có của ADE làm tăng sự xâm nhập của SARS-CoV-2 vào tế bào thông qua sự tương tác giữa các vùng Fc và các thụ thể Fc, dẫn đến sự trầm trọng thêm của COVID-19. CS được đặc trưng bởi nồng độ chất trung gian gây viêm tăng cao và là đặc điểm đặc biệt trung tâm đối với kết quả kém ở những bệnh nhân bị nhiễm trùng nặng hoặc nguy kịch. Đáp ứng IFN-I giảm hoặc chậm làm cản trở sự thanh thải của virus và gây ra quá trình tăng viêm nghịch lý, do đó làm xấu đi tiên lượng ở bệnh nhân COVID-19. BALF: dịch rửa phế quản phế nang, ADE: tăng cường phụ thuộc vào kháng thể
Một số cơ chế có thể góp phần vào sự suy giảm và cạn kiệt tế bào lympho do SARS-CoV-2 gây ra: (1) SARS-CoV-2 có thể lây nhiễm trực tiếp vào tế bào T thông qua thụ thể ACE2 biểu hiện trên tế bào T, 37 dẫn đến chết tế bào T; 38,39 (2) một số cytokine tiền viêm hoặc chống viêm có thể đẩy nhanh sự suy giảm và kiệt quệ của các tế bào T với các chức năng tương ứng của chúng. Ngoài ra, vi rút có thể phá hủy các mô lympho thứ cấp ở lách và các hạch bạch cầu lympho, dẫn đến giảm bạch cầu lympho, điều này được hỗ trợ bởi các quan sát thấy teo lách, hoại tử hạch bạch cầu lympho và giảm số lượng tế bào lympho; 24,40-42 (3) Mô hình COVID-19 của linh trưởng cho thấy phản ứng của tế bào T chống vi-rút bị suy giảm có thể là do số lượng tế bào T điều tiết tăng lên (Tregs). 34 Tuy nhiên, chúng ta không thể loại trừ khả năng sự suy giảm và cạn kiệt của các tế bào lympho do các liệu pháp chống viêm như sử dụng glucocorticoid.
Nói chung, giảm bạch cầu lympho có thể biểu hiện một kết quả xấu của bệnh. Một thử nghiệm lâm sàng hồi cứu, đa trung tâm, khẩn cấp ở một cộng đồng người Hán bao gồm 14.117 đối chứng bình thường và 69 bệnh nhân COVID-19 nhập viện (25 nặng hoặc nguy kịch và 44 nhẹ) cho thấy giảm bạch cầu lympho xảy ra ở gần như 100% các trường hợp nghiêm trọng/nghiêm trọng, và số lượng tế bào lympho giảm dần theo tiến triển của bệnh và tình trạng lâm sàng xấu đi. Tập hợp con tế bào lympho T CD4 + và CD8 + cho thấy sự khác biệt rõ rệt giữa các trường hợp nhẹ và nặng. Do đó, các tác giả gợi ý rằng phân tích số lượng và tỷ lệ tế bào lympho khi nhập viện ngay lập tức góp phần cải thiện tiên lượng lâm sàng.43
Tăng cường phụ thuộc vào kháng thể
Tế bào B được coi là bảo vệ trong nhiễm SARSCoV-2 bằng cách tạo ra kháng thể trung hòa chống lại thụ thể ACE2 để ngăn chặn sự xâm nhập của virus.44 Tuy nhiên, các kháng thể trung hòa do tế bào B tạo ra không nhất thiết phải bảo vệ, tùy thuộc vào yếu tố virus mà nó nhắm đến và cả Fc vùng của kháng thể. ADE là hiện tượng trong đó các kháng thể trung hòa có sẵn nhắm vào một kiểu huyết thanh của một loại vi rút nhất định làm tăng cường sự xâm nhập của không chỉ vi rút đó mà còn cả một loại huyết thanh khác của vi rút vào bạch cầu thông qua sự tương tác giữa các vùng Fc của kháng thể và các thụ thể Fc hoặc các thụ thể bổ thể trên các tế bào như vậy. 45-49 Hiện tượng ADE đã được tìm thấy trong các bệnh nhiễm vi rút khác nhau như sốt xuất huyết, Flavivirus, SARS-CoV, MERS-CoV và Ebola.45,48,50-52
Các nghiên cứu gần đây đã chỉ ra rằng mức độ tương đối cao của tế bào B hoặc kháng thể có liên quan tích cực đến mức độ nghiêm trọng của COVID-19, 32,53,54 cho thấy sự tham gia tiềm tàng của ADE trong nhiễm trùng SARS-CoV-2. Ngoài ra, một nghiên cứu đã báo cáo rằng kháng thể đơn dòng MW05 nhắm mục tiêu SARS-CoV-2 cũng có thể gây ra hoạt động ADE bằng cách liên kết với các thụ thể FcγRIIB trên các tế bào đích trong ống nghiệm. Tuy nhiên, việc sử dụng kháng thể được thiết kế có đột biến vùng Fc in vivo đã bảo vệ động vật khỏi nhiễm SARS-CoV-2 một cách hiệu quả.55 Điều này nhấn mạnh tầm quan trọng của việc phát triển các kháng thể trung hòa bảo vệ chống lại SARS-CoV-2. Tuy nhiên, cần có các cuộc điều tra thêm về ADE trong trường hợp nhiễm SARS-CoV2 để tạo điều kiện phát triển liệu pháp dựa trên vắcxin hoặc kháng thể đối với COVID-19.
Bạch cầu đa nhân trung tính
Sự gia tăng số lượng bạch cầu đa nhân trung tính ở bệnh nhân COVID-19 được công nhận rộng rãi. Ai cũng biết rằng trong điều kiện bình thường, bạch cầu đa nhân trung tính đóng vai trò bảo vệ chống lại nhiễm trùng bằng cách tạo ra bẫy ngoại bào của bạch cầu đa nhân trung tính (NET, neutrophil extracellular traps) để tiêu diệt mầm bệnh ngoại bào; 56 tuy nhiên, kích hoạt bạch cầu đa nhân trung tính quá mức cũng có thể làm hỏng các tế bào xung quanh và làm tan các mô liên kết.57
Một thử nghiệm lâm sàng trước đó bao gồm 138 bệnh nhân đến từ Vũ Hán, Trung Quốc, cho thấy số lượng bạch cầu đa nhân trung tính đã tăng ở những người không sống sót so với những người sống sót và tiếp tục tăng cho đến khi tử vong ở những người không sống sót.11 Một nghiên cứu lâm sàng khác tích hợp các nền tảng chuyển hóa, proteomic và transcriptomic cho thấy số lượng bạch cầu đa nhân trung tính tăng lên ở những bệnh nhân bị COVID19 nặng, nhưng không nhẹ so với nhóm chứng khỏe mạnh, và các phân tử liên kết với NET được điều chỉnh đáng kể ở những trường hợp COVID-19 nặng.58
Sự gia tăng bạch cầu đa nhân trung tính biểu hiện khi cả số lượng tế bào trưởng thành và chưa trưởng thành đều tăng lên. Trong một thử nghiệm lâm sàng tích hợp trình tự RNA đơn bào với proteomics tế bào đơn của máu và tế bào đơn nhân máu ngoại vi (PBMC, peripheral blood mononuclear cells), tiền thân bạch cầu đa nhân trung tính chưa trưởng thành và bạch cầu đa nhân trung tính trưởng thành bị rối loạn chức năng biểu hiện phối tử chết được lập trình 1 đã xuất hiện trong các trường hợp COVID-19 nghiêm trọng. 59 Ngoài ra, phân tích trình tự đơn bào của Wilk và cộng sự 32 và phân tích đo lưu lượng tế bào của Ronit và cộng sự 33 cũng xác định sự xuất hiện của các tiền nhân bạch cầu đa nhân trung tính ở các giai đoạn phát triển khác nhau trong PBMC hoặc dịch rửa phế quản phế nang (BALF) của COVID- 19 bệnh nhân ARDS.
Mặc dù cơ chế mà vi rút thúc đẩy sự phát triển bạch cầu đa nhân trung tính trong COVID-19 vẫn còn chưa được hiểu rõ, McElvaney và cộng sự đã phát hiện ra rằng mức độ của pyruvate kinase M2 (PKM2), một chất điều hòa quá trình đường phân 61 và chất đông tụ của yếu tố gây giảm oxy-1α, 62 cũng như PKM2 được phosphoryl hóa trong bạch cầu đa nhân trung tính của bệnh nhân COVID-19 trong ICU cao hơn ở bệnh nhân không ICU COVID-19. Điều này chỉ ra rằng bạch cầu đa nhân trung tính trải qua quá trình tái lập trình miễn dịch trong các trường hợp COVID-19 nghiêm trọng, điều này thể hiện một mục tiêu can thiệp tiềm năng đối với việc tạo ra và hoạt hóa quá mức bạch cầu đa nhân trung tính trong COVID-19 nghiêm trọng hoặc nghiêm trọng.
Rối loạn điều hòa của bạch cầu đơn nhân và đại thực bào
Bạch cầu đơn nhân và đại thực bào là những tế bào miễn dịch bẩm sinh chính trong nhiễm trùng và viêm không chỉ nhờ số lượng cao hơn mà còn bởi chức năng của chúng. Phân tích trình tự RNA đơn bào cho thấy bạch cầu đơn nhân CD14 + cổ điển tăng lên đáng kể, trong khi bạch cầu đơn nhân CD16 + không cổ điển và bạch cầu đơn nhân trung gian CD14 + CD16 + giảm đáng kể trong máu của bệnh nhân COVID-19 có các triệu chứng nghiêm trọng. Bạch cầu đơn nhân cổ điển có thể biệt hóa thành đại thực bào trong mô để bắt đầu phản ứng viêm, trong khi bạch cầu đơn nhân không cổ điển được coi là chống viêm vì chúng có thể duy trì cân bằng nội môi mạch máu, 63 có thể giải thích sự thay đổi kiểu hình của bạch cầu đơn nhân lưu hành từ CD16 + sang CD14 +. Phân tích các cấu trúc phân biệt của BALF và các đại thực bào đơn nhân lưu hành từ cùng một bệnh nhân cho thấy một quá trình chuyển đổi của máu sang BALF. Quan trọng hơn, nhiều cytokine và chemokine gây viêm được biểu hiện cao bởi các đại thực bào BALF monocyte, cho thấy rằng các tế bào bị viêm. bệnh nhân mắc ARDS, với sự thay đổi kiểu hình từ CD16 + sang CD14 +. Tuy nhiên, sự điều chỉnh đáng kể của các gen mã hóa các cytokine hoặc chemokine gây viêm không được tìm thấy trong các tế bào đơn nhân ngoại vi, cho thấy rằng các tế bào đơn nhân ngoại vi có thể không chịu trách nhiệm cho sự tiến triển của CS trong COVID-19.32 Hơn nữa, định hình kiểu hình quần thể bạch cầu trong BALF và máu COVID-19 bệnh nhân mắc ARDS cho thấy sự biểu hiện của các dấu hiệu hoạt hóa như CD16, CD64, CD69 và HLA-DR ở đại thực bào BALF cao hơn ở đại thực bào ngoại vi.33 Nói chung, những nghiên cứu hiện có này nói chung là nhất quán và tiết lộ quá trình sự chuyển đổi BALF hướng về máu – và sự đóng góp của các đại thực bào-bạch cầu đơn nhân phổi vào CS thông qua việc giải phóng nhiều cytokine và chemokine gây viêm trong thời gian COVID-19 nghiêm trọng.
Điều thú vị là, một nghiên cứu thuần tập cho thấy bạch cầu đơn nhân HLA-DRhighCD11chighCD14 + được kích hoạt đã tăng lên ở PBMC của những bệnh nhân mắc COVID-19 nhẹ, trong khi HLADRlowCD163high bị rối loạn chức năng (biểu hiện của chức năng chống viêm) Bạch cầu đơn nhân CD14 + được quan sát thấy ở những trường hợp COVID-19 nặng. 59 Điều này đáng để nghiên cứu thêm để hiểu cơ chế cơ bản và ý nghĩa lâm sàng.
Đáp ứng ifn-i giảm hoặc chậm trễ
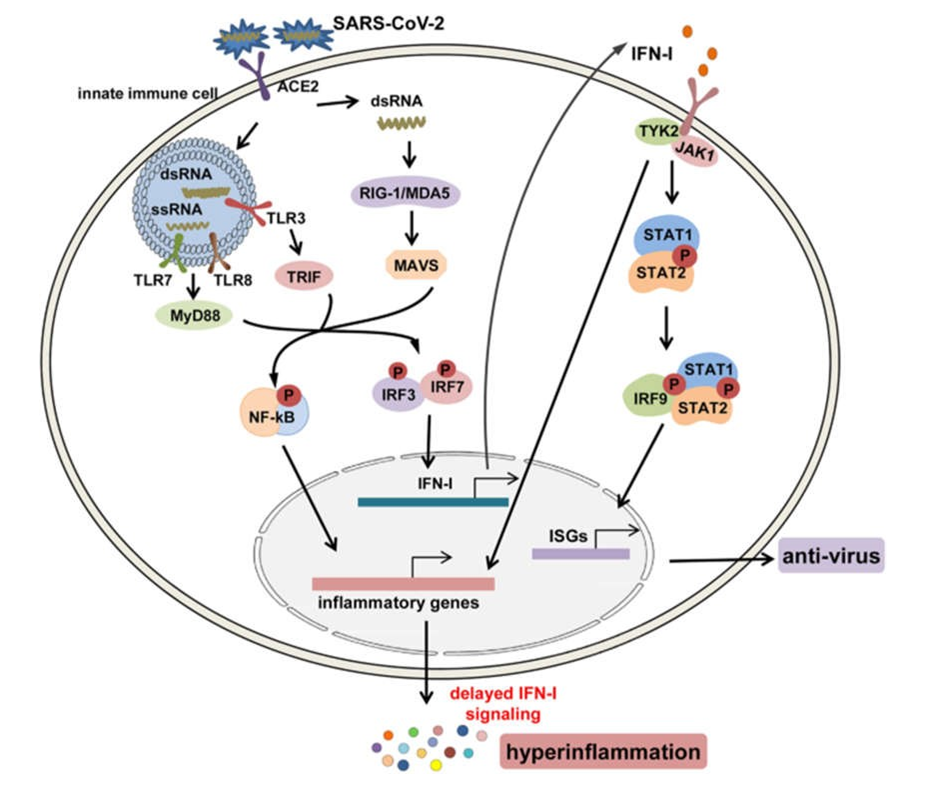
Đáp ứng IFN-I là dòng phản ứng bảo vệ đầu tiên và rất quan trọng để chống lại nhiễm vi rút bằng cách thúc đẩy quá trình thanh thải vi rút và điều chỉnh các phản ứng miễn dịch bẩm sinh và thích ứng.65 Mặc dù cơ chế chi tiết vẫn chưa được biết rõ khi nhiễm trùng xảy ra, nhưng RNA của SARS-CoV- 2 virus có thể được nhận biết bởi các tế bào miễn dịch bẩm sinh thông qua các thụ thể nhận dạng mẫu (PRR) bao gồm cả thụ thể giống như số điện thoại (TLR); các thụ thể giống như gen I (RIG-I) giống axit retinoic (RLRs)/gen liên quan đến biệt hóa hắc tố 5 (MDA5); và các thụ thể giống NOD (NLR).66 Sau đó, các yếu tố phiên mã xuôi dòng bao gồm yếu tố hạt nhân-κB (NF-κB), protein hoạt hóa-1 (AP-1) và yếu tố điều hòa IFN 3/7 (IRF3/7) được kích hoạt để thúc đẩy phiên mã của các cytokine tiền viêm và IFN-I. IFN-I có thể kích hoạt bộ chuyển đổi tín hiệu Janus kinase 1 (JAK1)/tyrosine kinase 2 và chất kích hoạt con đường phiên mã 1/2 (STAT1/2), thúc đẩy sự hình thành phức hợp STAT1/2/IRF9 và bắt đầu phiên mã IFN -gien được kích thích (ISG) (Hình 3).66,67
Hình 3 Các con đường tín hiệu cho sự sản sinh và chức năng của IFN-I sau khi nhiễm SARS-CoV-2. Sau khi lây nhiễm, các ssRNA của bộ gen và các chất trung gian dsRNA sao chép của SARS-CoV-2 được nhận biết bởi các thụ thể giống như thụ thể nội bào TLR3, 7, 8 và cảm biến RNA tế bào, RIG-1/MDA5; tiếp theo, các yếu tố phiên mã xuôi dòng bao gồm NF-κB và IRF3/7 được kích hoạt để tạo ra các cytokine tiền viêm và IFN-I. IFN-I có thể kích hoạt con đường JAK1/TYK2 – STAT1/2, thúc đẩy sự hình thành phức hợp STAT1/2/IRF9 và bắt đầu phiên mã ISG để tạo ra các chất trung gian chống vi rút và nó cũng có thể kích hoạt không theo cách thông thường các con đường gây viêm như NF Các con đường -κB và MAPK để gây ra sự biểu hiện của các cytokine tiền viêm và quá trình viêm siêu vi nghịch lý trong COVID-19
Tuy nhiên, tích lũy bằng chứng cho thấy đáp ứng IFN-I bảo vệ đã giảm đáng kể ở bệnh nhân COVID19 nặng. 26,68,69 Ít nhất hai cơ chế đã được đề xuất để giải thích đáp ứng IFN-I thiếu: (1) các nghiên cứu trước đây đã đề xuất rằng SARS-CoV sử dụng nhiều cơ chế khác nhau để ức chế phản ứng IFN, đặc biệt là thông qua các thành phần của protein cấu trúc của nó như protein M, protein N 70, protein khung đọc mở 71 3a (ORF3a), protein 72 và ORF6.73 Xem xét rằng cấu trúc của SARS-CoV-2 tương tự như của SARS-CoV, có thể suy đoán rằng SARSCoV-2 có thể gây ra các tác động tương tự đối với phản ứng IFN. Ví dụ, Yang và cộng sự 74 đã phát hiện ra rằng protein NSP1 của SARS-CoV-2 có thể ức chế quá trình phosphoryl hóa STAT1 và phiên mã ISG. (2) Tế bào đuôi gai (pDCs) plasmacytoid suy giảm có thể là nguyên nhân một phần gây ra phản ứng IFN-I bị thiếu hụt. Có đủ bằng chứng cho thấy pDC là tác nhân nổi bật của IFN-I khi nhiễm virus.75-77 Tuy nhiên, các nghiên cứu hiện có cho thấy số lượng pDC đã giảm trong máu của bệnh nhân COVID-19, đặc biệt trong những trường hợp nặng.26, 32
Lưu ý, mặc dù mức IFN-I toàn thân thấp, IFN-I và ISG cục bộ đáng chú ý trong BALF của một số bệnh nhân nặng, 78 có liên quan đến hiện tượng chậm đáp ứng IFN-I.69 Bằng chứng đã xác nhận rằng đáp ứng IFN-I chậm không chỉ cản trở sự thanh thải của virus mà còn gây ra quá trình tăng viêm nghịch lý, do đó làm trầm trọng thêm phản ứng bệnh lý miễn dịch.79,80 Nói chung, những nghiên cứu này gợi ý rằng liệu pháp điều trị COVID-19 dựa trên IFN-I nên được áp dụng càng sớm càng tốt sau khi nhiễm trùng được xác nhận.
Bão cytokine
Trong phần này, chúng tôi xem xét và thảo luận một cách hệ thống về các đặc điểm, cơ chế cảm ứng có thể xảy ra, cơ chế bệnh sinh và chẩn đoán CS trong COVID-19.
Bằng chứng đầy đủ đã tiết lộ các thành phần và đặc điểm của CS ở bệnh nhân bị COVID-19 nặng, bao gồm một loạt các cytokine bao gồm interleukin-1 (IL-1), 2, 6, 7, 8, 10, 12, 17 , 18; yếu tố hoại tử khối u-α (TNF-α); IFN-γ; yếu tố kích thích thuộc địa bạch cầu hạt (G-CSF); yếu tố kích thích thuộc địa bạch cầu hạt-đại thực bào (GM-CSF); và protein hóa trị monocyte-1 (MCP-1).26,33,60,81-86 Các báo cáo về sự tăng sinh tế bào máu và lợi ích lâm sàng từ các liệu pháp nhắm mục tiêu cytokine ở bệnh nhân COVID-19 nặng đã khẳng định thêm sự tồn tại và cơ chế bệnh sinh của COVID-CS.87,88 Các bằng chứng hiện có đã xác định và phân biệt COVID-CS với CS trong các điều kiện khác nhau như HLH gây ra bởi nhiễm virus cụ thể, 89 hội chứng hoạt hóa đại thực bào (MAS) xảy ra sau các rối loạn tự miễn dịch,90 và hội chứng giải phóng cytokine (CRS) gây ra bởi liệu pháp tế bào CAR T23 ở một số khía cạnh. Đầu tiên, COVID-CS liên quan đến nhiều cytokine gây viêm hơn các tình trạng CS khác, do đó cung cấp lời giải thích cho bản chất hung hăng của COVID-19. Thứ hai, giảm bạch cầu lympho, mặc dù tương đối ít xảy ra hơn ở các bệnh CS khác, thường được quan sát thấy ở những bệnh nhân mắc COVID-CS,88 cho thấy COVID-CS có thể chủ yếu là do bẩm sinh chứ không phải do các tế bào miễn dịch thích ứng. Cuối cùng, so với CS gây ra nhiễm trùng do vi khuẩn (ví dụ, nhiễm trùng huyết), việc điều trị COVID-CS có nhiều thách thức hơn, vì việc ngăn chặn chức năng cytokine gây viêm mà không có sự hỗ trợ hiệu quả của thuốc chống vi rút có thể làm trầm trọng thêm tình trạng nhiễm trùng.
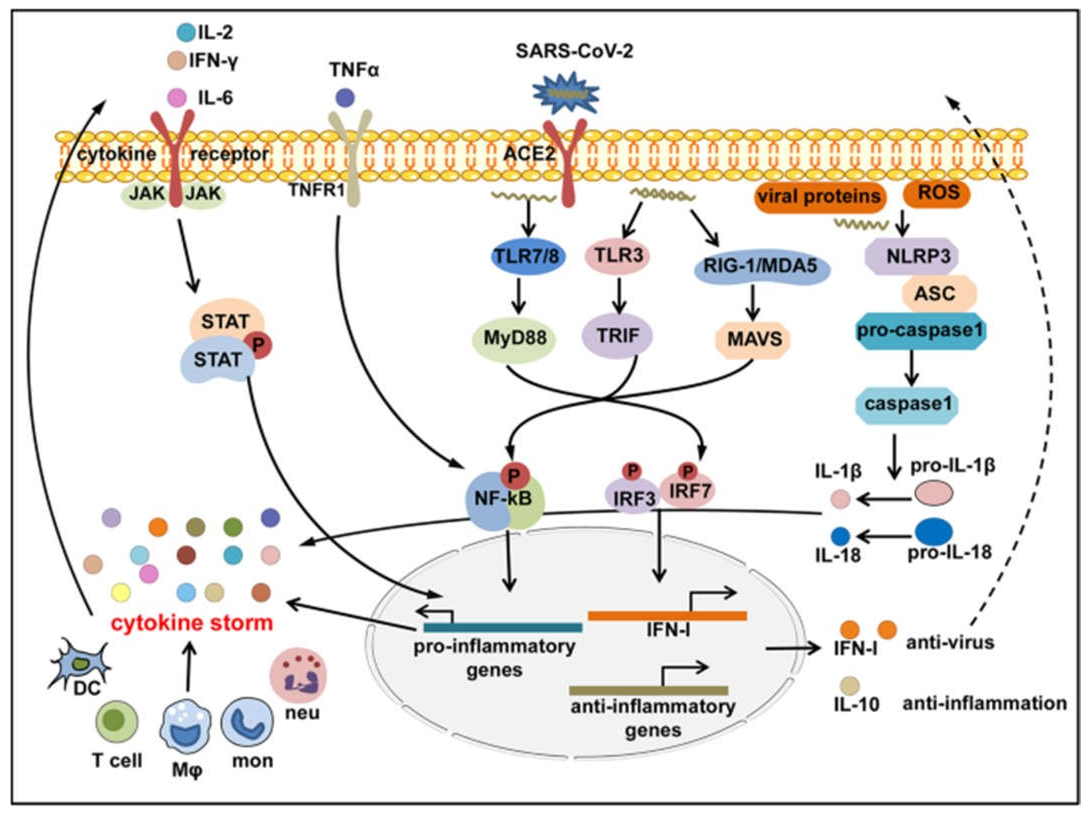
Sự bắt đầu của cảm ứng COVID-CS trong quá trình nhiễm trùng và cytokine gây bệnh chiếm ưu thế trong bệnh lý miễn dịch COVID-19 phần lớn vẫn chưa được biết. Mặc dù thiếu mô hình phân tử liên quan đến mầm bệnh (PAMP) xác định của SARSCoV-2, tương tự với SARS-CoV và MERS-CoV, có thể suy đoán rằng khi SARS-CoV-2 xâm nhập vào tế bào thông qua thụ thể ACE2 của nó, RNA sợi đơn bộ gen của virus hoặc các thành phần RNA khác (RNA sợi đôi) như PAMP có thể được cảm nhận bởi các PRR liên quan, bao gồm TLR và RLR trong tế bào chủ. Các yếu tố phiên mã xuôi dòng IRF3/7 và NF-κB được kích hoạt sau khi nhận biết PAMP để tạo ra IFN-I và các cytokine tiền viêm tương ứng.91,92,93 Tuy nhiên, như đã đề cập ở trên, đáp ứng IFN-I bảo vệ là được thay thế một cách nhanh chóng và có chọn lọc bởi SARS-CoV-2 thông qua các cơ chế khác nhau. Điều này đi kèm với việc sản xuất quá nhiều các cytokine tiền viêm trong bối cảnh COVID-19, không chỉ làm suy giảm sự thanh thải của virus mà còn thúc đẩy quá trình viêm siêu vi nghịch lý bao gồm cả CS. Do đó, từ góc độ miễn dịch học, COVID-CS có thể là một sự kiện đáng tiếc khi phản ứng miễn dịch của vật chủ dự định chống lại SARS-CoV-2 đã mất kiểm soát và chuyển thành một dạng viêm.
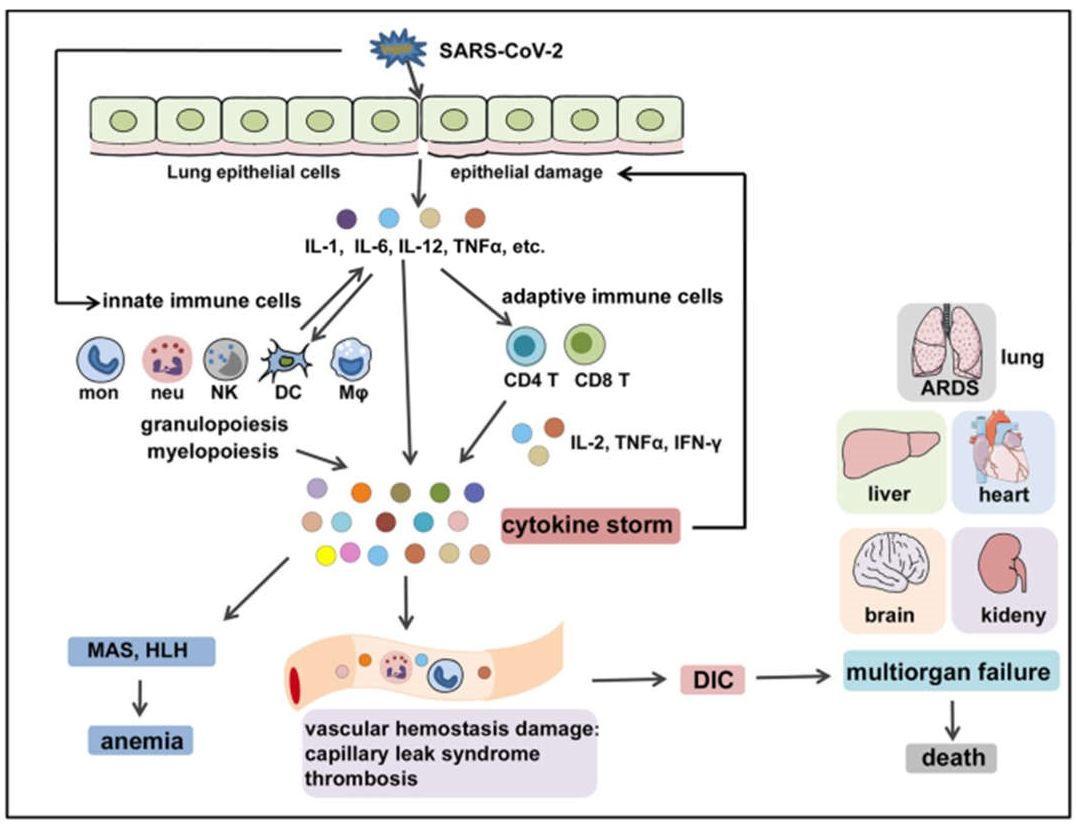
Trong nhiễm trùng SARS-CoV-2, vi rút lây nhiễm vào mô biểu mô đường hô hấp và kích hoạt các tế bào miễn dịch bẩm sinh tại chỗ để giải phóng các cytokine gây viêm như IL-1, IL-6, IL-8, IL-12, TNF-α và các chemokine khác. Sau đó, các cytokine và chemokine gây viêm này sẽ thu nạp thêm các tế bào miễn dịch bẩm sinh (bạch cầu đơn nhân, đại thực bào, bạch cầu đa nhân trung tính, DC và tế bào NK) và kích hoạt các tế bào miễn dịch thích ứng (tế bào T CD4 + và CD8 +) từ các mô ngoại vi để tạo ra các cytokine gây viêm bền vững như IL-2, IFN-γ và TNF-α, gây ra quá trình tạo tủy và tạo hạt khẩn cấp làm trầm trọng thêm tổn thương phổi và biểu mô (Hình 4). Ngoài ra, sản xuất quá mức các cytokine hệ thống, đặc biệt là IL-2, IFN-γ, GM-CSF và TNF-α, gây ra hoạt hóa đại thực bào (tức là MAS) và bạch cầu lympho bào thực bào (tức là, HLH), dẫn đến thiếu máu, 94, 95 cũng như gây ra rối loạn đông máu và cầm máu mạch máu, dẫn đến hội chứng rò rỉ mao mạch, huyết khối, 96 và DIC. Những sự kiện này cùng nhau dẫn đến ARDS, suy đa cơ quan và tử vong (Hình 4).15 Lưu ý, hệ thống điều hòa miễn dịch của vật chủ thường có khả năng duy trì và điều chỉnh tình trạng viêm bảo vệ đến mức thích hợp. Các tế bào điều hòa như Tregs97,98 có thể tạo ra các cytokine điều hòa như IL-10 và yếu tố tăng trưởng khối u-β để đối kháng với các phản ứng miễn dịch bị kích hoạt quá mức. 99,100 Tuy nhiên, các tình trạng viêm tích cực như CS không thể được làm dịu bằng khả năng tự nhiên của hệ thống điều tiết.
Hình 4 Các cơ chế bệnh lý miễn dịch của COVID-CS. SARS-CoV-2 lây nhiễm vào các tế bào biểu mô hoặc tế bào miễn dịch, gây tổn thương mô và giải phóng các cytokine gây viêm (ví dụ, IL-1, IL-6, IL-12 và TNFα) bởi các tế bào biểu mô và tế bào miễn dịch. Sau đó, các cytokine gây viêm này chiêu mộ các tế bào miễn dịch bẩm sinh (bạch cầu đơn nhân, đại thực bào, bạch cầu đa nhân trung tính, DC và tế bào NK) và kích hoạt các tế bào miễn dịch thích ứng (tế bào T CD4 + và tế bào T CD8 +) để gây ra sự xuất hiện của quá trình tạo tế bào dòng tủy và tạo tế bào dòng hạt khẩn cấp, cũng như sản xuất của các cytokine tuần hoàn quá mức và bền vững có thể làm trầm trọng thêm tổn thương biểu mô. Ngoài ra, sản xuất quá mức các cytokine toàn thân gây ra sự hoạt hóa đại thực bào (tức là MAS) và thực bào hồng cầu (tức là HLH), dẫn đến thiếu máu và làm rối loạn quá trình cầm máu mạch máu, dẫn đến hội chứng rò rỉ mao mạch, huyết khối và DIC. Những sự kiện này cùng nhau dẫn đến ARDS, suy đa cơ quan và tử vong. HLH: tăng bạch cầu lympho bào thực bào, MAS: hội chứng hoạt hóa đại thực bào, ARDS: hội chứng nguy kịch hô hấp cấp, DIC: đông máu nội mạch lan tỏa .
Mặc dù hiểu biết về miễn dịch học và bệnh lý học về COVID-CS đã cung cấp thông tin có giá trị liên quan đến việc phát triển các chiến lược chẩn đoán và điều trị, các hướng dẫn chi tiết vẫn còn thiếu.
Việc phát triển các hệ thống tính điểm như HScore, điểm MS, HLH-2004, thang điểm Penn và Tiêu chí thuật ngữ chung cho các sự kiện bất lợi có thể có lợi để dự đoán COVID-CS hoặc các kết quả liên quan.
Caricchio và cộng sự101 đề xuất tiêu chuẩn dự đoán cho chẩn đoán COVID-CS. Các tiêu chí này bao gồm ba nhóm: (1) albumin 11,4 × 103/mL; (2) alanin aminotransferase> 60 IU/L, aspartate aminotransferase> 87 IU/L, D-dimer> 4930 ng/mL, lactate dehydrogenase> 416 U/L, troponin I> 1,09 ng/mL; và (3) khoảng trống anion 106 mmol/L, kali> 4,9 mmol/L, và tỷ lệ nitơ urê máu: creatinin> 29. Ngoài ra, ferritin> 250 ng/mL và protein phản ứng C (CRP)> 4,6 mg/dL được bổ sung để trấn an tình trạng viêm toàn thân đang diễn ra. Trong một nghiên cứu khác, các tác giả đề xuất rằng tiêu chuẩn chẩn đoán bao gồm độ bão hòa oxy trong máu ngoại vi chia cho nồng độ oxy hít vào (SpO2/FiO2), CRP, ferritin, cytokine/chemokine và tỷ lệ bạch cầu đa nhân trung tính/tế bào lympho có thể có khả năng chẩn đoán mạnh mẽ đối với COVID- CS.102 Mehta và cộng sự đã đề xuất rằng sàng lọc tiền cứu chứng viêm quá phát bằng các xét nghiệm trong phòng thí nghiệm và HScore nên được thực hiện ở tất cả bệnh nhân COVID-19 bị bệnh nặng để xác định COVID-CS. Bất chấp yêu cầu xác nhận thêm, các tiêu chí này thực sự cung cấp các đề xuất mang tính xây dựng cho việc phát triển các hướng dẫn được công nhận chính thức cho COVID-CS.
COVID-CS là một quá trình viêm phức tạp và động gây ra bởi một nhóm các cytokine từ khởi phát, tăng hoạt tế bào miễn dịch đến rối loạn chức năng cơ quan. Cần có sự phát triển của can thiệp điều trị chính xác trong thời gian thích hợp để kiểm soát COVID-CS một cách hiệu quả. Về nguyên tắc, chiến lược điều trị là kiểm soát phản ứng viêm đang diễn ra bằng cách nhắm mục tiêu cụ thể hoặc không đặc hiệu vào các cytokine gây viêm hoặc các con đường tín hiệu liên quan và để khôi phục lại hệ thống điều hòa miễn dịch của vật chủ. Ở đây, chúng tôi thảo luận về vai trò của các cytokine chính và các đường dẫn tín hiệu liên quan liên quan đến COVID-CS (Hình 5).
Hình 5 Các tầng tín hiệu viêm được kích hoạt trong COVID-CS. SARS-CoV-2 xâm nhập vào tế bào vật chủ và được cảm nhận bởi các thụ thể giống như số (TLR) 3, 7, 8; RIG-I-like receptor, RIG-I hoặc MDA5; và thụ thể giống NOD, NLRP3, cũng có thể được kích hoạt trực tiếp bởi các protein của virus hoặc ROS được giải phóng bởi các tế bào apoptotic hoặc bị viêm. Các yếu tố phiên mã xuôi dòng IRF3/7 được kích hoạt để tạo ra IFN-I và quá trình siêu viêm nghịch lý liên quan; NF-κB được kích hoạt để tạo ra các cytokine gây viêm; và NLRP3 thể viêm được kích hoạt để tạo ra IL-1β và IL-18 trưởng thành. Các cytokine chống viêm như IL-6, IL-2, TNF-α, và IFN-γ lần lượt kích hoạt tín hiệu JAK-STAT hoặc NF-κB thông qua liên kết với các thụ thể của chúng biểu hiện trên các tế bào miễn dịch để tạo ra nhiều pro- các gene gây viêm, tạo thành một phản hồi tích cực để kích hoạt ngưỡng của CS. Ngược lại, các cytokine điều hòa như IL-10 được sản xuất bù trừ để chống lại sự tăng động miễn dịch.
Tín hiệu il-6/jak/stat
Một nghiên cứu hồi cứu, đa trung tâm bao gồm 150 bệnh nhân từ Vũ Hán, Trung Quốc cho thấy mức IL-6 tăng cao đáng kể trong các trường hợp COVID-19 nặng.103 Một nghiên cứu từ Đức cho thấy IL-6> 80 pg/mL kết hợp với CRP> 97 mg/L thể hiện độ đặc hiệu và độ nhạy tương đối cao để dự đoán suy hô hấp.104 Ngoài ra, các nghiên cứu khác cũng cho thấy nồng độ IL-6 trong huyết thanh tăng lên đáng kể ở những bệnh nhân bị COVID-19 nặng.68,105,106
IL-6, đầu tiên được sản xuất bởi bạch cầu đơn nhân, đại thực bào và DC, đóng vai trò như một chất hoạt hóa nổi bật của con đường JAK/STAT3 trong bối cảnh viêm. Các nghiên cứu gần đây đã xác định rằng trục IL-6 – JAK – STAT3 có liên quan chặt chẽ đến mức độ nghiêm trọng của COVID-19,107,108 và mức độ STAT3 được phosphoryl hóa cao hơn trong các tập hợp con bạch cầu khác nhau ở bệnh nhân COVID-19 so với nhóm chứng khỏe mạnh.109 IL- 6 triển khai hai con đường tín hiệu — tín hiệu cis cổ điển và tín hiệu trans — để kích hoạt sự kích hoạt của tín hiệu JAK/STAT3 xuôi dòng thông qua dạng liên kết màng (mIL-6R) và dạng hòa tan của IL-6R (sIL-6R), tương ứng.110 Trong tín hiệu cis, IL-6 liên kết với mIL-6R được biểu hiện hạn chế trên các tế bào miễn dịch, tạo thành phức hợp IL6/IL-6R/gp130 để kích hoạt tín hiệu JAK/STAT3, Akt/mTOR và MAPK. Điều này tạo ra các tác động toàn thân lên các tế bào miễn dịch, được biểu hiện bằng việc thúc đẩy sự biệt hóa của tế bào T-helper loại 17 (Th17), CD8 + T và B; tăng di cư của bạch cầu đa nhân trung tính; và giảm sự phát triển của Tregs.111,112 Những thứ này lại gây tăng tiết IL-6 và làm trầm trọng thêm tình trạng viêm. Trong truyền tín hiệu, IL-6 lưu hành liên kết với sIL-6Rs để tạo thành một phức hợp, sau đó liên kết với dimer gp130 được biểu hiện trên hầu hết các loại tế bào.
Kết quả là sự kích hoạt tín hiệu JAK-STAT3 xảy ra ở các tế bào không có biểu hiện mIL-6R, chẳng hạn như tế bào nội mô và tế bào cơ trơn mạch máu (VSMC). Sự hoạt hóa mạnh mẽ của con đường IL-6 – IL-6R – JAK – STAT3 kích hoạt bài tiết các chất trung gian khác nhau, chẳng hạn như chính IL-6, IL-8, MCP-1, và yếu tố tăng trưởng nội mô mạch máu (VEGF), và làm giảm sự biểu hiện của Ecadherin được biểu hiện trên các tế bào nội mô.113 Một số nghiên cứu đã chỉ ra rằng MCP-1 có thể tạo điều kiện thuận lợi cho sự hình thành xơ vữa, sản xuất 114 phân tử kết dính, 115,116 và sự tăng sinh và di chuyển của VSMC, 117 điều này giải thích một phần sự xuất hiện của các triệu chứng tim mạch được quan sát trong COVID-CS. Ngoài ra, tăng VEGF và giảm E-cadherin có thể dẫn đến tính thấm và rò rỉ mạch máu và đẩy nhanh sự hiện diện của hạ huyết áp và rối loạn chức năng phổi trong COVID-CS.87 Hơn nữa, IL-6 có thể thúc đẩy sự bài tiết của các protein pha cấp tính khác nhau như CRP , hepcidin, fibrinogen, thrombopoietin, bổ thể C3, và ferritin trong tế bào gan.118,119
Bằng chứng cho thấy việc sản xuất IL-6 có thể được tạo ra bởi angiotensin II trong các mạch bị viêm. Cơ chế cơ bản là angiotensin II liên kết với thụ thể angiotensin II type 1 (AT1) và sau đó kích hoạt tín hiệu JAK/STAT để tạo ra IL-6.120,121 Điều thú vị là các nghiên cứu hiện có đã chỉ ra rằng SARS-CoV có thể thúc đẩy sự biểu hiện của angiotensin II bằng cách điều chỉnh ACE2,122,123 có khả năng dẫn đến khả năng SARS-CoV-2 tăng cường sản xuất IL-6 thông qua thụ thể angiotensin II/AT1/trục JAK/STAT, và cuối cùng là phản hồi tiền viêm tích cực của IL-6/JAK/STAT thúc đẩy các dấu hiệu lâm sàng của COVID-19, đặc biệt là COVID-CS.124
Tín hiệu ifn-γ/jak/stat
IFN-γ, được sản xuất chủ yếu bởi đại thực bào, tế bào T và tế bào NK, tham gia vào các quá trình miễn dịch như viêm. Nó là trình điều khiển chi phối hoạt động của đại thực bào, NK và tế bào T, và có tác dụng chủ yếu đối với khả năng miễn dịch bảo vệ chống lại nhiễm trùng do vi khuẩn và vi rút thông qua việc kích hoạt phức hợp JAK1/JAK2 và các dòng xuống vị trí kích hoạt STAT1-IFN-γ (GAS).125-127
Bằng chứng cho thấy IFN-γ có liên quan nhiều đến các rối loạn khác nhau liên quan đến CS, 128 được minh họa bởi vai trò bệnh lý của nó trong HLH nguyên phát, một hội chứng không loại bỏ được mầm bệnh do hoạt động của tế bào NK bị suy giảm. Trong những trường hợp như vậy, mặc dù kích hoạt quá mức tế bào T và sản xuất số lượng lớn IFN-γ, nồng độ IFN-γ tăng lên không chống lại được mầm bệnh và thay vào đó gây ra bệnh lý miễn dịch vì hoạt động NK bị lỗi.129 Liệu IFN-γ có đóng một vai trò cụ thể trong COVID- CS vẫn chưa rõ; tuy nhiên, xem xét vai trò của nó trong việc thúc đẩy kích hoạt tế bào miễn dịch, chúng ta có thể suy đoán rằng nó đóng góp đáng kể vào COVID-CS.
Nhiều nghiên cứu đã báo cáo mức độ IFN-γ tăng cao ở những bệnh nhân mắc bệnh COVID-19,9,130,131. được giải thích bởi số lượng giảm và sự cạn kiệt chức năng của tế bào T trong COVID19,132 nghiêm trọng như đã mô tả ở trên. Do đó, nghiên cứu này cho rằng nồng độ IFN-γ tăng cao trong COVID-19 được sản xuất chủ yếu bởi các đại thực bào, không phải tế bào T.
Tín hiệu tnfα/nf-κb
TNFα là một cytokine tiền viêm nổi tiếng và có liên quan chặt chẽ với nhiều bệnh truyền nhiễm, tự miễn dịch và ung thư, và chủ yếu được sản xuất bởi bạch cầu đơn nhân, đại thực bào và tế bào T. 133,134 NFκB đóng một vai trò bảo tồn tiến hóa trong hệ thống miễn dịch, 135,136 đặc biệt trong việc điều chỉnh sự biểu hiện của các cytokine quan trọng khác nhau liên quan đến chứng viêm.137 TNFα, như là một trình điều khiển ban đầu của sự hoạt hóa NF-κB, có thể kích hoạt con đường tín hiệu NF-κB để gây ra sự biểu hiện của một số gen chống viêm và kháng nhiễm trùng thông qua nó thụ thể TNFR1 và một loạt các bộ điều hợp trung gian.138-140 Đến lượt nó, NF-κB có thể gây ra biểu hiện TNFα trong bối cảnh viêm, chẳng hạn như kích thích lipopolysaccharide (LPS).141 Do đó, tín hiệu TNFα/NF-κB có thể đóng vai trò bệnh lý trong giai đoạn khởi động và tăng cường tế bào miễn dịch trong CS bằng cách gây ra quá trình apoptosis của tế bào biểu mô để thúc đẩy sự tương tác giữa biểu mô và tế bào miễn dịch và làm tăng thêm tình trạng viêm toàn thân.
Các nghiên cứu trước đây đã phát hiện ra rằng quá nhiều TNFα gây ra tiên lượng xấu trong các trường hợp SARS-CoV và MERS, 142-145 và việc ức chế NF-κB đã cải thiện các triệu chứng phổi ở chuột nhiễm SARS-CoV.146 Tuy nhiên, vai trò của TNFα trong COVID-19 là, cho đến nay, vẫn chưa hoàn toàn rõ ràng. Các nghiên cứu gần đây đã báo cáo nồng độ TNFα trong huyết thanh tăng cao trong các trường hợp COVID-19 nghiêm trọng. với số lượng tế bào T ở bệnh nhân COVID-19.27 Ngược lại, một thử nghiệm lâm sàng từ Trùng Khánh, Trung Quốc, bao gồm 102 trường hợp nhẹ và 21 trường hợp nặng cho thấy mức TNFα nằm trong giá trị bình thường ở hầu hết bệnh nhân COVID-19 (121/123) .147 Vì vậy, cần phải nghiên cứu thêm để hiểu rõ hơn về vai trò của TNFα trong COVID-CS. Mặc dù một báo cáo gần đây gợi ý rằng việc ức chế con đường TNFαNF-κB có thể có tác dụng bảo vệ trong COVID19,124 cần thận trọng khi áp dụng dựa trên hai khía cạnh: (1) như đã đề cập ở trên, vai trò của TNFα trong COVID-CS vẫn chưa được xác định. ; (2) việc ngăn chặn NF-κB một cách không đặc hiệu có thể đồng thời làm suy giảm các chức năng bảo vệ của nó trong cân bằng nội môi tế bào, như được minh chứng bằng sự ức chế chung đối với khả năng miễn dịch bẩm sinh.148
Tín hiệu nlrp3/il-1β
IL-1β có lẽ là thành viên được nghiên cứu nhiều nhất trong họ IL-1 vì vai trò nổi bật của nó trong các bệnh tự viêm như bệnh gút và viêm khớp mãn tính. 49,150,151 IL-1β chủ yếu được các đại thực bào tiết ra thông qua quá trình apoptosis và pyroptosis và có tác dụng tích cực về sự di chuyển của các tế bào miễn dịch đến các mô bị viêm; Biệt hóa tế bào Th17; biểu hiện và giải phóng các cytokine khác nhau và các yếu tố kết dính; và kích hoạt con đường NF-κB để hình thành phản hồi tích cực cho quá trình sản xuất của chính nó.152,153 Ngược dòng, protein NLRP3 tạo thành một phức hợp với protein dạng đốm liên quan đến quá trình apoptosis chứa miền tuyển dụng caspase (ASC) và proteinase-1 đặc hiệu cysteinyl aspartate ( caspase-1), được gọi là thể viêm NLRP3, để phân cắt tiền chất IL-1β không hoạt động thành dạng trưởng thành của IL-1β.154,155 Xem xét vai trò tích cực của IL-1β trong việc kích hoạt chủ động và kéo dài tình trạng viêm, 156 người ta đã công nhận rằng NLRP3- Tín hiệu IL-1β có thể tham gia vào COVID-CS.
Nhiều chỉ số từ các bằng chứng trước đây đã gợi ý rằng IL-1β có thể góp phần vào CS trong các trường hợp nhiễm coronavirus. 157,158,159 Zhang và cộng sự 160 đã báo cáo mức độ tăng cao của nhiều cytokine bao gồm IL-1β trong các trường hợp COVID-19 có các triệu chứng nghiêm trọng, cũng liên quan đến SARS, tăng đông máu và DIC. Đồng thời, Huang và cộng sự cũng cho thấy nồng độ IL-1β trong huyết thanh cao ở bệnh nhân COVID-19. Hơn nữa, một nghiên cứu trước đây cho thấy NLRP3 có thể được kích hoạt trực tiếp bởi các protein virus SARS-CoV như ORF3a và ORF8b, 161,162 cũng được tìm thấy trên bộ gen của SARS-CoV-2,163 cho thấy tác dụng tương tự có khả năng kích hoạt trực tiếp NLRP3 bởi protein SARS-CoV-2. Các vai trò tiềm năng của NLRP3 gây viêm nhiễm trong COVID-19 nghiêm trọng đã được thảo luận trong các bài tổng quan có liên quan.164.165 Các loài oxy phản ứng (ROS) được cho là yếu tố khởi đầu kích hoạt NLRP3.166-168 COVID-19 có thể dẫn đến kích hoạt NLRP3 và phân cắt tiền chất IL-1β, làm trầm trọng thêm tình trạng viêm trong COVID-CS.
Tín hiệu il-2/il-2r/jak/stat5
IL-2 chủ yếu được tiết ra bởi các tế bào T CD4 và đóng vai trò quan trọng trong việc mở rộng và biệt hóa của CD4 + T, CD8 + T, NK và các tế bào khác thông qua con đường tín hiệu IL-2R – JAK – STAT5. 169,170 IL-2 có thể tinh- điều chỉnh các phản ứng miễn dịch và duy trì khả năng tự chịu đựng, 171 và sự thiếu hụt của nó là nguyên nhân dẫn đến sự xuất hiện của các bệnh tự miễn dịch.172
Nồng độ IL-2 tăng cao đã được báo cáo trong các loại nhiễm trùng coronavirus khác. 173,174 Các nghiên cứu gần đây cũng chỉ ra rằng nồng độ IL-2 hoặc IL-2R tăng cao ở bệnh nhân COVID-19, đặc biệt là ở những người bị bệnh nặng. 9,13,24,132 Tuy nhiên, một thử nghiệm lâm sàng bao gồm 54 bệnh nhân COVID-19 từ Bắc Kinh, Trung Quốc, đã báo cáo một kết quả trái ngược. Các tác giả nhận thấy rằng so với những bệnh nhân nặng (n = 14), những người bị bệnh nguy kịch (n = 6) có nồng độ IL-2 trong huyết tương giảm đáng kể. Theo đó, nồng độ IL-2Rα đã giảm đáng kể trong PBMC của bệnh nhân bị bệnh nặng và nguy kịch so với bệnh nhân thông thường (n = 34) hoặc nhóm chứng khỏe mạnh. Hơn nữa, mức JAK1 và STAT5 ở cả ba nhóm đều thấp hơn đáng kể so với nhóm chứng bình thường. Xem xét vai trò hỗ trợ của IL-2 trong sự mở rộng và biệt hóa của tế bào T, các tác giả suy đoán rằng sự hiện diện của giảm bạch cầu lympho, đặc biệt là trong COVID-19 nghiêm trọng có thể do giảm mức IL-2, IL-2R, JAK1 và STAT5.175 Ngoài ra, các tế bào T CD4 là nguồn chính của IL-2, và số lượng tế bào lympho giảm trong giai đoạn CS sau khi nhiễm COVID-19 ít nhất có thể giải thích một phần mức IL-2 giảm và điều hòa IL-2 giảm. tín hiệu. Cần phải có các cuộc điều tra trong tương lai để xác nhận những phát hiện này ở nhiều bệnh nhân hơn.
Tín hiệu il-7/il-7r
Tín hiệu IL-7/IL-7R cần thiết cho cân bằng nội môi ngoại vi và sự tồn tại, biệt hóa và duy trì của các tế bào T bao gồm CD4 + T, CD8 + T, T ngây thơ và tế bào T nhớ.176-179 Nó cũng không thể thiếu cho sự phát triển và duy trì các tế bào lymphoid bẩm sinh (ILC), hình thành các cấu trúc lymphoid và hàng rào bảo vệ.180
Các báo cáo gần đây cho thấy mức độ IL-7 tăng cao ở bệnh nhân COVID-19 và những sự gia tăng này có liên quan đến mức độ nghiêm trọng của bệnh. Xem xét vai trò bảo vệ của IL-7, chúng ta có thể suy đoán rằng sự gia tăng IL-7 có thể là một cơ chế phản hồi để đáp ứng với tình trạng giảm bạch cầu lympho ở những bệnh nhân bị COVID-19 nặng/nguy kịch.
Tín hiệu il-10
IL-10 là một cytokine điều hòa miễn dịch quan trọng được sản xuất bởi nhiều loại tế bào miễn dịch bao gồm tế bào Th2, tế bào Tregs, tế bào CD8 +, tế bào B, DC, đại thực bào và tế bào NK, và tín hiệu thông qua con đường IL-10R/JAK/STAT3. IL-10 thực hiện chức năng chống viêm bằng cách hạn chế trực tiếp các chức năng liên quan đến miễn dịch bẩm sinh của đại thực bào và DC theo cách tự tiết và nội tiết hoặc gián tiếp thông qua việc cải thiện sự phát triển của Treg. Ngoài ra, IL-10 có thể kích hoạt tế bào mast và tăng cường chức năng của tế bào CD8 + T, B và NK.181
Một thử nghiệm lâm sàng bao gồm 102 bệnh nhân COVID-19 và 45 đối chứng từ Vũ Hán, Trung Quốc, cho thấy nồng độ IL-10 huyết thanh của những bệnh nhân mắc bệnh hiểm nghèo (n = 17) cao hơn đáng kể so với những bệnh nhân ở mức độ trung bình (n = 42) và bệnh nặng (n = 43); hơn nữa, nồng độ IL-10 có tương quan thuận với nồng độ CRP huyết thanh, cho thấy tiềm năng của IL-10 như một chỉ báo về mức độ nghiêm trọng của bệnh.182 Huang và cộng sự9 cũng báo cáo nồng độ IL-10 trong huyết tương cao đáng kể trong COVID -19 bệnh nhân được nhận vào ICU so với những người không nhập viện. Ngoài ra, một thử nghiệm lâm sàng tiếp theo bao gồm 71 bệnh nhân COVID-19 (53 nhẹ và 18 nặng) từ Bắc Kinh, Trung Quốc và 18 đối chứng cho thấy việc sản xuất IL-10 trong giai đoạn đầu có tương quan đáng kể với mức độ nghiêm trọng của bệnh.183
Có thể suy đoán rằng việc sản xuất quá nhiều IL-10 là một cơ chế phản hồi tiêu cực để chống lại sự hiếu động của hệ thống miễn dịch. Tuy nhiên, khi đối mặt với sự bài tiết quá mức của các chất trung gian gây viêm và sự hoạt hóa của các tế bào tiền viêm trong COVID-CS, chức năng điều chỉnh của IL-10 là khá bất cập. Do đó, việc sử dụng IL-10 đã được khuyến cáo để điều trị ARDS trong COVID-19.184 Tuy nhiên, một báo cáo gần đây cho thấy IL-10 có thể gây bất lợi trong giai đoạn khởi đầu của nhiễm SARS-CoV-2 bằng cách thúc đẩy quá trình kiệt sức của tế bào T. Các tác giả đề xuất rằng việc ngăn chặn IL-10 bằng kháng thể trung hòa trong giai đoạn khởi đầu của nhiễm SARS-CoV-2 có thể là một phương pháp điều trị đầy hứa hẹn.185
Tín hiệu il-12
IL-12, chủ yếu được sản xuất bởi DC, đại thực bào và tế bào lympho B, 186 là một yếu tố điều hòa miễn dịch đa chức năng có thể thúc đẩy tăng sinh các tế bào Th1 và Th17; cải thiện độc tính tế bào của tế bào NK; và gây ra biểu hiện IFN-γ trong tế bào Th1, tế bào NK, DC và đại thực bào thông qua cơ chế phản hồi tích cực.187,188 Do đó, IL-12 đóng một vai trò tích cực trong CS bằng cách tăng cường kích hoạt các tế bào miễn dịch khác nhau.
Các nghiên cứu hiện tại đã báo cáo rằng nhiễm virút tạo ra IL-12 để bảo vệ chống lại nhiễm trùng.189191 Ví dụ: trong quá trình nhiễm vi-rút cúm, IL-12 được sản xuất nội sinh để gây tiết IFN-γ từ các tế bào Th1 và NK, do đó ức chế sự nhân lên của virus.190 Một nghiên cứu trước đây báo cáo nồng độ IL-12 trong huyết tương tăng cao ở những bệnh nhân bị nhiễm SARS-CoV.192 Tuy nhiên, Huang và cộng sự9 gần đây đã phát hiện ra rằng nồng độ IL12p70 trong huyết tương không cho thấy sự khác biệt giữa bệnh nhân COVID-19 và người lớn khỏe mạnh. Do đó, cần khẩn trương nghiên cứu thêm với các mẫu có kích thước lớn để xác định các thay đổi và chức năng của IL-12 trong COVID-19, đặc biệt là COVID-CS.
Tín hiệu il-17
IL-17 (chủ yếu là IL-17A) được tạo ra bởi Th17, CD8 + T, và ILC nhóm 3 (ILC3) và tham gia vào nhiều quá trình tiền viêm và các bệnh tự miễn. gánh nặng của một số bệnh tự miễn dịch như bệnh vẩy nến và viêm khớp vẩy nến.193-195 Tuy nhiên, các chức năng của cytokine gây viêm này khác nhau, từ bảo vệ chống lại nhiễm trùng cho đến tác dụng chống viêm bất lợi, tùy thuộc vào loại mô và vị trí (ruột, phổi hoặc da) nơi nó được biểu hiện và các yếu tố kích hoạt của nó.196
Sự gia tăng nồng độ IL-17 đã được báo cáo trước đây ở những bệnh nhân nhiễm SARS-CoV- hoặc MERS-CoV.197,198 Ngoài ra, IL-17 có thể làm tăng tổn thương phổi và giảm khả năng sống sót tổng thể thông qua việc tuyển dụng bạch cầu đa nhân trung tính; kích thích sự biểu hiện của các yếu tố tiền viêm; và gây ra sự biểu hiện của G-CSF để ngăn chặn quá trình apoptosis ở cả ARDS và mô hình tổn thương phổi cấp do LPS.199,200 Tương tự, bằng chứng cho thấy nồng độ IL-17 tăng cao ở bệnh nhân COVID-19, đặc biệt là ở những người bị bệnh nặng và nguy kịch. 201 Asrani và Hassan156 cho thấy IL17 đóng vai trò quan trọng trong các giai đoạn tăng hoạt tế bào miễn dịch và rối loạn chức năng cơ quan đích trong COVID-CS bằng cách thúc đẩy việc tuyển dụng bạch cầu đa nhân trung tính và tạo ra các triệu chứng như sốt, tổn thương chất nền, tái cấu trúc mô, và thâm nhiễm viêm.
Mặc dù có nhiều bằng chứng cho thấy tiềm năng của IL-17 như một mục tiêu can thiệp cho COVIDCS, các nghiên cứu đã chỉ ra rằng nồng độ IL-17 nằm trong giới hạn bình thường ở 102 và 21 bệnh nhân bị COVID-19 nhẹ và nặng.147 Do đó , cần có thêm các thử nghiệm lâm sàng và nghiên cứu cơ bản để làm rõ thêm.
Tín hiệu gm-csf
GM-CSF được sản xuất bởi tế bào nội mô, biểu mô, cơ quan tạo máu và các loại tế bào khác.202 Trong điều kiện sinh lý, mức GM-CSF thấp có thể điều chỉnh cân bằng nội môi của đại thực bào phế nang để duy trì chức năng kháng khuẩn của chúng.203,204 Trong các điều kiện siêu viêm như CS, GM -CSF thúc đẩy quá trình tạo tủy khẩn cấp và thu nhận các tế bào dòng tủy đến các vị trí viêm để duy trì các phản ứng viêm.205 Mức độ GM-CSF tăng lên đã được quan sát thấy trong SARS, 206 ARDS, 207 và CRS.208 Một nghiên cứu gần đây cũng báo cáo mức GM-CSF tăng cao trong cả COVID-19 nặng và nhẹ.9
Với vai trò của GM-CSF trong việc duy trì các chức năng kháng khuẩn của đại thực bào phế nang, việc sử dụng GM-CSF cho bệnh nhân bị COVID-19 giai đoạn đầu có thể củng cố thành phế nang và tăng cường thanh thải virus.209 Ngược lại, việc phong tỏa tín hiệu GM-CSF có thể đạt được lợi ích lâm sàng trong COVID-CS.
Các can thiệp dựa trên cytokine
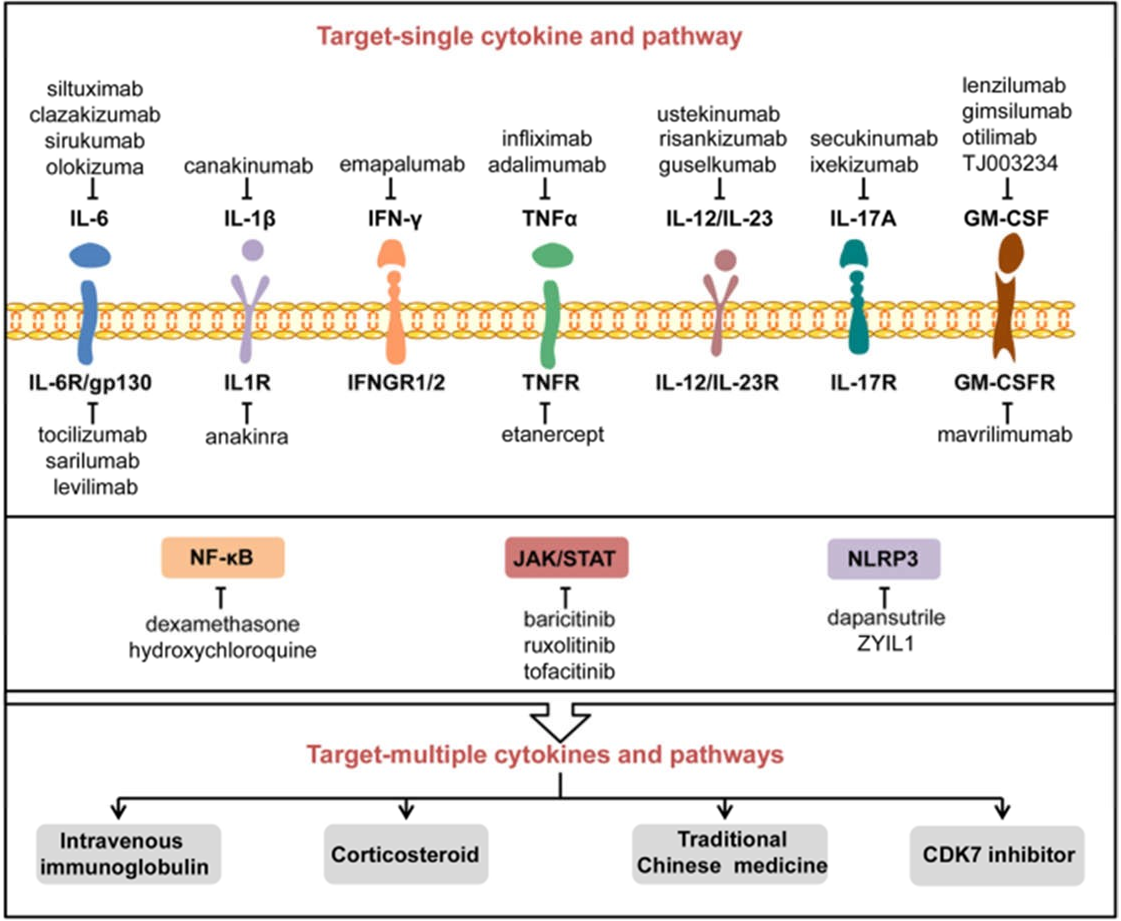
Phương pháp điều trị CS hiện nay chủ yếu dựa trên các loại thuốc chống viêm truyền thống như sử dụng corticosteroid, chloroquine và colchicines.210,211 Gần đây, các sinh học như cytokine tái tổ hợp; kháng thể đơn dòng chống lại IL-6, IL-1β, TNF-α và IFN-γ; và các chất ức chế đường truyền tín hiệu cũng có sẵn hoặc trong đường ống để sản xuất. Trong phần này và phần tiếp theo, chúng tôi nhằm mục đích thảo luận về các sinh học chính hiện đang hoặc có khả năng được áp dụng để điều trị CS (Hình 6).
Ifn-i
Việc quản lý IFN-I trước đây đã được nghiên cứu để điều trị SARS-CoV và MERS-CoV. Nói chung, nó được phát hiện là tương đối hiệu quả trong ống nghiệm và trong một số mô hình động vật, 212 mặc dù các nghiên cứu trên người không có kết quả.213
Nhóm nghiên cứu tại Đại học Texas Medical Branch, Hoa Kỳ, cho thấy nồng độ thấp của IFN-α và IFN-β làm giảm hiệu giá virus một cách hiệu quả và ức chế sự nhân lên của virus trong tế bào Vero theo cách phụ thuộc vào liều lượng, và họ cũng phát hiện ra rằng SARS- CoV-2 nhạy cảm hơn SARSCoV với IFN-I in vitro.214 Một nghiên cứu thăm dò, không kiểm soát từ Trường Cao đẳng Y tế Tongji, Vũ Hán, Trung Quốc, cho thấy rằng việc sử dụng IFN-α2b một mình hoặc kết hợp với arbidol đã tăng tốc đáng kể quá trình thanh thải vi rút như cũng như sự phục hồi IL-6 và CRP về mức bình thường ở bệnh nhân COVID-19.215 Một thử nghiệm lâm sàng ngẫu nhiên, đa trung tâm, tiền cứu, giai đoạn 2 được thực hiện tại Đại học Hồng Kông cho thấy rằng so với nhóm chứng (lopinavir/ritonavir), Bệnh nhân COVID-19 dùng ba thuốc (IFNβ-1b cộng với lopinavir/ritonavir + ribavirin) biểu hiện các triệu chứng thuyên giảm đáng kể; rút ngắn thời gian phát tán vi rút và thời gian nằm viện; và cải thiện tình trạng viêm nhiễm (NCT04276688) .216 Một nghiên cứu tiền cứu bao gồm 2944 nhân viên y tế khỏe mạnh trong vùng dịch từ Bệnh viện Taihe ở thành phố Shiyan, Hồ Bắc, Trung Quốc, cho thấy tỷ lệ mắc COVID-19 là 0 ở cả nhóm nguy cơ thấp (n = 2415) và nhóm nguy cơ cao (n = 529) sau khi điều trị bằng thuốc nhỏ mũi IFN-α tái tổ hợp trong 30 ngày (NCT04320238), 217 cho thấy vai trò phòng ngừa của IFN-α tái tổ hợp trong COVID-19. Một thử nghiệm so sánh hiệu quả lâm sàng của IFN-β1a tiêm dưới da cộng với lopinavir/ritonavir với lopinavir/ritonavir đơn thuần; hydroxychloroquine; và remdesivir trong COVID-19 vẫn đang tiếp tục (NCT04315948). Nói chung, những nghiên cứu này gợi ý rằng IFN-I có thể ức chế lây nhiễm SARSCoV-2 và COVID-CS tiềm năng.
Một loại interferon khác – IFN-III – cũng có thể có lợi ích lâm sàng trong điều trị COVID-19. Dinnon và cộng sự 218 đã xác nhận tác dụng chống virus của IFN-λ1a pegyl hóa trên cả tế bào biểu mô đường thở của người nhiễm SARS-CoV-2 và mô hình chuột. Một số nghiên cứu đã xác định rằng MDA5 đóng vai trò hàng đầu trong việc kích hoạt phản ứng IFN-I/III để bảo vệ chống lại SARS-CoV-2 trong tế bào biểu mô của người, 219-221 có thể mở ra một con đường mới để tăng cường phản ứng IFN trong COVID-19. Ngoài ra, một số thử nghiệm lâm sàng đánh giá hiệu quả lâm sàng của IFN-λ đang được nghiên cứu (NCT04343976, NCT04331899).
Il-7
Vai trò hỗ trợ của IL-7 trong sự tồn tại và mở rộng của tế bào lympho cung cấp ý nghĩa lâm sàng cho việc phục hồi chức năng của tế bào lympho trong COVID-19 nặng/nghiêm trọng.
Hình 6 Các chất ức chế và liệu pháp tiềm năng để chống lại COVID-CS. Nhiều loại thuốc hoặc chất ức chế đã được áp dụng hoặc đang được xem xét để điều trị COVID-CS, bao gồm cả những thuốc nhắm vào một cytokine gây viêm đơn lẻ hoặc thụ thể của nó và con đường tín hiệu liên quan. Ngoài ra, một số phương pháp điều trị như immunoglobulin tiêm tĩnh mạch, corticosteroid, thuốc Đông y và chất ức chế CDK7 có thể có khả năng chống lại nhiều cytokine và các con đường liên quan đến COVID-CS. CDK7: kinase 7 phụ thuộc cyclin.
Một báo cáo trường hợp từ Hospices Civils de Lyon, Pháp, cho thấy một giai đoạn điều trị IL-7 (rhIL-7) tái tổ hợp ở người đã cải thiện đáng kể chức năng miễn dịch ở một bệnh nhân ICU 74 tuổi bị COVID-19 nặng, biểu hiện như tăng số lượng tế bào lympho và biểu hiện mHLA-DR. Trong trường hợp này, IL-7 được sử dụng khá muộn, vào ngày 24 nhập viện. Do đó, các tác giả đề xuất một cách tiềm năng rằng việc sử dụng IL-7 sớm hơn có thể cho kết quả lâm sàng tốt hơn.222 Trong một loạt trường hợp từ Bệnh viện Đại học St. Luc, Brussels, Bỉ, các tác giả cho thấy rằng bệnh nhân trong nhóm điều trị IL7 dường như có mức độ số lượng tế bào lympho cao hơn so với những người trong nhóm chứng, không có tình trạng viêm và tổn thương phổi trầm trọng hơn.223 Thật không may, việc không có các nghiên cứu chi tiết về kiểu hình hoặc chức năng trên tế bào lympho làm suy yếu độ tin cậy của các nghiên cứu này. Một thử nghiệm lâm sàng mù đôi, đa trung tâm trong một nhóm thuần tập tại Vương quốc Anh hiện đang đánh giá liệu việc sử dụng CYT107 (một sản phẩm thương mại của rhIL-7) có thể cải thiện lâm sàng ở những bệnh nhân bị COVID-19 nặng thông qua việc phục hồi miễn dịch hay không (NCT04379076). Clark et al.224 đề xuất rằng việc sử dụng IL-7 kết hợp với dexamethasone có thể là phương pháp điều trị tối ưu cho COVID-19 nặng. Cơ chế cơ bản là dexamethasone tăng cường hoạt động IL-7 bằng cách điều chỉnh thụ thể IL-7Rα của nó, cũng có thể được sử dụng để giải thích các đặc tính hiệu quả nhất của dexamethasone trong giai đoạn bệnh nặng hơn.225-226
Những nghiên cứu này chỉ ra rằng việc sử dụng IL7 một mình hoặc kết hợp với các thuốc khác nên được xem xét càng sớm càng tốt cho những bệnh nhân COVID-19 nguy kịch bị giảm bạch cầu lympho nặng.
Phong tỏa cytokine
Phong tỏa il-6
Như đã đề cập ở trên, tín hiệu IL-6 là chất cảm ứng hàng đầu của COVID-CS. Hiện tại, một số loại thuốc nhắm mục tiêu tín hiệu IL-6 như chất ức chế IL-6 (siltuximab, clazakizumab, sirukumab, olokizumab) và chất ức chế IL-6R (tocilizumab, sarilumab, levilimab) có sẵn.227,228,229
Một thử nghiệm lâm sàng hồi cứu ở An Huy, Trung Quốc, bao gồm 21 bệnh nhân COVID-19 bị bệnh nặng hoặc nguy kịch cho thấy rằng liệu pháp tocilizumab trong 5 ngày ngay lập tức cải thiện kết quả lâm sàng ở hầu hết các bệnh nhân, biểu hiện là giảm nhu cầu oxy, nồng độ CRP trong huyết thanh và thời gian nằm viện, cũng như sự phục hồi nhanh chóng của tỷ lệ tế bào lympho.230 Một nghiên cứu thuần tập đa trung tâm khác bao gồm 3924 bệnh nhân COVID-19 trong ICU trên 68 bệnh viện ở Hoa Kỳ cho thấy nguy cơ tử vong thấp hơn ở 433 bệnh nhân được điều trị tocilizumab ngay sau khi nhập viện ICU Ngoài ra, nhiều báo cáo đánh giá việc sử dụng tocilizumab đối với COVID-19 nghiêm trọng cũng đã được công bố, 106,232-247 và tổng số 75 thử nghiệm lâm sàng hiện đang được đăng ký trong các thử nghiệm lâm sàng. gov.
Một nghiên cứu nhãn mở từ Ý bao gồm 56 bệnh nhân bị COVID-19 nặng cho thấy rằng sau 28 ngày theo dõi, điều trị bằng sarilumab (n = 28) dường như thúc đẩy sự phục hồi của những bệnh nhân bị xơ phổi nhẹ (248 Một thử nghiệm lâm sàng hồi cứu, đơn trung tâm khác từ Ý bao gồm 15 bệnh nhân COVID-19 cho thấy điều trị bằng sarilumab đã cải thiện các triệu chứng lâm sàng và giảm nồng độ CRP huyết thanh ở hầu hết bệnh nhân (n = 10).249 Hiện tại, có tổng cộng 17 thử nghiệm lâm sàng trên sarilumab được đăng ký trên ClinicalTrials.gov để điều trị COVID-19.
Một thử nghiệm lâm sàng ngẫu nhiên, giai đoạn 3, đánh giá việc sử dụng levilimab ở những bệnh nhân bị COVID-19 nặng đã được hoàn thành, nhưng kết quả vẫn chưa được công bố (NCT04397562).
Một nghiên cứu thuần tập quan sát, có đối chứng từ Ý bao gồm 30 bệnh nhân cần hỗ trợ thở máy cho thấy tỷ lệ tử vong trong 30 ngày giảm đáng kể ở những người được điều trị bằng siltuximab cộng với chăm sóc hỗ trợ tối ưu so với nhóm chứng chỉ được chăm sóc hỗ trợ tối ưu; ~ 50% bệnh nhân được điều trị bằng siltuximab cuối cùng đã được xuất viện (NCT04322188).250 Ba thử nghiệm lâm sàng khác đánh giá hiệu quả và độ an toàn của siltuximab trong COVID-19 nặng đang được tiến hành (NCT04329650, NCT04330638, NCT04486521).
Nhìn chung, các thử nghiệm lâm sàng đã được công bố cho thấy kết quả tích cực đối với một số thuốc đối kháng IL-6 hoặc IL-6R phổ biến để điều trị COVID-CS. Một số thử nghiệm lâm sàng về các chất đối kháng IL-6 hoặc IL-6R khác bao gồm clazakizumab (NCT04381052, NCT04494724, NCT04343989, NCT04363502, NCT04348500, NCT04659772); sirukumab (NCT04380961); và olokizumab (NCT04380519, NCT04452474) đã được đăng ký trên ClinicalTrials.gov để điều tra tiềm năng điều trị của chúng trong COVID-CS.
Phong tỏa il-1β
Xem xét vai trò bệnh lý của tín hiệu IL-1β trong CS, một số loại thuốc nhắm mục tiêu tín hiệu IL-1β, bao gồm canakinumab đối kháng IL-1β và anakinra đối kháng thụ thể IL-1, có thể mang lại lợi ích lâm sàng trong điều trị COVID-19, đặc biệt ở CS.
Một thử nghiệm lâm sàng hồi cứu, ba trung tâm, từ Pháp bao gồm 22 bệnh nhân bị COVID-19 nặng/nguy kịch cho thấy sau> 8 ngày điều trị, bệnh nhân trong nhóm anakinra (n = 12) đã cải thiện tình trạng lâm sàng cũng như giảm thở máy. yêu cầu và nồng độ CRP huyết thanh, so với nhóm chứng (n = 10) (INDS, MR4115050520) .251 Một nghiên cứu thuần tập tiến cứu từ Hà Lan cho thấy một số thông số lâm sàng bao gồm nhiệt độ; số lượng bạch cầu; và nồng độ ferritin, creatinin, procalcitonin, và bilirubin trong huyết tương đã giảm sau 28 ngày điều trị bằng anakinra.252 Một số nghiên cứu khác cũng đã điều tra tác dụng lâm sàng của anakinra đối với COVID-19,253-261 Tổng số 35 thử nghiệm lâm sàng hiện đã được đăng ký trên ClinicalTrials .gov.
Một nghiên cứu hồi cứu từ Ý lần đầu tiên báo cáo rằng tiêm dưới da 300 mg canakinumab làm giảm nhanh chóng tình trạng viêm toàn thân và cải thiện quá trình oxy hóa ở bệnh nhân COVID-19 (n = 10) có biểu hiện tăng viêm nhưng không cần thở máy.262 Một trung tâm đơn lẻ khác, Nghiên cứu thuần tập từ Ý đã thu nhận 34 bệnh nhân không ICU bị COVID-19 nhẹ hoặc nặng, với 17 người được điều trị tiêu chuẩn và 17 người nhận được 300 mg canakinumab tiêm dưới da. Kết quả cho thấy điều trị bằng canakinumab làm tăng đáng kể tỷ lệ PaO2/FiO2 và giảm các chỉ số viêm.263 Hai nghiên cứu này cho thấy rằng điều trị bằng canakinumab có thể có tiềm năng điều trị ở những bệnh nhân không phải ICU với COVID-19 nhẹ hoặc nặng. Một số báo cáo khác cũng đã đánh giá việc sử dụng canakinumab trong COVID-19,264-266 và sáu thử nghiệm lâm sàng hiện đã được đăng ký trên ClinicalTrials.gov (NCT04348448, NCT04476706, NCT04362813, NCT04365153, NCT04510493, NCT04278404).
Phong tỏa ifn-γ
Emapalumab, một kháng thể đơn dòng nhắm mục tiêu IFN-γ, đã được phê duyệt để điều trị HLH nguyên phát, một tình trạng có nồng độ IFN-γ trong huyết thanh tăng cao. 267 Xem xét sự đóng góp của IFN-γ đối với CS như đã đề cập ở trên, emapalumab có thể có hiệu quả trong điều trị COVID-CS.
Một thử nghiệm lâm sàng ngẫu nhiên, đa trung tâm từ Ý đã được đăng ký để điều tra hiệu quả của việc điều trị bằng emapalumab kết hợp với anakinra để làm giảm chứng viêm siêu vi và cải thiện tình trạng hô hấp (NCT04324021). Rất tiếc, bản dùng thử này hiện đã kết thúc và hiện không có thêm dữ liệu nào. Do đó, các thử nghiệm lâm sàng ngẫu nhiên, có đối chứng khác được yêu cầu khẩn cấp để giải quyết những vấn đề này.
Phong tỏa tnfα
Các nghiên cứu gần đây đã cung cấp cơ sở lý thuyết và thực tiễn để hỗ trợ phong tỏa TNFα như một chiến lược tiềm năng để giải phóng quá mức cytokine và quá trình viêm nhiễm trong COVID-19.268-271
Etanercept là một protein dung hợp thụ thể TNFα hòa tan đã được sử dụng để điều trị hoại tử biểu bì nhiễm độc (TEN), một tình trạng viêm siêu vi toàn thân. Do sự tương đồng về biểu hiện lâm sàng và đặc điểm bệnh lý giữa COVID-19 và TEN, Chen và cộng sự 268 đã đề xuất việc sử dụng tạm thời etanercept như một cách tiếp cận có giá trị để điều trị COVID-19 nặng. Một báo cáo trường hợp mô tả rằng một người đàn ông 60 tuổi được điều trị bằng etanercept dưới da cho chứng viêm đốt sống trước khi nhiễm SARS-CoV-2 không có dấu hiệu suy hô hấp và suy giảm tiến triển và cho thấy sự hồi phục nhanh chóng sau COVID-19.269 Infliximab là một TNFα khác đã được phê duyệt lâm sàng máy chặn. Tổng cộng bốn thử nghiệm lâm sàng về infliximab đánh giá tiềm năng điều trị của nó trong COVID-19 hiện đang được tiến hành (NCT04425538, NCT04734678, NCT04593940, NCT04344249). Adalimumab là một kháng thể đơn dòng nhắm mục tiêu TNFα và hiện đang được đánh giá trong hai thử nghiệm lâm sàng (ChiCTR2000030089, NCT04705844).
Mặc dù có những kết quả đầy hứa hẹn này, chúng tôi không thể loại trừ khả năng may rủi, và do đó, các thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, tiền cứu với kích thước mẫu lớn được yêu cầu khẩn cấp để xác nhận thêm.
Phong tỏa il-12/il-23
Các chất ức chế IL-12/23 hiện được sử dụng tại phòng khám bao gồm risankizumab, guselkumab, tildrakizumab (nhắm mục tiêu IL-23p19) và ustekinumab (nhắm mục tiêu IL-12/IL-23p40) chủ yếu cho các bệnh viêm mãn tính và tự miễn dịch như bệnh vẩy nến và bệnh viêm ruột.272-276 Một đánh giá gần đây đã đề xuất các chất ức chế IL12/IL-23 hoặc IL-23 làm mục tiêu can thiệp tiềm năng cho đại dịch COVID-19 đang diễn ra.277
Một số báo cáo trường hợp đã mô tả hiệu quả lâm sàng của các chất ức chế IL-12/IL-23 bao gồm ustekinumab, guselkumab, risankizumab và risankizumab ở bệnh nhân mắc bệnh vẩy nến COVID-19.278-282 Độ tin cậy của các báo cáo ca bệnh tương đối yếu, đó là lý do tại sao các thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, tiền cứu lại rất quan trọng.
Một thử nghiệm lâm sàng đa trung tâm, ngẫu nhiên, đang được tiến hành để đánh giá hiệu quả của risankizumab một mình hoặc risankizumab kết hợp với remdesivir trong COVID-19 (NCT04583956).
Phong tỏa il-17a
Một số bài báo đã đề xuất nhắm mục tiêu tín hiệu IL-17A như một biện pháp can thiệp cho bệnh nhân COVID-CS.196,283-289
Các báo cáo trường hợp từ Ý đã chỉ ra rằng những bệnh nhân có tiền sử bệnh vẩy nến và điều trị trước đó bằng thuốc đối kháng IL-17A bao gồm secukinumab và ixekizumab cho thấy các triệu chứng COVID-19 tương đối nhẹ hoặc thậm chí không có triệu chứng.290-292 Một thử nghiệm lâm sàng hồi cứu, quan sát, đa trung tâm từ Ý với 5206 bệnh nhân mắc bệnh vẩy nến đã được kê đơn thuốc bao gồm thuốc ức chế IL-17 cho thấy chỉ có bốn bệnh nhân nhập viện vì COVID-19 và không có trường hợp tử vong nào xảy ra, 293 cho thấy vai trò bảo vệ của chất ức chế IL-17A trong COVID-CS và ARDS. Tuy nhiên, việc sử dụng dân số Ý nói chung làm nhóm đối chứng làm giảm mức độ tiêu chuẩn hóa và độ tin cậy của thử nghiệm này. Việc không có chẩn đoán lâm sàng hoặc thực nghiệm tiêu chuẩn cho COVID-19 là một hạn chế khác. Ngoài ra, các thử nghiệm lâm sàng tiền cứu, ngẫu nhiên khác đánh giá việc sử dụng ixekizumab (NCT04724629) và secukinumab (NCT04403243) trong COVID-19 cũng đang được tiến hành. Ngoài ra, nhiều nhà nghiên cứu đã đề xuất rằng việc nhắm mục tiêu đồng thời tín hiệu IL-17A và tín hiệu IL-6 hiệp đồng có thể mang lại nhiều lợi ích lâm sàng hơn cho bệnh nhân COVID-19, đặc biệt là đối với những người trải qua CS.283,286
Phong tỏa gm-csf
Một số nghiên cứu đã báo cáo vai trò bảo vệ của GM-CSF trong giai đoạn đầu của nhiễm trùng, 294296 và nhiều thử nghiệm lâm sàng về GM-CSF tái tổ hợp ở người bao gồm sargramostim và molgramostim đã được đăng ký để điều trị COVID19; tuy nhiên, như đã đề cập ở trên, GM-CSF thực sự có chức năng bệnh lý trong giai đoạn CS, ngụ ý rằng việc ngăn chặn tín hiệu GM-CSF có thể đạt được lợi ích lâm sàng trong COVID-CS.
Mavrilimumab là một kháng thể đơn dòng chống lại GM-CSF-Rα.297 Một nghiên cứu đoàn hệ tiền cứu từ Ý bao gồm 39 bệnh nhân bị COVID-19 nặng cho thấy rằng các bệnh nhân trong nhóm mavrilimumab (n = 13) cho thấy sự cải thiện sớm hơn, ít tiến triển đến thở máy hơn và Giải quyết cơn sốt nhanh hơn những người trong nhóm chứng (n = 26).298 Ngoài ra, một số thử nghiệm lâm sàng đánh giá việc sử dụng mavrilimumab trong COVID-19 nghiêm trọng đã được đăng ký (NCT04447469, NCT04463004, NCT04492514, NCT04399980, NCT04397497).
Lenzilumab là một kháng thể đơn dòng tái tổ hợp chống lại GM-CSF của người. Một nghiên cứu thuần tập ca bệnh bao gồm 39 bệnh nhân bị COVID-19 nặng từ Hoa Kỳ báo cáo rằng so với nhóm chứng (n = 27), những bệnh nhân được điều trị bằng lenzilumab đường tĩnh mạch (n = 12) có cải thiện lâm sàng nhanh chóng đáng kể; giảm tiến triển thành ARDS; và giảm các dấu hiệu viêm và tế bào tủy viêm.299 Ngoài ra, một số thử nghiệm lâm sàng đối với lenzilumab đã được đăng ký để điều trị COVID-19 nghiêm trọng (NCT04351152, NCT04583969, NCT04534725).
Các thử nghiệm lâm sàng này cho thấy việc phong tỏa tín hiệu GM-CSF thực sự đã cải thiện kết quả lâm sàng ở bệnh nhân COVID-CS. Hơn nữa, một số chất ức chế GM-CSF khác như gimsilumab, otilimab và TJ003234 đang được đánh giá lâm sàng như liệu pháp COVID-19 tiềm năng (NCT04351243, NCT04376684, NCT04341116, tương ứng).
Phong tỏa các con đường tín hiệu
Phong tỏa tín hiệu jak/stat
Con đường JAK/STAT nằm ở hạ lưu của các cytokine khác nhau liên quan đến CS. Do đó, một số nghiên cứu đã đề xuất rằng ức chế tín hiệu JAK/STAT có thể là một lựa chọn phòng ngừa hoặc điều trị có giá trị đối với COVID-CS.126,300-305 Hiệu quả lâm sàng của các chất ức chế JAK khác nhau (JAKinibs) như tofacitinib nhắm mục tiêu JAK1 và JAK3 306,307 cũng như baricitinib và ruxolitinib, cả hai nhắm mục tiêu JAK1 và JAK2, 308-310 hiện đang được điều tra trong các thử nghiệm lâm sàng trong bối cảnh COVID-19.
Hoang và cộng sự 311 nhận thấy rằng điều trị baricitinib đã cải thiện đáng kể tình trạng viêm ở khỉ rhesus bị nhiễm SARS-CoV-2, biểu hiện bằng cách giảm thâm nhiễm tế bào viêm và tuyển dụng bạch cầu đa nhân trung tính; bệnh lý phổi hạn chế; và ức chế biểu hiện của chất trung gian gây viêm trong đại thực bào phổi. Baricitinib cũng đã được đánh giá trong một loạt các thử nghiệm lâm sàng. Một thử nghiệm quan sát theo chiều dọc bao gồm 76 bệnh nhân COVID-19 cho thấy rằng so với nhóm chứng (n = 56), bệnh nhân trong nhóm baricitinib (n = 20) cho thấy nồng độ IL-6, IL-1β và TNF trong huyết thanh giảm đáng kể. -α; tăng tốc phục hồi số lượng tế bào T và B trong máu; tăng sản xuất kháng thể chống lại SARS-CoV-2; và tăng dần tỷ lệ PaO2/FiO2 (NCT04438629).109 Một nghiên cứu thuần tập quan sát khác từ Tây Ban Nha cho thấy baricitinib cải thiện chức năng phổi ở những bệnh nhân bị COVID-19 mức độ trung bình đến nặng được điều trị bằng corticosteroid.312 Thật thú vị, các nghiên cứu hiện có cho thấy rằng bên cạnh các tác dụng ức chế được thừa nhận trên CS, baricitinib cũng có thể làm giảm quá trình nội bào tử SARS-CoV-2 qua trung gian ACE2 bằng cách ức chế protein kinase 1 liên kết với AP2 và kinase liên kết với cyclin G, 313,314, đóng vai trò như một cơ chế hoạt động khác của nó trong COVID-19. Hơn nữa, một số báo cáo khác cũng đã được công bố, 313,315322 và nhiều thử nghiệm lâm sàng về baricitinib đã được đăng ký tại ClinicalTrials.gov để đánh giá tác dụng lâm sàng của nó trong COVID-19 nghiêm trọng.
Một số nghiên cứu đã chỉ ra rằng ruxolitinib cũng có thể có hiệu quả trong điều trị COVID-19 nặng/nguy kịch.323-326 Trong một thử nghiệm lâm sàng giai đoạn 2, đa trung tâm, mù đơn, bao gồm 41 bệnh nhân COVID-19 từ Vũ Hán, Trung Quốc, so với các bệnh nhân trong nhóm giả dược (n = 21), những người trong nhóm ruxolitinib (n = 20) biểu hiện mức độ giảm đáng kể của bảy cytokine, cũng như tốc độ cải thiện lâm sàng và phục hồi số lượng tế bào lympho nhanh hơn.325 Ngoài ra, một số lâm sàng khác các thử nghiệm để đánh giá ruxolitinib và sáu thử nghiệm lâm sàng đánh giá việc sử dụng tofacitinib ở bệnh nhân COVID-19 đã được đăng ký tại ClinicalTrial.gov (NCT04412252, NCT04415151, NCT04750317, NCT04469114, NCT04390061, NCT04332042).
Bất chấp những dữ liệu lâm sàng đầy hứa hẹn này, JAKinibs nên được sử dụng thận trọng vì các tác dụng phụ của chúng, dựa trên những cân nhắc sau: (1) sự ức chế không chọn lọc con đường JAK/STAT làm tăng nguy cơ nhiễm trùng thứ cấp chẳng hạn như sự tái hoạt của virus herpes zoster. Các tác động ức chế trên nhiều khía cạnh của các hoạt động sinh lý, bao gồm cả hệ thống miễn dịch bẩm sinh. dẫn đến kết quả kém trong COVID-19. Do đó, một số thử nghiệm lâm sàng hồi cứu đã được tiến hành để giải quyết những lo ngại này; 329334 (2) COVID-19 quan trọng thường đi kèm với rối loạn đông máu và huyết khối, và Cục Quản lý Thực phẩm và Dược phẩm đã cảnh báo rằng việc sử dụng một số JAKinib đã làm tăng nguy cơ hình thành huyết khối. 335 Do đó, phát triển các JAKinib với độ đặc hiệu tốt hơn có thể là một hướng nghiên cứu trong tương lai nhằm ngăn ngừa/giảm thiểu bệnh CS và cải thiện sự sống còn của bệnh nhân COVID19.
Phong tỏa tín hiệu nf-κb
Sự biểu hiện áp đảo của nhiều protein gây viêm trong COVID-CS đã chỉ ra vai trò trung tâm của các con đường tín hiệu tiền viêm, và cụ thể là con đường NF-κB. Điều hòa miễn dịch kích hoạt NF-κB đã được chứng minh là có hiệu quả ở các tế bào hoặc chuột bị nhiễm SARS-CoV.146 Do đó, các đánh giá gần đây đã đề xuất rằng con đường NF-κB đại diện cho một mục tiêu điều trị tiềm năng đối với bệnh nặng do COVID-19.336-338
Một nghiên cứu trong ống nghiệm cho thấy rằng phillyrin (KD-1), một chất chống viêm và chống oxy hóa đã được nghiên cứu kỹ lưỡng, làm giảm đáng kể sự sao chép của SARS-CoV-2 và sự biểu hiện của các yếu tố gây viêm trong tế bào Huh-7 thông qua việc ức chế Con đường tín hiệu NFκB.339 Một nghiên cứu khác cho thấy rằng một dẫn xuất pyrazole mới làm giảm đáng kể sự biểu hiện của IL-6, TNFα và IL-1β trong các tế bào RAW267.4 được LPS kích thích bằng cách ức chế sự kích hoạt con đường tín hiệu NF-κB.340 Nó có được gợi ý rằng việc ngăn chặn quá trình phosphoryl hóa chất ức chế tiểu đơn vị NF-κB kinase beta, một protein hạ nguồn chính của tín hiệu NF-κB, với các chất ức chế dược lý có thể là một cách tiếp cận hiệu quả để điều trị COVID-CS.339 Hơn nữa, viên nang Liu Shen, một thuốc cổ truyền Trung Quốc, cũng được báo cáo là có tác dụng chống vi rút và chống viêm ở các tế bào Huh-7 và Vero E6 bị nhiễm SARS- CoV-2, tương ứng bằng cách ức chế dòng thác tín hiệu NF-κB.341 Tác dụng của một số thuốc chống viêm hoặc thuốc chống vi rút trên COVID-19 như dexamethasone, 342 hydroxychloroquine, 343 kháng sinh macrolide, 344,345 và N-acetylcysteine346,347 cũng liên quan đến ức chế thác NF-κB.
Bất chấp sự tồn tại của nhiều tác nhân không chọn lọc khác nhau để ức chế NF-κB, việc phát triển các chất ức chế NF-κB có chọn lọc và một loạt các thử nghiệm lâm sàng là cần thiết để xác nhận thêm các lợi ích lâm sàng.
Phong tỏa tín hiệu nlrp3
Một số nghiên cứu đã chỉ ra rằng thể viêm NLRP3 là một mục tiêu điều trị tiềm năng cho COVID-CS.164,348,349
Sự ức chế tín hiệu NLRP3 có thể là một cơ chế hoạt động tiềm tàng của một số loại thuốc chống viêm hiệu quả trong COVID-19, chẳng hạn như colchicine. Các nghiên cứu đã chỉ ra rằng colchicine có thể ức chế không chọn lọc phản ứng viêm NLRP3 bằng cách ức chế sự hoạt hóa của thụ thể P2X7 hoặc sự tương tác giữa protein NLRP3 và ASC.350,351 Ngoài ra, chloroquine352 và curcumin353 cũng có khả năng ức chế tín hiệu NLRP3. Một số tác nhân nghiên cứu có khả năng ức chế sự hoạt hóa NLRP3, chẳng hạn như tranilast, 354 dapansutrile (OLT1177, chất ức chế chọn lọc), 354 và dẫn xuất thiazolo-alkenyl sulfonylurea 7.355 cũng đang được xem xét để điều trị COVID-CS theo đánh giá của Freeman và Swartz.164 Ngoài ra, Một số tác nhân không chọn lọc hoặc có chọn lọc chống lại bệnh viêm nhiễm NLRP3 bao gồm melatonin (NCT04409522), OLT1177 (NCT04540120), chiết xuất quả cọ açai (Euterpe oleracea) (NCT04404218) và ZYIL1 (chất ức chế chọn lọc) (NCT04731324) đang được điều tra.
Các can thiệp nhắm mục tiêu đến nhiều cytokine và con đường
Liệu pháp globulin miễn dịch tiêm tĩnh mạch (ivig)
IVIg là một nhóm globulin miễn dịch tự nhiên với mạng lưới kháng thể đa dạng cao và được sử dụng để chồng lên cơ thể mất cân bằng của bệnh nhân do nhiễm trùng.356 Người ta đã biết từ lâu rằng một loạt các tự kháng thể tự nhiên chống cytokine như kháng thể chống lại IL- 1, IL-6 và IFN-γ có thể được phát hiện trong IVIg của những người khỏe mạnh.357-360 Mặc dù cách các tự kháng thể được tạo ra vẫn còn chưa được hiểu rõ, nhưng người ta đã chứng minh rằng nhiều tự kháng thể kháng cytokine là kháng thể trung hòa và có thể chịu trách nhiệm về tác dụng chống viêm của IVIg trong các rối loạn viêm và tự miễn dịch.
Hiệu quả tiềm năng của liệu pháp IVIg đã được báo cáo trong SARS và đại dịch cúm H1N1 2009.361,362 Trong một thử nghiệm ngẫu nhiên, có đối chứng bao gồm 84 bệnh nhân COVID-19, điều trị IVIg không cho thấy bất kỳ lợi ích điều trị nào trong các trường hợp nặng; tuy nhiên, mối quan hệ tích cực đáng kể giữa số ngày kể từ khi nhập viện điều trị IVIg và thời gian nằm viện đã được quan sát, 363 cho thấy lợi ích lâm sàng tiềm năng của việc sử dụng IVIg trong giai đoạn đầu của COVID-19.
Ngược lại, Suzuki et al.364 đã báo cáo hiệu quả tiềm năng của việc dùng IVIg cùng với thở máy, methylprednisolone, favipiravir, ivermectin và liệu pháp tocilizumab trong giai đoạn muộn ở bệnh nhân cao tuổi bị COVID-19 nặng.
Nhìn chung, các nghiên cứu này không nhất quán về thời gian dùng IVIg, tức là giai đoạn sớm so với giai đoạn muộn; do đó, một số lượng lớn hơn các thử nghiệm lâm sàng được đảm bảo.
Điều trị corticosteroid
Corticosteroid là một trong những loại thuốc chống viêm được sử dụng phổ biến trong điều trị nhiều chứng rối loạn viêm. Chúng có tác dụng điều hòa miễn dịch bằng cách ức chế sự biểu hiện của nhiều cytokine tiền viêm và kích hoạt các tế bào miễn dịch khác nhau. Vào đầu năm 2020, điều trị bằng corticosteroid trong COVID-19 bị chống chỉ định hoặc không được khuyến cáo, 365 vì tuyên bố rằng không có dữ liệu lâm sàng nào cho thấy lợi ích của việc điều trị bằng corticosteroid. Hơn nữa, nó thậm chí còn làm tăng tỷ lệ tử vong và tỷ lệ nhiễm trùng thứ phát ở SARS-CoV và MERS-CoV.366 Vào tháng 3 năm 2020, thử nghiệm PHỤC HỒI, một trong những thử nghiệm ngẫu nhiên, có đối chứng lớn nhất đối với phương pháp điều trị COVID-19 bao gồm ~ 15% tổng số COVID nhập viện -19 bệnh nhân ở Anh, đã được đưa ra. Nhóm dexamethasone thu nhận 2104 bệnh nhân nhận liều dexamethasone từ thấp đến trung bình là 6 mg mỗi ngày trong 10 ngày và nhóm đối chứng bao gồm 4321 bệnh nhân được chăm sóc tiêu chuẩn. So với nhóm chứng, điều trị bằng dexamethasone làm giảm 1/3 tỷ lệ tử vong trong 28 ngày ở bệnh nhân thở máy và 1/5 ở bệnh nhân chỉ được thở oxy, nhưng không giảm ở bệnh nhân không cần hỗ trợ thở máy.367 Do đó, chính phủ Anh (https://www.gov.uk/go Government/news/ world-first-coronavirus-treatment-approved-fornhs-use-by-go Government/) và Viện Y tế Quốc gia Hoa Kỳ (https:// /www.covid19treatment guidelines.nih.gov/dexamethasone/) đã cho phép sử dụng dexamethasone tiêu chuẩn ở những bệnh nhân COVID-19 nhập viện cần thở oxy. Ngoài ra, một phân tích tổng hợp của bảy thử nghiệm lâm sàng cho thấy điều trị bằng corticosteroid có liên quan đến tỷ lệ tử vong do mọi nguyên nhân trong 28 ngày thấp hơn ở bệnh nhân COVID-19 bị bệnh nặng.225
Nói chung, lợi ích lâm sàng của glucocorticoid trong điều trị COVID-19 dựa trên việc lựa chọn đúng liều lượng, đúng bệnh nhân và thời điểm thích hợp. Một số nghiên cứu đã chỉ ra động thái thời gian của sự phát triển virus trong SARS-CoV-2.368370 Sau các đỉnh sao chép, các yếu tố bệnh lý miễn dịch có thể đóng vai trò chủ đạo trong bệnh, trong khi sự sao chép tích cực của virus có thể đóng vai trò thứ yếu. Do đó, tải lượng virus có thể là một chỉ số để xác định chính xác thời điểm điều trị bằng glucocorticoid. Hơn nữa, trái ngược với các tác nhân khác, dexamethasone có sẵn trên toàn thế giới với chi phí thấp, điều này có lợi ở các nước đang phát triển với khả năng tiếp cận chăm sóc sức khỏe hạn chế. Tuy nhiên, mặc dù corticosteroid cải thiện các hội chứng lâm sàng ở bệnh nhân COVID-19 bị bệnh nặng, tác động của nó đối với CS vẫn chưa rõ ràng và cần được điều tra thêm.
Điều trị y học cổ truyền trung quốc (tcm)
Các nghiên cứu trước đây đã báo cáo tác dụng điều trị của một số bệnh TCM như Lizhong Decoction, 371 Liujunzi Decoction, 372 và Huanglian Jiedu Decoction373 đối với các bệnh viêm nhiễm. Gần đây, phương pháp điều trị TCM cũng đã cho thấy hiệu quả đối với COVID-19 và góp phần đáng kể vào việc kiểm soát đại dịch ở Trung Quốc. Ví dụ, một thử nghiệm đa trung tâm, ngẫu nhiên, có đối chứng của nhóm nghiên cứu Nanshan Zhong ’cho thấy viên nang Lianhuaqingwen, một loại thảo mộc Trung Quốc tái sử dụng, có thể cải thiện các triệu chứng lâm sàng và rút ngắn thời gian phục hồi ở bệnh nhân COVID-19 mà không có tác dụng phụ nghiêm trọng.374
Một số bệnh TCM có thể đóng vai trò ức chế miễn dịch để điều trị CS thông qua nhiều cytokine hoặc con đường liên quan đến CS. Yang và cộng sự.375 đã chỉ ra rằng Qingfei Paidu Decoction, một trong những công thức chống COVID-19 nổi tiếng nhất, có thể bảo vệ chống lại COVID-19 bằng cách điều chỉnh nhiều con đường tín hiệu liên quan đến CS như con đường NF-κB và MAPK và cytokine chẳng hạn như TNF-α, IL-1β và IL-8. Ngoài ra, Dai et al.376 đã thực hiện một nghiên cứu phiên mã quy mô lớn để đánh giá tác dụng của 578 loại thảo mộc và tất cả 338 công thức kháng COVID-19 TCM được báo cáo về tín hiệu liên quan đến CS, bằng cách kết hợp xét nghiệm sàng lọc dựa trên giải trình tự thông lượng cao với tin sinh học và thiết kế thuốc có sự hỗ trợ của máy tính. Kết quả cho thấy một số loại thảo mộc có thể ức chế con đường IL-6, một số, con đường TNF-α, và một số loại thuốc như Guizhi và Qingfei Paidu Decoction có thể ức chế cả hai con đường. Cùng với nhau, các nghiên cứu này cung cấp bằng chứng khoa học cho việc quản lý bệnh TCM trong COVID-CS.
Phong tỏa kinase 7 phụ thuộc cyclin (cdk7)
Rất khó để ngăn chặn các cytokine riêng lẻ để đạt được lợi ích lâm sàng mong muốn do tín hiệu cytokine bị nhiễu tương tác phức tạp trong quá trình CS.377 Do đó, việc phát triển các chiến lược chống viêm với tác dụng ức chế phổ rộng là cần thiết.
CDK7 có thể điều chỉnh chu kỳ tế bào và phiên mã gen.378 Các nghiên cứu trước đây đã chỉ ra rằng sự phong tỏa của CDK7 điều khiển quá trình phân giải viêm bằng cách tái tạo lại khả năng miễn dịch kháng khối u378 và điều chỉnh sự bài tiết cytokine.379 Một nghiên cứu gần đây của Wei và cộng sự đã chỉ ra rằng chất ức chế phân tử nhỏ, THZ1, qua trung gian sự phong tỏa của CDK7 và do đó làm giảm các trạng thái quá viêm và CRS do liệu pháp tế bào T CAR gây ra. Về mặt cơ học, khi CDK7 bị THZ1 chặn, các gen gây viêm khác nhau, đặc biệt là STAT1 và IL1 được điều chỉnh bởi các chất siêu tăng cường CDK7/RNA Pol II, sẽ bị ức chế ưu tiên ở cấp độ phiên mã. Điều này cho thấy rằng việc phong tỏa CDK7 có thể là một chiến lược đầy hứa hẹn để điều trị CRS. Xem xét các cấu hình cytokine tương tự giữa COVID-CS và CRS, chúng ta có thể giả thuyết rằng chiến lược này cũng có thể hoạt động trong COVID-CS.
Kết luận
Các nghiên cứu lâm sàng và nghiên cứu cơ bản đã xác định và đặc trưng cho COVID-CS, điều này đã nâng cao hiểu biết của chúng ta về CS và các bệnh lý miễn dịch liên quan trong COVID-19. Một kịch bản đầy đủ về COVID-CS hiện đang xuất hiện và nó có vẻ có quy mô lớn hơn nhiều và chứa nhiều cytokine hơn so với CS được công nhận trong các điều kiện khác, và do đó cũng gây hại nhiều hơn. Mặc dù vẫn chưa rõ bằng cách nào virus biến cấu trúc cytokine bảo vệ thành CS gây viêm, các cytokine dường như được tạo ra chủ yếu bởi các tế bào bẩm sinh vì tình trạng này thường được báo cáo về tình trạng giảm bạch cầu lympho. Mặc dù hiệu quả gây bệnh của từng cytokine đối với sự phát triển của một số thông số miễn dịch gây bệnh trong tình trạng này vẫn chưa được hiểu đầy đủ; Rõ ràng là COVID-CS nói chung có liên quan chặt chẽ với những thay đổi gây bệnh chính của COVID-19. Để điều trị COVID-CS, một số can thiệp sinh học nhắm mục tiêu cụ thể vào các cytokine gây viêm hoặc các con đường tín hiệu liên quan đã được đánh giá lâm sàng với kết quả đầy hứa hẹn và nhiều biện pháp khác đang được triển khai.
Về nguyên tắc, chiến lược điều trị phải là kiểm soát hoạt động hoặc sản xuất cytokine gây viêm đang diễn ra và tiếp tục cân bằng nội môi của vật chủ. Tuy nhiên, chúng ta vẫn còn thiếu các loại thuốc an toàn và hiệu quả để kiểm soát bệnh CS, và trên lâm sàng, việc điều trị CS gặp nhiều khó khăn vì một số lý do: (1) nhiều y bác sĩ không biết về tình trạng bệnh và do đó, các hướng dẫn chẩn đoán và điều trị lâm sàng không được thực hiện. hiện đang thiếu; (2) việc nhắm mục tiêu đồng thời nhiều cytokine là một thách thức đối với dược phẩm. Do đó, điều quan trọng là phải xác định và nhắm mục tiêu các cytokine quan trọng ngược dòng và mạng lưới cảm ứng cytokine, hoặc nhắm mục tiêu trực tiếp vào các tế bào sản xuất cytokine chiếm ưu thế như bạch cầu đơn nhân và đại thực bào. Ngoài ra, học hỏi từ hệ thống điều hòa miễn dịch chủ và xác định yếu tố/cytokine chống viêm hiệu quả hơn và an toàn hơn với tác dụng ức chế phổ rộng có thể cung cấp một lựa chọn tốt hơn cho can thiệp điều trị; IL-37 đã được đề xuất cho mục đích này; 381-384 (3) rất khó để cân bằng giữa CS và miễn dịch bảo vệ trong các bệnh truyền nhiễm, vì mức độ thích hợp của các cytokine gây viêm có tác dụng bảo vệ chống lại nhiễm trùng và việc nhắm mục tiêu không thích hợp các cytokine gây viêm có thể dẫn đến suy giảm miễn dịch mắc phải và sau đó nhiễm trùng; (4) sự khác biệt giữa các cá nhân về tuổi tác, tình trạng miễn dịch và các bệnh đi kèm khác có thể dẫn đến sự khác biệt ảo về thành phần và quy mô của CS và điều trị. Do đó, cần phải điều trị chính xác. Lưu ý, việc nhắm mục tiêu lý tưởng vào các cytokine hoặc con đường phân tử chiếm ưu thế trong một tình trạng CS cụ thể nên được tiến hành trước và kịp thời.
COVID-19 đã dạy cho chúng ta một bài học quan trọng về cách đối phó với những kẻ thù gây bệnh tự nhiên. Kiến thức và các lựa chọn điều trị được phát triển từ COVID-CS sẽ là vô giá, không chỉ đối với bệnh này mà còn đối với các tình trạng CS khác.