Có 4 loại antithrombin được mô tả [I-IV], việc thiết kế AT từ I đến IV xuất phát từ những nghiên cứu ban đầu thực hiện những năm 1950 bởi Seeger, Johnson và Fell. ATI liên quan đến việc chú ý vào sự thu hút thrombin tới fibrin sau khi thrombin chuyển fibrinogen thành fibrin. ATII liên quan đến hoạt tính cofactor trong huyết tương, cùng với heparin tác động lên mối tương tác thrombin và fibrinogen. ATIII liên quan đến một chất trong huyết tương làm bất hoạt thrombin.
ATIV liên quan đến một antithrombin được hoạt hóa trong và một thời gian ngắn sau khi đông máu. Chỉ có ATIII và có lẽ ATI là có ý nghĩa y học. ATIII được thương mại dưới tên gọi AT.
Một thời gian ủ ngắn trong xét nghiệm cofactor heparin làm mẫu nhạy với những biến đổi trong việc gắn heparin trong khi đó một thời gian ủ dài hơn làm xét nghiệm trở nên kém nhạy.
Xét nghiệm Antithrombin tiến triển (Progressive AT Assay) tương tự xét nghiệm tạo màu nhưng test này không chứa bất kỳ heparin nào. Test đòi hỏi thời gian ủ nhiều phút và vì vậy, sự ức chế cơ chất có thể xảy ra không chỉ do antithrombin mà còn do những protease khác hiện diện trong huyết tương. Việc sử dụng heparin trong xét nghiệm này làm tăng hoạt tính của antithrombin lên hàng nghìn lần và làm test này chỉ nhạy với antithrombin.
Bovine FXa được dùng như là cơ chất để nổ lực cải thiện sự phân biệt giữa bất thường và bình thường trong trường hợp mức hoạt tính antithrombin gần hoặc ở giới hạn trên bình thường.
Đột biến type I, đột biến tác động lên vị trí hoạt hóa (RS) và đột biến đa hướng (PL) liên kết với nguy cơ cao huyết khối tĩnh mạch hơn là đột biến ảnh hưởng lên vị trí gắn của heparin (HBS)
Cho đến ngày nay, đột biến mất hoàn toàn antithrombin chưa được báo cáo, và có lẽ dạng này không thể sống được. Đột biến đồng hợp tử đã được báo cáo nhưng chỉ liên kết với khiếm khuyết vị trí hắn heparin và có xu hướng tăng đông nhẹ.
Mức antithrombin giảm nhanh trong sepsis và cũng ở bệnh nhân điều trị asparaginase.
Giới thiệu
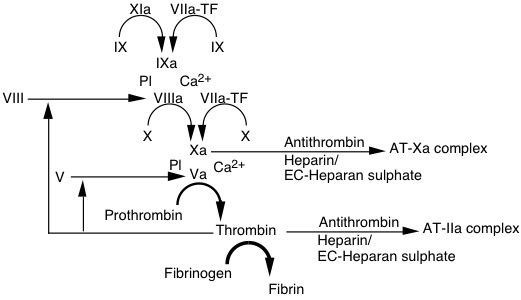
Antithrombin (AT) là một chất chống đông tự nhiên đóng vai trò quan trọng trong hemostasis thông qua việc ức chế các serine protease gồm thrombin (IIa), FXa và một phần các yếu tố IXa, XIa.
Khiếm khuyết di truyền antithrombin liên kết với tăng nguy cơ huyết khối thuyên tắc tĩnh mạch (VTE) và có thể gặp ở 1-2% bệnh nhân VTE so với 0.02-0.2% ở dân số chung. Khiếm khuyết antithrombin di truyền có thể gặp ở dân số chung với tỷ lệ trong khoảng
0.2/1000 đến 0.5/1000
Antithrombin được tổng hợp chủ yếu ở gan, lưu hành trong huyết tương dạng chuỗi đơn 432 amino acid với trọng lượng 58200 Dalton. Mức bình thường trong huyết tương là 150 µg/ml và thời gian bán hủy là khoảng 3 ngày.
Gene mã hóa AT là [SERPINC1] nằm trên NST số 1 và nhiều loại đột biến đã được xác định ở người suy giảm antithrombin và huyết khối tĩnh mạch.
AT có thể được xác định bằng cả phương pháp miễn dịch (định lượng) và chức năng (định tính), và dựa trên cơ sở những xét nghiệm này, suy giảm AT được phân loại:
|
Type |
Giải thích |
|
Type I |
Biến đổi số lượng – Suy giảm type I liên kết với sự suy giảm đồng thời cả xét nghiệm miễn dịch và chức năng, xấp xỉ 50% người bình thường. |
|
Type II |
Biến đổi chất lượng – Suy giảm type II liên kết với suy giảm xét nghiệm chức năng hơn là xét nghiệm miễn dịch. |
|
Type II HBS (Heparin Binding Site): Đột biến tác động lên vị trí gắn hepatin của thrombin |
|
|
Type II RS (Reactive Site): Đột biến vị trí hoạt hóa của AT |
|
|
Type II PL (Pleiotropic): Đột biến tác động lên cả vị trí gắn heparin và vị trí hoạt hóa của phân tử. |
|
Nguyên lý và phương pháp
Xét nghiệm chức năng AT dựa trên nguyên lý ức chế FIIa và FXa khi có mặt heparin. Hoạt tính chống FIIa và FXa của AT có thể được đo bằng phương pháp cục máu đông hoặc phương pháp tạo màu. Phương pháp tạo màu được sử dụng phổ biến hơn vì sự tiện lợi của nó.
Phương pháp tạo màu (chromogenic)
3 xét nghiệm AT dựa vào sự ức chế FIIa bò, FXa người, FIIa người đều đã có và sử dụng cùng một nguyên lý giống nhau. Huyết tương được ủ với một lượng dư cơ chất trong sự hiện diện của heparin. Heparin gắn và gây ra sự thay đổi cấu dạng của AT, làm tăng hoạt tính của AT một cách đáng kể. Một cơ chất tạo màu đặc hiệu với protease (như FIIa) được cho vào và lượng dư của protease gây ra việc cắt cơ chất làm thay đổi màu. Phổ hấp thụ được đo tại 405nm tỷ lệ nghịch với nồng độ hoạt tính AT trong huyết tương.
|
Cơ chất |
Nguyên lý |
|
Human IIa |
Huyết tương pha loãng với nước muối trong sự có mặt của heparin, ủ 90 giây với lượng dư human IIa tạo thành phức hợp AT-ThrombinHeparin. Lượng human IIa dư sẽ cắt và giải phóng p-nitroanaline (pNa) từ cơ chất tạo màu. Phổ hấp thụ được đo tại 405nm tỷ lệ nghịch với nồng độ hoạt tính AT trong huyết tương. |
|
Bovine IIa |
Huyết tương được pha loãng và ủ 30 giây với dung dịch đệm chứa bovine IIa dư và heparin sulfate. Hoạt tính bovine IIa dư được đo bằng cơ chất tạo màu nhạy với IIa. Phổ hấp thụ được đo tại 405nm tỷ lệ nghịch với nồng độ hoạt tính AT trong huyết tương. |
|
Bovine FXa |
Huyết tương được pha loãng và ủ 90 giây với lượng dư bovine Xa trong sự có mặt của heparin sulfate. FXa dư được đo bởi tỷ lệ thủy phân cơ chất tạo màu S-2765. pNa giải phóng ra được đo tại 405nm và tỷ lệ nghịch với mức hoạt tính AT trong mẫu. |
Xét nghiệm miễn dịch
|
Test |
Nguyên lý |
|
Xét nghiệm ELISA |
AT:Ag chủ yếu được đo bằng ELISA. Các giếng được phủ với kháng thể anti-AT đa dòng. Pha loãng huyết tương bệnh nhân, huyết tương chứng và hỗn hợp huyết tương bình thường để xây dựng đường chuẩn; cho vào dĩa và ủ ở nhiệt độ phòng. Sau một số chu kỳ rửa, cho kháng thể anti-AT gắn horse radish peroxidase vào. Cơ chất của horse radish peroxidase được thêm vào và phổ hấp thụ được đo tại 490nm. Dựa vào đường cong tham chiếu để suy ra mức AT. |
|
Điện di miễn dịch Laurell |
Trong lịch sử, AT (và nhiều protein khác) được đo bằng điện di miễn dịch [EIA], còn được gọi là “những viên đá của Laurell”. Hiện không còn dùng, bạn đọc quan tâm có thể đọc thêm ở phần tài liệu tham khảo. |
Phân tích
Có một sự khác biệt rõ ràng về khả năng của các xét nghiệm AT trong việc xác định tất cả các biến thể của AT. Bovine FVIIa là xét nghiệm nhạy nhất và với thời gian ủ ngắn, xét nghiệm này có thể xác định được tất cả những biến đổi trong AT kể cả thay đổi vị trí gắn heparin. Ngược lại, human FIIa và bovine FXa có thể không xác định được một số lớn các biến đổi quan trọng trong lâm sàng. Sự khác nhau về độ nhạy của 3 xét nghiệm phản ánh khiếm khuyết phân tử bên dưới, sự hiện diện của các chất ức chế serine protease hoặc những biến đổi về thời gian ủ trong xét nghiệm.
Khoảng tham chiếu
Trẻ sơ sinh có mức AT thấp lúc sinh (30-50% mức người lớn) nhưng chúng có thể tăng lên gần 60% (tương ứng mức người lớn) 1 tháng sau sinh.
Đề nghị xét nghiệm nào tiếp?
Những người có AT thấp, rất quan trọng xác định liệu do type I hay type II và liệu nó ảnh hưởng lên vị trí gắn heparine (HBS), vị trí hoạt hóa (RS) hay cả 2 (PL). Điều này có thể thực hiện bằng việc giải trình tự gene [SERPINC1]
Tài liệu tham khảo
Tait, R.C., Walker, I.D., Perry, D.J., Islam, S.I.A.M., Daly, M.E., McCall, F., Conkie, J.A. & Carrell, R.W. (1994) Prevalence of antithrombin III deficiency in the healthypopulation. British Journal Of Haematology, 87, 106-112.
Perry, D.J. (1994) Antithrombin and its Inherited Deficiencies. Blood Reviews, 8, 37-55.
Olds, R.J., Lane, D.A. & Thein, S.L. (1994) The Molecular Genetics of Antithrombin Deficiency. Br J Haem, 87, 221-226.
Chowdhury, V., Lane, D.A., Mille, B., Auberger, K., Gandenberger, B.S., Pabinger, I., Olds, R.J. & Thein, S.L. (1994) Homozygous antithrombin deficiency: report of two new cases (99 Leu to Phe) associated with arterial and venous thrombosis. [Review]. Thrombosis & Haemostasis, 72, 198-202.
Bruce, D., Perry, D.J., Borg, J.Y., Carrell, R.W. & Wardell, M.R. (1994) Thromboembolic disease due to thermolabile conformational changes of antithrombin Rouen-VI (187 Asn–>Asp). Journal Of Clinical Investigation, 94, 2265-2274.
Mourey, L., Samama, J.-P., Delarue, M., Petitou, M., Choay, J. & Moras, D. (1993) Crystal Structure of Cleaved Bovine Antithrombin III at 3.2Å Resolution. Journal of Molecular Biology, 232, 223-241.
Lane, D.A., Olds, R.J., Conard, J., Boisclair, M., Bock, S.C., Hultin, M., Abildgaard, A., Ireland, H., Thompson, E., Sas, G., Horellou, M.H., Tamponi, G. & Thein, S.-L. (1993) Pleiotropic Effects of Antithrombin Strand 1C Substitution Mutations. Journal Of Clinical Investigation, 90, 2422-2433.
Lane, D.A., Olds, R.J., Boisclair, V., Chowdhury, V., Thein, S.L., Cooper, D.N., Blajchman, M., Perry, D.J., Emmerich, J. & Aiach, M. (1993) Antithrombin III Mutation Database: First Update. Thrombosis And Haemostasis, 70, 361-369.
Laurell, C.B. (1965) Antigen-Antibody crossed electrophoresis. Analytical Biochemistry, 10, 358-361.
Laurell, C.B. (1966) Quantitative estimation of proteins by electrophoresis in agarose gel containing antibodies. Analytical Biochemistry, 15, 45-52.
Laurell, C.B. (1972) Electroimmunoassay. Scandinavian Journal of Clinical and Laboratory Investigation, 125, 21-37.
http://en.wikipedia.org/wiki/Antithrombin