Xét nghiệm Bethesda có thể làm tăng tỷ lệ dương giả ở nồng độ chất ức chế thấp [
Xét nghiệm Bethesda được thiết kế để đo những chất ức chế FVIII ở bệnh nhân haemophilia A. Tuy nhiên, nó được dùng để kiểm tra và báo cáo những chất ức chế liên kết với các yếu tố đông máu khác như FXI, FIX… Nguyên lý tương tự, mặc dù trong một số trường hợp, protein phản ứng ngay lập tức với chất ức chế nên không đòi hỏi thời gian ủ (như FIX)
Ở những bệnh nhân mà động học chất ức chế phức tạp như phổ biến hay gặp ở bệnh nhân có chất ức chế mắc phải (như chất ức chế FVIII mắc phải) – nồng độ chất ức chế tính được có thể tăng khi độ pha loãng tăng.
Sàng lọc chất ức chế VWF bằng phương pháp xác định chất ức chế cổ điển (trộn huyết tương bình thường và huyết tương test, sau đó đo mức VWF) là rất khó. Xét nghiệm chất ức chế theo kiểu Bethesda chuẩn thường xuyên thất bại trong việc xác định chất ức VWF. Xét nghiệm ELISA đã được giới thiệu để tìm kiếm chất ức chế VWF, nhưng lại một lần nữa không phải luôn luôn xác định được kháng thể. Tiền sử có thể rất quan trọng trong những trường hợp này, một tiền sử không ghi nhận những rối loạn chảy máu thường xuyên mãi cho tới gần đây. Thời gian bán hủy của VWF truyền vào cũng giảm đáng kể và xác nhận điều này rất có giá trị. Đo tỉ số VWF:pp/VWF:Ag có thể rất hữu ích.
Giới thiệu
Chất ức chế là những kháng thể mà trong hoạt động đông máu, đích nó chống lại thường là:
Những yếu tố đông máu đặc hiệu (như FVIII)
Phospholipid như LA (thật ra hầu hết LA chống lại trực tiếp phức hợp proteinphospholipid)
Một chất ức chế thường được nghi ngờ từ tiền sử hoặc xét nghiệm đông máu kéo dài không hiệu chỉnh lại được với mix test (50:50). Những chất ức chế phổ biến nhất là chống lại phospholipid – LA.
Những chất ức chế hoặc kháng đông lưu hành chống lại các yếu tố đông máu có thể hoặc phụ thuộc thời gian (như chất ức chế FVIII) hoặc phản ứng ngay lập tức (như chất ức chế FIX).
Nguyên lý và phương pháp
Xét nghiệm sàng lọc dựa vào aptt
Sàng lọc chất ức chế dựa vào APTT và liên quan đến việc đo APTT của mẫu huyết tương trước và sau khi nó được ủ 37 độ C. 3 ống được chuẩn bị như bảng bên dưới. Các ống này được ủ ở 37 độ C trong 120 phút và sau đó đặt trong nước đá để làm ngừng phản ứng. Ống thứ 4 được chuẩn bị từ một thể tích bằng nhau của ống 1 và ống 2, APTT được thực hiện ở cả 4 ống.
|
|
Ống 1 |
Ống 2 |
Ống 3 |
|
|
Huyết tương bình thường |
Huyết tương test |
Huyết tương trộn (1:1) |
|
Bước 1 |
Ủ 37 độ C trong 120 phút |
Ủ 37 độ C trong 120 phút |
Ủ 37 độ C trong 120 phút |
|
Bước 2 |
Đặt mẫu vào nước đá |
Đặt mẫu vào nước đá |
Đặt mẫu vào nước đá |
|
Bước 3 |
Chuẩn bị một phần thể tích bằng nhau của huyết tương thường + huyết tương test chưa ủ (ống 4) |
||
|
Bước 4 |
Đo APTT ở ống 1, 2, 3 và 4. |
||
Giải thích kết quả của các APTT thu được từ 4 ống như sau:
|
Ống |
APTT |
|
|
|
|
1 [BT] |
BT |
BT |
BT |
BT |
|
2 [Test=T] |
BT |
Tăng = T |
T |
T |
|
3 [T+BT ủ] |
BT |
BT |
T |
T |
|
4 [T+BT chưa ủ] |
BT |
BT |
T |
BT |
|
Giải thích |
BT |
Suy giảm yếu tố |
Chất ức chế hoạt động tức thì |
Chất ức chế phụ thuộc thời gian |
Nên nhớ rằng, một xét nghiệm sàng lọc thì cần nhạy chứ không cần đặc hiệu. Vì vậy nó có thể xác định chất ức chế của tất cả yếu tố nhưng nó rất không đặc hiệu, tuy nhiên khi test sàng lọc dương tính, bạn có thể điều tra chi tiết hơn bằng xét nghiệm Bethesda.
Xét nghiệm định lượng: xét nghiệm bethesda
Xét nghiệm Bethesda được dùng một cách rộng rãi để định lượng nồng độ của chất ức chế FVIII.
1 đơn vị Bethesda (Bu) được định nghĩa là số lượng một chất ức chế cần để trung hòa 50%
1 đơn vị FVIII:C trong huyết tương bình thường sau 120 phút ủ ở 37 độ C. Chất ức chế FVIII là phụ thuộc thời gian trong khi những loại khác là phản ứng tức thì (như FIX) và vì vậy không đòi hỏi một bước ủ. Tuy nhiên, những nguyên lý cơ bản là giống nhau.
Vì chất ức chế FVIII là phụ thuộc thời gian, nếu FVIII ngoại sinh được thêm vào huyết tương và hỗn hợp được ủ, FVIII sẽ bị trung hòa tăng dần. Nếu số lượng FVIII được thêm vào và thời gian ủ được chuẩn hóa thì độ mạnh hoặc nồng độ của chất ức chế có thể đo được theo đơn vị là bao nhiêu FVIII thêm vào bị phá hủy. Xét nghiệm này có thể được thực hiện bằng cách sử dụng cả FVIII nguồn gốc từ người lẫn từ lợn (FVIII của lợn hiện không có sẵn, sản phẩm tái tổ hợp của nó đang được phát triển).
Hiệu chỉnh Nijmegen của xét nghiệm chất ức chế FVIII liên quan đến việc đệm huyết tương bình thường với 0.1M imidazole tại pH 7.4 và sử dụng huyết tương đã loại bỏ FVIII bằng phương pháp miễn dịch, để tạo thành hỗn hợp chứng. Ở hiệu giá chất ức chế thấp (
Xét nghiệm Bethesda:
Đơn vị Bethesda (Bu) được định nghĩa là lượng chất ức chế trong mẫu huyết tương có thể trung hòa 50% 1 đơn vị FVIII:C trong huyết tương bình thường sau khi ủ 2h ở 37 độ C.
Pha loãng gấp đôi huyết tương bệnh nhân (thường từ ½-1/1024) trong chất đệm Imidazole được ủ với một lượng thể tích bằng nhau với “huyết tương bình thường pool” tại 37 độ C.
Huyết tương bình thường pool sẽ chứa xấp xỉ 100UI/dl FVIII.
Một mẫu chứng bao gồm 1 thể tích bằng nhau huyết tương bình thường trộn với dung dịch đệm (hoặc trong hiệu chỉnh Nijmegen sẽ là huyết tương thiếu FVIII) được thực hiện để đại diện giá trị 100%. Hỗn hợp này thật sự có giá trị nồng độ FVIII ban đầu là 50% do pha trộn nhưng điều này không quan trọng vì cùng nguồn và thể tích được thêm vào để ủ tất cả hỗn hợp.
Vào cuối thời kỳ ủ, nồng độ FVIII còn lại được đo bằng phương pháp dựa vào APTT một giai đoạn, với mẫu chứng được lấy chuẩn 100%.
Nồng độ chất ức chế được tính từ đồ thị hoạt tính FVIII còn lại so với đơn vị chất ức chế. Độ pha loãng của huyết tương test mà tại đó nồng độ FVIII tồn dư gần 50% nhất, nhưng trong giới hạn 30-60% được chọn để tính chất ức chế. Cũng có thể tính nồng độ chất ức chế ở mỗi độ pha loãng, sau đó lấy trung bình. Bất cứ mức FVIII còn lại nào 75% đều không nên dùng để tính mức chất ức chế.
Nếu mức hoạt tính FVIII còn lại trong khoảng 80-100% thì mẫu không chưa chất ức chế.
Suy ra nồng độ chất ức chế từ biểu đồ và nhân với độ pha loãng để có nồng độ cuối cùng. Một huyết tương chứng dương tính với nồng độ chất ức chế đã biết nên có sẵn.
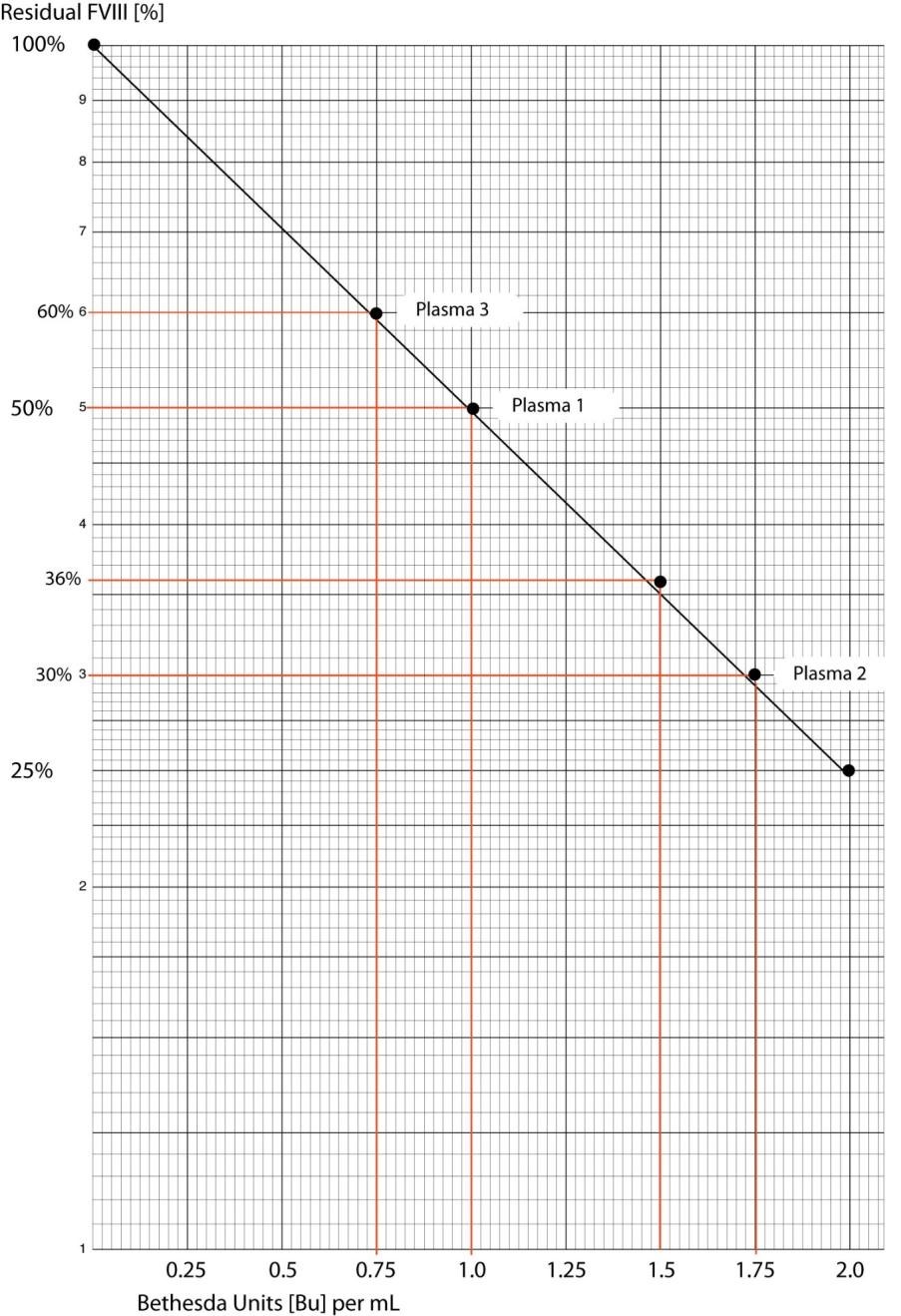
Nên nhớ rằng, khi biểu diễn mức hoạt tính FVIII còn lại so với nồng độ BU trên đồ thị thì trục Y là thang đo Log và trục X là thang tuyến tính. Mức hoạt tính FVIII còn lại được vẽ trên trục Y và nồng độ BU được vẽ trên trục X.
Trong bảng và đồ thị bên dưới, 4 mẫu huyết tương với những độ pha loãng khác nhau đã được xét nghiệm và nồng độ Bu được tính toán.
|
Mẫu huyết tương |
Độ pha loãng |
Hoạt tính FVIII còn lại |
Bu x Độ pha loãng |
Nồng độ Bu |
|
1 |
1:10 |
50% |
1 x 10 |
10 |
|
2 |
1:20 |
30% |
1.75 x 20 |
35 |
|
3 |
1:40 |
60% |
0.75 x 40 |
30 |
|
4 |
1:100 |
36% |
1.5 x 100 |
150 |
Phân tích kết quả
Xem ở trên.
Những chất ức chế yếu tố viii
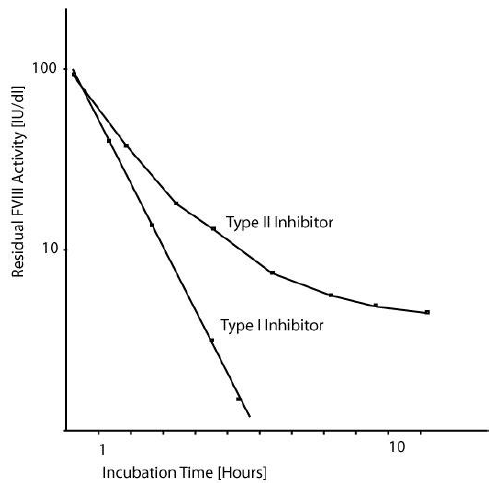
Những chất ức chế FVIII về phương diện cổ điển, được chia thành 2 type I hoặc II dựa vào động học của chất ức chế. Chất ức chế type I có động học ức chế theo dạng tuyến tính, và phụ thuộc vào cả thời gian và nồng độ (có mối quan hệ tuyến tính giữa logarithm FVIII:C còn lại và nồng độ kháng thể). Dị kháng thể hình thành từ những bệnh nhân haemophilia thể nặng trong đáp ứng với điều trị, cho thấy động học kiểu type I điển hình và ức chế hoàn toàn hoạt tính FVIII.
Ngược lại, chất ức chế type II cho thấy mô hình động học phức tạp hơn và thường thấy trong tự kháng thể hình thành ở haemophilia A mắc phải. Chất ức chế type II không thể nào bất hoạt hoàn toàn hoạt tính FVIII dù ở nồng độ tối đa (chưa pha loãng). Điều này giải thích tại sao một số bệnh nhân với một số lượng nhỏ chất ức chế FVIII (haemophilia A mắc phải) có thể xác định được.
|
Type |
Động học |
Ức chế FVIII |
Gặp trong: |
|
Type I |
Đơn giản – First Order |
Hoàn toàn |
Dị kháng thể xuất phát từ người haemophilia được điều trị với sản phẩm FVIII và sản sinh kháng thể chống lại protein ngoại lai. |
|
Type II |
Phức tạp – Second Order |
Không hoàn toàn |
Tự kháng thể – gặp trong haemophilia A mắc phải |
Đồ thị sau tóm tắt sự khác biệt giữa chất ức chế type I và type II:
Trong những trường hợp haemophilia biến chứng xuất hiện chất ức chế, hầu hết xuất hiện ở người thể nặng (như FVIII:C
Mức FVIII nền giảm => có sự thay đổi kiểu hình từ haemophilia nhẹ-vừa chuyển sang nặng.
Mức FVIII nền không giảm nhưng chất ức chế hiện diện. Những bệnh nhân như vậy duy trì kiểu hình nhẹ-vừa, nhưng khi điều trị với chế phẩm FVIII ngoại sinh thì FVIII ngoại sinh bị hủy nhanh chóng.
Đề nghị xét nghiệm nào tiếp?
Bảng sau cho một tóm tắt các gợi ý:
|
Yếu tố giảm |
|
|
||
|
FVIII |
Nếu suy giảm FVIII là mới phát hiện và không dự đoán trước thì mức von Willebrand và FV cần được kiểm tra. Điều này không cần thiết nếu FVIII suy giảm trong bối cảnh đã biết (như người đã biết Haemophilia A) Có một số hiếm trường hợp bệnh nhân suy giảm FVIII không tương hợp giữa mức FVIII đo bằng phương pháp 1 giai đoạn với phương pháp 2 giai đoạn hoặc so màu. Mức yếu tố cao hơn ở phương pháp 1 giai đoạn, nhưng kiểu hình chảy máu phù hợp với xét nghiệm FVIII bằng phương pháp 2 giai đoạn hoặc so màu hơn. Suy giảm FVIII mắc phải: một người khỏe mạnh có thể sinh tự kháng thể chống lại FVIII dẫn đến Haemophilia A mắc phải. Những tự kháng thể như vậy cũng có thể thấy ở những bệnh nhân với rối loạn miễn dịch như viêm khớp dạng thấp. Bạn cũng thấy FVIII giảm trong bệnh von Willebrand mắc phải FVIII là một protein pha cấp và có thể cao ở những người chịu stress vì bất kỳ lý do gì, bao gồm cả mang thai. Nồng đồ FVIII là thành phần quyết định chính của APTT và mức thấp sẽ gây kéo dài, ngược lại mức cao sẽ rút ngắn APTT. Ở phụ nữ có FVIII hoặc FIX thấp mà không có tiền căn gia đình, karyotype nên được kiểm tra (như xem xét hội chứng Turner) |
|
||
|
FIX |
FIX thấp trong haemophilia B Chất ức chế FIX mắc phải (tự kháng thể) hiếm gặp |
|
||
|
FX |
Nếu suy giảm FX nghi ngờ nhưng xét nghiệm dựa vào APTT không cho ra kết quả như mong đợi thì một kỹ thuật khác cần được sử dụng (dựa vào PT, so màu, miễn dịch) vì những đột biến gây nên suy giảm chỉ có thể xác định bởi những kỹ thuật nhất định. Chất ức chế FX hiếm gặp nhưng mức thấp FX có thể gặp ở một số bệnh nhân amyloidosis. |
|
||
|
FXI |
Suy giảm FXI là hiếm nhưng cao hơn đáng kể ở người gốc Do thái. Chủng tộc này có đột biến gene FII chiếm số lượng nhiều. |
|
||
|
|
Suy giảm bất kỳ yếu tố nào |
Xem xét: Sàng lọc gia đình Phân tích đột biến |
||
Tài liệu tham khảo
Goodeve, A.C., Williams, I., Bray, G.L. & Peake, I.R. (2000) Relationship between factor VIII mutation type and inhibitor development in a cohort of previously untreated patients treated with recombinant factor VIII (Recombinate). Recombinate PUP Study Group. Thromb Haemost, 83, 844-848.
Giles AR, Verbruggen B, Rivard GE, Teitel J, Walker I. A detailed comparison of the performance of the standard versus the Nijmegen modification of the Bethesda assay in detecting factor VIII:C inhibitors in the haemophilia A population of Canada. Association of Hemophilia Centre Directors of Canada. Factor VIII/IX Subcommittee of Scientific and Standardization Committee of International Society on Thrombosis and Haemostasis. Thromb Haemost. 1998 Apr;79(4):872-5.
Reber G, Aurousseau MH, Dreyfus M, Delahousse B, Caron C, Trzeciack MC, et al. Inter-laboratory variability of the measurement of low titer factor VIII:C inhibitor in haemophiliacs: improvement by the Nijmegen modification of the Bethesda assay and the use of common lyophilized plasmas. Haemophilia. 1999 Jul;5(4):292-3.
Verbruggen B, Giles A, Samis J, Verbeek K, Mensink E, Novakova I. The type of factor VIII deficient plasma used influences the performance of the Nijmegen modification of the Bethesda assay for factor VIII inhibitors. Thromb Haemost. 2001 Dec;86(6):1435-9.
Verbruggen B, Novakova I, Wessels H, Boezeman J, van den Berg M, Mauser- Bunschoten E. The Nijmegen modification of the Bethesda assay for factor VIII:C inhibitors: improved specificity and reliability. Thromb Haemost. 1995 Feb;73(2):247-51
Keeling D, Beavis J, Sukhu K. A simple inhibitor screen is more sensitive than a Bethesda assay in monitoring for the development of inhibitors in haemophilia A and B. Br J Haematol. 2005 Mar;128(6):885.
Verbruggen B, Dardikh M, Polenewen R, C VAND, Meijer P. The factor VIII inhibitor assays can be standardized: results of a workshop. J Thromb Haemost 2011;9:2003-8.
Collins PW. Management of acquired haemophilia A. J Thromb Haemost 2011;9 Suppl 1:226-35.