Phần 1: giới thiệu
Trẻ sơ sinh có mức VWF tăng lúc sinh và đạt mức bình thường lúc 6 tháng tuổi.
VWF tăng theo độ tuổi với tỷ lệ khoảng 10IU/dl mỗi thập kỷ.
VWF thay đổi theo nhóm máu – nhóm máu O có mức thấp hơn các nhóm khác. Điều này quan trọng trong chẩn VWD khi mức VWF nằm ở giới hạn dưới và bệnh nhân có nhóm máu O.
Tiền sử chảy máu là cơ bản để chẩn đoán VWD – sử dụng thang điểm chảy máu quy ước được khuyến cáo.
Nhớ rằng Ristocetin gây kết dính hơn là gây ngưng tập tiểu cầu. Sự ngưng tập phụ thuộc vào việc gắn fibrinogen vào phức hợp GpIIb/IIIa.
VWD type 1C (Type 1 Vicenza) là một dưới nhóm của VWD do đột biến gây rút ngắn thời gian bán hủy của phân tử VWF.
VWD type 2A nay được chia làm 2 nhóm nhỏ: 2A1 do bất thường tổng hợp VWD và 2A2 do tăng ly giải protein bởi ADAMTS13.
Giới thiệu
VWF là một glycoprotein kích thước lên tới 20 x 106 Da. Nó được tổng hợp bởi:
Tế bào nội mạc mạch máu, nơi nó được lưu giữ trong thể Weibel-Palade trước khi được bài xuất 2. Mẫu tiểu cầu của tủy xương và nó cũng hiện diện ở tiểu cầu.
VWF ban đầu được tổng hợp như một chuỗi multimer rất lớn, sau đó được thoái giáng bởi ADAMTS13. Một sự suy giảm ADAMTS13 dẫn đến tích tụ multimer trọng lượng phân tử cao và gây ra đặc điểm lâm sàng, cận lâm sàng của bệnh lý xuất huyết giảm tiểu cầu huyết khối (TTP). Xét nghiệm yếu tố ADAMTS13 cũng được viết ở bài riêng.
VWF có 2 vai trò cơ bản:
Là một chất mang của FVIII, đảm bảo nó không bị thoái giáng trong huyết tương
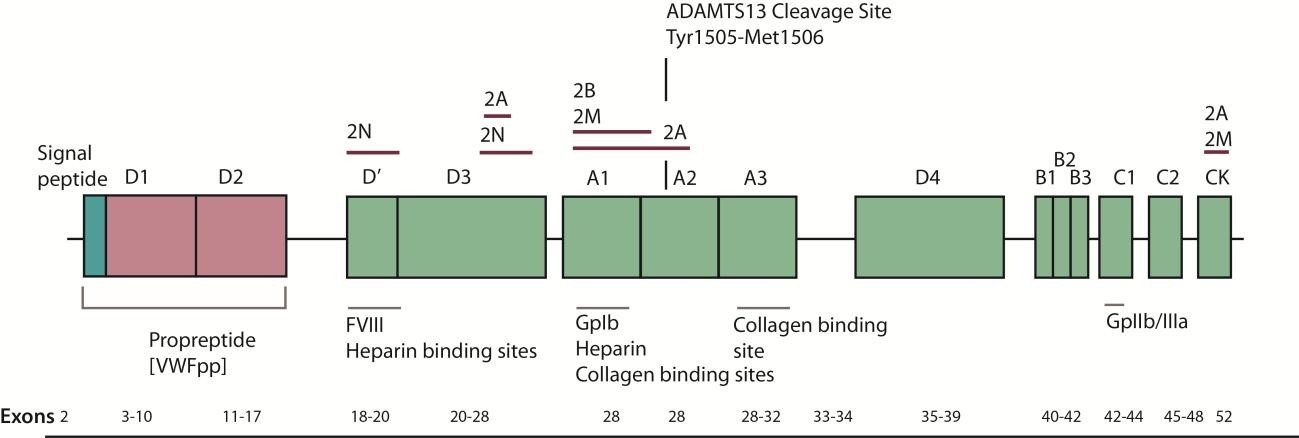
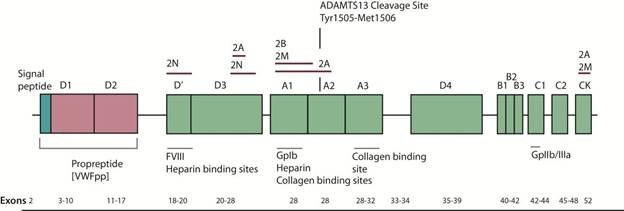
Là một protein kết dính liên quan đến sự tương tác giữa tiểu cầu và thành mạch Gene mã hóa VWF dài 172kb, gồm 52 exon, ở NST số 12 (12p13.3), mã hóa một protein có 2813 amino acid(aa) bao gồm 3 phần: một peptide tín hiệu (signal peptide) 22 aa, một prepropeptide 741 aa (từ 23-763), một protein trưởng thành 2050 aa (từ 764-2800). Protein trưởng thành chia ra một loạt các domain chứa những vùng chức năng khác nhau. VWF trưởng thành trong huyết tương có thời gian bán hủy khoảng 12 giờ. (9-15 giờ)
Có một giả gene (pseudogene) của một phần yếu tố von Willebrand chưa được xử lý nằm ở NST 22.
Tóm tắt những ký hiệu liên quan đến yếu tố von willbrand
|
Tên gọi |
Sơ lược |
|
Von Willebrand Disease [VWD] |
Rối loạn do bất thường số lượng hoặc chức năng của VWF |
|
Von Willebrand Factor [VWF] |
Đã giới thiệu ở trên |
|
von Willebrand Factor Ristocetin Cofactor Activity [VWF:RCo] |
Xét nghiệm chức năng VWF dựa vào mức độ huy động kết dính tiểu cầu sau khi cho thêm ristocetin |
|
von Willebrand Collagen Binding Activity [VWF:CB] |
Xét nghiệm chức năng VWF dựa vào định lượng khả năng gắn của VWF lên dĩa ELISA phủ collagen |
|
von Willebrand Factor Antigen [VWF:Ag] |
Xét nghiệm miễn dịch giúp định lượng số lượng hơn là hoạt tính của VWF |
|
von Willebrand Factor Propeptide [VWFpp] |
Prepropeptide của VWF |
|
FVIII |
Yếu tố đông máu đóng vai trò là cofactor cho việc tạo thành phức hợp Xnase (“Tenase”) |
|
FVIII:C |
Xét nghiệm chức năng hoạt tính FVIII |
|
FVIII:Ag |
Xét nghiệm miễn dịch FVIII |
|
Ristocetin-Induced Platelet Aggregation [RIPA] |
Xét nghiệm đo khả năng VWF gắn với tiểu cầu |
|
VWF gene |
Gene mã hóa VWF |
|
F8 gene |
Gene mã hóa FVIII |
Chẩn đoán bệnh von willebrand
VWD được phân thành 3 type từ 1 đến 3.
|
Đánh giá |
Diễn giải |
|
|
Triệu chứng chảy máu |
Khó đánh giá vì những vấn đề chảy máu nhẹ diễn ra phổ biến ở người khỏe mạnh. Sử dụng thang điểm chảy máu chuẩn hóa tỏ ra hữu ích (xem phần tài liệu tham khảo) |
|
|
Tiền sử gia đình |
Xác nhận sự hiện diện của bất cứ tiền sử gia đình nào nghi ngờ có rối loạn chảy máu |
|
|
Test ban đầu |
Công thức máu PT APTT Fibrinogene [PFA-100] |
|
|
Tỉ số VWF:RCo/VWF:Ag |
Tỉ số này giúp chẩn đoán các type 2A, 2B, 2M và giúp phân biệt với type 1. Nếu |
|
|
Tỉ số VWF:CB/VWF:Ag |
Tương tự như tỷ số ở trên. Type 2A: tỉ này thường thấp Type 2B: tỉ này thường thấp, nhưng có thể bình thường Type 2M: VWF:Ag có thể giảm hoặc bình thường, nhưng tỷ này |
|
|
Tỉ số VWFpp/VWF:Ag |
Điều này hữu ích trong nghiên cứu Type 1 và giúp chia type 1 thành VWF có thời gian bán hủy bình thường và VWF có thời gian bán hủy ngắn (1C, Vicenza) |
|
|
Test LABO đặc hiệu |
Nghiên cứu gắn kết FVIII |
Có giá trị trong chẩn đoán type 2N, nhưng test này không phổ biến. Xét nghiệm gene VWF có giá trị tương đương |
|
Phân tích multimer |
Là xét nghiệm định tính, phân tích các multimer VWF có kích thước khác nhau. |
|
|
RIPA liều thấp |
Có giá trị trong chẩn đoán type 2B |
|
|
Các test LABO ban đầu có thể trong VWD |
VWF:Ag |
Xét nghiệm miễn dịch, cung cấp tổng số lượng VWF, không phản ánh chức năng |
|
VWF:Act |
Xét nghiệm chức năng, bằng dùng kháng thể đơn dòng gắn vào vị trí gắn thụ thể GpIb của VWF |
|
|
FVIII:C |
Đo hoạt tính đông máu của yếu tố VIII bằng phương pháp 1 giai đoạn |
|
|
Xét nghiệm chất ức chế VWF. |
Sàng lọc chất ức chế VWF bằng phương pháp xác định chất ức chế cổ điển (trộn huyết tương bình thường và huyết tương test, sau đó đo mức VWF) là rất khó. Xét nghiệm chất ức chế theo kiểu Bethesda chuẩn thường xuyên thất bại trong việc xác định chất ức VWF. Xét nghiệm ELISA đã được giới thiệu để tìm kiếm chất ức chế VWF, nhưng lại một lần nữa không phải luôn luôn xác định được kháng thể. Tiền sử có thể rất quan trọng trong những trường hợp này, một tiền sử không ghi nhận những rối loạn |
|
|
|
chảy máu thường xuyên mãi cho tới gần đây. Thời gian bán hủy của VWF truyền vào cũng giảm đáng kể và xác nhận điều này rất có giá trị. Đo tỉ số VWF:pp/VWF:Ag có thể rất hữu ích. |
|
Tài liệu tham khảo
VWD
Laffan M, Brown SA, Collins PW, Cumming AM, Hill FG, Keeling D, et al. The diagnosis of von Willebrand disease: a guideline from the UK Haemophilia Centre Doctors’ Organization. Haemophilia. 2004 May;10(3):199-217.
Keeney S, Bowen D, Cumming A, Enayat S, Goodeve A, Hill M. The molecular analysis of von Willebrand disease: a guideline from the UK Haemophilia Centre Doctors’ Organisation Haemophilia Genetics Laboratory Network. Haemophilia. 2008 Sep;14(5):1099-111.
Tosetto A, Rodeghiero F, Castaman G, Goodeve A, Federici AB, Batlle J, et al. A quantitative analysis of bleeding symptoms in type 1 von Willebrand disease: results from a multicenter European study (MCMDM-1 VWD). J Thromb Haemost. 2006 Apr;4(4):76673.
Rodeghiero F, Castaman G, Tosetto A, Batlle J, Baudo F, Cappelletti A, et al. The discriminant power of bleeding history for the diagnosis of type 1 von Willebrand disease: an international, multicenter study. J Thromb Haemost. 2005 Dec;3(12):2619-26.
Rodeghiero F, Tosetto A, Castaman G. How to estimate bleeding risk in mild bleeding disorders. J Thromb Haemost. 2007 Jul;5 Suppl 1:157-66.
Tosetto A, Castaman G, Rodeghiero F. Assessing bleeding in von Willebrand disease with bleeding score. Blood Rev. 2007 Mar;21(2):89-97.
Rodeghiero F, Kadir RA, Tosetto A, James PD. Relevance of quantitative assessment of bleeding in haemorrhagic disorders. Haemophilia. 2008 Jul;14 Suppl 3:6875.
Tosetto A, Castaman G, Rodeghiero F. Bleeding scores in inherited bleeding disorders: clinical or research tools? Haemophilia. 2008 May;14(3):415-22.
Bowman M, Riddel J, Rand ML, Tosetto A, Silva M, James PD. Evaluation of the diagnostic utility for von Willebrand disease of a pediatric bleeding questionnaire. J Thromb Haemost. 2009 Aug;7(8):1418-21.
Schneppenheim R, Budde U. von Willebrand factor: the complex molecular genetics of a multidomain and multifunctional protein. J Thromb Haemost 2011;9 Suppl 1:209-15
Favaloro EJ. Diagnosis and classification of von Willebrand disease: a review of the differential utility of various functional von Willebrand factor assays. Blood coagulation & fibrinolysis 2011;22:553-64.
Favaloro EJ. Rethinking the diagnosis of von Willebrand disease. Thromb Res 2011;127 Suppl 2:S17-21.
Phần 2: xét nghiệm miễn dịch
Kết quả VWF:Ag nên được biểu diễn bằng IU/dl hoặc IU/ml nếu xét nghiệm đã được chuẩn hóa theo tiêu chuẩn quốc tế.
Giới thiệu
VWF:Ag là xét nghiệm miễn dịch đo nồng độ VWF trong huyết tương. Chúng không cho biết hoạt tính của VWF. Một số phương pháp dùng để đo VWF:Ag bao gồm ELISA và hấp phụ miễn dịch latex [LIA]. Nhiều LABO hiện nay sử dụng phương pháp LIA.
Nguyên lý và phương pháp
Miễn dịch Latex:
Phương pháp này dùng các vi ống latex phủ kháng thể chống VWF người. Trong sự hiện diện của VWF, các vi ống này sẽ ngưng kết và tỉ lệ với nồng độ VWF:Ag trong mẫu.
Xét nghiệm ELISA
Bánh kẹp ELISA đo VWF:Ag bằng cách sử dụng kháng thể cố định ở trên dĩa bằng cách vi ống, đặc hiệu cho VWF người. Huyết tương bệnh nhân, chất kiểm soát và hàng loạt mẫu tham chiếu pha loãng được thêm vào, và VWF trong mẫu sẽ gắn kết với kháng thể. Dĩa sau đó được rửa để loại bỏ các VWF chưa gắn. Một kháng thể thứ 2 có gắn Horseradish Peroxidase (HRP). Một bước rửa thứ 2 được thực hiện và cơ chất cho HRP được thêm vào (Tetramethylbenzidine – TMB) theo sau bởi hydrogen peroxidase để tạo màu. Phổ hấp thụ tại 450nm được đo và từ đường cong tham chiếu, nồng độ VWF:Ag được suy ra. Việc sử dụng mẫu chứng với nồng độ VWF đã biết để đảm bảo rằng xét nghiệm là chính xác.
Một số kháng thể đơn dòng (gắn vào domain gắn GpIb của VWF) có thể phân biệt giữa type 2A và 2B.
Phân tích kết quả
Diễn giải xét nghiệm VWF:Ag phải được làm trong bối cảnh với các xét nghiệm khác (FVIII:C và hoạt tính VWF), nhóm máu và tiền sử chảy máu. Hơn nữa, VWF là một protein pha cấp và sẽ tăng trong các trường hợp viêm, mang thai, phẫu thuật…
Khoảng tham chiếu
Giá trị tham chiếu của VWF:Ag là 50-150 IU/dl.
Đề nghị xét nghiệm nào tiếp?
Ở bệnh nhân nghi ngờ VWD, cần cố gắng sử dụng các xét nghiệm để phân type của bệnh, vì nó ảnh hưởng đến quyết định điều trị.
Tài liệu tham khảo
Christophe, O., Rouault, C., Obert, B., Pietu, G., Meyer, D. & Girma, J.P. (1995) A monoclonal antibody (B724) to von Willebrand factor recognizing an epitope within the A1 disulphide loop (Cys509-Cys695) discriminates between type 2A and type 2B von Willebrand disease. Br J Haematol, 90, 195-203.
Laffan, M., Brown, S.A., Collins, P.W., Cumming, A.M., Hill, F.G., Keeling, D., Peake, I.R. & Pasi, K.J. (2004) The diagnosis of von Willebrand disease: a guideline from the UK Haemophilia Centre Doctors’ Organization. Haemophilia, 10, 199-217.
Gadisseur, A., Berneman, Z., Schroyens, W. & Michiels, J.J. (2009) Laboratory diagnosis of von Willebrand disease type 1/2E (2A subtype IIE), type 1 Vicenza and mild type 1 caused by mutations in the D3, D4, B1-B3 and C1-C2 domains of the von Willebrand factor gene. Role of von Willebrand factor multimers and the von Willebrand factor propeptide/antigen ratio. Acta Haematol, 121, 128-138.
Favaloro, E.J., Bonar, R. & Marsden, K. (2008) Lower limit of assay sensitivity: an under-recognised and significant problem in von Willebrand disease identification and classification. Clin Lab Sci, 21, 178-183.
Gombos, T., Mako, V., Cervenak, L., Papassotiriou, J., Kunde, J., Harsfalvi, J., Forhecz, Z., Pozsonyi, Z., Borgulya, G., Janoskuti, L. & Prohaszka, Z. (2009) Levels of von Willebrand factor antigen and von Willebrand factor cleaving protease (ADAMTS13) activity predict clinical events in chronic heart failure.
Thromb Haemost, 102, 573-580. Davies, J.A., Collins, P.W., Hathaway, L.S. & Bowen, D.J. (2009) C1584: effect on von Willebrand factor proteolysis and von Willebrand factor antigen levels. Acta Haematol, 121, 98-101.
Phần 3: xét nghiệm hoạt tính vwf đặc hiệu epitope (vwf:act)
Xét nghiệm đặc hiệu epitope là xét nghiệm bán chức năng (semi-functional)
Xét nghiệm này sẽ cho ra kết quả bình thường ở bệnh nhân type 2N
Xét nghiệm ELISA sử dụng kháng thể chống trực tiếp epitope gắn GpIb của VWF bị chỉ trích vì chức năng của các multimer VWF kích thước lớn không được đo trực tiếp.
Giới thiệu
Test này sử dụng kháng thể đơn dòng đặc hiệu cho vị trí gắn GpIb của tiểu cầu định vị trên domain A1 của phân tử von Willebrand và độc lập với ristocetin.
Nguyên lý và phương pháp
Xét nghiệm ELISA: Trong xét nghiệm này, các giếng kích thước micro đã được phủ kháng thể đơn dòng chống trực tiếp phần gắn GpIb của VWF. Mẫu huyết tương (tham chiếu, test và chuẩn) được pha loãng và cho vào các giếng. Dĩa được ủ để kháng thể cố định kháng nguyên. Những VWF đã gắn này, được nhận diện bởi một kháng thể anti-human có gắn HRP. Kháng thể anti-human này được định lượng bằng phản ứng so màu bằng cách thêm cơ chất của HRP là OPD (1,2 orthophenylendiamine dihydrochloride) và đo độ phổ hấp thụ tại 492nm. Phổ hấp thụ tỷ lệ với nồng độ VWF. Đường cong chuẩn được xây dựng bằng cách vẽ nhiều điểm trên đồ thị bậc nhất của VWF:Act và OD, từ đó nồng độ trong mẫu được suy ra. Test này độc lập với ristocetin.
Phương pháp ngưng kết latex tự động: Nó sử dụng những phần tử latex được phủ kháng thể đơn dòng chống lại domain gắn GpIb. Hoạt tính của VWF được xác định bằng cách đo độ đục được tạo ra do sự ngưng kết của phần tử latex như là hậu quả của việc tương tác với receptor GpIb của VWF. Test này độc lập, có thể tự động hóa hoàn toàn và được chạy trên một số máy phân tích.
Phân tích kết quả
Sử dụng ELISA, đối với bệnh nhân type 1 hoặc 2A thì kết quả tương tự test hoạt tính VWF:RCo. Trong type 1, thì ELISA tương tự như đo mức kháng nguyên VWF:Ag. VWF:Act thấp hơn đáng kể so với VWF:Ag trong type 2A và 2B giúp phân biệt các dưới nhóm. Type 2M thì VWF:Act ở mức biên hoặc thấp. Type 3 thì VWF:Act rất thấp hoặc không xác định được.
Ngưng kết latex tương tự như ELISA
Khoảng tham chiếu
Khoảng tham chiếu của xét nghiệm VWF:Act thường từ 50-150 IU/dl. Nhớ rằng VWF là một protein pha cấp vì vậy nó tăng lên trong thời gian stress, mang thai….
Đề nghị xét nghiệm nào tiếp?
VWF:Act thường là một phần trong xét nghiệm chẩn đoán hoặc loại trừ bệnh lý VWD. Nó cũng được dùng để theo dõi điều trị.
Tài liệu tham khảo
Chand S, McGraw A, Hutton R, Tuddenham EGD, Goodall AH. A Two-Site Monoclonal Antibody-Based Immunoassay for von Willebrand Factor-Demonstration that vWF Function Resides in a Conformational Epitope. Thrombosis and Haemostasis. 1986;55(3):318-24.
Murdock PJ, Woodhams BJ, Matthews KB, Pasi KJ, Goodall AH. von Willebrand factor activity detected in a monoclonal antibody-based ELISA: an alternative to the ristocetin cofactor platelet agglutination assay for diagnostic use. Thromb Haemost. 1997;78(4):1272-7.
Phần 4: xét nghiệm khả năng gắn fviii
VWD Type 2N giống haemophilia A hoặc người mang gene. Ở type 2N, FVIII giảm do giảm khả năng gắn của VWF với FVIII.
Trong hầu hết type 2N, đột biến tìm thấy ở exon 18-20 của gene VWF, mã hóa vị trí gắn FVIII, mặc dù đột biến ở các vùng khác gần đây cũng được báo cáo.
2 đột biến cùng xuất hiện mới đủ khả năng tạo ra kiểu hình ở bệnh nhân VWD type 2N. Rối loạn này gặp ở người đồng hợp tử hoặc dị hợp kép. Với những người đồng hợp tử, bố mẹ của họ thường là người mang gene.
Nhớ rằng trong type 2N, FVIII giảm là do khả năng gắn của VWF với FVIII bất thường, còn các chức năng khác vẫn bình thường, nên xét nghiệm miễn dịch cũng như chức năng của nó đều bình thường.
Giới thiệu
VWD type 2N là bệnh lý di truyền lặn do đột biến vị trí gắn kết của VWF với FVIII, dẫn đến giảm khả năng gắn và vận chuyển FVIII trong huyết tương. Hậu quả là thời gian bán hủy của FVIII giảm đáng kể vì nó không còn được bảo vệ trước sự thoái giáng bởi các protease trong huyết tương. Bệnh nhân VWD type 2N thỉnh thoảng bị chẩn đoán nhầm với Haemophilia A.
Chẩn đoán type 2N cần có:
Phân tích phả hệ (bệnh di truyền lặn)
Đo đồng thời hoạt tính FVIII và VWF (FVIII giảm nhưng hoạt tính VWF bình thường)
Nghiên cứu khả năng gắn FVIII
Phân tích gene
Nguyên lý và phương pháp
Có một số phương pháp hiện có để đo khả năng gắn FVIII với VWF. Phương pháp ELISA thường được sử dụng:
Một dĩa có 96 ô chuẩn được phủ bởi kháng thể kháng VWF người.
Dĩa được ủ với mẫu huyết tương (cho phép kháng thể kháng VWF gắn kết phức hợp VWF-FVIII cố định lên dĩa)
Dĩa được rửa, sau đó ủ với calcium chloride để loại bỏ FVIII đã gắn với VWF nội sinh trước đó (điều này để đảm bảo chỉ có VWF gắn trên dĩa)
Nồng độ chuẩn FVIII tái tổ hợp được thêm vào để gắn với VWF đã cố định ở tất cả mẫu.
Sau khi rửa lại, tiếp tục cho vào dĩa hoặc anti-VWF thỏ gắn peroxidase hoặc antihuman FVIII gắn peroxidase. Sau bước rửa cuối cùng, cơ chất tetramethylbenzidine dihydrochloride được thêm vào và sự tạo màu được ghi nhận như xét nghiệm VWF:Ag chuẩn.
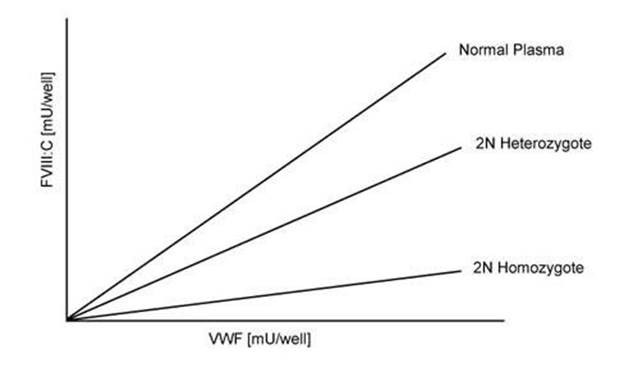
Đường cong chuẩn được tạo ra bằng cách sử dụng hàng loạt huyết tương bình thường pool (thường >60 người)
Tại mỗi độ pha loãng, giá trị của yếu tố VIII tái tổ hợp được biểu diễn cùng với VWF được cố định. Giá trị VWF:FVIII được biểu diễn bằng phần trăm so với huyết tương bình thường.
Phân tích kết quả
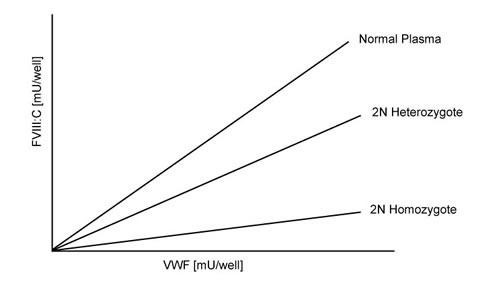
Những người với VWF bình thường sẽ cho thấy khả năng gắn FVIII bình thường ở bước 4, trong khi đó bệnh nhân type 2N sẽ cho thấy có rào cản trong việc gắn kết
Đề nghị xét nghiệm nào tiếp?
Hầu hết bệnh nhân type 2N bị chẩn đoán nhầm với haemophilia A thể nhẹ. Bất kỳ bệnh nhân haemophilia A thể nhẹ nào cũng cần sàng lọc bệnh VWD type 2N. Một tình huống suy giảm kết hợp FV và FVIII cũng nên được xem xét ở bệnh nhân haemophilia A thể nhẹ.
Tài liệu tham khảo
Gaucher C, Jorieux S, Mercier B, Oufkir D, Mazurier C. The “Normandy” variant of von Willebrand disease: characterization of a point mutation in the von Willebrand factor gene. Blood. 1991;77(9):1937-41.
Tuley EA, Gaucher C, Jorieux S, Worrall NK, Sadler JE, Mazurier C. Expression of von Willebrand factor “Normandy”: an autosomal mutation that mimics hemophilia A. Proc Natl Acad Sci U S A. 1991;88(14):6377-81.
Caron C, Mazurier C, Goudemand J. Large experience with a factor VIII binding assay of plasma von Willebrand factor using commercial reagents. Br J Haematol. 2002 Jun;117(3):716-8.
Miller CH, Kelley L, Green D. Diagnosis of von Willebrand disease type 2N: a simplified method for measurement of factor VIII binding to von Willebrand factor. Am J Hematol. 1998 Aug;58(4):311-8.
Xét nghiệm hoạt tính cofactor của ristocetin (vwf:rco)
Ristocetin là một kháng sinh, nhưng gây giảm tiểu cầu nên bị rút khỏi thị trường. Nó gây giảm tiểu cầu do kết dính tiểu cầu với nhau, nhưng chỉ xảy ra khi có sự hiện diện của ristocetin. Ristocetin làm tăng sự gắn VWF vào phức hợp GpIb bằng cách thay đổi lực tĩnh điện giữa GpIb và VWF. Trong vi tuần hoàn, lực cắt cao (high
shear) dẫn đến việc gắn VWF với tiểu cầu hơn là nhờ phân tử như ristocetin.
Kết quả của VWF:RCo nên được biểu diễn bằng đơn vị IU/dl dựa vào tiêu chuẩn của WHO Botrocetin là nọc độc được phân lập từ loài rắn Bothrops jararaca, sẽ làm thay đổi cấu dạng của VWF và tăng ái lực với GpIb. Xét nghiệm Botrocetin trong VWF cũng tương tự như ristocetin, tuy nhiên có một số bệnh nhân cho thấy hoạt tính 100% với botrocetin nhưng là 0% với ristocetin. Vì vậy chẩn đoán một số thể của VWD không thể loại trừ chỉ dựa vào xét nghiệm cofactor của botrocetin bình thường.
Kết dính tiểu cầu nhờ ristocetin (RIPA – Ristocetin induced platelet agglutination) được thực hiện trên huyết tương giàu tiểu cầu của bệnh nhân với nồng độ thấp ristocetin (khoảng 0.5µg/ml). Nồng độ thấp ristocetin này không thể gây ra việc gắn VWF và kết dính tiểu cầu trong mẫu từ người bình thường, nhưng sẽ xảy ra với bệnh nhân type 2B hoặc những đột biến trong receptor VWF của tiểu cầu (VWD type tiểu cầu hay bệnh giả Von Willebrand). Vì vậy, nó được dùng để sàng lọc type 2B.
VWF:CB ít có sự biến thiên giữa các xét nghiệm cũng như giữa các LABO nên tốt hơn trong việc phân biệt những VWF có/rối loạn chức năng hơn là VWF:RCo.
VWF:RCo là xét nghiệm định lượng, cho phép xác định số lượng VWF bất thường, vì sự tương tác giữa VWF và receptor GpIb trên màng tiểu cầu trong sự có mặt của ristocetin phụ thuộc vào VWF multimer. Tuy nhiên xét nghiệm này không thật sự là xét nghiệm “chức năng”, mà đúng hơn là xét nghiệm khả năng gắn của VWF với GpIb khi có mặt ristocetin (Lý do là tiểu cầu không phải của bệnh nhân)
Một số đa hình trong gene VWF cho thấy ảnh hưởng lên xét nghiệm VWF:RCo và điều này giải thích sự khác biệt của các chủng tộc trong đáp ứng với liều quan sát ở xét nghiêm VWF:RCo.
Giới thiệu
VWF:RCo đo khả năng của huyết tương bệnh nhân tọa ra sự kết dính tiểu cầu khi có mặt kháng sinh ristocetin. Tỉ lệ kết dính tiểu cầu nhờ ristocetin tương quan với nồng độ cũng như hoạt tính chức năng của VWF huyết tương. Ristocetin được cho là gắn với VWF tại Glu1239-Pro-Gly Gly1242.
RIPA là test tương tự như VWF:RCo nhưng ở đây ristocetin được cho trực tiếp vào huyết tương giàu tiểu cầu của bệnh nhân và không cần pha loãng mẫu huyết tương.
Có một số phương pháp để đo VWF:RCo. Trước đây, tiểu cầu rửa được sử dụng, nhưng nay người ta dùng tiểu cầu formaldehyde hoặc tiểu cầu đông lạnh.
Phương pháp
Phương pháp kết dính tiểu cầu: Phương pháp này tương tự xét nghiệm yếu tố
|
Bước |
|
|
1 |
Tiểu cầu rửa hoặc cố định được trộn với huyết tương bệnh nhân pha loãng (nghèo tiểu cầu) |
|
2 |
Huyết tương bệnh nhân thường được pha loãng gấp đôi |
|
3 |
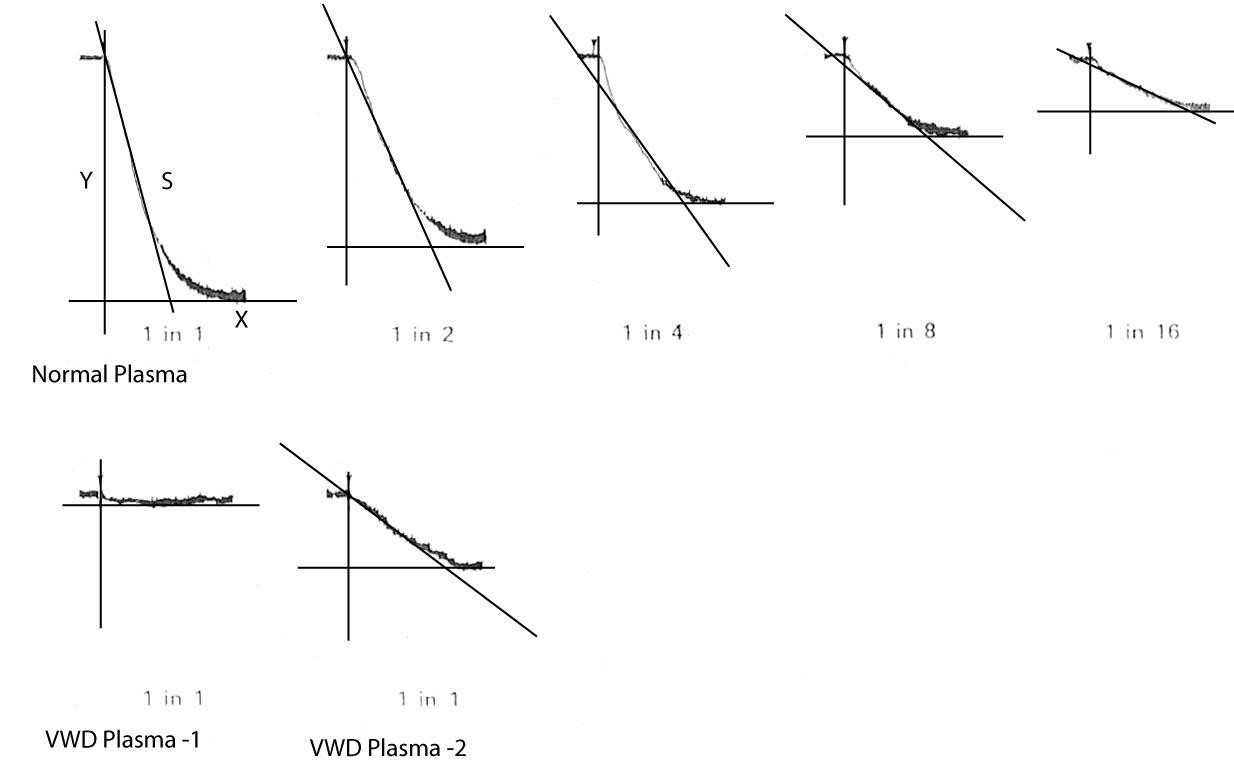
Kết dính được cho phép diễn ra và độ dốc (hệ số góc) đường cong được ghi lại. Một đường cong chuẩn được thành lập bằng cách sử dụng phương pháp tương tự nhưng thay huyết tương bệnh nhân bằng một loạt độ pha loãng của huyết tương bình thường. |
|
4 |
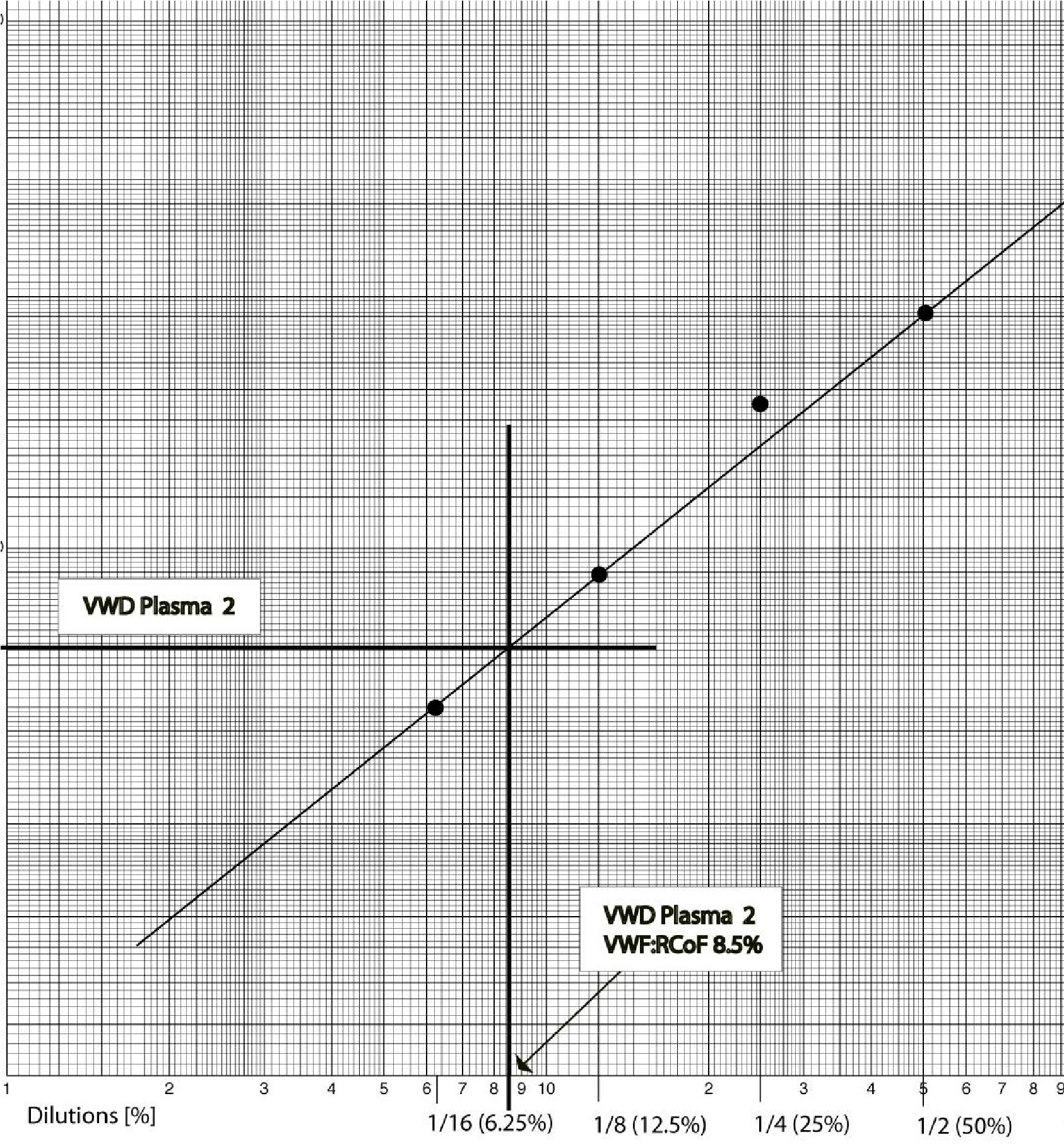
Độ dốc của đường cong được biểu diễn trên đồ thị log-log tại mỗi độ pha loãng và một đường thẳng được kẻ. Từ đó, hoạt tính cofactor của ristocetin được suy ra Nhớ rằng độ dốc (hệ số góc) được xác đinh bằng cách vẽ tiếp tuyến của đường cong, nó cắt trục hoành và trục tung, lấy khoảng cách trên trục tung chia cho trục hoành. |
|
5 |
Nếu chúng ta tính độ dốc (S=Slope) của mỗi độ pha loãng huyết tương bình thường và biểu diễn trên đồ thị log-log thì sẽ được một đường thẳng. Dựa trên đường này, mức hoạt tính VWF:RCo được suy ra |
|
6 |
Trong mẫu huyết tương 1, gần như không có sự kết dính tiểu cầu nên VWF:RCo Cuối cùng, do ta sử dùng cùng độ pha loãng với huyết tương chứng, nên không cần phải hiệu chỉnh theo độ pha loãng. |
|
Có thể thay aggregometer bằng đọc dĩa ELISA hoặc microtitre nhưng nguyên lý vẫn vậy. |
|
Xét nghiệm ELISA đánh giá khả năng gắn trực tiếp của VWF với GpIb tiểu cầu: trong xét nghiệm này, GpIb có thể từ 1 trong 2 nguồn:
Mảnh GpIb tái tổ hợp: dùng dĩa ELISA phủ kháng thể kháng GpIb, cho GpIb tái tổ hợp vào, sau cho VWF (huyết tương chứng hoặc bệnh nhân) vào, và phát hiện VWF bằng kỹ thuật so màu tương như các xét nghiệm ELISA đã đề cập (dùng kháng thể anti-VWF gắn HRP, cho cơ chất tạo màu OPD, rồi so màu)
Mảnh protein có thuật ngữ là “glycocalicin”, bao gồm phần ngoại bào của chuỗi α trong cấu trúc GpIb của tiểu cầu, nó có thể được tách khỏi tiểu cầu bằng việc sử dụng một số protease, điều thú vị là glycocalicin cũng tìm thấy trong huyết tương bình thường và có thể ly tâm để sử dụng trong xét nghiệm. Nguyên lý xét nghiệm tương tự như ở trên.
Flow cytometry: trong phương pháp này, một hỗn hợp tiểu cầu cố định formalin được gắn nhãn fluochrome màu đỏ và xanh, ủ với huyết tương test trong sự hiện diện ristocetin. Một phân tử VWF multimer có nhiều vị trí gắn GpIb tiểu cầu. Khi cả 2 tín hiệu tiểu cầu “đỏ” và “xanh” được gắn vào 1 phân tử VWF thì hiện tượng vi ngưng tập xảy ra. Mức độ vi ngưng tập, phản ánh qua hiện tượng “dương kép”, tương ứng với hoạt tính VWF:RCo. Sẽ không có hiện tượng dương kép nếu trọng lượng phân tử VWF multimer quá thấp để gắn ít nhất 2 tiểu cầu.
Xét nghiệm VWF:RCo dựa trên latex: dùng hạt latex phủ kháng thể đơn dòng để gắn chuỗi GpIbα, sau đó cho ngưng kết với VWF trong sự hiện diện của ristocetin. Tiến hành đo độ đục.
Phân tích kết quả
Xét nghiệm VWF:RCo có sự biến thiên lớn trong mỗi LABO cũng như giữa các LABO, và nó không thật sự đo chức năng sinh lý của VWF. Mặc dù với những hạn chế đó, nó vẫn là test để đo hoạt tính VWF phổ biến nhất hiện nay.
Ở người bình thường, kết quả VWF:Ag và VWF:RCo là giống nhau.
Khoảng tham chiếu
Khoảng tham chiếu của xét nghiệm VWF:RCo thường từ 50-150 IU/dl. Nhớ rằng VWF là một protein pha cấp vì vậy nó tăng lên trong thời gian stress, mang thai….
Đề nghị xét nghiệm nào tiếp?
VWF:RCo thường là một phần trong xét nghiệm chẩn đoán hoặc loại trừ bệnh lý VWD. Nó cũng được dùng để theo dõi điều trị.
Tài liệu tham khảo
Chen D, 4 CA, Hendricksen JI, Pruthi RK, Nichols WL, Heit JA, et al. A highly- sensitive plasma von Willebrand factor ristocetin cofactor (VWF:RCo) activity assay by flow cytometry. J Thromb Haemost. 2008 Feb;6(2):323-30.
De Vleeschauwer A, Devreese K. Comparison of a new automated von Willebrand factor activity assay with an aggregation von Willebrand ristocetin cofactor activity assay for the diagnosis of von Willebrand disease. Blood Coagul Fibrinolysis. 2006 Jul;17(5):353-8.
Dowling SV, Ekert H. A comparison of two methods for measurement of von Willebrand’s factor (ristocetin cofactor). Thromb Haemost. 1976 Aug 31;36(1):284-5.
Ewenstein BM. Use of ristocetin cofactor activity in the management of von Willebrand disease. Haemophilia. 2001 Jan;7 Suppl 1:10-5.
Federici AB, Canciani MT, Forza I, Cozzi G. Ristocetin cofactor and collagen binding activities normalized to antigen levels for a rapid diagnosis of type 2 von Willebrand disease–single center comparison of four different assays. Thromb Haemost. 2000 Dec;84(6):1127-8.
Flood VH, Friedman KD, Gill JC, Morateck PA, Wren JS, Scott JP, et al. Limitations of the ristocetin cofactor assay in measurement of von Willebrand factor function. J Thromb Haemost. 2009 Nov;7(11):1832-9.
Lattuada A, Preda L, Sacchi E, Gallo L, Federici AB, Rossi E. A rapid assay for ristocetin cofactor activity using an automated coagulometer (ACL 9000). Blood Coagul Fibrinolysis. 2004 Sep;15(6):505-11.
Lippi G, Franchini M, Salvagno GL, Montagnana M, Poli G, Guidi GC. Correlation between von Willebrand factor antigen, von Willebrand factor ristocetin cofactor activity and factor VIII activity in plasma. J Thromb Thrombolysis. 2008 Oct;26(2):150-3.
Macfarlane DE, Stibbe J, Kirby EP, Zucker MB, Grant RA, McPherson J. Letter: A method for assaying von Willebrand factor (ristocetin cofactor). Thromb Diath Haemorrh. 1975 Sep 30;34(1):306-8.
Redaelli R, Corno AR, Borroni L, Mostarda G, Nichelatti M, Morra E, et al. von Willebrand factor ristocetin cofactor (VWF:RCo) assay: implementation on an automated coagulometer (ACL). J Thromb Haemost. 2005 Dec;3(12):2684-8.
Strandberg K, Lethagen S, Andersson K, Carlson M, Hillarp A. Evaluation of a rapid automated assay for analysis of von Willebrand ristocetin cofactor activity. Clin Appl Thromb Hemost. 2006 Jan;12(1):61-7.
Truss NJ, Beavis J, MacCallum PK, Harrison P, Warner TD. Rapid and accurate method for the von Willebrand factor ristocetin cofactor assay using 96-well microtiter plates. J Thromb Haemost. 2009 Jul;7(7):1226-8.
Vanhoorelbeke K, Cauwenberghs N, Vandecasteele G, Vauterin S, Deckmyn H. A Reliable von Willebrand factor: ristocetin cofactor enzyme-linked immunosorbent assay to differentiate between type 1 and type 2 von Willebrand disease. Semin Thromb Hemost. 2002 Apr;28(2):161-6.
Vanhoorelbeke K, Cauwenberghs N, Vauterin S, Schlammadinger A, Mazurier C, Deckmyn H. A reliable and reproducible ELISA method to measure ristocetin cofactor activity of von Willebrand factor. Thromb Haemost. 2000 Jan;83(1):107-13.
Veyradier A, Fressinaud E, Boyer-Neumann C, Trossaert M, Meyer D. von Willebrand factor ristocetin cofactor activity correlates with platelet function in a high shear stress system. Thromb Haemost. 2000 Oct;84(4):727-8.
Federici AB, Canciani MT, Forza I, Mannucci PM, Marchese P, Ware J, et al. A sensitive ristocetin co-factor activity assay with recombinant glycoprotein Ibalpha for the diagnosis of patients with low von Willebrand factor levels. Haematologica. 2004 Jan;89(1):77-85.
Vanhoorelbeke K, Pareyn I, Schlammadinger A, Vauterin S, Hoylaerts MF, Arnout J, et al. Plasma glycocalicin as a source of GPIbalpha in the von Willebrand factor ristocetin cofactor ELISA. Thromb Haemost. 2005 Jan;93(1):165-71.
Chen D, Daigh CA, Hendricksen JI, Pruthi RK, Nichols WL, Heit JA, et al. A highlysensitive plasma von Willebrand factor ristocetin cofactor (VWF:RCo) activity assay by flow cytometry. J Thromb Haemost. 2008 Feb;6(2):323-30.
Lindahl TL, Fagerberg IH, Larsson A. A new flow cytometric method for measurement of von Willebrand factor activity. Scand J Clin Lab Invest. 2003;63(3):217-23.
Bowyer AE, Shepherd F, Kitchen S, Makris M. A rapid, automated VWF ristocetin cofactor activity assay improves reliability in the diagnosis of Von Willebrand disease. Thromb Res 2011;127:341-4.
Phần 6: xét nghiệm pre-propeptide (vwfpp)
Trong lịch sử, VWFpp được biết như là VWF:AgII
Trong type 1, đột biến làm giảm khả năng cắt của ADAMTS13, dẫn đến hiện diện các multimer kích thước siêu lớn => tăng đào thải, làm giảm VWF.
Đo VWFpp có giá trị trong việc phân biệt liệu VWF giảm là do giảm tổng hợp hay tăng đào thải. Trong giảm tổng hợp thì tỉ số giữa VWFpp và VWF:Ag bằng 1, trong khi tăng thải thì tỉ số này tăng lên.
Các chế phẩm VWF cô đặc không có bất cứ VWFpp nào.
Type 1 Vicenza và những biến thể tương tự với thời gian bán hủy VWF ngắn, được xếp vào nhóm 1C.
Giới thiệu
VWF được tổng hợp là protein gồm 2813 amino acid với 22 amino acid làm peptide tín hiệu, 741 amino acid làm pre-propeptide và một protein trưởng thành 2050 amino acid (pro-VWF). Chúng trải qua quá trình dimer hóa trong lưới nội bào tương thông qua cầu nối disulphide ở đầu C tận. Những dimer này sau đó được chuyển đến bộ máy Golgi, tại đây nó được tạo các liên kết chéo qua thành viên cysteine ở đầu N tận, tạo thành hàng loạt những multimer, làm tăng trọng lượng phân tử. Cũng tại bộ máy Golgi, phần pre-propeptide được tách ra khỏi mảnh protein trưởng thành.
VWFpp có nồng độ trong huyết tương khoảng 1µg/ml và thời gian bán hủy 2-3 giờ, trong khi đó mảnh VWF trưởng thành có nồng độ 10 µg/ml và thời gian bán hủy 8-12 giờ.
Một cơ chế mới trong Type 1 VWD liên quan đến việc tăng đào thải VWD khỏi huyết tương. Những bệnh nhân này cho thấy triệu chứng chảy máu cổ điển của type 1, xét nghiệm giảm VWF:Ag, VWF:RCo, FVIII và di truyền mô hình kiểu trội. Multimer cho thấy sự hiện diện của nhứng siêu phân tử. Sử dụng DDAVP cho thấy tăng đáng kể cả mức
VWF và FVIII nhưng chúng nhanh chóng bị đào thải khỏi huyết tương, ngược với type 1 cổ điển, tốc độ đào thải chậm hơn nhiều.
Nguyên lý và phương pháp
Sử dụng ELISA với kháng thể và kháng kháng thể đặc hiệu của VWFpp
Phân tích kết quả
Ở những bệnh nhân type 1 do tăng đào thải, tỉ số VWFpp/VWF:Ag có xu hướng tăng (khoảng bằng 4). Điều này gợi ý VWFpp có thời gian bán hủy bình thường nhưng của VWF trưởng thành thì giảm, nó bị đào thải nhanh chóng do đột biến bên trong protein VWF trưởng thành.
Type 1C có chức năng VWF-tiểu cầu bình thường, mức VWF huyết tương 6-10IU/dl và sự hiện diện của những multimer kích thước siêu lớn.
Khoảng tham chiếu
VWFpp có sự khác biệt đáng kể giữa nhóm máu O và các nhóm còn lại. Gía trị tham khảo từ 55-219IU/dl, tỉ số VWFpp/VWF:Ag có kỳ vọng bằng 1.
Đề nghị xét nghiệm nào tiếp?
Những cá nhân bất thường tỷ số VWFpp/VWF:Ag hướng đến bệnh VWD type 1 do tăng đào thải. Sử dụng DDAVP cũng giúp ích chẩn đoán.
Tài liệu tham khảo
Haberichter SL, Balistreri M, Christopherson P, Morateck P, Gavazova S, Bellissimo DB, et al. Assay of the von Willebrand factor (VWF) propeptide to identify patients with type 1 von Willebrand disease with decreased VWF survival. Blood. 2006 Nov 15;108(10):3344-51.
Nossent AY, V VANM, NH VANT, Rosendaal FR, Bertina RM, JA VANM, et al. von Willebrand factor and its propeptide: the influence of secretion and clearance on protein levels and the risk of venous thrombosis. J Thromb Haemost. 2006 Dec;4(12):2556-62.
Sztukowska M, Gallinaro L, Cattini MG, Pontara E, Sartorello F, Daidone V, et al. Von Willebrand factor propeptide makes it easy to identify the shorter Von Willebrand factor survival in patients with type 1 and type Vicenza von Willebrand disease. Br J Haematol. 2008 Sep;143(1):107-14.
Gadisseur A, Berneman Z, Schroyens W, Michiels JJ. Laboratory diagnosis of von Willebrand disease type 1/2E (2A subtype IIE), type 1 Vicenza and mild type 1 caused by mutations in the D3, D4, B1-B3 and C1-C2 domains of the von Willebrand factor gene. Role of von Willebrand factor multimers and the von Willebrand factor propeptide/antigen ratio. Acta Haematol. 2009;121(2-3):128-38.
Phần 7: xét nghiệm khả năng gắn fviii
VWD Type 2N giống haemophilia A hoặc người mang gene. Ở type 2N, FVIII giảm do giảm khả năng gắn của VWF với FVIII.
Trong hầu hết type 2N, đột biến tìm thấy ở exon 18-20 của gene VWF, mã hóa vị trí gắn FVIII, mặc dù đột biến ở các vùng khác gần đây cũng được báo cáo.
2 đột biến cùng xuất hiện mới đủ khả năng tạo ra kiểu hình ở bệnh nhân VWD type 2N. Rối loạn này gặp ở người đồng hợp tử hoặc dị hợp kép. Với những người đồng hợp tử, bố mẹ của họ thường là người mang gene.
Nhớ rằng trong type 2N, FVIII giảm là do khả năng gắn của VWF với FVIII bất thường, còn các chức năng khác vẫn bình thường, nên xét nghiệm miễn dịch cũng như chức năng của nó đều bình thường.
Giới thiệu
VWD type 2N là bệnh lý di truyền lặn do đột biến vị trí gắn kết của VWF với FVIII, dẫn đến giảm khả năng gắn và vận chuyển FVIII trong huyết tương. Hậu quả là thời gian bán hủy của FVIII giảm đáng kể vì nó không còn được bảo vệ trước sự thoái giáng bởi các protease trong huyết tương. Bệnh nhân VWD type 2N thỉnh thoảng bị chẩn đoán nhầm với Haemophilia A.
Chẩn đoán type 2N cần có:
Phân tích phả hệ (bệnh di truyền lặn)
Đo đồng thời hoạt tính FVIII và VWF (FVIII giảm nhưng hoạt tính VWF bình thường)
Nghiên cứu khả năng gắn FVIII
Phân tích gene
Nguyên lý và phương pháp
Có một số phương pháp hiện có để đo khả năng gắn FVIII với VWF. Phương pháp ELISA thường được sử dụng:
Một dĩa có 96 ô chuẩn được phủ bởi kháng thể kháng VWF người.
Dĩa được ủ với mẫu huyết tương (cho phép kháng thể kháng VWF gắn kết phức hợp VWF-FVIII cố định lên dĩa)
Dĩa được rửa, sau đó ủ với calcium chloride để loại bỏ FVIII đã gắn với VWF nội sinh trước đó (điều này để đảm bảo chỉ có VWF gắn trên dĩa)
Nồng độ chuẩn FVIII tái tổ hợp được thêm vào để gắn với VWF đã cố định ở tất cả mẫu.
Sau khi rửa lại, tiếp tục cho vào dĩa hoặc anti-VWF thỏ gắn peroxidase hoặc antihuman FVIII gắn peroxidase. Sau bước rửa cuối cùng, cơ chất tetramethylbenzidine dihydrochloride được thêm vào và sự tạo màu được ghi nhận như xét nghiệm VWF:Ag chuẩn.
Đường cong chuẩn được tạo ra bằng cách sử dụng hàng loạt huyết tương bình thường pool (thường >60 người)
Tại mỗi độ pha loãng, giá trị của yếu tố VIII tái tổ hợp được biểu diễn cùng với VWF được cố định. Giá trị VWF:FVIII được biểu diễn bằng phần trăm so với huyết tương bình thường.
Phân tích kết quả
Những người với VWF bình thường sẽ cho thấy khả năng gắn FVIII bình thường ở bước 4, trong khi đó bệnh nhân type 2N sẽ cho thấy có rào cản trong việc gắn kết
Đề nghị xét nghiệm nào tiếp?
Hầu hết bệnh nhân type 2N bị chẩn đoán nhầm với haemophilia A thể nhẹ. Bất kỳ bệnh nhân haemophilia A thể nhẹ nào cũng cần sàng lọc bệnh VWD type 2N. Một tình huống suy giảm kết hợp FV và FVIII cũng nên được xem xét ở bệnh nhân haemophilia A thể nhẹ.
Tài liệu tham khảo
Gaucher C, Jorieux S, Mercier B, Oufkir D, Mazurier C. The “Normandy” variant of von Willebrand disease: characterization of a point mutation in the von Willebrand factor gene. Blood. 1991;77(9):1937-41.
Tuley EA, Gaucher C, Jorieux S, Worrall NK, Sadler JE, Mazurier C. Expression of von Willebrand factor “Normandy”: an autosomal mutation that mimics hemophilia A. Proc Natl Acad Sci U S A. 1991;88(14):6377-81.
Caron C, Mazurier C, Goudemand J. Large experience with a factor VIII binding assay of plasma von Willebrand factor using commercial reagents. Br J Haematol. 2002 Jun;117(3):716-8.
Miller CH, Kelley L, Green D. Diagnosis of von Willebrand disease type 2N: a simplified method for measurement of factor VIII binding to von Willebrand factor. Am J Hematol. 1998 Aug;58(4):311-8.