Chẩn đoán ung thư tuyến tiền liệt
Lâm sàng
UTTTL nghèo nàn về triệu chứng ở giai đoạn sớm, các triệu chứng biểu hiện chủ yếu là tại chỗ khi bệnh tiến triển hoặc bệnh di căn.
Các triệu trứng UTTTL tại chỗ là triệu chứng rối loạn tiểu tiện, bít tắc, suy thận hoặc triệu chứng của cơ quan bị di căn đến như tủy sống, xương….
Việc phát hiện sớm UTTTL rất có ý nghĩa để điều trị bệnh triệt để tuy nhiên chỉ áp dụng phương pháp điều trị triệt để ở những người 10 năm.
Để chẩn đoán UTTTL dựa vào thăm trực tràng, siêu âm TTL và xét nghiệm PSA từ đó chỉ định người bệnh làm sinh thiết tuyến tiền liệt để chẩn đoán xác định UTTTL.
Thăm trực tràng có bất thường
Thăm trực tràng bằng ngón tay là thăm khám bắt buộc để chỉ định sinh thiết TTL. Hầu hết các UTTTL xuất hiện ở vùng ngoại vi của TTL và có thể được phát hiện qua thăm khám trực tràng khi thể tích khoảng 0,2 ml hoặc lớn hơn. Richie và cộng sự chỉ ra rằng 18% BN UTTTL được phát hiện qua thăm trực tràng khi có bất thường. Năm 1998 Schroder và cộng sự báo cáo thăm trực tràng có ít giá trị để phát hiện UTTTL và yêu cầu làm nhiều xét nghiệm khác để tăng độ nhạy kể từ thời gian đó ở Châu Âu nhiều nghiên cứu ngẫu nhiên để tầm soát UTTTL bằng thăm trực tràng, tuy nhiên Carvalhal và cộng sự khuyến cáo rằng thăm trực tràng nên thực hiện ở BN có PSA = 1 ng/ml hoặc lớn hơn nhưng tỉ lệ phát hiện UTTTL từ 14-30% ở những BN thăm trực tràng có bất thường và có PSA từ 1-4 ng/ml và được phát hiện UTTTL khi lần đầu sinh thiết.
Trước khi phương pháp siêu âm tuyến tiền liệt phát triển thì phương pháp duy nhất để khám thực thể tuyến tiền liệt chỉ là cách thăm khám tuyến này bằng ngón tay gián tiếp qua thành trước của trực tràng và đánh giá theo chủ quan. Với phương pháp này khi người thày thuốc cảm nhận thấy bất kỳ cảm giác có nốt hoặc cục hoặc bất kỳ cảm giác rắn hoặc không đều nào ở tuyến tiền liệt đều có thể nghi ngờ đó là các dấu hiệu của ung thư tuyến tiền liệt.
Khám trực tràng nghi ngờ là một chỉ định tuyệt đối sinh thiết TTL và là một dự báo khả năng UTTTL rất cao.
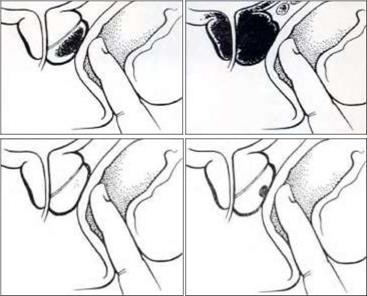
Phân loại lâm sàng sớm các giai đoạn ung thư tuyến tiền liệt dựa vào thăm khám trực tràng bằng ngón tay
Loại A: ung thư ẩn dấu, và thăm khám trực tràng bằng ngón tay thấy tuyến bình thường; ung thư thường chỉ được chẩn đoán sau khi tuyến tiền liệt được cắt bỏvì cho là phì đại tuyến tiền liệt lành tính
Loại B (ung thư giai đoạn sớm): khi thăm khám trực tràng bằng ngón tay thì sờ nắn thấy có một cục nhỏ, đơn độc ở bên trong bao của tuyến tiền liệt và chưa có bằng chứng di căn.
Loại C: Ung thư phát triển ra hết 1 thùy chưa có bằng chứng di căn.
Loại D: Ung thư xâm lấn các tạng xung quanh.
Xét nghiệm kháng nguyên đặc hiệu tuyến tiền liệt.
Kháng nguyên đặc hiệu tuyến tiền liệt (Prostatic Specific Antigent PSA)
PSA là một enzyme glucoprotein, được tiết ra duy nhất của biểu mô tuyến tiền liệt, PSA có trọng lượng phân tử khoảng 30.000, chứa 240 axit amin với 7% carbonhydrat, nó có vai trò làm loãng tinh dịch. PSA được tìm ra lần đầu tiên trong tinh dịch năm 1971 bởi Hara và công sự được gọi là gama-seminoprotein, Li và Beling (1973) Sensabaugh (1978) cũng tìm ra miễn dịch và thấy rằng nó không phản ứng chéo với tổ chức khác. Thời gian bán hủy của PSA là 48 – 72 giờ, bình thường nồng độ PSA trong máu là
PSA là kháng nguyên đặc hiệu của TTL, trong UTTTL nồng độ PSA thường tăng cao và tỷ lệ với thể tích khối ung thư nhưng không chỉ đặc hiệu riêng với UTTTL. Nồng độ PSA tăng cũng gặp trong viêm TTL mạn tính cũng như tất cả những tác động trên tuyến tiền liệt (đặt sonde bàng quang, soi bàng quang, chọc bàng quang, chọc sinh thiết, cắt nội soi nội tuyến tiền liệt qua đường niệu đạo,…). Tuy nhiên PSA tăng do những nguyên nhân này thường ở mức độ thấp, sau 7 ngày của những can thiệp, xét nghiệm đánh giá lại chỉ số chính xác hơn (thời gian bán hủy của PSA là 48-72 giờ).
Năm 1979, Wang và cộng sự phân lập được PSA từ tổ chức TTL bằng kỹ thuật miễn dịch. Và năm 1980, Kuriyama và cộng sự đã định lượng được PSA trong huyết thanh. Trong tuyến tiền liệt, PSA đượctiết trực tiếp vào các ống tuyến. Bình thường chỉ một lượng rất nhỏ của PSA thoát được vào hệ tuần hoàn. Trong UTTTL, cấu trúc mô học bị phá vỡ, PSA được tiết trực tiếp vào khoảng gian bào, đi thẳng vào hệ tuần hoàn. Do đó trong UTTTL, nồng độ PSA huyết thanh thường tăng cao có thể gấp 10 lần so với mô tuyến tăng sinh lành tính [45]. Nghiên cứu của Catalonavà cộng sự trên 6.630 bệnh nhân nhận thấy trong số bệnh nhân có tăng PSA trên 4 ng/mL có hơn 80% bệnh nhân có giá trị PSA huyết thanh nằm trong khoảng 4- 10 ng/ml, khoảng 2/3 các trường hợp kết quả sinh thiết TTL lành tính.
Giá trị của PSA đối với chẩn đoán UTTTL.
PSA từ 0 – 2.4 ng/ml không chắc chắn ung thư
PSA từ 2 ng/ml – 4 ng/ml tỷ lệ ung thư khoảng 12-23%
PSA 4.1- 10 ng/ml tỷ lệ ung thư khoảng 25%
PSA >10 ng/ml tỷ lệ ung thư > 50%
Bảng 1.5. Nguy cơ UTTTL liên quan đến giá trị PSA
|
Nồng độ PSA (ng/ml) |
Nguy cơ UTTTL |
Nguy cơ Gleason ≥ 7 |
|
0-0,5 |
6,6% |
0,8% |
|
0,6-1 |
10,1% |
1,0% |
|
1,1-2 |
17,0% |
2,0% |
|
2,1-3 |
23,9% |
4,6% |
|
3,1-4 |
26,9% |
6,7% |
Giá trị PSA đối với giai đoạn của ung thư
Mối tương quan giữa PSA và giai đoạn của UTTTL, khối u càng ở giai đoạn muộn thì nồng độ PSA trong máu càng tăng.
PSA
PSA >30ng/ml 80% khối u tuyến tiền liệt ở giai đoạn pT3.
PSA >50ng/ml 80% khối u tuyến tiền liệt có xâm lấn vào túi tinh hoặc có di căn hạch N+
PSA > 100ng/ml 100% khối u tuyến tiền liệt có di căn xa.
Giá trị PSA đối với quá trình theo dõi UTTTL
PSA cho phép theo dõi đánh giá đáp ứng điều trị. Sau cắt tuyến tiền liệt toàn bộ tiệt căn, tỷ lệ PSA phải bằng 0 sau 21 ngày (hoặc
Sau điều trị Hocmon nồng độ PSA bình thường sau 3 tháng có thể coi như là một tiêu chuẩn dự đoán về thời gian sống thêm > 42 tháng.
Sau điều trị tia xạ nồng độ PSA phải dần hết (sự giảm nồng độ PSA 50% sau 6 tháng, nồng độ nhỏ nhất ở tháng thứ 14-16)
PSA tỷ trọng (PSAD)
Mật độ kháng nguyên tuyến tiền liệt là tỷ số giữa nồng độ PSA chia cho khối lượng tuyến tiền liệt được xác định bằng siêu âm tuyến tiền liệt qua đường trực tràng. Mật độ PSA càng cao thì khả năng ung thư càng có ý nghĩa về mặt lâm sàng. Trị số bình thường là 0,15 ng/ml/gram, nếu tỷ số này
Tỷ lệ PSA tự do /PSA toàn phần
Là thông số được sử dụng rộng rãi trong lâm sàng để phân biệt giữa tăng sinh lành tính và UTTTL. Tỉ lệ này được sử dụng trong trường hợp nồng độ PSA từ 4-10ng/ml và thăm khám trực tràng không có dấu hiệu nghi ngờ UTTTL. Tỷ lệ PSAf/ PSAt càng thấp thì nguy cơ mắc UTTTL càng tăng lên.
Trong một thử nghiệm đa trung tâm, UTTTL được phát hiện qua sinh thiết ở 56% nam giới có tỷ lệ fPSA/PSAt 0.25 .Những dữ liệu này đã được xác nhận trong một thử nghiệm sàng lọc gần đây bao gồm 27 730 người đàn ông với nồng độ PSA huyết thanh từ 2,1 đến 10 ng/ml. Sử dụng tỷ lệ fPSA/PSAt, số lượng sinh thiết không cần thiết giảm đáng kể và tỷ lệ phát hiện UTTTL tăng lên đáng kể, vì vậy PSA tự do/PSA toàn phần nên được xem xét thường xuyên ở mọi bệnh nhân có kết quả đáng ngờ.
Với các bệnh nhân có PSA 0,25 không sinh thiết, từ 0,1-0,25 cân nhắc chỉ định sinh thiết,
Tốc độ PSA và thời gian tăng gấp đôi
PSA vận tốc (PSA velocity) hay tốc độ tăng PSA: là sự thay đổi nồng độ PSA trong máu theo thời gian, khái niệm này được Carter và cộng sự nêu ra vào năm 1992, theo Carter nếu PSA vận tốc tăng 0.75 ng/ml/năm hoặc lớn hơn thì có đến 72% bệnh nhân có ung thư.
Thời gian nhân đôi PSA (PSA-DT): đo lường sự gia tăng theo cấp số nhân PSA huyết thanh theo thời gian.
PSAV và và PSA – DT có thể có vai trò tiên lượng trong điều trị UTTTL, nhưng trong chẩn đoán lại hạn chế do nhiều yếu tố nhiễu (tổng khối lượng TTL và TSTTL)
PSA vận tốc (PSA-V) đã được đề xuất như một hoán vị PSA khác để đạt được sự cải thiện tính đặc hiệu để phát hiện UTTTL. Ban đầu PSA-V vượt quá 0,75 ng/ml/ năm có liên quan đến nguy cơ UTTTL cao hơn PSA tăng chậm theo thời gian. Các bằng chứng gần đây cho thấy điểm cắt này chỉ hữu ích đối với nam giới có tổng PSA> 4.0 ng/ml. Ở những người đàn ông trẻ tuổi có mức PSA thấp hơn, giá trị cắt PSA-V 0,3-0,5 ng/ml/năm được đề xuất làm cơ sở để khuyến cáo thực hiện sinh thiết. Nghiên cứu này chứng minh rằng PSA-V có thể cải thiện khả năng tiên đoán của một mô hình kết hợp PSA. Trong một nghiên cứu khác các nhà nghiên cứu đã chứng minh rằng PSA-V trong vòng 3 năm đã tiên đoán được chẩn đoán UTTTL. Tuy nhiên khi thêm vào một mô hình tiên đoán bao gồm PSA, PSA-V không bổ sung giá trị độc lập trong dự đoán nguy cơ ung thư.
D’Amico và cộng sự đã điều tra xem PSA-V có thể tiên đoán giai đoạn và thời gian tái phát sinh hóa, nghiên cứu này báo cáo thời gian ngắn hơn đáng kể để tái phát và tử vong ở bệnh nhân ung thư TTL có PSA-V hàng năm > 2,0 ng/ ml/ năm trong số 1054 bệnh nhân trong năm trước khi chẩn đoán ung thư tuyến tiền liệt.
Chất chỉ điểm PCA3 (Prostate cancer gene 3)
Gen UTTTL 3 (PCA3) là một dấu ấn sinh học mRNA không mã hóa đặc hiệu cho tuyến tiền liệt, được phát hiện trong nước tiểu sau ba lần xoa tuyến tiền liệt qua trực tràng. PCA3 được cho là có nhiều ưu điểm hơn so với PSA toàn phần và tự do. Một vấn đề chủ yếu đang diễn ra trong tầm soát UTTTL là hạn chế đặc biệt của PSA. Mức gia tăng nồng độ PSA trong huyết thanh có thể xảy ra trong trường hợp lành tính, dẫn đến sinh thiết không cần thiết. Hơn nữa mức độ PSA phản ánh quang phổ của nguy cơ UTTTL, chẳng hạn có một tỷ lệ của UTTTL sẽ được bỏ qua bằng cách sử dụng ngưỡng PSA truyền thống. Những vấn đề này đã mở đường cho các cuộc nghiên cứu trên diện rộng vào chỉ thị sinh học UTTTL thay thế PSA. Năm 1999, Bussemakers và các đồng nghiệp nhận thấy rằng gen DD3 (PCa3) được biểu hiện quá mức trong mô UTTTL so với tăng sản lành tính tuyến tiền liệt (BPH) hoặc mô tuyến tiền liệt bình thường và chứng minh không gặp ở các khối u cơ quan khác. Kể từ thời điểm đó xét nghiệm nước tiểu định lượng cho PCa3 mRNA đã được phát triển và một số nghiên cứu đã xem xét đến vai trò của PCa3 trong sàng lọc UTTTL.
Xét nghiệm gen PCa3 được chỉ định trong các trường hợp sau:
BN có nồng độ PSA cao nhưng sinh thiết ban đầu âm tính
BN tìm thấy có ung thư mặc dù mức độ của PSA bình thường.
BN có PSA cao liên quan với mức độ khác nhau của viêm tuyến tiền liệt.
BN trải qua hoạt động giám sát cho giả định ung thư.
Phosphataza axit của tuyến tiền liệt (PAP)
Bình thường
Phosphataza kiềm
Nó là chất chỉ thị đặc biệt cho những di căn xương đặc khi đó chụp phim khung chậu, xương đùi, cột sống, đặc biệt là chụp đồng vị phóng xạ thấy rõ di căn xương, chụp phổi tìm di căn phổi, siêu âm di căn gan….
Chẩn đoán hình ảnh
Siêu âm trực tràng (TRUS-Trans Rectal Ultrasound)
TRUS đã trải qua hàng loạt sự phát triển mang tính cách mạng. Vào những năm 1960 – 1970, 75% trường hợp ung thư TLT mới được chẩn đoán không còn ở giai đoạn khu trú và tỷ lệ sống còn sau 5 năm rất thấp, đến thập niên 90 > 60% trường hợp ung thư mới chẩn đoán còn ở giai đoạn khu trú và tỷ lệ sống còn sau 5 năm được cải thiện đáng kể. Năm 1985 lần đầu tiên Lee và cộng sự đã mô tả hình ảnh giảm âm của thương tổn ung thư TLT cho rằng có khoảng 70% các nốt cứng sờ được khi DRE có biểu hiện là vùng phản âm kém trên siêu âm và > 50% trường hợp ung thư không có tổn thương sờ thấy được có biểu hiện phản âm kém trên siêu âm, khi thương tổn ở vùng ngoại vi cho hình ảnh phản âm kém hỗn hợp đồng âm và tăng âm thì tỷ lệ ung thư lần lượt là 35%, 25 – 30%, 10 – 15% và 10% hơn nữa, thương tổn phản âm kém không đặc hiệu cho ung thư TLT vì có thể biểu hiện của tình trạng viêm nhiễm, thiểu sản, tăng sản và ngay cả trên mô tuyến bình thường.
Khoảng 60% các ung thư tiền liệt tuyến nằm ở vùng ngoại biên, 2% ở vùng trung tâm, 38% ở vùng chuyển tiếp, cho nên tìm ung thư tiền liệt tuyến không chỉ tìm ở vùng ngoại vi mà phải tìm cả vùng ở chuyển tiếp và vùng trung tâm. Hình ảnh siêu âm của ung thư tiền liệt tuyến rất thay đổi nhưng trong 70% các trường hợp biểu hiện là hình giảm âm, có gianh giới và có thể có vôi hoá hay nang. Nghiên cứu vùng ngoại biên là thăm khám lâu nhất và cần thận trọng, đầu tiên thăm khám bằng các lớp cắt ngang để phân tích kỹ hình ảnh tổng quát của tiền liệt tuyến nhất là tính cân đối của nó so với trục dọc của tiền liệt tuyến. Tất cả các cấu trúc bất thường hay thay đổi bất thường về hình thái của tuyến cũng có thể gợi ý có tổn thương ác tính. Trên siêu âm Doppler màu nhất là Doppler năng lượng theo đường qua trực tràng ta có thể nghiên cứu được tưới máu của tiền liệt tuyến nhất là nốt ung thư. Tổn thương nốt ác tính của tiền liệt tuyến có hiện tượng tăng sinh mạch hơn so với vung nhu mô lành, thấy khá rõ trên Doppler năng lượng.
Chụp cắt lớp vi tính tuyến tiền liệt (CLVT)
Đánh giá tình trạng xâm lấn tại chỗ của ung thư như vỏ bao, túi tinh, bàng quang. Phát hiện hạch ung thư.
Đánh giá ảnh hưởng trên hệ tiết niệu cao (thận niệu quản), nghiên cứu những bất thường sau phúc mạc như di căn sau phúc mạc.
Phát hiện tổn thương di căn xa: Gan, phổi, xương…
Chụp CLVT giống như siêu âm là một kỹ thuật thăm dò không xâm hại, ngày càng được sử dụng rộng rãi trong chẩn đoán nhiều loại bệnh lý nói chung và ung thư tuyến tiền liệt nói riêng. So với thăm dò bằng siêu âm, chụp CLVT cho độ chính xác cao hơn. CLVT có tiêm thuốc cung cấp thông tin về mức độ xâm lấn các tạng lân cận, hạch hoặc di căn xương, các tổn thương kèm theo nếu có vùng tầng sinh môn và tiểu khung. Tuy nhiên do độ phân giải kém nên CLVT hạn chế trong việc đánh giá các tổn thương trong tuyến.
Chỉ định chính của CLVT là phát hiện và xác định giai đoạn của UTTTL.
Chụp cộng hưởng từ (CHT) tuyến tiền liệt.
Chụp CHT tuyến tiền liệt có giá trong chẩn đoán ung thư tuyến tiền liệt để và cóvai trò theo dõi điều trị. Vai trò của CHT có giá trị cao đối với ung thư tuyến tiền liệt như trong việc phát hiện, xác định vị trí, tính chất và giai đoạn cũng như giúp cho dự kiến điều trị UTTTL
Hình ảnh ung thư TTL trên CHT
UTTTL phá vỡ vỏ bao, xâm lấn lớp mỡ quanh tuyến biểu hiện là hình giảm tín hiệu của lớp mỡ và mất cân xứng bó mạch quanh tuyến.
Vùng ngoại vi: Là nơi xuất phát khoảng 70% ung thư, thường biểu hiện là vùng giảm tín hiệu.
Vùng chuyển tiếp: Là nơi xuất phát khoảng 25% ung thư, giảm tín hiệu và biểu hiện tổn thương thường là dạng hình cầu hoặc thấu kính, bờ không đều và không có vỏ rõ.
Vùng trung tâm tuyến: Khoảng 5% ung thư xuất phát từ đây, chẩn đoán rất khó khăn với tăng sản mô đệm vì cấu trúc không đồng nhất. Tuy nhiên có thể dựa vào các đặc điểm như bờ rõ nét, vỏ rõ giảm tín hiệu và tổn thương hình tròn để hướng đến chẩn đoán phì đại TTL lành tính.
Vùng mô đệm xơ cơ phía trước có thể bị xâm lấn bởi khối u ở vùng chuyển tiếp, trong khi đó các nốt phì đại lành tính TTL có thể gây đè đẩy chứ không xâm lấn.
Một số nghiên cứu của các tác giả nước ngoài về giá trị chẩn đoán UTTTL của CHT. Trên thế giới đã có nhiều công trình nghiên cứu về giá trị của CHT trong chẩn đoán UTTTL, trong đó đa số các tác giả đều đưa ra nhận xét CHT là phương pháp thăm khám hình ảnh rất có giá trị.
Theo một nghiên cứu năm 2014 khi khảo sát dữ liệu của 526 bệnh nhân trong 7 công trình nghiên cứu đã nhận thấy CHT có độ đặc hiệu 88%, độ nhạy 74% trong việc xác định UTTTL, với giá trị dự báo âm tính dao động trong khoảng từ 65- 94%.
Khi sử dụng CHT 1.5 Tesla để đánh giá 122 trường hợp, Shimizu và các cộng sự đã nhận thấy rằng: độ nhạy của các chuỗi xung T2W, DWI, bản đồ ADC lần lượt là 41,2%, 56,7%, 57,7%, giá trị dự báo dương tính của các chuỗi xung này lần lượt tương ứng là 83%, 86,4%, 87,2%. Không có mối tương quan giữa độ nhạy của các chuỗi xung CHT với vị trí khối u.
Các tác giả cũng nhận thấy rằng với việc kết hợp các chuỗi xung với nhau và CHT phổ sẽ làm tăng giá trị và độ chính xác của CHT, trong đó độ nhạy, độ đặc hiệu, độ chính xác, giá trị dự báo dương tính và âm tính lần lượt là 69- 95%, 63- 96%, 68- 92% và 80- 95%.
Xạ hình xương
Xạ hình xương là công cụ hữu ích để phát hiện ung thư di căn xương. Xạ hình xương có giá trị tiên đoán âm tính từ 87-100%. Tuy nhiên, lợi ích của việc chẩn đoán lại phụ thuộc nhiều vào trị số PSA, giai đoạn ung thư và điểm số Gleason. Trong một phân tích gộp, tỷ lệ xạ hình xương dương tính lần lượt là 2,3%; 5,3%; 16,2%; 39,2% và 73,4% với PSA huyết thanh lần lượt là 0-9,9; 10-19,9; 20-49,9; và >100 ng/mL.
Di căn xương hiếm khi xảy ra ở những BN không triệu chứng, do đó không nên thực hiện thường quy vì có thể dẫn đến dương tính giả, tốn kém, cũng như gây lo lắng cho BN. Hầu hết các khuyến cáo thực hiện xạ hình xương cho BN có PSA ≥ 20 ng/mL, điểm số Gleason 8-10, giai đoạn cT3- 4, hoặc có triệu chứng nghi ngờ di căn xương.
Chụp PSMA-PET (Chụp PET/CT Kháng nguyên màng tế bào tuyến tiền liệt)
Kháng nguyên màng tế bào tuyến tiền liệt (PSMA), là một protein xuyên màng có biểu hiện quá mức đáng kể trên hầu hết các tế bào ung thư tuyến tiền liệt. Cho đến nay, một số hợp chất nhỏ để ghi nhãn PSMA đã được phát triển và hiện đang được nghiên cứu như chất chỉ điểm hình ảnh cho PET với chất ức chế PSMA gắn nhãn Ga.
Hình ảnh PSMA-PET có thể tăng cường phát hiện tổn thương ung thư tuyến tiền liệt bằng cách phát hiện tổn thương di căn ngay cả ở những BN có giá trị PSA huyết thanh thấp trong ung thư tuyến tiền liệt tái phát sinh hóa. có thể cho phép cải thiện kế hoạch điều trị phù hợp với bệnh nhân và, do đó, dẫn đến kết quả điều trị được cải thiện
Phân định các tổn thương đáng ngờ cho sinh thiết được nhắm mục tiêu, đặc biệt ở những bệnh nhân có mẫu sinh thiết là âm tính.
Dấu ấn sinh học kháng nguyên sớm ung thư tuyến tiền liệt (epca)
Năm 1991 lần đầu tiên Getzenberg và cộng sự đã tìm thấy một loại protein chất nền nhân có trong mô TTL của chuột ung thư mà không có trong mô TTL của chuột bình thường. Ông đặt tên protein này là kháng nguyên UTTTL sớm (EPCA). Tháng 4 năm 2000, lần đầu tiên Leman, Getzenberg và cộng sự đã xác định chính xác một protein khác cũng xuất hiện trong nhân của tế bào UTTTL với lượng nhỏ mà không có trong nhân của tế bào TTL bình thường, đó là EPCA-2. Sau đó nhiều nghiên cứu đã chứng minh EPCA-2 là kháng nguyên rất đặc trưng cho UTTT do vậy việc dùng kháng thể đặc hiệu xác định sự có mặt của EPCA trong máu để chẩn đoán sớm UTTTL là phương pháp có giá trị trong thời gian tới
Phân nhóm nguy cơ ung thư ttl
Năm 1998, dựa trên kết quả tái phát sinh hóa thời điểm 10 năm sau phẫu thuật cắt
TTL tận gốc và xạ trị UTTTL giai đoạn khu trú, D’Amico và cộng sự phân BN ung thư
TTL giai đoạn khu trú thành 3 nhóm nguy cơ.
Nhóm nguy cơ thấp (T1-2a và PSA ≤ 10 ng/mL và điểm số Gleason ≤ 6);
Nguy cơ trung bình (T2b hoặc PSA 10-20 ng/mL hoặc điểm số Gleason 7)
Nguy cơ cao (T2c hoặc PSA> 20 ng/mL hoặc điểm số Gleason 8-10) có tỷ lệ sống còn không bệnh thời điểm 10 năm lần lượt là 83%, 46% và 29%
Nhiều Hiệp hội Tiết Niệu và ung thư trên thế giới cũng đưa ra phân nhóm nguy cơ dựa trên cải tiến phân nhóm nguy cơ của D’Amico.
Bảng 1.3: Phân nhóm nguy cơ theo EAU 2016
|
Nguy cơ thấp |
Nguy cơ TB |
Nguy cơ cao |
|
|
|
|
|
|||||
|
|
|||||
|
cT1-2a và Gleason PSA≤10 ng/mL
|
cT2b và Gleason = 7 và PSA10-20 ng/mL
|
cT2c hoặc Gleason > 7 hoặc PSA>20ng/mL |
cT3-4 hoặc N1 Gleason bất kỳ PSA bất kỳ
|
cT bất kỳ cN bất kỳ, M1 Gleason bất kỳ PSA bất kỳ
|
|
|
|
|||||
|
Giai đoạn khu trú |
Tiến triển tại chỗ |
Di căn |
|
||
Bảng 1.4: Phân nhóm nguy cơ theo NCCN 2016
|
Nguy cơ rất thấp* |
Nguy cơ thấp |
Nguy cơ trung bình |
Nguy cơ cao |
Nguy cơ rất cao |
Di căn tại chỗ |
Di căn xa |
|
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
cT1c GS≤6 PSA ng/ml |
cT1-2a GS≤6 PSA ng/ml |
cT2b-2c GS=7 PSA 10-20 ng/ml |
cT3a hoặc GS 8-10 hoặc PSA > 20 ng/ml |
cT3b-4 Độ mô học đầu tiên trong GS là 5 hoặc >4 mẫu sinh thiết GS 8-10 |
T bất kỳ N1, M0 |
T bất kỳ N bất kỳ M1 |
|
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
|||||||
|
|
0,15 ng/ml/g.
Điều trị: liệu pháp ức chế androgen cách quãng trong ung thư tuyến tiền liệt diễn tiến xa
Tối ưu hoá điều trị nội tiết trong ung thư tuyến tiền liệt (UTTTL) diễn tiến xa còn nhiều điểm bàn cãi trong đó có vấn đề điều trị liên tục hay cách quãng.
Phân tầng nguy cơ ut ttl theo nccn phiên bản 2.2014 : 5 nhóm
Nguy cơ rất thấp: T1c và điểm Gleason ≤ 6 và PSA
Nguy cơ thấp: T1-T2a và điểm Gleason ≤ 6 và PSA
Nguy cơ trung bình: T2b -T2c hay điểm Gleason=7 hay PSA từ 10-20 ng/ml
Nguy cơ cao: T3a hay điểm Gleason từ 8-10 hay PSA > 20ng/ml
Nguy cơ rất cao: T3b -T4 hay N1 hay M1
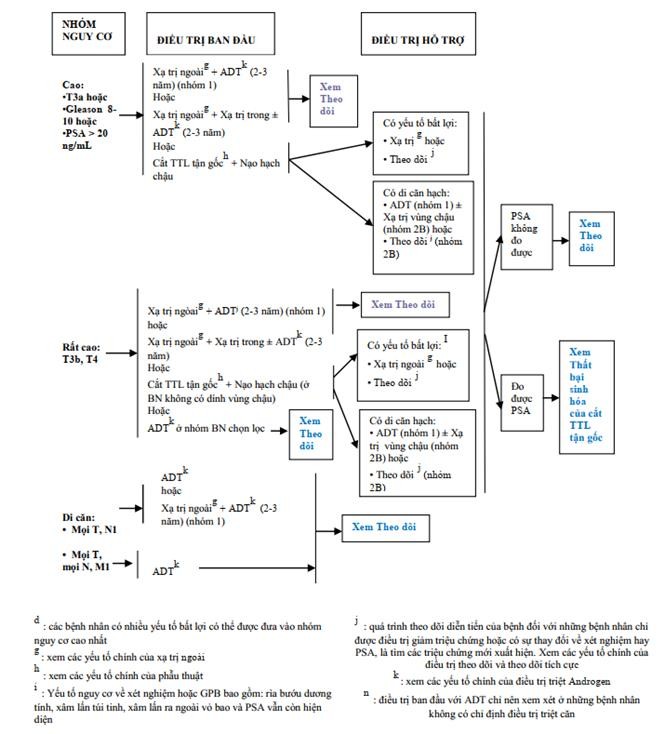
Bệnh nhân này thuộc nhóm nguy cơ rất cao (có di căn xương)
Hướng điều trị nhóm bệnh nhân nguy cơ rất cao/di căn, theo nccn 2.2014
Bệnh nhân này thuộc nhóm nguy cơ rất cao, có di căn, theo NCCN điều trị chủ yếu là liệu pháp triệt androgen (androgen deprivation therapy-ADT) hoặc xạ trị kết hợp ADT.
Dùng nội tiết cách quãng trong ung thư tuyến tiền liệt diễn tiến xa
Chẹn androgen tối đa (MAB) nhằm ức chế toàn bộ androgen của cả tinh hoàn lẫn tuyến thượng thận. Tuy nhiên, hậu quả là các tác dụng phụ gặp trong đa số bệnh nhân sau 3 – 6 tháng.
Khi triệt tiêu androgen liên tục (continuous androgen deprivation-CAD) điều trị ung thư tuyến tiền liệt sau khoảng 24 tháng có sự gia tăng PSA trở lại và phát sinh hiện tượng kháng cắt tinh hoàn (castration resistant prostate cacer – CRPC). Dùng nội tiết cách quãng trên thực nghiệm có thể kéo dài thời gian dẫn đến tình trạng kháng cắt tinh hoàn [9]
Các nghiên cứu pha iii
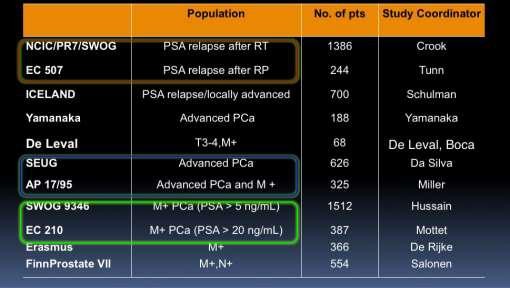
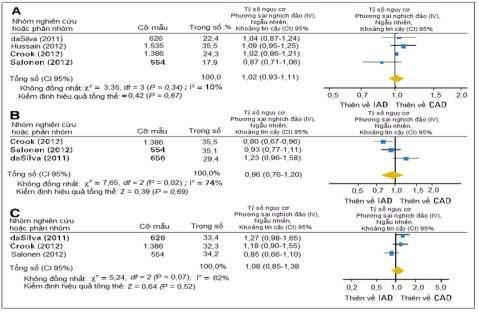
Các nghiên cứu chủ yếu so sánh IAD với CAD: có khoảng 11 thử nghiệm pha III nhưng trong đó chỉ có 3 nghiên cứu chủ lực là của Crook [2], Calais da Silva [1] và Hussain [3,4]
Các nghiên cứu so sánh IAD với CAD về tỉ lệ sống còn toàn bộ (OS) và tỉ lệ sống không tiến triển bệnh (PFS) [10]
|
Nghiên cứu |
|
Bệnh |
Tiến triển |
OS |
|
Miller |
|
Di căn |
= |
= |
|
Tunn |
|
Tái phát sau RP |
= |
NR |
|
Mottet |
|
Di căn |
= |
= |
|
Calais da Silva (SEUG 9401) |
Hỗn hợp |
= |
= |
|
|
Crook/Klotz |
(SWOG JPR.7) |
Tái phát M0 |
+ |
= |
|
Hussain |
(SWOG 9345) |
Di căn |
NR |
Kém hơn |
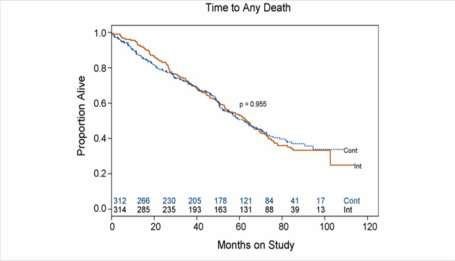
Trong UT TTL tiến triển tại chỗ di căn: Thử nghiệm SEUG 9401 (South European Urooncology Group) [1]
626 bệnh nhân T3-4 M0-1. Khởi đầu 3 tháng điều trị nội tiết theo kiểu MAB. Các BN có PSA 10 ở BN có triêu chứng hoặc PSA > 20 ở BN không triệu chứng; phân nhóm có PSA giảm hơn 80% sẽ bắt đầu điều trị lại khi PSA gia tăng > 20% so với nadir Kết quả: không khác biệt về tỉ lệ sống còn toàn bộ (OS) ở hai nhóm. (Hình 6)
Thử nghiệm SEUG 9401: Không khác biệt về sống còn toàn bộ giữa IAD và CAD trong ung thư TTL diễn tiến xa
Trong tái phát sinh hóa: Thử nghiệm SWOG JPR.7 [2]
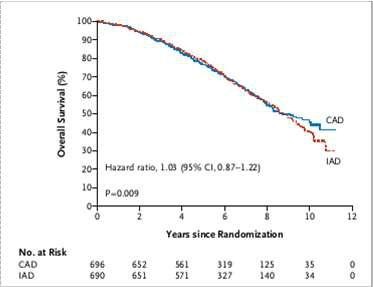
Crook phân ngẫu nhiên 1386 BN có PSA > 3 ng/mL sau xạ trị thành nhóm dùng IAD hay CAD.
Sau 6,9 năm: nhóm điều trị cách quãng tương đương nhóm điều trị liên tục về sống còn toàn bộ (8,8 so với 9,1 năm; HR=1,02, 95% CI, 0,86-1,21) (Hình 7)
Nhiều BN chết vì K TTL ở nhóm điều trị IAD hơn nhưng có nhiều BN chết vì nguyên nhân khác hơn ở nhóm điều trị CAD. Ở nhóm điều trị IAD: triệu chứng yếu mệt, rối loạn chức năng đường tiểu, cơn bừng mặt, ước muốn tình dục, chức năng cương cải thiện hơn
Thử nghiệm SWOG JPR.7. IAD không thua kém CAD về sống còn toàn bộ
Trong ut ttl có di căn:
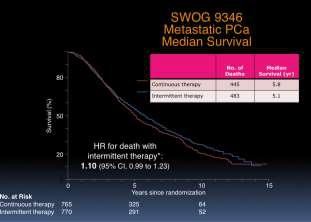
Thử nghiệm SWOG 9346
Hussain và cs đánh giá IAD so với CAD. Sau 7 tháng dùng ADT, 1535 BN có PSA ≤ 4 ng/mL được phân ngẫu nhiên thành điều trị cách quãng hay liên tục. Sau 9,8 năm: OS là 5,1 năm so với 5,8 năm, HR=1,10, 95% CI, 0,99-1,23.
Kết luận: không kết luận được về OS và không loại trừ được nguy cơ tử vong cao hơn 20% ở nhóm điều trị cách quãng. Ở nhóm IAD: chức năng cương và sức khỏe tinh thần tốt hơn sau điều trị 3 tháng nhưng sau đó không còn rõ nữa. (Hình 8)
Thử nghiệm SWOG 9346: Nguy cơ tử vong của nhóm IAD: 1,10
Ước tính gộp về tỉ số nguy cơ (HR) đối với (A) Sống còn toàn bộ (OS), (B) Thời gian dẫn đến tiến triển bệnh (TTP), (C) Sống còn đặc hiệu đối với ung thư (PCaSS): IAD so với CAD [7]
Có thể điều trị nội tiết cách quãng ở những bệnh nhân nào?
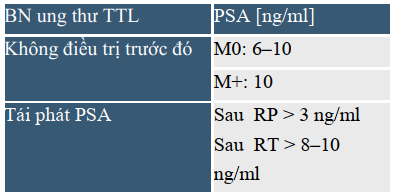
Theo Mottet và cs, 2011 [5], bệnh nhân có đáp ứng với ADT với PSA giảm về trị số bình thường: ở bệnh nhân chưa điều trị trước đó: PSA 4 ng/mL, ở bệnh nhân tái phát PSA sau xạ trị hoặc phẫu thuật : PSA 0,5 ng/mL.
Khi nào dùng lại adt?
Các trị số PSA kích hoạt dùng lại ADT BN ung thư
Nhận xét kết quả điều trị trên bệnh nhân này
Chẩn đoán: UT TTL, giai đoạn cT3b Nx M1, nguy cơ rất cao, có di căn xương.
Từ tháng 11/2008 đến 7/2014: trong thời gian gần 6 năm bệnh nhân đã được điều trị 3 chu kỳ (MAB-ngưng thuốc) và chưa phát sinh tình trạng kháng cắt tinh hoàn. Đây có thể được xem là thắng lợi của IAD vì đã kéo dài thời gian dẫn đến tình trạng káng cắt tinh hoàn.
Mức PSA để ngưng thuốc ở bệnh nhân này (ung thư di căn, chưa điều trị) chỉ cần 4 ng/mL nhưng tôi đã quá dè dặt (ngưng thuốc ở khoảng 0,1 ng/mL). Điều này làm thời gian dùng thuốc của bệnh nhân là khoảng 1 năm, dài hơn so với thời gian khuyến cáo là 6-9 tháng (thời gian hằng định tương đối) [10]. Tương tự, mức PSA để dùng lại MAB ở bệnh nhân này là khoảng 8 ng/mL, khá dè dặt so với khuyến cáo là 10 ng/mL.
Nhận định hiện nay của hướng dẫn điều trị của hội tiết niệu châu âu, 2013
IAD chưa được chứng minh làm kéo dài tình trạng nhạy với điều trị nội tiết hay làm tăng OS
Mặc dù ích lợi về chất lượng cuộc sống là ít hơn sự kỳ vọng (ngoại trừ một số ít nghiên cứu), IAD được dung nạp tốt hơn và có ích lợi về chức năng tình dục.
Các lợi ích lâu dài khác, tuy chưa được chứng minh rõ ràng, có thể là giúp bảo vệ xương và / hoặc giúp tránh hội chứng chuyển hóa.
Trong hầu hết các nghiên cứu, có sự phục hồi testosterone nên đây cũng là cách điều trị thiến cách quãng.
Kết luận
Liệu pháp ức chế androgen cách quãng cho thấy cũng có hiệu quả như liệu pháp ức chế androgen liên tục đồng thời có lợi thế về khả năng dung nạp và chất lượng cuộc sống. Trường hợp lâm sàng này là một bằng chứng hợp lý để khuyến cáo sử dụng liệu pháp cách quãng với điều kiện bệnh nhân đáp ứng một số tiêu chuẩn. Liệu pháp ức chế androgen cách quãng đã dần được đưa vào các phiên bản hướng dẫn điều trị mới nhất của Hiệp hội Tiết niệu châu Âu và NCCN 2.2014, tuy vẫn còn dè dặt.
Tài liệu tham khảo
Calais da Silva F et al, Intermittent androgen deprivation for locally advanced and metastatic prostate cancer: results from a randomised phase 3 study of the South European Uroncological Group. Eur Urol 2009; 55-1269-77
Crook J.M. et al. Intermittent androgen suppression for rising PSA level after radiotherapy. N Engl J Med, Sept 2012, 367:895-903.
Hussain M. et al. Intermittent (IAD) versus continuous androgen deprivation (CAD) in hormone sensitive metastatic prostate cancer patients: Results of SWOG 9346 (INT-0162), an international phase III trial. ASCO 2012.
Hussain M. et al. Commentary on « Intermittent versus continuous androgen deprivation in prostate cancer » . N Engl J Med 2013;368(14):1314-25
Mottet et al. EAU guidelines on prostate cancer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cancer. Eur Urol 2011; 59: 572-583;
NCCN Clinical practice Guidelines in Oncology, Prostate cancer.Version 2.2014.
Niraula S., Le LVV, Tannock IF. Treatment of prostate cancer with intermittent versus continuous androgen deprivation: a systematic review of randomized trials. J Clin Oncol 2013 Jun 1;31(16):2029-36.
Guidelines on Prostate cancer. EAU 2013
Sato N, Gleave ME, Bruchovsky N, Rennie PS, Goldenberg SL, Lange PH, Sullivan LD. Intermittent androgen suppression delays progression to androgen-independent regulation of prostate-specific antigen gene in the LNCaP prostate tumour model. J Steroid Biochem Molec Biol 1996 May;58(2):139-46.
Tunn U. et al. The current status of intermittent androgen deprivation (IAD) therapy for prostate cancer: putting IAD under the spotlight. BJU Int 2007;99 (Suppl 1):19-22;