Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (ARDS) là phản ứng nhanh chóng và thảm khốc của phổi đối với một chấn thương dẫn đến suy hô hấp nặng, thiếu oxy. Định nghĩa hiện tại của Berlin định nghĩa ARDS là một quá trình xảy ra trong vòng 7 ngày kể từ khi bị tổn thương lâm sàng đã biết, biểu hiện bằng các hình ảnh mờ hai bên trên hình ảnh ngực và biểu hiện với tình trạng thiếu oxy với tỷ lệ PaO2/FiO2 300 mm Hg. Định nghĩa phân loại thêm mức độ nghiêm trọng của ARDS dựa trên tỷ lệ PaO 2/FiO 2 .1,2 Bệnh nhân mắc ARDS chiếm 10% nhập viện tại khoa chăm sóc đặc biệt (ICU), gần 25% bệnh nhân được thở máy và có tỷ lệ tử vong 40%.3 Thông khí cơ học là một công cụ thiết yếu trong xử trí ARDS, và trong chương này, chúng tôi xem xét các bằng chứng xung quanh các chiến lược thông khí cơ học và các liệu pháp bổ trợ cho ARDS.
Tổn thương gây ra do máy thở
Trong ARDS, thở máy hỗ trợ trao đổi khí và cho phép hệ hô hấp nghỉ ngơi trong khi phổi phục hồi sau chấn thương. Tuy nhiên, việc áp dụng thở máy không phù hợp có thể làm tổn thương nặng hơn.4 Trước khi thảo luận về bằng chứng lâm sàng về thở máy trong ARDS, chúng tôi xem xét các cơ chế mà tổn thương phổi do máy thở (VILI) có thể phát triển.
Volutrauma
Trong quá trình thở máy, chấn thương có thể xảy ra do quá căng phế nang theo chu kỳ (volutrauma) với áp lực hít vào tăng cao. Dreyfuss et al.5 nhận thấy rằng thông khí thể tích cao dẫn đến tổn thương phổi nhiều hơn khi so sánh với các chiến lược áp lực đường thở cao và thể tích thấp hơn, cho thấy chấn thương trong mô hình này là do căng giãn phổi. Webb và Tierney6 cho thấy rằng thông khí với áp lực hít vào đỉnh rất cao cũng gây ra thương tích do quá căng. Tuy nhiên, đó không phải là áp lực đường thở tuyệt đối, mà là áp lực xuyên phổi (áp lực phế nang trừ áp lực màng phổi) là áp lực căng thực sự của phổi và là áp lực gây ra tổn thương.7-11
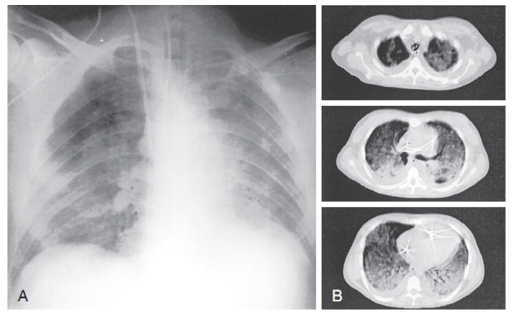
Trong ARDS, phổi bao gồm các khu vực sục khí (aerated) bình thường, sục khí kém (poorly aerated), không sục khí (nonaerated) và quá căng.12,13 Mặc dù thành phần phổi sục khí bình thường, hoặc “phổi trẻ em”, vẫn bị viêm, nhưng nó vẫn còn chức năng, có thể huy động và độ giãn nở gần như bình thường; kích thước của nó tương quan nghịch với mức độ ARDS (Hình 16.1).14 Thành phần nhỏ này chịu stress và strain khi thở máy, giải thích tại sao áp lực cao và thể tích lớn có thể gây ra VILI.15,16
Atelectrauma
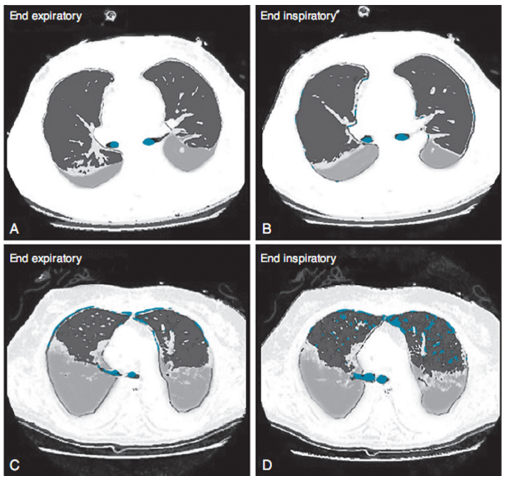
Hiện tượng xẹp phổi là một đặc điểm bệnh lý phổ biến trong ARDS và có thể góp phần vào một dạng VILI khác, được gọi là atelec-trauma.17 Trong quá trình thông khí, việc mở và đóng các đường thở bị xẹp phổi này đòi hỏi lực cao và ứng suất cắt ( shear stress) gây ra có thể dẫn đến chấn thương.7 Hơn nữa, sự xẹp phổi làm giảm kích thước của phổi em bé, nó cũng làm tăng tác dụng của volutrauma (Hình 16.2).18-20
Tổn thương phổi do bệnh nhân tự gây ra
Tổn thương phổi do bệnh nhân tự gây ra (P-SILI, Patient self-inflicted lung injury) là một dạng VILI do hô hấp tự phát của bệnh nhân. Như đã đề cập trước đó, áp lực xuyên phổi là áp lực thực sự của phổi. Khi kết hợp với hơi thở áp lực dương, hơi thở tự nhiên (áp lực âm) sẽ làm giảm áp lực màng phổi, tăng áp lực xuyên phổi. Hơi thở tự phát cũng có thể gây ra rối loạn đồng bộ máy thở, có thể dẫn đến việc cung cấp thể tích khí lưu thông lớn hơn và áp lực xuyên phổi cao hơn. P-SILI cũng có thể được điều khiển bởi một hiện tượng gọi là Pendelluft, hay không khí thông nối. Trong phổi khỏe mạnh, lưu lượng qua đường thở và phổi là đồng nhất, những thay đổi về áp lực màng phổi được phân bổ đều và thông khí là đồng nhất. Trong ARDS, phổi là không đồng nhất, và lưu lượng qua đường thở cũng vậy. Khi có hơi thở tự phát, những thay đổi về áp lực màng phổi không được truyền qua phổi một cách đồng đều, dẫn đến sự bơm phồng phổi khác nhau ở các vùng phổi nơi không khí lưu thông từ vùng này sang vùng khác (ví dụ, Pendelluft) và quá căng phế nang vùng có thể gây tổn thương.23-25
Thông khí bảo vệ phổi
Thuật ngữ thông khí bảo vệ phổi dùng để chỉ thông khí thể tích khí lưu thông thấp hơn (LTV, low tidal volume) và áp lực hít vào hạn chế. Trong nghiên cứu quan trọng về thông khí bảo vệ phổi, nhóm LTV được thông khí với thể tích khí lưu thông mục tiêu là 6 mL/kg (dao động từ 4 đến 8 mL/kg) trong khi duy trì áp lực cao nguyên (Pplat) dưới 30 cm H2O; nhóm thể tích khí lưu thông truyền thống được thông khí với thể tích khí lưu thông 12 ml/kg PBW (trọng lượng cơ thể dự đoán) và Pplat 27 Áp lực dương cuối thì thở ra (PEEP) và FiO2 ở cả hai nhóm được chuẩn độ theo cùng một giao thức. Thể tích khí lưu thông trung bình ± độ lệch chuẩn (SD) trong các ngày 1-3 của nghiên cứu lần lượt là 6,2 ± 0,8 mL/kg PBW và 11,8 ± 0,8 mL/kg PBW trong các nhóm LTV và truyền thống.
Hình 16.1 Chụp X-quang ngực (A) và chụp cắt lớp vi tính (CT) quét (B) cho thấy những thay đổi phổi không đồng nhất ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS).
Hình 16.2 Chụp cắt lớp (CT) quét các lát cắt của bệnh nhân có thành phần “phổi em bé” lớn hơn khi thở ra (A) và cuối thì hít vào (B). Một bệnh nhân có thành phần “phổi em bé” nhỏ hơn khi thở ra (C) với quá căng phồng của thành phần phổi được sục khí trước đây sau khi bơm phồng với phân phối thể tích khí lưu thông (D) được hiển thị.
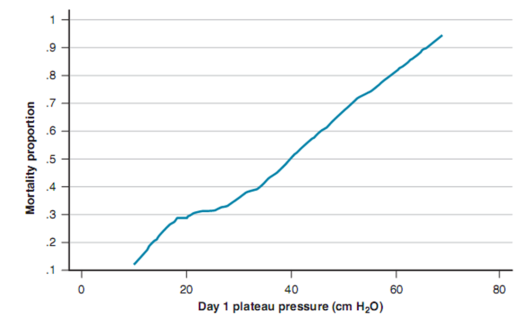
Hình 16.3 Biểu đồ cho thấy tỷ lệ tử vong giảm liên quan đến mức áp lực cao nguyên (Pplat) thấp hơn vào ngày 1 ở những bệnh nhân mắc ARDS; không có ngưỡng Pplat an toàn có thể xác định rõ ràng.
Giá trị trung bình của ±SD của Pplat lần lượt là 25 ± 6 và 33 ± 8 cm trong nhóm LTV và nhóm truyền thống. Nghiên cứu đã được dừng lại sớm sau khi 861 bệnh nhân được chọn ngẫu nhiên vì nhóm LTV có tỷ lệ tử vong là 31,0% so với 39,8% ở nhóm thể tích khí lưu thông truyền thống, với mức giảm nguy cơ tuyệt đối là 8,8% và số lượng cần điều trị (NNT, number needed to treat) là 11 (P
Các phân tích thứ cấp của thử nghiệm ARMA cho thấy rằng có một lợi ích liên quan đến việc giảm thể tích khí lưu thông, ngay cả khi Pplat tương đối thấp và cho thấy Pplat dự đoán độc lập tỷ lệ tử vong khi thể tích khí lưu thông không đổi (Hình 16.3).28,29
VILI vẫn có thể xảy ra, mặc dù ta có tuân thủ nghiêm ngặt việc bảo vệ phổi và việc giảm thêm thể tích khí lưu thông có thể có lợi,4,20,30 nhưng thể tích khí lưu thông rất thấp có thể dẫn đến nhiễm toan hô hấp.31 Loại bỏ carbon dioxide ngoài cơ thể (ECCO2-R, Extracorporeal carbon dioxide removal) đã được đề xuất như là một biện pháp bổ sung có thể để thông khí bảo vệ phổi với thể tích khí lưu thông cực thấp (32-35 Các nghiên cứu lâm sàng sớm đã cho thấy một số hứa hẹn, nhưng bằng chứng vẫn chưa đủ để áp dụng rộng rãi.36,37 May mắn thay, thông khí bảo vệ với thử nghiệm Protective Ventilation With Veno-Venous Lung Assist in Respiratory Failure (REST) và thử nghiệm Strategy of Ultraprotective Lung Ventilation With Extracorporeal CO2 Removal for New-Onset Moderate to Severe ARDS (SUPERNOVA) hiện đang được tiến hành.
Tối ưu hóa peep và thủ thuật huy động
Một cách tiếp cận phổi mở bao gồm mức PEEP cao hơn và thủ thuật huy động (RM, recruitment maneuvers) có thể cải thiện trao đổi khí bằng cách tăng thể tích phổi cuối thì hít vào, giảm stress và strain phổi, và giảm thiểu ảnh hưởng của atelectrauma.26,38-40
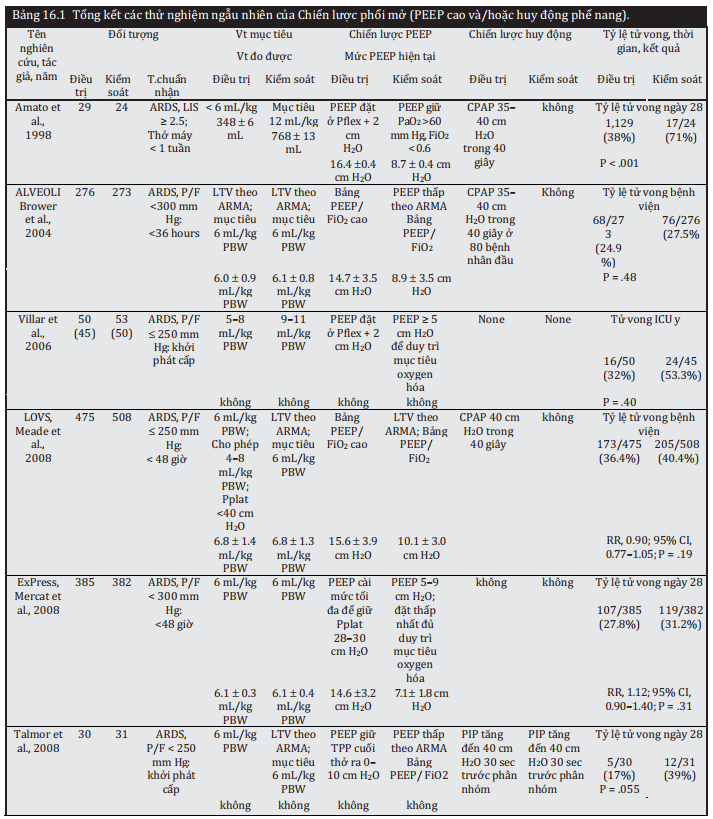
Amato et al.41 và Villar et al.42 cho thấy các chiến lược thông khí với mức PEEP cao hơn có liên quan đến việc giảm tỷ lệ tử vong khi so sánh với các chiến lược có mức PEEP thấp hơn. Tuy nhiên, những phát hiện này đã bị nhầm lẫn bởi việc sử dụng đồng thời thể tích khí lưu thông cao hơn trong các nhóm PEEP thấp hơn.
Thử nghiệm Assessment of Low Tidal Volume and Elevated End-Expiratory Pressure to Obviate Lung Injury trial (ALVEOLI) so sánh các chiến lược chuẩn độ PEEP/FiO2 cao và PEEP/FiO2 thấp.43 Tất cả những người tham gia nghiên cứu cũng được thở máy với LTV. Nghiên cứu này đã được dừng lại sớm vì vô ích và cho thấy không có sự khác biệt về tỷ lệ tử vong tại bệnh viện giữa các nhóm PEEP thấp hơn và PEEP cao hơn.
Nghiên cứu Expiratory Pressure Study (ExPress) đã so sánh chiến lược giảm ap1lu75c căng tối thiểu với chiến lược huy động gia tăng.44 Thử nghiệm này cũng được dừng lại sớm và cho thấy không có sự khác biệt về tỷ lệ tử vong trong 28 ngày giữa các nhóm. Tuy nhiên, nhóm huy động gia tăng đã có nhiều ngày không có máy thở hơn: 7 (phạm vi liên phân vị [IQR] 0-19) so với 3 (IQR 0-17); P = .004.
Trong nghiên cứu Lung Open Ventilation Study (LOVS) , một giao thức thông khí kinh điển với PEEP thấp hơn được so sánh với một giao thức phổi mở bao gồm các giá trị PEEP cao hơn và RM và không có sự khác biệt có ý nghĩa thống kê về tỷ lệ tử vong giữa các nhóm.
Một phân tích tổng hợp dữ liệu bệnh nhân riêng lẻ từ các thử nghiệm ALVEOLI, ExPress và LOVS cho thấy ở những bệnh nhân mắc ARDS từ trung bình đến nặng (với tỷ lệ PaO 2/FiO2 ngưỡng 200 mm Hg), các chiến lược PEEP cao hơn được liên kết với tỷ lệ tử vong thấp hơn (34,1 so với 39,1%; nguy cơ tương đối [RR] 0,90; khoảng tin cậy 95% [CI] 0,81-1,00; P = .49) .46 Một phân tích thứ cấp khác về các thử nghiệm ExPress và LOVS cho thấy bệnh nhân đáp ứng với PEEP tăng với quá trình oxy hóa được cải thiện có tỷ lệ tử vong thấp hơn, và sự kết hợp này mạnh hơn ở những bệnh nhân mắc ARDS nặng, với PaO2/FiO2 150 mm Hg.47
RM liên quan đến sự gia tăng tạm thời áp lực xuyên phổi đến mức cao hơn mức đạt được trong thông khí thông thường và có thể mang lại lợi ích sinh lý tương tự như PEEP.16,48-50 Một số nghiên cứu lâm sàng về RM đã được thực hiện và hai phân tích thứ cấp về các nghiên cứu này cho biết RM có liên quan đến việc giảm tỷ lệ tử vong đáng kể (RR 0,81; KTC 95% 0,69-0,95; I 2 = 6%).26,51
Thử nghiệm Alveolar Recruitment in ARDS Trial (ART) ngẫu nhiên, đa trung tâm, đã so sánh một giao thức RM và chuẩn độ PEEP với giao thức PEEP thấp hơn.52 Điều đó cho thấy rằng RM với chuẩn độ PEEP dẫn đến tăng tỷ lệ tử vong trong 28 ngày (55,3 so với 49,3%; P = .041), tăng tỷ lệ tử vong trong 60 ngày (65,3 so với 59,9%; P = 0,04) và ít ngày không thở máy hơn (5,3 so với 6,4%; P = .03).
Không giống như một số nghiên cứu lâm sàng khác, RM trong thử nghiệm ART chỉ dẫn đến những cải thiện khiêm tốn về độ giãn nở phổi và giảm áp lực đẩy.52-54 Ngoài ra, thử nghiệm ART không bao gồm đánh giá đáp ứng cơ bản với PEEP. Điều này rất quan trọng, vì khả năng huy động ở bệnh nhân mắc ARDS rất khác nhau và có thể bị ảnh hưởng bởi mức độ nghiêm trọng của bệnh và đáp ứng oxygen hóa đối với tăng PEEP 16,46,47,55
Ngoài ra, những bệnh nhân có các kiểu phụ viêm khác nhau của ARDS có thể có các biểu hiện lâm sàng khác nhau để đáp ứng với mức PEEP cao hơn. Trong một phân tích thứ cấp của những người tham gia thử nghiệm của AVEOLI, Calfee et al.56 đã chỉ ra rằng những bệnh nhân có kiểu hình viêm ARDS cao hơn đáp ứng với PEEP cao hơn với tỷ lệ tử vong thấp hơn và ngày không có máy thở và ngày không có suy cơ quan ít hơn so với kiểu hình ít viêm hơn.
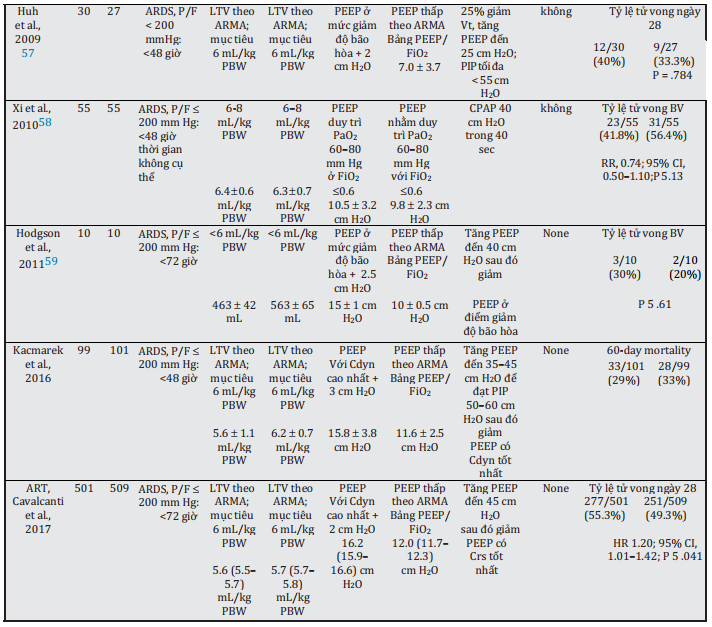
Một bản tóm tắt chi tiết về các thử nghiệm đã nói ở trên về cách tiếp cận phổi mở trong ARDS được trình bày trong Bảng 16.1 .
Áp lực đẩy
Trong ARDS, khái niệm về “phổi trẻ em” cung cấp một lý do hợp lý cho lợi ích tử vong liên quan đến thông khí LTV.14,27,41 Gần như tất cả các nghiên cứu về LTV phân phối thể tích dựa trên PBW, được tính toán dựa trên chiều cao. Cách tiếp cận này giả định rằng phổi còn lại tùy thuộc vào chiều cao, nhưng có thể phù hợp hơn để cung cấp một thể tích tương ứng với phổi chức năng còn lại, hoặc thành phần “phổi trẻ em”.60 Độ giãn nở của hệ hô hấp được tính là thể tích khí lưu thông chia cho sự thay đổi áp lực (Pplat trừ PEEP). Trong ARDS, độ giãn nở của hệ hô hấp tương quan với lượng phổi chức năng: do đó, độ giãn nở ước tính kích thước của “phổi trẻ em”.61 Áp lực đẩy có thể được hiểu là thể tích khí lưu thông được bình thường hóa theo độ giãn nở của hệ hô hấp (tức là phổi trẻ em) và có thể được tính toán lâm sàng bằng Pplat trừ PEEP. 60 Khi phổi được huy động, PEEP tăng nên giảm áp lực đẩy, nhưng khi phổi không được huy động, PEEP tăng sẽ dẫn đến quá căng và sẽ tăng áp lực đẩy.16
Trong một nghiên cứu về dữ liệu bệnh nhân riêng lẻ từ chín thử nghiệm ARDS, Amato et al. 60 cho thấy áp lực đẩy cao hơn có liên quan đến tỷ lệ tử vong tăng. Tuy nhiên, mối quan hệ này chỉ được thử nghiệm ở những bệnh nhân đang sử dụng LTV và thở một cách thụ động trong quá trình đo Pplat được sử dụng để tính áp lực đẩy. Guérin et al.62 cho thấy mối quan hệ tương tự giữa áp lực đẩy và tỷ lệ tử vong của hai thử nghiệm khác. Schmidt et al.63 đã xác nhận những phát hiện này một lần nữa trong một nghiên cứu hồi cứu những bệnh nhân không tham gia vào bất kỳ thử nghiệm nào. Điều quan trọng cần lưu ý là tất cả các nghiên cứu này đều là quan sát và không có thử nghiệm can thiệp thông khí nào được điều chỉnh theo áp lực đẩy vẫn chưa được thực hiện.
Phương thức thông khí
Thông khí nhắm mục tiêu theo thể tích so với áp lực
Trong các chế độ nhắm mục tiêu theo thể tích, thể tích khí lưu thông và lưu lượng hít vào tối đa được đặt bởi bác sĩ lâm sàng, và áp lực đường thở và áp lực đẩy có thể thay đổi theo sự thay đổi của độ giãn nở phổi.64,65 Tuy nhiên, tăng nỗ lực của bệnh nhân và nhịp thở chồng (breath-stacking) do mất đồng bộ (dyssynchrony) bệnh nhân – máy thở có thể dẫn đến việc cung cấp thể tích khí lưu thông cao hơn giá trị cài đặt.66,67 Trong các chế độ nhắm mục tiêu áp lực, bác sĩ lâm sàng đặt áp lực đẩy; thể tích và lưu lượng khí lưu thông thay đổi theo sự thay đổi trong độ giãn nở hệ hô hấp và nỗ lực của bệnh nhân.68,69
Hai tổng quan hệ thống và phân tích tổng hợp của 34 nghiên cứu và 3 thử nghiệm so sánh các chế độ thông khí nhắm mục tiêu theo thể tích và áp lực không tìm thấy mối liên quan giữa chế độ máy thở và kết quả lâm sàng.22,70
Xem xét các bằng chứng có sẵn, không rõ liệu các chế độ nhắm mục tiêu theo thể tích hoặc nhắm mục tiêu áp lực là vượt trội để thông khí cho bệnh nhân mắc ARDS. Bất kể chế độ đã chọn, điều quan trọng là phải hiểu làm thế nào thay đổi mức độ nghiêm trọng của ARDS và độ giãn nở phổi có thể ảnh hưởng đến biến phụ thuộc trong mỗi chế độ. Khi sử dụng các chế độ nhắm mục tiêu theo thể tích, điều quan trọng là phải đo Pplat thường xuyên và khi sử dụng các chế độ nhắm mục tiêu áp lực, các thể tích khí lưu thông phải được theo dõi chặt chẽ để đảm bảo rằng các giá trị này vẫn nằm trong giới hạn của thông khí bảo vệ phổi.
Hơi thở tự phát
Trong một số trường hợp, thông khí có kiểm soát có thể liên quan đến tăng nguy cơ gây hại và điều này có thể được giảm nhẹ bằng cách sử dụng thở tự nhiên được hỗ trợ. Trong trường hợp không có bất kỳ hô hấp tự phát nào, việc không hoạt động cơ hoành có thể gây ra teo cơ và có thể dẫn đến cai máy kéo dài từ hỗ trợ thông khí.71-74 Hô hấp tự phát cũng có thể cải thiện sự phù hợp thông khí – tưới máu thông qua huy động phổi. 75 Thông khí áp lực dương kiểm soát tốt nhất là thông khí cho các phần trước và đỉnh của phổi, khiến các vùng phụ thuộc thông khí kém có xu hướng dễ bị xẹp phổi hơn,17,76-78 trong khi co thắt cơ hoành trong thông khí tự phát giúp cải thiện tình trạng thông khí ở các phân đoạn phụ thuộc thường được tưới máu tốt, giảm tình trạng xẹp phổi. 79,80
Trong một nghiên cứu quan sát trên 48 bệnh nhân được thở máy có kiểm soát, Cereda et al.81 cho thấy 79% bệnh nhân dung nạp chuyển sang thở máy hỗ trợ áp lực (PSV) không có sự khác biệt về oxy hoặc tử vong giữa bệnh nhân dung nạp PSV và những người cần quay lại thông khí kiểm soát. Trong một thử nghiệm trên 30 bệnh nhân có nguy cơ bị ARDS, Putensen và cộng sự82 cho thấy bệnh nhân được phép thở tự nhiên bằng thông khí giải phóng áp lực đường thở (APRV, airway pressure release ventilation) có nhiều ngày không thở máy hơn và thời gian lưu lại ICU ngắn hơn so với bệnh nhân bị thông khí kiểm soát áp lực với phong tỏa thần kinh cơ.
Trong một thử nghiệm với 138 bệnh nhân mắc ARDS được thở máy hoặc bằng APRV hoặc thông khí kiểm soát hỗ trợ thể tích, Zhou et al. cho thấy APRV dẫn đến nhiều ngày không có máy thở hơn (19 [IQR 8-22] so với 2 [IQR 8-22]; P 83 Tuy nhiên, bệnh nhân được thở máy với kiểm soát hỗ trợ thể tích bị viêm phổi và các bệnh kèm theo khác, bao gồm cả bệnh phổi tắc nghẽn mạn tính, và cũng bị sốc nhiều hơn khi cần dùng thuốc vận mạch.84
Bệnh nhân tham gia vào các nghiên cứu này có ARDS nhẹ đến trung bình. Như đã thảo luận trước đó, trong trường hợp thở tự nhiên nghiêm trọng ARDS có thể dẫn đến pendelluft, có thể gây ra VILI.23-25 Do đó, lợi ích có liên quan đến việc thở tự nhiên được hỗ trợ có thể nên giới hạn ở những bệnh nhân mắc bệnh từ nhẹ đến trung bình và có thể thực sự có hại trong ARDS nghiêm trọng.73
Bằng chứng có sẵn cho đến nay là không đủ để đưa ra các khuyến nghị dứt khoát là cho hoặc chống lại việc sử dụng hơi thở tự nhiên được hỗ trợ trong ARDS nhẹ đến trung bình. Tuy nhiên, thử nghiệm Early Spontaneous Breathing in ARDS (BiRDS), so sánh nhịp thở tự nhiên với APRV so với thông khí nhắm mục tiêu theo thể tích được kiểm soát, đang diễn ra và có thể cung cấp nhiều hơn về vai trò được hỗ trợ tự phát thông khí trong thông khí ARDS.
Thông khí dao động tần số cao
Trong quá trình thông khí dao động tần số cao ( HFOV, high-frequency oscillatory ventila-tion), áp lực đường thở trung bình cao được áp dụng cho phổi và thể tích khí lưu thông rất nhỏ, thường là 1-3 mL/kg, được cung cấp bởi một màng ngăn dao động ở tốc độ 3-15 Hz, hoặc 180 – 900 hơi thở mỗi phút.85-88 Về mặt lý thuyết, đây nên là một cách tiếp cận lý tưởng để giảm thiểu VILI trong ARDS. Thể tích khí lưu thông nhỏ có thể ngăn ngừa volutrauma, áp lực đường thở trung bình cao có thể huy động phổi và ngăn ngừa atelectrauma, và tránh sự thay đổi áp lực hít vào cao có thể ngăn ngừa barotrauma.40,89
Hai thử nghiệm đầu tiên ở những bệnh nhân mắc ARDS với tỷ lệ PaO2/FiO2 ≤ 300 mm Hg cho thấy rằng không có sự khác biệt về mặt tử vong và ngày không thở máy khi HFOV được so sánh với thở máy kiểm soát áp lực, cho thấy HFOV an toàn khi sử dụng trong ARDS.90,91 Tuy nhiên, các nhóm kiểm soát trong các thử nghiệm này không nhận được thông khí LTV.
Vào năm 2013, Ferguson và cộng sự đã báo cáo kết quả của thử nghiệm HFOV đối với ARDS được điều trị sớm (OSCILLATE) so sánh HFOV với thông khí bảo vệ phổi với thể tích khí lưu thông PBW 6 ml/kg, Pplat ≤ 35 cm H2O và PEEP cao ở những bệnh nhân mắc ARDS có tỷ lệ PaO2/FiO2 ≤ 200 mm Hg. Thử nghiệm đã bị dừng lại sau khi 548 trong số 1200 bệnh nhân được lên kế hoạch đã được chọn ngẫu nhiên do tín hiệu gây hại trong nhóm HFOV. Tỷ lệ tử vong tại bệnh viện là 47% ở nhóm HFOV và 35% ở nhóm đối chứng (nguy cơ tuyệt đối 12%; RR 1,33, 95% CI 1,12-1,79; P = 0,04).
Đồng thời, Young et al.93 đã báo cáo kết quả của thử nghiệm HFOV đa trung tâm lớn trong thử nghiệm ARDS (OSCAR) so sánh HFOV và thông khí bảo vệ phổi thông thường ở bệnh nhân ARDS với tỷ lệ PaO2/FiO2 ≤ 200 mmHg. Thử nghiệm bao gồm 789 bệnh nhân và không tìm thấy sự khác biệt về tỷ lệ tử vong trong 30 ngày (41,7 so với 41,1%; P = .85).
Trong thử nghiệm OSCILLATE, chiến lược thông khí thông thường đã được giao thức hóa nghiêm ngặt, trong khi các bệnh nhân trong nhánh thông thường của thử nghiệm OSCAR được quản lý theo thông lệ địa phương. Do đó, thể tích khí lưu thông trong nhóm kiểm soát của thử nghiệm OSCILLATE nhỏ hơn so với thử nghiệm OSCAR (6.1 ± 1.3 mL/kg PBW so với 8.3 ± 2.9 mL/kg PBW) và mức PEEP cao hơn trong thử nghiệm OSCILLATE ( 18 ± 3,2 cm H2O so với 11,4 ± 3,6 cm H2O).94
Hai phân tích tổng hợp các thử nghiệm kiểm tra HFOV cho thấy rằng không có lợi ích gì khi sử dụng HFOV so với thông khí bảo vệ phổi thông thường và cho rằng HFOV thực sự có thể gây hại.26,95 Tuy nhiên, phân tích tổng hợp dữ liệu bệnh nhân cá nhân gần đây cho thấy sự không đồng nhất đáng kể của hiệu quả điều trị với HFOV so với thông khí thông thường, với tỷ lệ PaO2/FiO2 cơ bản là một công cụ điều chỉnh hiệu quả quan trọng.96 Bệnh nhân bị thiếu oxy nặng có lợi ích từ HFOV, trong khi những người có ARDS vừa phải có thể bị tổn hại.
Thuốc chẹn thần kinh cơ
Hít thở tự nhiên trong ARDS có thể liên quan đến tăng áp lực xuyên phổi, quá căng phổi vùng do pendelluft và cung cấp thể tích khí lưu thông cao hơn mục tiêu do tăng nỗ lực của bệnh nhân và mất đồng bộ máy thở.23-25,66,73 Thuốc ức chế thần kinh cơ (NMBA) đã được sử dụng trong nhiều thập kỷ cho thiếu oxy máu kháng trị, rối loạn đồng bộ máy thở và giảm độ giãn nở hệ hô hấp.97,98
Các thử nghiệm ban đầu của NMBA cho thấy rằng việc truyền cisatracurium trong 48 giờ đã dẫn đến tăng oxy ở bệnh nhân mắc ARDS với tỷ lệ PaO2/FiO2 ≤150 mm Hg (P = .021) 99 và với tỷ lệ PaO2/FiO2 ≤200 mm Hg (P 100 Tuy nhiên, những nghiên cứu này không được cung cấp để phát hiện kết quả lâm sàng.
Thử nghiệm lớn nhất được công bố cho đến nay về việc sử dụng NMBA trong ARDS là thử nghiệm ARDS et Curarisation Systematique (ACURASYS) trên 340 bệnh nhân mắc ARDS với tỷ lệ PaO2/FiO2 ≤150 mmHg trong vòng 48 giờ kể từ khi phát bệnh.101 Tất cả bệnh nhân được cho an thần sâu và được thông khí bảo vệ phổi.27 Bệnh nhân trong nhóm NMBA được dùng cisatracurium dưới dạng bolus 15 mg sau đó truyền liên tục 37,5 mg/giờ trong 48 giờ. Bệnh nhân trong nhóm đối chứng được tiêm bolus và truyền liên tục một giả dược giống hệt nhau. Mặc dù không có sự khác biệt về tỷ lệ tử vong trong 90 ngày giữa NMBA và giả dược (40,7 so với 48,8%; P = 0,08), NMBA giảm tỷ lệ tử vong trong 90 ngày khi điều chỉnh tỷ lệ PaO2/FiO2, Pplat và mức độ nghiêm trọng của điểm bệnh (điều chỉnh tỷ lệ nguy hiểm [HR] cho tử vong 0,68; 95% CI 0,48-0,98; P = .04). Nhóm NMBA cũng có nhiều ngày không có máy thở hơn vào ngày 28 (P = .03) và ngày 90 (P = .04). Họ cũng cho thấy không có sự khác biệt trong yếu cơ do ICU theo quy định của thang đo của Hội đồng nghiên cứu y tế.
Một đánh giá có hệ thống và phân tích tổng hợp của ba thử nghiệm này cho thấy NMBA với cisatracurium có nguy cơ tử vong thấp hơn sau 28 ngày (RR 0,66; 95% CI 0,50-0,87; P = .003; I2 = 0; NNT = 7 ) .102
Các bệnh nhân trong nhóm kiểm soát của thử nghiệm ACURASYS cũng bị an thần sâu và đây không phải là đại diện của thực hành thông thường và có thể làm nhiễu kết quả của thử nghiệm.103,104 Mức độ an thần trong nhóm đối chứng là một trong những yếu tố khiến được đánh giá trong thử nghiệm Re-evaluation of Systemic Early Neuromuscular Blockade (ROSE).105 Thử nghiệm này bao gồm các bệnh nhân mắc ARDS với tỷ lệ PaO 2/FiO2
Tư thế
Ở một bệnh nhân nằm ngửa, áp lực dương từ máy thở nâng thành ngực trên (bụng), nhưng có tác dụng tối thiểu lên thành ngực dưới (lưng).106 Khi ở tư thế nằm sấp, áp lực dương nâng lên thành ngực, nhưng vì thành ngực không độ giãn nở, có sự giảm độ giãn nở tổng thể của thành ngực, dẫn đến di động cơ hoành.107 Bởi vì phổi lưng lớn hơn phổi bụng, huy động vùng phổi lưng vượt quá mất huy động vùng phổi bụng, cải thiện thông khí tổng thể và tăng độ giãn nở phổi.108,109 Ngoài tác dụng của cơ học thành ngực, trọng lực cũng gây ra chèn ép phổi khi bệnh nhân nằm ngửa.110 Tim kết hợp với phổi phù nề nặng trong ARDS, làm tăng độ chênh lệch áp lực màng phổi giữa bụng-lưng và gây ra xẹp phổi, có thể giảm do tư thế nằm sấp.107,111-113 Vì lưu lượng máu phổi phần lớn không thay đổi ở tư thế nằm sấp, thông khí phổi được cải thiện cũng giúp cải thiện tình trạng tưng xứng thông khí – tưới máu.114,115
Các thử nghiệm lâm sàng sớm cho thấy việc tư thế nằm sấp trong 6, 8 và 20 giờ ở những bệnh nhân có tỷ lệ ARDS và PaO2/FiO 2 116-118
Sau đó, Guérin et al.119 đã công bố kết quả của thử nghiệm large Effect of Prone Positioning on Mortality in Patients with Severe Acute Respiratory Distress Syndrome (PROSEVA) . Thử nghiệm bao gồm 466 bệnh nhân mắc ARDS nặng với tỷ lệ PaO2/FiO2
Hai phân tích tổng hợp gần đây về các thử nghiệm tư thế nằm sấp không có lợi ích tử vong chung liên quan đến tư thế nằm sấp nhưng đã báo cáo rằng can thiệp có liên quan đến tỷ lệ tử vong thấp hơn khi áp dụng hơn 12 giờ mỗi ngày ở bệnh nhân mắc ARDS từ trung bình đến nặng với PaO2/FiO2 26,120
Điều thú vị là, quá trình oxy hóa được cải thiện với tư thế nằm sấp ảnh hưởng ở những người tham gia thử nghiệm PROSEVA không dự đoán được sự sống sót, cho thấy rằng việc giảm tỷ lệ mắc bệnh không chỉ do cải thiện oxy, mà nhiều khả năng là do giảm VILI.119,121 Thông khí được cải thiện trong quá trình nằm sấp dẫn đến phân phối thể tích khí lưu thông đồng đều hơn, thậm chí áp lực xuyên phổi cao hơn và có thể tạo điều kiện cho việc huy động bền vững với việc áp dụng PEEP.122,123 Việc sục khí đồng nhất hơn cũng làm giảm căng phồng phổi khu vực và giảm diện tích của các đơn vị phổi mở và đóng, giảm barotrauma và atelectrauma.106,109,124
khuyến cáo của tác giả
Bệnh nhân mắc ARDS phải được thông khí với thể tích khí lưu thông thấp nhắm mục tiêu 6 ml/kg PBW (phạm vi 4-8 mL/kg PBW) và Pplat nên được duy trì dưới 30 cm H2O.
Chúng tôi đề xuất các chiến lược PEEP cao hơn ở những bệnh nhân mắc ARDS từ trung bình đến nặng. Thao tác huy động có thể được sử dụng thận trọng ở những bệnh nhân mắc ARDS nhưng nên giới hạn ở những bệnh nhân có nhiều khả năng phổi huy động hơn.
Chúng tôi khuyên bạn nên nhắm mục tiêu áp lực đẩy dưới 15 cm H2O, mặc dù các giá trị thấp hơn có thể liên quan đến việc giảm thêm tỷ lệ tử vong. Áp lực nhắm mục tiêu nên được sử dụng kết hợp với các chiến lược thông khí bảo vệ phổi đã được chứng minh để cải thiện kết quả, và không nên thay thế chúng.
Không đủ bằng chứng cho thấy sự vượt trội của các chế độ thông khí nhắm mục tiêu theo thể tích hoặc áp lực. Bất kể chế độ được chọn, thể tích khí lưu thông và Pplat phải được theo dõi chặt chẽ để đảm bảo chúng vẫn nằm trong giới hạn bảo vệ phổi. Có bằng chứng không đầy đủ để khuyến nghị hoặc chống lại thông khí tự phát được hỗ trợ trong ARDS.
Chúng tôi khuyên rằng bệnh nhân mắc ARDS với PaO2/FiO2 150 mm Hg phải trải qua phong tỏa thần kinh cơ, nên được bắt đầu trong vòng 48 giờ kể từ khi bệnh khởi phát.
Chúng tôi khuyên các bệnh nhân mắc ARDS có tỷ lệ PaO2/FiO2 150 mm Hg nên được tư thế nằm sấp hơn 12 giờ mỗi ngày.
References
Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526-2533.
Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplemen-tary material. Intensive Care Med. 2012;38(10):1573-1582.
Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315(8):788-800.
Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369(22):2126-2136.
Dreyfuss D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure. Am Rev Respir Dis. 1988;137(5):1159-1164.
Webb HH, Tierney DF. Experimental pulmonary edema due to intermittent positive pressure ventilation with high inflation pressures. Protection by positive end-expiratory pressure. Am Rev Respir Dis. 1974;110(5):556-565.
Slutsky AS. Lung injury caused by mechanical ventilation. Chest. 1999;116(suppl 1):9S-15S.
Beitler JR, Malhotra A, Thompson BT. Ventilator-induced lung injury. Clin Chest Med. 2016;37(4):633-646.
Sajjad H, Schmidt GA, Brower RG, Eberlein M. Can the plateau be higher than the peak pressure? Ann Am Thorac Soc. 2018;15(6):754-759.
Talmor D, Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med. 2008;359(20):2095-2104.
Mauri T, Yoshida T, Bellani G, et al. Esophageal and transpul-monary pressure in the clinical setting: meaning, usefulness and perspectives. Intensive Care Med. 2016;42(9):1360-1373.
Gattinoni L, Pesenti A. ARDS: the non-homogeneous lung; facts and hypothesis. Intensive Crit Care Dig. 1987;6:1-4.
Gattinoni L, Caironi P, Pelosi P, Goodman LR. What has computed tomography taught us about the acute respiratory distress syndrome? Am J Respir Crit Care Med. 2001;164(9): 1701-1711.
Gattinoni L, Pesenti A. The concept of “baby lung”. Intensive Care Med. 2005;31(6):776-784.
Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The “baby lung” became an adult. Intensive Care Med. 2016;42(5):663-673.
Gattinoni L, Caironi P, Cressoni M, et al. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. 2006;354(17):1775-1786.
Albert RK. The role of ventilation-induced surfactant dysfunc-tion and atelectasis in causing acute respiratory distress syn-drome. Am J Respir Crit Care Med. 2012;185(7):702-708.
Cereda M, Emami K, Xin Y, et al. Imaging the interaction of atelectasis and overdistension in surfactant-depleted lungs. Crit Care Med. 2013;41(2):527-535.
Tsuchida S, Engelberts D, Peltekova V, et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 2006;174(3):279-289.
Terragni PP, Rosboch G, Tealdi A, et al. Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2007;175(2):160-166.
Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017;195(4):438-442.
Rittayamai N, Katsios CM, Beloncle F, Friedrich JO, Mancebo J, Brochard L. Pressure-controlled vs. volume-controlled ventilation in acute respiratory failure: a physiology-based narrative and systematic review. Chest. 2015;148(2):340-355.
Yoshida T, Nakahashi S, Nakamura MAM, et al. Volume-controlled ventilation does not prevent injurious inflation during spontaneous effort. Am J Respir Crit Care Med. 2017;196(5):590-601.
Yoshida T, Torsani V, Gomes S, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med. 2013;188(12):1420-1427.
Yoshida T, Uchiyama A, Matsuura N, Mashimo T, Fujino Y. Spontaneous breathing during lung-protective ventilation in an experimental acute lung injury model: high transpulmonary pressure associated with strong spontaneous breathing effort may worsen lung injury. Crit Care Med. 2012;40(5):1578-1585.
Fan E, Del Sorbo L, Goligher EC, et al. An official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine clinical practice guideline: mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017;195(9):1253-1263.
Brower RG, Matthay MA, Morris A, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342(18):1301-1308.
Hager DN, Krishnan JA, Hayden DL, Brower RG, Network ACT. Tidal volume reduction in patients with acute lung in-jury when plateau pressures are not high. Am J Respir Crit Care Med. 2005;172(10):1241-1245.
Brower RG, Matthay M, Schoenfeld D. Meta-analysis of acute lung injury and acute respiratory distress syndrome trials. Am J Respir Crit Care Med. 2002;166(11):1515-1517.
Morelli A, Del Sorbo L, Pesenti A, Ranieri VM, Fan E. Extra-corporeal carbon dioxide removal (ECCO2R) in patients with acute respiratory failure. Intensive Care Med. 2017;43(4):519-530.
Costa EL, Amato MB. Ultra-protective tidal volume: how low should we go? Crit Care. 2013;17(2):127.
Cove ME, MacLaren G, Federspiel WJ, Kellum JA. Bench to bedside review: Extracorporeal carbon dioxide removal, past, present and future. Crit Care. 2012;16(5):232.
Batchinsky AI, Jordan BS, Regn D, et al. Respiratory dialysis: reduction in dependence on mechanical ventilation by venovenous extracorporeal CO2 removal. Crit Care Med. 2011;39(6):1382-1387.
Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults. N Engl J Med. 2011;365(20):1905-1914.
Del Sorbo L, Cypel M, Fan E. Extracorporeal life support for adults with severe acute respiratory failure. Lancet Respir Med. 2014;2(2):154-164.
Bein T, Weber-Carstens S, Goldmann A, et al. Lower tidal volume strategy ( 3 ml/kg) combined with extracorporeal CO2 removal versus ‘conventional’ protective ventilation (6 ml/kg) in severe ARDS: the prospective randomized Xtravent-study. Intensive Care Med. 2013;39(5):847-856.
Winiszewski H, Aptel F, Belon F, et al. Daily use of extracorpo-real CO2 removal in a critical care unit: indications and results. J Intensive Care. 2018;6:36.
Suter PM, Fairley B, Isenberg MD. Optimum end-expiratory airway pressure in patients with acute pulmonary failure. N Engl J Med. 1975;292(6):284-289.
Caironi P, Cressoni M, Chiumello D, et al. Lung opening and closing during ventilation of acute respiratory distress syn-drome. Am J Respir Crit Care Med. 2010;181(6):578-586.
Lachmann B. Open up the lung and keep the lung open.Intensive Care Med. 1992;18(6):319-321.
Amato MB, Barbas CS, Medeiros DM, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338(6):347-354.
Villar J, Kacmarek RM, Pérez-Méndez L, Aguirre-Jaime A. A high positive end-expiratory pressure, low tidal volume venti-latory strategy improves outcome in persistent acute respira-tory distress syndrome: a randomized, controlled trial. Crit Care Med. 2006;34(5):1311-1318.
Brower RG, Lanken PN, MacIntyre N, et al. Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med. 2004;351(4):327-336.
Mercat A, Richard JC, Vielle B, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008;299(6):646-655.
Meade MO, Cook DJ, Guyatt GH, et al. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008;299(6):637-645.
Briel M, Meade M, Mercat A, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis. JAMA. 2010;303(9):865-873.
Goligher EC, Kavanagh BP, Rubenfeld GD, et al. Oxygenation response to positive end-expiratory pressure predicts mortality in acute respiratory distress syndrome. A secondary analysis of the LOVS and ExPress trials. Am J Respir Crit Care Med. 2014;190(1):70-76.
Lapinsky SE, Aubin M, Mehta S, Boiteau P, Slutsky AS. Safety and efficacy of a sustained inflation for alveolar recruitment in adults with respiratory failure. Intensive Care Med. 1999;25(11):1297-1301.
Rimensberger PC, Cox PN, Frndova H, Bryan AC. The open lung during small tidal volume ventilation: concepts of recruitment and “optimal” positive end-expiratory pressure. Crit Care Med. 1999;27(9):1946-1952.
Crotti S, Mascheroni D, Caironi P, et al. Recruitment and derecruitment during acute respiratory failure: a clinical study. Am J Respir Crit Care Med. 2001;164(1):131-140.
Goligher EC, Hodgson CL, Adhikari NKJ, et al. Lung recruit-ment maneuvers for adult patients with acute respiratory distress syndrome. A systematic review and meta-analysis. Ann Am Thorac Soc. 2017;14(Suppl. 4):S304-S311.
Cavalcanti AB, Suzumura ÉA, Laranjeira LN, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs. low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318(14):1335-1345.
Borges JB, Okamoto VN, Matos GF, et al. Reversibility of lung collapse and hypoxemia in early acute respiratory distress syndrome. Am J Respir Crit Care Med. 2006;174(3): 268-278.
de Matos GF, Stanzani F, Passos RH, et al. How large is the lung recruitability in early acute respiratory distress syndrome: a prospective case series of patients monitored by computed tomography. Crit Care. 2012;16(1):R4.
Rubenfeld GD. How much PEEP in acute lung injury. JAMA.2010;303(9):883-884.
Calfee CS, Delucchi K, Parsons PE, et al. Subphenotypes in acute respiratory distress syndrome: latent class analysis of data from two randomised controlled trials. Lancet Respir Med. 2014;2(8):611-620.
Huh JW, Jung H, Choi HS, Hong SB, Lim CM, Koh Y. Efficacy of positive end-expiratory pressure titration after the alveolar recruitment manoeuvre in patients with acute respiratory dis-tress syndrome. Crit Care. 2009;13(1):R22. doi:10.1186/ cc7725.
Xi XM, Jiang L, Zhu B, RM group. Clinical efficacy and safety of recruitment maneuver in patients with acute respiratory distress syndrome using low tidal volume ventilation: a multi-center randomized controlled clinical trial. Chin Med J (Engl). 2010;123(21):3100-3105.
Hodgson CL, Tuxen DV, Davies AR, et al. A randomised controlled trial of an open lung strategy with staircase recruit-ment, titrated PEEP and targeted low airway pressures in patients with acute respiratory distress syndrome. Crit Care. 2011;15(3):R133. doi: 10.1186/cc10249
Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015;372(8):747-755.
Gattinoni L, Pesenti A, Baglioni S, Vitale G, Rivolta M, Pelosi P. Inflammatory pulmonary edema and positive end-expiratory pressure: correlations between imaging and physiologic stud-ies. J Thorac Imaging. 1988;3(3):59-64.
Guérin C, Papazian L, Reignier J, et al. Effect of driving pressure on mortality in ARDS patients during lung protective mechanical ventilation in two randomized controlled trials. Crit Care. 2016;20(1):384.
Schmidt MFS, Amaral ACKB, Fan E, Rubenfeld GD. Driving pressure and hospital mortality in patients without ARDS: a cohort study. Chest. 2018;153(1):46-54.
Chiumello D, Pelosi P, Calvi E, Bigatello LM, Gattinoni L. Different modes of assisted ventilation in patients with acute respiratory failure. Eur Respir J. 2002;20(4):925-933.
Marini JJ. Point: Is pressure assist-control preferred over volume assist-control mode for lung protective ventilation in patients with ARDS? Yes. Chest. 2011;140(2):286-290.
Beitler JR, Sands SA, Loring SH, et al. Quantifying unintended exposure to high tidal volumes from breath stacking dyssyn-chrony in ARDS: the BREATHE criteria. Intensive Care Med. 2016;42(9):1427-1436.
Kallet RH, Campbell AR, Dicker RA, Katz JA, Mackersie RC. Work of breathing during lung-protective ventilation in patients with acute lung injury and acute respiratory distress syndrome: a comparison between volume and pressure-regulated breathing modes. Respir Care. 2005;50(12):1623-1631.
MacIntyre N. Counterpoint: Is pressure assist-control preferred over volume assist-control mode for lung protective ventila-tion in patients with ARDS? No. Chest. 2011;140(2):290-292.
Nichols D, Haranath S. Pressure control ventilation. Crit Care Clin. 2007;23(2):183-199, viii-ix.
Chacko B, Peter JV, Tharyan P, John G, Jeyaseelan L. Pressure-controlled versus volume-controlled ventilation for acute respiratory failure due to acute lung injury (ALI) or acute respiratory distress syndrome (ARDS). Cochrane Database Syst Rev. 2015;1:CD008807.
Jaber S, Petrof BJ, Jung B, et al. Rapidly progressive diaphrag-matic weakness and injury during mechanical ventilation in humans. Am J Respir Crit Care Med. 2011;183(3):364-371.
Levine S, Nguyen T, Taylor N, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans. N Engl J Med. 2008;358(13):1327-1335.
Rittayamai N, Brochard L. Recent advances in mechanical ventilation in patients with acute respiratory distress syn-drome. Eur Respir Rev. 2015;24(135):132-140.
Goligher EC, Dres M, Fan E, et al. Mechanical ventilation-induced diaphragm atrophy strongly impacts clinical out-comes. Am J Respir Crit Care Med. 2018;197(2):204-213.
Marini JJ. Spontaneously regulated vs. controlled ventilation of acute lung injury/acute respiratory distress syndrome. Curr Opin Crit Care. 2011;17(1):24-29.
Katzenstein AL, Bloor CM, Leibow AA. Diffuse alveolar damage—the role of oxygen, shock, and related factors. A review. Am J Pathol. 1976;85(1):209-228.
Taskar V, John J, Evander E, Robertson B, Jonson B. Surfactant dysfunction makes lungs vulnerable to repetitive collapse and reexpansion. Am J Respir Crit Care Med. 1997;155(1):313-320.
Neumann P, Wrigge H, Zinserling J, et al. Spontaneous breath-ing affects the spatial ventilation and perfusion distribution during mechanical ventilatory support. Crit Care Med. 2005;33(5):1090-1095.
Wrigge H, Zinserling J, Neumann P, et al. Spontaneous breath-ing improves lung aeration in oleic acid-induced lung injury. Anesthesiology. 2003;99(2):376-384.
Froese AB, Bryan AC. Effects of anesthesia and paralysis on diaphragmatic mechanics in man. Anesthesiology. 1974; 41(3):242-255.
Cereda M, Foti G, Marcora B, et al. Pressure support ventila-tion in patients with acute lung injury. Crit Care Med. 2000;28(5):1269-1275.
Putensen C, Zech S, Wrigge H, et al. Long-term effects of spontaneous breathing during ventilatory support in patients with acute lung injury. Am J Respir Crit Care Med. 2001; 164(1):43-49.
Zhou Y, Jin X, Lv Y, et al. Early application of airway pressure release ventilation may reduce the duration of mechanical ventilation in acute respiratory distress syndrome. Intensive Care Med. 2017;43(11):1648-1659.
Mireles-Cabodevila E, Dugar S, Chatburn RL. APRV for ARDS: the complexities of a mode and how it affects even the best trials. J Thorac Dis. 2018;10(Suppl. 9):S1058-S1063.
Hickling KG, Henderson SJ, Jackson R. Low mortality associated with low volume pressure limited ventilation with permissive hypercapnia in severe adult respiratory distress syndrome. Intensive Care Med. 1990;16(6):372-377.
Ferguson ND, Villar J, Slutsky AS. Understanding high-frequency oscillation: lessons from the animal kingdom. Intensive Care Med. 2007;33(8):1316-1318.
Slutsky AS, Drazen JM. Ventilation with small tidal volumes. N Engl J Med. 2002;347(9):630-631.
Hager DN, Fessler HE, Kaczka DW, et al. Tidal volume delivery during high-frequency oscillatory ventilation in adults with acute respiratory distress syndrome. Crit Care Med. 2007; 35(6):1522-1529.
Fessler HE, Derdak S, Ferguson ND, et al. A protocol for high-frequency oscillatory ventilation in adults: results from a roundtable discussion. Crit Care Med. 2007;35(7):1649-1654.
Derdak S, Mehta S, Stewart TE, et al. High-frequency oscilla-tory ventilation for acute respiratory distress syndrome in adults: a randomized, controlled trial. Am J Respir Crit Care Med. 2002;166(6):801-808.
Bollen CW, van Well GT, Sherry T, et al. High frequency oscillatory ventilation compared with conventional mechani-cal ventilation in adult respiratory distress syndrome: a ran-domized controlled trial [ISRCTN24242669]. Crit Care. 2005;9(4):R430-439.
Ferguson ND, Cook DJ, Guyatt GH, et al. High-frequency oscillation in early acute respiratory distress syndrome. N Engl J Med. 2013;368(9):795-805.
Young D, Lamb SE, Shah S, et al. High-frequency oscillation for acute respiratory distress syndrome. N Engl J Med. 2013;368(9):806-813.
Goffi A, Ferguson ND. High-frequency oscillatory ventilation for early acute respiratory distress syndrome in adults. Curr Opin Crit Care. 2014;20(1):77-85.
Goligher EC, Munshi L, Adhikari NKJ, et al. High-frequency oscillation for adult patients with acute respiratory distress syndrome. a systematic review and meta-analysis. Ann Am Thorac Soc. 2017;14(Suppl. 4):S289-S296.
Meade MO, Young D, Hanna S, et al. Severity of hypoxemia and effect of high-frequency oscillatory ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017;196(6):727-733.
Hansen-Flaschen JH, Brazinsky S, Basile C, Lanken PN. Use of sedating drugs and neuromuscular blocking agents in patients requiring mechanical ventilation for respiratory failure. A national survey. JAMA. 1991;266(20):2870-2875.
Mehta S, Burry L, Fischer S, et al. Canadian survey of the use of sedatives, analgesics, and neuromuscular blocking agents in critically ill patients. Crit Care Med. 2006;34(2):374-380.
Gainnier M, Roch A, Forel JM, et al. Effect of neuromuscular blocking agents on gas exchange in patients presenting with acute respiratory distress syndrome. Crit Care Med. 2004; 32(1):113-119.
Forel JM, Roch A, Marin V, et al. Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome. Crit Care Med. 2006;34(11):2749-2757.
Papazian L, Forel JM, Gacouin A, et al. Neuromuscular block-ers in early acute respiratory distress syndrome. N Engl J Med. 2010;363(12):1107-1116.
Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuscular blocking agents in acute respiratory distress syndrome: a sys-tematic review and meta-analysis of randomized controlled trials. Crit Care. 2013;17(2):R43.
Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013;41(1):263-306.
Reade MC, Finfer S. Sedation and delirium in the intensive care unit. N Engl J Med. 2014;370(5):444-454.
Huang DT, Angus DC, Moss M, et al. Design and rationale of the reevaluation of systemic early neuromuscular blockade trial for acute respiratory distress syndrome. Ann Am Thorac Soc. 2017;14(1):124-133.
Gattinoni L, Taccone P, Carlesso E, Marini JJ. Prone position in acute respiratory distress syndrome. Rationale, indications, and limits. Am J Respir Crit Care Med. 2013;188(11):1286-1293.
Pelosi P, D’Andrea L, Vitale G, Pesenti A, Gattinoni L. Vertical gradient of regional lung inflation in adult respiratory distress syndrome. Am J Respir Crit Care Med. 1994;149(1):8-13.
Gattinoni L, Pelosi P, Vitale G, Pesenti A, D’Andrea L, Mascheroni D. Body position changes redistribute lung computed-tomographic density in patients with acute respiratory failure. Anesthesiology. 1991;74(1):15-23.
Cornejo RA, Díaz JC, Tobar EA, et al. Effects of prone position-ing on lung protection in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2013;188(4):440-448.
Lai-Fook SJ, Rodarte JR. Pleural pressure distribution and its relationship to lung volume and interstitial pressure. J Appl Physiol. 1991;70(3):967-978.
Malbouisson LM, Busch CJ, Puybasset L, Lu Q, Cluzel P, Rouby JJ. Role of the heart in the loss of aeration characteriz-ing lower lobes in acute respiratory distress syndrome. CT Scan ARDS Study Group. Am J Respir Crit Care Med. 2000;161(6):2005-2012.
Puybasset L, Cluzel P, Chao N, Slutsky AS, Coriat P, Rouby JJ. A computed tomography scan assessment of regional lung volume in acute lung injury. The CT Scan ARDS Study Group. Am J Respir Crit Care Med. 1998;158(5 Pt 1):1644-1655.
Scholten EL, Beitler JR, Prisk GK, Malhotra A. Treatment of ARDS with prone positioning. Chest. 2017;151(1):215-224.
Prisk GK, Yamada K, Henderson AC, et al. Pulmonary perfu-sion in the prone and supine postures in the normal human lung. J Appl Physiol (1985). 2007;103(3):883-894.
Glenny RW, Lamm WJ, Albert RK, Robertson HT. Gravity is a minor determinant of pulmonary blood flow distribution.J Appl Physiol (1985). 1991;71(2):620-629.
Gattinoni L, Tognoni G, Pesenti A, et al. Effect of prone positioning on the survival of patients with acute respiratory failure. N Engl J Med. 2001;345(8):568-573.
Guerin C, Gaillard S, Lemasson S, et al. Effects of systematic prone positioning in hypoxemic acute respiratory failure: a randomized controlled trial. JAMA. 2004;292(19):2379-2387.
Taccone P, Pesenti A, Latini R, et al. Prone positioning in patients with moderate and severe acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2009; 302(18):1977-1984.
Guérin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med. 2013;368(23):2159-2168.
Munshi L, Del Sorbo L, Adhikari NKJ, et al. Prone position for acute respiratory distress syndrome. a systematic review and meta-analysis. Ann Am Thorac Soc. 2017;14(Suppl.4):S280-S288.
Albert RK, Keniston A, Baboi L, Ayzac L, Guérin C; Proseva Investigators. Prone position-induced improvement in gas exchange does not predict improved survival in the acute respiratory distress syndrome. Am J Respir Crit Care Med. 2014;189(4):494-496.
Gattinoni L, Pesenti A, Carlesso E. Body position changes redistribute lung computed-tomographic density in patients with acute respiratory failure: impact and clinical fallout through the following 20 years. Intensive Care Med. 2013;39(11):1909-1915.
Cakar N, der Kloot TV, Youngblood M, Adams A, Nahum A. Oxygenation response to a recruitment maneuver during supine and prone positions in an oleic acid-induced lung injury model. Am J Respir Crit Care Med. 2000;161(6): 1949-1956.
Galiatsou E, Kostanti E, Svarna E, et al. Prone position aug-ments recruitment and prevents alveolar overinflation in acute lung injury. Am J Respir Crit Care Med. 2006;174(2):187-197.