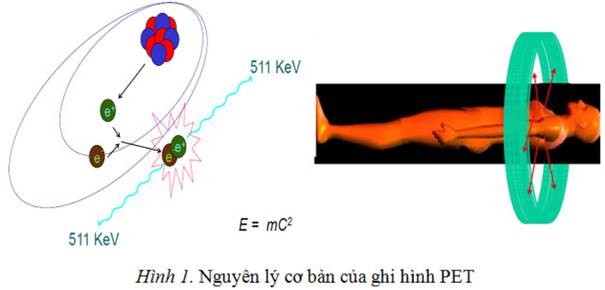
Nguyên lý cơ bản của ghi hình pet
Từ giữa những năm 1970, ghi hình cắt lớp bằng bức xạ positron (Positron Emission Tomography: PET) được sử dụng nghiên cứu trong lâm sàng các bệnh thần kinh và tim mạch. Hơn một thập kỷ sau, các nhà nghiên cứu nhận thấy PET còn là một công cụ chẩn đoán có giá trị trong ung thư. Khác với các phương pháp chẩn đoán hình ảnh cấu trúc, giải phẫu như chụp cắt lớp vi tính (Computed Tomography-CT) hay cộng hưởng từ (Magnetic Resonance Imaging- MRI), PET ghi lại hình ảnh định tính và định lượng quá trình sinh – bệnh lý và chuyển hóa của các bệnh lý thông qua dược chất phóng xạ được đánh dấu. Về nguyên lý, bất cứ đồng vị phóng xạ nào có khả năng phát positron đều có thể dùng làm chất đánh dấu trong chụp hình PET. Sự kết hợp giữa PET và CT trong cùng một hệ thống PET/CT cho phép khai thác tối ưu các lợi thế của PET là xác định hoạt tính chuyển hóa của tổ chức kết hợp với các thông tin xác định vị trí, biến đổi về hình thái, cấu trúc của tổn thương trên hình ảnh CT. Nhờ các tiến bộ không ngừng về công nghệ tạo ra các thế hệ PET/CT mới, sự phát triển liên tục các dược chất phóng xạ được sử dụng trong nghiên cứu và lâm sàng ngày càng góp phần khẳng định vai trò quan trọng của phương pháp này trong y học hiện đại.
Một cặp photon sinh ra từ sự hủy positron di chuyển theo 2 chiều trái ngược nhau được phát hiện bởi 2 detector đặt trong vòng detector. Vòng detector này được lắp đặt rất nhiều cặp detector để ghi nhận đồng thời nhiều cặp photon tạo ra từ bất kỳ vị trí nào trên đối tượng cần chụp hình. Mỗi cặp được ghi nhận và một mẫu dữ liệu thô được mã hóa, truyền về máy tính và được xử lý bởi những thuật toán chuyên dụng và cuối cùng cho ra kết quả là những hình ảnh của cơ quan cần khảo sát. Kể từ khi được ứng dụng trong lâm sàng năm 1998, các hệ thống PET được cải tiến không ngừng về công nghệ nhằm đạt được độ nhạy cao, tăng độ phân giải, giảm thời gian ghi hình.
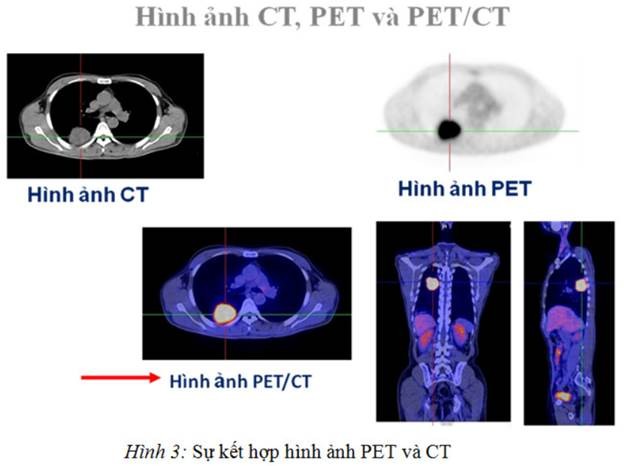
Để khắc phục những hạn chế, đặc biệt là trong việc xác định vị trí tổn thương của PET, mô hình PET/CT đã ra đời từ năm 1992 và được thử nghiệm ứng dụng trong lâm sàng lần đầu tiên từ 1998 đến 2001 tại Pittsburgh, Hoa kỳ. Các hệ thống PET/CT thương mại đã được sản xuất từ năm 2001. PET/CT cung cấp không những thông tin về sinh lý- chuyển hóa mà cả hình ảnh giải phẫu trên cùng một hệ thống. Các nghiên cứu lâm sàng cho thấy hình ảnh PET/CT có giá trị chẩn đoán chính xác hơn các thông tin từ PET hay CT riêng rẽ. Từ năm 2003, PET/CT bắt đầu thay thế PET và đến nay PET/CT đã thay thế hoàn toàn các hệ thống PET trong thực hành lâm sàng.
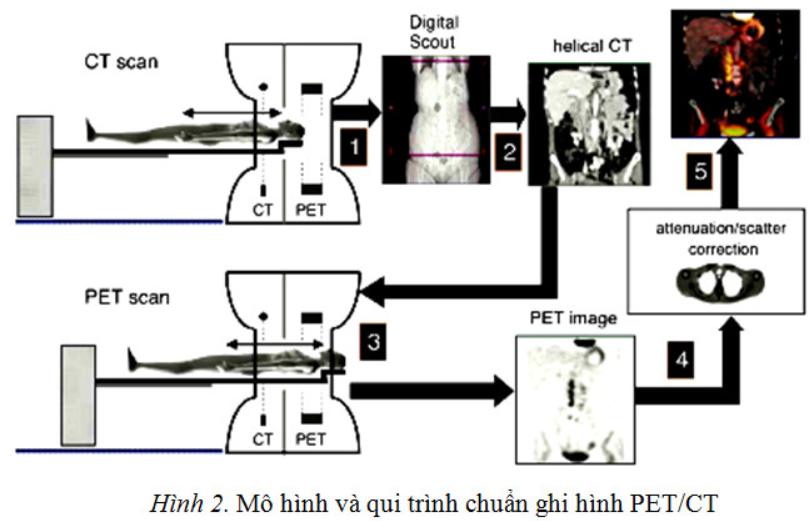
Quy trình chuẩn ghi hình PET/CT gồm các bước như trên hình 2: Sau khi sử dụng dược chất phóng xạ có đồng vị phát bức xạ positron, bệnh nhân được quét hình định hướng (scout scan) toàn thân để xác định phần chụp CT và PET (1). Bệnh nhân được chụp CT (2) nhằm mục đích xác định độ suy giảm của các mô cơ quan trong cơ thể và khu trú, đối chiếu vị trí tổn thương với hình ảnh PET. Tiếp theo là bệnh nhân được ghi hình PET (3). Sử dụng hệ số suy giảm có được từ phần chụp CT để hiệu chỉnh tán xạ và hiệu ứng suy giảm, hình ảnh PET và CT được trình bày riêng biệt (4). Trộn hình tạo nên hình ảnh kết hợp PET và CT (5).
Dược chất phóng xạ dùng trong ghi hình pet
Các đặc trưng của đồng vị phóng xạ dùng cho pet
Các đồng vị phóng xạ phát bức xạ positron dùng trong ghi hình PET được sản xuất từ các máy gia tốc vòng (cyclotron) như 18F, 11C, 15O, 13N hoặc từ các generator như 82Rb, 68Ga… Các đồng vị phóng xạ hay được sử dụng hiện nay gồm 18F, 11C, 13N, 15O, 82Rb. Các đồng vị phóng xạ này có các đặc điểm sinh học, chuyển hóa giống như trong tự nhiên.
Điều đặc biệt của đồng vị phóng xạ dùng trong PET là chỉ dùng một lượng rất nhỏ dưới mức sinh lý vào mục đích chẩn đoán. Một lượng chất tiêm vào ở mức nanomoles đến picomoles, như vậy các nồng độ sinh lý sẽ không bị tác động hoặc bị thay đổi. Các đồng vị phóng xạ không có dược tính và không gây tác dụng phụ ở mức nồng độ rất thấp đó.
Hoạt độ riêng (Specific Activity):
Hoạt độ riêng được định nghĩa là hoạt độ phóng xạ của 1 đơn vị khối lượng của nguyên tố, phân tử hay hợp chất được đánh dấu kể cả khối lượng của phần không phải phóng xạ (bền hoặc lạnh). Đơn vị hoạt độ riêng được biểu diễn bằng mCi/mg, Ci/mmol hoặc GBq/mmol. Khi làm việc với các phản ứng hóa học hay phân tử thì hoạt độ riêng được biểu thị chuẩn là mCi/mmol. Khái niệm hoạt độ riêng rất quan trọng khi làm việc có liên quan với dược chất phóng xạ của PET, đặc biệt khi chuẩn bị để gắn đồng vị phóng xạ với các chất đánh dấu phóng xạ.
Không chất mang (carrier free):
Đó là các loại dược chất phóng xạ không có lẫn các hợp chất không phóng xạ. Trong quá trình sản xuất hạt nhân phóng xạ trong máy gia tốc, các nguyên tố bia bị biến thành nguyên tố khác có nguyên tử số cao hơn. Như vậy, về mặt nguyên tắc thì các hạt nhân phóng xạ được sản xuất trong các máy gia tốc được coi như là không có chất mang. Nhưng thực tế vẫn có nhiều tạp chất như carbon tự nhiên, fluorine, hoặc các kim loại vi lượng khác có lẫn trong quá trình tổng hợp. Một khái niệm thích hợp hơn là “không chất mang thêm vào” (non carrier added), vì không chủ ý thêm vào một chất mang (không phóng xạ, bền vững) nào cả. Để thực hiện phản ứng hóa sinh hay hóa học dễ dàng thì chất mang có thể chủ động đưa vào trong quá trình sản xuất hạt nhân.
Dược chất phóng xạ dùng cho pet hay pet/ct
Hầu hết các bệnh tật đều có đặc điểm là làm thay đổi có tính đặc hiệu về nội môi và sinh hoá. Khi so sánh với SPECT ta thấy kỹ thuật PET có ưu điểm là sự phát triển dược chất phóng xạ dựa trên một số lượng lớn các đồng vị phóng xạ phát positron. Sử dụng đồng vị phóng xạ phát positron làm chất đánh dấu gắn với các chất hoá sinh và các phân tử thuốc. Một lượng các dược chất phóng xạ đã được sử dụng là các chất đánh dấu phóng xạ hoặc các chất ghi hình ở mức độ phân tử để phát hiện và định lượng chức năng, chuyển hóa của một cơ quan hoặc một quá trình sinh hoá nhất định trong một tổ chức đặc hiệu.
Thăm dò tưới máu cơ quan hay tổ chức
Lưu lượng máu là khối lượng hoặc thể tích máu được cung cấp đến một cơ quan (não, cơ tim…) hoặc một tổ chức đặc hiệu (khối u) trong một đơn vị thời gian, được tính bằng ml/phút. Tưới máu được định nghĩa là lưu lượng máu trong một đơn vị thể tích của mô và được tính bằng ml/phút/g. Chất đánh dấu phóng xạ lý tưởng cho thăm dò tưới máu được phân bố và đào thải tỷ lệ thuận với lưu lượng máu. Quan hệ tuyến tính giữa lưu lượng máu và sự tập trung hoặc thanh thải chất đánh dấu là một hằng số, không phụ thuộc vào những thay đổi sinh bệnh học hoặc chuyển hoá trong tổ chức đó. Nước đánh dấu 15O đáp ứng hầu hết các tiêu chuẩn của một chất đánh dấu để đo lưu lượng máu hoặc tưới máu tổ chức. Nó khuếch tán một cách tự do và được tiết/thoát ra đồng nhất qua vòng lưu chuyển đầu tiên không phụ thuộc vào lưu lượng máu tổ chức và tình trạng chuyển hoá tại đây. Nó là dược chất phóng xạ thường dùng nhất cho đánh giá tưới máu não và cơ tim. Ngoài ra, vài dược chất phóng xạ khác cũng được sử dụng cho ghi hình tưới máu cơ tim bằng PET/CT.
13N-amoniac được tiêm vào tĩnh mạch, tồn tại trong máu dưới dạng chủ yếu là NH4+, ion này vượt qua mao mạch và màng tế bào qua cơ chế khuếch tán thụ động. Ion NH4+ phản ứng với glutamin thành glutamate, chất này bị lưu giữ ở tế bào cơ tim. Ion NH4+ có thể thay thế ion K trong hồng cầu do đó nó có thể được vận chuyển một cách tích cực và tập trung vào tế bào cơ tim.
82Rb+ được vận chuyển vào trong cơ tim tương tự như K+ nhưng sự thoát tiết của nó qua vòng quay đầu tiên ít hơn [13N]NH3 và 82Rb đã được FDA Hoa kỳ chính thức phê chuẩn dùng trong thăm dò tưới máu cơ tim. Một phức hợp Cu (II) ái mỡ, trung tính được biết đến là 62Cu-PTSM được dùng cho đánh giá tưới máu cơ tim và tổ chức u. Sau quá trình khuếch tán qua màng tế bào, bị giáng hoá bởi nhóm sulfhydryl và liên kết không đặc hiệu với đại phân tử trong tế bào, 62Cu sẽ bị lưu giữ trong tế bào.
[11C]-Acetat cũng được sử dụng để đo lường sự phân bố trong cơ tim. Sau khi khuếch tán vào trong tế bào cơ tim nó được chuyển thành acetyl-CoA trong bào tương và sau đó bị oxy hoá trong ty thể bởi acid tricarboxylic tạo ra CO2 và H2O. Sự tập trung ban đầu trong cơ tim của các chất này dùng để đo lường lưu lượng máu, trong khi sự thải trừ có thể phản ánh chuyển hoá oxy hoá.
Thăm dò chuyển hoá
Các chất đánh dấu phóng xạ phát positron được ứng dụng để ghi hình chuyển hoá của một số quá trình hoá sinh.
Chuyển hoá glucose:
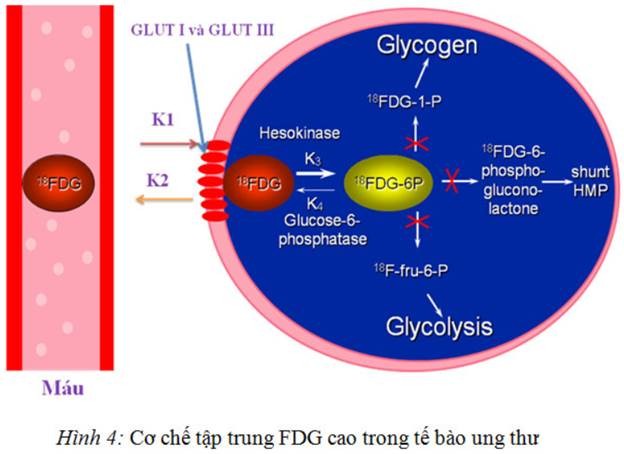
Phân tử quan trọng nhất cung cấp năng lượng cho các phản ứng hoá sinh đa dạng trong cơ thể là adenosin triphosphat (ATP), chất được sinh ra trong ty thể do quá trình chuyển hoá glucose. ở não chuyển hoá glucose sinh ra tất cả ATP, trong khi ở tim chuyển hóa axit béo là nguồn năng lượng chính để tổng hợp ATP. Chuyển hoá glucose tăng cao thậm chí ngay cả khi sự cung cấp oxy tại đó bị suy giảm. Điều này có thể thấy được trong các mô ung thư. Glucose được vận chuyển vào trong tế bào qua cơ chế khuếch tán thụ động thông qua kênh vận chuyển glucose đặc hiệu nằm trên màng tế bào. Trong bào tương, glucose được phosphoryl hóa nhờ men hexokinase để tạo thành glucose 6-phosphat, chuyển hoá đến sản phẩm cuối cùng là CO2 và H2O.
Phân tử 2-deoxy-2-fluoro-deoxyglucose (FDG) được tạo bởi việc đánh dấu nguyên tử C số 2 trong phân tử bằng 18F (thay thế 1 nguyên tử H liên kết với C số 2 bằng F-18). Tương tự như glucose, 18FDG được vận chuyển vào tế bào nhờ các chất vận chuyển ở màng (membran transport) và được phosphoryl hóa nhờ men hexokinase nhưng sau đó tập trung trong tế bào do bị “bẫy chuyển hóa” (metabolically trapped). Các nghiên cứu đã thấy rằng việc bắt giữ 18FDG trong tế bào ác tính chủ yếu là do tăng nồng độ các chất vận chuyển glucose (đặc biệt là GLUT-1) ở màng tế bào, các men hexokinase… trong hầu hết các loại ung thư. ở người bình thường thì glucose được lọc và tái hấp thu ở các nephron. Còn 18FDG lại được tái hấp thu rất ít và bài xuất chủ yếu qua nước tiểu.
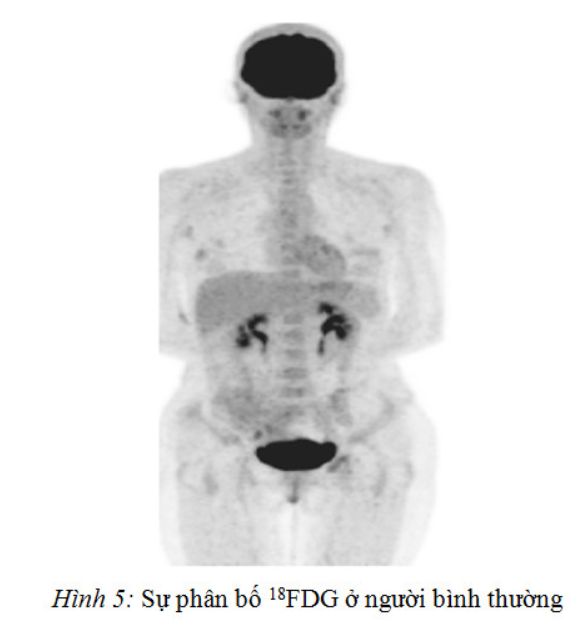
Thời gian bán thải của 18FDG khoảng 2 giờ. Nghĩa là khi vào cơ thể, cứ sau khoảng 2 giờ hoạt độ phóng xạ của 18FDG trong cơ thể giảm còn một nửa. Sau 10 giờ, hoạt độ phóng xạ tiêm vào cơ thể còn lại chỉ khoảng 3%. Hình ảnh PET chính là hình ảnh sự phân bố 18FDG trong cơ thể. Sự tập trung cao 18FDG trong nhiều loại tế bào ung thư cho phép phát hiện tổn thương ung thư khi so sánh chúng với sự tập trung 18FDG ở tế bào lành. Hình 7.5 cho thấy hình ảnh PET hấp thụ glucose ở người bình thường: tập trung glucose cao ở não, kế tiếp là ở tim, gan và lách. Có thể nhận thấy tăng hấp thụ glucose ở thận, bàng quang…
Người ta có thể tính mức độ hấp thụ glucose ở từng vùng quan tâm trên hình ảnh PET. Giá trị đó được gọi là độ bắt chuẩn glucose (Standardized Uptake Value -SUV). Có thể hiểu là nếu 18FDG phân bố đều khắp toàn cơ thể thì SUV ở các mô, cơ quan đều có giá trị như nhau và bằng 1. Có thể tính được SUV tương đối của các mô, các cơ quan khác nhau trong cơ thể, so sánh SUV giữa các mô khác nhau hoặc giữa các lần ghi hình khác nhau trên cùng một bệnh nhân. Từ đó đánh giá được tổn thương, đánh giá đáp ứng với điều trị…
Tuy nhiên, SUV cũng chỉ là trị số bán định lượng, vì mức glucose trong tế bào bình thường có thể thay đổi đáng kể.
Ngoài các ứng dụng phổ biến trong ung thư, 18FDG còn được áp dụng chụp hình PET chẩn đoán sa sút trí tuệ do bệnh Alzheimer, chẩn đoán khu trú nguyên nhân gây động kinh, chẩn đoán cơ tim sống còn (myocardial viability), chẩn đoán khu trú viêm, nhiễm trùng…
Mặc dù 18FDG vẫn là dược chất chính được sử dụng trong chụp PET và PET/CT. Tuy nhiên, nhiều trường hợp 18FDG-PET có nhược điểm như trong ung thư tiền liệt tuyến, ung thư gan, ung thư hệ thần kinh trung ương và ung thư thần kinh nội tiết. Khi đó, những dược chất phóng xạ đặc hiệu cho từng loại ung thư cụ thể gắn với 11C, 18F và 68Ga sẽ được cân nhắc sử dụng. Trong số các dược chất phóng xạ này, một vài đồng vị phóng xạ rất khó tổng hợp do thời gian bán hủy ngắn, chỉ những trung tâm y học hạt nhân có cyclotron mới đủ khả năng tổng hợp và sử dụng. Trong tương lai, số lượng dược chất phóng xạ sẽ còn tăng mạnh để đáp ứng yêu cầu sử dụng trong lâm sàng và tăng độ nhạy, độ đặc hiệu ở từng loại bệnh ung thư khác nhau.
Chuyển hoá acid béo:
ATP trong cơ tim được tạo ra trên cơ sở một số chất nền (axit béo tự do, glucose, lactate và ceton), phụ thuộc vào sự sẵn sàng tương đối của nồng độ chất nền, oxy và hormon (catecholamin, insulin, glucagon). Khi mức độ glucose trong huyết tương tăng lên dẫn đến sự thay đổi chuyển hoá glucose trong cơ tim, kết quả là FDG có thể sử dụng để đánh giá chuyển hoá cơ tim.
Chuyển hoá Cholin:
Tất cả các tế bào đều sử dụng cholin như chất tiền thân để sinh tổng hợp phospholipid, thành phần cơ bản của màng tế bào. Bên trong tế bào, cholin được chuyển hoá qua quá trình phosphoryl hoá, oxy hoá hoặc acetyl hoá; sự phosphoryl hoá cholin bị thuỷ phân bởi cholin kinase. Phosphorylcholin là một dạng dự trữ cholin trong tế bào và sau đó được chuyển thành phosphatidylcholin (lecithin), thành phần chính của màng tế bào.
Quá trình sinh ung thư được biểu hiện bởi quá trình tăng sinh tế bào. Người ta cho rằng sự chuyển dạng ác tính tế bào có liên quan đến hoạt động men cholin kinase dẫn tới tăng nồng độ phosphorylcholin. Hơn nữa, khối u phát triển nhanh chứa một khối lượng lớn phospholipid, đặc biệt phosphatidylcholin. Năm 1997-1998, [11C] cholin (CH) được giới thiệu như một chất đánh dấu tiềm năng trong ghi hình u não và tuyến tiền liệt.
Do việc bắt giữ 18FDG có thể bị ảnh hưởng bởi quá trình viêm hoặc bài tiết hoặc ung thư, do đó, khó có thể đánh giá ung thư nguyên phát và đặc biệt là những tổn thương nghi ngờ tái phát tại chỗ. Cholin được đánh giá là có ái tính cao đối với ung thư tiền liệt tuyến, thậm chí với các loại ung thư độ ác tính thấp. Chất này có thể được gắn với 11C và 18F, 11C được bài tiết ít hơn qua đường niệu do đó giảm liều hấp thu cho bệnh nhân. Trái lại, sử dụng 18F thuận tiện hơn ở những trung tâm y học hạt nhân không có cyclotron tại chỗ do thời gian bán hủy dài hơn (109,7 phút).
Vai trò của Cholin PET/CT trong ung thư tiền liệt tuyến rõ nhất là chẩn đoán tái phát. ở những bệnh nhân được phẫu thuật cắt bỏ tiền liệt tuyến hoặc xạ trị mà chỉ số PSA tăng cao, đồng thời không phát hiện được tổn thương trên những phương pháp chẩn đoán hình ảnh thông thường như siêu âm qua đường trực tràng, xạ hình xương, MRI tiểu khung thì Cholin PET/CT là phương pháp chẩn đoán có giá trị với độ nhạy, độ đặc hiệu và độ chính xác cao trong chẩn đoán sớm di căn hạch và di căn xương. Tổn thương di căn xương trên Cholin PET có thể được chẩn đoán sớm hơn so với xạ hình xương do Cholin bắt giữ vào màng tế bào trước khi có sự thay đổi của tổ chức ác tính dạng đặc xương. Ngoài ra Cholin PET còn có lợi ích trong phát hiện tái phát tại chỗ nhưng với độ nhạy thấp hơn.
Nồng độ PSA có mối liên hệ mật thiết với kết quả dương tính trên PET (có nghĩa là nồng độ PSA càng cao thì tốc độ phát triển của ung thư tiền liệt tuyến càng nhanh). Hiện nay, 11C-Cholin PET được coi là một xét nghiệm có hiệu quả để đánh giá những bệnh nhân ung thư tiền liệt tuyến đã được phẫu thuật triệt căn, có tăng nồng độ PSA và âm tính đối với những phương pháp chẩn đoán thông thường khác.
Tổng hợp ADN:
Tỷ lệ phân bào, tăng sinh tế bào và giảm biệt hoá được coi là yếu tố chính dẫn tới sự phát triển ồ ạt của tổ chức ung thư. Hầu hết u lành phát triển chậm và kéo dài đến hàng năm, nhưng khối u ác tính thì phát triển rất nhanh, đôi khi lại di chuyển. Số lượng tế bào pha S trong chu trình tế bào cũng cao hơn so với mô lành. Do vậy, nó đòi hỏi tăng nhu cầu về nguyên liệu (nucleotides) cho tổng hợp ADN. Trong tế bào, thymidin được phosphoryl hoá bởi thymidin kinase (TK) để chuyển thành thymidin phosphat, chất này tham gia cấu thành ADN. Định lượng nucleotid cấu thành ADN trong u in vitro bằng cách sử dụng [3H]thymidin là một phương pháp đánh giá sự tăng sinh tế bào. Vì vậy [11C]thymidin được sử dụng là chất đánh dấu trong PET để ghi hình khối u và đo lường sự tăng sinh tế bào. Tuy nhiên, vì sự chuyển hoá nhanh của chất đánh dấu trong máu, sự tập trung vào u của thymidin[11C] nên nó không phải là chất tối ưu cho ghi hình ảnh và định lượng. Các chất chuyển hoá tương tự thymidin là những chất nền của men TK đang được nghiên cứu và ứng dụng.
Vận chuyển acid amin và tổng hợp protein:
Sự tăng sinh và phát triển khối u có đặc điểm là tăng sinh và tổng hợp protein. Vì các acid amin là thành phần cấu tạo protein nên việc sử dụng các acid amin có đánh dấu đồng vị phóng xạ có thể tạo nên hình ảnh chuyển hoá protein. Tuy nhiên, các amino axit cũng trải qua quá trình chuyển hoá như chuyển amin (transamination) và khử carboxyl (decarboxylation). Do đó, vị trí chính xác nơi 11C và 18F gắn vào trong phân tử mang tính cốt yếu cho việc đánh giá tổng hợp protein. [Carboxyl-11C]-L-leucin và [11C]-L-methionin đã được nghiên cứu. Trong methionin, 11C được đưa vào nhóm carboxyl hoặc nhóm methyl gắn với nguyên tử S do đó 11C-S-methyl-L-methyonin dễ dàng có được nhưng có thể bao gồm sự chuyển methyl (transmethylation) thêm vào quá trình tổng hợp protein.
Định lượng 11C-methionin và tyrosin cho phép đánh giá chuyển hóa amino acid và tổng hợp protein. Methionin cần cho tổng hợp protein như một tiền chất của S- adenosylmethionin, cung cấp cho quá trình tổng hợp các chuỗi amin. Sự tăng bắt giữ methionin phản ánh sự tăng của chất vận chuyển trung gian, tăng độ thẩm thấu của mạch máu và sinh tổng hợp protein ở những tổ chức ung thư (tế bào ác tính có nhu cầu methionin cao hơn bình thường rất nhiều). Nhược điểm chính khi sử dụng 11C-methionin là phải bắt buộc có trung tâm cyclotron tại chỗ, vì vậy, 18F gắn tyrosin được khuyến cáo để thay thế. Những chất này được dùng chủ yếu để chụp hình chẩn đoán u hệ thần kính trung ương. Bình thường chất não (chất xám), tổ chức xơ-sẹo, hoại tử, phù nề bắt giữ các dược chất này ở mức thấp. PET được chỉ định chụp khi mà các phương pháp thông thường khác không phân biệt được những tổ chức lành tính như phù nề, xơ hóa, hoại từ với tổn thương ác tính. Chỉ số SUV cao nhất trong khối u não đôi khi được cân nhắc như một yếu tố có giá trị tiên lượng bệnh. 11C-Methionin PET cũng được áp dụng để xác định trường chiếu trong xạ trị tốt hơn, mặt khác, PET/CT còn định vị chính xác những vị trí bắt giữ phóng xạ cao nhất ở khối u não để dẫn đường cho sinh thiết hoặc đánh giá sớm hiệu quả sau xạ trị ở bệnh nhân ung thư đầu – cổ (những tổ chức viêm thường bắt giữ 11C- methionin thấp).
Receptor:
18F-DOPA: có cấu tạo là một vòng thơm axit amin gắn với 18F. 18F-DOPA đã được sử dụng để đánh giá hoạt tính của vòng thơm amino axit dercarboxylase đánh giá hệ dopaminergic trên bệnh nhân Parkinson. Bên cạnh đó, 18F-DOPA còn được biết đến với những ứng dụng trong thực hành ung thư, cụ thể là ung thư mào thần kinh (neural crest tumor). Các ung thư thần kinh nội tiết (carcinoid, pheocromocytoma, nguyên bào thần kinh, ung thư tuyến giáp thể tủy, microcytoma, ung thư tiểu thể cảnh và ung thư hắc tố) có biểu hiện tăng chuyển hóa của L-DOPA decarboxylase, do đó những ung thư này đều tăng chuyển hóa cao đối với 18F-DOPA. 111In-Ostreoscan SPECT hoặc 123I-MIBG SPECT thường được chỉ định trong những trường hợp này. Tuy nhiên, do độ phân giải không cao nên những tổn thương nhỏ nhiều khả năng bị bỏ sót. Do khả năng tập trung nồng độ acid amin trong tế bào, 18F-DOPA được coi như một dược chất đặc hiệu có độ nhạy và độ đặc hiệu cao hơn những phương pháp chẩn đoán khác. Tuy nhiên, theo y văn, ứng dụng của dược chất này vẫn còn tương đối ít vì sản xuất 18F-DOPA là không hề dễ dàng và ung thư thần kinh nội tiết là bệnh hiếm gặp.
Người ta chú trọng đến những đồng chất của somatostatin dùng trong PET như 68Ga và sử dụng 18F-DOPA trong ung thư tuyến giáp thể tủy và pheochromo-cytoma. Đối với chuyên ngành thần kinh, có thể sử dụng 18F-DOPA vì L-DOPA (L-dihydroxyphenylalanin) liên quan rất chặt chẽ đến thoái hóa tế bào thần kinh và những rối loạn vận động dùng để chẩn đoán sớm và theo dõi bệnh lý liên quan đến sự thoái hóa dẫn truyền dopamin như bệnh Parkinson.
Thụ thể 68Ga-DOTA-somatostatin: 111In-DTPA-ostreotid (Ostreocan) có độ nhạy rất cao trong phát hiện ung thư thần kinh nội tiết và được sử dụng một cách kinh điển để đánh giá bệnh và định hướng điều trị. Nguyên tắc cơ bản trong điều trị đặc hiệu cho loại ung thư này là dùng thụ cảm thể tương tự somatostatin và sử dụng chất gắn với somatostatin để điều trị ở những bệnh nhân không phẫu thuật được. Trong những nghiên cứu về ung thư thần kinh nội tiết, dược chất phóng xạ được dùng trong PET là 68Ga-DOTA-NOC. Hợp chất dùng trong chụp hình PET có ái tính cao với thụ thể SST 2 và SST5 trong chẩn đoán bệnh ung thư này. Sự tăng chuyển hóa của 68Ga-DOTA-NOC phụ thuộc vào thụ cảm thể tại khối u. Mặc dù vẫn chưa được nghiên cứu đầy đủ nhưng độ nhạy của chất này cao hơn so với Octreoscan nhưng thấp hơn 18F-DOPA – chất được tích lũy thông qua cơ chế chuyển hóa vì một vài loại ung thư có biểu hiện thụ thể somatostatin ở mức thấp. Hơn nữa, 68Ga-DOTA-NOC có nhiều ưu điểm hơn so với Octreoscan do có độ phân giải cao, chụp đánh giá được toàn thân với thời gian ngắn hơn, dễ tổng hợp và áp dụng được trong PET/CT, làm tăng độ chính xác trong chẩn đoán. 68Ga-DOTA-NOC PET đem lại ưu thế trước khi điều trị để đánh giá phân bố sinh học của thuốc. Độ nhạy và độ đặc hiệu của 68Ga-DOTA-NOC so với 18F-DOPA thì vẫn còn đang trong quá trình nghiên cứu. Tuy vậy, cả 2 chất này đều có ý nghĩa thực tiễn nhất định trong chẩn đoán ung thư thần kinh nội tiết.
Giảm oxy máu:
Việc tăng kích thước khối u có thể dẫn tới sự giảm cung cấp oxy và không đáp ứng được nhu cầu phân chia rất nhanh của tế bào ung thư. Sự thiếu oxy dẫn tới ức chế tế bào phát triển, thậm chí gây chết tế bào. Nhưng cũng có thể nhờ sự đáp ứng của các tế bào với tình trạng đó mà làm cho các tế bào vẫn sống sót và phát triển. Thiếu oxy trong một thời gian dài có thể là yếu tố quan trọng trong sự tiến triển của khối u và dẫn tới kháng với các phương pháp điều trị. Các tế bào được cung cấp giàu oxy nhạy cảm hơn với tia xạ so với các tế bào nghèo oxy.
Các Nitroimidazol có thể được sử dụng như là một chất dò để phát hiện tình trạng thiếu oxy. Chất được nghiên cứu rộng rãi trong PET để nghiên cứu sự giảm oxy là [18F]fluoromisonidazol. Các Nitroimidazol được khuếch tán thụ động và được khử 1 electron tạo thành chất dễ phản ứng. Trong điều kiện giàu oxy, phân tử này ngay lập tức bị oxy hoá lại và quá trình này xảy ra một vài lần trước khi nó khuếch tán ra ngoài tế bào. Trong điều kiện thiếu oxy, nitroimidazol tiếp tục bị khử tạo thành các đại phân tử, chúng sẽ liên kết đồng hoá trị với các đại phân tử trong tế bào, một quá trình của sự chuyển hóa trong tế bào thiếu oxy.
Nhiều chất đánh dấu dùng cho PET để thăm dò thiếu oxy đã được nghiên cứu sử dụng. Cu-ATSM có độ tập trung đủ cao và dễ dàng đào thải ra ngoài tế bào vì tính thấm cao qua màng tế bào đồng thời tập trung nhanh trong khối u. ATSM là một marker được chọn lọc để đánh giá sự thiếu oxy trong tổ chức ung thư và cũng là yếu tố tiên đoán cho sự đáp ứng với điều trị.
11C-Acetat: được dùng trong PET như là tiền chất của axit béo trong màng tế bào và được chuyển hóa thành Acetyl-CoA. Do đó, nó có tính chất như một phân tử tham gia vào quá trình chuyển hóa dị hóa đường và chuyển hóa qua màng thế bào. Ban đầu, người ta ứng dụng 11C-acetat trong tim mạch để đánh giá chuyển hóa trong cơ tim. Ngày nay, 11C-acetate được sử dụng trong ung thư như một chất tương tự choline để chẩn đoán ung thư tiền liệt tuyến. 11C-acetat còn được sử dụng phối hợp với 18F-FDG để đánh giá khối u gan. Kết quả bước đầu cho thấy 11C-acetat có độ nhạy cao với ung thư gan độ ác tính thấp trong khi đó FDG nhạy hơn với ung thư gan độ ác tính cao.
Những dược chất phóng xạ khác: 18FLT (Fluoro-levo-thymidin) là một trong những dược chất được đặt nhiều kỳ vọng trong ung thư. Thymidin có cấu trúc cơ bản giống như acid deoxyribonucleic (ADN). Chính vì vậy 18FLT là dấu ấn đặc hiệu của sự phân chia tế bào. Do đó, 18FLT có độ nhạy và độ đặc hiệu cao hơn so với 18FDG trong chẩn đoán ung thư bởi vì chất này không tập trung ở tổ chức viêm. ứng dụng phổ biến nhất của 18FLT là trong ung thư phổi, chẩn đoán phân biệt tổn thương dạng nốt đơn độc ở phổi là lành tính hay ác tính. Mặc dù 18FDG-PET có độ nhạy và độ đặc hiệu cao nhưng đôi khi cũng gặp trường hợp u hạt và các tổ chức viêm bắt giữ 18FDG gây ra dương tính giả trong chẩn đoán. Đối với ung thư phổi không tế bào nhỏ, 18FLT rất phù hợp nhưng lại có giá trị thấp hơn so với 18FDG-PET trong chẩn đoán di căn hạch và di căn xa. Một ứng dụng khác của 18FLT là chẩn đoán u hệ thần kinh trung ương. Tương tự như đã phân tích với methionin, 18FLT tăng chuyển hóa không nhiều ở nhu mô não bình thường. 18FLT-PET có hình ảnh với độ tương phản cao nhưng không có nhiều thông tin về mặt giải phẫu. Do vậy, những nghiên cứu trong tương lai cần phải trả lời câu hỏi làm thể nào để phân biệt được giữa tổn thương lành tính và ác tính, giữa tổn thương ác tính tồn dư và hoại tử do xạ trị. Nếu 18FLT trở thành dược chất đặc hiệu trong chẩn đoán ung thư não thì sẽ rất có ích trong việc phối hợp với CT và MRI để định hướng chính xác cho sinh thiết, lập kế hoạch xạ trị đối với khối u không đồng nhất, phát hiện sớm tổn thương tái phát.