Điều trị bệnh đa hồng cầu nguyên phát, bệnh bạch cầu mạn tính bằng 32p
Bệnh đa hồng cầu nguyên phát
Đa hồng cầu nguyên phát (polycythemia vera) hay còn gọi là bệnh Vaquez, là một trong những bệnh thuộc nhóm bệnh lý tăng sinh tủy mạn tính. Tăng sinh quá mức của tế bào gốc sinh máu vạn năng, nghiêng về dòng hồng cầu làm tăng thể tích khối hống cầu toàn thể. Bệnh chưa rõ nguyên nhân, được xem là hậu quả của tình trạng loạn sản tế bào tuỷ xương tạo huyết và được biểu hiện bằng tăng giá trị tuyệt đối của thể tích hồng cầu do tăng số lượng hồng cầu (thường gấp 2-3 lần so với bình thường).
Bệnh thường xuất hiện ở người già với các đặc điểm lâm sàng như: tăng độ nhớt máu, tăng khối lượng máu hoặc tăng chuyển hóa. Các triệu chứng thường gặp: đau đầu; ngứa, nhất là sau khi tắm nước nóng; ra mồ hôi đêm; mờ mắt; da đỏ tím, niêm mạc đỏ tím nhất là niêm mạc lưỡi, môi, mắt; có thể có xuất huyết dạ dày, tiết niệu, não hoặc tắc nghẽn mạch; lách to: khoảng 2/3 người bệnh có lách to; hội chứng tắc mạch: lách, dương vật, chi dưới, chảy máu từng mức độ; tăng huyết áp, có thể bị Gout.
Những chỉ tiêu chính để chẩn đoán: thể tích hồng cầu tăng (> 36 ml/kg ở nam và > 32 ml/kg ở nữ), bão hoà ôxy ở động mạch (> 92 %), lách to. Nếu chỉ có 2 triệu chứng đầu tiên thì phải tính đến 2 trong số các triệu chứng phụ: tiểu cầu > 400 G/l, bạch cầu > 12 G/l, không sốt không nhiễm trùng, tăng phosphatase kiềm của lymphocyte và B12 huyết thanh > 900 pg/ml. Đặc biệt là hồng cầu tăng nhưng nồng độ erythropoietin không tăng, chứng tỏ có những rối loạn về sinh sản các dòng máu ở tủy xương.
Cần chẩn đoán phân biệt:
Với tăng hồng cầu giả: tăng thể tích hồng cầu nhưng giảm thể tích huyết tương. Thường gặp trong chấn thương, bỏng, sốt xuất huyết Dengue, tiêu chảy mất nước.
Với tăng hồng cầu thứ phát: Tăng sinh hồng cầu sinh lý – bù trừ vì nguyên nhân thiếu oxy tổ chức (giảm áp lực oxy tổ chức; bệnh phổi mạn; tạo shunt trong hệ tuần hoàn; bệnh lý của Hb…).
Tăng Erythropoietin: (bệnh thận: u thận, kén thận, ứ nước thận; cường vỏ thượng thận; các ung thư gây tăng erythropoietin: ung thư gan, u xơ tử cung; tăng sản xuất hoặc tiêm androgen).
Bệnh đa hồng cầu thực sự là bệnh nguy hiểm, nếu không điều trị kịp thời thì tỷ lệ tử vong cao, thời gian sống trung bình 55% thì độ quánh của máu tăng cao dễ gây huyết khối (thrombose). Có thể thấy tăng song song cả bạch cầu và tiểu cầu.
Hai mục tiêu chính trong điều trị bệnh đa hồng cầu là giảm hematocrit xuống dưới 55% và giảm sự sản xuất hồng cầu.
Có nhiều phương pháp điều trị. Trong trường hợp cấp tính, để tránh tắc mạch người ta có thể chích huyết. Phương pháp điều trị thông thường là phối hợp giữa cắt lách và dùng hóa chất để làm giảm số lượng hồng cầu, giảm sự sinh sản hồng cầu bằng hóa chất busulphan hoặc hydroxyurea (ức chế men ribonucleotit).
Từ những năm 1930, 32P đã được dùng để điều trị đa hồng cầu. 32P phát bức xạ beta đơn thuần, năng lượng Eb = 1,71 MeV, chu kỳ bán rã T1/2 = 14,3 ngày, thường tiêm tĩnh mạch dưới dạng muối phosphat. Thời gian tồn tại của 32P trong tuỷ xương từ 7 – 9 ngày. Phospho là thành phần cần thiết cho tổng hợp các acid nhân nên 32P thâm nhập nhiều vào nhân tế bào bệnh, ức chế phân bào, sự nhạy cảm phóng xạ của tế bào bệnh cao hơn tế bào máu bình thường. Xếp theo thứ tự nhạy cảm phóng xạ: lympho bào trong bệnh bạch cầu > bạch cầu hạt trong bệnh bạch cầu > hồng cầu trong bệnh đa hồng cầu > lympho bào bình thường > hồng cầu bình thường. Chỉ định cho bệnh nhân trên 40 tuổi được chẩn đoán xác định là đa hồng cầu nguyên phát. Thuốc dưới dạng Na2HPO4, tiêm tĩnh mạch chậm.
Liều dùng: 32P sodium phosphate, 2,3 mCi/m2 diện tích cơ thể. Tiêm tĩnh mạch tốt hơn cho uống. Có tác giả cho rằng liều > 2,7 mCi/m2 thì thời gian hết bệnh kéo dài hơn. Nếu cần thiết có thể điều trị lần 2 cách 3 tháng với liều cao hơn 25%. Có thể sau 3 tháng nữa dùng một liều thứ 3 cao hơn lần thứ hai 25%, nhưng không vượt quá 7 mCi. Khoảng 2 năm sau có thể điều trị lại một đợt khác.
Hiệu quả điều trị: giảm biến chứng tắc mạch từ 25,7% xuống còn 4,2%. Tăng thời gian sống còn: với các bệnh nhân điều trị P-32 thời gian sống thêm trung bình 11-16 năm. Nhóm bệnh nhân điều trị 32P có tuổi thọ trung bình 13,3 năm so với các nhóm khác chỉ 6-7 năm. Mỗi đợt lui bệnh được 24-30 tháng. Đây là phương pháp điều trị hữu hiệu, kinh tế.
Nguy cơ của bệnh đa hồng cầu là phát sinh leukemia. Dù điều trị bằng chích huyết, bằng hoá chất hoặc bằng 32P cũng đều có khả năng xảy ra leukemia 3 – 15% trong vòng 10 năm.
Có thể dùng 32P đường uống hoặc đường tiêm tĩnh mạch (thường dùng hơn) để điều trị bệnh leukemia. Tổng liều 1 – 2,5 mCi, tiêm làm nhiều lần; nếu dùng đường uống, bệnh nhân cần nhịn ăn trước đó vài giờ. Liều dùng đường uống chỉ đạt khoảng 75% của đường tiêm; trong một tuần lượng thải ra qua phân và nước tiểu là 25 – 50%.
Bệnh bạch cầu mạn thể lympho
Bệnh bạch cầu lympho mạn (CML-Chronic Myeloid Leukemia) là một bệnh tăng sinh ác tính bạch cầu lympho trưởng thành về hình thái học, có xu hướng tích lũy ở trong máu ngoại vi, tủy xương, hạch, lách và gan dẫn đến suy giảm chức năng tủy xương và phì đại các cơ quan nói trên. Trong số các trường hợp mắc bệnh, 98% thuộc dòng lympho B và chỉ có 2% thuộc dòng lympho T.
Nguyên nhân chưa xác định rõ ràng. Bệnh bạch cầu lympho mạn không liên quan đến tiếp xúc phóng xạ. Hiện chưa có bằng chứng về nguyên nhân virus retro của bệnh.
Bệnh bạch cầu lympho mạn thường xuất hiện một cách âm thầm với giai đoạn không có triệu chứng khá dài, vì vậy, có đến 25-30% trường hợp được phát hiện tình cờ qua xét nghiệm công thức bạch cầu vì một bệnh khác hoặc khi khám sức khỏe định kỳ.
Sau thời kỳ không có triệu chứng bệnh bắt đầu với những triệu chứng không điển hình như: người bệnh có thể mệt mỏi, suy nhược, gầy sút cân nhiều, giảm khả năng lao động. Ở giai đoạn muộn hơn, bệnh có biểu hiện: gầy sút cân; hạch to, vị trí hay gặp ở cổ, thượng đòn và nách. Hạch thường chắc, di động, không đau. Một số ít trường hợp hạch tạo khối lớn, chèn ép gây phù chi, cản trở đường mật, đường tiết niệu, hoặc đường hô hấp. Khoảng 50% số trường hợp có lách và gan to với mức độ nhẹ và vừa. Xuất huyết dưới da, ở một số trường hợp có giảm tiểu cầu nặng.
Bạch cầu thường tăng từ 15 – 200 G/L. Trong công thức bạch cầu, lympho tăng từ 5-150.000 G/L (bình thường ≤ 4G/L) và chiếm tới 70-95% số lượng bạch cầu. Trên phiến đồ máu ngoại vi thấy dày đặc các lympho bào có hình dạng tương đối bình thường.
Tiêu chuẩn chính để chẩn đoán:
Tăng lympho trong máu ngoại vi (>4000G/L) trong ít nhất 4 tuần, liên quan với tăng lympho trong tủy xương (>40%) hoặc sinh thiết tủy xương hoặc sinh thiết hạch phù hợp với bệnh bạch cầu lympho mạn.
Nhiều hạch to có thể kèm theo lách to, gan to.
Người bệnh thường >50 tuổi.
Hiện nay, trên thế giới và nước ta vẫn đang áp dụng hệ thống xếp giai đoạn cho bệnh bạch cầu lympho mạn theo Rai và Binet. Đây là 2 hệ thống xếp giai đoạn đơn giản, dễ áp dụng và rất có ý nghĩa trong thái độ xử trí cũng như tiên lượng bệnh.
Bệnh bạch cầu lympho mạn ở giai đoạn sớm (0, 1, 2 theo Rai và A,B theo Binet) hầu như không cần điều trị. Việc điều trị bằng các thuốc hóa chất ở giai đoạn này có thể còn làm thời gian sống của người bệnh giảm đi do biến chứng của hóa chất.
Việc điều trị chỉ nên bắt đầu khi người bệnh có các biểu hiện sau:
Hạch to gây các rối loạn chức năng các cơ quan: gây liệt, gây đau, gây tắc bạch mạch, động, tĩnh mạch …
Hoặc lách to gây khó thở, đầy tức khó chịu.
Hoặc có các diễn biến toàn thân nặng lên: sút cân (>10% trong vòng 6 tháng), mệt mỏi nhiều, sốt (trên 380 C trong hơn 2 tuần).
Hoặc có các biến đổi về huyết học: Bạch cầu lymphô tăng quá cao hoặc có hiện tượng non hóa (chuyển thành prolymphocyte), hoặc bạch cầu lympho tăng hơn 50% trong 2 tháng hoặc thời gian nhân đôi số lượng ước tính dưới 6 tháng.
Thiếu máu (Hb
Giảm tiểu cầu (
Về diều trị hóa chất: phác đồ được sử dụng nhiều cho người bệnh bệnh bạch cầu lympho mạn là phối hợp chlorambucil và prednisolon. Tỉ lệ đáp ứng ở các nghiên cứu khác nhau dao động từ 38% – 74% và thời gian sống trung bình khoảng 5 năm.
Phác đồ CVP (hay còn gọi là COP) cũng cho tỉ lệ đáp ứng và thời gian sống tương đương với phác đồ chlorambucil + prednisolon. Phác đồ không những có hiệu quả khi điều trị các người bệnh mới (chưa điều trị) mà còn có tác dụng cả với các người bệnh trước đó đã điều trị bằng chlorambucil + prednisolon. Độc tính với tủy xương của phác đồ CVP cũng cao hơn chlorambucil + prednisolon.
Phác đồ CHOP cho tỉ lệ đáp ứng cao hơn nhưng thời gian sống thêm sau điều trị không khác với các phác đồ nói trên là bao. Phác đồ được sử dụng khi bệnh tiến triển mạnh, cần sự lui bệnh nhanh.
Về kháng thể đơn dòng: Alemtuzumab là kháng thể đơn dòng chống CD52 có mặt trên cả tế bào B và tế bào T. Hiện thuốc đã được công nhận trong điều trị bệnh bạch cầu lympho mạn tế bào B kháng với các thuốc hoá chất. Do thuốc ức chế tế bào T có nguy cơ nhiễm trùng khá cao nên phải sử dụng các thuốc kháng sinh và kháng virus kèm theo.
Rituximab là kháng thể đơn dòng đặc hiệu với CD20. CD20 bộc lộ ít hơn trên tế bào bệnh bạch cầu lympho mạn so với u lympho ác tính do đó rituximab đem lại lợi ích thấp hơn khi điều trị bệnh bạch cầu lympho mạn. Khi sử dụng điều trị ban đầu cho bệnh bạch cầu lympho mạn, rituximab cho tỷ lệ đáp ứng 51% với đáp ứng hoàn toàn 4%. Phối hợp rituximab với hoá chất cho kết quả cao hơn khi sử dụng riêng rẽ từng loại.
Trong các trường hợp hạch quá to gây đau, gây chèn ép, bít tắc hoặc làm biến dạng ảnh hưởng đến thẩm mỹ, hoặc lách to gây khó chịu cho người bệnh thì cần tia xạ tại chỗ (liều thấp: 20 Gy) để giảm bớt triệu chứng. Tia xạ vào lách còn có tác dụng giảm số lượng bạch cầu máu ngoại vi và cải thiện tình trạng thiếu máu.
Chỉ định điều trị 32P cho những người bệnh bạch cầu lympho mạn trong một số trường hợp sau:
Điều trị hóa chất hiệu quả kém.
Người bệnh có thể trạng yếu, không chịu đựng được hóa trị.
Người bệnh mắc các bệnh mạn tính như: Viêm gan mạn, xơ gan, suy thận, suy tim, COPD …
Chống chỉ định: Người bệnh có số lượng tiểu cầu
Quy trình điều trị bệnh bệnh bạch cầu lympho mạn:
Chuẩn bị người bệnh: Trước điều trị người bệnh ăn chế độ ít sắt và calci vì nó có thể tạo thành muối phosphat không hòa tan làm giảm hấp thu 32P. Đối với điều trị bằng đường uống, người bệnh cần nhịn ăn trước khi uống dung dịch 32P ít nhất 2 giờ.
Điều trị: liều dùng 1- 2,5mCi/kg cân nặng tiêm tĩnh mạch, có thể chia làm nhiều lần. Đường uống dùng 1 lần duy nhất. Hiệu quả điều trị theo đường uống và đường tiêm là tương đương, nhưng giá thành điều trị bằng đường uống có giá thành thấp hơn. Kết quả đáp ứng tốt đạt 60-90%.
Biến chứng giảm tiểu cầu: tùy theo mức độ số lượng tiểu cầu trong máu ngoại vi để xử trí. Giảm tiểu cầu mức độ nhẹ và vừa dùng Corticoid (methylpredniosolon) 40-80 mg/ngày/tiêm truyền tĩnh mạch). Giảm tiểu cầu nặng
Điều trị u máu nông bằng tấm áp 32p
U máu (dị dạng mạch máu bẩm sinh) là căn bệnh thường gặp ở trẻ em, xuất hiện ngay khi sinh hoặc trong vài tuần, vài tháng sau sinh. Khối u thường phát triển nhanh từ tháng thứ 6 – 10 và bắt đầu quá trình thoái triển tự nhiên sau 1 năm. U có thể biến mất hoàn toàn hay một phần khi trẻ 5 – 8 tuổi.
Vị trí: đầu-cổ 60%; thân mình 20%; chi 15%.
Tổn thương cơ bản: dạng bớt máu: đó là các vết, mảng da màu hồng hoặc đỏ, hình thù đa dạng, ranh giới rõ với da lành, mật độ mềm.
Về hình thái, u máu được chia làm 3 loại:
U máu mao mạch: xuất hiện như một vết son hay một mảng màu rượu chát trên cùng mặt phẳng với da bình thường, ấn xuống không mất màu. U thường lớn dần theo cơ thể trẻ em, phát triển nhanh hay chậm tuỳ theo từng vị trí. Chẳng hạn, những u máu ở vùng gần niêm mạc như môi, mắt, vùng cổ, tuyến nước bọt sẽ phát triển nhanh hơn những u ở bề mặt da, tứ chi, ngực, bụng…
U máu dạng hang: thường lớn, nhô khỏi mặt da. Trong đa số trường hợp, u lan rộng và xâm lấn mô dưới da, cơ và có thể làm biến dạng cơ thể. Loại u này có thể xuất hiện cả ở các cơ quan nội tạng hay trong não.
U máu hỗn hợp: thường gồm cả thể nang và mạch bạch huyết, gặp nhiều nhất ở tuyến mang tai, thương tổn nằm cả trong và dưới da.
Có thể tiến hành một số thăm dò cận lâm sàng sau để đánh giá thêm:
Siêu âm: đánh giá có u máu trong gan không.
Siêu âm Doppler: đánh giá có dị dạng hệ mạch máu sâu dưới da không.
MRI, CT, Angiography: đánh giá có dị dạng hệ mách máu não hoặc cơ quan khác không.
Trước đây để điều trị u máu người ta thường sử dụng các phương pháp tiêm xơ, phẫu thuật… Tuy nhiên, những biện pháp này thường để lại sẹo xấu.
Một số phương pháp mới được áp dụng trong điều trị u máu như tia laser hay dùng sản phẩm Heberon Alpha đều mang lại hiệu quả nhất định.
Tấm áp 32P do Viện nghiên cứu hạt nhân Đà Lạt sản xuất. Dược chất phóng xạ 32P được tẩm vào vải thô, mềm, bọc kín trong túi polyethylen, hoạt độ phóng xạ ban đầu 120 mCi/ tấm (hoạt độ riêng 15 mCi/cm2) được sử dụng điều trị u máu nông ở trẻ em.
Liều điều trị 250 – 300 cGy/lần x 5 lần/tuần, tổng liều 3.000 cGy. Đánh giá kết quả theo các mức:
Tốt: xóa hết tổn thương.
Khá: xóa được 50-70% tổn thương, tiếp tục theo dõi, nếu cần có thể điều trị tiếp liệu trình thứ 2 sau 3 tháng.
Trung bình: xóa được
Kết quả cho thấy đạt tốt khoảng 70-80% trường hợp, phụ thuộc vào tuổi bệnh nhân, kích thước u. Dưới 5 tuổi, u nhỏ dưới 1 cm kết quả tốt hơn. Phương pháp có ưu điểm đơn giản, không chảy máu, không đau đớn, có thể điều trị nội trú và ngoại trú.
Chỉ định: u máu phẳng, dày dưới 3 mm, vị trí cho phép có thể áp. Không áp ở bờ mi mắt đề phòng tổn thương giác mạc, sau tai trước xương chũm ít hiệu quả. không điều trị được diện quá rộng.
Trong quá trình điều trị cần chú ý kiểm tra các dấu hiệu: đỏ da, rát, ngứa, có phỏng nước tại vị trí áp không, trạng thái toàn thân có gì bất thường. Sau điều trị: tái khám định kỳ 3 tháng 1 lần để đánh giá kết quả và xử trí các tác dụng phụ muộn nếu có.
Điều trị bệnh tim mạch
Nổi bật của YHHN ứng dụng trong tim mạch là điều trị bệnh động mạch vành. Một trong các phương pháp điều trị được coi là hữu hiệu đối với bệnh hẹp động mạch vành là nong mạch và đặt stent tại chỗ chít hẹp. Tuy nhiên, đó chưa phải là một biện pháp điều trị triệt để vì vẫn còn một tỷ lệ nhất định tái hẹp dẫn tới phải điều trị lại. Nguyên nhân là do sự tăng sinh của tổ chức nội mạc trong lòng mạch, nơi đặt stent dẫn đến tái hẹp. Các nghiên cứu cho thấy liều phóng xạ từ 10 – 30 Gy có vai trò hữu ích, ức chế quá trình tăng sinh của tổ chức nội mạc, duy trì sự thông suốt động mạch. Phương pháp này được áp dụng từ 1990 và được gọi là phương pháp điều trị áp sát trong lòng mạch. 32P là ĐVPX thích hợp đưa vào áp sát lòng mạch nhất. Nguồn phóng xạ đưa vào dưới dạng một nguồn kín. Stent được chế tạo bằng Titani nguyên chất, hợp kim Titani – Nitin hay thép không rỉ, được tráng một lớp 32P bền vững về hóa học, cứng và chịu được ma sát.
Điều trị các khối u trong phúc mạc, phế mạc
Cơ thể con người có 3 màng thanh mạc sinh ra từ trung bì, đó là: màng bụng (phúc mạc), màng phổi (phế mạc) và màng ngoài tim (ngoại tâm mạc). Màng thường có 2 lớp: lớp mô liên kết và lớp mesothelium. Các tế bào khối u, các kháng thể và các keo phóng xạ đều có thể bám vào lớp màng mesothelium. Mesothelium có chứa các vi mao làm cho diện tích của nó tăng lên và tăng cả khả năng chế tiết. Màng bụng là một túi kín đối với nam giới, và là túi mở ở ống dẫn trứng đối với nữ giới. Màng bụng phân ra thành nhiều phần vì có mạc treo.
Cổ trướng thường do bệnh ở gan (xơ gan, rượu), suy tim; tế bào ung thư bám vào bề mặt thanh mạc của màng bụng. Khi có các ổ di căn ung thư vào màng bụng tiên lượng sẽ rất xấu. Phần này đề cập đến việc điều trị các ổ di căn đó.
Ung thư buồng trứng di căn vào màng bụng:
Có 2 loại ung thư hay di căn vào màng bụng: ung thư dạ dày và buồng trứng. Trong ung thư buồng trứng hay gặp nhất là cystadenoma và papillary carcinoma. Khi chẩn đoán ung thư thì trên 50% số bệnh nhân đã có di căn xa.
Tại Bệnh viện Norwegium Radium, người ta đã dùng keo 32P tiêm vào màng bụng để điều trị, liều dùng: 7 – 10 mCi. Kết quả cho thấy tần suất sống thêm đạt cao hơn so với điều trị bằng hoá chất cisplatin. Theo dõi sau 72 tháng thấy thời gian sống thêm không còn bệnh ở nhóm 32P dài hơn nhóm cisplatin.
Dùng 32P tiêm vào màng bụng để điều trị gây tắc ruột nhiều hơn so với cisplatin. Bệnh nhân điều trị bằng chiếu xạ ngoài còn bị tắc ruột cao hơn nữa. Có thể điều trị cho bệnh nhân ung thư buồng trứng có di căn vào màng bụng bằng cách tiêm nhỏ giọt vào màng bụng 32P chromic phosphate (5 mCi) phối hợp với dùng cisplatin.
Các hợp chất platinum được áp dụng có kết quả, thuốc được tiêm vào tĩnh mạch hoặc màng bụng, dùng đơn thuần hoặc phối hợp với hoá chất. DCPX được dùng là 193mPt hoặc 195mPt. Cần nghiên cứu thêm về phối hợp platinum với 32P và với những chất bảo vệ phóng xạ, tránh tắc ruột.
Các bước tiến hành:
Siêu âm xác định mức dịch ổ bụng, xác định vị trí chọc hút dịch.
Sát khuẩn. Tiêm vô cảm bằng lidocain, xylocaine.
Chọc dịch ổ bụng tại điểm giao giữa 1/3 ngoài và 2/3 trong đường thẳng nối từ rốn đến gai chậu trước trên bên trái. Rút dịch ổ bụng cho chảy hết.
Tiêm thuốc phóng xạ vào khoang màng bụng. Rút kim. Sát khuẩn. Sau khi tiêm phóng xạ bệnh nhân cần nằm tại giường 2-4h, thay đổi tư thế nằm liên tục.
Theo dõi và xử trí tai biến:
Toàn thân: bệnh nhân buồn nôn, chán ăn, giảm bạch cầu. Xử trí: kháng sinh, chống viêm, chống nôn, corticoid, thuốc kích bạch cầu.
Tại chỗ: tổn thương viêm do bức xạ. Xử trí: kháng sinh, chống viêm, corticoid.
Điều trị tràn dịch màng phổi bằng dcpx:
Tràn dịch màng phổi do ung thư di căn là triệu chứng thường gặp. Tràn dịch màng phổi với số lượng lớn gây đau tức ngực, ho, khó thở ảnh hưởng đến chất lượng sống.
Các phương pháp điều trị dịch màng phổi thông thường là chọc hút, đặt ống dẫn lưu, sử dụng các thuốc gây độc tế bào toàn thân, bơm hoá chất (bleomycin, fluorouracil, cisplatin…), bơm chất gây xơ dính (doxycyclin, bột talc…) vào khoang màng phổi. Phẫu thuật mở ngực và bóc màng phổi đối với tràn dịch kháng điều trị nội khoa.
Có đến 50% tràn dịch phế mạc là do ung thư. Ung thư loại nào cũng có thể lan vào phế mạc, nhưng hay gặp nhất là ung thư vú, ung thư phổi, lymphoma. Những bệnh không phải ung thư mà gây tràn dịch phế mạc thường là phế viêm, lao phổi, suy tim, bệnh về collagen ở mạch máu.
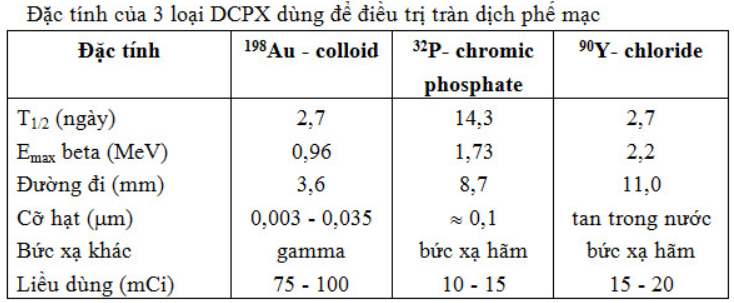
Bơm keo phóng xạ vào khoang màng phổi là phương pháp mới. Có 3 chất hay được dùng: 198Au – colloid, 32P – chromic phosphate, 90Y – chloride.
Tia beta có thể phá hủy các tế bào u trong dịch màng phổi và chính màng phổi làm giảm sự tạo thành dịch bởi mesothelium, đồng thời một số hạt keo phóng xạ bị thực bào làm cho hạch bạch huyết bị chiếu xạ. Đôi khi tiêm keo phóng xạ vào màng phổi gây khó thở và sốt. Tai biến nghiêm trọng hiếm xảy ra.
Tuy nhiên, dùng các chất phóng xạ cũng không được ưa chuộng vì cơ thể bị chiếu xạ. Dùng 198Au thì có thêm tia gamma, dùng 32P và 90Y thì có bức xạ hãm đều bất lợi cho cơ thể. Điều trị bằng keo phóng xạ chỉ là tạm thời, không phải là điều trị triệt căn. Tác dụng của DCPX chỉ giới hạn ở mức làm giảm dịch tiết, bớt khó thở, giảm ho.
Cắt bỏ bao hoạt dịch bằng phóng xạ
Trước đây người ta đã cắt bỏ bao hoạt dịch bằng phẫu thuật (Synovectomy) để điều trị một số bệnh xương khớp, dùng corticoid tiêm vào khớp. Gần đây phương pháp dùng DCPX tiêm thẳng vào ổ khớp để tiêu hủy bao hoạt dịch mang lại kết quả tốt trong các bệnh khớp viêm mạn tính không phải do nhiễm khuẩn, giải quyết được nguồn gốc đau.
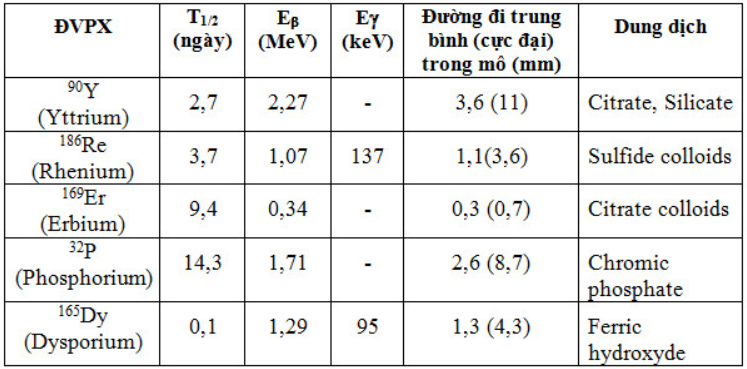
ĐVPX được gắn với chất mang dưới dạng các hạt keo, kích thước đủ nhỏ để các tế bào hoạt dịch (Synovial) có thể “thực bào” được, phân bố đều trong bao khớp. Đồng thời kích thước hạt phải đủ lớn để không thoát ra ngoài theo mao mạch hoặc hạch bạch huyết, gây chiếu xạ cho gan, lách, sụn khớp. Kích thước hạt tối ưu khoảng 2 – 5mm.
Sau khi tiêm thuốc phóng xạ vào nội khớp, bức xạ beta tác động vào bao hoạt dịch phì đại mà không ảnh hưởng đến sụn khớp, làm giảm xung huyết và gây xơ hóa. DCPX xâm nhập vào tế bào màng hoạt dịch và phân bố bên trong bề mặt của bao hoạt dịch gây viêm tắc các vi mạch cấp máu màng hoạt dịch + tác dụng độc tế bào do tia xạ, “cắt” bao hoạt dịch, phá hủy dịch viêm.
Đặc tính vật lý DCPX thường dùng:
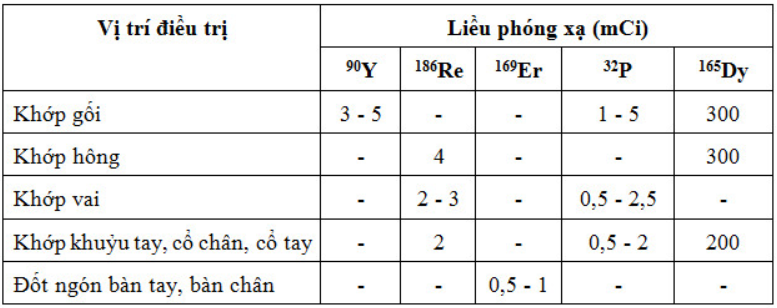
Liều lượng DCPX dùng cho các khớp
Chỉ định cho các trường hợp:
Viêm đa khớp dạng thấp.
Các bệnh viêm khớp mạn không do nhiễm khuẩn và lao.
Tràn dịch bao hoạt dịch kéo dài (khớp gối giả).
Viêm bao hoạt dịch thể lông, nốt sắc tố.
Bệnh khớp ưa chảy máu (biến chứng của bệnh Hemophilly).
Không điều trị bằng phương pháp này cho bệnh nhân trẻ em.
Sau khi tiêm DCPX, các khớp điều trị phải được bất động 48 giờ. Kết quả tùy thuộc vào tiến triển của bệnh và sự phá hủy của xương. Trong các bệnh khớp không có phá hủy xương nghiêm trọng cải thiện tốt được 70 – 80% trường hợp, tương đương với phẫu thuật cắt bỏ bao hoạt dịch. Liều lượng phóng xạ được chỉ định phụ thuộc vào loại ĐVPX lựa chọn và kích thước khớp.