Nguyên tắc điều trị ung thư
Ung thư là một bệnh lý ác tính, tuy nhiên có thể điều trị khỏi nếu thực hiện tốt các nguyên tắc điều trị sau đây.
Phối hợp các phương pháp điều trị
Các phương pháp chính điều trị ung thư hiện nay là: phẫu thuật, xạ trị, hoá trị, điều trị miễn dịch. Chỉ thực hiện đơn trị liệu trong trường hợp bệnh được phát hiện sớm và loại ung thư nhạy cảm với phương pháp điều trị. Với đa số các trường hợp ung thư đều phải phối hợp các phương pháp mới có thể đạt được hiệu quả điều trị tốt vì:
Đặc điểm của tổ chức và tế bào ung thư là phát triển mạnh tại chỗ, xâm lấn ra các tổ chức xung quanh, di căn xa.
Đa số bệnh nhân đến với thầy thuốc thì bệnh đã ở giai đoạn muộn.
Đáp ứng của mỗi loại ung thư với phương pháp điều trị rất khác nhau, vì vậy khi phối hợp các phương pháp điều trị có thể sẽ đưa lại hiệu quả cao hơn.
Xác định mục đích điều trị
Điều trị triệt căn, điều trị hỗ trợ hoặc điều trị triệu chứng. Để xác định được mục đích cần phải có chẩn đoán chính xác và cụ thể cho từng bệnh nhân.
Chẩn đoán chính xác loại ung thư nguyên phát: căn cứ vào kết quả giải phẫu bệnh lý (tiêu chuẩn vàng và bắt buộc), phân chia thành các nhóm nhỏ để hiểu rõ bản chất của tổ chức ung thư giúp cho phép tiên lượng, chỉ định phương pháp điều trị thích hợp.
Xác định đúng giai đoạn bệnh: phải căn cứ vào kết quả thăm khám lâm sàng, cận lâm sàng để chẩn đoán giai đoạn bệnh. Việc xác định giai đoạn bệnh đối với từng loại ung thư có khác nhau tuy nhiên thông dụng nhất hiện nay là xếp loại ung thư theo hệ thống TNM của UICC cho từng bệnh nhân với mỗi loại ung thư cụ thể.
Lập kế hoạch điều trị
Để lập kế hoạch điều trị cho một bệnh nhân ung thư phải căn cứ vào:
Chẩn đoán lâm sàng.
Tiến triển của bệnh.
Chẩn đoán giải phẫu bệnh lý.
Mục đích của điều trị.
Kế hoạch điều trị và chăm sóc phải toàn diện và chi tiết cho từng giai đoạn, điều này có vai trò quan trọng quyết định hiệu quả điều trị.
Khi lập kế hoạch điều trị việc lựa chọn phương pháp điều trị khởi đầu cho bệnh nhân (phẫu thuật, xạ trị hay hoá trị) là hết sức quan trọng.
Trong quá trình thực hiện kế hoạch và theo dõi kết quả điều trị, thấy những điểm, những biện pháp không phù hợp hoặc bệnh nhân có diễn biến bất thường thì phải bổ sung, điều chỉnh kế hoạch nhằm đạt được kết quả điều trị tối ưu nhất, đồng thời hạn chế các biến chứng có thể xảy ra cho bệnh nhân.
Theo dõi kết quả điều trị
Ung thư là bệnh có nguy cơ cao di căn xa, tái phát và có nhiều biến chứng sau điều trị, vì vậy theo dõi tiến triển của bệnh và kết quả điều trị thông qua khám định kỳ là việc làm bắt buộc nhằm mục đích:
Phát hiện và khắc phục các biến chứng do điều trị gây nên.
Phát hiện sớm di căn và tái phát của ung thư.
Trong 2 năm đầu yêu cầu khám định kỳ 2 – 3 tháng/lần, những năm tiếp theo 6 tháng /lần cho đến hết cuộc đời của bệnh nhân.
Các phương pháp điều trị ung thư
Mục tiêu của điều trị ung thư là phải lấy hết khối ung thư và/ hoặc tiêu diệt được toàn bộ các tế bào ung thư có trong cơ thể.
Ngày nay cùng với căn bệnh của thế kỷ HIV-AIDS mà Thế giới đang phải đương đầu, ung thư cũng là một thách thức to lớn của nền y học hiện đại. Phát hiện bệnh sớm, điều trị sớm, tích cực và triệt để với nhiều mô thức và phương tiện hữu hiệu sẽ giúp cứu sống và điều trị khỏi cho nhiều người bệnh ung thư. Các phương pháp điều trị ung thư hiện nay là: phẫu thuật, xạ trị, hoá trị. Miễn dịch trị liệu là hướng mới đang được nghiên cứu ứng dụng và hứa hẹn nhiều triển vọng. Lựa chọn phương pháp điều trị đầu tiên đúng đắn, phối hợp các phương pháp hợp lý sẽ góp phần nâng cao hiệu quả điều trị.
Phẫu thuật
Phẫu thuật là phương pháp được sử dụng sớm nhất, qua nhiều thế kỷ cho đến nay vẫn là phương pháp điều trị ung thư chủ yếu, cơ bản và hữu hiệu. Theo thống kê của Tổ chức chống ung thư Quốc tế có tới 80% bệnh nhân ung thư được điều trị bằng phẫu thuật. Ở Việt Nam tỷ lệ này còn thấp hơn, một phần do thiếu điều kiện, một phần do thiếu hiểu biết, một số còn cho rằng đối với ung thư nếu “đụng dao kéo vào” bệnh sẽ phát triển nhanh, sớm đi đến tử vong hơn.
Mục đích của phẫu thuật gồm có: phẫu thuật dự phòng, phẫu thuật chẩn đoán và phẫu thuật điều trị (triệt căn hoặc triệu chứng).
Ưu điểm của phẫu thuật
Có khả năng điều trị khỏi một số BN đang ở giai đoạn tại chỗ (I, II).
Loại bỏ một cách nhanh nhất khối u ra khỏi cơ thể và đánh giá tương đối chính xác mức độ xâm lấn, di căn khu vực, đồng thời làm chẩn đoán giải phẫu bệnh lý, cho phép chẩn đoán chính xác loại ung thư.
Ung thư không có sự đề kháng sinh học đối với phẫu thuật.
Không có nguy cơ tiềm tàng gây ung thư thứ phát (như xạ trị, hoá trị).
Nhược điểm của phẫu thuật
Phẫu thuật cắt bỏ khối u thì đồng thời sẽ gây tổn thương các mô, tổ chức lành và khó có thể lấy hết khối u đã có sự xâm lấn mà mắt thường không nhìn thấy được hoặc ở những vị trí nguy hiểm.
Phẫu thuật có nhiều biến chứng cấp tính có thể đe doạ đến tính mạng và/hoặc để lại di chứng làm ảnh hưởng đến sức khoẻ, chức năng giải phẫu và sinh lý của bệnh nhân.
Phẫu thuật không thực hiện được đối với những trường hợp ung thư ở giai đoạn muộn, có di căn xa, ở những vùng giải phẫu đặc biệt của cơ thể hoặc ở những bệnh nhân tuổi cao, có các bệnh lý phối hợp.
Xạ trị
Là phương pháp điều trị ung thư mà trong đó người ta sử dụng bức xạ ion hoá năng lượng cao để tiêu diệt các tế bào ung thư.
Xạ trị ung thư xuất hiện vào đầu thế kỷ 20. Ngày nay nhờ sự tiến bộ nhanh chóng của khoa học và công nghệ, các thiết bị có công nghệ tiên tiến ra đời, xạ trị đang chứng tỏ là phương tiện hữu hiệu và ưu việt trong các phương pháp điều trị ung thư.
Ưu điểm của phương pháp xạ trị
Đối với ung thư giai đoạn sớm, bức xạ ion – hoá có khả năng điều trị khỏi tương tự như phẫu thuật, thậm chí trong một số trường hợp, xạ trị còn tỏ ra ưu việt hơn phẫu thuật do ít gây tổn thương và rối loạn chức năng của cơ quan và tổ chức lân cận hơn và ít gây đau đớn hơn.
Chiếu xạ có thể điều trị được ung thư ở một số vị trí mà các phương pháp khác không có khả năng can thiệp hoặc nếu can thiệp dễ gây ảnh hưởng nặng nề, làm mất chức năng tổ chức lành xung quanh (ung thư vòm họng).
Chiếu xạ còn được dùng trong một số trường hợp như: giảm đau (trong di căn cột sống, xương), giảm chèn ép do khối u quá lớn, cầm máu.
Chiếu xạ không gây độc toàn thân, không gây nên những biến chứng cấp tính đe doạ tính mạng của người bệnh.
Nhược điểm của xạ trị
Vùng lõi của khối u thường bị hoại tử, thiếu oxy, do đó ít nhạy cảm với tia xạ hơn, vì vậy sự tái phát thường từ các tế bào ở vùng trung tâm của khối ung thư.
Sự nhạy xạ của các mô lành và cơ quan khác nằm sát cạnh u là yếu tố cản trở việc nâng liều xạ đến mức tối đa để có thể tiêu diệt hoàn toàn khối ung thư.
Bức xạ ion hoá có nguy cơ gây ung thư thứ phát.
Hoá trị
Hoá trị là phương pháp được đưa vào áp dụng từ thập niên 40 của thế kỷ trước và nhanh chóng được giới y học công nhận là một phương pháp điều trị ung thư chính thức. Đầu tiên hoá trị được sử dụng điều trị ung thư hệ tạo máu, sau đó người ta nhận thấy hoá chất cũng có tác dụng đối với những khối u đặc như: carcinoma tế bào đệm, ung thư tinh hoàn. Thời gian đầu hoá trị được sử dụng nhiều đối với những trường hợp ung thư đã có di căn xa. Ngày nay với sự phát triển mạnh mẽ của công nghệ hoá dược, hoá trị liệu được sử dụng rộng rãi trong hầu hết các loại ung thư ở các giai đoạn khác nhau. Tuy nhiên hiệu quả của hoá trị ung thư còn tỏ ra hạn chế khi khối ung thư quá lớn và trong trường hợp ung thư còn khu trú tại chỗ, tại vùng thì hoá trị đơn thuần cũng không đủ khả năng làm tan hoàn toàn khối u mà cần phải dựa vào các phương pháp điều trị khác như: phẫu thuật, chiếu xạ.
Nhược điểm của hoá trị là:
Các thuốc ung thư chỉ hữu hiệu khi tổng tế bào khối ung thư còn nhỏ (dưới một tỷ tế bào).
Mật độ tưới máu của khối u không đồng đều do vậy thuốc khó đến được vùng trung tâm của khối ung thư nơi có hệ thống mạch máu nghèo nàn.
Các tế bào ung thư có cơ chế thải độc dẫn tới kháng thuốc sau một số chu kỳ hóa trị.
Các hoá chất gây độc cho nhiều cơ quan, tổ chức của cơ thể là cản trở lớn cho điều trị.
Các hoá chất có nguy cơ tiềm tàng sinh ung thư thứ phát về sau.
Miễn dịch liệu pháp
Miễn dịch liệu pháp là phương pháp ra đời muộn nhất trong các phương pháp điều trị ung thư.
Ưu điểm của liệu pháp miễn dịch là tính đặc hiệu cao và có tác dụng toàn thân. Vào những năm 90 của thế kỷ 20 việc ứng dụng các interferon, interleukin cũng tỏ ra chưa hữu hiệu lắm, bên cạnh đó các phản ứng phụ của liệu pháp này cũng đáng kể. Những năm gần đây các nghiên cứu tìm liệu pháp sinh học tác dụng có chọn lọc vào các oncogen, vào sản phẩm của oncogen là các protein gây chuyển dạng hoặc vào thụ thể của các protein đó. Các liệu pháp này có chung tên gọi là “liệu pháp nhắm vào đích” (targettherapy).
Một hướng điều trị mới khác cũng đang được nghiên cứu và ứng dụng là “phương pháp trị liệu bằng kháng thể đơn dòng”. Các nghiên cứu hiện đang còn ở pha I, một số pha II và một số thuốc đã được cấp phép lưu hành trên thị trường dược phẩm, cho thấy có cải thiện về mặt lâm sàng.
Tuy nhiên các biện pháp miễn dịch trên vẫn còn gặp phải các trở ngại sau:
Có sự lệ thuộc đáng kể giữa tổng khối tế bào ung thư và khả năng đáp ứng miễn dịch của cơ thể người bệnh.
Sự biểu hiện của các oncogen trong các tế bào của một khối u ở trong cơ thể không hoàn toàn giống nhau.
Một số tế bào ung thư có khả năng tạo ra các yếu tố khoá, ức chế đáp ứng miễn dịch làm vô hiệu hoá các kháng thể.
Một số vấn đề về xạ trị
Cơ sở sinh học của xạ trị
Năm 1943 Albert Bechem đã đưa ra “Các nguyên tắc liều lượng Radium và tia X”. Đây được xem là cơ sở sinh học phóng xạ đầu tiên trong điều trị.
Vùng tế bào có tỷ lệ tưới máu lớn hơn sẽ nhạy cảm với tia xạ hơn.
Tế bào không biệt hoá nhạy cảm với tia xạ hơn tế bào biệt hoá.
Trong các phase của quá trình phân bào thì giai đoạn phân chia là giai đoạn nhạy cảm nhất với tia xạ, ở pha M tế bào nhạy cảm với tia xạ nhất.
Khả năng phục hồi của các tế bào lành sau khi bị chiếu xạ cao hơn tế bào ung thư.
Để đề ra các chỉ định kỹ thuật chiếu xạ, người ta phải dựa trên các phase của chu kỳ sinh sản tế bào (chu kỳ phân bào) và sự phản ứng của của các chất gian bào (trong việc bảo vệ tổ chức lành xung quanh).
Tất cả các kỹ thuật xạ trị đều nhằm đạt liều lượng tối đa tại khối u, giảm tối thiểu liều ở các tổ chức lành xung quanh, nghĩa là phải dựa vào độ nhạy cảm phóng xạ của các tế bào khối u và tế bào lành. Mức độ nhạy cảm phóng xạ của tế bào cụ thể như sau:
Tế bào biệt hoá kháng tia xạ hơn các tế bào không biệt hoá.
Trong một chu kỳ phân bào gồm 4 phase: G1, S, G2, M (tế bào không phân chia ở trạng thái G0) độ nhạy cảm phóng xạ tăng cao ở cuối G1, từ G2 chuyển sang M. Đặc biệt dưới ảnh hưởng của bức xạ, chu kỳ sinh sản bị dừng lại ở phase G2. Đây là một phản ứng tự vệ có lợi vì G2 có nhiệm vụ kiểm tra, tu sửa, hiệu chỉnh trước khi sang phân bào. Nếu thúc đẩy nhanh phase G2 tế bào bị chết nhiều hơn.
Tác động của bức xạ ion hoá tới tế bào có thể là trực tiếp, có thể là gián tiếp qua các gốc tự do. Trong tế bào, phần bào tương ít nhạy cảm với phóng xạ, ngược lại nhân tế bào mà đặc biệt là acid nhân (ADN) rất nhạy cảm với phóng xạ.
Trong điều trị bằng tia xạ nhằm diệt các tế bào cần chú ý đến hiệu ứng ôxy: tế bào càng giàu ôxy thì càng nhạy cảm với tia xạ. Vì vậy muốn tăng khả năng diệt tế bào ung thư thì cần tăng nồng độ ôxy. Trong tổ chức ung thư, tế bào ung thư phát triển mạnh nên mạch máu phát triển, các tế bào phía ngoài khối u được cấp máu tốt hơn, ôxy đủ hơn nên nhạy cảm hơn với tia xạ. Những tế bào ở giữa khối u lại rất thiếu ôxy cho nên ít nhạy cảm hơn với tia xạ.
Để điều trị bằng tia xạ đạt hiệu quả tốt có thể dùng chất cảm xạ (sensitizer) làm cho tế bào khối u nhạy cảm hơn với tia xạ (như tăng cường Vitamin C, glucose cho tế bào) hoặc gây tăng nhiệt tại chỗ (bằng sóng siêu cao tần vào khối u, liệu pháp ôxy cao áp).
Các mục tiêu của xạ trị
Xạ trị triệt căn
Xạ trị đơn thuần hoặc kết hợp với các phương pháp điều trị khác, nhằm mục đích tiêu diệt hoàn toàn khối ung thư. Tất cả các kỹ thuật điều trị bằng tia xạ đều nhằm đạt được một liều lượng tối đa tại khối u và giảm thiểu liều chiếu ở các mô lành lân cận.
Xạ trị dự phòng
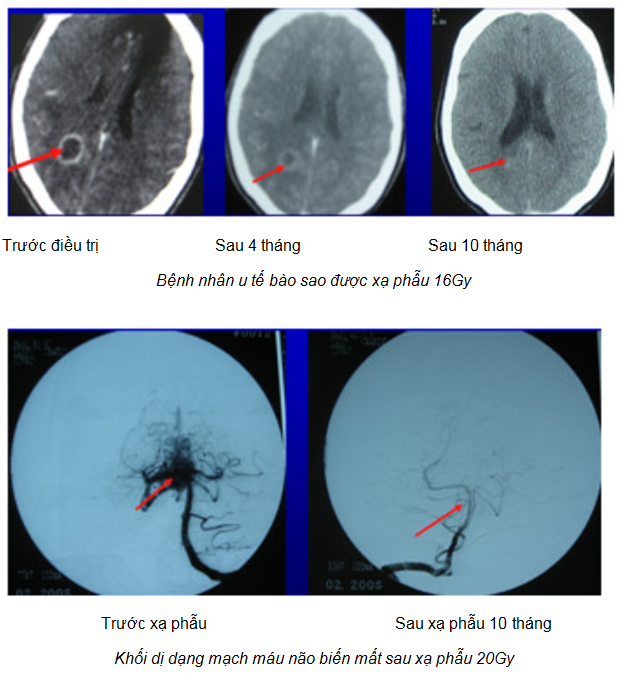
Mục đích là để phòng ngừa tái phát hoặc di căn sau phẫu thuật, sau hoá trị. Tổng liều có thể từ 18 – 60Gy tuỳ từng trường hợp cụ thể.
Xạ trị hỗ trợ
Với mục đích làm giảm thể tích khối u, biến ung thư ở giai đoạn không mổ được thành mổ được, hoặc hỗ trợ cho hoá trị đạt hiệu quả. Liều không quá 45Gy.
Xạ trị tạm thời, điều trị giảm nhẹ triệu chứng
Giảm đau (analgic) trong ung thư di căn xương, gan.
Giảm áp (decompressive) trong ung thư di căn não, tuỷ sống, trung thất, chèn ép tĩnh mạch chủ.
Cầm máu trong chảy máu do ung thư vòm họng, bàng quang, tử cung…
Giảm thể tích khối u, giảm chèn ép nhằm tạo sự thoải mái cho bệnh nhân ở giai đoạn cuối hoặc bệnh nhân tuổi quá cao, bệnh nhân mắc bệnh lý khác mà các biện pháp điều trị khác không thực hiện được.
Các chỉ định xạ trị trong điều trị ung thư
Xạ trị đơn thuần
Chỉ định xạ trị đơn thuần cho các trường hợp:
Khối u kích có thước nhỏ, được phát hiện ở giai đoạn sớm, ung thư vùng tai – mũi – họng, vú, cổ tử cung.
Ung thư nhạy với tia phóng xạ: Hodgkin, u lympho không Hodgkin, ung thư tinh hoàn…
Ung thư không mổ được vì:
Vị trí: Vòm họng, 1/3 giữa thực quản.
Khối ung thư xâm lấn rộng tại chỗ, tại vùng hoặc đã có di căn xa, ung thư giai đoạn muộn, chiếu xạ mang tính chất tạm thời.
Bệnh nhân từ chối phẫu thuật.
Bệnh nhân lớn tuổi, thể trạng kém.
Xạ trị điều trị triệu chứng: giảm đau, cầm máu, chống chèn ép…
Xạ trị kết hợp với phẫu thuật
Có thể chiếu xạ tại cùng một mô đích hay ở các mô đích khác nhau (tại khối u, tại hạch hoặc tại ổ di căn).
Xạ trị tiền phẫu
Mục đích giảm thể tích u, chuẩn bị cho phẫu thuật triệt để, giảm nguy cơ tái phát, di căn của ung thư vào các bộ phận lân cận.
Tổng liều thường không quá 30Gy, phẫu thuật sau xạ trị 4 – 6 tuần.
Chỉ định:
Ung thư vú > 3cm.
Ung thư cổ tử cung giai đoạn sớm (T1, T2).
Ung thư trực tràng.
Một số ung thư vùng đầu cổ, phế quản hay ung thư mô mềm.
Xạ trị hậu phẫu
Được tiến hành khi lấy không hết được khối u, có nhiều nguy cơ tái phát hoặc khi nạo vét hạch dương tính: Ung thư tai-mũi-họng, vú, cổ tử cung, phế quản…
Xạ trị vào hạch vùng sau mổ ung thư tinh hoàn.
Điều trị bảo tồn ung thư vú.
Phòng ngừa tái phát sau cắt đốt sống di căn.
Xạ trị trong lúc phẫu thuật
Xạ trị lúc đang mở bụng trong phẫu thuật ung thư dạ dày, ung thư tuỵ, trực tràng. Mục đích nhằm tiêu diệt các tế bào ung thư rơi rớt trong phẫu thuật. Liều duy nhất 15 – 25Gy.
Xạ trị kết hợp với hoá trị
Sự kết hợp 2 phương pháp nhằm nâng cao hiệu quả điều trị trên khối u nguyên phát cũng như phòng ngừa di căn. Xạ trị và hoá trị có tác dụng tương hỗ, cộng hưởng. Hiệu quả đạt được là:
Thể tích khối u giảm nhanh, các tế bào ung thư trở nên giàu ôxy hơn, nhạy cảm với tia xạ và hoá chất hơn.
Nhờ có quá trình phá huỷ tế bào ung thư nhanh hơn nên tránh được sự kháng tia và kháng hoá chất.
Bên cạnh sự kết hợp tác dụng điều trị, cần chú ý các tác dụng độc mang tính cộng hưởng của 2 phương pháp.
Trong một số trường hợp, xạ trị và hoá trị nhằm các mục tiêu khác nhau.
Trong bệnh bạch cầu cấp dạng lymphô bào đã được hoá trị ổn định, xạ trị vào não (18Gy) nhằm tiêu diệt các tế bào ung thư mà hoá chất không đến được do màng não ngăn chặn. Trong bệnh Hodgkin giai đoạn IV thể phổi, gan, tuỷ xạ trị áo khoác (Mantelet) hay Y ngược để đề phòng tái phát hạch.
Xạ hoá trị đồng thời
Tăng cường tác dụng của xạ trị hay ngăn ngừa nguy cơ di căn xa bằng hoá trị trong lúc phải xạ trị vào khối ung thư nguyên phát. Có thể áp dụng với ung thư tai – mũi – họng, ung thư vú dạng bùng phát. Nhiều ý kiến cho rằng khi dùng đồng thời cả 2 phương pháp này hiệu quả điều trị tốt hơn, nhưng mức độ biến chứng cũng nặng hơn vì vậy phải lựa chọn hoá chất và liều lượng điều trị thích hợp để tránh các biến chứng nặng khiến phải ngừng điều trị.
Xạ trị – hoá trị xen kẽ
Hoá trị và xạ trị được sử dụng tuần tự nhưng cách nhau một khoảng thời gian ngắn trong một số trường hợp chẳng hạn như ung thư ít nhạy với tia xạ, nguy cơ di căn cao ngay trong lúc điều trị ung thư nguyên phát (ung thư phổi loại không biệt hoá). Ưu điểm là ít biến chứng hơn xạ – hoá trị đồng thời.
Chiếu xạ với sự hỗ trợ của hoá trị
Thực hiện hoá trị trước xạ trị với mục đích nhằm làm giảm thể tích khối ung thư để xạ trị có hiệu quả, thực hiện sau xạ trị hoặc xạ phẫu để ngăn ngừa nguy cơ di căn xa của ung thư.
Các phương pháp xạ trị
Xạ trị chiếu ngoài
Còn gọi là xạ trị từ xa, hoặc cobalt liệu pháp vì đây là phương pháp chiếu xạ bằng tia gamma trên máy cobalt-60, được sử dụng cách đây hơn nửa thế kỷ. Ngày nay có rất nhiều thế hệ máy gia tốc tuyến tính (Linear Accelerator- LINAC) có nhiều tính năng vượt trội ra đời, đang dần thay thế máy cobalt trong điều trị ung thư.
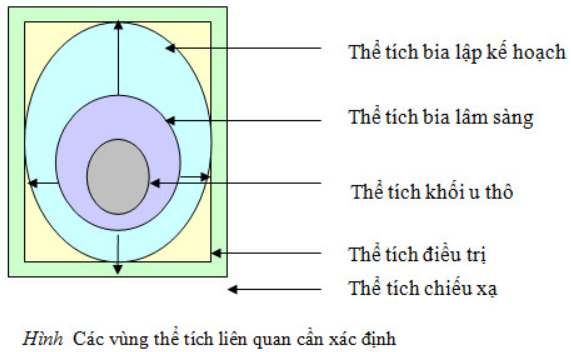
Các khái niệm thể tích trong chiếu xạ ngoài
Trong quá trình lập kế hoạch điều trị chiếu xạ cho bệnh nhân ung thư, một số thể tích cần phải được xác định, để có căn cứ xác định kỹ thuật điều trị tối ưu.
Hai loại thể tích cần xác định trước khi lập kế hoạch điều trị là:
Thể tích khối u thô (Gross Tumor Volume – GTV): là thể tích thể hiện sự lan rộng của tế bào ác tính mà có thể sờ, nắn hay nhìn thấy được bằng thăm khám, chụp CT, MRI… Thể tích khối u thô bao gồm cả khối u nguyên phát và các hạch di căn, các tổ chức di căn khác.
Thể tích bia lâm sàng (Clinical Target Volume – CTV): là thể tích khối u và những vùng bao quanh khối u mà tế bào ung thư có thể lan tới.
Ngoài ra trong quá trình lập kế hoạch điều trị một số loại thể tích khác cũng phải được xác định đó là:
Thể tích bia lập kế hoạch (Planning Target Volume – PTV): Là một khái niệm hình học, được xác định để lựa chọn kích thước chùm tia phù hợp, trong đó cần tính đến hiệu quả cao nhất của tất cả những thay đổi hình học có thể xảy ra, đảm bảo cho liều lượng đã chỉ định được phân bố tối ưu bên trong thể tích bia lâm sàng. Những thay đổi hình học này gồm:
Sự chuyển động của các thể tích bia: hít thở, cử động của bệnh nhân.
Những khác nhau về hình dạng của các tổ chức chứa bia lâm sàng, chẳng hạn như sự chứa đầy hay vơi của bàng quang.
Những khác nhau về tính chất hình học của chùm tia chẳng hạn kích thước, hướng của các chùm tia.
Thể tích điều trị (Treatment Volume – TV): là một thể tích bao quanh bởi một đường đồng liều trên bề mặt, đã được các bác sỹ điều trị lựa chọn và định rõ để đạt được mục đích điều trị. Một cách lý tưởng, liều lượng chỉ phân bố trên thể tích bia lập kế hoạch. Tuy nhiên, do những hạn chế của kỹ thuật điều trị mà mục đích này rất khó thực hiện hoàn chỉnh. Điều này dẫn đến phải xác định một thể tích điều trị.
Thể tích chiếu xạ (Irradiated Volume – IV): là một thể tích mà các mô nhận được một liều lượng được coi là có ý nghĩa trong việc liên quan đến tổng liều chịu đựng của các mô lành.
Các tổ chức có nguy cơ cao (Organ at Risk – OR): là các mô lành, nơi mà độ nhạy cảm phóng xạ của chúng có thể ảnh hưởng một cách có ý nghĩa đến việc lập kế hoạch điều trị và liều lượng được chỉ định (tuỷ sống, não, tim…)
Trong thập kỷ qua, một số phương pháp mới đã được phát triển để áp dụng một cách tốt hơn trong lĩnh vực xạ trị nhằm tăng hiệu quả điều trị, giảm thiểu nguy cơ các biến chứng. Sự ra đời của các phương pháp chẩn đoán hình ảnh chính xác như chụp cắt lớp, cộng hưởng từ, PET/CT cho phép xác định kích thước, vị trí u chính xác hơn, do đó thể tích chiếu xạ giảm đáng kể. Kỹ thuật xạ trị định vị, xạ trị điều biến liều của chùm tia cho phép giảm thiểu vùng mô lành bị chiếu xạ, giảm tác dụng không mong muốn của chiếu xạ.
Các trường chiếu
Trường chiếu đơn: sử dụng điều trị các loại ung thư da, ung thư nông dưới da (hạch cổ, nách, bẹn).
Trường chiếu đối song song: là các trường chiếu đối xứng với trục cơ thể, thường dùng để điều trị các loại ung thư nằm sâu gần mặt phẳng giữa cơ thể (tử cung, bàng quang, phổi)
Trường chiếu kết hợp: có thể kết hợp 3 trường chiếu (vòm họng), 4 trường chiếu (các khối u vùng chậu).
Các mô đích
Ung thư nguyên phát: vú, vòm họng, hạ họng – thanh quản, phổi
Hạch vùng: hạch cổ do ung thư đầu cổ, hạch nách trong ung thư vú, hạch thượng đòn trong ung thư phổi.
Ung thư nguyên phát và hạch vùng: ung thư cổ tử cung, ung thư bàng quang, tiền liệt tuyến, trực tràng và các hạch chậu
Các ổ di căn xa: xương, phổi, gan …
Phân liều điều trị
Phân liều chuẩn: thông thường: 2Gy x 5 lần/tuần hoặc 1,8Gy x 5 lần/tuần. Chiếu 1lần/ngày với tất cả các trường chiếu.
Đa phân liều: chiếu 2 hoặc 3 lần/ngày với phân liều nhỏ hơn (1,15 – 1,3 Gy/lần). Các lần chiếu cách nhau tối thiểu 6 giờ.
Gia tốc: chiếu xạ 2 lần/ngày với liều gần bằng hay bằng phân liều chuẩn (1,5 – 2 Gy), cho phép rút ngắn thời gian điều trị nhưng nguy cơ biến chứng cao.
Giảm phân liều: tăng liều mỗi lần (5Gy/1 lần/ngày), rút ngắn thời gian điều trị, nhưng hiện nay ít được sử dụng vì biến chứng nặng nề.
Mô phỏng
Là bước chuẩn bị tối cần thiết cho việc điều trị. Sử dụng một máy Xquang (CT) đặc biệt có tất cả các tính năng của một máy xạ trị, trừ nguồn phóng xạ được thay bằng bóng phát tia X, giúp xác định khu vực sẽ được chiếu xạ (trường chiếu) trên người bệnh nhân, giúp cho việc điều trị được chính xác.
Với các hình ảnh chụp trường chiếu từ máy mô phỏng, việc tính liều chiếu sẽ được các kỹ sư y Vật lý thực hiện một cách chính xác cho từng trường chiếu của mỗi bệnh nhân.
Một số kỹ thuật xạ trị đặc biệt
Xạ trị toàn thân: được thực hiện cho bệnh nhân chuẩn bị ghép tuỷ. Liều duy nhất 10Gy hay 12 Gy trong 6 phân liều trong 3 ngày.
Xạ trị nửa thân: chỉ định điều trị chống đau trong ung thư di căn nhiều vị trí. Xạ trị nửa thân trên hoặc nửa thân dưới trước. Liều 6Gy trong một phân liều đối với u tuỷ. Liều 8Gy (khi đến 6Gy thì phải che phổi) khi xạ trị nửa thân trên trong ung thư vú và tuyến tiền liệt di căn xương. Hai nửa thân được xạ trị cách nhau 4-6 tuần để có thời gian cho tiểu cầu phục hồi.
Xạ trị toàn bộ da: sử dụng chùm điện tử từ máy gia tốc có năng lượng 7-8 MeV. Hiệu suất cao nhất ở độ sâu 4 – 6 mm. Chỉ định cho u dạng nấm da bề mặt, liều 30Gy trong 6 tuần.
Xạ trị toàn bộ hệ bạch huyết: chỉ định chính cho ghép tuỷ cùng loài khác cá thể ở các bệnh nhân bị loạn sản tuỷ không rõ nguyên nhân. Ngoài ra còn chỉ định cho bệnh tự miễn. Phân một liều duy nhất 20-30 Gy.
Xạ trị với chùm tia nhỏ: dùng ống chuẩn trực đặc biệt với chùm tia cực nhỏ, đường kính ≤ 20 mm. Chỉ định cho dị dạng mạch máu não, một số khối u nhỏ có độ ác tính thấp ở trong não. Dùng khung định vị giữ đầu cổ cố định hoàn toàn. Liều 30Gy, một hoặc nhiều lần tia.
Xạ trị áp sát
Một số khối u ở những vị trí thuộc vùng hang hốc của cơ thể như cổ tử cung, trực tràng, thực quản… có thể dùng một ống áp (applicator) đặt trước rồi đưa ĐVPX vào sát với khối u để chiếu xạ. Như vậy có thể tăng liều chiếu ở khối u và giảm liều chiếu cho mô lành. Việc đưa nguồn xạ được thực hiện sau khi đã đặt ống áp đúng vị trí, thực hiện bằng điều khiển từ xa (qua máy tính) cho nên còn gọi là xạ trị áp sát nạp nguồn sau.
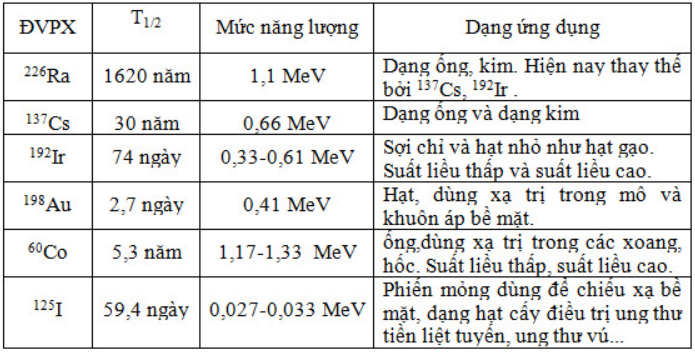
Các kỹ thuật như dùng kim phóng xạ Radium, dùng các hạt (seed) gắn phóng xạ cấy vào mô ung thư cũng được coi là xạ trị áp sát.
Chỉ định
Phối hợp với xạ trị ngoài: thường được sử dụng để giảm bớt các biến chứng do liều xạ ngoài vào mô lành đồng thời tăng liều chiếu tại khối u lên cao.
Phối hợp phẫu thuật: mục đích là để giảm khối lượng khối ung thư giúp phẫu thuật dễ dàng và triệt để hơn.
Điều trị đơn thuần: ít có chỉ định, chỉ sử dụng cho các trường hợp phát hiện sớm (giai đoạn 0 hay IA) hay các tổn thương vi thể còn lại sau phẫu thuật.
Nguyên tắc của xạ trị áp sát
Nguyên tắc chung của xạ trị áp sát là: “Liều chiếu tỷ lệ nghịch với bình phương khoảng cách”. Với nguyên tắc này, nếu nguồn phóng xạ càng được đưa vào sát tổn thương, sát các tế bào ung thư, thì liều chiếu tại khối u càng cao, còn các mô lành xung quanh chỉ phải nhận liều chiếu thấp hơn nhiều.
Các vị trí được xạ trị áp sát bao gồm tất cả các vị trí trong cơ thể mà các kỹ thuật hiện nay có thể đưa nguồn phóng xạ tới được các vị trí tổn thương.
Các loại xạ trị áp sát
Phân loại theo thời gian điều trị
Xạ trị áp sát có thời hạn: được sử dụng phổ biến nhất hiện nay, đồng vị phóng xạ được đưa vào sát khối ung thư và được để lại đó trong một thời gian xác định (theo suất liều đã được tính toán) sau đó được rút ra khỏi cơ thể.
Xạ trị áp sát vĩnh viễn: dùng các đồng vị phóng xạ có thời gian bán huỷ ngắn, và sẽ được để lại vĩnh viễn trong mô ung thư cần điều trị (198Au).
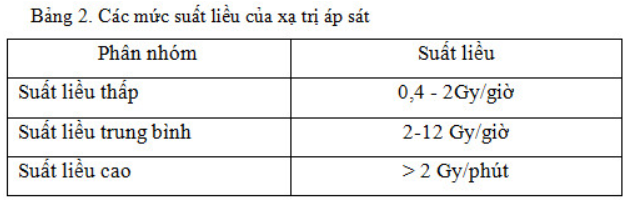
Theo suất liều chiếu
Theo vị trí tổn thương
Xạ trị áp sát trong các xoang, các hốc như ung thư cổ tử cung, vòm họng
Xạ trị áp sát trong mô: Ung thư vú, lưỡi, môi, sàn miệng, tiền liệt tuyến
Xạ trị áp sát trong lòng ống: Ung thư phế quản, thực quản , trực tràng
Theo phương pháp nạp nguồn
Xạ trị áp sát nạp nguồn tức thì: ĐVPX đặt sẵn trong applicator, được đưa vào vị trí điều trị của bệnh nhân cùng một lúc.
Xạ trị áp sát nạp nguồn sau: nguồn phóng xạ được đưa vào vị trí điều trị của bệnh nhân sau khi applicator đã được đặt sẵn trước đó.
Xạ trị áp sát nạp nguồn trực tiếp: nguồn phóng xạ được đưa trực tiếp bằng tay vào vị trí điều trị của bệnh nhân mà không có dụng cụ mang nguồn.
Xạ trị áp sát nạp nguồn từ xa: Người ta dùng bộ phận điều khiển từ xa (bên ngoài phòng điều trị) để đưa nguồn vào vị trí điều trị của bệnh nhân.
Xạ trị chuyển hoá
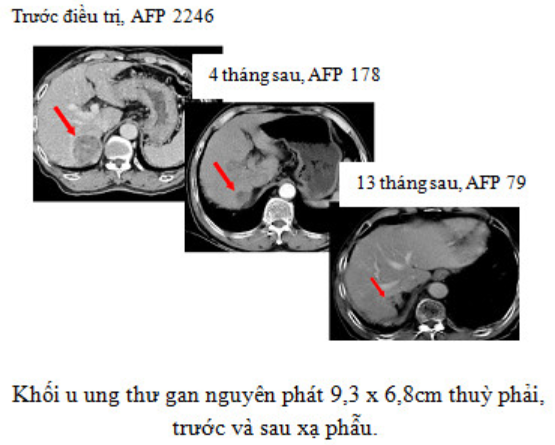
Là loại xạ trị mà người ta dùng dược chất phóng xạ đưa vào cơ thể bằng đường uống hoặc đường tiêm, chúng sẽ được tập trung tại mô ung thư (theo cơ chế vận chuyển tích cực, hoặc cơ chế lắng đọng, chuyển hoá, miễn dịch…). Bức xạ alpha hoặc beta do các chất phóng xạ phát ra làm chết các tế bào ung thư. Ví dụ 131I phát tia beta 0,611 MeV để điều trị bệnh UTTG, 32P phát tia beta 1,71MeV để điều trị ung thư di căn xương, bệnh đa u tuỷ, đa hồng cầu…
Các yếu tố ảnh hưởng tới tác động của tia xạ
Sự nhạy cảm phóng xạ
Các loại ung thư rất nhạy cảm với tia xạ như Seminoma, Lympho ác tính…
Nhạy cảm với tia xạ mức độ trung bình: hầu hết các Carcinoma.
Ung thư ít nhạy cảm với tia xạ: Melanoma, Sarcoma…
Người ta không thấy mối tương quan hằng định giữa khả năng xạ trị tan hoàn toàn khối u với vận tốc thu nhỏ khối u trong quá trình xạ trị.
Yếu tố thời gian
Tất cả các trường hợp điều trị bằng chiếu xạ đều phải đảm bảo 3 yếu tố:
Tổng liều chiếu (Gy).
Thời gian chiếu: từ ngày đầu tiên cho tới ngày kết thúc xạ trị.
Số lần chiếu xạ.
Phân liều chiếu xạ: liều chiếu cho mỗi lần phát tia (tổng liều/thời gian chiếu) là yếu tố rất quan trọng ảnh hưởng lên khối ung thư và mô lành khác nhau, từ đó đưa đến hiệu quả điều trị, cũng như biến chứng do tia khác nhau.
Thời gian chiếu xạ và phân liều chiếu được tính toán dựa vào 4 yếu tố tái tạo của sinh học phóng xạ sau:
Sự tái ôxy hoá của mô thiếu oxy.
Sự tái hồi phục tế bào.
Sự tái phân bố chu kỳ tế bào.
Sự tái tạo quần thể tế bào.
Kinh nghiệm trên thực tế lâm sàng và các nghiên cứu thực nghiệm từ trước tới nay đều cho thấy sự phân liều điều trị hiệu quả được sử dụng thông dụng nhất là 2Gy/ngày x 5lần/tuần.
Suất liều
Trong phần lớn các mô ung thư, ở phân liều cao (> 12Gy/giờ) sự nhạy với tia xạ thường không ảnh hưởng bởi suất liều.
Các nghiên cứu cho thấy không có sự thay đổi đột ngột từ tác dụng 0% (khối u trơ với tia) lên 100% (khối u tan hẳn) mà mức độ tiêu diệt khối u tăng dần theo liều chiếu trong một giới hạn nào đó. Các nghiên cứu cũng cho thấy có thể chỉ cần tăng thêm vài Gy thì mức độ tiêu diệt khối u cũng có thể tăng từ 50 – 90%.
Yếu tố oxy
Thực tế cho thấy, các mô ung thư được cung cấp ôxy phong phú thì nhạy cảm với tia phóng xạ hơn những mô được cung cấp ôxy nghèo nàn.
Nhiệt độ
Nhiệt độ có tác động cộng hưởng với tia xạ, ở nhiệt độ ≥ 42 độ sẽ giết chết tế bào. Vì vậy nếu ta nâng được nhiệt độ tại khối u lên thì hiệu quả của xạ trị sẽ tăng lên, đây là cơ sở của phương pháp nhiệt trị liệu trong ung thư.
Thể tích khối ung thư
Kinh nghiệm lâm sàng cho thấy các khối u lớn thường khó tiêu diệt hơn các khối u nhỏ (do tổ chưc của khối ung thư lớn thường nghèo ô xy hơn, đặc biệt ở vùng tâm khối u), và liều chiếu để diệt hết các tế bào ung thư xâm lấn vi thể thấp hơn liều chiếu cần cho khối u đã phát hiện được trên lâm sàng.
Các biến chứng do chiếu xạ
Các biến chứng cấp tính
Các phản ứng sớm của cơ thể đối với tia xạ xuất hiện sau vài ngày hay vài tuần của xạ trị, nguyên nhân là do một số lớn tế bào bị chết, đồng thời trong mô có sự tăng trưởng nhanh do vậy sẽ được phục hồi sau vài tuần nhờ sự tái lập từ các tế bào mầm.
Các biến chứng muộn
Các phản ứng muộn thường ít hồi phục, xuất hiện sau xạ trị vài tháng cho tới nhiều năm. Cơ chế của hiện tượng này chưa được rõ. Tuy nhiên người ta cho rằng tổn thương các mô lành do chiếu xạ dẫn tới tình trạng thiếu hụt tế bào, hậu quả của sự tái tạo không hoàn toàn của tế bào mầm, sự rối loạn của hệ thống tuần hoàn do các tổn thương của nội mạc mạch máu, hậu quả là xuất hiện hiện tượng teo, xơ chai, giảm hoặc mất chức năng của các mô và tổ chức lành. Đây là hạn chế lớn nhất của phương pháp xạ trị. Một số biến chứng thường gặp là:
Tác động lên hệ tạo máu: các tế bào máu đã trưởng thành trong hệ thống tuần hoàn là những tế bào đã biệt hoá và trưởng thành không có khả năng phân chia ít ảnh hưởng bởi tia xạ, vì vậy chỉ khi chiếu xạ vào tuỷ xương mới ảnh hưởng tới công thức máu. Để hạn chế tổn thương tuỷ xương, người ta hạn chế xạ trị với các trường chiếu rộng. Nếu xạ trị toàn thân với liều 4,5Gy thì sẽ dẫn tới liều chết 50% (LD50) do nhiễm trùng và xuất huyết trầm trọng.
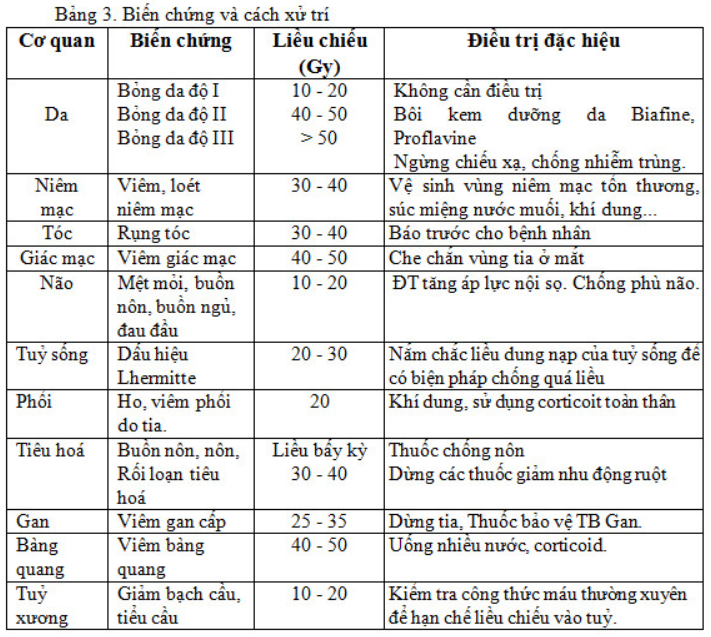
Da và niêm mạc: các phản ứng mạn tính đối với da và niêm mạc là tình trạng da teo, mất màu, rụng lông, loét lâu liền, niêm mạc khô. Thường thấy đối với liều chiếu trên 60 Gy.
Đường tiêu hoá: khi chiếu xạ với liều > 45Gy sẽ xảy ra hiện tượng mất vị giác, khô miệng, giảm tiết tuyến nước bọt, viêm teo niêm mạc. Liều > 60Gy có thể gây nên teo thực quản, dạ dày, ruột…
Gan: liều chiếu vào gan > 30Gy/4 tuần có thể dẫn đến viêm gan cấp, tử vong. Với liều chiếu thấp có thể dẫn tới viêm gan mạn và xơ gan.
Để đề phòng các biến chứng thường chiếu vào vùng gan liều
Phổi: bệnh phổi cấp có thể xảy ra sau xạ trị 2 – 4 tháng ở liều 40Gy, các triệu chứng sẽ tự hết. Xơ phổi xuất hiện chậm, thường vào cuối năm đầu sau xạ trị. Đây là biến chứng không hồi phục, vì vậy khi chiếu vào phổi phải có biện pháp che chắn cho phần nhu mô phổi lành.
Tim: viêm màng tim mạn tính xảy ra 1 năm sau xạ trị với biểu hiện tràn dịch màng tim, có thể viêm cơ tim. Biến chứng tăng lên nếu xạ trị kết hợp với hoá trị Adriamycin. Để đề phòng biến chứng, khi chiếu xạ vào vùng tim không nên vượt quá liều 40Gy/4 tuần, và có biện pháp che chắn.
Thận: biến chứng thận xuất hiện sau chiếu xạ vài tháng đến vài năm với biểu hiện như protein niệu, tăng huyết áp nhẹ, có thể dẫn tới suy thận mạn.
Để đề phòng liều chiếu vào thận không vượt quá 20Gy/2 tuần. Nếu chiếu xạ toàn ổ bụng cần che chắn thận khi đạt liều 15 Gy.
Bàng quang và niệu quản: biến chứng thường gặp là xơ chai làm giảm thể tích bàng quang. Gây teo, hẹp niệu đạo, niệu quản ở liều 65Gy/6,5 tuần.
Tuyến sinh dục:
Nam: với liều duy nhất 2Gy/1 lần có thể dẫn tới tình trạng vô tinh tạm thời trong vòng 1 – 2 năm. Liều 6Gy có thể làm vô tinh vĩnh viễn.
Nữ: liều 12 – 15Gy đối với lứa tuổi trẻ có thể làm mất kinh hoàn toàn, ở người ≥ 45 tuổi với liều 5 – 7 Gy có thể dẫn tới vô kinh tạm thời.
Xương – sụn: liều 10Gy làm chậm tăng trưởng xương, 20Gy có thể ngừng phát triển hoàn toàn tế bào xương, liều 60 – 70Gy có thể gây hoại tử xương.
Hệ thần kinh: xạ trị toàn não liều 50Gy/5 tuần sau 1 – 3 tuần có thể gây nên giảm trí nhớ, nhược não. Liều 40 – 45 Gy/4 – 5 tuần vào tuỷ sống sau 2 – 4 tháng có thể xuất hiện các triệu chứng như: tê đầu chi, bỏng buốt do tổn thương myelin. Tình trạng này sẽ hồi phục sau 4 – 6 tháng. Với liều 55Gy làm tổn thương các dây thần kinh ngoại vi với biểu hiện giảm cảm giác, giảm phản xạ, giảm vận động.
Những tiến bộ trong lĩnh vực xạ trị ung thư
Ngày 8/11/1895, Wilhem Conrad Roentgen phát hiện ra tia X, chỉ 5 tháng sau đó (tháng 3/1896) một bệnh nhân ung thư vòm họng đã được điều trị bằng loại tia này, đây là một mốc quan trọng trong việc ứng dụng năng lượng bức xạ vào mục đích điều trị bệnh ung thư. Vào những năm đầu thế kỷ 20 các nhà nghiên cứu tìm kiếm công nghệ phát bức xạ ion hoá năng lượng cao phục vụ cho điều trị đã liên tục có những tiến bộ. Năm 1931 máy gia tốc 700 kV ra đời được đặt tại bệnh viện Memorial New York, không lâu sau đó các máy gia tốc sử dụng loại biến áp cộng hưởng đã được đưa vào sử dụng, từ đó máy gia tốc thực sự đã trở thành một công cụ tiên tiến với công nghệ cao, phục vụ cho lĩnh vực điều trị ung thư, đặc biệt từ những năm đầu 1970 các máy gia tốc tuyến tính, còn gọi là máy gia tốc thẳng (Linear Accelerator – LINAC) ra đời đã đánh dấu một mốc quan trọng mới của công nghệ này.
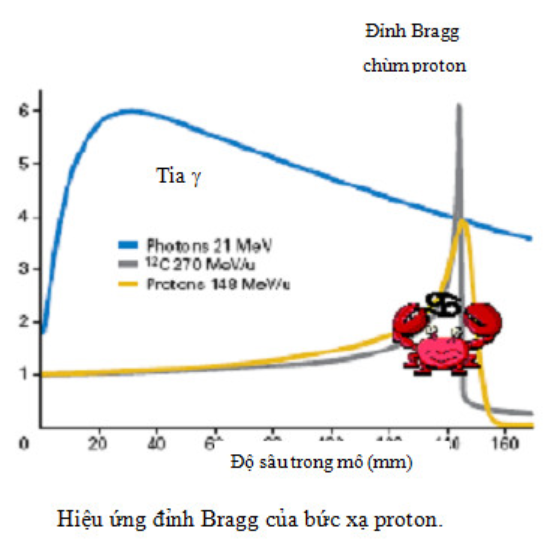
Gần đây một số công nghệ mới dùng phân bố liều lượng bức xạ cho điều trị ung thư một cách có hiệu quả hơn như: xạ trị theo hình thái khối u, xạ trị định vị (Streotactic Radiotherapy – SRT), xạ phẫu định vị (Streotactic Radiosurgery – SRS), xạ trị theo kỹ thuật điều biến liều lượng chùm tia (Intensity Modulate Radiotherapy – IMRT), điều trị bằng Proton, bằng Neutron nhanh, Neutron chậm. Đặc biệt thiết bị xạ trị proton/ion ra đời có thể tạo ra năng lượng cực đại tại khối ung thư, trong khi đó ở các mô lành lân cận liều chiếu lại rất thấp, điều đó sẽ đưa lại hiệu quả điều trị khỏi bệnh cao và giảm thiểu các biến chứng.
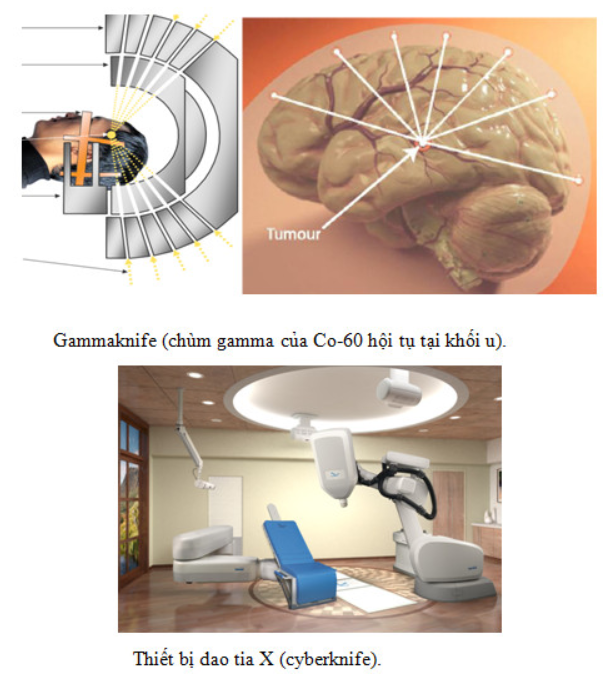
SRS và SRT là hai kỹ thuật tương tự nhau về ý nghĩa vật lý. Sự khác nhau căn bản là cách phân chia liều lượng. SRS thực hiện điều trị bằng một phân liều đơn, còn SRT thực hiện đa phân liều. SRS được hạn chế trong điều trị các tổn thương nhỏ ở vùng não, chẳng hạn các dị dạng động tĩnh mạch (AVM), các u thần kinh thính giác, các ung thư nguyên phát và những di căn đơn hay đa di căn rải rác… SRS cũng được sử dụng để điều trị một số bệnh rối loạn chức năng như bệnh động kinh, bệnh Parkinson… Còn SRT được sử dụng phổ biến trong điều trị ung thư nguyên phát hay thứ phát lớn trong não và những tổn thương gần các tổ chức nhạy cảm mà trong đó có một tỷ lệ đáng kể các tổ chức mô lành cũng phải chịu liều chiếu cao, việc phân chia liều lượng phải được tính toán tỷ mỉ, chính xác để các tế bào lành có khả năng hồi phục. Việc xác định vị trí chính xác cần được chiếu xạ bằng cách kết hợp một hay vài kỹ thuật chẩn đoán hình ảnh như CT, MRI hay chụp động mạch não (đối với AVM). Thiết bị chủ yếu là máy gia tốc có collimator đa lá (multileaf – MLC). Người ta áp dụng các trường chiếu tĩnh hay vòng cung với nhiều điểm đồng tâm để điều trị những thể tích u có hình dạng không đều. Dao gamma (gamma knife) dùng nhiều nguồn cobalt-60 cùng phát tia đồng tâm hay Cyberknife – một máy gia tốc phát chùm photon tia X năng lượng 6MeV lắp trên cánh tay 6 khuỷu của một Robot, được điều khiển bằng máy tính là những thiết bị dùng trong xạ trị định vị và xạ phẫu định vị.
Kỹ thuật xạ trị điều biến liều lượng chùm tia (IMRT) là một tiến bộ mới được áp dụng từ năm 1996 có khả năng phân bố liều lượng chùm tia tương đối đồng đều cho bất kỳ khối u nào trong cơ thể, giảm thiểu liều chiếu cho các tổ chức lành bao quanh, đồng thời chỉ cần sử dụng các trường chiếu theo một vài hướng mà thôi. Điều này đạt được bằng cách tạo cho mỗi trường chiếu không đồng nhất về cường độ, sử dụng bộ lọc bù trừ, hệ MLC.
Cùng với các thế hệ máy xạ trị, các công cụ hỗ trợ cũng lần lượt ra đời giúp cho việc điều trị được tối ưu hoá, đạt hiệu quả cao nhưng lại giảm thiểu được các biến chứng trong điều trị. Một số thiết bị đó là:
Lập kế hoạch điều trị theo không gian 3 chiều (3D).
Mô phỏng bằng máy CT (CT simulator).
Các thiết bị chụp phim kiểm tra trong điều trị.
Hiện nay trong cả nước ta có một số cơ sở bệnh viện lớn đã được trang bị máy gia tốc, máy Cobalt-60, máy CT mô phỏng, Gamma knife và Cyberknife. Tuy nhiên số lượng thiết bị này còn ít, chưa thể đáp ứng nhu cầu điều trị bệnh ung thư. Theo đề án phát triển Y học hạt nhân và xạ trị ung thư trong chương trình Quốc gia ứng dụng năng lượng hạt nhân vì mục đích hoà bình thì đến 2020 ở nước ta phấn đấu đạt 1 máy gia tốc/1 triệu dân.
LINAC phát 2 loại bức xạ: chùm hạt electron được gia tốc trực tiếp và chùm photon tia X được tạo ra do chùm điện tử đập vào đối âm cực. Năng lượng của chùm tia có rất nhiều mức khác nhau, từ 3MeV đến 15 MeV, 18MeV… Máy hiện đại có ống định hướng chùm tia (collimator) đa lá (Multi Leaf Collimator – MLC) với sự điều khiển tự động của máy tính, cho phép thực hiện được các kỹ thuật điều trị điều biến liều (Intensity Modulated Radiation Therapy – IMRT). IMRT là một kỹ thuật hiện đại trong điều trị UT, liều xạ được phân bố tối đa theo hình dạng khối u được hạn chế tối thiểu ở tổ chức lành xung quanh.
Về thiết bị, dao gamma (gammaknife) và dao tia X (cyberknife) được ứng dụng ngày càng rộng rãi và hiệu quả. Dao tia X thực chất là một máy gia tốc LINAC năng lượng 6 MeV được gắn trên một tay robot 6 khuỷu rất linh động, có thể tạo ra chùm tia hội tụ với tâm điểm là khối u. Còn dao gamma sử dụng bức xạ tia gamma của nguồn Co-60. Dao gamma cổ điển sử dụng 201 nguồn Co-60 sắp xếp trên một mũ chụp hình cầu có các collimator định hướng. Nhờ kỹ thuật định vị không gian 3 chiều, thiết bị này đem lại độ chính xác cao, hiệu quả điều trị tốt và an toàn.
Hệ gamma quay cũng dựa theo nguyên lý dao gamma cổ điển nhưng thay cho collimator cố định là hệ thống collimator quay quanh đầu. Hệ thống xạ phẫu gamma quay sử dụng bộ điều khiển đồng tâm (isocenter) được tạo bởi 30 nguồn phóng xạ Co-60. Nhờ bộ collimator quay mà hệ gamma quay không đòi hỏi phải chụp mũ và cố định mũ định hướng. Với hệ thống gamma quay, suất liều tại các điểm đồng tâm có thể đạt 3Gy / phút với độ lệch vị trí
Để đạt được liều đủ lớn ở điểm hội tụ và liều cực tiểu tới các mô lành xung quanh, các chùm tia gamma phát ra từ các nguồn phải mảnh và hội tụ tốt. Vì vậy, về nguyên tắc chỉ nên dùng dao gamma để tiêu diệt các khối u có kích thước nhỏ, thường dưới 5cm.
Tia gamma có thể tiêu diệt được hầu hết các loại khối u trong hộp sọ tuỳ vào liều tia xạ. Tuy nhiên, để không gây tổn thương các tổ chức lành xung quanh, liều chiếu phải được hạn chế. Đến nay người ta đã thống nhất các chỉ định điều trị bằng dao gamma cho các trường hợp sau đây:
Các khối u di căn vào não, điều trị bằng dao gamma đạt hiệu quả tốt.
U màng não ở các vị trí khác nhau, đặc biệt là vùng không can thiệp được bằng phẫu thuật hoặc phẫu thuật gây ra nhiều biến chứng như: u ở vùng rãnh trượt (Cluvis), u góc cầu tiểu não, u gần các mạch máu lớn, u ở phần ba trong cánh nhỏ xương bướm.
U thần kinh đệm độ I, II, III.
U tuyến yên, đặc biệt là những khối u xâm lấn vào tổ chức xung quanh như động mạch cảnh, xoang tĩnh mạch, mổ hở không lấy được hết u.
U sọ hầu thể đặc.
U vùng tuyến tùng như: u tế bào mầm, u màng não, u thần kinh đệm.
U dây thần kinh số V, số VIII, u dây thần kinh hỗn hợp…
Các khối dị dạng mạch máu não…
Dao tia X ngoài những chỉ định như dao gamma, do có năng lượng lớn hơn nên còn có chỉ định xạ phẫu cho cả u ngoài não như u gan, u phổi…
Gần đây một số công nghệ mới điều trị ung thư bằng bức xạ proton, neutron nhanh, neutron chậm và neutron bắt nguyên tố Boron, bằng các hạt nặng đã được ứng dụng. Các thiết bị này đều có ưu điểm là chùm hạt có năng lượng lớn, lên đến hàng trăm MeV, tuân theo hiệu ứng đỉnh Bragg, nghĩa là giải phóng năng lượng ở cùng một độ sâu trong mô; điều đó cho phép tập tạo ra năng lượng cực đại tại khối ung thư, trong khi đó ở các mô lành lân cận liều chiếu lại rất thấp, điều đó sẽ đưa lại hiệu quả điều trị khỏi bệnh và giảm thiểu được các biến chứng do tia xạ gây nên.
Cùng với các thế hệ máy xạ trị, các công cụ hỗ trợ cũng lần lượt ra đời giúp cho việc điều trị được tối ưu hoá, đạt hiệu quả cao nhưng lại giảm thiểu được các biến chứng trong điều trị như:
Lập kế hoạch điều trị theo không gian 3 chiều (3D).
Mô phỏng bằng máy CT.
Các thiết bị chụp phim điện tử kiểm tra trong điều trị.