Value of mri with gadoxetic acid (primovist) for diagnosing hepatocellular carcinoma
Nguyễn Tiến Sơn, Phạm Minh Thông
Tóm tắt
Mục tiêu: Đánh giá giá trị của thuốc đối quang từ Gd-EOB-DTPA (Primovist) trong phát hiện ung thư biểu mô tế bào gan có đối chiếu với kết quả giải phẫu bệnh.
Đối tượng và phương pháp nghiên cứu: Nghiên cứu mô tả cắt ngang, được thực hiện trên 28 bệnh nhân thuộc hai nhóm: Nhóm I gồm 18 bệnh nhân ung thư gan và nhóm II gồm 10 bệnh nhân không phải ung thư gan (7 bệnh nhân có tổn thương tăng sản thể nốt khu trú, 3 bệnh nhân di căn gan). Những bệnh nhân trên được phát hiện tổn thương gan thông qua các phương tiện chẩn đoán hình ảnh và được chụp cộng hưởng từ gan mật với thuốc đối quang từ đặc hiệu mô Gd-EOB-DTPA (Primovist). Sau đó, việc chẩn đoán xác định được dựa trên kết quả mô bệnh học thông qua sinh thiết hoặc phẫu thuật.
Kết quả: Dấu hiệu giảm tín hiệu pha tế bào gan của thuốc đối quang từ Gd-EOB-DTPA có độ nhạy rất cao trong chẩn đoán UTG (94,4%), tuy nhiên, độ đặc hiệu chỉ ở mức 70%. Trong chẩn đoán ung thư gan, dấu hiệu ngấm thuốc mạnh thì ĐMG kèm thải thuốc thì TMC hoặc thì muộn có độ nhạy, giá trị dự báo âm tính và độ chính xác ở mức lần lượt 61,1%; 58,8%; 75%. Khi kết hợp dấu hiệu giảm tín hiệu pha tế bào gan vào tiêu chuẩn trên, các giá trị chẩn đoán tăng lần lượt lên 72,2%; 67,7%; 82,1% trong khi độ đặc hiệu và giá trị dự báo dương tính không đổi.
Kết luận: Giảm tín hiệu PTBG là dấu hiệu tốt để phát hiện UTG hơn là chẩn đoán phân biệt với các tổn thương gan khác. Việc bổ xung đặc điểm hình ảnh PTBG của thuốc đối quang từ Gd-EOB-DTPA (Primovist) vào tiêu chuẩn chẩn đoán làm tăng khả năng phát hiện tổn thương UTG.
Đặt vấn đề
Ung thư biểu mô tế bào gan (UTG) là bệnh lý hay gặp, chiếm phần rất lớn trong gánh nặng ung thư toàn cầu. Ở Việt Nam, năm 2018, ung thư gan đứng hàng đầu về tỉ lệ mắc mới và tử vong, đặc biệt ở nam giới với số lượng 19.568 ca [1]. Trong quá trình thực hành lâm sàng, nhiều trường hợp tổn thương ung thư gan có đặc điểm hình ảnh không điển hình, gây khó khắn cho việc chẩn đoán xác định bệnh. Gadolinium ethoxybenzyl dimeglumine (Gd-EOB-DTPA, Primovist) là thuốc đối quang từ đặc hiệu mô gan mới được ứng dụng trên lâm sàng trong vài năm gần đây, với nhiều ưu điểm trong đánh giá các tổn thương gan không điển hình hoặc phát hiện UTG ở giai đoạn sớm. Trên thế giới, đã có nhiều nghiên cứu về giá trị của cộng hưởng từ với thuốc đối quang từ đặc hiệu mô này. Tuy nhiên tại Việt Nam, nghiên cứu về thuốc đối quang từ Gd-EOBDTPA (Primovist) trong thực hành lâm sàng hiện còn ít. Vì vậy chúng tôi thực hiện đề tài: “Nghiên cứu giá trị của cộng hưởng từ với thuốc đối quang từ Primovist trong chẩn đoán ung thư biểu mô tế bào gan”.
Đối tượng và phương pháp
Đối tượng nghiên cứu
Nghiên cứu được thực hiện trên các bệnh nhân có phát hiện tổn thương u gan thông qua các phương tiện chẩn đoán hình ảnh. Tất cả các bệnh nhân sau đó được chụp CHT với thuốc đối quang từ đặc hiệu mô Gd-EOBDTPA (Primovist) và được chẩn đoán xác định dựa trên kết quả giải phẫu bệnh thông qua sinh thiết hoặc kết quả mô bệnh học sau mổ (6 BN tiến cứu, 22 BN hồi cứu).
Phương pháp nghiên cứu
Nghiên cứu mô tả cắt ngang
Địa điểm thực hiện: Bệnh viện Bạch Mai và Bệnh viện K trung ương cở sở Tân Triều trong thời gian từ tháng 09/2018 – 9/2020
Phương tiện nghiên cứu
Máy chụp CHT 1.5 Tesla BRIVO MR 355 hoặc SIGNA Explorer của hãng GE, Mỹ; máy CHT 1,5 Tesla ECHELON của hãng HITACHI, Nhật Bản.
Thuốc đối quang từ đặc hiệu mô Gd-EOB-DTPA (Primovist®, hãng Bayer, Đức).
Hệ thống PACS. Hồ sơ bệnh án với kết quả mô bệnh học của tổn thương.
Kỹ thuật chụp cht gan mật với thuốc đối quang từ gd-eob-dtpa (primovist)
Bệnh nhân được đặt ở trung tâm bàn chụp ở tư thế nằm ngửa. Sau khi đánh giá sự hô hấp bình thường của bệnh nhân, bộ phận đánh giá nhịp thở của máy được đặt ở vị trí có biên độ thở lớn nhất. Sử dụng cuộn phát và thu tín hiệu bụng (Phased array coil) với trung tâm ở mức mũi ức.
Tiến hành chụp định vị. Sau đó chụp các chuỗi xung T1W 3D GRE in-out phase và T1W trước tiêm thuốc theo mặt phẳng ngang (axial), độ dày lát cắt 4-6 mm, bệnh nhân nín thở trong khi chụp.
Bệnh nhân được tiêm thuốc đối quang từ đặc hiệu mô gan Gd-EOB-DTPA (Primovist). Liều tiêm tĩnh mạch được sử dụng là 0,025 mmol/kg cân nặng với tốc độ tiêm 1mL/giây, theo sau là 20 mL dung dịch nước muối sinh lý 0,9%. Sau khi tiêm thuốc đối quang từ, bệnh nhân được chụp động học 4 pha, thời điểm chụp lần đầu khoảng 30 giây sau tiêm, các pha sau cách nhau khoảng 15s để thu được hình ảnh ở các thì động mạch sớm, động mạch muộn, tĩnh mạch cửa. Thì muộn (thì chuyển tiếp) được chụp sau khoảng 3 phút.
Chụp chuỗi xung T2W SSFSE và DWI ở các mức B0, 400 và 800 trên mặt phẳng axial, độ dày lát cắt 5mm. Có xây dựng bản đồ ADC.
Cuối cùng, chụp pha tế bào gan sau khoảng 15-20 phút sau tiêm, sử dụng chuỗi xung 3D SPGR, xóa mỡ, độ dày lát cắt 4 – 5mm, gap 2-2,5 mm, flip angle 12°. Thời điểm chụp pha này có thể kéo dài hơn trong trường hợp bệnh nhân xơ gan nặng, chức năng gan suy giảm.
Phân tích và xử lý số liệu.
Thông tin về đối tượng nghiên cứu được thu thập theo mẫu bệnh án nghiên cứu. Tất cả hình ảnh thu thập được xử lý thông qua hệ thống PACS INFINITT. Kết quả giải phẫu bệnh được sử dụng làm tiêu chuẩn đối chiếu nhằm đánh giá giá trị của các dấu hiệu hình ảnh trên phim cộng hưởng từ.
Phân tích dự liệu dựa trên phần mềm SPSS 16.0. Kết quả được phân tích thống kê bằng Test χ² và Fisher’s Exact Test.
Kết quả
Đặc điểm lâm sàng
Có 28 bệnh nhân trong nghiên cứu (17 nam, 11 nữ). Tuổi trung bình của nhóm nghiên cứu là 49,3 ± 12,6 tuổi. Đối với nhóm bệnh nhân UTG, tuổi trung bình là 52,9 ± 10,4 tuổi, trẻ nhất là 36 tuổi, lớn tuổi nhất là 72 tuổi.
Kết quả giải phẫu bệnh tổn thương UTG chiếm tỉ lệ cao nhất 64,3% (n=18). Trong số đó, có 1 tổn thương trên nền u tuyến gan (3,6%). Tổn thương khác bao gồm tăng sản thể nốt khu trú (FNH) (n=7; 25%) và di căn gan (n=3, 10,7%).
Bệnh nhân ung thư gan trong nghiên cứu chủ yếu là nam giới (n=15;83%) và có độ tuổi phổ biến nhất là 40 – 60 tuổi (n=13;72%). Viêm gan B hoặc nghiện rượu kèm theo xơ gan là yếu tố nguy cơ gây phổ biến nhất (n=13;72%).
Phần lớn bệnh nhân ung thư gan trong nghiên cứu của chúng tôi tình cờ phát hiện bệnh thông qua các phương tiện chẩn đoán hình ảnh (n=9;50%)
Đặc điểm hình ảnh
Kích thước trung bình của các tổn thương trong nghiên cứu là 37,3 ± 16 mm. Trong nhóm UTG, hơn một nửa có kích thước dưới 30 mm (n=11; 61,1%). Phần lớn, UTG gặp ở vị trí phân thùy gan phải (n=13;72%).
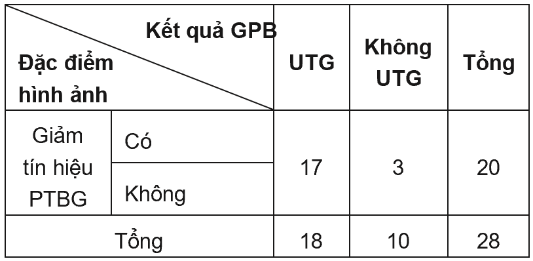
Bảng 1. Đặc điểm hình ảnh của tổn thương trên phim cộng hưởng từ với thuốc đối quang từ Gd-EOB-DTPA (Primovist)
|
Hình ảnh CHT |
Tổn thương u gan (n = 28) |
P |
|
|
UTG (n = 18) |
Không UTG (n = 10) |
||
|
Giảm trên T1W |
15 (83%) |
5 (50%) |
0,091 |
|
Tăng trên T2W |
17 (94%) |
7 (70%) |
0,116 |
|
Hạn chế khuêch tán |
17 (94%) |
3 (30%) |
0,001 |
|
Mỡ vi thể |
1 (6%) |
0 (0%) |
0,643 |
|
Vỏ |
4 (22%) |
0 (0%) |
0,265 |
|
Ngấm thuốc thì động mạch gan |
14 (78%) |
5 (50%) |
0,210 |
|
Thải thuốc thì tĩnh mạch cửa hoặc thì muộn |
12 (67%) |
0 (0%) |
0,001 |
|
Giảm tín hiệu pha tế bào gan |
17 (94%) |
3 (30%) |
0,001 |
Giá trị của cht với thuốc đối quang từ gdeob-dtpa (primovist) trong chẩn đoán utg
Giá trị chẩn đoán UTG của dấu hiệu giảm tín hiệu PTBG trên phim CHT với thuốc đối quang từ Gd-EOB-DTPA (Primovist)
Bảng 2. Giá trị chẩn đoán của dấu hiệu giảm tín hiệu PTBG
Giá trị chẩn đoán của dấu hiệu giảm tín hiệu PTBG: Sn= 94,4%; Sp = 70%; PPV = 85%; NPV = 87,5%; Ac = 85,7%.
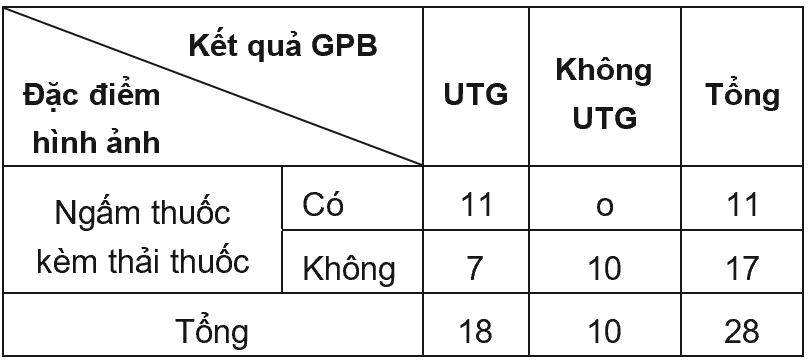
Giá trị chẩn đoán UTG của dấu hiệu ngấm thuốc thì ĐMG kết hợp thải thuốc thì TMC hoặc thì muộn
Bảng 3. Giá trị chẩn đoán của dấu hiệu ngấm thuốc thì của dấu hiệu ngấm thuốc thì động mạch kết hợp thải thuốc thì TMC hoặc thì muộn
Giá trị chẩn đoán của dấu hiệu ngấm thuốc thì ĐMG kết hợp thải thuốc thì TMC hoặc thì muộn: Sn= 61,1%; Sp = 100%; PPV = 100%; NPV = 58,8%; Ac = 75%.
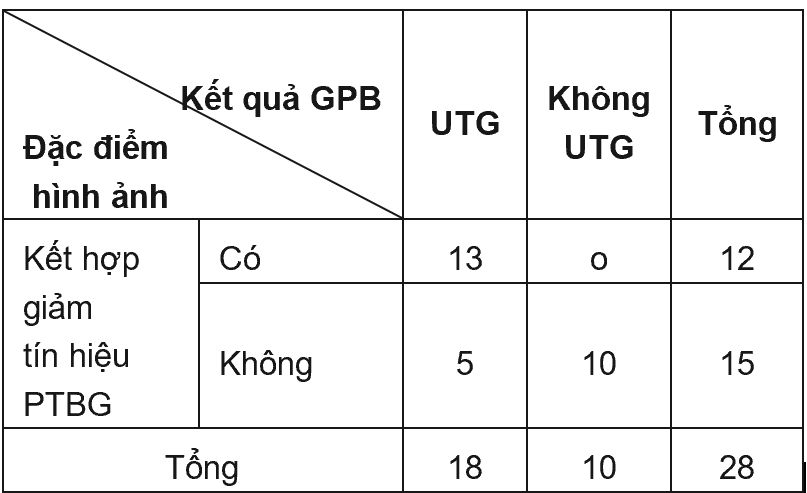
Giá trị của việc đánh giá dấu hiệu thải thuốc bao gồm cả PTBG trên phim CHT với thuốc đối quang từ Gd-EOB-DTPA (Primovist) trong chẩn đoán UTG
Giá trị chẩn đoán của dấu hiệu ngấm thuốc mạnh thì ĐMG kết hợp với giảm tín hiệu ở thì TMC, thì muộn hoặc PTBG: Sn = 72,2%; Sp = 100%; PPV = 100%; NPV = 67,7%; Ac = 82,1%.
Bàn luận
Nghiên cứu của chúng tôi được thực hiện trên 28 BN với tổng số 28 tổn thương gan được lấy vào nghiên cứu, trong đó có 18 tổn thương UTG.
Tuổi trung bình của nhóm UTG là 52,9 ± 10,4 tuổi, bệnh nhân trẻ nhất là 36 tuổi và lớn tuổi nhất là 72 tuổi. UTG rất hiếm gặp ở tuổi dưới 40. Nhóm tuổi từ 40-60 chiếm tỉ lệ cao nhất. Theo Lê Văn Quang (2019), tuổi trung bình của nhóm bệnh nhân UTG tại thời điểm chẩn đoán là 57 tuổi, trong đó nhóm bệnh nhân > 50 tuổi chiếm đa số (75,8%) và tỉ lệ bệnh nhân
Nam giới có xu hướng mắc UTG cao hơn nữ giới. Trong nghiên cứu của chùng tôi, có tổng số 17 BN nam (60,7%). Ở Việt Nam, theo số liệu ước tính của GLOBOCAN năm 2018, tỉ lệ mắc chuẩn hóa theo tuổi của UTG ở giới nam cao gấp 4 lần so với nữ (tỉ lệ 39 so với 9,5/100000 người) [3]. Điều này có thể do nam giới có tỉ lệ nhiễm virus viêm gan và mắc xơ gan rượu cao hơn. Ngoài ra, trong một số nghiên cứu gần đây cho thấy sự khác biệt về hormone giới tính testosterol cũng có vai trò gây ra sự khác biệt này [4].
Nghiên cứu của chúng tôi và các nghiên cứu khác trong nước đều chỉ ra bệnh nhân UTG có tỉ lệ mắc viêm gan B rất cao dao động từ 60 – 90 % [2], [5]. Virus viêm gan B gây phản ứng viêm mạn tính, xơ hóa gan và tích tụ các đột biến gen dẫn tới khởi phát UTG. Nhiễm viêm gan virus B mạn tính làm tăng nguy cơ UTG 5 -100 lần [6].
Tỉ lệ tổn thương UTG chứa mỡ vi thể thấp (n=1; 6%). Không có tổn thương nào trong nhóm không phải UTG có dấu hiệu này. Đặc điểm chứa mỡ vi thể trong tổn thương thường gặp trong UTG giai đoạn sớm7. Ở giai đoạn này, có sự thay đổi trong nguồn cấp máu chuyển dần từ nguồn tĩnh mạch cửa sang động mạch tân tạo. Điều này gây ra hiện tượng thiếu oxy tạm thời trong tổn thương do mất cân bằng trong cấp máu kết hợp với tăng mật độ tế bào, gây hiện tượng thoái hóa mỡ [8].
Vỏ ngấm thuốc là dấu hiệu chẩn đoán rất có giá trị. Nó là một trong số những tiêu chuẩn chẩn đoán chính UTG trong phân loại của LIRADS 2018 [9]. Trong nghiên cứu của chúng tôi, có 4/18 (22%) khối UTG có vỏ. Các tổn thương khác không phải UTG không có dấu hiệu này. Ngoài giá trị chẩn đoán, dấu hiệu này còn có ý nghĩa tiên lượng điều trị. Các khối UTG có vỏ có xu hướng đáp ứng tốt hơn với phương pháp điều trị nút mạch hóa chất (TACE), tỉ lệ tái phát thấp hơn sau phẫu thuật hoặc các phương pháp điều trị tại chỗ như đốt sóng cao tần [10], [11].
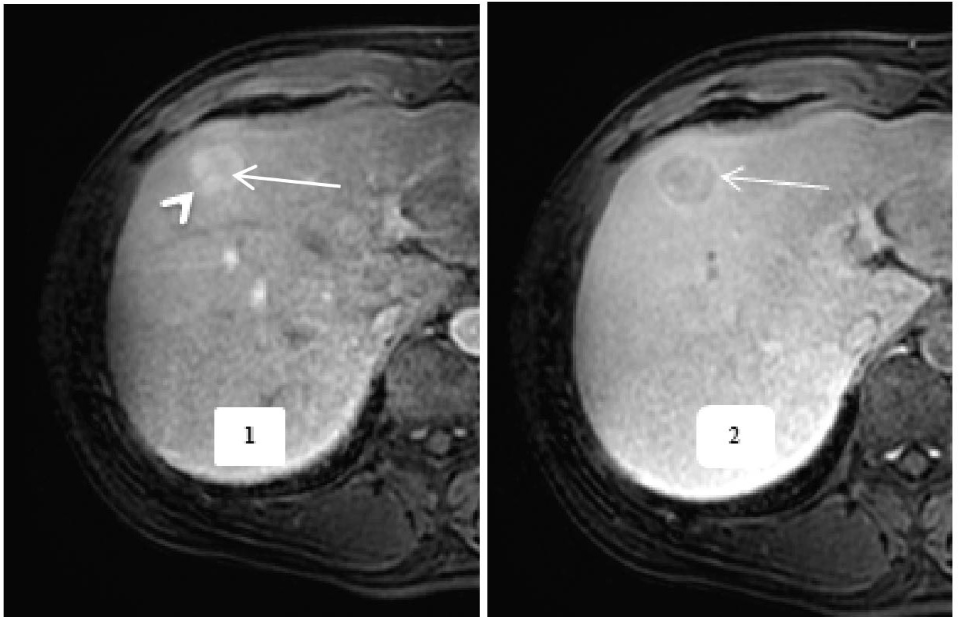
Hình 1. Tổn thương UTG chứa mỡ vi thể. BN nam, 58 tuổi, khối vị trí gần rốn gan, có biểu hiện giảm tín hiệu trên hình ảnh T1W out phase (2) so với hình ảnh in phase (1) thể hiện tổn thương chứa mỡ vi thể.
Hình 2. Đặc điểm UTG có vỏ. BN nam, 39 tuổi. Khối vị trí HPT VIII (đầu mũi tên) ngấm thuốc thì ĐMG (1) kèm thải thuốc thì TMC (2). Tổn thương có vỏ ngấm thuốc (mũi tên).
Hầu hết các tổn thương UTG trong nghiên cứu của chúng tôi đều có hạn chế khuếch tán (n=17; 96%). Kết quả nghiên cứu của chúng tôi tương đương Huỳnh Quang Huy (2008), với tỉ lệ 99,6%12. Trong một nghiên cứu khác của G. Piana (2011), tỉ lệ UTG hạn chế khuếch tán dao động từ 64-82% tùy thuộc vào kích thước tổn thương với tỉ lệ thấp hơn trong nhóm UTG .
Giá trị chẩn đoán của dấu hiệu giảm tín hiệu PTBG trong nghiên cứu của chúng tôi: Sn= 94,4%; Sp = 70%; PPV = 85%; NPV = 87,5%; Ac = 85,7%. Độ nhạy trong chẩn đoán UTG của dấu hiệu trên rất cao, ở mức 94,4%. Kết quả này tương tự các nghiên cứu khác trên thế giời như của R.Golfieri (2013) hoăc S.Choi (2016) ở mức lần lượt 88,23 và 99,5% [15], [16]. Tuy nhiên, độ đặc hiệu của dấu hiệu chỉ ở mức 70%. Trong các nghiên cứu khác, độ đặc hiệu của dấu hiệu giảm tín hiệu PTBG rất thay đổi, dao động từ 21,4 – 53,3% [15], [17]. Do đó, dấu hiệu này có giá trị trong phát hiện UTG hơn là giúp chẩn đoán phân biệt UTG với các tổn thương khác.
Có sự gia tăng về Sn, NPV và Ac khi kết hợp PTBG vào tiêu chuẩn chẩn đoán so với việc chỉ đánh giá đơn thuần dấu hiệu thải thuốc ở thì TMC hoặc thì muộn (lần lượt tăng từ mức 61,1%, 58,8% và 75% lên 72,2%, 67,7% và 82,1%). Trong khi đó, độ đặc hiệu cũng như giá trị dự đoán dương tính không thay đổi. Theo S.Phongkitkarun (2013), việc đánh giá thêm PTBG làm tăng độ nhạy (79,7% lên 93,2%) và giá trị dự đoán âm tính (78,9% lên 91,8%) trong chẩn đoán UTG. Trong khí đó, độ đặc hiệu không thay đổi (97,8%) và giá trị dự đoán dương tính tăng nhẹ (97,9% lên 98,2%) [17].
Dấu hiệu giảm tín hiệu ở PTBG đã được Hiệp hội gan mật Nhật Bản (JSH) đưa vào tiêu chuẩn chẩn đoán trong hướng dẫn về UTG từ năm 2010 [18]. Tuy nhiên, đối với các hướng dẫn khác như của Hiệp hội nghiên cứu bệnh gan Hoa Kỳ (AASLD) hoặc Hiệp hội gan mật Châu Âu (EASL), dấu hiệu này vẫn chưa được coi là tiêu chuẩn chính trong chẩn đoán UTG [19], [20].
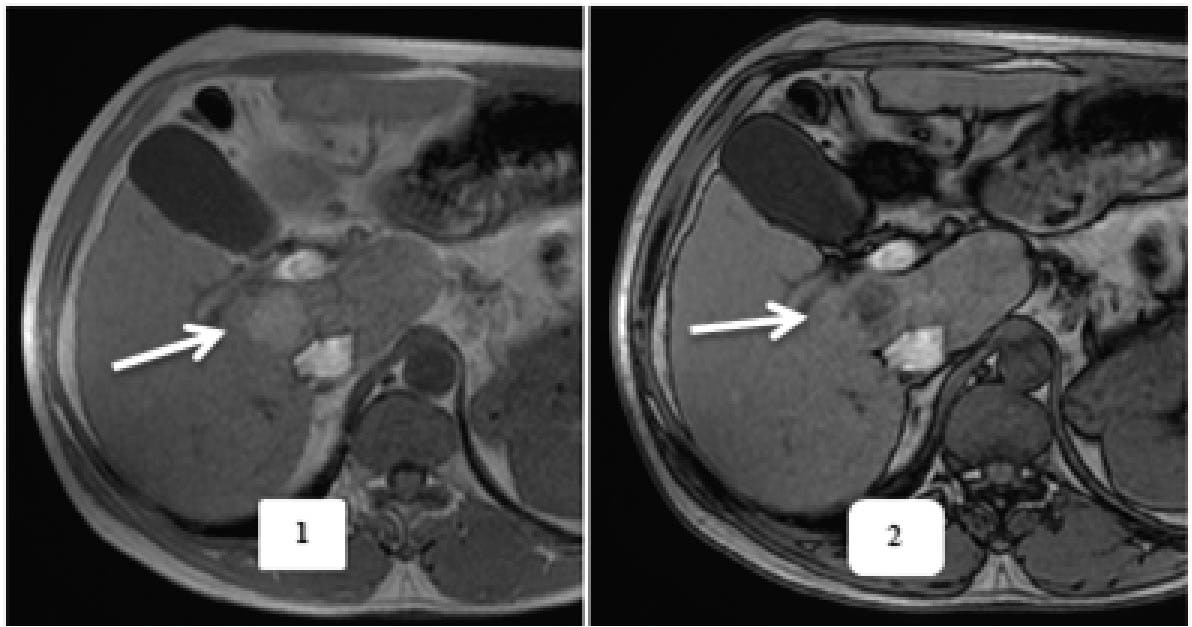
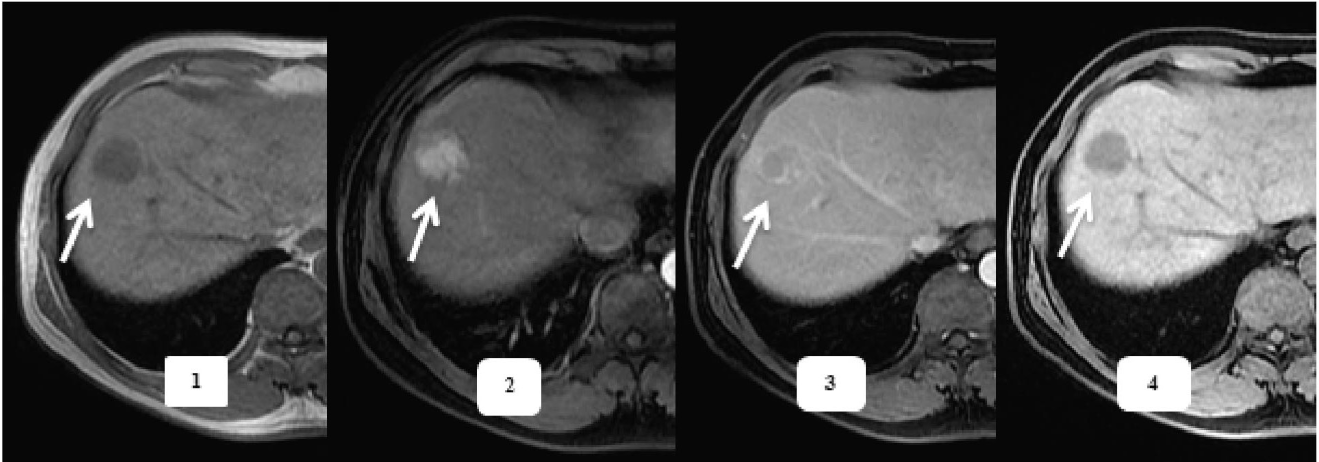
Hình 3. Động học ngấm thuốc của tổn thương UTG điển hình. BN nam, 58 tuổi. Khối UTG vị trí HPT VIII, giảm tín hiệu trên phim T1W trước tiêm (1). Sau tiêm tổn thương ngấm thuốc mạnh thì ĐMG (2), thải thuốc thì TMC (3). Ở PTBG (4), tổn thương giảm tín hiệu rõ so với nhu mô gan xung quanh.
Kết luận
Giảm tín hiệu PTBG là dấu hiệu tốt để phát hiện UTG hơn là chẩn đoán phân biệt với các tổn thương Giảm tín hiệu PTBG là dấu hiệu tốt để phát hiện UTG hơn là chẩn đoán phân biệt với các tổn thương.
Tài liệu tham khảo
Estimated number of new cases in 2018, Viet Nam, both sexes, all ages. https://gco.iarc.fr/today/home. Accessed June 28, 2019.
Le VQ, Nguyen VH, Nguyen VH, et al. Epidemiological Characteristics of Advanced Hepatocellular Carcinoma in the Northern Region of Vietnam. Cancer Control. 2019;26(1):1-6. doi:10.1177/1073274819862793
Bray F, Ferlay J, Soerjomataram I, et al. cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians. 2018;68(6):394-424. doi:10.3322/caac.21492
Nguyen VTT, Law MG, Dore GJ. An enormous hepatitis B virus-related liver disease burden projected in Vietnam by 2025. Liver International. 2008;28(4):525-531. doi:10.1111/j.1478-3231.2007.01646.x
Huy LM, Hà HTN, Oanh NT. Tương quan giữa AFP huyết thanh và các yếu tố tiên lượng khác trong carcinoma tế bào gan. 2010:36-42.
El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142(6):12641273.e1. doi:10.1053/j.gastro.2011.12.061
International Consensus Group for Hepatocellular NeoplasiaThe International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology. 2009;49(2):658-664. doi:10.1002/hep.22709
Kutami R, Nakashima Y, Nakashima O, Shiota K, Kojiro M. Pathomorphologic study on the mechanism of fatty change in small hepatocellular carcinoma of humans. Journal of Hepatology. 2000;33(2):282-289. doi:10.1016/ S0168-8278(00)80369-4
Mri CT, Core L. American College of Radiology: Core LI-RADS CT/MRI Diagnostic Table.
Ng MMT, Fan ST, Glas FRCS. Tumor Encapsulation in Hepatocellular Carcinoma A Pathologic Study of 189 Cases. 1991:45-49.
Cho ES, Choi JY. MRI features of hepatocellular carcinoma related to biologic behavior. Korean Journal of Radiology. 2015;16(3):449-464. doi:10.3348/kjr.2015.16.3.449
Huy HQ. Nghiên cứu vai trò cộng hưởng từ trong chẩn đoán và đánh giá kết quả điều trị ung thư biểu mô tế bào gan bằng phương pháp nút mạch hóa dầu. Luận án tiến sĩ – Đại học Y Hà Nội. 2008:1-50.
Piana G, Trinquart L, Meskine N, et al. New MR imaging criteria with a diffusion-weighted sequence for the diagnosis of hepatocellular carcinoma in chronic liver diseases. Journal of Hepatology. 2011;55(1):126-132. doi:10.1016/j.jhep.2010.10.023
Kim YK, Kim CS, Han YM, et al. Detection of liver malignancy with gadoxetic acid-enhanced MRI: Is addition of diffusion-weighted MRI beneficial? Clinical Radiology. 2011;66(6):489-496. doi:10.1016/j.crad.2010.09.007
Choi SH, Byun JH, Lim YS, et al. Diagnostic criteria for hepatocellular carcinoma ≤3 cm with hepatocyte-specific contrast-enhanced magnetic resonance imaging. Journal of Hepatology. 2016;64(5):1099-1107. doi:10.1016/j. jhep.2016.01.018
Golfieri R, Grazioli L, Orlando E, et al. Which is the best MRI marker of malignancy for atypical cirrhotic nodules: Hypointensity in hepatobiliary phase alone or combined with other features? Classification after Gd-EOB-DTPA administration. Journal of Magnetic Resonance Imaging. 2012;36(3):648-657. doi:10.1002/jmri.23685
Phongkitkarun S, Limsamutpetch K, Tannaphai P, Jatchavala J. Added value of hepatobiliary phase gadoxetic acid-enhanced MRI for diagnosing hepatocellular carcinoma in high-risk patients. World Journal of Gastroenterology. 2013;19(45):8357-8365. doi:10.3748/wjg.v19.i45.8357
Kudo M, Matsui O, Izumi N, et al. JSH consensus-based clinical practice guidelines for the management of hepatocellular carcinoma: 2014 Update by the liver cancer study group of Japan. Liver Cancer. 2014;3(34):458-468. doi:10.1159/000343875
Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis , Staging , and Management of Hepatocellular Carcinoma : 2018 Practice Guidance by the American Association for the Study of Liver Diseases. 2018;68(2):723-750. doi:10.1002/hep.29913
Galle PR, Forner A, Llovet JM, et al. Clinical Practice Guidelines OF HEPATOLOGY EASL Clinical Practice Guidelines : Management of hepatocellular carcinoma q. Journal of Hepatology. 2018;69(1):182-236. doi:10.1016/j.jhep.2018.03.019