Ở các nước phát triển, u ác là nguyên nhân gây tử vong đúng hàng thứ hai, chỉ sau các bệnh tim mạch. Ở nước ta, tuy chưa có một con số thống kê chính xác nhưng có thể dự đoán số trường hợp tử vong do u ác sẽ ngày một tăng, nhất là khi tuổi thọ của người dân đã được gia tăng một cách đáng kể trong khoảng thời gian gần đây (tuổi thọ trung bình > 65 tuổi). Theo Bộ Y tế (2002), ước lượng mỗi năm cả nước có thêm 150.000 trường hợp ung thư mới và 100.000 trường hợp tử vong do ung thư.
Định nghĩa:
U là 1 khối mô tân sản (neoplasm), được hình thành do sự tăng sinh bất thường, quá mức và tự động của các tế bào cơ thể đã bị chuyển dạng (transformed cell).
Trong y khoa, ngành học chuyên nghiên cứu về các loại u được gọi là ung bướu học (oncology).
Trong giai đoạn phôi thai, quá trình tăng trưởng và biệt hoá để hình thành các loại mô và cơ quan khác nhau khiến nhiều loại tế bào bị mất đi khả năng sinh sản, khả năng này chỉ còn được duy trì ở các tế bào gốc ( thí dụ: tế bào lớp đáy của biểu bì, tế bào tủy trong tủy xương, v.v…). Tốc độ sinh sản trong các mô được kiểm soát chặt chẽ bởi các cơ chế điều hoà tăng trưởng nhằm đảm bảo sự hiệp đồng giữa chúng, phục vụ cho sự phát triển của 1 cơ thể thống nhất (thí dụ: tế bào của lớp đáy biểu bì có tốc độ sinh sản phù hợp nhịp độ bong tróc của các tế bào lớp bề mặt ). Tốc độ sinh sản của tế bào trong mô có thể được đẩy nhanh lên nhằm bù đắp cho các thương tổn mô gây ra bởi các tác nhân vật lý, hoá học, vi sinh vật (thí dụ: tăng sinh mô liên kết-mạch máu trong phản ứng sửa chữa); hoặc khi mô bị kích thích bởi các hormôn đặc hiệu tương ứng (thí dụ: phì đại tăng sản cơ tử cung khi mang thai). Khi các tác nhân kích thích nói trên không còn nữa, tốc độ sinh sản lại trở về bình thường như trước.
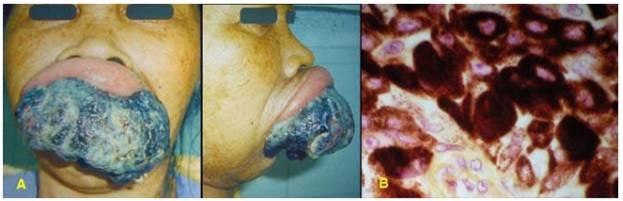
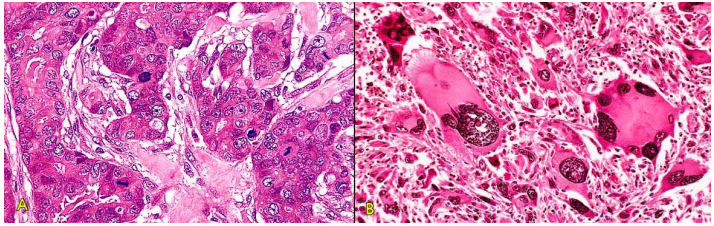
U có thể xuất phát từ các tế bào cơ thể đã bị chuyển dạng của bất kỳ mô nào trong cơ thể. Tuy vậy, u hay gặp hơn ở những mô còn duy trì hiện tượng phân bào thường xuyên như biểu mô, mô liên kết… Những tế bào và mô đã biệt hoá cao không còn hoạt động phân bào như mô cơ tim hoặc các nơron thì hiếm khi bị chuyển dạng để tạo thành u. Tốc độ sinh sản của các tế bào u có thể nhanh hoặc chậm nhưng không bao giờ ngừng lại, cho dù các tác nhân sinh u không còn nữa; nói cách khác, sự sinh sản của các tế bào u có tính tự động, không còn bị kiểm soát bởi các cơ chế điều hoà tăng trưởng bình thường trong cơ thể. Chính vì vậy mà u vẫn tiếp tục lớn lên trong khi bệnh nhân ngày một suy mòn, có thể gây tử vong nếu không được phẫu thuật cắt bỏ kịp thời. (Hình 1)
Hình 1: U hắc tố ác (melanoma) niêm mạc miệng (A), trên vi thể các tế bào ung thư ứ đầy sắc tố melanin trong bào tương (B)
Tính sinh sản tự động của tế bào u giúp phân biệt các trường hợp sau đây không phải là u thực, còn gọi là u giả hoặc tổn thương giả u:
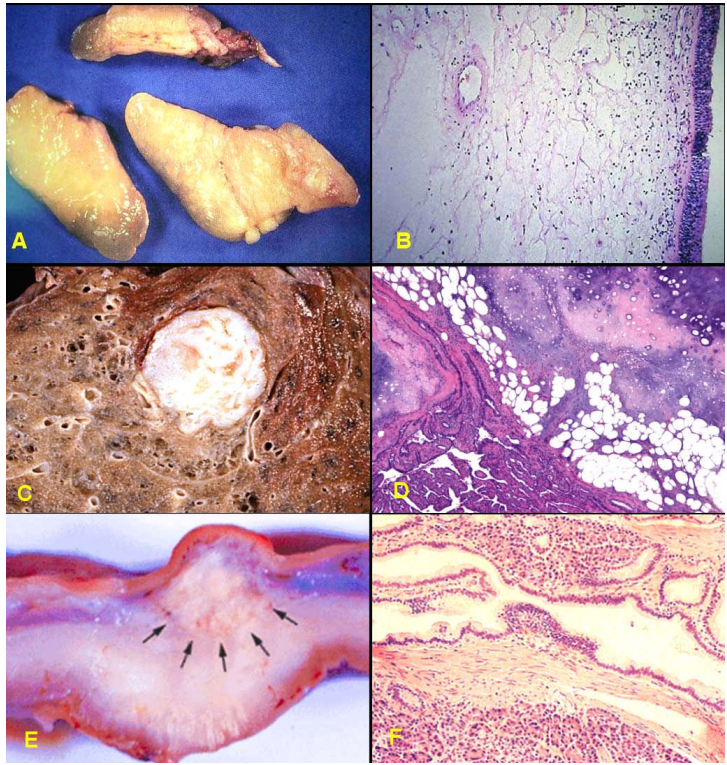
U hạt viêm, polýp mũi. (Hình 2 A,B)
Nang bẩm sinh (nang khe mang, nang giáp thiệt).
Nang ứ đọng ( bọc thượng bì ở da, bọc nang noãn buồng trứng).
Các biến đổi hình thái do rối loạn nội tiết (phình giáp, biến đổi sợi bọc tuyến vú).
Hamartôm: là 1 dị tật bẩm sinh có dạng giống u, được hình thành do sự tăng sinh quá mức nhưng không có tính tự động của các tế bào và mô trưởng thành tại ngay chính vị trí bình thường của chúng; thí dụ các hamartôm ở phổi, hamartôm ở vú. (Hình 2C,D)
Choristôm: cũng là 1 dị tật bẩm sinh có dạng giống u, cấu tạo bởi các mô có cấu trúc bình thường nhưng không ở đúng vị trí bình thường của chúng, vì vậy còn được gọi là mô lạc chỗ (heterotopic tissue). Thí dụ 1 đám mô tuyến tụy nằm trong lớp dưới niêm mạc của thành dạ dày. (Hình 2E,F)
Hình 2: Các tổn thương giả u: polýp mũi (A), trên vi thể chỉ là tình trạng viêm và phù nề niêm mạc mũi (B); Hamartôm phổi (C), cấu tạo vi thể gồm biểu mô hô hấp, sụn, cơ trơn trưởng thành sắp xếp lộn xộn (D); Choristôm ở thành dạ dày (E), cấu tạo vi thể gồm các nang tuyến tụy và ống bài xuất (F).
Danh pháp u:
Dựa vào diễn tiến của u và tác động của nó đối với bệnh nhân, u được phân biệt thành hai loại chính:
U lành: thường lớn chậm, khu trú tại chỗ, không xâm nhập mô xung quanh hoặc lan đi nơi khác (còn gọi là di căn), khỏi hẳn sau cắt bỏ và hiếm khi gây tử vong cho bệnh nhân
U ác: còn gọi là ung thư, thường lớn nhanh, xâm nhập vào mô xung quanh, cho di căn xa và gây ra tử vong.
Ngoài 2 loại trên, còn gặp một số loại u có độ ác tính không rõ ràng, diễn tiến khó lường, được gọi là u có độ ác tính giáp biên hoặc u giáp biên ác. U giáp biên ác thường lớn chậm, xâm nhập tại chỗ, hay tái phát sau cắt bỏ nhưng hiếm khi di căn xa; thí dụ: u đại bào xương, u diệp thể vú giáp biên, u bọc buồng trứng giáp biên…
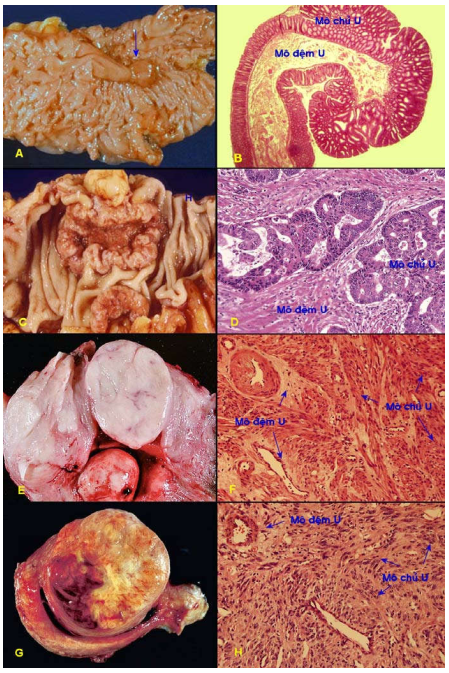
Tất cả các loại u (ngoại trừ các ung thư máu), dù lành hay ác cũng đều được tạo nên bởi 2 thành phần căn bản: Mô chủ u và mô đệm u. (Hình 3)
Hình 3: Phân biệt dễ dàng giữa mô chủ và mô đệm đối với u tuyến dạng polýp đại tràng lành tính (A,B) và carcinôm tuyến đại tràng (C,D); nhưng khó khăn đối với u xuất phát từ trung mô, thí dụ như u cơ trơn lành tính thân tử cung (E,F), hoặc sarcôm cơ trơn thân tử cung (G,H).
Mô chủ U (parenchyma): tạo bởi các tế bào chuyển dạng tức là các tế bào u; chính thành phần này quyết định diễn tiến cũng như tên gọi của khối u.
Mô đệm U (stroma): tạo bởi mô liên kết, các mạch máu và mạch bạch huyết; tuy không phải là các tế bào u nhưng có vai trò nâng đỡ và cung cấp các chất dinh dưỡng cần thiết cho sự tăng trưởng của khối u.
Sự phân biệt giữa 2 thành phần trên thì dễ dàng đối với các u xuất phát từ biểu mô nhưng rất khó khăn đối với các u xuất phát từ mô liên kết, vì cả 2 thành phần đều có chung nguồn gốc
Danh pháp u lành:
Tên của u được tạo ra bằng cách gắn đuôi OMA vào tên loại tế bào mà từ đó u xuất phát. Thí dụ:
U lành xuất phát từ mô sợi là fibrom
U lành xuất phát từ mô sụn là chondroma
Đối với u lành xuất phát từ biểu mô, việc đặt tên phức tạp hơn nhiều. Một số u được đặt tên dựa theo hình ảnh đại thể, vi thể hoặc cả hai; số khác lại dựa theo tế bào nguyên ủy. Thí dụ:
U tuyến (adenoma) là u xuất phát từ biểu mô tuyến, hình ảnh vi thể cho thấy u tạo bởi các cấu trúc tuyến.
U tuyến bọc (cystadenoma) là u tạo bởi các bọc, lót bởi biểu mô tuyến
U nhú (Papilloma) u xuất phát từ các biểu mô phủ (da, ống tiêu hoá), hình ảnh đại thể và vi thể cho thấy cấu trúc giống như lá cây dương xỉ.
Polýp là u xuất phát từ biểu mô phủ của các niêm mạc (thí dụ polýp tuyến đại tràng)
Danh pháp u ác:
Các u ác xuất phát từ trung mô và mô liên kết được gọi là SARCÔM. Thí dụ:
Sarcôm sợi (fibrosarcoma) là ung thư của mô sợi.
Sarcôm sụn (chondrosarcoma) là ung thư của mô sụn.
Các u ác xuất phát từ biểu mô được gọi là CARCINÔM.
Thí dụ:
Carcinôm tế bào gai (squamous cell carcinoma) là ung thư xuất phát từ biểu mô lát tầng.
Carcinôm tuyến (adenocarcinoma) là ung thư xuất phát từ các biểu mô tuyến.
Carcinôm tế bào gan (hepatocellular carcinoma) là ung thư xuất phát từ tế bào gan.
Một số trường hợp đặc biệt:
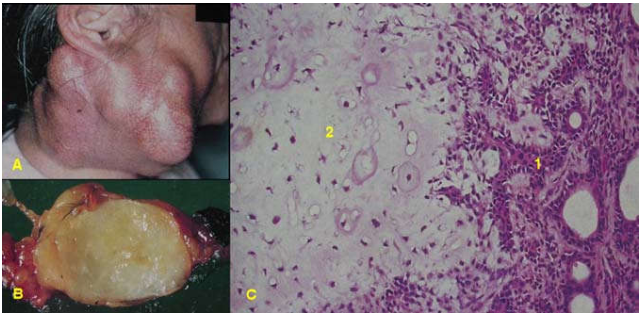
U tuyến đa dạng của tuyến nước bọt (pleomorphic adenoma): đại đa số các u, dù lành hoặc ác, đều có các tế bào của mô chủ u ít nhiều giống nhau; lý do là tất cả các tế bào u đều được sinh ra từ một tế bào chuyển dạng đầu tiên (tính chất đơn dòng).
Hình 4: U hỗn hợp tuyến mang tai (A); đại thể u giới hạn rõ, mặt cắt đặc, óng ánh do có vùng biệt hóa theo hướng sụn (B); vi thể gồm các đám biểu mô tuyến (1) và sụn trong (2, C).
Tuy nhiên trong 1 số trường hợp, tế bào chuyển dạng có thể sinh sản và biệt hoá theo nhiều hướng khác nhau, tạo ra u hỗn hợp nhiều thành phần. Thí dụ u tuyến đa dạng tuyến nước bọt, cấu tạo gồm các đám tế bào biểu mô nằm trên 1 mô đệm sợi niêm có chứa các ổ xương hoặc sụn, tất cả các thành phần khác nhau này đều có chung 1 nguồn gốc là các tế bào cơ – biểu mô chuyển dạng của tuyến nuớc bọt. (Hình 4)
U quái (teratoma): cấu tạo gồm các thành phần tế bào và mô rất khác nhau xuất nguồn từ cả 3 lá phôi – như biểu mô, xương, sụn, mô thần kinh – sắp xếp hỗn độn với nhau. Các thành phần trên đều được sinh ra từ một tế bào mầm chuyển dạng, là tế bào có khả năng biệt hoá thành bất kỳ loại tế bào nào trong cơ thể (xem hình 40, 41 trong chương bệnh lý sinh dục nữ).
Một số u ác lại được đặt tên theo kiểu u lành với đuôi OMA. Thi dụ u ác trung biểu mô (mesothelioma), ung thư hạch nguyên phát (lymphoma), u hắc tố ác (melanoma), u tinh bào (seminoma). Các tên gọi này không hợp lý nhưng vì quá quen dùng nên vẫn được giữ nguyên.
Một số u được đặt tên theo tên của tác giả đầu tiên tìm ra. Thí dụ sarcôm Ewing của xương, bệnh Hodgkin của hạch, limphôm Burkitt, sarcôm Kaposi, bướu Wilms…
Bảng sau đây giới thiệu tên gọi của một số u thường gặp:
Hình thái tổn thương:
Đại thể:
Hình dạng:
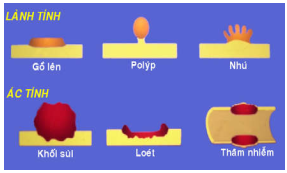
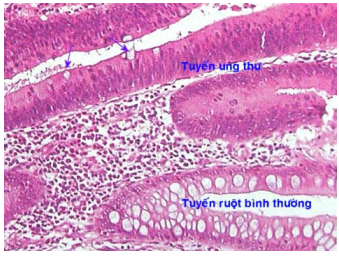
Thay đổi tuỳ theo loại u và vị trí xuất hiện u. U lành xuất phát từ biểu mô phủ thì thường có dạng một vùng gồ lên trên bề mặt, polýp hoặc nhú; trái lại u ác thường có dạng khối sần sùi, loét, thâm nhiễm hoặc phối hợp giữa 3 dạng này với nhau (Hình 6, 7). Các u xuất phát từ biểu mô nhưng nằm sâu trong các tạng (gan, phổi, thận) hoặc từ trung mô thì thường có dạng khối cục mà tính chất lành ác chỉ có thể xác định được qua khảo sát vi thể.
Hình 6: Dạng đại thể của u xuất phát từ biểu mô phủ.
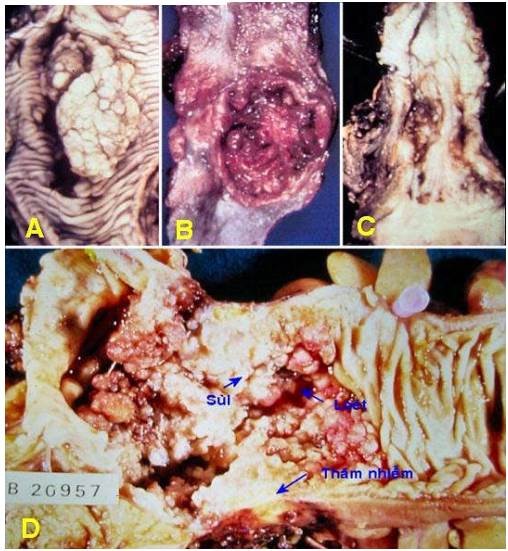
Hình 7: Ung thư thực quản: dạng khối sùi (A), loét (B), thâm nhiễm (C); Ung thư đại tràng có đại thể phối hợp cả 3 dạng (D).
Kích thước:
Tuỳ theo thời điểm phát hiện, u có đường kính thay đổi từ 1-2 cm đến 15-20 cm. Tương quan giữa kích thước với tính chất lành ác không quan trọng cho bằng tốc độ phát triển của khối u; một u lớn nhanh thường là u ác.
Giới hạn- vỏ bao:
U lành thường có giới hạn rõ, có vỏ bao sợi ngăn cách với mô lành lân cận; vì vậy u có tính chất di động, dễ dàng bóc tách cắt bỏ toàn bộ khối u (Hình 8A,C). Tuy nhiên cũng có những u lành có giới hạn rõ nhưng không có vỏ bao (thí dụ u cơ trơn thân tử cung) và những u lành có giới hạn không rõ cũng như không có vỏ bao (thí dụ u lành mạch máu).
U ác thường không có vỏ bao, giới hạn không rõ rệt do sự xâm nhập của tế bào ung thư vào mô lành lân cận; vì vậy u di động kém, khó bóc tách cắt bỏ trọn vẹn khối u. (Hình 8B,D)
Hình 8: U sợi tuyến vú lành tính có vỏ bao, gIới hạn rõ (A); carcinôm tuyến vú không có vỏ bao, giới hạn không rõ (mũi tên, B). U tuyến tuyến giáp dạng nang lành tính, có vỏ bao, mặt cắt đơn dạng (C); carcinôm tuyến giáp không có vỏ bao, giới hạn không rõ, mặt cắt không đồng nhất (D).
Mật độ:
Thay đổi tuỳ theo loại u. U lành thường có mật độ chắc hơn mô xung quanh. Mật độ của u ác thường mềm bở (thí dụ ung thư tuyến vú dạng tủy, sarcôm mỡ) nhưng cũng có khi rất cứng do phản ứng tạo sợi trong mô đệm u (thí dụ carcinôm ống tuyến vú thể xơ chai).
Mặt cắt:
Mặt cắt của u lành thường đồng nhất, đơn dạng (thí dụ u mỡ có mầu vàng, u sợi tuyến vú có mầu hồng) (Hình 8C); trái lại mặt cắt của u ác thường không đồng nhất, nhiều mầu sắc do các hiện tượng hoại tử, xuất huyết trong khối u (tuy nhiên cũng có những u ác có mặt cắt rất đồng nhất như limphôm, seminôm). (Hình 8D)
Vi thể:
Cấu tạo vi thể của u lành
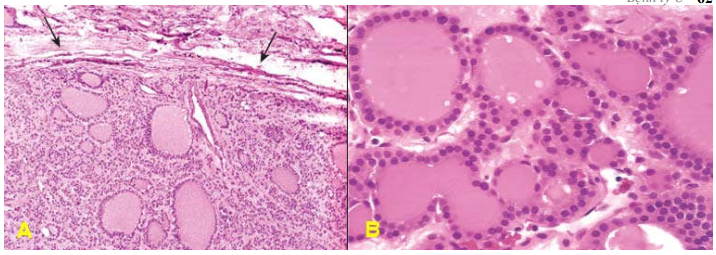
Giống hệt như mô nguyên ủy bình thường; các tế bào u đạt đến độ biệt hoá hoàn toàn về cấu trúc và chức năng giống như tế bào bình thường. Thí dụ trong u tuyến tuyến giáp dạng nang lành tính (Hình 8C), tế bào u có cấu trúc giống tế bào nang giáp bình thường, hợp thành các túi tuyến có chứa chất keo giáp do tế bào u sản xuất. Do hoạt động tăng sinh trong khối u, có thể thấy một ít hình ảnh phân bào nhưng không bao giờ có phân bào bất thường. Tính chất lành tính của khối u còn đuợc khẳng định bởi sự không tìm thấy hình ảnh xâm nhập vào mô xung quanh và di căn đến nơi khác của các tế bào u. (Hình 9)
Hình 9: U tuyến tuyến giáp dạng nang lành tính có vỏ bao (mũi tên, A); tế bào u có hình thái giống hệt tế bào nang giáp bình thường, hợp thành nang chứa chất keo (B).
Cấu tạo vi thể của u ác
Được đặc trưng bởi tình trạng suy giảm độ biệt hóa (anaplasia) – từ ít đến nhiều hoặc mất biệt hoá hoàn toàn – về cấu trúc và chức năng của tế bào u, bởi sự xâm nhập của tế bào u vào mô lân cận.
Đặc điểm hình thái tế bào u ác:
Các biểu hiện của tình trạng suy giảm độ biệt hóa gồm có:
Mật độ tế bào tăng, định hướng sắp xếp bị rối loạn.
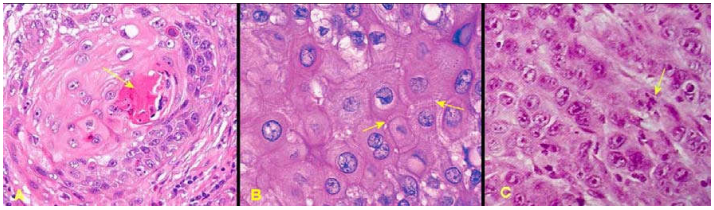
Đa dạng về hình thái và kích thước tế bào và nhân, có thể thấy những tế bào dị dạng, tế bào khổng lồ nhiều nhân, tế bào có nhân quái, nhân nhiều thùy, nhân có thể vùi (Hình 10).
Nhân lớn, tăng sắc, màng nhân không đồng đều, chất nhiễm sắc thô, vón cục; hạch nhân to.
Tỉ lệ nhân/ bào tương tăng, có thể đạt đến 1/1 thay vì 1/4 đến 1/6 như ở tế bào bình thường (tương ứng với tình trạng đa bội thể trong nhân). (Hình 10)
Hình 10: Trong u ác như carcinôm ống tuyến vú (A) hoặc sarcôm cơ vân (B), có sự đa dạng về kích thước của tế bào và nhân; nhân lớn. hạch nhân to, tỉ lệ nhân/bào tương tăng, có tế bào khổng lồ nhiều nhân hoặc nhân quái.
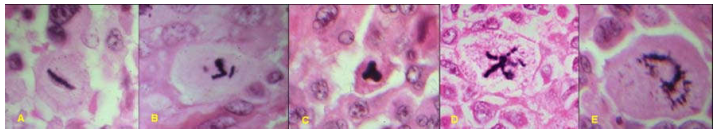
Tỉ lệ phân bào tăng, phản ánh tốc độ tăng sinh cao của u ác; nhưng quan trọng hơn cả là có sự xuất hiện các hình ảnh phân bào bất thường như phân bào 3 cực, 4 cực hoặc đa cực (tương phản với phân bào bình thường có 2 cực), phản ánh các rối loạn về cấu trúc và số lượng của bộ nhiễm sắc thể trong tế bào u và các bất thường của bộ máy phân bào. (Hình 11)
Hình 11: Phân bào bình thường 2 cực (A) và các phân bào bất thường đa cực (B,C,D,E)
Bào tương có thể chứa các thể vùi tương ứng với các sản phẩm bình thường hoặc bất thường do tế bào u sản xuất. Thí dụ bào tương tế bào ung thư tuyến ruột già có thể chứa chất nhầy như tế bào biểu mô ruột bình thường (Hình 12); các tế bào melanôm ứ đầy sắc tố melanin trong bào tương (Hình 1B); bào tương tế bào gan ung thư có chứa protein phôi AFP (alpha feto protein) (Hình 17A).
Hình 12: Tế bào ung thư tuyến ruột già vẫn có thể chứa chất chất nhầy (mũi tên) như tế bào tuyến ruột bình thường.
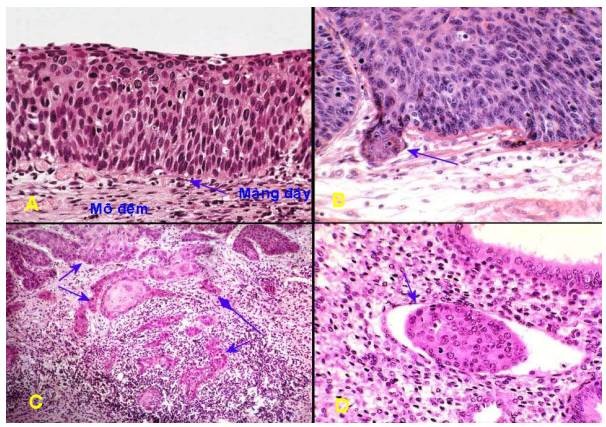
Sự xâm nhập vào mô lân cận: tính chất ác tính của khối u còn được biểu hiện qua sự xâm nhập của các tế bào u vào mô lân cận khiến ranh giới giữa khối u và mô lành xung quanh không còn rõ rệt. Thí dụ như sự xâm nhập của các đám tế bào ung thư vú vào trong mô mỡ và cân cơ bên dưới u. Đặc điểm này không được thấy ở những ung thư còn trong thời kỳ tiền xâm nhập, còn gọi là ung thư tại chỗ. Thí dụ trong ung thư tại chỗ ở cổ tử cung, các tế bào ung thư vẫn còn nằm trong lớp biểu mô bề mặt, chưa xâm nhập qua màng đáy (Hình 13A), sau một thời gian, tế bào ung thư sẽ phá vỡ màng đáy và xâm nhập vào mô đệm bên dưới, trong đó có các mạch máu và mạch bạch huyết (Hình 13B,C). Sự xâm nhập của tế bào ung thư vào trong các mạch máu và mạch bạch huyết trong khối u là điềm báo có thể đã có di căn xa (Hình 13D). Ngoài ra có thể thấy hiện tượng hoại tử xuất huyết trong khối u và trong mô lân cận.
Hình 13: Carcinôm tại chỗ (A); Tế bào ung thư bắt đầu phá màng đáy chui xuống mô đệm (mũi tên B); các đám tế bào ung thư xâm nhập sâu xuống mô đệm (mũi tên, C); Một đám tế bào ung thư xâm nhập vào trong mạch bạch huyết của mô đệm (mũi tên, D)
Độ biệt hoá và grad mô học:
Do tình trạng suy giảm độ biệt hóa về cấu trúc và chức năng của tế bào u, cấu trúc mô học của u ác bị đảo lộn không còn giống với mô nguyên ủy bình thường; tùy theo mức độ đảo lộn này ít hoặc nhiều, người ta phân biệt u ác thành 4 độ biệt hóa : Ung thư biệt hoá tốt, ung thư biệt hoá vừa, ung thư biệt hoá kém và ung thư không biệt hoá.
Trong loại ung thư biệt hoá tốt, cấu trúc của mô chủ u ít bị đảo lộn, nhìn giống mô nguyên uỷ đến mức nhiều khi khó phân biệt với u lành; thí dụ khó phân biệt giữa ung thư tuyến giáp dạng nang với 1 u tuyến tuyến giáp dạng nang lành tính, giữa carcinôm tế bào gai dạng mụn cóc ở da hoặc niêm mạc với u nhú lành tính.
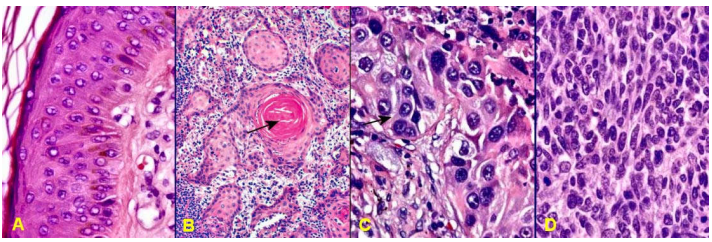
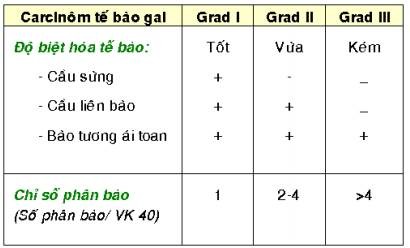
Đối với carcinôm tế bào gai của da, ung thư có độ biệt hóa tốt nếu tế bào u còn giữ được chức năng giống tế bào bình thường của mô nguyên ủy tức biểu bì, nghĩa là tế bào u vẫn sản xuất được keratin, tạo ra cầu sừng giống như lớp sừng bề mặt của biều bì; ung thư có độ biệt hóa vừa khi tế bào u không còn tạo được cầu sừng, nhưng vẫn liên kết được với nhau bằng cầu liên bào tương tự các tế bào thuộc các lớp trung gian của biểu bì. Ung thư có độ biệt hóa kém, tế bào u chỉ còn giữ được bào tương mầu hồng nhờ có bộ xương tế bào bằng cytokeratin, giống tế bào thuộc các lớp cận đáy của biểu bì nhưng sắp xếp rời rạc, do không liên kết được với nhau bằng cầu liên bào, không tạo được cầu sừng. (Hình 14)
Hình 14 : Biểu bì bình thường (A); carcinôm tế bào gai có độ biệt hóa tốt (B), tạo được cầu sừng (mũi tên); độ biệt hóa vừa (C), có cầu liên bào giữa các tế bào u (mũi tên); độ biệt hóa kém (D), tế bào u có bào tưong mầu hồng.
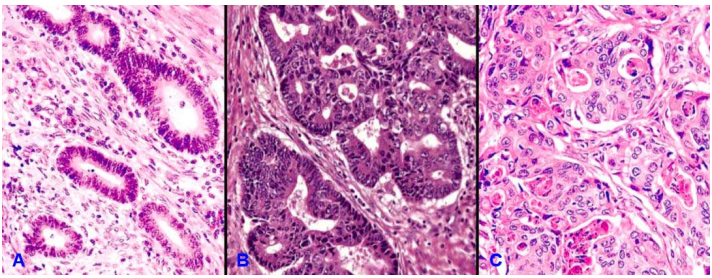
Đối với carcinôm tuyến như carcinôm tuyến đại tràng. Ung thư sẽ có độ biệt hóa tốt, vừa kém, hay không biệt hóa tùy theo thành phần tế bào u tạo được cấu trúc tuyến chiếm trên 95%, 50-95%, 5% đến dưới 50% hay dưới 5% tổng khối u. (Hình 15)
Hình 15: Carcinôm tuyến đại tràng có độ biệt hóa tốt (A); biệt hóa vừa (B); biệt hóa kém (C)
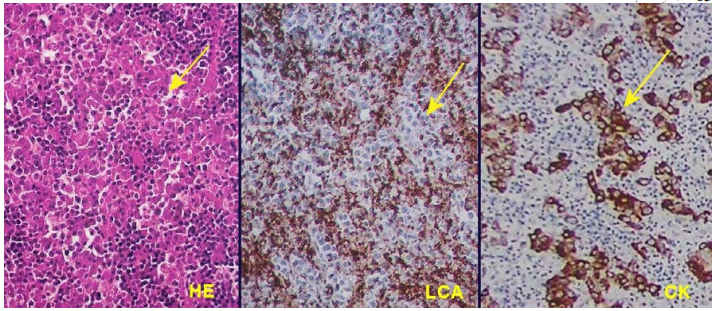
Đối với ung thư không biệt hoá, thí dụ như carcinôm không biệt hóa ở vòm hầu, có khi không phân biệt nổi nguyên ủy của ung thư, tức là không thể xác định được đây là 1 trường hợp carcinôm, sarcôm, limphôm hay melanôm, nếu không có các kỹ thuật bổ sung như hóa mô miễn dịch hoặc kính hiển vi điện tử.(Hình 16)
Hình 16: Carcinôm không biệt hóa vòm hầu: nhuộm HE thấy các đám tế bào nhân lớn dị dạng (mũi tên), không phân biệt chắc chắn là carcinôm hay limphôm. Nhuộm hóa mô miễn dịch thấy các đám tế bào này âm tính với LCA nhưng dương tính với cytokeratin; chứng tỏ đây là một carcinôm.
Các u ác tính được xếp loại grad mô học (Histologic grade) để đánh giá độ ác tính, u có grad mô học càng cao thì độ ác tính càng tăng. Có nhiều hệ thống grad mô học khác nhau như hệ thống 4 grad mô học (grad I, II, II, IV), hệ thống 3 grad ( grad I, II, III) và hệ thống 2 grad (grad thấp và grad cao). Các tiêu chuẩn được dùng để phân grad cũng khác nhau tùy từng loại u, vị trí u và tùy theo tác giả, thường bao gồm các tiêu chuẩn như mật độ tế bào trong u, độ biệt hóa tế bào u, mức độ đa dạng và dị dạng tế bào, chỉ số phân bào, mức độ hoại tử trong u…
Trên thực tế, hệ thống 3 grad được sử dụng nhiều nhất trong xếp loại grad mô học, dựa vào 2 tiêu chuẩn chính là độ biệt hóa của tế bào u và chỉ số phân bào trong khối u; thí dụ như cách xếp loại grad mô học của carcinôm tế bào gai của da theo tác giả Warren. (Hình 17)
Hình 17: Carcinôm tế bào gai Grad I, có cầu sừng (mũi tên, A); Grad II không có cầu sừng nhưng có cầu liên bào (mũi tên, B); Grad III với tế bào u có bào tương ái toan, nhiều phân bào (mũi tên, C), nhưng không có cầu sừng và cầu liên bào.
Nói chung, việc xếp loại grad mô học ít nhiều mang tính chủ quan của bác sĩ giải phẫu bệnh, vì vậy vai trò của nó trong việc đánh giá tiên lượng bệnh thì không quan trọng bằng việc xếp giai đoạn ung thư.
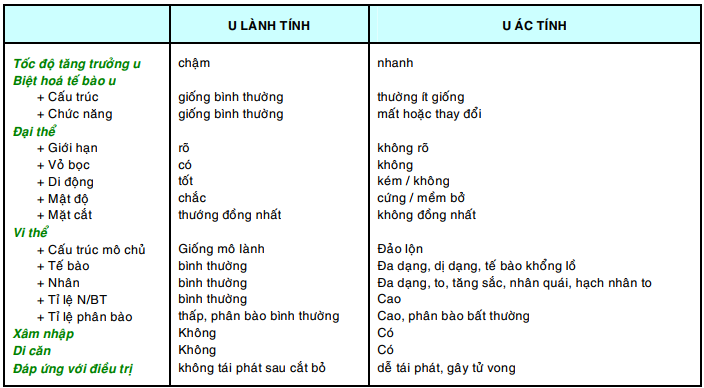
Bảng sau đây tóm tắt các điểm khác biệt chính giữa u lành và u ác:
Quá trình phát triển tự nhiên của ung thư (natural history):
Trong hơn 200 loại ung thư đã được mô tả, có thể nói mỗi loại đều có 1 quá trình phát triển tự nhiên riêng biệt. Nhưng nhìn chung, quá trình nào cũng gồm có 4 bước nối tiếp nhau là: Sự chuyển dạng ác tính của một tế bào cơ thể, sự tăng trưởng của khối u, sự xâm nhập tại chỗ và sự di căn.
Sự chuyển dạng ác tính:
Ung thư được khởi phát từ một tế bào cơ thể (còn gọi là tế bào soma) bị đột biến gen không gây chết do tác động của các yếu tố từ môi trường bên ngoài (hoá chất, bức xạ, virút) hoặc do tự phát, một số ít trường hợp do yếu tố di truyền. Kết quả tế bào soma này bị chuyển dạng, trở nên có khả năng tăng sinh quá mức và tự động, tạo thành 1 dòng tế bào u giống hệt nhau.
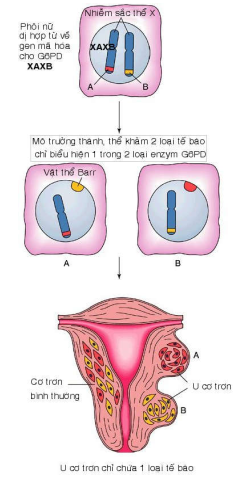
Tính chất đơn dòng của khối u đã được chứng minh qua nghiên cứu u xảy ra ở các phụ nữ dị hợp tử về gen mã hoá cho glucose-6-phosphat dehydrogenase (G6PD), là gen nằm trên nhánh dài của nhiễm sắc thể X. Các phụ nữ này có kiểu gen là XAXB, mỗi nhiễm sắc thể X chứa gen mã hoá cho 1 isoenzym, A hoặc B, của G6PD.
Ngay từ rất sớm trong thời kỳ phát triển phôi (giai đoạn phôi nang), ở mỗi tế bào phôi sẽ có hiện tượng bất hoạt ngẫu nhiên một trong 2 nhiễm sắc thể X (tạo thành vật thể giới tính Barr), cho nên cơ thể người phụ nữ nói trên thực chất là một thể khảm gồm 2 loại tế bào soma với tỉ lệ bằng nhau, mỗi loại chỉ biểu hiện 1 loại isoenzym của G6PD. Khi phụ nữ này bị 1 u cơ trơn thân tử cung, người ta thấy các tế bào u chỉ có biểu hiện của 1 trong 2 loại isoenzym của G6PD, chứng tỏ tất cả tế bào của u này đều đã được tạo ra từ cùng 1 tế bào soma bị chuyển dạng ban đầu. (Hình 18)
Hinh 18: Tính chất đơn dòng của u
Tế bào cơ thể khi đã chuyển dạng ác tính thành tế bào ung thư sẽ có khả năng tăng sinh tự động, không còn phụ thuộc vào các yếu tố tăng trưởng (YTTT) như các tế bào bình thường nữa. Một trong các lý do là các thụ thể đối với YTTT trên bề mặt tế bào u đã bị thay đổi khiến nó có thể tự kích thích mà không cần đến YTTT hoặc bản thân tế bào u có thể tự sản xuất ra các YTTT cần thiết cho sự tăng sinh của chính mình (kích thích tự tiết – autocrine stimulation).
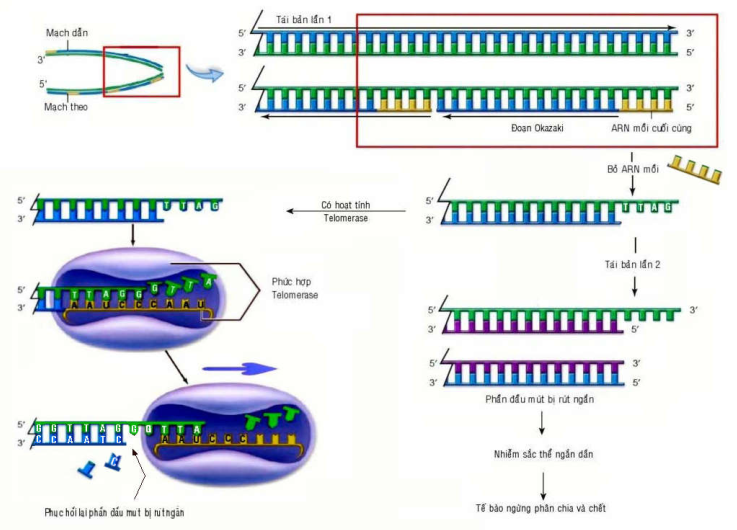
Trong môi trường nuôi cấy, tế bào bình thường chỉ có thể phân chia 1 số lần nhất định rồi trở nên già cỗi và chết, gọi là đã đạt đến giới hạn Hayflick; trái lại, tế bào u sẽ phân chia mãi mãi khi có đầy đủ chất dinh dưỡng, coi như đã trở nên bất tử. Chúng ta biết đặc điểm cấu tạo của phân tử ADN và cơ chế tái bản ADN ở tế bào nhân thực (eukaryote) chỉ cho phép các nucleotid mới được gắn thêm vào đầu 3′ , vì vậy phần đầu mút của nhiễm sắc thể (telomere) sẽ bị rút ngắn từ 50-100 cặp baz sau mỗi lần phân bào. Tuy phần đầu mút của mỗi nhiễm sắc thể có chứa các chuỗi 6 nucleotid 5′-TTAGGG-3′ lập lại hàng ngàn lần, giúp bảo vệ các gen chứa bên trong phân tử ADN nhưng vẫn không ngăn được sự rút ngắn ADN sau mỗi lần tái bản. Chống lại sự rút ngắn này là vai trò của Telomerase, một phức hợp enzym lớn có chứa phân tử ARN mồi cho phép phục hồi phần ADN bị rút ngắn; enzym có hoạt tính mạnh ở các tế bào gốc hoặc tế bào mầm sinh dục nhưng hầu như không còn thấy ở các tế bào đã biệt hoá.
Như vậy, giới hạn Hayflick tương ứng với sự lão hoá của các tế bào cơ thể, do phần đầu mút của nhiễm sắc thể đã bị biến mất hoàn toàn sau vài chục lần phân bào, khiến tế bào mất khả năng phân bào và chết. Tế bào u bất tử, có thể phân chia mãi mãi vì sản xuất được enzym telomerase, ức chế sự rút ngắn phần đầu mút nhiễm sắc thể sau mỗi lần phân bào; thực vậy, trong 90% các loại u của người, ghi nhận có sự gia tăng hoạt tính của telomerase, điều này mở ra 1 hướng tiếp cận mới trong phương pháp điều trị nhắm đích. (Hình 19).
Hình 19: Vai trò của enzym telomerase
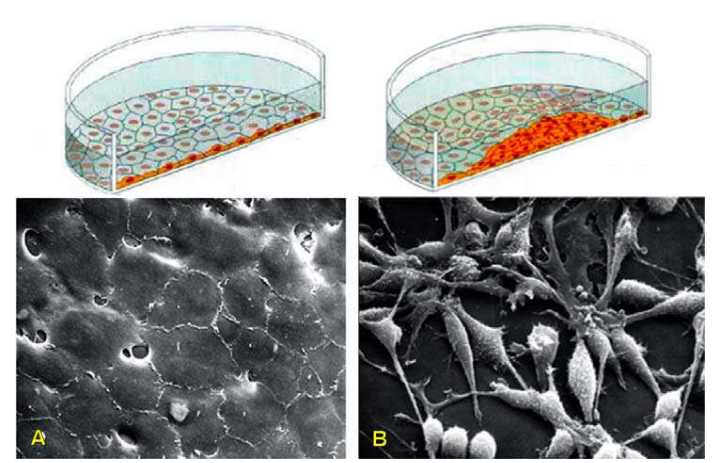
Cũng trong môi trường nuôi cấy, các tế bào bình thường chỉ có thể phân chia sau khi đã bám chắc được lên bề mặt của một giá đỡ và khi đã sinh sản thành một lớp thì ngừng lại, do có sự kiểm soát của cơ chế ức chế tiếp cận và cơ chế ức chế mật độ tế bào (Hình 20A). Sự tăng sinh của tế bào u thì không còn chịu sự kiểm soát này, vì vậy chúng có thể sinh sản chồng chất hỗn độn lên nhau mà chẳng cần bám lên 1 giá đỡ; hơn thế nữa, chúng còn có thể tách rời nhau một cách dễ dàng do có những thay đổi cấu trúc màng tế bào làm giảm độ kết dính. (Hình 20B)
Hình 20: Tế bào bình thường (A) và tế bào ung thư (B) trong môi trường nuôi cấy.
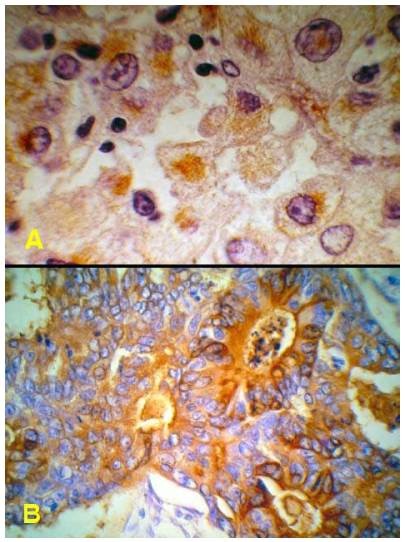
Tế bào u có thể sản xuất ra các chất giống như ở tế bào nguyên ủy; thí dụ tế bào ung thư của carcinôm tế bào gai ở da có thể sản xuất ra chất keratin. Một số loại tế bào u lại có thể sản xuất ra những chất không thấy có ở tế bào nguyên ủy hoặc chỉ có ở tế bào nguyên ủy trong thời kỳ phôi thai; thí dụ tế bào u của ung thư phổi loại tế bào nhỏ có thể sản xuất ra ACTH, ADH, seretonin; tế bào ung thư gan sản xuất ra alpha fetoprotein AFP; tế bào ung thư ruột sản xuất ra kháng nguyên carcinôm phôi CEA (carcinoembryonic antigen). Sự sản xuất nghịch thường này được giải thích là do hiện tượng giải ức chế các gen (gene derepression) mã hoá cho các protein nói trên, vốn đã bị đóng lại trong quá trình tăng trưởng và biệt hóa của tế bào (Hình 21).
Tóm lại, tế bào cơ thể một khi đã chuyển dạng ác tính sẽ có khả năng tăng sinh quá mức và tự động, thoát khỏi sự kiểm soát của mọi cơ chế điều hòa tăng trưởng trong cơ thể.
Hình 21: Tế bào ung thư gan sản xuất AFP, tế bào ung thư ruột sản xuất CEA ( nhuộm mầu nâu bằng kỹ thuật hóa mô miễn dịch)
Sự tăng trưởng của khối u:
Tốc độ tăng trưởng:
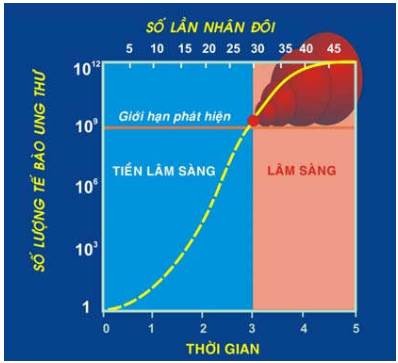
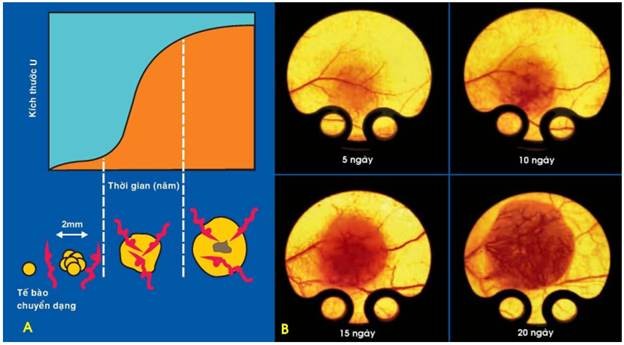
Tốc độ tăng trưởng của khối u được biểu thị bằng thời gian nhân đôi (TGNĐ), là thời gian cần thiết để số lượng tế bào u tăng gấp đôi.
Vì tất cả tế bào trong u đều là con cháu của một tế bào cơ thể chuyển dạng ban đầu (đường kính khoảng 10 µm, nên cần phải qua 30 lần nhân đôi để từ tế bào ban đầu này tạo thành 1 tỷ tế bào, tương ứng với 1 u có đường kính 1cm, nặng 1 gram; là giới hạn nhỏ nhất có thể phát hiện được qua thăm khám lâm sàng. Từ khối u nhỏ này, chỉ cần thêm 10 lần nhân đôi nữa là có thể đạt đến trọng lượng 1kg, chứa 1000 tỷ tế bào; là giới hạn lớn nhất mà cơ thể chấp nhận được. (Hình 22)
Hình 22: Tốc độ tăng trưởng của khối u
Thời gian tăng sinh từ tế bào chuyển dạng đầu tiên đến 1 khối u phát hiện được trên lâm sàng được gọi là thời kỳ tiền lâm sàng; nếu mỗi TGNĐ là 3 ngày (bằng với chu kỳ tế bào bình thường) thì thời kỳ này chỉ kéo dài có 3 tháng. Tất nhiên tính toán trên chỉ đúng khi tất cả các tế bào u đều cùng hoạt động tăng sinh và không có tế bào nào thất thoát khỏi khối u; nhưng một điều chắc chắn đúng và đáng buồn là khi phát hiện được u trên lâm sàng thì nó đã tiến được khá xa trên con đường phát triển tự nhiên của mình.
Trên thực tế, thời kỳ tiền lâm sàng thay đổi rất khác nhau tùy loại ung thư, khoảng 3 tháng đối với ung thư có độ ác tính cao như limphôm Burkitt (TGNĐ= 3 ngày), 17 tháng đối với sarcôm Ewing (TGNĐ= 17 ngày) hoặc hàng chục năm đối với carcinôm tuyến đại tràng (TGNĐ= 600 ngày). Nói chung, thời kỳ tiền lâm sàng trung bình của đa số các loại ung thư của người được ước lượng vào khoảng 2 năm.
Sự khác nhau về tốc độ tăng trưởng (tức TGNĐ) giữa các loại u là do khác biệt về phân số tăng trưởng và tỉ lệ giữa số lượng tế bào u mới được sản sinh so với số lượng tế bào bị chết hoặc thất thoát khỏi khối u.
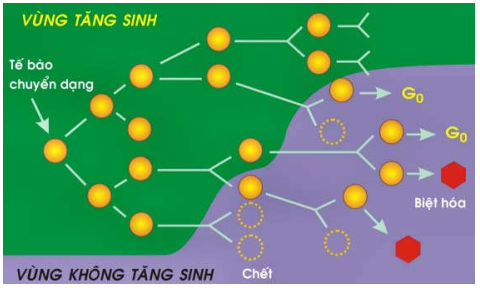
Phân số tăng trưởng là tỷ lệ tế bào đang hoạt động tăng sinh trong khối u. Nghiên cứu cho thấy phân số này chỉ cao trong giai đoạn đầu của quá trình tăng trưởng u, nghĩa là hầu hết các tế bào u đều hoạt động tăng sinh; nhưng sau đó phân số tăng trưởng sẽ giảm dần vì càng lúc càng có nhiều tế bào u được biệt hoá không còn khả năng phân chia hoặc tế bào dừng lại nghỉ ngơi ở giai đoạn G0 hoặc G1. Vì vậy, vào thời điểm được phát hiện trên lâm sàng; phân số tăng trưởng của đa số ung thư thường không vượt quá 20%. (Hình 23).
Hình 23: Phân số tăng trưởng
Mặt khác, có những tế bào u bị thất thoát hoặc chết do thiếu nguồn dinh dưỡng, có thể làm thay đổi mối cân bằng giữa số lượng tế bào mới sinh ra trên số lượng tế bào mất đi. Các loại ung thư như limphôm, ung thư phổi loại tế bào nhỏ có phân số tăng trưởng cao (khoảng 30%), số lượng tế bào mới sinh vượt trội số tế bào chết nên sẽ có tốc độ phát triển nhanh. Trái lại, các ung thư vú, ung thư ruột già có phân số tăng trưởng thấp (khoảng 2-8%), số lượng tế bào mới sinh chỉ hơi trội hơn số tế bào chết nên tốc độ phát triển sẽ chậm hơn.
Sự tăng sinh mạch máu trong khối u:
Sự tăng trưởng khối u phụ thuộc rất nhiều vào nguồn dinh dưỡng do mạch máu đưa tới; không có phân bố mạch máu, khối u không thể có đường kính vượt quá 1-2 mm (tương ứng với giới hạn khuyếch tán của oxy và chất dinh dưỡng từ mạch máu ra xung quanh).
Hình 24: Sự tăng sinh mạch máu trong khối u (A). Cấy tế bào carcinôm tuyến ruột giá của người vào mô dưới da chuột, tế bào ung thư phát triển thành 1 u ghép; sự tăng sinh mạch máu giúp u gia tăng kích thước rõ rệt chỉ sau 20 ngày (B).
Chính vì vậy, bản thân tế bào u thường có khả năng tiết ra nhiều yếu tố tạo mạch khác nhau như yếu tố tăng trưởng nguyên bào sợi FGF (Fibroblast growth factor), yếu tố tăng trưởng nội mô mạch máu VEGF (vascular endothelial growth factor); để kích thích sự tăng sinh mạch máu trong khối u (Hình 24).
Sự tăng sinh mạch máu có 1 tác động kép đối với sự tăng trưởng khối u:
Mạch máu tăng sinh cung cấp oxy và chất dinh dưỡng cần thiết cho hoạt động tăng sinh của u.
Tế bào nội mô của mạch máu mới thành lập, lại tiếp tục tiết ra các yếu tố tăng trưởng kích thích sự tăng trưởng khối u.
Mặt khác, sự tăng sinh mạch máu trong khối u càng làm tăng khả năng di căn xa đối với 1 số loại ung thư như melanôm, ung thư vú, ung thư phổi.
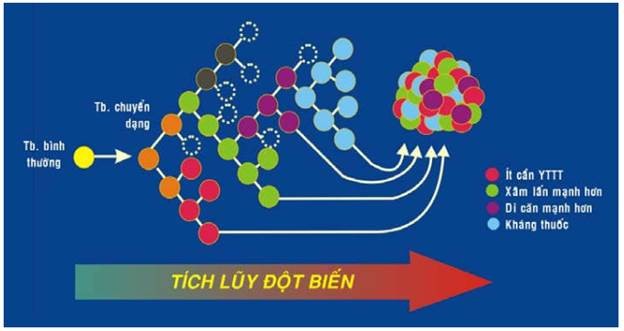
Sự đa dạng hoá tế bào u:
Thực tế cho thấy có nhiều ung thư trở nên ác tính hơn sau một thời gian tiến triển. HIện tượng này được giải thích là do tính không ổn định về mặt di truyền của các tế bào u khiến chúng dễ bị thêm nhiều đột biến mới một cách tự phát trong quá trình tăng sinh. Các đột biến mới này có loại gây chết tế bào u nhưng cũng có loại làm tế bào u có khả năng sống sót cao hơn hoặc trở nên ác tính hơn. Như vậy quá trình tăng trưởng u cũng là quá trình tích lũy và chọn lọc đột biến; làm xuất hiện thêm nhiều tiểu dòng tế bào u khác nhau với những thuộc tính sinh học mới như ít cần yếu tố tăng trưởng hơn, khả năng xâm lấn và di căn mạnh hơn, khả năng kháng thuốc cao hơn. Tóm lại, u khởi đầu có tính đơn dòng nhưng khi được phát hiện trên lâm sàng thì có thể nói nó đã được cấu tạo bởi những thành phần tế bào rất đa dạng về mặt sinh học. (Hình 25)
Hình 25: Sự đa dạng hóa tế bào u.
Sự xâm nhập tại chỗ (local invasion)
Khả năng xâm nhập tại chỗ và di căn xa là 2 đặc trưng riêng biệt của ung thư, không bao giờ thấy ở u lành.
Ung thư thường phát triển tại chỗ trong 1 thời gian khá lâu nhưng khó phát hiện vì u còn quá nhỏ, chưa xâm lấn phá hủy mô lân cận; nói cách khác, ung thư còn trong thời kỳ tiền lâm sàng. Thí dụ trong carcinôm tế bào gai cổ tử cung, các tế bào ung thư có thể còn giới hạn trong lớp biểu mô chưa xâm nhập qua màng đáy trong hàng chục năm mà không gây ra triệu chứng gì đáng kể; giai đoạn này được gọi là carcinôm tại chỗ. Khi có biểu hiện triệu chứng trên lâm sàng thì ung thư thường đã tiến triển qua giai đoạn xâm nhập và di căn (Hình 13). Hiện nay người ta nhấn mạnh nhiều đến các chương trình tầm soát nhằm phát hiện sớm ung thư ngay trong thời kỳ tiền lâm sàng, để tăng khả năng chữa khỏi và giảm thiểu tỉ lệ tử vong do ung thư đã bước vào giai đoạn xâm nhập và di căn.
Ung thư đuợc xác định đã tiến triển qua giai đoạn xâm nhập khi nó không còn giới hạn trong mô nguyên ủy và bắt đầu xâm nhập vào mô lành lân cận. Hậu quả của sự xâm nhập rất khác nhau tùy theo loại mô học và vị trí của ung thư, có khi rất nặng nề đe doạ đến tính mạng bệnh nhân. Thí dụ:
Ung thư cổ tử cung xâm nhập vào âm đạo và vùng chu cung, gây tắc nghẽn niệu quản.
Carcinôm ống tuyến vú xâm nhập gây lở loét da vú, tụt núm vú.
Carcinôm tuyến tụy xâm nhập vào đám rối thần kinh giao cảm thân tạng (celiac plexus) gây đau bụng dữ dội.
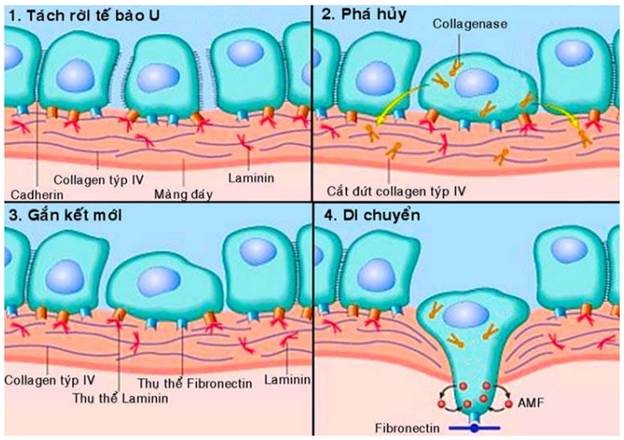
Giải thích về cơ chế của hiện tượng xâm nhập đối với các loại carcinôm; chúng ta biết trong cơ thể bình thường, các cấu trúc biểu mô được phân cách nhau bằng chất nền ngoại bào gồm có 2 thành phần là màng đáy và mô liên kết kẽ. Vì vậy để tiến triển từ giai đoạn ung thư tại chỗ sang giai đoạn xâm nhập, các tế bào u phải thực hiện 4 bước sau (Hình 26):
Sự tách rời các tế bào u: các tế bào biểu mô bình thường được liên kết với nhau chặt chẽ nhờ vào các thể liên kết tế bào (desmosome) và các phân tử kết dính có trên bề mặt (thí dụ như E- cadherin). Ở các tế bào ung thư, có sự thay đổi cấu trúc màng làm mất đi các phân tử kết dính khiến chúng dễ bong rời nhau hơn.
Phá hủy chất nền ngoại bào: tế bào ung thư chế tiết ra các enzym metalloproteinase (gelatinase, collagenase, stromelysin) cắt đứt các sợi collagen týp IV và laminin, làm phân hủy màng đáy, tạo ra các “lỗ thủng”.
Gắn kết mới: các sợi collagen týp IV và laminin bị cắt đứt ở bước 2 sẽ để lộ ra các vị trí gắn kết mới tương ứng với các thụ thể có trên bề mặt tế bào ung thư. Các mối gắn kết mới này sẽ thúc đẩy tế bào ung thư di chuyển.
Di chuyển trong chất nền ngoại bào: tế bào ung thư chui qua “lỗ thủng” trên màng đáy đi vào mô liên kết kẽ. Tại đây, tế bào ung thư lại tiếp tục hoạt động gắn kết (thí dụ với fibronectin), phân hủy các thành phần của chất nền ngoại bào và di chuyển. Sự di chuyển của các tế bào ung thư có thể được kích thích bởi chính các chất do chúng tiết ra, thí dụ như các yếu tố di chuyển tự tiết AMF (autocrine motility factor) mà tế bào ung thư có thụ thể tương ứng.
Hình 26: Cơ chế của hiện tượng xâm nhập
Sự di căn
Di căn là thuật ngữ dùng để mô tả sự hình thành những ổ ung thư thứ phát nằm cách xa khối ung thư nguyên phát, do sự phát tán các tế bào u từ khối ung thư nguyên phát. Cấu tạo vi thể của u thứ phát phần lớn đều giống với u nguyên phát. Khoảng 30 – 50% bệnh nhân ung thư khi được phát hiện thì đã có biểu hiện di căn rõ rệt.
Mọi loại ung thư đều có thể cho di căn nhưng khả năng di căn của chúng không đồng đều nhau. Thí dụ carcinôm tế bào đáy của da hiếm khi cho di căn xa trong khi sarcôm xương thì lại cho di căn xa rất sớm.
Các ung thư có thể cho di căn theo 3 đường sau:
Đường mạch bạch huyết :
Tế bào ung thư xâm nhập vào mạch bạch huyết đi đến các hạch. Đây là đường di căn trước tiên thường thấy đối với các carcinôm; trong khi đó sarcôm lại rất hiếm khi cho di căn theo đường bạch huyết. Kiểu phân bố các hạch di căn của mỗi loại ung thư thay đổi tùy theo vị trí của khối u nguyên phát và hệ thống dẫn lưu mạch bạch huyết tự nhiên tại đó. Thí dụ: carcinôm ống tuyến vú ở vị trí 1/4 trên ngoài vú thường cho di căn trước tiên đến hạch nách cùng bên (Hình 27A). Ung thư cổ tử cung cho di căn đến hạch chậu. Ung thư dương vật cho di căn đến hạch bẹn. Ung thư phổi cho di căn đến các hạch cạnh phế quản, rồi đến hạch rốn phổi và hạch trung thất.
Sự hình thành các ổ ung thư thứ phát trong hạch làm các hạch sưng to, cứng, dính nhau thành khối. Về mặt vi thể, các ổ ung thư thứ phát có cấu tạo tương tự u nguyên phát, được hình thành trước tiên trong xoang dưới vỏ, sau đó sẽ xâm lấn sâu vào trong và cuối cùng có thể phá hủy toàn bộ nhu mô hạch. (Hinh 27B)
Hình 27: Carcinôm ống tuyến vú di căn hạch nách cùng bên (A); các ổ ung thư thứ phát (*) được thấy trước tiên ở xoang dưới vỏ của hạch, tăng sinh phá hủy dần nhu mô hạch (B).
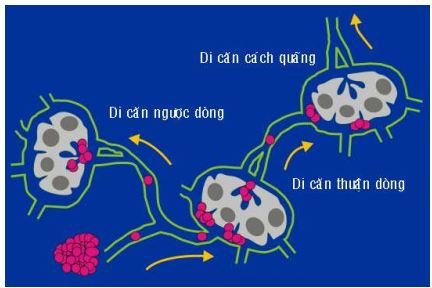
Hình 28: Tế bào ung thư di căn đến hạch theo đường bạch huyết (A); đôi khi di căn ngược dòng (B).
Có những trường hợp đặc biệt gọi là di căn cách quãng (skip metastases), các tế bào ung thư không tạo ra ổ thứ phát trong hạch đầu tiên mà chúng đến, nhưng tiếp tục di chuyển theo dòng bạch huyết để tạo ổ thứ phát trong những hạch tiếp sau đó. Cũng có những trường hợp gọi là di căn ngược, tế bào ung thư từ ổ thứ phát trong 1 hạch đã bị di căn sẽ di chuyển ngược dòng bạch huyết để tạo ra 1 ổ thứ phát khác trong hạch ở phía trước. (Hình 28)
Sau cùng, tế bào ung thư có thể vượt qua tất cả hệ thống bạch huyết, theo ống ngực đổ vào hệ tuần hoàn để tạo ra ổ ung thư thứ phát theo đường máu.
Đường máu:
Là đường di căn trước tiên thường gặp ở các sarcôm; các carcinôm thường cho di căn hạch trước rồi sau đó mới di căn theo đường máu nhờ vào những thông nối tự nhiên giữa hệ thống mạch bạch huyết và hệ thống mạch máu, hoặc do bản thân tế bào ung thư trực tiếp xâm nhập vào mạch máu (tuy nhiên trong một số trường hợp, di căn theo đường máu của carcinôm có khi còn được thấy trước cả di căn hạch). Tế bào ung thư xâm nhập phá hủy thành các tĩnh mạch (động mạch ít bị hơn do có thành dầy), chui vào dòng máu phát tán đi khắp nơi trong cơ thể. Các ổ ung thư thứ phát do di căn theo đường máu thường thấy nhất ở gan và phổi; bởi vì gan là nơi tiếp nhận máu của toàn bộ hệ tĩnh mạch cửa còn phổi là nơi tiếp nhận máu của hệ tĩnh mạch chủ (Hình 28).
Các ổ ung thư nguyên phát nằm gần cột sống (ung thư tuyến giáp, ung thư tuyến tiền liệt ) thường cho di căn theo mạng tĩnh mạch cạnh sống, tạo ra các ổ thứ phát tại các xương đốt sống. Như vậy ít nhiều cũng có thể dự đoán được kiểu phân bố giải phẫu học của các ung thư thứ phát trong cơ thể, dựa vào vị trí của ung thư nguyên phát và sự dẫn lưu tĩnh mạch tại đó. Tuy nhiên nếu chỉ đơn giản như thế thì khó mà giải thích được kiểu di căn xa của nhiều loại ung thư; thí dụ như ung thư phổi thường cho di căn đến tuyến thượng thận và não; ung thư vú hay cho di căn đến xương, ung thư tuyến giáp lại hay cho di căn đến da và mô mềm. Ngược lại cũng có những mô-cơ quan hầu như không bao giờ bị di căn như cơ vân, cơ tim, lách. Có thể đã có một cơ chế chọn lọc – hướng cơ quan khác nhau tùy từng loại ung thư và từng bệnh nhân trong việc hình thành các ổ ung thư thứ phát do di căn theo đường máu.
Hình 28: Tổn thương di căn phổi gồm nhiều ổ (A); trên vi thể là các đám tuyến ung thư xâm nhập nhu mô phổi (B); di căn gan đa ổ (C); vi thể cho thấy các đám tuyến ung thư xâm nhập vào mô gan (D).
Cũng cần nhấn mạnh là không phải mọi tế bào ung thư sau khi lọt vào dòng máu đều tạo ra được các ổ ung thư thứ phát. Nghiên cứu trên chuột cho thấy mặc dù mỗi ngày có hàng triệu tế bào từ khối ung thư nguyên phát lọt vào dòng máu nhưng chỉ có vài ổ ung thư thứ phát được hình thành. Người ta ước lượng có không quá 1/1000 số tế bào ung thư lọt vào dòng máu là có khả năng tạo ra được ổ ung thư thứ phát.
Đường ống tự nhiên:
Các ung thư có thể mượn đường ống tự nhiên như khoang màng bụng, khoang màng phổi; để di căn đến các nơi khác trong cơ thể. Thí dụ:
Carcinôm tuyến đại tràng có thể xâm nhập qua thành ruột, tạo ra các ổ thứ phát trong khoang màng bụng cách xa vị trí nguyên phát.
Ung thư phổi xâm nhập qua màng phổi, tạo ra các ổ thứ phát trong khoang màng phổi.
Ung thư buồng trứng gieo rắc vào trong khoang màng bụng, tạo các ổ thứ phát tại mạc nối, mạc treo ruột. (Hình 29)
Ung thư não mượn đường não thất đến màng não.
Ngoài ra, người ta còn đề cập đến 1 con đường di căn nhân tạo, xảy ra do sự gieo rắc các tế bào ung thư dính vào dao mổ, găng tay trong khi mổ.
Hình 29: Đại thể và vi thể của ung thư buồng trứng di căn mạc nối theo đường khoang màng bụng
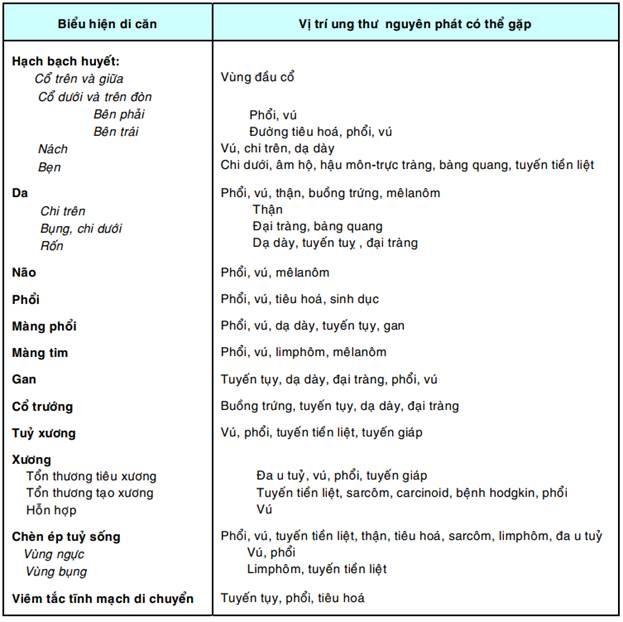
Ung thư di căn không rõ ổ nguyên phát:
Khoảng 4% bệnh nhân ung thư chỉ có biểu hiện di căn mà ổ nguyên phát thì không thấy rõ. Tiên lượng các trường hợp chỉ cho di căn hạch thì tốt hơn so với trường hợp có di căn nơi khác, nhưng cũng chỉ 1/4 trong số này là có đáp ứng với điều trị. Những trường hợp di căn không rõ ổ nguyên phát gây khó khăn cho cả thầy thuốc lẫn bệnh nhân vì phải làm nhiều xét nghiệm để tìm ổ nguyên phát. Bảng dưới đây gợi ý vị trí ung thư nguyên phát cần tìm tương ứng với các biểu hiện di căn khác nhau:
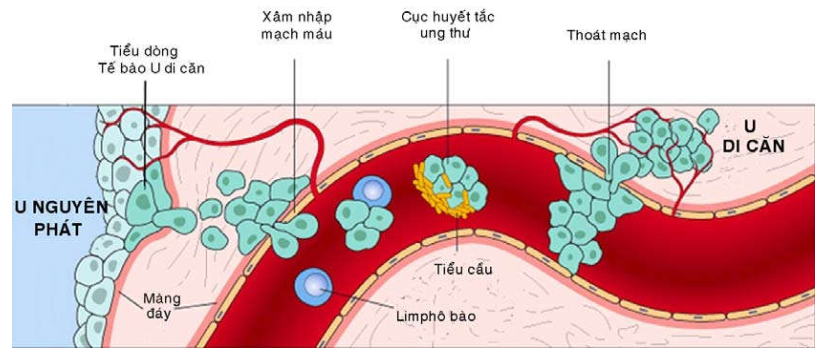
Cơ chế của hiện tượng di căn theo đường bạch huyết hoặc đường máu thì cũng tương tự như hiện tượng xâm nhập. Các tế bào ung thư di chuyển trong chất nền ngoại bào phải đến gắn kết vào màng đáy bao quanh các tĩnh mạch và mạch bạch huyết rồi phá hủy nó để chui vào lòng mạch. Trong lòng mạch, đại đa số các tế bào ung thư di chuyển riêng rẽ nhưng cũng có thể kết dính với các tiểu cầu và bạch cầu tạo thành một cục huyết tắc ung thư. Khi di chuyển đến vùng thích hợp, tế bào ung thư kết dính lên tế bào nội mô, phá hủy màng đáy, chui ra khỏi lòng mạch và tăng sinh thành một khối u thứ phát. (Hình 30)
Hình 30: Cơ chế của hiện tượng di căn
Dịch tễ học ung thư (cancer epidemiology):
Là môn học nghiên cứu về sự phân bố ung thư trong 1 quần thể dân cư và những yếu tố có liên quan như tuổi tác, nghề nghiệp, chủng tộc, văn hoá, tập quán…
Nghiên cứu dịch tễ ung thư cung cấp những thông tin rất giá trị, góp phần làm sáng tỏ nguyên nhân sinh ung, thí dụ như qua điều tra dịch tễ học có thể chứng minh mối liên hệ nhân quả giữa thói quen hút thuốc lá và ung thư phổi, xuất độ ung thư phổi gia tăng tỉ lệ thuận với số điếu thuốc hút mỗi ngày.
Sau đây là 1 số yếu tố thường được khảo sát trong các nghiên cứu dịch tễ học ung thư.
Xuất độ ung thư:
Là số trường hợp ung thư mới xuất hiện trong quần thể dân cư hàng năm, tính trên 100.000 dân.
Theo Tổ chức Y tế thế giới (WHO), năm 2008 ước tính trên toàn thế giới có khoảng 12,5 triệu trường hợp ung thư mới và gần 7,5 triệu trường hợp tử vong do ung thư; dự đoán đến 2020 mỗi năm sẽ có 16 triệu trường hợp ung thư mới và 10 triệu trường hợp tử vong.
Ở Mỹ, xuất độ ung thư là vào khoảng 523 trường hợp/ 100.000 dân/ năm; ước lượng trong năm 2012 có 1.638.910 triệu trường hợp ung thư mới và 577.190 trường hợp tử vong do ung thư. Phí tổn dành cho ung thư tại Mỹ vào năm 2007 đã lên đến 226 tỷ đô la.
Ở nước ta, theo số liệu của Bộ Y tế (2002) thì mỗi năm có khoảng 150.000 trường hợp ung thư mới và 100.000 trường hợp tử vong; tương ứng với 1 xuất độ ung thư vào khoảng 180 – 190 trường hợp/100.000 dân/ năm.
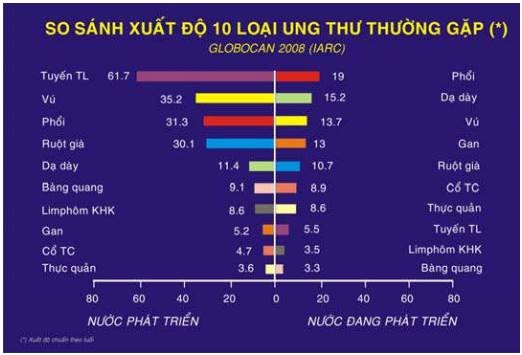
So sánh giữa các nuớc công nghiệp phát triển và các nước đang phát triển về xuất độ của 10 loại ung thư thường gặp nhất (Tổ chức nghiên cứu ung thư quốc tế – IARC, 2008), ta thấy có sự liên quan giữa một số loại ung thư với trình độ phát triển của các quốc gia. Thí dụ:
Ung thư tuyến tiền liệt đứng hàng thứ 1 ở các nước phát triển nhưng chỉ đứng hàng thứ 8 ở các nước đang phát triển; trái lại, ung thư gan và ung thư cổ tử cung vẫn còn là ung thư phổ biến ở những nước nghèo, đứng hàng thứ 4 và 6, so với hàng thứ 8 và 9 ở các nước giàu. (Hình 31).
Hình 31 : So sánh xuất độ chuẩn theo tuổi của 10 loại ung thư thường gặp giữa 2 nhóm nước.
Giữa những vùng khác nhau trong cùng một quốc gia, cũng có thể thấy sự khác biệt về xuất độ của các loại ung thư thường gặp. So sánh giữa thành phố Hồ chí Minh và Hà nội trong khoảng thời gian 5 năm từ 2004 đến 2008, ta thấy 4 loại ung thư thường gặp nhất ở giới nam đều là ung thư phổi, gan, ruột già và dạ dày; ở giới nữ, ung thư hàng đầu đều là ung thư vú nhưng xuất độ ở Hà nội cao gần gấp đôi, ung thư cổ tử cung còn chiếm vị trí thứ 2 ở thành phố Hồ chí Minh trong khi chỉ đứng hàng thứ 5 ở Hà nội. Tìm hiểu nguyên nhân gây ra những khác biệt này có thể giúp đề ra những biện pháp phòng chống ung thư tốt hơn cho mỗi cộng đồng dân cư.(Hình 32 )
Hình 32: So sánh xuất độ 10 loại ung thư thường gặp giữa thành phố Hồ Chí Minh và Hà Nội
Yếu tố địa dư:
Có sự khác biệt về xuất độ của nhiều loại ung thư giữa những vùng địa dư khác nhau. Để lý giải sự khác biệt này là do ảnh hưởng của yếu tố chủng tộc hoặc do yếu tố môi trường, người ta thường tiến hành nghiên cứu trên những nhóm người di dân nhập cư.
Thí dụ:
Ở Nhật, ung thư dạ dày có xuất độ cao nhất, nhiều hơn ở Mỹ gấp 10 lần. Nhưng trong các gia đình người Nhật nhập cư vào Mỹ, các thế hệ con cháu lại có xuất độ ung thư dạ dày thấp như dân bản xứ. Như vậy xuất độ ung thư dạ dày cao tại Nhật có lẽ là do các yếu tố môi trường (chế độ ăn nhiều gia vị ?) hơn là do yếu tố chủng tộc.
Phụ nữ các nước Bắc Mỹ có xuất độ ung thư vú cao nhất, nhiều hơn phụ nữ Châu Á từ 2-3 lần, có lẽ do chế độ ăn nhiều mỡ, sinh con ít và muộn.
Ung thư gan tương đối hiếm gặp ở Mỹ nhưng khá phổ biến ở các nước Đông Nam Á, có lẽ liên quan với tình trạng viêm gan siêu vi B và thực phẩm nhiễm Aflatoxin thường thấy tại vùng này.
Tuổi:
Khoảng 77% các trường hợp carcinôm xảy ra sau 55 tuổi. Ghi nhận ung thư tại bệnh viện ung bướu cho thấy xuất độ các ung thư hàng đầu ở cả 2 giới bắt đầu tăng nhanh sau 40 tuổi. Sự gia tăng xuất độ ung thư theo tuổi tác được xem là hậu quả của sự tích luỹ theo thời gian các đột biến tế bào soma dưới tác động của các yếu tố sinh ung trong môi trường. Bảng sau đây cho thấy nguy cơ bị ung thư tăng dần theo tuổi tác.
|
|
Nguy cơ bị ung thư |
|
|
Độ tuổi |
Nam giới |
Nữ giới |
|
Mới sinh – 39 40-59 60-79 |
1/58 1/13 1/3 |
1/52 1/11 1/4 |
Tuy nhiên cũng có những loại ung thư hay xảy ra ở trẻ em dưới 5 tuổi như bệnh bạch cầu nguyên bào limphô, u nguyên bào võng mạc, u nguyên bào thần kinh, u Wilms, sarcôm cơ vân…
Nghề nghiệp:
Percival Pott là người đầu tiên vào năm 1775, ghi nhận sự gia tăng xuất độ ung thư da bìu ở những người thợ cạo ống khói, từ đó đưa ra giả thiết bồ hóng là thủ phạm gây ung thư này. Ngày nay đã xác định tác nhân sinh u trong bồ hóng chính là các hydrocarbon thơm đa vòng.
Ung thư cổ tử cung có xuất độ cao ở những công nhân tình dục nhưng lại rất hiếm gặp ở nữ tu sĩ, chứng tỏ nguyên nhân gây ung thư có thể là 1 yếu tố được lây truyền qua đường sinh hoạt tình dục mà ngày nay đã xác định được là các virút HPV (human papillomavirus).
Di truyền:
Trong hơn 200 loại ung thư đã được biết, đại đa số là do các đột biến gen xảy ra tự phát hoặc do tác động của các yếu tố môi trường; chỉ có khoảng 5-10% trường hợp là có vai trò của yếu tố di truyền với những mức độ khác nhau như ung thư di truyền, bệnh di truyền làm cho cơ địa người bệnh dễ bị ung thư và ung thư có tính gia đình.
Ung thư di truyền: cho đến nay đã xác định được hơn 30 loại ung thư là bệnh di truyền theo kiểu gen trội-nhiễm sắc thể thường. Thí dụ:
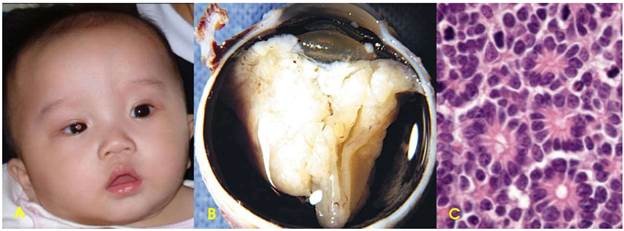
U nguyên bào võng mạc (Hình 33):
Hình 33: U nguyên bào võng mạc mắt phải làm đồng tử có ánh xám trắng (A); do u phát triển từ võng mạc xâm lấn vào thể thuỷ tinh (B); trên vi thể, tế bào u hình trụ thấp, nhân lệch đáy, xếp thành các cấu trúc hoa hồng (C).
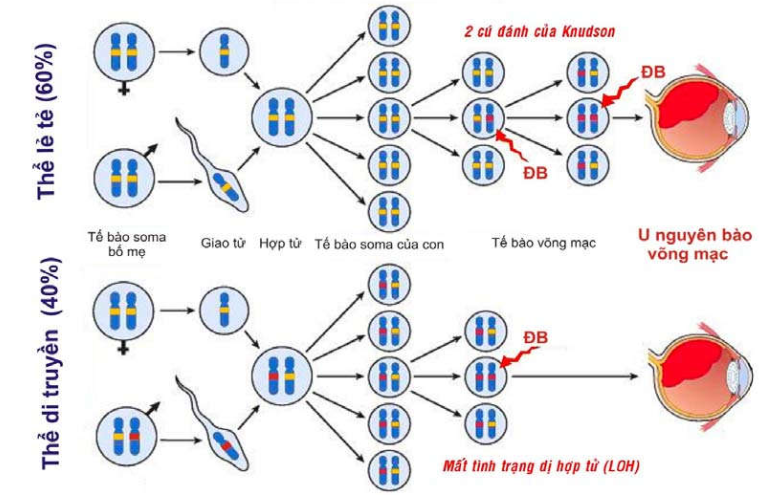
Là 1 ung thư trẻ em hiếm gặp, xuất độ chỉ vào khoảng 1/30.000 trẻ sinh sống, gồm 2 thể bệnh: thể lẻ tẻ (60%) và thể di truyền (40% các trường hợp). Trong thể di truyền, trẻ mang gen bệnh có nguy cơ bị u cao gấp 10.000 lần so với trẻ bình thường; u thường xuất hiện ở cả 2 mắt, khác với thể lẻ tẻ thường chỉ ở 1 mắt. Hiện nay chúng ta đã biết cơ chế sinh ung là do đột biến gen Rb, nằm trên nhánh dài nhiễm sắc thể 13.
Bệnh polýp tuyến đại tràng có tính gia đình (familial adenomatous polyposis) : chiếm tỉ lệ không quá 1% ung thư đại trực tràng. Người mang gen bệnh sẽ có hàng trăm polýp tuyến ở đại – trực tràng vào độ tuổi 30; đến tuổi 50, một số polýp này sẽ tiến triển thành carcinôm tuyến. Cơ chế sinh ung đột biến gen APC, nằm trên nhánh dài nhiễm sắc thể số 5.
Cơ địa di truyền dễ bị ung thư: có một số bệnh di truyền theo kiểu gen lặn- nhiễm sắc thể thường tuy không phải là bệnh ung thư nhưng người mang gen bệnh ở trạng thái đồng hợp tử sẽ có cơ địa dễ bị ung thư hơn người bình thường. Thí dụ:
Bệnh khô bì sắc tố (xeroderma pigmentosum): cá thể đồng hợp tử về gen này dễ bị melanôm ác và các loại ung thư da khác do tác động của bức xạ cực tím có trong ánh sáng mặt trời.
Ung thư có tính gia đình: trong 1 số gia đình, đôi khi có sự xuất hiện trùng hợp 2 – 3 thành viên bị cùng một loại ung thư như ung thư vú, ung thư buồng trứng, ung thư đại trực tràng, ung thư tuyến giáp…mà kiểu di truyền không thể hiện rõ trội hay lặn. Nguyên nhân của những trường hợp này có thể là do sự lưu truyền trong dòng họ một vài loại đột biến gen nào đó, khiến cho các thành viên có nguy cơ mắc ung thư cao hơn người bình thường từ 2-3 lần.
Các tổn thương tiền ung:
Là những tổn thương có nguy cơ cao chuyển thành ung thư nhưng không tất yếu xảy ra như vậy. Thí dụ:
Tổn thương sửa chữa tái tạo kéo dài: các vết loét da không lành, lổ dò da mãn tính có thể chuyển thành carcinôm tế bào gai; viêm gan mãn có thể chuyển thành ung thư gan.
Tăng sản không điển hình và nghịch sản: Tăng sản không điển hình nội mạc tử cung có thể chuyển thành ung thư nội mạc tử cung; tăng sản không điển hình biểu mô ống tuyến vú có thể chuyển thành carcinôm ống tuyến vú; nghịch sản biểu mô cổ tử cung có thể chuyển thành ung thư cổ tử cung; nghịch sản biểu mô hô hấp do hút thuốc lá có thể chuyển thành ung thư phế quản; nghịch sản biểu mô tiêu hoá trong viêm loét đại tràng mãn tính có thể chuyển thành carcinôm đại- trực tràng.
Tổn thương bạch sản ở niêm mạc miệng, dương vật và âm hộ có thể chuyển thành carcinôm tế bào gai.
Nguyên nhân gây ung thư:
Các tác nhân sinh ung được xếp vào 3 nhóm chính: các hoá chất, bức xạ và virút.
Chúng có thể tác động riêng rẽ hoặc hiệp đồng với nhau.
Các hoá chất sinh ung (chemical carcinogen):
Các hoá chất sinh ung có cấu tạo rất đa dạng, có nguồn gốc tự nhiên hoặc nhân tạo. Đặc điểm chung của các hoá chất sinh ung là chúng có ái lực điện tử rất cao, dễ dàng tương tác với các phân tử protein, ARN và ADN. Vì vậy, hầu hết các hoá chất sinh ung cũng là những tác nhân gây đột biến (mutagen), có thể gây tổn thương cho phân tử ADN. Phân biệt 2 loại hoá chất sinh ung:
Hoá chất sinh ung trực tiếp: có khả năng trực tiếp gây tổn thương phân tử ADN, tạo ra ung thư. Thí dụ các chất alkyl hoá. Đáng chú ý là một số chất alkyl hoá như cyclophosphamide, chlorambucil đã được sử dụng thành công trong điều trị một số loại ung thư (ung thư buồng trứng, limphôm) thì lại có khả năng gây ra một ung thư mới về sau (thường là bệnh bạch cầu).
Hoá chất sinh ung gián tiếp: đa số các hoá chất sinh ung thuộc về loại này, bản thân chúng chưa phải là các tác nhân sinh ung, cần phải được chuyển hoá trong cơ thể để trở thành một tác nhân sinh ung thực sự. Thí dụ:
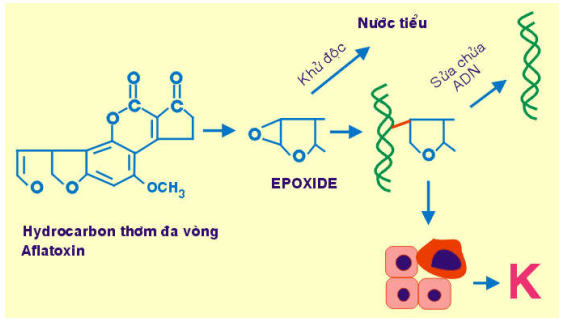
Các hydrocarbon thơm đa vòng có trong dầu mỏ ( benzanthracene), trong khói thuốc (benzopyrene); khi vào cơ thể được chuyển hoá thành epoxide, có khả năng tạo liên kết hoá trị với ADN, làm đột biến gen , gây ra ung thư da và ung thư phổi. (Hinh 34)
Hình 34 : Cơ chế sinh ung của hydrocarbon thơm và aflatoxin
Các amin thơm và phẩm nhuộm nhóm azo: thí dụ chất bêta naphthylamine, một amin thơm được sử dụng nhiều trong các xí nghiệp chế biến cao su; các phẩm nhuộm nhóm azo được dùng để nhuộm màu thực phẩm trông cho đẹp mắt. Các chất này khi vào cơ thể sẽ được chuyển hoá tại gan, trở thành tác nhân sinh ung thực sự, có thể gây ra ung thư gan và ung thư bàng quang.
Nitrosamin: nitrat được sử dụng làm phân bón, chất bảo quản thực phẩm; khi vào cơ thể, chúng được chuyển hoá bởi các vi khuẩn thường trú tại ruột, kết hợp với amin thành nitrosamin. Nitrosamin là một tác nhân sinh ung thực sự, có khả năng gây ra các ung thư đường tiêu hoá.
Aflatoxin: là sản phẩm của Aspergillus flavus, một loại nấm mốc phát triển mạnh trên thực phẩm ngũ cốc bảo quản kém. Trong cơ thể, aflatoxin được chuyển hoá thành epoxide, là tác nhân sinh ung mạnh, có thể gây ra ung thư gan.
Các hợp chất có chứa arsênic có khả năng gây ung thư da; các thuốc bảo vệ thực vật có thể gây ung thư gan.
Một điểm cần nhấn mạnh là không phải mọi tổn thương ADN do tác động của các hoá chất sinh ung đều dẫn đến ung thư, bởi vì tế bào vẫn có khả năng sửa chữa một số loại tổn thương ADN; không vậy thì xuất độ ung thư do hoá chất hẳn đã tăng vọt.
Các bức xạ (radiation)
Năng lượng bức xạ, hoặc dưới dạng tia cực tím của ánh sáng mặt trời, hoặc dưới dạng các bức xạ ion hoá, đều có thể gây chuyển dạng tế bào nuôi cấy, làm phát sinh ung thư ở người và các động vật thí nghiệm.
Tia cực tím:
Tia cực tím có trong ánh sáng mặt trời được chia thành 3 loại theo độ dài sóng: UVA (320-400nm), UVB (280 – 320nm) và UVC (200 – 280nm). UVB được xem là tác nhân chính có thể gây ra nhiều loại ung thư da khác nhau như mêlanôm, carcinôm tế bào gai, carcinôm tế bào đáy; người da trắng có nguy cơ mắc bệnh cao hơn người da mầu do thiếu tác động bảo vệ của sắc tố mêlanin trong lớp biểu bì (giúp hấp thu tia cực tím). UVC cũng có khả năng sinh ung nhưng rất may là nó đã được chặn gần hết bởi tầng ozon bao quanh trái đất; vì vậy sự hủy hoại tầng ozon như hiện nay do các khí thải từ mặt đất (như chất làm lạnh chlorofluorocarbon) có khả năng làm tăng số trường hợp ung thư da trong tương lai.
Hình 35 : Cơ chế sinh ung của tia cực tím
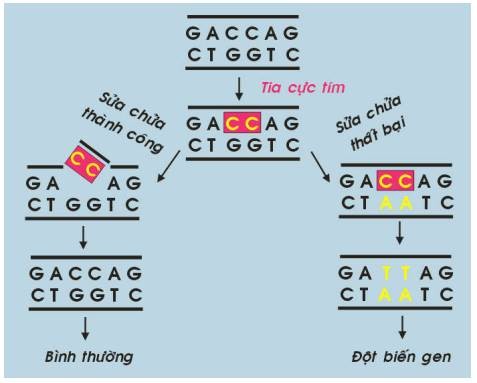
Cơ chế sinh ung của tia cực tím là do tác động của nó trên phân tử ADN, tạo cầu nối giữa các baz pyrimidin. Nếu những tổn thương ADN này không được sửa chữa kịp thời, đột biến gen có thể xảy ra và dẫn đến ung thư. (Hình 35)
Bức xạ ion hoá:
Gồm có 2 dạng: các sóng điện từ (tia X, tia gamma) và các hạt mang điện tích hoặc có năng lượng cao (hạt alpha, hạt bêta, proton, neutron). Tất cả đều có khả năng sinh ung như đã được thấy qua sự gia tăng xuất độ của nhiều loại ung thư ở những nạn nhân sống sót sau 2 vụ nổ bom nguyên tử tại Nhật bản năm 1945 và vụ nổ nhà máy điện hạt nhân Tchernobyl tại Liên xô năm 1986.
Công nhân khai thác mỏ uranium cũng có xuất độ ung thư phổi cao gấp 10 lần người bình thường. Ngay cả những liều phóng xạ dùng trong trị liệu cũng có thể gây ung thư nếu không được chỉ định đúng; thí dụ có 9% số trẻ em đã từng được chiếu xạ vào vùng cổ ngực khi còn bé về sau sẽ bị ung thư tuyến giáp.
Có một sự khác biệt về độ nhạy cảm giữa các mô cơ thể đối với tác động sinh ung của các bức xạ ion hoá. Các mô đặc biệt nhạy cảm gồm có mô tạo huyết, tuyến giáp, tuyến mang tai, vú, phổi; trái lại, da, xương, ống tiêu hoá thì tương đối ít nhạy cảm hơn.
Cơ chế sinh ung của các bức xạ ion hoá là do chúng có khả năng gây ra đột biến gen và các rối loạn cấu trúc nhiễm sắc thể.
Các virút sinh u (oncogenic virus):
Trên động vật thí nghiệm, người ta đã chứng minh khả năng sinh u của hàng trăm loại virút ARN và ADN khác nhau, nhưng đến nay cũng chỉ mới có vài loại virút được xác nhận là có khả năng sinh u ở người. Dù sao thì sự nghiên cứu về các virút sinh u ở động vật đã giúp khám phá sự tồn tại của các gen sinh u (oncogen) và làm gia tăng mức hiểu biết về cơ chế sinh ung ở mức độ phân tử.
Virút ARN sinh u:
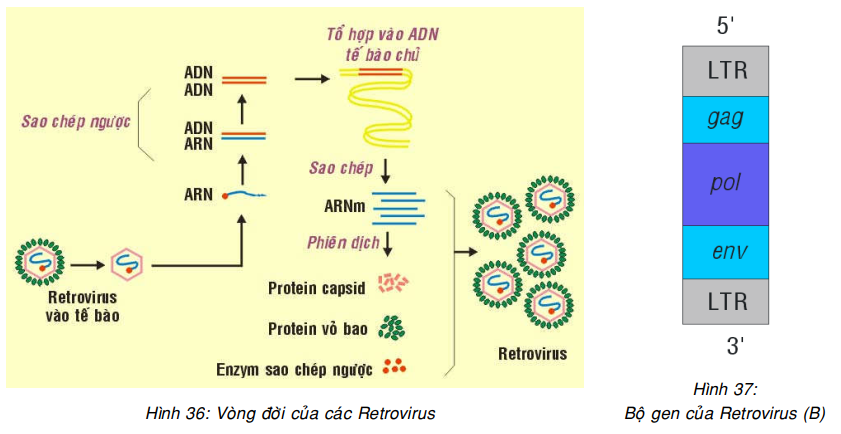
Tất cả các virút ARN sinh u đều thuộc về họ Retrovirus, nghĩa là chúng có chứa enzym sao chép ngược (reverse transcriptase), cho phép sao chép ARN của virút thành ADN (Hình 29A). Cấu tạo di truyền của Retrovirus là một mạch đơn ARN, có chứa các gen pol mã hóa cho enzym sao chép ngược, gen gag mã hóa cho protein capsid và gen env mã hóa cho protein vỏ bao; ngoài ra ở về phía hai đầu 3′ và 5′ còn có 2 đoạn LTR ( Long terminal repeats) dài khoảng 250-1200 nucleotid, chứa các yếu tố điều hòa cần thiết cho hoạt động của retrovirus như tổ hợp gen vào bộ gen tế bào chủ, tổng hợp protein. (Hình 36, 37)
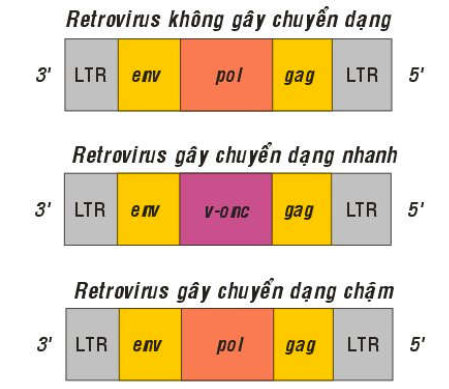
Tùy theo khả năng gây chuyển dạng các tế bào động vật nuôi cấy nhanh hay chậm (sau vài tuần hoặc vài tháng), virút ARN sinh u được phân thành 2 loại: (Hình 38)
Virút ARN sinh u gây chuyển dạng nhanh (Acute transforming oncogenic RNA virus):
Khả năng gây chuyển dạng nhanh của các virút này là do bộ gen của chúng có chứa các gen gây chuyển dạng, gọi là gen virút sinh u, hoặc oncogen-virút (viral oncogene), viết tắt là v-onc (Hình 31). Thí dụ: v-sis là oncogen của retrovirus gây sarcôm ở khỉ (simian sarcoma virus), v-fes là oncogen của retrovirus gây sarcôm ở loài mèo (feline sarcoma virus) . Cấu tạo của bộ gen các retrovirus này đều gồm có các gen env, v-onc, gag và 2 đoạn LTR ở 2 đầu. Những loại retrovirus không gây chuyển dạng thì không chứa các oncogen trong bộ gen của chúng.
Hình 38: Bộ gen của Retrovirus sinh u
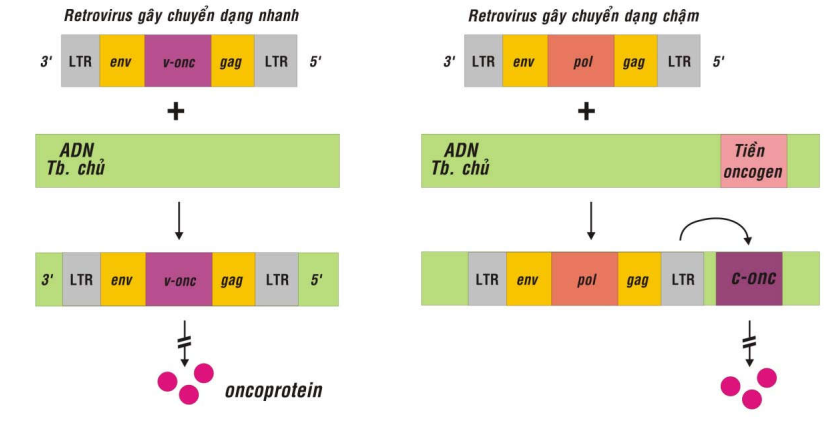
Các phân tử protein mã hóa bởi oncogen được tổng hợp, gọi là oncoprotein, có khả năng chuyển dạng tế bào nuôi cấy thành tế bào ung thư; vì vậy còn được gọi là yếu tố chuyển dạng (transforming factor) (Hình 39).
Hình 39: Cơ chế sinh u của 2 loại Retrovirus gây chuyển dạng
Bằng kỹ thuật lai ghép phân tử (molecular hybridization), người ta rất ngạc nhiên khi phát hiện trong ADN của tế bào người bình thường cũng có chứa các gen tương tự với oncogen virút; các gen này được gọi là tiền-oncogen (proto-oncogene); thí dụ tiền-oncogen tương tự v-sis được gọi là sis, được tìm thấy trên nhiễm sắc thể 22, tiền-oncogen tương tự v-fes là fes nằm trên nhiễm sắc thể 15.
Các tiền-oncogen cũng được tìm thấy ở hầu hết các loài sinh vật, từ sinh vật cấp thấp cho đến loài người. Sự bảo tồn các gen này trong suốt quá trình tiến hoá chứng tỏ các tiền-oncogen rất cần thiết cho sự tăng trưởng và biệt hoá của tế bào bình thường. Khi cấu trúc tiền-oncogen bị thay đổi hoặc khi sự biểu hiện của nó lệch lạc, tiền-oncogen được hoạt hoá thành oncogen-tế bào, viết tắt là c-onc (cellular oncogen), có thể gây rối loạn tăng sinh tế bào, dẫn đến sự hình thành u.
Dựa vào phát hiện trên, người ta cho rằng các retrovirus sinh u gây chuyển dạng nhanh khởi đầu có cấu tạo bộ gen giống các retrovirus không gây chuyển dạng khác, nghĩa là không có chứa các v-onc. Các v-onc này là kết quả của sự tái tổ hợp ngẫu nhiên giữa bộ gen của virút và ADN của tế bào chủ bình thường, nhờ đó các tiền-oncogen trong bộ gen của tế bào chủ được chuyển sang bộ gen của virút và biến thành các v-onc.
Virút ARN sinh u gây chuyển dạng chậm (Slow transforming oncogenic RNA virus):
Loại virút này không chứa các v-onc; sau khi xâm nhập vào tế bào nuôi cấy, toàn bộ bộ gen của virút được sao chép ngược thành ADN gọi là tiền virút (provirus) và được tổ hợp ngẫu nhiên vào bộ gen của tế bào chủ. Nếu tiền virút ngẫu nhiên được gắn kết gần với một tiền-oncogen thì dưới tác dụng của yếu tố điều hòa nằm trong chuỗi LTR của tiền virút, tiền-oncogen của tế bào chủ có thể bị hoạt hoá thành oncogen-tế bào, đưa đến sự chuyển dạng tế bào. Do tính chất ngẫu nhiên này mà phải mất vài tháng mới có tác động gây chuyển dạng.
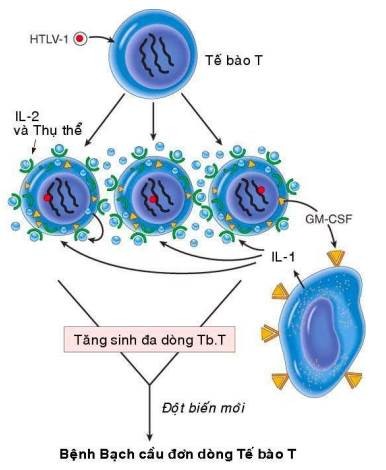
Mặc dù trên động vật thực nghiệm, đã phát hiện được nhiều loại retrovirus có khả năng sinh u; nhưng đối với người thì chỉ mới xác định được 1 loại retrovirus có khả năng gây ung thư là virút HTLV-1 (human T-cell leukemia virus type 1), gây ra bệnh bạch cầu tế bào T týp 1. Đây là bệnh thường gặp ở một số vùng của Nhật bản và vịnh Caribê. Virút HTLV-1 sau khi xâm nhập vào người sẽ tấn công và gây chuyển dạng các limphô bào T CD4+; 1% số người nhiễm virút sẽ phát bệnh bạch cầu đơn dòng tế bào T sau thời gian tiềm ẩn từ 20 – 30 năm.
Cấu trúc bộ gen của HTLV-1 cũng có chứa các gen gag, pol, env và LTR như các retrovirus khác, ngoài ra còn có thêm 1 gen tax ở đầu 3′. Cơ chế gây ung thư của HTLV-1 không giống với 2 loại virút ARN sinh u đã nói trên; bởi vì nó không chứa các v-onc và cũng không được tổ hợp ngẫu nhiên vào cạnh một tiền-oncogen nào của tế bào chủ. Khả năng gây ung thư của HTLV-1 là do hoạt động của gen tax: protein tax có khả năng hoạt hoá một số gen của tế bào chủ, thí dụ như gen mã hoá cho IL-2 và thụ thể tương ứng, gen mã hoá cho GM-CSF. Khi vào được cơ thể, virút HTLV-1 xâm nhập và kích thích sự tăng sinh nhiều dòng tế bào T theo kiểu tự tiết (qua sự sản xuất IL-2 và thụ thể tương ứng) hoặc cận tiết (qua sự sản xuất GM-CSF kích thích đại thực bào sản xuất IL-1). Sự tăng sinh đa dòng tế bào T tạo thuận lợi cho việc xảy ra các đột biến mới, làm xuất hiện 1 dòng tế bào T tăng sinh trội hơn, dẫn đến ung thư. (Hình 40)
Hình 40: Cơ chế gây ung thư của HTLV-1
Virút ADN sinh u:
Đến nay, chỉ có 3 loại virút ADN được xác định là có khả năng gây ung thư ở người. Khi xâm nhập vào tế bào, ADN của virút thường được tổ hợp bền vững với ADN của tế bào chủ; nhờ đó ta có thể phát hiện ra sự hiện diện của chúng bằng kỹ thuật lai ghép phân tử.
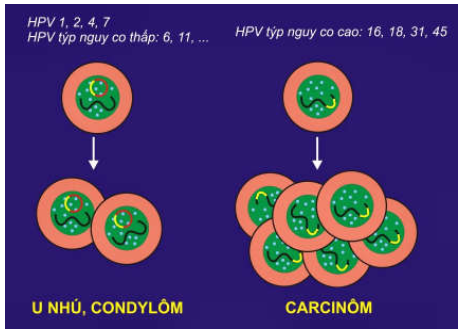
Các papillomavirus ở người (HPV):
Phân tích di truyền cho thấy có khoảng hơn 100 týp HPV khác nhau. HPV týp 1, 2, 4, 7 có khả năng gây u nhú da lành tính; các HPV týp 6, 11, 42, 44, 53, 54, 62, 66 ( gọi chung là HPV týp nguy cơ thấp) gây ra một loại u lành ở cổ tử cung gọi là condylôm; trái lại, HPV týp 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 (gọi chung là HPV týp nguy cơ cao) có thể gây ra ung thư cổ tử cung; người ta đã tìm thấy ADN của HPV týp nguy cơ cao trong 75 – 95% trường hợp ung thư cổ tử cung. (Hình 41)
Hình 41: Cơ chế sinh u của HPV
Sự khác biệt về khả năng sinh u giữa các HPV týp nguy cơ thấp và HPV týp nguy cơ cao là do phương cách hoạt động của virút trong tế bào chủ: ADN của týp nguy cơ thấp tồn tại dưới dạng ADN vòng (episome) và không được tổ hợp vào ADN tế bào chủ; trái lại, ADN của týp nguy cơ cao được tổ hợp ngẫu nhiên vào ADN tế bào chủ, dẫn đến sự tăng biểu hiện 2 gen E6 và E7 của virút. Protein E7 gây bất hoạt protein p53 và Rb của tế bào chủ, protein E6 thúc đẩy sự giáng hoá p53 và protein bax đồng thời tái hoạt hoá telomerase; kết quả là tế bào chủ bị thúc đẩy tăng sinh và bất tử hoá.
Tuy nhiên sự nhiễm HPV đơn thuần chưa đủ để gây ra ung thư mà phải cần thêm một số đột biến gen khác (chẳng hạn như đột biến tiền-oncogen ras), nay đã dễ xảy ra hơn do bộ gen tế bào chủ không còn ổn định như lúc chưa bị nhiễm virút.
Virút Epstein-Barr (EBV):
Là virút thuộc họ Herpes, được xem là nguyên nhân gây ra 2 loại ung thư là limphôm Burkitt và carcinôm không biệt hoá của vòm hầu.
Limphôm Burkitt hay gặp ở 1 số vùng của Châu Phi, người ta đã tìm thấy ADN của EBV trong tế bào ung thư của tất cả các bệnh nhân này. EBV có ái tính mạnh với các limphô bào B, sau khi xâm nhập sẽ kích thích limphô bào B tăng sinh. Trong cơ thể bình thường, sự tăng sinh limphô bào B được kiểm soát nhưng ở những bệnh nhân bị suy giảm miễn dịch (do mắc bệnh sốt rét hoặc nhiễm trùng), cơ chế kiểm soát không còn hiệu quả; các limphô bào B tiếp tục tăng sinh, tạo thuận lợi cho sự xảy ra các đột biến mới, làm xuất hiện 1 dòng limphô bào B tăng sinh trội hơn, dẫn đến limphôm Burkitt.
Carcinôm không biệt hoá của vòm hầu là ung thư thường gặp ở vùng Đông nam Á và Trung quốc, người ta đã tìm thấy ADN của EBV trong tế bào ung thư của tất cả các bệnh nhân mắc loại ung thư này. Tương tự như trong limphôm Burkitt, EBV có thể đã tương tác với 1 số yếu tố khác để gây ra carcinôm không biệt hoá của vòm hầu.
Virút viêm gan B (HBV):
Các nghiên cứu dịch tễ học cho thấy có mối liên hệ chặt chẽ giữa tình trạng nhiễm HBV mãn tính với ung thư gan. Cơ chế gây ung thư của HBV vẫn chưa được biết rõ mặc dù có sự tổ hợp giữa ADN của virút và ADN tế bào chủ. Cơ chế sinh u của HBV có lẽ thông qua khả năng gây tổn thương làm chết tế bào gan khiến các tế bào gan còn lại phải tăng sinh liên tục, tạo thuận lợi cho sự xuất hiện các đột biến mới dẫn đến ung thư.
Ngoài các virút trên. gần đây đã xác định được vai trò của vi khuẩn Helicobacter pylori (Hp) trong 2 loại ung thư dạ dày là carcinôm tuyến và limphôm tế bào B. Cơ chế gây ung thư của Hp có lẽ thông qua khả năng gây viêm dạ dày mãn tính; dẫn đến chuyển sản ruột , nghịch sản và cuối cùng là carcinôm tuyến. Sự tăng sinh đa dòng tế bào limphô B trong viêm dạ dày mãn tính tạo thuận lợi cho việc xảy ra các đột biến mới, làm xuất hiện 1 dòng tế bào B tăng sinh trội hơn, dẫn đến limphôm dạ dày.
Tóm lại, nghiên cứu về các virút sinh u đã giúp chúng ta phát hiện ra sự tồn tại của các tiền-oncogen ở người, mà đến nay đã biết hơn 100 loại khác nhau. Mặc dù đa số các loại ung thư ở người không phải do virút trực tiếp gây ra, nhưng chính sự hoạt hoá các tiền-oncogen cùng với sự bất hoạt nhiều loại gen khác nữa, đã gây ra chuyển dạng tế bào soma, dẫn đến sự hình thành các khối u như được thấy trong phần tiếp sau đây.
Cơ sở phân tử của quá trình sinh ung (carcinogenesis):
Mấu chốt của quá trình sinh ung là các đột biến gen không gây chết xảy ra trên 4 loại gen sau:
Tiền-oncogen (proto-oncogene)
Gen ức chế u (tumor suppressor gene)
Gen điều hoà sự tự hủy tế bào (apoptosis)
Gen sửa chữa ADN
Các đột biến gen không gây chết này xảy ra là do tác động của các yếu tố môi trường (virút, hoá học, bức xạ), do bố mẹ truyền cho (thí dụ gen gây u nguyên bào võng mạc) hoặc có tính tự phát.
Tiền-oncogen:
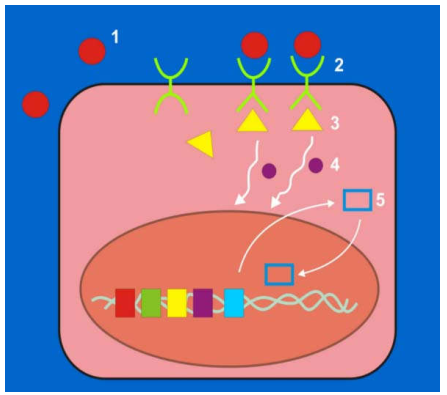
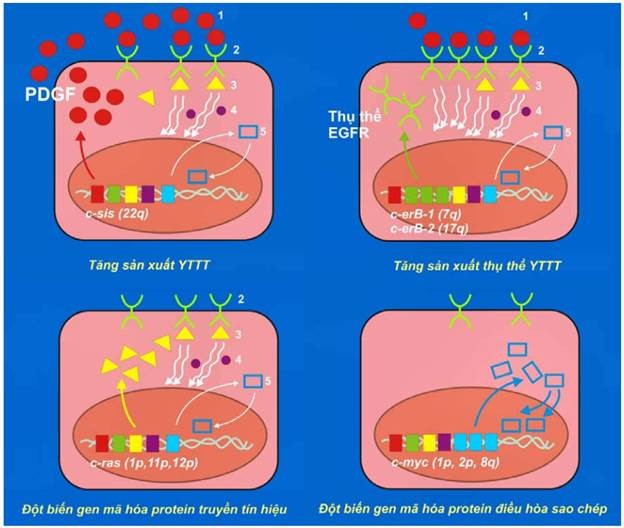
Trong điều kiện sinh lý bình thường, sự tăng sinh tế bào được kiểm soát rất chặt chẽ, một tế bào muốn hoạt động tăng sinh thì phải qua các bước sau (Hình 42):
Có yếu tố tăng trưởng đặc hiệu.
Gắn kết yếu tố tăng trưởng lên thụ thể tương ứng có trên bề mặt tế bào; sự gắn kết này phát ra tín hiệu tăng sinh cho tế bào.
Tín hiệu được chuyển từ màng tế bào vào trong nhân nhờ vào hoạt động của các protein truyền tín hiệu có trên màng tế bào và trong bào tương.
Gen mã hoá cho protein điều hoà sao chép được hoạt hoá, protein điều hoà sao chép được tổng hợp, đi vào trong nhân kích thích sự tổng hợp ADN làm tế bào phân chia.
Các tiền-oncogen giữ vai trò quan trọng đối với sự tăng sinh tế bào; bởi vì chúng mã hoá các protein cần thiết cho tất cả các bước trên như các yếu tố tăng trưởng, protein truyền tín hiệu, protein điều hoà sao chép trong nhân.
Hình 42: Các bước kiểm soat sự tăng sinh tế bào: Yếu tố tăng trưởng (1), thụ thể tương ứng (2), protein truyền tín hiệu ở mặt trong màng tế bào (3) và tự do trong bào tương (4), protein điều hòa sao chép (5)
Chính vì vậy, khi cấu trúc của tiền-oncogen bị thay đổi do các đột biến hoặc khi sự biểu hiện của nó bị rối loạn, tiền-oncogen được hoạt hoá thành oncogen-tế bào (c-onc), có khả năng kích thích tế bào chuyển dạng tăng sinh một cách quá mức và tự động, thoát khỏi mọi cơ chế kiểm soát bình thường trong cơ thể.
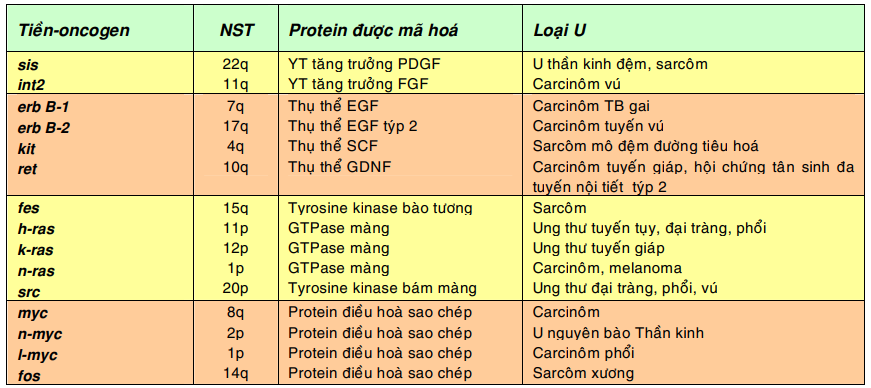
Bảng sau đây giới thiệu 1 số trong hơn 100 tiền-oncogen đã được biết cho đến nay và các loại u có thể xuất hiện khi các tiền-oncogen này được hoạt hóa thành oncogen- tế bào:
Chú thích: PDGF, yếu tố tăng trưởng xuất phát từ tiểu cầu (platelet derived growth factor); FGF, yếu tố tăng trưởng nguyên bào sợi (fibroblast growth factor); EGF, yếu tố tăng trưởng biểu bì (epidermal growth factor); SCF, yếu tố tế bào gốc (Stem cell factor); GDNF, yếu tố hướng thần kinh xuất phát từ dòng tế bào thần kinh đệm ( Glial cell line derived neutrotrophic factor)
Các oncogen được xem là những gen ung thư trội (dominant cancer gene) bởi vì chỉ cần một trong 2 tiền-oncogen alen với nhau bị hoạt hoá thành oncogen là đủ để có tác động sinh u. Thí dụ (hình 43):
Khi 1 trong 2 tiền-oncogen sis (simian sarcoma) bị hoạt hoá thành oncogen c-sis, sản phẩm bình thường của nó là yếu tố tăng trưởng PDGF sẽ được sản xuất quá mức, có khả năng kích thích tế bào tăng sinh tạo thành u; thí dụ như u sao bào, sarcôm xương.
Tiền-oncogen erb B-1 ( avian erythroblastosis) mã hoá cho protein thụ thể đối với yếu tố tăng trưởng biểu bì EGF (epidermal growth factor), khi bị hoạt hoá thành oncogen c-erb-1 sẽ khiến protein thụ thể này được sản xuất quá mức, kết quả tế bào tăng sinh mạnh dù chỉ có ít yếu tố tăng trưởng tác động. Ghi nhận có sự hoạt động của oncogen này trong 80% các trường hợp carcinôm tế bào gai ở phổi. Tương tự như vậy, khoảng 30% các trường hợp carcinôm tuyến vú di căn, có sự hoạt hoá tiền oncogen erb B-2 thành oncogen c-erb-2 (còn gọi là oncogen Her-2/neu).
Tiền-oncogen ras (rat sarcoma) mã hoá cho 1 protein truyền tín hiệu tăng sinh nằm ở mặt trong màng tế bào. Các đột biến điểm xảy ra trên tiền-oncogen ras sẽ biến nó thành oncogen c-ras có khả năng kích thích tế bào tăng sinh tạo thành u, dù không có yếu tố tăng trưởng tác động. Ghi nhận có sự hoạt động của oncogen này trong khoảng 30% các ung thư ở người.
Tiền-oncogen myc (myelocytomatosis), mã hoá cho 1 protein điều hoà sao chép trong nhân. Các chuyển đoạn nhiễm sắc thể, khuyếch đại gen có thể biến tiền-oncogen myc thành oncogen c-myc; kết quả protein điều hoà trên được sản xuất quá mức, kích thích tế bào tăng sinh tạo thành các ung thư như limphôm Burkitt, ung thư phổi loại tế bào nhỏ.
Hình 43: Sơ đồ hoạt hóa các tiền oncogen thành oncogen tế bào, tác động sinh u.
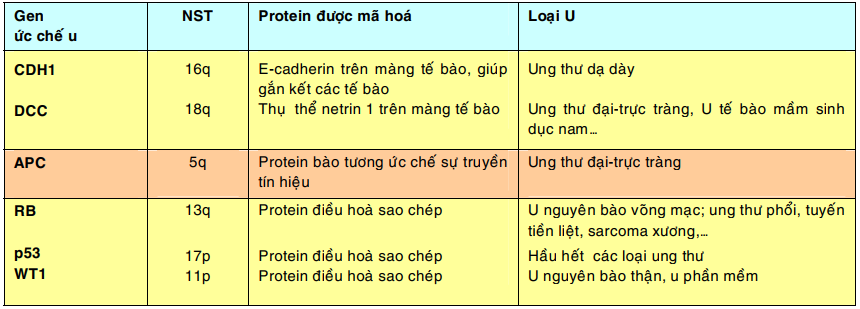
Gen ức chế u (tumor suppressor gene):
Các gen ức chế u giữ vai trò kìm hãm sự tăng sinh tế bào; chúng mã hoá cho các yếu tố ức chế tăng trưởng, các phân tử điều hoà sự kết dính giữa các tế bào, phân tử truyền tín hiệu ức chế và các phân tử điều hoà sao chép trong nhân. Các đột biến gây thiếu hụt hoặc bất hoạt các gen này có thể dẫn đến sự hình thành u do sự tăng sinh tế bào không còn bị kìm hãm nữa. Vì cả 2 gen ức chế u alen với nhau phải cùng bị thiếu hụt hoặc bất hoạt thì mới có tác động sinh u nên chúng còn được gọi là các gen ung thư lặn (recessive cancer gene).
Bảng sau đây giới thiệu 1 số trong hơn 30 gen ức chế u đã được biết cho đến nay:
Gen Rb: là gen ức chế u đầu tiên được phát hiện, nằm trên nhiễm sắc thể 13. Khi cả 2 gen Rb bị bất hoạt sẽ dẫn đến sự hình thành u nguyên bào võng mạc, một loại ung thư trẻ em hiếm gặp. Trong nhiều loại ung thư của người lớn như ung thư phổi, ung thư vú và ung thư ruột già, cũng thấy có sự bất hoạt cả 2 gen Rb.
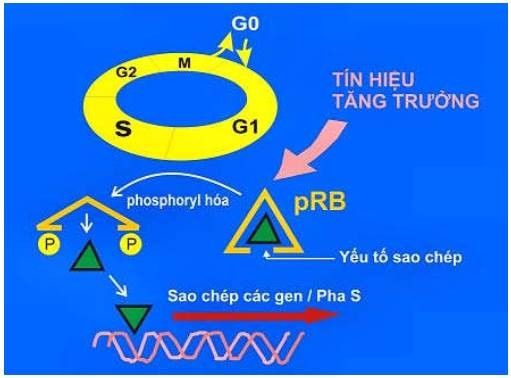
Gen Rb mã hoá cho protein Rb (pRb). Bình thường khi tế bào nghỉ ngơi ở giai đoạn G0 hoặc G1, pRb ở dạng không bị phosphoryl hoá, có khả năng ức chế các protein điều hoà sao chép làm cho sự tăng sinh của tế bào bị kìm hãm. Trái lại, khi tế bào nhận được tín hiệu tăng sinh, pRb được phosphoryl hoá sẽ không còn ức chế các protein điều hoà sao chép, các tế bào đi vào phân chia. Như vậy, khi cả 2 gen Rb bị thiếu hụt hoặc khi pRb bị bất hoạt, protein điều hoà sao chép không bị ức chế sẽ khiến tế bào tăng sinh tự do, dẫn đến sự hình thành u (Hình 44).
Hình 44: Cơ chế tác động của gen Rb
Ở đây cần giải thích vì sao u nguyên bào võng mạc-thể di truyền được xem là 1 ung thư di truyền trội nhiễm sắc thể thường trong khi đó gen Rb lại là gen ung thư lặn: Trong thể bệnh di truyền này, trẻ sinh ra đã nhận được 1 gen Rb bị bất hoạt từ bố hoặc mẹ, gen alen Rb còn lại vẫn bình thường nên tất cả các tế bào soma trong cơ thể trẻ đều ở tình trạng dị hợp tử về gen Rb lành. Các tế bào võng mạc của trẻ ban đầu vẫn bình thường vì chỉ cần có 1 gen Rb lành cũng đủ đảm bảo chức năng kìm hãm sự tăng sinh tế bào. Tuy nhiên, tình trạng dị hợp tử về gen Rb lành của tế bào võng mạc dễ bị mất đi do 1 đột biến mới làm bất hoạt gen Rb lành còn lại (Loss of heterozygosity), khiến sự tăng sinh của tế bào này không còn kiểm soát được, dẫn đến u nguyên bào võng mạc. Trái lại, trong u nguyên bào võng mạc – thể lẻ tẻ, trẻ sinh ra nhận đủ 2 gen Rb lành từ bố mẹ; vì thế để tạo được u thì phải có 1 tế bào võng mạc chịu 2 lần đột biến liên tiếp để bất hoạt cả 2 gen alen Rb (mô hình 2 cú đánh của Knudson); điều này ít khả năng xảy ra hơn so với chỉ 1 lần đột biến trong thể di truyền. Như vậy, gen Rb là 1 gen ung thư lặn, nhưng trong u nguyên bào võng mạc-thể di truyền thì “tình trạng dị hợp tử làm dễ bị u nguyên bào võng mạc” đã được truyền theo kiểu trội – nhiễm sắc thể thường. (Hình 45)
Hình 45 : Mô hình 2 cú đánh của Knudson trong cơ chế phát sinh u nguyên bào võng mạc
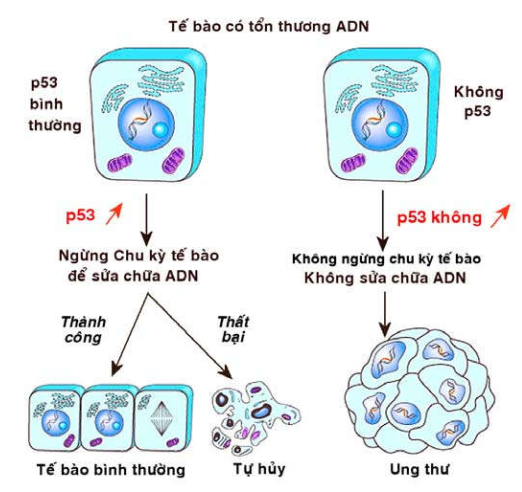
Gen p53: là một gen ức chế u khác nằm trên nhiễm sắc thể 17. Người ta ghi nhận có sự bất hoạt cả 2 gen alen p53 trong hầu hết các loại ung thư ở người.
Hình 46: Cơ chế tác động của gen p53
Khác với gen Rb, hoạt động kìm hãm của gen p53 chỉ xảy ra khi ADN của tế bào bị tổn thương (một cách tự phát hoặc do tác động của các yếu tố môi trường). Khi đó, hàm lượng protein p53 trong nhân tăng lên nhanh chóng, giúp tế bào ngừng lại ở giai đoạn G1 để có thời gian sửa chữa các tổn thương trên ADN. Nếu sửa chữa thành công, tế bào tiếp tục đi vào giai đoạn S và hoạt động tăng sinh bình thường; trường hợp thất bại, protein p53 sẽ làm tăng sản xuất protein Bax và Bak, đồng thời ức chế bcl-2; kết quả là tế bào bị thúc đẩy đi vào quá trình tự hủy. Như vậy, khi cả 2 gen p53 đều bị đột biến bất hoạt (do nhiễm HPV, EBV, HBV), các tế bào dù đang bị tổn thương ADN vẫn tiếp tục tăng sinh và có thể dẫn đến ung thư (Hình 46)
Gen sửa chữa adn:
Các tổn thương ADN vẫn thường xuyên xảy ra trong quá trình hoạt động của tế bào, một cách tự phát hoặc do tác động của các yếu tố môi trường. Tuy nhiên phần lớn các tổn thương này đều được sửa chữa kịp thời nhờ vào hoạt động của các gen sửa chữa ADN sẵn có như gen MSH2, MLH1, PMS1, PMS2 v.v… Do đó khi các gen này bị thiếu hụt hay bất hoạt thì sẽ làm tăng nguy cơ xuất hiện ung thư (Hình 47).
Thí dụ: Trong bệnh khô bì sắc tố, có sự khiếm khuyết về các gen sửa chữa ADN vì vậy các tổn thương ADN do bức xạ cực tím gây ra không được sửa chữa kịp thời, bệnh nhân dễ bị ung thư da hơn người bình thường.
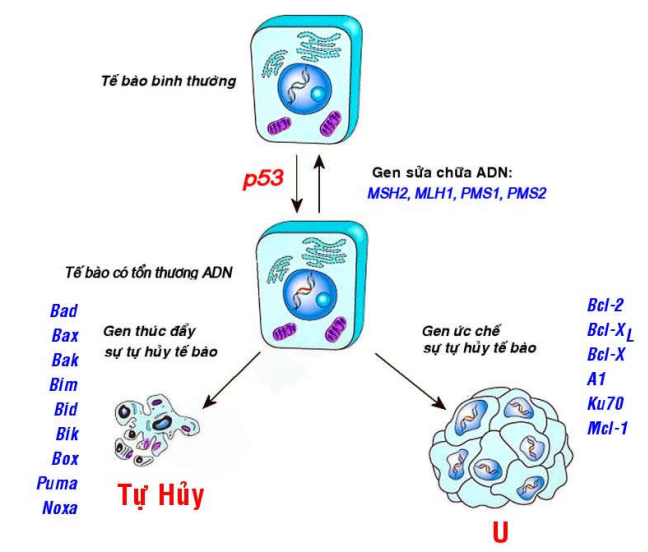
Các gen điều hoà sự tự hủy tế bào (apoptosis):
Gồm 2 nhóm gen có tác động trái ngược nhau:
Gen thúc đẩy sự tự hủy tế bào, thí dụ như các gen bad, bax, bak, bim, bid, bik, bok,…
Gen ức chế sự tự hủy tế bào, thí dụ gen Bcl-2, Bcl-XL, Bcl-X,…
Các đột biến gây thiếu hụt nhóm gen thứ nhất hoặc làm tăng biểu hiện của nhóm gen thứ hai sẽ khiến các tế bào dù có tổn thương ADN vẫn không tự hủy, tiếp tục sống sót và tăng sinh, dẫn đến sự hình thành ung thư (Hình 47).
Hình 47: Hoạt động của các gen sửa chữa ADN và các gen điều hòa sự tự hủy tế bào
Tóm lại, quá trình phát triển tự nhiên của ung thư gồm 4 bước nối tiếp nhau là chuyển dạng ác tính, tăng trưởng u, xâm nhập và di căn. Xét về mặt phân tử, diễn tiến tuần tự từng bước này tương ứng với sự tích lũy các đột biến (xuất hiện tự phát hoặc do tác động của môi trường) làm hoạt hoá các tiền-oncogen, bất hoạt các gen ức chế u, gen điều hòa sự tự hủy tế bào và gen sửa chữa ADN. Trong sự hình thành mỗi loại ung thư ở người, ước lượng phải có từ 3 đến 7 đột biến như vậy.
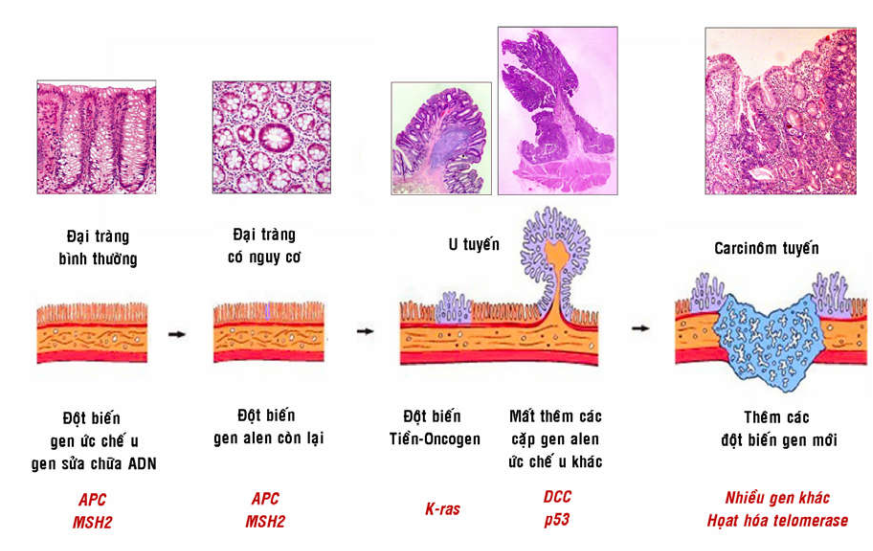
Thí dụ trong carcinôm tuyến đại tràng; người ta cho rằng tổn thương bắt đầu bằng sự chuyển dạng và tăng sinh tế bào biểu mô tuyến tạo thành 1 u tuyến lành tính; u tuyến này lớn dần và sau cùng hoá ác, xâm nhập tại chỗ qua các lớp thành ruột và cho di căn. Diễn tiến này tương ứng với sự bất hoạt trước tiên các gen ức chế u APC và gen sửa chữa ADN MSH2, tiếp theo là sự hoạt hoá tiền-oncogen ras, rồi đến các đột biến làm thiếu hụt các gen ức chế u khác như DCC, p53 và thêm nhiều gen khác nữa (Hình 48).
Hình 48: Sự tích lũy đột biến trong quá trình hình thành carcinôm tuyến đại tràng.
Liên hệ lâm sàng:
Tác động của u trên cơ thể:
Mọi khối u đều là những vật ký sinh trên cơ thể, có thể gây ra những tác động từ nhẹ đến nặng, tùy vào vị trí xuất hiện và tính chất lành hoặc ác của chúng.
Tại chỗ:
Sự phát triển của khối u sẽ chèn ép và cản trở hoạt động của các mô – cơ quan lân cận, vì vậy có thể gây nguy hiểm nếu u xuất hiện ở những vị trí quan trọng, cho dù đó là 1 u lành tính.
Thí dụ:
Một u tuyến yên lành tính có kích thước nhỏ, đường kính 1 cm, vẫn có thể chèn ép phá hủy mô tuyến bình thường xung quanh, dẫn đến tình trạng suy tuyến yên. Các u não, dù lành hoặc ác đều nguy hiểm tính mạng do khả năng làm tăng áp lực nội sọ, chèn ép lên các cấu trúc quan trọng của hệ thần kinh trung ương.
U thành ruột, dù lành tính, vẫn có thể dẫn đến lồng ruột và tắc ruột.
Các u lành có tính di động, như u nang buồng trứng, polýp đại tràng; có thể bị xoắn lại gây xuất huyết, hoại tử.
Toàn thân:
Tác động nội tiết: xảy ra đối với những u xuất phát từ tuyến nội tiết, thí dụ:
U vỏ thượng thận, lành hoặc ác, có thể gây ra hội chứng Cushing do tế bào u sản xuất quá nhiều corticosteroid.
U tế bào bêta tuyến tụy có thể gây hạ đường huyết do sản xuất quá nhiều insulin.
Suy mòn: là tình trạng biến mất dần khối cơ – mỡ trong cơ thể, hay gặp ở các bệnh nhân ung thư. Tình trạng suy mòn đuợc giải thích là do sự thay đổi về vị giác, mất cảm giác thèm ăn hoặc do tác động của một số cytokin lưu hành trong máu.
Hội chứng cận ung thư (Paraneoplastic syndrome):
Là các phức hợp triệu chứng xảy ra ở các bệnh nhân ung thư ( khoảng 10% số bệnh nhân ung thư) mà không thể giải thích được bằng sự xâm nhập tại chỗ hoặc di căn xa của khối u, hoặc bằng hoạt động sản xuất các hormôn vốn có ở mô nguyên ủy của khối u.
Các hội chứng cận ung thư thường gặp là hội chứng Cushing, sự tăng canxi máu, huyết khối tĩnh mạch. Các loại ung thư thường có hội chứng cận ung thư là ung thư phổi, ung thư vú và ung thư hệ tạo huyết. Thí dụ:
Trong ung thư phổi loại tế bào nhỏ, có thể gặp hội chứng Cushing và tăng canxi máu do tế bào u có khả năng sản xuất ra ACTH và các péptid tương tự hormôn tuyến cận giáp.
Hạ đường huyết có thể gặp ở bệnh nhân bị sarcôm sợi, u mô đệm đường tiêu hóa; do tế bào u sản xuất được insulin hoặc chất tương tự insulin.
Huyết tắc tĩnh mạch có thể gặp ở ung thư phổi, ung thư tuyến tụy, do tế bào u sản xuất các chất hoạt hoá hệ thống đông máu.
Xếp giai đoạn ung thư (staging of cancer):
Nhằm đánh giá mức độ lan tràn của ung thư, làm cơ sở cho việc xác định phác đồ điều trị hợp lý, đánh giá tiên lượng, so sánh hiệu quả của các phương pháp điều trị khác nhau hoặc giữa các cơ sở điều trị. Để xếp giai đoạn, người ta dựa vào kích thước của khối u nguyên phát, mức độ xâm nhập vào mô xung quanh, mức độ di căn vào các hạch bạch huyết và di căn xa.
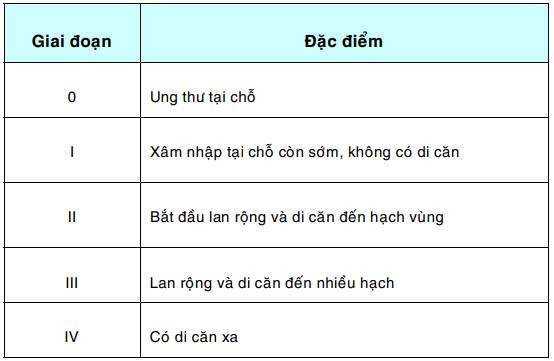
Thí dụ : Ung thư cổ tử cung được xếp thành 5 giai đoạn như sau:
Nếu ung thư cổ tử cung được phát hiện sớm ở giai đoạn 0 thì khả năng chữa khỏi bằng phương pháp điều trị tại chỗ đơn giản như khoét chóp là 100%; trái lại khi đã ở vào giai đoạn IV thì coi như không còn khả năng chữa khỏi, dù với bất kỳ phương pháp điều trị nào.
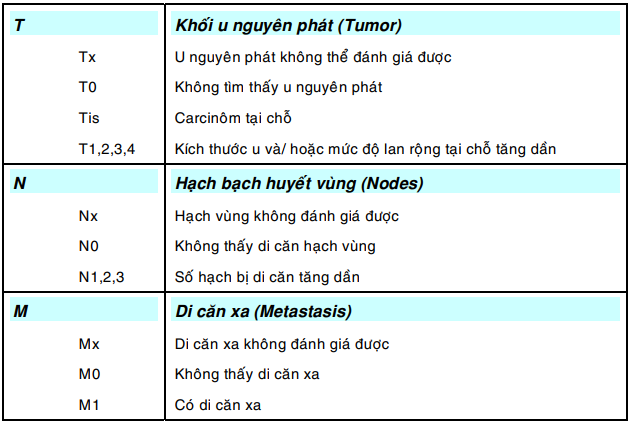
Để việc xếp giai đoạn ung thư mang tính khách quan, Hiệp hội quốc tế chống ung thư (UICC) đã đưa ra hệ thống xếp hạng TNM ( Tumor, Nodes, Metastasis) mà từ nhiều năm nay đã được áp dụng rộng rãi tại các cơ sở điều trị. Sau đây là các định nghĩa được dùng trong hệ thống này:
Các chất đánh dấu u (tumor marker):
Là các sản phẩm của tế bào u được phóng thích vào trong tuần hoàn. Định lượng huyết thanh các chất này có thể trợ giúp công tác chẩn đoán và theo dõi điều trị một số bệnh ung thư. Thí dụ:
Alpha fetoprotein (AFP) là 1 protein phôi được tìm thấy trong gan, túi noãn hoàng và ống tiêu hoá của phôi thai. AFP tăng cao trong các ung thư gan, ung thư tế bào mầm của tinh hoàn và buồng trứng
Kháng nguyên carcinôm phôi CEA (carcinoembryonic antigen) là 1 glycoprotein do gan, tuyến tụy và ống tiêu hoá của phôi thai sản xuất. CEA có thể tăng cao trong ung thư vú, buồng trứng, đại tràng, ung thư phổi loại tế bào nhỏ.
HCG (human chorionic gonadotropin) là 1 glycoprotein do hợp bào nuôi sản xuất, tăng cao trong các u tế bào nuôi
Calcitonin là 1 hormôn được sản xuất bởi tế bào C của tuyến giáp, tăng cao trong các ung thư tuyến giáp dạng tủy
Kháng nguyên đặc hiệu tuyến tiền liệt PSA ( Prostate specific antigen) là 1 protease do biểu mô tuyến tiền liệt sản xuất, tăng cao trong ung thư tuyến tiền liệt.
Phosphatase acid tuyến tiền liệt – PAP (prostatic acid phosphatase) tăng cao ở những bệnh nhân bị ung thư di căn tuyến tiền liệt.
Lactate dehydrogenase (LDH) tăng cao ở những bệnh nhân bệnh bạch cầu, u hắc tố, các limphôm.
Enolase đặc hiệu nơron NSE ( Neuron specific enolase) là 1 glycoprotein có nguồn gốc thần kinh, tăng cao trong các u thần kinh nội tiết, u nguyên bào thần kinh.
Kháng nguyên ung thư CA (cancer antigen) là các glycoprotein không thấy ở tế bào bình thường nên rất có giá trị trong tầm soát ung thư. Có nhiều loại CA khác nhau: CA 15-3, tăng cao trong ung thư vú; CA 19-9, tăng cao trong ung thư tuyến tụy; CA 72-4, tăng cao trong ung thư vú và buồng trứng; CA-125, tăng cao trong ung thư buồng trứng.
Tầm soát ung thư:
Khả năng chữa khỏi một ung thư tùy thuộc rất lớn vào việc phát hiện sớm khi nó còn trong thời kỳ tiền lâm sàng. Sự hiểu biết rõ hơn về bản chất của mỗi loại ung thư cùng với kết quả điều tra dịch tễ học cho phép xác định các nhóm nguy cơ cao để từ đó tìm ra những biện pháp tầm soát thích hợp. Sau đây là chế độ tầm soát một số loại ung thư thường gặp do Hiệp hội ung thư Hoa kỳ ACS (American Cancer Society) đề nghị: