Cơ sở và mục đích: Bệnh nhân bị chấn thương não mắc phải và rối loạn ý thức cấp tính hoặc kéo dài (DoC) là những thách thức. Bằng chứng để hỗ trợ các quyết định chẩn đoán về hôn mê và DoC khác bị hạn chế nhưng có sự tích lũy. Hướng dẫn này cung cấp bằng chứng tiên tiến về chẩn đoán DoC, tóm tắt dữ liệu từ các kỹ thuật thăm khám tại giường, thần kinh chức năng và điện não đồ (EEG).
Phương pháp: Mười sáu thành viên Hội đồng khoa học của Viện Hàn lâm Thần kinh học (EAN) về hôn mê và rối loạn mãn tính của ý thức, đại diện cho 10 quốc gia châu Âu, đã xem xét các bằng chứng khoa học để đánh giá hôn mê và DoC khác bằng các biện pháp thư mục tiêu chuẩn. Các khuyến nghị tuân theo hệ thống Đánh giá, Phát triển và Đánh giá (GRADE). Hướng dẫn đã được chứng thực bởi EAN
Kết quả: Bên cạnh thăm khám thần kinh toàn diện, các gợi ý sau đây được đưa ra: thăm dò chuyển động mắt tự nguyện bằng gương; lặp lại các đánh giá lâm sàng trong môi trường bán cấp và mạn tính, sử dụng thang hồi phục Coma – Sửa đổi (The Coma Recovery Scale-Revied); sử dụng Toàn bộ số điểm không phản hồi (Full Outline of Unresponsiveness score) thay vì Thang điểm hôn mê của Glasgow trong bệnh cảnh cấp tính; đạt được điện não đồ chuẩn; tìm kiếm các kiểu sóng ngủ trên điện não đồ, đặc biệt là giấc ngủ chuyển động mắt nhanh và giấc ngủ sóng chậm; và, bất cứ khi nào khả thi, hãy xem xét chụp cắt lớp phát xạ positron, chụp ảnh cộng hưởng từ chức năng trạng thái nghỉ (fMRI), mô hình fMRI hoặc EEG hoạt động và phân tích định lượng EEG mật độ cao để bổ sung đánh giá hành vi ở bệnh nhân không có y lệnh tại giường bệnh.
Kết luận: Đánh giá lâm sàng được chuẩn, các kỹ thuật dựa trên EEG và hình ảnh thần kinh chức năng nên được tích hợp để đánh giá đa phương thức của bệnh nhân mắc DoC. Trạng thái của thức tỉnh nên được phân loại theo mức cao nhất được tiết lộ bởi bất kỳ phương pháp nào trong ba phương pháp này.
Từ khóa: điện não đồ, điện thế gợi lên, hình ảnh cộng hưởng từ chức năng, trạng thái thức tỉnh tối thiểu, chụp cắt lớp phát xạ positron (PET), fMRI trạng thái nghỉ, kích thích từ xuyên sọ, chấn thương sọ não, hội chứng thức giấc không đáp ứng, trạng thái thực vật
Giới thiệu
Phát hiện thức tỉnh ở bệnh nhân không đáp ứng bằng phương pháp thăm khám lâm sàng là một thách thức vì bệnh nhân phải tỉnh táo, họ phải có động lực tự nguyện để huy động chức năng vận động, và sau đó phải được bảo tồn ở mức độ có thể đo lường được. Hơn nữa, tất cả các yêu cầu này cần được đáp ứng tại thời điểm kiểm tra [1-4].
Vấn đề phức tạp hơn nữa, nguồn gốc của nhiều dấu hiệu và hành vi lâm sàng ở bệnh nhân rối loạn thức tỉnh (DoC) không hoàn toàn rõ ràng và tầm quan trọng của chúng là liệu bệnh nhân có thức tỉnh hay không thậm chí còn ít chắc chắn hơn [2,5,6]. Hơn nữa, thức tỉnh có thể cùn mòn và suy yếu dần, cả trong ngắn hạn (vài giây đến vài giờ) và dài hạn hơn (ngày). Ví dụ, mặc dù theo dõi trực quan cho thấy trạng thái thức tỉnh tối thiểu (MCS-minimally conscious state) [7], sự hiện diện của nó có thể dao động một cách tự nhiên trong ngày [3], và nó chỉ có thể được gợi ra bởi một số kích thích nổi bật nhất định (ví dụ như khuôn mặt của bệnh nhân được phản chiếu trong gương ) hoặc trong các tình huống cụ thể (ví dụ: khi sự hiện diện của người thân có thể tăng cường kích thích) [4,8-14]. Mặc dù có biến động hàng ngày, thức tỉnh thường cải thiện qua nhiều tháng và đôi khi thậm chí nhiều năm sau chấn thương não [3,15-18]. Do đó, không có gì đáng ngạc nhiên khi có tới 40% bệnh nhân không giao tiếp với DoC có thể được phân loại sai là ở trạng thái thực vật /hội chứng thức giấc không phản ứng (VS/UWS – the vegetative state/unresponsive wakefulness syndrome ) [5,6,19,20]. Điều này có ý nghĩa đạo đức và thực tiễn lớn đối với bệnh nhân và người chăm sóc họ, bao gồm tiên lượng, điều trị, phân bổ nguồn lực và quyết định cuối đời [21-30].
Kiến thức hạn chế về DoC góp phần vào tình huống khó xử này. Hội chứng khóa trong cổ điển, trong đó các cử động mắt được bảo tồn một phần cho phép giao tiếp ở những bệnh nhân còn nguyên vẹn nhưng bị tê liệt, được các nhà thần kinh học biết đến [31]. Tuy nhiên, người ta ít nhận ra rằng các bệnh nhân khác có thể không thể tương tác với thế giới bên ngoài vì bị liệt hoàn toàn vận động hoặc suy giảm ngôn ngữ, mặc dù có thức tỉnh. Tình trạng bí mật này được ghi nhận lần đầu tiên vào năm 2006 trong một bài viết mang tính bước ngoặt của Owen et al. [32]. Ở đây, các tác giả đã chỉ ra rằng một nạn nhân tai nạn giao thông trẻ tuổi, đáp ứng các tiêu chí lâm sàng của VS/UWS, chỉ có thể tuân theo các mệnh lệnh bằng cách điều chỉnh hoạt động trao đổi chất não của cô ấy khi được đo bằng hình ảnh cộng hưởng từ chức năng (fMRI) [32].
Do đó, các mô hình phát hiện ý thức bằng phương pháp chụp cắt lớp phát xạ positron (PET), fMRI và điện não đồ (EEG) đã được phát triển trong hai thập kỷ qua để bổ sung cho đánh giá lâm sàng của DoC (đối với các đánh giá gần đây, xem các tài liệu tham khảo [1,33,34]). Chúng bao gồm các mô hình hoạt động trong đó bệnh nhân được yêu cầu thực hiện các nhiệm vụ nhận thức khác nhau [20,35-39]; mô hình thụ động dựa vào đánh giá kết nối chức năng để đáp ứng với các kích thích bên ngoài [40]; và đánh giá hoạt động não tự phát trong thời gian nghỉ ngơi [20,41-45]. Một số nghiên cứu mô hình hoạt động đã chỉ ra rằng, mặc dù bệnh nhân bị chấn thương sọ não nghiêm trọng có thể không tiết lộ bất kỳ dấu hiệu thức tỉnh nào ở đầu giường, một số người trong số họ có thể điều chỉnh hoạt động não theo lệnh, thậm chí thỉnh thoảng trả lời có/không có câu hỏi bằng cách thực hiện nhiệm vụ hình ảnh tinh thần [36]. Thật vậy, khoảng 15% bệnh nhân VS/UWS có hành vi có thể tuân theo các mệnh lệnh bằng cách điều chỉnh hoạt động não của họ trong mô hình ý thức hoạt động dựa trên EEG và/hoặc fMRI, cho thấy rằng họ có khả năng nhận thức bí mật [1].
Mặc dù vẫn còn nhiều thách thức, đặc biệt liên quan đến các định nghĩa chẩn đoán về DoC và độ nhạy và độ đặc hiệu của mô hình ý thức [1,46], những dữ liệu này đã mở đường cho sự hiểu biết tốt hơn về DoC. Theo đó, các khái niệm mới đã xuất hiện thách thức thiết lập thực hành thần kinh, bao gồm phân ly vận động nhận thức (tức là lệnh theo fMRI và EEG mặc dù không phản ứng ở tại giường [47]) và phân ly vận động vỏ não bậc cao (ví dụ fMRI và EEG của vỏ não hoạt động để kích thích thụ động ở những bệnh nhân đáp ứng thấp trên lâm sàng hoặc không đáp ứng [48]).
Tóm lại, đánh giá đa phương thức sử dụng PET, fMRI và EEG cùng với thang đo hành vi lâm sàng được tiêu chuẩn hóa cung cấp đánh giá mạnh mẽ hơn về ý thức và chức năng vỏ não bậc cao so với thăm khám đầu giường thông thường, nhưng kiến thức này chưa được triển khai rộng rãi trong thực hành lâm sàng. Do đó, một hướng dẫn toàn diện của Châu Âu để chẩn đoán hôn mê và DoC khác dựa trên dữ liệu khoa học và lâm sàng tốt nhất hiện có là cần thiết.
Phương pháp
Vấn đề
Mục đích là cung cấp cho cộng đồng thần kinh châu Âu các khuyến nghị dựa trên bằng chứng tốt nhất có liên quan đến chẩn đoán và phân loại hôn mê và DoC khác, bao gồm các kỹ thuật khám lâm sàng và điều tra trong phòng thăm dò dựa trên thần kinh chức năng (PET, fMRI) và EEG [bao gồm cả từ tính xuyên sọ kích thích (TMS) và điện thế gợi lên].
Định nghĩa
Thuật ngữ DoC bao gồm các bệnh nhân hôn mê, VS / UWS và MCS. Hôn mê có thể được định nghĩa là một trạng thái không nhận thức sâu sắc mà từ đó bệnh nhân không thể được thức. Điều quan trọng là, mắt vẫn nhắm và không có chu kỳ thức – ngủ bình thường. Điều này thường chỉ kéo dài một vài ngày hoặc vài tuần sau chấn thương não cấp tính [49]. Thuật ngữ VS/UWS biểu thị tình trạng tỉnh táo mà không có (dấu hiệu lâm sàng) nhận thức [19]. Những bệnh nhân như vậy có thể mở mắt nhưng chỉ thể hiện các hành vi phản xạ (tức là không chủ ý) và do đó được coi là không nhận thức được bản thân và môi trường xung quanh. Ngược lại, bệnh nhân trong MCS cho thấy các dấu hiệu không rõ ràng về hành vi qua trung gian vỏ não không phản xạ [50], xảy ra không nhất quán, nhưng có thể tái tạo, để đáp ứng với các kích thích môi trường [7]. Mặc dù một số bệnh nhân MCS có thể tuân theo các mệnh lệnh ở một mức độ nhất định, giao tiếp chức năng là không thể. Sự khác biệt giữa VS/UWS và MCS có lẽ là dần dần (liên tục) chứ không phải nhị phân (tất cả hoặc là không) [51], và một số người sống sót với VS/UWS có thể hồi phục MCS hoặc tốt hơn, thậm chí nhiều năm sau chấn thương não [3, 15 -18]. Tính không đồng nhất của MCS hiện được công nhận và do đó, bệnh nhân có thể được phân loại theo mức độ phản ứng hành vi của họ với MCS cộng (nghĩa là nếu họ có thể tuân theo các lệnh, tạo ra các từ dễ hiểu và/hoặc hiển thị giao tiếp có chủ ý) hoặc trừ (ví dụ: nếu họ chỉ thể hiện các dấu hiệu tự nguyện của ý thức như nội tại hóa đến đau đớn hoặc theo đuổi trực quan nhưng không có hành vi gợi ý xử lý ngôn ngữ) [52]. Bệnh nhân phục hồi giao tiếp chức năng hoặc sử dụng đối tượng chức năng được coi là “xuất hiện từ MCS”[7].
Rối loạn thức tỉnh phải được phân biệt với các điều kiện bắt chước không phản ứng nhưng trong đó ý thức là nguyên vẹn. Như đã nêu trước đó, trong hội chứng khóa trong, một bệnh nhân hoàn toàn nhận thức được và, mặc dù bị đau và liệt nửa người, vẫn có thể giao tiếp bằng cử động mắt được bảo tồn một phần [31]. Điều quan trọng, những bệnh nhân không tuân theo mệnh lệnh ở đầu giường nhưng có thể tuân theo mệnh lệnh bằng cách điều chỉnh hoạt động não của họ trong các mô hình ý thức hoạt động của fMRI và EEG dựa trên trạng thái phân ly vận động nhận thức [47]. Tình trạng này còn được gọi là MCS không hành vi, MCS*, hội chứng khóa trong chức năng hoặc thức tỉnh bí mật [16,20,53-55].
Phương pháp học
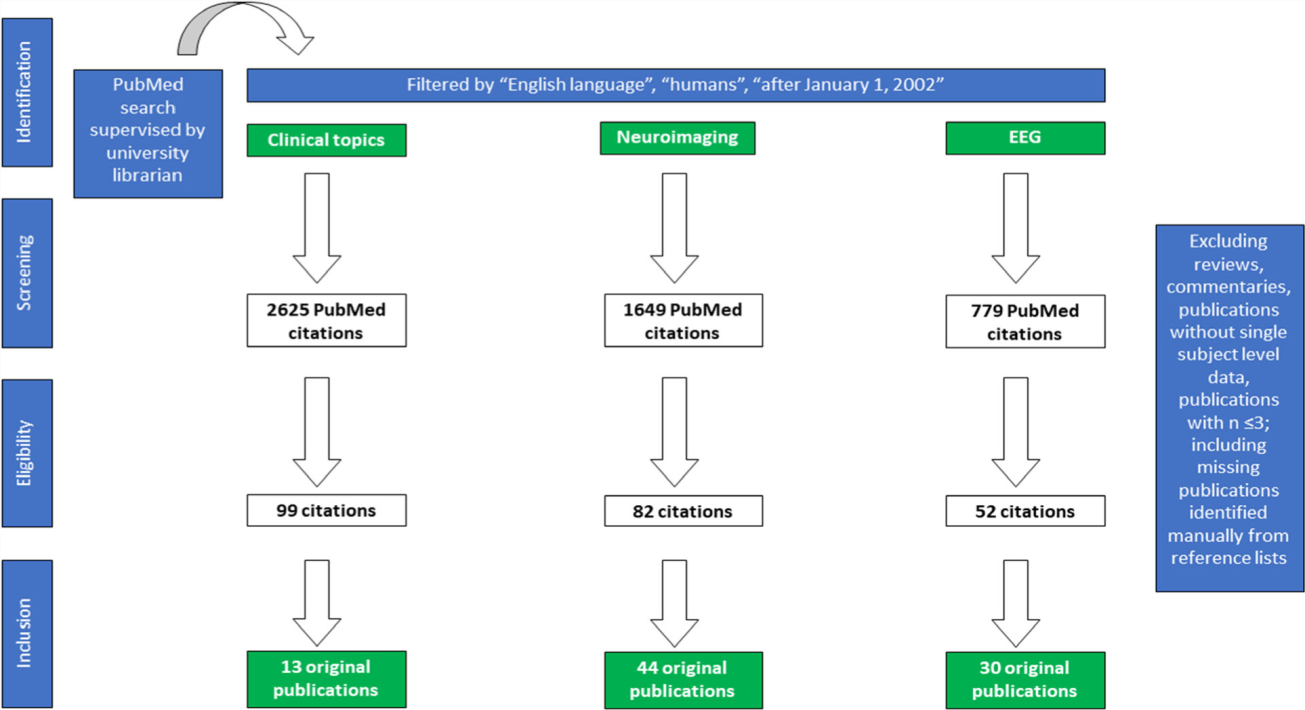
Tổng quan về thời gian của quy trình hình thành hướng dẫn được nêu trong Bảng 1. Thông tin chi tiết về quy trình phương pháp, bao gồm khởi xướng và tổ chức ủy ban các chuyên gia, định nghĩa các chủ đề liên quan và câu hỏi nghiên cứu, nghiên cứu tài liệu, trích xuất và phân tích dữ liệu, phân loại bằng chứng khoa học, tổng hợp các khuyến nghị và viết bài báo, có thể được tìm thấy trong protocol hướng dẫn (Thông tin hỗ trợ; Tệp bổ sung S5). Một phác thảo của tìm kiếm tài liệu được cung cấp trong hình 1.
Hướng dẫn này đã được thực hiện theo các khuyến nghị thiết thực cho quá trình đề xuất, lập kế hoạch và viết một hướng dẫn quản lý thần kinh của ủy ban các chuyên gia của Viện Hàn lâm Thần kinh học Châu Âu (EAN) [56]. Tóm lại, 16 thành viên của Hội đồng khoa học EAN về hôn mê và rối loạn nhận thức mãn tính của 10 quốc gia châu Âu (Hình S1; Tập tin bổ sung S4) đã hợp tác để xác định các câu hỏi nghiên cứu lâm sàng và khoa học có liên quan, sử dụng cách tiếp cận Bệnh nhân, Can thiệp, So sánh, Kết quả (PICO – Patient, Intervention, Comparator, Outcome ) [57]. Các câu hỏi được nhóm thành ba chủ đề: thăm khám lâm sàng, hình ảnh thần kinh chức năng và kỹ thuật dựa trên EEG (bao gồm các điện thế gợi lên và TMS). Xem lại sau đó để định nghĩa các điều kiện mục tiêu. Do thiếu tiêu chuẩn vàng [1], đánh giá lâm sàng đầu giường cho các dấu hiệu thức tỉnh, sử dụng thang đo chuẩn (đáng chú ý là Thang hồi phục Coma – Sửa đổi (CRSR) [58], được coi là tiêu chuẩn tham khảo. Ngày 1 tháng 1 năm 2002 đến ngày 31 tháng 12 năm 2018 đối với các tài liệu liên quan theo các phương pháp tiêu chuẩn trên PubMed. Tháng 1 năm 2002 được chọn vì đây là năm mà thuật ngữ ‘trạng thái thức tỉnh tối thiểu’ được giới thiệu trong tài liệu y khoa [7]. Dữ liệu được trích xuất, tổng hợp, phân tích và giải thích bằng cách sử dụng hệ thống Đánh giá, Phát triển và Đánh giá (GRADE) Phân loại Khuyến nghị (59). Xem thông tin trong protocol chi tiết. (Tệp bổ sung S5). Chất lượng bằng chứng được xếp loại cao, trung bình, thấp hoặc rất thấp; các khuyến nghị được phân loại là mạnh hoặc yếu và được chấp thuận bởi tất cả các thành viên trong ủy ban các chuyên gia [59]. Các bảng dự phòng (Tệp bổ sung S1), bảng phân loại bằng chứng (Tệp bổ sung S2) và các bảng khuyến nghị (Tệp bổ sung S3) được cung cấp trực tuyến (Thông tin hỗ trợ). Dự án 2 năm này được tài trợ, giám sát và chứng thực bởi EAN.
Các kết quả
Thăm khám lâm sàng
Câu hỏi PICO 1 – 3 đề cập đến các dấu hiệu lâm sàng, câu hỏi PICO 4 – 8 để đánh giá thang điểm lâm sàng. Mười ba bài báo được đưa vào để phân tích cuối cùng [4-6,9,11,20,58,60-65].
PICO 1 Có nên mở mí mắt của bệnh nhân để chẩn đoán cử động mắt tự nguyện ở bệnh nhân mắc DoC mà không mở mắt tự phát?
Không có nghiên cứu đủ điều kiện được tìm thấy.
Khuyến cáo thực hành tốt: Mặc dù thiếu các nghiên cứu đủ điều kiện, để đánh giá các dấu hiệu chuyển động mắt tự nguyện, điều quan trọng là phải mở mắt một cách thụ động mà không cần mở mắt tự phát hoặc kích thích (bằng chứng rất thấp, khuyến nghị mạnh mẽ). Đó là kinh nghiệm của các thành viên trong ủy ban mà lời khuyên đơn giản này bị quên đi sẽ là một trong những lý do tại sao một hội chứng bị khóa trong có thể bị bỏ qua. Trước khi đánh giá các dấu hiệu thức tỉnh, bệnh nhân cần được đánh thức đúng cách. Người khám phải nhớ thăm dò cả chuyển động mắt dọc và ngang, vì bệnh nhân mắc hội chứng khóa trong cổ điển chỉ bảo tồn cử động mắt dọc [31,66]. Nếu bệnh nhân không hiển thị chuyển động mắt theo lệnh, người khám nên thăm dò để theo dõi trực quan (tức là sử dụng gương; xem PICO 2). Mở mí mắt cho phép hội chứng khóa trong, MCS và bệnh nhân có thức tỉnh với cử động mí mắt bị suy yếu (ví dụ ptosis) được chẩn đoán [67]. Chống lại việc mở mắt thụ động có thể là một dấu hiệu của thức tỉnh được bảo tồn[68].
PICO 2 Có nên sử dụng gương để chẩn đoán theo đuổi trực quan ở bệnh nhân mắc DoC?
Ba nghiên cứu đã đủ điều kiện để đưa vào [9,11,64]. Một nghiên cứu đã bị loại do chồng chéo bệnh nhân hoàn toàn [11], kết quả là hai nghiên cứu với tổng số 272 bệnh nhân. Nguy cơ tương đối cho việc theo đuổi trực quan được phát hiện bằng gương so với các kích thích khác (ví dụ: hình ảnh khuôn mặt) là 1,47 [khoảng tin cậy 95% (CI) 1,29 – 1,66; P
Khuyến cáo: Cho rằng gương là một công cụ tại giường tiện lợi, nên luôn luôn sử dụng nó ở bệnh nhân DoC để chẩn đoán theo đuổi trực quan (bằng chứng thấp, khuyến nghị mạnh mẽ). Khi kiểm tra theo đuổi trực quan, cần phải loại trừ mù vỏ não, tổn thương cấu trúc thần kinh thị giác và liệt trung tâm hoặc ngoại biên [69]. Đánh giá lại thường xuyên rất quan trọng vì mức độ thức tỉnh có thể dao động nhanh chóng [3]. Nếu gương không gợi lên phản hồi, có thể sử dụng các kích thích khác như hình ảnh cho thấy mặt bệnh nhân hoặc người thân hoặc vật thể cá nhân.
Figure 1 Overview of the literature search (January 2002 to December 2018); see Methods and the guideline protocol (Supporting information) for details. [Colour figure can be viewed at wileyonlinelibrary.com]
PICO 3 Có nên quan sát hành vi vận động tự phát để chẩn đoán các dấu hiệu thức tỉnh ở bệnh nhân mắc DoC?
Không có nghiên cứu đủ điều kiện.
Khuyến cáo thực hành tốt: Mặc dù không có các nghiên cứu đủ điều kiện, hành vi vận động tự phát và phản ứng vận động tự động có thể được quan sát và ghi lại trong biểu đồ bệnh nhân, bao gồm kéo ống, gãi mũi, lấy tấm, bắt chéo chân và hành vi định vị, vì những điều này có thể phản ánh cao hơn mức độ thức tỉnh còn lại [70] (bằng chứng rất thấp, khuyến nghị yếu). Thật vậy, một số hành vi tự phát đã được đề xuất như chỉ ra các khả năng qua trung gian vỏ não như phản ứng vận động tự động ( bao gồm trong CRS-R [58]) hoặc kích động tâm lý [71]. Quan sát các hành vi vận động tự phát (có thể có hoặc không cố ý) có thể giúp chẩn đoán sự thức tỉnh “giấu giếm”, ví dụ: sử dụng các phương pháp phân tích như “Công cụ hành vi động cơ đã sửa đổi – Motor Behavior Tool”[70,72] hoặc phương pháp tiếp cận chủ quan dựa trên những người chăm sóc, chẳng hạn như ‘DoC cảm thấy hồi phục [28]. Người thăm khám nên chú ý đến các yếu tố gây nhiễu như liệt dây thần kinh sọ, nguyên nhân trung ương và ngoại biên của liệt tứ chi, co cứng nghiêm trọng, hypokinesia – giảm động và bradykinesia- giảm động, và hypertonus- tăng trương lực hoặc hypotonus-giảm trương lực [69].
PICO 4 Có nên sử dụng CRS-R để chẩn đoán mức độ thức tỉnh ở bệnh nhân mắc DoC?
Tám nghiên cứu được thực hiện ở các trung tâm và quốc gia khác nhau, bao gồm cả 925 bệnh nhân đã được đưa vào nghiên cứu [5,6,20,58,60,61,65,73]. Khả năng để phát hiện bằng chứng về thức tỉnh với CRS-R so với các phương pháp đánh giá hành vi khác, bao gồm thăm khám đầu giường thần kinh không cấu trúc, là 1,45 (95% CI 1,32, – 1,60; P
Khuyến nghị: Vì CRS-R có sẵn miễn phí, nên sử dụng CRS-R để phân loại mức độ thức tỉnh (bằng chứng vừa phải, khuyến nghị mạnh mẽ). Khuyến cáo này bao gồm cả bệnh nhân DoC bán cấp trong phòng chăm sóc đặc biệt (ICU), với điều kiện thuốc an thần đã được dừng lại (hoặc giảm càng nhiều càng tốt), và bệnh nhân mãn tính tại các cơ sở phục hồi chức năng và chăm sóc dài hạn. Nhóm các chuyên gia hướng dẫn thừa nhận rằng CRS-R có thể đặt ra những thách thức về hậu cần, tốn nhiều thời gian (15 – 60 phút) và đòi hỏi nhân viên có kinh nghiệm. Các phương pháp đánh giá khác có thể được sử dụng khi thời gian bị hạn chế để theo dõi bệnh nhân thường xuyên, lưu ý giảm độ nhạy của chúng để phát hiện MCS (xem PICO 6). Người thăm khám phải ghi nhận điểm số phụ CRS-R hoặc sử dụng điểm số đã sửa đổi [76] để chẩn đoán, vì tổng số điểm bị giới hạn để phân biệt VS/UWS với MCS [76,77]. Các yếu tố gây nhiễu như suy giảm vận động, thị giác, thính giác và/hoặc nhận thức (ví dụ: ngôn ngữ, trí nhớ, tính linh hoạt, sự chú ý) [78], đặt nội khí quản, an thần và hoàn cảnh (ví dụ như sự hiện diện hoặc vắng mặt của người thân) [13,14] cần phải được xem xét đến [69]. Một nghiên cứu cho thấy rằng sự hiện diện của các thành viên trong gia đình có thể làm tăng cơ hội phát hiện các phản ứng thị giác [13].
PICO 5 Có nên lặp lại đánh giá hành vi về mức độ thức tỉnh (và, nếu vậy, tần suất) để chẩn đoán mức độ thức tỉnh ở bệnh nhân mắc DoC?
Một nghiên cứu với 123 bệnh nhân đã giải quyết câu hỏi này [4]. Khả năng cho bằng chứng về thức tỉnh với các đánh giá lặp đi lặp lại so với các đánh giá đơn lẻ là 1,36 (KTC 95% 1,101,69; P = 0,005). Năm đánh giá trong vài ngày (ví dụ trong vòng 10 ngày) có vẻ phù hợp để đánh giá mức độ thích hợp ở bệnh nhân mắc DoC kéo dài (chẩn đoán sai 36% với một đánh giá duy nhất so với 5% với năm đánh giá) [4]. Không có dữ liệu có sẵn cho bệnh nhân trong giai đoạn cấp tính. Mặc dù sự biến đổi ban ngày hiếm khi được nghiên cứu một cách có hệ thống [2], nhưng đáp ứng không nhất quán của bệnh nhân DoC được biết đến và là một phần của tiêu chí chẩn đoán cho MCS [2,3,7].
Khuyến nghị: Không bao giờ nên phân loại mức độ thức tỉnh dựa trên đánh giá riêng biệt (bằng chứng thấp, khuyến nghị mạnh mẽ).
PICO 6 Có nên sử dụng Điểm số hoàn toàn không phản hồi (FOURFull Outline of Unresponsiveness) để chẩn đoán mức độ thức tỉnh ở bệnh nhân mắc DoC trong ICU?
Ba nghiên cứu đã so sánh FOUR [67] với Thang đo hôn mê của Glasgow (GCS) [79] để phân loại bệnh nhân DoC trong ICU (n = 313) [6163]. Khả năng tương đối cho bằng chứng về ý thức được FOUR phát hiện so với GCS là 1,46 (95% CI 1,04 Lần2,05; P = 0,03).
Khuyến nghị: Hội đồng chuyên gia khuyến nghị sử dụng điểm FOUR để đánh giá mức độ thức tỉnh ở bệnh nhân mắc DoC trong ICU thay vì GCS (bằng chứng vừa phải, khuyến nghị mạnh mẽ). Mặc dù ít nhạy hơn CRSR, nhưng điểm FOUR thuận tiện hơn cho việc đánh giá thường xuyên bởi các bác sĩ lâm sàng và nhân viên điều dưỡng trong ICU, nơi thời gian thường bị giới hạn và bệnh nhân được đặt nội khí quản [61,63]. Trái ngược với GCS, FOUR bao gồm đánh giá chuyển động của mắt, giúp giảm chẩn đoán sai về hội chứng khóa trong và MCS [67] và cho phép phân biệt chính xác hơn giữa bệnh nhân hôn mê và hồi phục [61 – 63].
PICO 7 Có nên sử dụng thang điểm Nociception Coma Scale – Revised (NCS-R) để chẩn đoán các dấu hiệu khó chịu hoặc gây đau ở bệnh nhân mắc DoC?
Không có nghiên cứu đủ điều kiện nào được tìm thấy (tức là các nghiên cứu so sánh NCS-R với các thang đo khác về số lượng bệnh nhân được phát hiện bị đau), mặc dù một số nghiên cứu từ các trung tâm và quốc gia khác nhau chỉ ra rằng thang đo có thể phù hợp để phát hiện các dấu hiệu của tình trạng có khả năng đau ở DoC [80 – 87].
Khuyến cáo thực hành tốt: Có ý kiến cho rằng NCS-R được xem xét để theo dõi thường xuyên các dấu hiệu khó chịu (bằng chứng rất thấp, khuyến nghị yếu). Bác sĩ và nhân viên điều dưỡng nên sàng lọc các dấu hiệu khó chịu cả trong khi thao tác / chăm sóc hàng ngày và khi nghỉ ngơi [84,88]. Tuy nhiên, cần lưu ý rằng NCS-R phụ thuộc nhiều vào khả năng vận động, chức năng cảm giác được bảo tồn và liệu bệnh nhân có được đặt nội khí quản hay không [86].
PICO 8 Có nên sử dụng Phương pháp đánh giá nhầm lẫn cho ICU (CAM-ICU; Confusion Assessment Method for the ICU) để chẩn đoán mê sảng ở bệnh nhân DoC trong ICU?
Không có nghiên cứu đủ điều kiện về CAM-ICU ở bệnh nhân DoC có sẵn. CAM-ICU dường như không phù hợp để chẩn đoán mê sảng ở bệnh nhân hôn mê, bệnh nhân VS/UWS và MCS vì những bệnh nhân này sẽ tự động được dán nhãn là mê sảng, có thể dẫn đến điều trị không phù hợp. Thang đo mê sảng như CAM-ICU [89], Intensive Care Delirium Screening Checklist [90] hoặc Giao thức đánh giá nhầm lẫn [91] có thể hữu ích để chẩn đoán và theo dõi mê sảng ở bệnh nhân có ý thức và giao tiếp (xuất hiện từ MCS; có thể là MCS + với giao tiếp có chủ ý). Tuy nhiên, ở những bệnh nhân bị tổn thương não nghiêm trọng, dữ liệu về các công cụ sàng lọc mê sảng rất thưa thớt [92] và có khả năng bị nhầm lẫn bởi thuốc an thần, suy giảm nhận thức và thức tỉnh .
Khuyến cáo thực hành tốt: Không nên sử dụng CAM-ICU ở bệnh nhân DoC trong ICU (bằng chứng rất thấp, khuyến nghị yếu). Thay vào đó, khuyến cáo rằng những bệnh nhân bị chấn thương não nghiêm trọng được phân loại có lợi là mê sảng từ một cuộc kiểm tra thần kinh chi tiết hơn bao gồm CRS-R. Điều quan trọng, người ta nên nhận thức được sự đơn giản hóa có thể (ví dụ: phân loại tất cả các bệnh nhân là có thức tỉnh, mê sảng hoặc hôn mê).
Hình ảnh thần kinh chức năng
Các câu hỏi PICO 1 – 3 đề cập đến trạng thái nghỉ PET và fMRI, các câu hỏi PICO 4 – 6 cho các mô hình fMRI thụ động và chủ động. Bốn mươi bốn bài báo được đưa vào để phân tích cuối cùng [20,36,40-42,48,54,93 128].
PICO 1 Có nên sử dụng PET trạng thái nghỉ để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân mắc DoC?
Năm ấn phẩm với tổng số 341 bệnh nhân được đưa vào [20,41,54,93,94]. Khả năng tương đối để phát hiện hoạt động vỏ não nội tại trong MCS so với hôn mê hoặc VS/UWS là 3,14 (KTC 95% 2,40 Lần4,12; P
Khuyến cáo: PET fluorodeoxyglucose trạng thái nghỉ ngơi (FDG) PET có thể được coi là một phần của đánh giá đa phương thức ở những bệnh nhân không đáp ứng (bằng chứng thấp, khuyến nghị yếu). Bằng chứng hiện tại cho thấy rằng PET trạng thái nghỉ có độ nhạy và độ đặc hiệu cao cho sự khác biệt giữa VS/UWS và MCS [20,41,54,93,94]. Cần phải đảm bảo các tiêu chuẩn kỹ thuật cao, loại trừ các yếu tố gây nhiễu (ví dụ: tiểu đường, động kinh) và đảm bảo đủ kích thích của bệnh nhân trong khi tiêm chất đánh dấu.
PICO 2 Có nên sử dụng fMRI trạng thái nghỉ để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân mắc DoC?
Sáu ấn phẩm được xác định với 218 bệnh nhân để phân tích cuối cùng [42,95 – 99]. Khả năng tương đối để phát hiện hoạt động vỏ não nội tại với fMRI trạng thái nghỉ trong MCS so với hôn mê hoặc VS/ UWS là 2,45 (KTC 95% 1,81 – 3,33; P
Khuyến cáo: Nếu chỉ định MRI lâm sàng (cấu trúc) tiêu chuẩn, có ý kiến cho rằng trình tự fMRI trạng thái nghỉ được thêm vào như một phần của đánh giá đa phương thức (bằng chứng thấp, khuyến nghị yếu). Trạng thái nghỉ ngơi fMRI cũng có thể cung cấp thông tin có giá trị ở bệnh nhân an thần nhưng thuốc an thần và chuyển động tạo tác có thể gây nhiễu kết quả [129].
PICO 3 Có nên sử dụng mạng chế độ mặc định để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân DoC?
Sáu bài báo bao gồm 236 bệnh nhân đã đánh giá mạng chế độ mặc định [42,95 – 97,99,100]. Khả năng tương đối để phát hiện hoạt động nội tại trong MCS so với hôn mê hoặc VS/UWS là 2,28 (KTC 95% 1,70 – 3,07; P
Khuyến nghị: Như đã nêu trong PICO 2, nên thêm một chuỗi fMRI trạng thái nghỉ như một phần của đánh giá đa phương thức bất cứ khi nào chỉ định MRI (cấu trúc) tiêu chuẩn; tuy nhiên, mạng lưới chế độ mặc định chỉ là một trong một số mạng lưới fMRI trạng thái nghỉ có thể được sử dụng để bổ sung cho đánh giá hành vi ở bệnh nhân mắc DoC (bằng chứng thấp, khuyến nghị yếu).
PICO 4 Có nên sử dụng mô hình fMRI thụ động để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân mắc DoC?
Mười sáu nghiên cứu đã được xác định với 313 bệnh nhân được kiểm tra bằng cách sử dụng mô hình fMRI thụ động [40,48,100 – 113]. Khả năng tương đối để phát hiện kết nối được bảo tồn trong MCS so với hôn mê hoặc VS / UWS là 1,69 (KTC 95% 1,38 – 2,07; P = 0,0001).
Khuyến nghị nghiên cứu: Do ảnh hưởng nhỏ và tính không đồng nhất của các mô hình được sử dụng, chỉ đề xuất rằng các mô hình fMRI thụ động được sử dụng trong các đề cương nghiên cứu (bằng chứng thấp, khuyến nghị yếu).
PICO 5 Có nên sử dụng mô hình fMRI hoạt động để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân mắc DoC?
Hai mươi ấn phẩm bao gồm 343 bệnh nhân được phân tích [20,35,36,48,101,112,114 – 27]. Khả năng tương đối cho lệnh làm theo trong MCS so với hôn mê hoặc VS / UWS là 1,60 (KTC 95% 1,16 – 2,20; P = 0,0037).
Khuyến cáo: Có ý kiến cho rằng các mô hình fMRI hoạt động nên được coi là một phần của đánh giá đa phương thức ở bệnh nhân không làm theo y lệnh tại giường (bằng chứng vừa phải, khuyến nghị yếu). Các mô hình fMRI hoạt động cho phép xác định một nhóm bệnh nhân cụ thể và quan trọng có thể tuân theo các mệnh lệnh mặc dù có vẻ hoàn toàn không phản ứng ở đầu giường (tức là phân ly vận động nhận thức). Coi chừng rằng thuốc an thần và suy giảm nhận thức như rối loạn ngôn ngữ có thể gây nhiễu kết quả, và – quan trọng – sự vắng mặt của mệnh lệnh không phải là bằng chứng của sự thiếu thức tỉnh. Theo sau các mô hình fMRI hoạt động có độ đặc hiệu cao nhưng độ nhạy rất thấp để phát hiện thức tỉnh bí mật.
PICO 6 Có nên sử dụng các kích thích nổi bật và / hoặc các hoạt động quen thuộc để chẩn đoán các dấu hiệu thức tỉnh bí mật ở bệnh nhân mắc DoC được kiểm tra bởi fMRI?
Chín nghiên cứu với 167 bệnh nhân được thu nhận [40,48,103,109 – 113,116]. Khả năng tương đối đối với hoạt động nội tại hoặc mệnh lệnh được bảo tồn trong MCS sau các kích thích nổi bật so với hôn mê hoặc VS / UWS là 1,69 (KTC 95% 1,23 – 2,32; P
Khuyến cáo: Do đó, nên sử dụng các kích thích nổi bật để kiểm tra bệnh nhân DoC bằng fMRI (bằng chứng rất thấp, khuyến nghị yếu).
Các kỹ thuật dựa trên eeg, bao gồm tms-eeg và điện thế gợi lên
Các câu hỏi về PICO 1 – 3 đề cập đến tiêu chuẩn lâm sàng (trạng thái nghỉ) EEG, các câu hỏi PICO 4 – 6 về các mô thức ý thức, bao gồm EEG mật độ cao, TMS-EEG và các điện thế gợi lên. Ba mươi ấn phẩm được đưa vào để phân tích cuối cùng [37 – 39,41,43,54,119,127,130 – 151].
PICO 1 Phân tích trực quan về EEG tiêu chuẩn lâm sàng có thể phân biệt hôn mê và VS / UWS với MCS không?
Hai nghiên cứu với 117 bệnh nhân phù hợp để đưa vào phân tích [119,130]. Phân tích EEG trực quan bao gồm, trong số những thứ khác, tổ chức nền, phản ứng với các kích thích và sự hiện diện của các yếu tố của kiến trúc giấc ngủ. Khả năng tương đối cho các dấu hiệu của thức tỉnh “giấu giếm” gợi ý MCS hoặc tốt hơn với EEG tiêu chuẩn so với khám lâm sàng là 11,25 (KTC 95% 2,85 – 44,46; P = 0,0006). Đáng lưu ý, tỷ lệ khả năng này là cao nhất trong tất cả các câu hỏi PICO của chúng tôi.
Khuyến cáo: Phân tích trực quan về EEG tiêu chuẩn lâm sàng dường như phát hiện bệnh nhân có thức tỉnh bảo tồn với độ đặc hiệu cao nhưng độ nhạy thấp [119,130] (bằng chứng thấp, khuyến nghị mạnh mẽ). EEG tiêu chuẩn bổ sung cho đánh giá hành vi và hình ảnh thần kinh của DoC. Nó là rất quan trọng để loại trừ động kinh với tình trạng không co giật. Cần nhấn mạnh vào phân tích hoạt động nền EEG và phản ứng EEG với các kích thích bên ngoài. Một nhịp alpha phản ứng sau khi tỉnh táo có lẽ loại trừ VS/UWS và có liên quan đến kết cuộc thuận lợi [152]. Điện não đồ phẳng đủ tiêu chuẩn kỹ thuật ở bệnh nhân chưa được điều trị không tương thích với thức tỉnh được bảo tồn.
PICO 2 Phân tích không trực quan (tức là bằng số) của EEG tiêu chuẩn lâm sàng (
Không có nghiên cứu đủ điều kiện. Phân tích định lượng EEG tiêu chuẩn cho đến nay vẫn chưa được nghiên cứu đầy đủ.
Khuyến cáo nghiên cứu: Không thể khuyến nghị phân tích EEG tiêu chuẩn (trực quan bằng số) cho phân biệt giữa VS/UWS và MCS (bằng chứng rất thấp, khuyến nghị yếu). Tuy nhiên, một nghiên cứu gần đây sử dụng các kỹ thuật máy đã chỉ ra rằng hiệu suất chẩn đoán tương tự có thể đạt được khi giảm số lượng cảm biến EEG từ mật độ cao (256 điện cực) xuống mật độ thấp (16 điện cực) [45].
PICO 3 Liệu EEG ngủ, trái ngược với khám lâm sàng, có giúp phân biệt hôn mê và VS / UWS với MCS không?
Sáu nghiên cứu với 153 bệnh nhân được thu nhận [119,131 – 134,153]. Khả năng tương đối cho các dấu hiệu thức tỉnh bí mật gợi ý MCS hoặc tốt hơn với EEG khi ngủ so với khám lâm sàng là 1,55 (KTC 95% 1,24 – 1,94; P = 0,0001).
Khuyến nghị: Nên sử dụng EEG khi ngủ để phân biệt giữa VS/UWS và MCS như một phần của đánh giá đa phương thức (bằng chứng thấp, khuyến nghị yếu). Sự hiện diện của giấc ngủ chậm [giấc ngủ không chuyển động nhãn cầu nhanh (REM) giai đoạn 3; Khả năng tương đối 5,90 (KTC 95% 2,32 – 15,01)] hoặc giấc ngủ REM [khả năng tương đối 4,34 (KTC 95% 2,11 – 8,90)] có thể chính xác hơn cho sự khác biệt giữa VS/UWS và MCS so với trục chính giấc ngủ [khả năng tương đối 1,78 (95 % CI 1.33 – 2,39)]. Phân tích dữ liệu điện não đồ giấc ngủ bằng phương pháp kỹ thuật học máy có thể mang lại độ chính xác chẩn đoán bổ sung [154].
PICO 4 EEG mật độ cao (ví dụ: ≥ 32 điện cực) với các kỹ thuật tính toán, so với khám lâm sàng, phân biệt hôn mê và VS / UWS với MCS?
Sáu nghiên cứu phù hợp đã được tìm thấy với tổng số 337 bệnh nhân [38,41,43,127,134,135]. Khả năng tương đối cho các dấu hiệu của thức tỉnh giấu giếm gợi ý MCS hoặc tốt hơn với EEG mật độ cao so với khám lâm sàng là 2,21 (KTC 95% 1,72 – 2,82; P
Khuyến nghị: Có ý kiến cho rằng phân tích định lượng EEG mật độ cao được xem xét để phân biệt giữa VS / UWS và MCS như một phần của đánh giá đa phương thức (bằng chứng trung bình, khuyến nghị yếu). EEG mật độ cao có khả năng đóng vai trò quan trọng hơn trong tương lai để phân biệt giữa VS/UWS và MCS. Kỹ thuật máy học và các thuật toán tương tự để phân tích có vẻ đầy hứa hẹn [155,156]. Các mô hình hoạt động với EEG mật độ cao (và EEG mật độ thấp [38,48]) cho phép xác định một nhóm bệnh nhân cụ thể và quan trọng có thể tuân theo mệnh lệnh mặc dù xuất hiện hoàn toàn không phản ứng ở đầu giường (nghĩa là phân ly vận động nhận thức). Các mô hình EEG mật độ cao dường như có độ đặc hiệu cao nhưng độ nhạy rất thấp để phát hiện thức tỉnh bí mật. Tuy nhiên, phân tích thống kê là một thách thức và bằng chứng về tính hợp lệ là rất quan trọng [157,158]. Đối với nghiên cứu trong tương lai về EEG mật độ cao, nên cải tiến mô hình ý thức và kỹ thuật phân tích, bao gồm tối ưu hóa phân tích thống kê, thay vì tối đa hóa số lượng điện cực EEG.
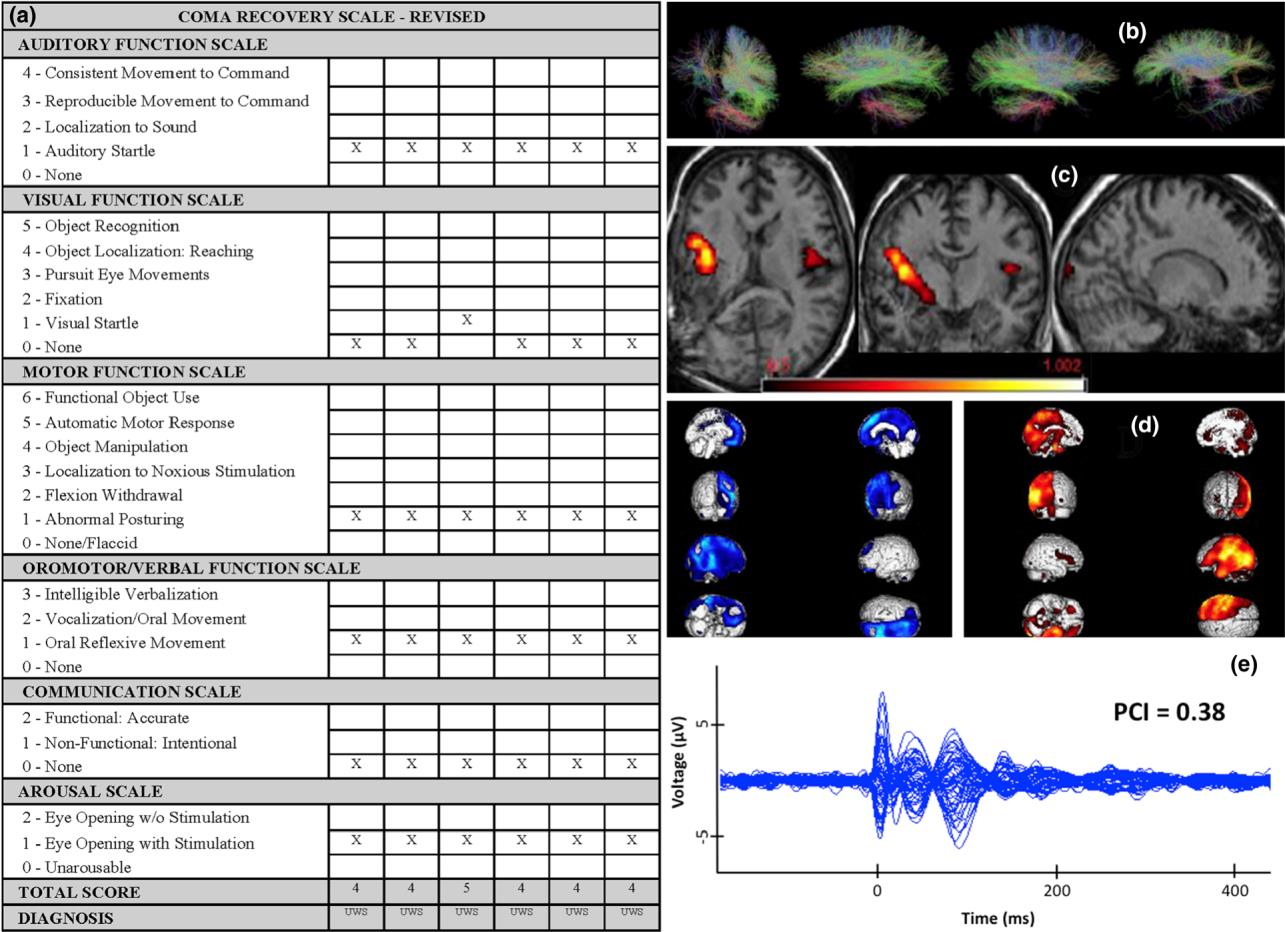
Hình 2 Ví dụ trường hợp: một phụ nữ 27 tuổi có tiền sử động kinh khu trú được nhập viện vì đau đầu, nhầm lẫn và mất thức tỉnh nhanh do xuất huyết nội sọ do dị dạng động tĩnh mạch đỉnh phải. Sau khi hút lấy khối máu tụ, phẫu thuật cắt bỏ sọ não phải giải nén và quản lý chăm sóc tích cực kéo dài, bao gồm phẫu thuật mở khí quản, đặt bơm baclofen vào trong, mở dạ dày ra da và đặt shunt não thất – màng bụng, cô vẫn không đáp ứng và thích hợp cho đánh giá sự thức tỉnh đa phương thức 13 tuần sau đó. Các xét nghiệm thần kinh lặp đi lặp lại (n = 6) là đáng chú ý khi mở mắt tự phát với phản xạ chớp mắt được bảo tồn đối với mối đe dọa thị giác nhưng không có sự cố định hoặc theo đuổi thị giác, không có các chuyển động tự phát khác ngoài run cơ ở chi dưới bên phải, giật mình thính giác, duỗi xoay rập khuôn và nhăn nhó theo sau kích thích đau, và phản xạ miệng được bảo tồn. Điểm CRS-R của cô phù hợp với VS/UWS (a). MRI cấu trúc cho thấy teo vỏ não phải và tổn thương do thiếu máu cục bộ ở cuống não trái và mesencephalon (có lẽ là do hiệu ứng khối bên phải với thoát vị của cuống não trái chống lại lều, Kernohan’s notch). Hình ảnh kéo căng khuếch tán cho thấy giảm bất đẳng hướng phân đoạn, phù hợp với tổn thương sợi trục và giảm cường độ sợi ở bán cầu não phải (b). Khi fMRI trạng thái nghỉ, mạng thính giác được bảo tồn tương đối (c). PET cho thấy sự giảm chuyển hóa (màu xanh) liên quan đến bán cầu não phải, bao gồm cả đồi thị, cũng như vùng trước trán bên trái, trong khi sự trao đổi chất dường như được bảo tồn (màu đỏ) trong não, tiểu não và các phần lớn của bán cầu não trái, bao gồm cả đồi não trái (d). EEG tiêu chuẩn lâm sàng cho thấy nền bán cầu phải chậm lại trong phạm vi theta và thiếu hoạt động epileptiform. Đáng chú ý, TMS-EEG cho thấy chỉ số phức tạp nhiễu loạn (PCI) là 0,38 (e), phù hợp với một mức độ nào đó của ý thức được bảo tồn. Sau 12 tháng theo dõi, bệnh nhân vẫn bị khuyết tật nặng (Thang điểm kết quả của Glasgow – Điểm 3 mở rộng) nhưng với MCS lâm sàng. (Có được sự đồng ý của người thân, cho phép của Aurore Thibaut, Olivier Bodart, Lizette Heine và Olivia Gosseries từ Tập đoàn Khoa học Coma, Liege, Bỉ.) [Hình màu có thể được xem tại wileyonlinel Library.com]
PICO 5 Các điện thể gợi lên nhận thức, so với khám lâm sàng, phân biệt hôn mê và VS / UWS với MCS?
Mười bốn nghiên cứu với 1298 bệnh nhân đã đủ điều kiện tham gia [37,39,136 – 145,158,159]. Khả năng tương đối để phát hiện các dấu hiệu của thức tỉnh bí mật với điện thế gợi lên nhận thức so với khám lâm sàng là 1,49 (KTC 95% 1,27, 1,75; P
Khuyến nghị: Các điện thể gợi lên nhận thức về sự khác biệt giữa VS / UWS và MCS có thể được coi là một phần của đánh giá đa phương thức (bằng chứng thấp, khuyến nghị yếu). P300 dường như phân biệt tốt hơn giữa VS / UWS và MCS so với âm tính không phù hợp. Độ nhạy đối với tất cả các điện thế gợi lên nhận thức là thấp, ngay cả ở những đối tượng khỏe mạnh [37,39,136 – 145,158,159]. Ngoài phân tích trực quan, việc đánh giá các điện thế này cần liên quan đến phân tích thống kê bao gồm, có thể, trên máy và các thuật toán tương tự.
PICO 6 Các mô hình EEG sử dụng TMS, trái ngược với thăm khám lâm sàng, có giúp phân biệt hôn mê và VS / UWS với MCS không?
Sáu nghiên cứu với 173 bệnh nhân được coi là phù hợp đưa vào phân tích [54,147 – 151]. Khả năng tương đối để phát hiện các dấu hiệu thức tỉnh bí mật với TMS-EEG so với khám lâm sàng là 5,40 (95% CI 3,29 – 8,87; P
Khuyến nghị: Nên xem xét TMS-EEG cho sự khác biệt giữa VS / UWS và MCS như một phần của đánh giá đa phương thức (bằng chứng thấp, khuyến nghị yếu). Bằng chứng hiện tại cho thấy TMS-EEG có độ nhạy và độ đặc hiệu cao cho sự khác biệt giữa VS/UWS và MCS [54,147 – 151] và có khả năng đóng vai trò quan trọng hơn trong tương lai.
Thảo luận
Bằng chứng hỗ trợ phân loại hôn mê và DoC kéo dài vẫn còn hạn chế nhưng ngày càng tăng. Các biện pháp đầu giường quan trọng, chi phí thấp và dễ thực hiện có thể có tác động lâm sàng ngay lập tức. Một vài trong số này đã được làm nổi bật, bao gồm tầm quan trọng của việc thăm dò chuyển động mắt tự nguyện bằng gương (nếu cần thiết sau khi mở mắt thụ động của người kiểm tra); dựa vào các đánh giá lâm sàng lặp đi lặp lại thay vì cô lập (tốt nhất là sử dụng CRS-R); ủng hộ điểm FOUR hơn GCS trong bệnh cảnh cấp tính; và phân tích trực quan về điện não đồ tiêu chuẩn, bao gồm tìm kiếm các kiểu ngủ REM và sóng chậm. Có rất nhiều dấu hiệu lâm sàng tại giường khác đã bị loại trừ ở đây do thiếu dữ liệu đầy đủ nhưng điều đó vẫn có vẻ đầy hứa hẹn. Chúng bao gồm tìm kiếm khả năng chống mở mắt [68], sau khi sử dụng phương pháp đo đồng tử tự động [160,161], đánh giá định lượng theo dõi trực quan [12,162], đánh giá tiêu chuẩn về hành vi vận động tự phát [70], khả năng cho ăn bằng miệng [163], bằng chứng về nhịp sinh học [164], khai thác các phản ứng thực vật như tăng tiết nước bọt với kích thích mặn [165] hoặc điều chỉnh chu kỳ tim [166,167] và lấy mẫu quan sát của nhân viên điều dưỡng [28].
Trái ngược với các phương pháp đầu giường lâm sàng, các mô hình ý thức liên quan đến EEG mật độ cao, PET và fMRI là thách thức về mặt logic và đòi hỏi chuyên môn về công nghệ và tính toán đáng kể. Tuy nhiên, chúng cho phép đánh giá tinh tế về thức tỉnh và chức năng vỏ não bậc cao (Hình 2). Do đó, đánh giá đa phương thức dựa trên các kỹ thuật EEG (bao gồm TMS-EEG) và hình ảnh thần kinh là rất hữu ích để phát hiện thức tỉnh bí mật, nếu có, và để tránh chẩn đoán sai ở bệnh nhân không thực hiện theo y lệnh hoặc các dấu hiệu thức tỉnh khác ở đầu giường. Tuy nhiên, hầu hết tất cả các dữ liệu đến từ các nghiên cứu đơn trung tâm quan sát với các sai lệch, bao gồm độ lực nghiên cứu yếu, lấy mẫu thuận tiện và chồng chéo bệnh nhân giữa các nghiên cứu. Do đó, cần có sự hợp tác giữa nhiều trung tâm, một vấn đề quan trọng là xác nhận bên ngoài các mô hình thức tỉnh dựa trên fMRI-, PET- và EEG có nguồn gốc từ 1 trung tâm [42,44,45]. Trong trường hợp không có tiêu chuẩn vàng để phân loại thức tỉnh, các ước tính chính xác về độ nhạy và độ đặc hiệu của trạng thái hoạt động, thụ động và nghỉ ngơi EEG- và mô hình dựa trên hình ảnh thần kinh là không thể. Đây là một vấn đề cố hữu của nghiên cứu thức tỉnh. Ví dụ, một bệnh nhân không đáp ứng lâm sàng nhưng có thể tuân theo các mệnh lệnh trong mô hình fMRI nên được xem là có ý thức, và không phải là một “dương tính giả”. Đánh giá nối tiếp có thể làm tăng năng suất chẩn đoán và cho thấy các dấu hiệu thức tỉnh trong mô hình fMRI / PET và EEG ở những bệnh nhân ban đầu thiếu các dấu hiệu đó [138,146,149].
Gần đây, hướng dẫn của Viện Hàn lâm Thần kinh học Hoa Kỳ năm 2018 về DoC đã tập trung vào chẩn đoán, lịch sử tự nhiên, tiên lượng và điều trị DoC kéo dài (tức là ít nhất 28 ngày sau chấn thương não) [168]. Giống như đối tác Mỹ, hướng dẫn này nêu bật sự cần thiết của các đánh giá đa phương thức kỹ lưỡng và lặp đi lặp lại để tìm bằng chứng về bảo tồn thức tỉnh ở bệnh nhân mắc DoC. Ngoài ra, các khuyến nghị đã được đưa vào hôn mê và DoC cấp tính (tức là
Tóm lại, các thang điểm đánh giá lâm sàng được tiêu chuẩn hóa như CRS-R và FOUR, bao gồm kiểm tra cẩn thận các chuyển động mắt tự nguyện, các kỹ thuật dựa trên EEG và thần kinh chức năng (fMRI, PET) nên được tích hợp vào một tiêu chuẩn tham chiếu tổng hợp. Điều này có nghĩa là một bệnh nhân nhất định phải được chẩn đoán với mức độ thức tỉnh cao nhất được bộc lộ bởi bất kỳ phương pháp nào trong ba phương pháp tiếp cận (lâm sàng, điện não đồ, hình ảnh thần kinh).
Xung đột lợi ích
Các thành viên trong nhóm tuyên bố không có xung đột lợi ích.
Supporting Information
Additional Supporting Information may be found in the online version of this article:
File S1. Contingency tables.
File S2. Grading of Evidence tables.
File S3. Recommendation tables.
File S4. Figure S1.
File S5. Protocol and appendix.
File S6. List of EAN coma and DoC panel members.
References
Kondziella D, Friberg CK, Frokjaer VG, et al. Preserved consciousness in vegetative and minimal conscious states: systematic review and meta-analysis. J Neurol Neurosurg Psychiatry 2016; 87: 485–92.
Cortese MD, Riganello F, Arcuri F, et al. Coma Recovery Scale – R: variability in the disorder of consciousness. BMC Neurol 2015; 15: 186.
Candelieri A, Cortese MD, Dolce G, et al. Visual pursuit: within-day variability in the severe disorder of consciousness. J Neurotrauma 2011; 28: 2013–2017.
Wannez S, Heine L, Thonnard M, et al. The repetition of behavioral assessments in diagnosis of disorders of consciousness. Ann Neurol 2017; 81: 883–889.
Schnakers C, Vanhaudenhuyse A, Giacino J, et al. Diagnostic accuracy of the vegetative and minimally conscious state: clinical consensus versus standardized neurobehavioral assessment. BMC Neurol 2009; 9: 35. https://doi.org/10.1186/1471-2377-9-35.
van Erp WS, Lavrijsen JCM, Vos PE, et al. The vegetative state: prevalence, misdiagnosis, and treatment limitations. J Am Med Dir Assoc 2015; 16: 85.e9–85.e14.
Giacino JT, Ashwal S, Childs N, et al. The minimally conscious state: definition and diagnostic criteria. Neurology 2002; 58: 349–53.
Schnakers C, Perrin F, Schabus M, et al. Detecting consciousness in a total locked-in syndrome: an active event-related paradigm. Neurocase 2009; 15: 271–7.
Thonnard M, Wannez S, Keen S, et al. (2014) Detection of visual pursuit in patients in minimally conscious state: a matter of stimuli and visual plane? Brain Inj 28:1164–1170.
Wannez S, Hoyoux T, Langohr T, et al. Objective assessment of visual pursuit in patients with disorders of consciousness: an exploratory study. J Neurol 2017; 264: 928–937.
Vanhaudenhuyse A, Schnakers C, Bredart S, LaureysS. Assessment of visual pursuit in postcomatose states: use a mirror. J Neurol Neurosurg Psychiatry 2008; 79: 223–223.
Trojano L, Moretta P, Loreto V, et al. Affective saliency modifies visual tracking behavior in disorders of consciousness: a quantitative analysis. J Neurol 2013; 260: 306–8.
Sattin D, Giovannetti AM, Ciaraffa F, et al. Assessment of patients with disorder of consciousness: do different Coma Recovery Scale scoring correlate with different settings? J Neurol 2014; 261: 2378–2386.
Formisano R, D’Ippolito M, Risetti M, et al. Vegetative state, minimally conscious state, akinetic mutism and Parkinsonism as a continuum of recovery from disorders of consciousness: an exploratory and preliminary study. Funct Neurol 2011; 26: 15–24.
Estraneo A, Moretta P, Loreto V, et al. Late recovery after traumatic, anoxic, or hemorrhagic long-lasting vegetative state. Neurology 2010; 75: 239–245. https://d oi.org/10.1212/WNL.0b013e3181e8e8cc.
Formisano R, D’Ippolito M, Catani S. Functionallocked-in syndrome as recovery phase of vegetative state. Brain Inj 2013; 27: 1332–1332. https://doi.org/10. 3109/02699052.2013.809555.
Luaute J, Maucort-Boulch D, Tell L, et al. Long-term outcomes of chronic minimally conscious and vegetative states. Neurology 2010; 75: 246–252.
Hammond FM, Giacino JT, Nakase Richardson R,et al. Disorders of consciousness due to traumatic brain injury: functional status ten years post-injury. J Neurotrauma 2019; 36: 1136–1146.
Laureys S, Celesia GG, Cohadon F, et al. Unresponsive wakefulness syndrome: a new name for the vegetative state or apallic syndrome. BMC Med 2010; 8: 68.
Stender J, Gosseries O, Bruno MA, et al. Diagnostic precision of PET imaging and functional MRI in disorders of consciousness: a clinical validation study. Lancet 2014; 384: 514–522.
Demertzi A, Jox RJ, Racine E, Laureys S. A Europeansurvey on attitudes towards pain and end-of-life issues in locked-in syndrome. Brain Inj 2014; 28: 1209–1215.
Kondziella D, Cheung MC, Dutta A. Public perceptionof the vegetative state/unresponsive wakefulness syndrome: a crowdsourced study. PeerJ 2019; 7: e6575.
Gipson J, Kahane G, Savulescu J. Attitudes of lay people to withdrawal of treatment in brain damaged patients. Neuroethics 2014; 7: 1–9.
Demertzi A, Ledoux D, Bruno M-A, et al. Attitudes towards end-of-life issues in disorders of consciousness: A European survey. J Neurol 2011; 258: 1058–1065.
Harvey D, Butler J, Groves J, et al. Management of perceived devastating brain injury after hospital admission: a consensus statement from stakeholder professional organizations. Br J Anaesth 2018; 120: 138–145.
Turgeon AF, Lauzier F, Simard J-F, et al. Mortality associated with withdrawal of lifesustaining therapy for patients with severe traumatic brain injury: a Canadian multicentre cohort study. CMAJ 2011; 183: 1581–8.
Ong CJ, Dhand A, Diringer MN. Early withdrawaldecision-making in patients with coma after cardiac arrest: a qualitative study of intensive care clinicians. Neurocrit Care 2016; 25: 258–265.
Hermann B, Goudard G, Courcoux K, et al. Wisdom of the caregivers: pooling individual subjective reports to diagnose states of consciousness in brain-injured patients, a monocentric prospective study. BMJ Open 2019; 9: e026211.
van Erp WS, Lavrijsen JCM, van de Laar FA, et al. The vegetative state/unresponsive wakefulness syndrome: a systematic review of prevalence studies. Eur J Neurol 2014; 21: 1361–1368.
Rohaut B, Eliseyev A, Claassen J. Uncovering consciousness in unresponsive ICU patients: technical, medical and ethical considerations. Crit Care 2019; 23: 78.
Laureys S, Pellas F, Van Eeckhout P, et al. The locked-in syndrome: what is it like to be conscious but paralyzed and voiceless? Prog Brain Res 2005; 150: 495–511.
Owen AM, Coleman MR, Boly M, et al. Detecting awareness in the vegetative state. Science 2006; 313: 1402.
Marino S, Bonanno L, Giorgio A. Functional connectivity in disorders of consciousness: methodological aspects and clinical relevance. Brain Imaging Behav 2016; 10: 604–608.
Gosseries O, Di H, Laureys S, Boly M. Measuring consciousness in severely damaged brains. Annu Rev Neurosci 2014; 37: 457–78.
Bekinschtein TA, Dehaene S, Rohaut B, et al. Neural signature of the conscious processing of auditory regularities. Proc Natl Acad Sci USA 2009; 106:1672–7.
Monti MM, Vanhaudenhuyse A, Coleman MR, et al. Willful modulation of brain activity in disorders of consciousness. N Engl J Med 2010; 362: 579–589.
Faugeras F, Rohaut B, Weiss N, et al. Probing consciousness with event-related potentials in the vegetative state. Neurology 2011; 77: 264–8.
Cruse D, Chennu S, Chatelle C, et al. Bedside detection of awareness in the vegetative state: a cohort study. Lancet 2011; 378: 2088–94.
Lule D, Noirhomme Q, Kleih SC, et al. Probing command following in patients with disorders of consciousness using a brain–computer interface. Clin Neurophysiol 2013; 124: 101–6.
Di HB, Yu SM, Weng XC, et al. Cerebral response to patient’s own name in the vegetative and minimally conscious states. Neurology 2007; 68: 895–9.
Chennu S, Annen J, Wannez S, et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain 2017; 140: 2120–2132.
Demertzi A, Antonopoulos G, Heine L, et al. Intrinsic functional connectivity differentiates minimally conscious from unresponsive patients. Brain 2015; 138: 2619–31.
Sitt JD, King J-RR, El Karoui I, et al. Large scale screening of neural signatures of consciousness in patients in a vegetative or minimally conscious state. Brain 2014; 137: 2258–2270.
Demertzi A, Tagliazucchi E, Dehaene S, et al. Human consciousness is supported by dynamic complex patterns of brain signal coordination. Sci Adv 2019; 5: eaat7603.
Engemann DA, Raimondo F, King J-R, et al. Robust EEG-based cross-site and cross-protocol classification of states of consciousness. Brain 2018; 141: 3179–3192.
Tzovara A, Simonin A, Oddo M, et al. Neural detection of complex sound sequences in the absence of consciousness. Brain 2015; 138: 1160–1166.
Schiff ND. Cognitive motor dissociation following severe brain injuries. JAMA Neurol 2015; 72: 1413.
Edlow BL, Chatelle C, Spencer CA, et al. Early detection of consciousness in patients with acute severe traumatic brain injury. Brain 2017; 140: 2399–2414.
Posner J, Plum F, Saper C. Plum and Posner’s Diagnosis of Stupor and Coma. Oxford University Press: New York, NY, 2007.
Naccache L. Minimally conscious state or corticallymediated state? Brain 2018; 141: 949– 960.
Kotchoubey B, Vogel D, Lang S, Muller F. What€ kind of consciousness is minimal? Brain Inj 2014; 28: 1156–63.
Bruno M-A, Vanhaudenhuyse A, Thibaut A, et al. From unresponsive wakefulness to minimally conscious PLUS and functional locked-in syndromes: recent advances in our understanding of disorders of consciousness. J Neurol 2011; 258: 1373–84.
Gosseries O, Zasler ND, Laureys S. Recent advancesin disorders of consciousness: focus on the diagnosis. Brain Inj 2014; 28: 1141–1150.
Bodart O, Gosseries O, Wannez S, et al. Measures of metabolism and complexity in the brain of patients with disorders of consciousness. NeuroImage Clin 2017; 14: 354–362.
Bruno MA, Fernandez-Espejo D, Lehembre R, et al. Multimodal neuroimaging in patients with disorders of consciousness showing ‘functional hemispherectomy’. Prog Brain Res 2011; 193: 323–33.
Leone MA, Keindl M, Schapira AH, et al. Practical recommendations for the process of proposing, planning and writing a neurological management guideline by EAN task forces. Eur J Neurol 2015; 22: 1505–1510.
Methley AM, Campbell S, Chew-Graham C, et al. PICO, PICOS and SPIDER: a comparison study of specificity and sensitivity in three search tools for qualitative systematic reviews. BMC Health Serv Res 2014; 14: 579.
Giacino JT, Kalmar K, Whyte J. The JFK ComaRecovery Scale – Revised: measurement characteristics and diagnostic utility. Arch Phys Med Rehabil 2004; 85: 2020–2029.
Balshem H, Helfand M, Schunemann€ HJ, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol 2011; 64: 401–406.
Estraneo A, Moretta P, De Tanti A, et al. An Italian multicentre validation study of the Coma Recovery Scale – Revised. Eur J Phys Rehabil Med 2015; 51: 627–34.
Iazeva EG, Legostaeva LA, Zimin AA, et al. A Russian validation study of the Coma Recovery Scale – Revised (CRS-R). Brain Inj 2018; 33: 1–8.
Bruno M-A, Ledoux D, Lambermont B, et al. Comparison of the full outline of UnResponsiveness and Glasgow Liege Scale/Glasgow Coma Scale in an intensive care unit population. Neurocrit Care 2011; 15: 447–453. https://doi.org/10.1007/s12028-011-9547-2.
Schnakers C, Majerus S, Giacino J, et al. A French validation study of the Coma Recovery Scale – Revised (CRS-R). Brain Inj 2008; 22: 786–792.
Wannez S, Vanhaudenhuyse A, Laureys S, Bredart S. Mirror efficiency in the assessment of visual pursuit in patients in minimally conscious state. Brain Inj 2017; 31: 1429–1435. https://doi.org/10.1080/02699052.2017. 1376755.
Tamashiro M, Rivas ME, Ron M, et al. A Spanish validation of the Coma Recovery Scale – Revised (CRSR). Brain Inj 2014; 28: 1744–1747.
Smith E, Delargy M. Locked-in syndrome. BMJ 2005; 330: 406–409.
Wijdicks EFM, Bamlet WR, Maramattom BV, et al. Validation of a new coma scale: the FOUR score. Ann Neurol 2005; 58: 585–593.
van Ommen HJ, Thibaut A, Vanhaudenhuyse A, et al. Resistance to eye opening in patients with disorders of consciousness. J Neurol 2018;265: 1376–1380.
Chatelle C, Bodien YG, Carlowicz C, et al. Detection and interpretation of impossible and improbable Coma Recovery Scale – Revised scores. Arch Phys Med Rehabil 2016; 97: 1295– 1300.e4.
Pincherle A, Johr J, Chatelle C,€ et al. Motor behavior unmasks residual cognition in disorders of consciousness. Ann Neurol 2019; 85: 443–447.
Formisano R, Bivona U, Penta F, et al. Early clinical predictive factors during coma recovery. Acta Neurochir Suppl 2005; 93: 201–5.
Pignat J-M, Mauron E, Johr J, et al. Outcome prediction of consciousness disorders in the acute stage based on a complementary motor behavioural tool. PLoS One 2016; 11: e0156882.
Schnakers C, Ledoux D, Majerus S, et al. Diagnostic and prognostic use of bispectral index in coma, vegetative state and related disorders. Brain Inj 2008; 22: 926–31.
Lovstad M, Froslie K, Giacino J, et al. Reliability and diagnostic characteristics of the JFK Coma Recovery Scale – Revised: exploring the influence of raters level of experience. J Head Trauma Rehabil 2010; 25: 349–356.
Seel RT, Sherer M, Whyte J, et al. Assessment scales for disorders of consciousness: evidence-based recommendations for clinical practice and research. Arch Phys Med Rehabil 2010; 91: 1795–1813.
Sattin D, Minati L, Rossi D, et al. The Coma Recovery Scale Modified Score: a new scoring system for the Coma Recovery Scale – Revised for assessment of patients with disorders of consciousness. Int J Rehabil Res 2015; 38: 350–356.
Bodien YG, Carlowicz CA, Chatelle C, Giacino JT.Sensitivity and specificity of the Coma Recovery Scale – Revised total score in detection of conscious awareness. Arch Phys Med Rehabil 2016; 97: 490-492.e1.
Schnakers C, Bessou H, Rubi-Fessen I, et al. Impact of aphasia on consciousness assessment: a cross-sectional study. Neurorehabil Neural Repair 2015; 29: 41–7.
Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet 1974; 2: 81–84.
Chatelle C, De Val M-D, Catano A, et al. Is the Nociception Coma Scale – Revised a useful clinical tool for managing pain in patients with disorders of consciousness? Clin J Pain 2016; 32: 321–326.
Schnakers C, Chatelle C, Vanhaudenhuyse A, et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain 2010; 148: 215–219.
Chatelle C, Majerus S, Whyte J, et al. A sensitive scale to assess nociceptive pain in patients with disorders of consciousness. J Neurol Neurosurg Psychiatry 2012; 83: 1233–1237.
Riganello F, Cortese MD, Arcuri F, et al. A study of the reliability of the Nociception Coma Scale. Clin Rehabil 2014; 29: 388–393.
Chatelle C, Hauger SL, Martial C, et al. Assessment of nociception and pain in participants in an unresponsive or minimally conscious state after acquired brain injury: the relation between the Coma Recovery Scale – Revised and the Nociception Coma Scale – Revised. Arch Phys Med Rehabil 2018; 99: https://doi.org/10. 1016/j.apmr.2018.03.009.
Vink P, Eskes AM, Lindeboom R, et al. Nurses assessing pain with the Nociception Coma Scale: interrater reliability and validity. Pain Manag Nurs 2014; 15: 881–887.
Vink P, Lucas C, Maaskant JM, et al. Clinimetric properties of the Nociception Coma Scale (– Revised): A systematic review. Eur J Pain 2017; 21: 1463–1474.
Formisano R, Contrada M, Aloisi M, et al. Nociception Coma Scale with personalized painful stimulation versus standard stimulus in non-communicative patients with disorders of consciousness. Neuropsychol Rehabil 2019; 1–12: https://doi.org/10.1080/09602011. 2019.1614464.
Bagnato S, Boccagni C, Sant’Angelo A, , et al. Pain assessment with the revised Nociception Coma Scale and outcomes of patients with unresponsive wakefulness syndrome: results from a pilot study. Neurol Sci 2018; 39: 1073–1077.
Ely EW, Margolin R, Francis J, et al. Evaluation of delirium in critically ill patients: validation of the confusion assessment method for the intensive care unit (CAM-ICU). Crit Care Med 2001; 29: 1370–1379.
Bergeron N, Dubois MJ, Dumont M, et al. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med 2001; 27: 859–64.
Sherer M, Nakase-Thompson R, Yablon SA, Gontkovsky ST. Multidimensional assessment of acute confusion after traumatic brain injury. Arch Phys Med Rehabil 2005; 86: 896–904. 92. Larsen LK, Frokjaer VG, Nielsen JS, et al. Delirium assessment in neuro-critically ill patients: a validation study. Acta Anaesthesiol Scand 2019; 63: 352–359.
Annen J, Blandiaux S, Lejeune N, et al. BCI performance and brain metabolism profile in severely braininjured patients without response to command at bedside. Front Neurosci 2018; 12: 370.
Stender J, Mortensen KN, Thibaut A, et al. The minimal energetic requirement of sustained awareness after brain injury. Curr Biol 2016; 26: 1494–1499.
Demertzi A, Gomez F, Crone JS, et al. Multiple fMRI system-level baseline connectivity is disrupted in patients with consciousness alterations. Cortex 2014; 52: 35–46.
Kondziella D, Fisher PM, Larsen VA, et al. Functional MRI for assessment of the default mode network in acute brain injury. Neurocrit Care 2017; 27: 401–406.
Soddu A, Vanhaudenhuyse A, Bahri MA, et al. Identifying the default-mode component in spatial IC analyses of patients with disorders of consciousness. Hum Brain Mapp 2012; 33: 778–96.
Crone JS, Schurz M, Holler Y,€ et al. Impaired consciousness is linked to changes in effective connectivity of the posterior cingulate cortex within the default mode network. NeuroImage 2015; 110: 101–109.
Rosazza C, Andronache A, Sattin D, et al. Multimodal study of default-mode network integrity in disorders of consciousness. Ann Neurol 2016; 79: 841–853.
Crone JS, Ladurner G, Holler Y,€ et al. Deactivation of the default mode network as a marker of impaired consciousness: an fMRI study. PLoS One 2011; 6: e26373.
Bekinschtein TA, Manes FF, Villarreal M, et al. Functional imaging reveals movement preparatory activity in the vegetative state. Front Hum Neurosci 2011; 5: 5.
Coleman MR, Rodd JM, Davis MH, et al. Do vegetative patients retain aspects of language comprehension? Evidence from fMRI. Brain 2007; 130: 2494– 2507.
Coleman MR, Davis MH, Rodd JM, et al. Towards the routine use of brain imaging to aid the clinical diagnosis of disorders of consciousness. Brain 2009; 132: 2541–52.
Fernandez-Espejo D, Junque C, Vendrell P, et al. Cerebral response to speech in vegetative and minimally conscious states after traumatic brain injury. Brain Inj 2008; 22: 882–890.
Heelmann V, Lippert-Gruner M, Rommel T, Wede-€ kind C. Abnormal functional MRI BOLD contrast in the vegetative state after severe traumatic brain injury. Int J Rehabil Res 2010; 33: 151–7.
Kremer S, Nicolas-Ong C, Schunck T, et al. Usefulness of functional MRI associated with PET scan and evoked potentials in the evaluation of brain functions after severe brain injury: preliminary results. J Neuroradiol 2010; 37: 159–66.
Li L, Jiang W, Xiong L, et al. Brain response to thermal stimulation predicts outcome of patients with chronic disorders of consciousness. Clin Neurophysiol 2014; 126: 1539–1547.
Nigri A, Nava S, Sattin D, et al. Central olfactory processing in patients with disorders of consciousness. Eur J Neurol 2015; 23: 605–612.
Nigri A, Catricala E, Ferraro S, et al. The neural correlates of lexical processing in disorders of consciousness. Brain Imaging Behav 2017; 11: 1526–1537.
Okumura Y, Asano Y, Takenaka S, et al. Brain activation by music in patients in a vegetative or minimally conscious state following diffuse brain injury. Brain Inj 2014; 9052: 1–7.
Qin P, Di H, Liu Y, et al. Anterior cingulate activity and the self in disorders of consciousness. Hum Brain Mapp 2010; 31: 1993–2002. https://doi.org/10.1002/hb m.20989. 112. Sharon H, Hassin D, Giladi N, et al. Emotional processing of personally familiar faces in the vegetative state. PLoS One 2013; 8: e74711.
Wang F, Huang W, Nie Y, et al. Cerebral response to subject’s own name showed high prognostic value in traumatic vegetative state. BMC Med 2015; 13: 1–13.
Bardin JC, Schiff ND, Voss HU. Pattern classificationof volitional functional magnetic resonance imaging responses in patients with severe brain injury. Arch Neurol 2012; 69: 176–181.
Bardin JC, Fins JJ, Katz DI, et al. (2011) Dissociations between behavioural and functional magnetic resonance imaging-based evaluations. Brain 134:769–82.
Bick AS, Leker RR, Ben-Hur T, Levin N. Implementing novel imaging methods for improved diagnosis of disorder of consciousness patients. J Neurol Sci 2013; 334: 130–138.
Braiman C, Conte MM, Schiff ND, et al. Cortical response to the natural speech envelope correlates with neuroimaging evidence of cognition in severe brain injury. Curr Biol 2018; 28: 3833–3839.e3.
Chennu S, Finoia P, Kamau E, et al. Dissociable endogenous and exogenous attention in disorders of consciousness. NeuroImage Clin 2013; 3: 450–61.
Forgacs PB, Conte MM, Fridman EA, et al. Preservation of electroencephalographic organization in patients with impaired consciousness and imaging-based evidence of command-following. Ann Neurol 2014; 76: 869–79.
Gibson RM, Gonzalez-Lara LE, FernA~¡ndez-Espejo D, et al. Multiple tasks and neuroimaging modalities increase the likelihood of detecting covert awareness in patients with disorders of consciousness. Front Hum Neurosci 2014; 8: 1–9.
Gibson RM, Chennu S, Fernandez-Espejo D, et al. Somatosensory attention identifies both overt and covert awareness in disorders of consciousness. Ann Neurol 2016; 80: 412–423.
Haugg A, Cusack R, Gonzalez-Lara LE, et al. Do patients thought to lack consciousness retain the capacity for internal as well as external awareness? Front Neurol 2018; 9: 1–13.
Monti MM, Rosenberg M, Finoia P, et al. Thalamofrontal connectivity mediates top-down cognitive functions in disorders of consciousness. Neurology 2015; 84: 167–73.
Rodriguez Moreno D, Schiff ND, Giacino J, et al. A network approach to assessing cognition in disorders of consciousness. Neurology 2010; 75: 1871–8.
Vogel D, Markl A, Yu T, et al. Can mental imagery functional magnetic resonance imaging predict recovery in patients with disorders of consciousness? Arch Phys Med Rehabil 2013; 94: 1891–1898.
Huang Z, Dai R, Wu X, et al. The self and its resting state in consciousness: an investigation of the vegetative state. Hum Brain Mapp 2014; 35: 1997–2008.
Curley WH, Forgacs PB, Voss HU, et al. Characterization of EEG signals revealing covert cognition in the injured brain. Brain 2018; 141: 1404–1421.
Golkowski D, Merz K, Mlynarcik C, et al. Simultaneous EEG–PET–fMRI measurements in disorders of consciousness: an exploratory study on diagnosis and prognosis. J Neurol 2017; 264: 1986–1995.
Kirsch M, Guldenmund P, Ali Bahri M, et al. Sedation of patients with disorders of consciousness during neuroimaging: Effects on resting state functional brain connectivity. Anesth Analg 2017; 124(2): 588–598. https://doi.org/10.1213/ANE.0000000000001721
Estraneo A, Loreto V, Guarino I, et al. Standard EEG in diagnostic process of prolonged disorders of consciousness. Clin Neurophysiol 2016; 127: 2379–2385.
Cologan V, Drouot X, Parapatics S, et al. Sleep in the unresponsive wakefulness syndrome and minimally conscious state. J Neurotrauma 2013; 30: 339–46.
de Biase S, Gigli GL, Lorenzut S, et al. The importance of polysomnography in the evaluation of prolonged disorders of consciousness: sleep recordings more adequately correlate than stimulus-related evoked potentials with patients’ clinical status. Sleep Med 2014; 15: 393–400.
Landsness E, Bruno M-A, Noirhomme Q, et al. Electrophysiological correlates of behavioural changes in vigilance in vegetative state and minimally conscious state. Brain 2011; 134: 2222–2232.
Malinowska U, Chatelle C, Bruno M-A, et al. Electroencephalographic profiles for differentiation of disorders of consciousness. Biomed Eng Online 2013; 12: 109.
Cruse D, Chennu S, Chatelle C, et al. Relationship between etiology and covert cognition in the minimally conscious state. Neurology 2012; 78: 816–22.
Boly M, Garrido MI, Gosseries O, et al. Preserved feedforward but impaired top-down processes in the vegetative state. Science 2011; 332: 858–62.
de Tommaso M, Navarro J, Ricci K, et al. Pain in prolonged disorders of consciousness: laser evoked potentials findings in patients with vegetative and minimally conscious states. Brain Inj 2013; 27: 962–72.
Faugeras F, Rohaut B, Weiss N, et al. Event related potentials elicited by violations of auditory regularities in patients with impaired consciousness. Neuropsychologia 2012; 50: 403–18.
Fischer C, Luaute J, Morlet D. Event-related potentials(MMN and novelty P3) in permanent vegetative or minimally conscious states. Clin Neurophysiol 2010; 121: 1032–1042.
Perrin F, Schnakers C, Schabus M, et al. Brain response to one’s own name in vegetative state, minimally conscious state, and locked-in syndrome. Arch Neurol 2006; 63: 562–569.
Risetti M, Formisano R, Toppi J, et al. On ERPs detection in disorders of consciousness rehabilitation. Front Hum Neurosci 2013; 7: 775.
Rohaut B, Faugeras F, Chausson N, et al. Probing ERP correlates of verbal semantic processing in patients with impaired consciousness. Neuropsychologia 2015; 66: 279–292.
Schnakers C, Perrin F, Schabus M, et al. Voluntary brain processing in disorders of consciousness. Neurology 2008; 71: 1614–20.
Kotchoubey B, Lang S, Mezger G, et al. Information processing in severe disorders of consciousness: vegetative state and minimally conscious state. Clin Neurophysiol 2005; 116: 2441–2453.
Sergent C, Faugeras F, Rohaut B, et al. Multidimensional cognitive evaluation of patients with disorders of consciousness using EEG: a proof of concept study. NeuroImage Clin 2017; 13: 455–469.
King JR, Faugeras F, Gramfort A, et al. Single-trial decoding of auditory novelty responses facilitates the detection of residual consciousness. NeuroImage 2013; 83: 726–38.
Casali AG, Gosseries O, Rosanova M, et al. A theoretically based index of consciousness independent of sensory processing and behavior. Sci Transl Med 2013; 5: 198ra105.
Casarotto S, Comanducci A, Rosanova M, et al. Stratification of unresponsive patients by an independently validated index of brain complexity. Ann Neurol 2016; 80: 718–729.
Rosanova M, Gosseries O, Casarotto S, et al. Recovery of cortical effective connectivity and recovery of consciousness in vegetative patients. Brain 2012; 135: 1308–20.
Ragazzoni A, Pirulli C, Veniero D, et al. Vegetative versus minimally conscious states: a study using TMSEEG, sensory and event-related potentials. PLoS One 2013; 8: e57069.
Bodart O, Fecchio M, Massimini M, et al. Meditationinduced modulation of brain response to transcranial magnetic stimulation. Brain Stimul 2018; 11: 1397– 1400.
Azabou E, Navarro V, Kubis N, et al. Value and mechanisms of EEG reactivity in the prognosis of patients with impaired consciousness: a systematic review. Crit Care 2018; 22: 184.
Pavlov YG, Gais S, Muller F,€ et al. Night sleep in patients with vegetative state. J Sleep Res 2017; 26: 629–640.
Wielek T, Lechinger J, Wislowska M, et al. Sleep in patients with disorders of consciousness characterized by means of machine learning. PLoS One 2018; 13: e0190458.
Claassen J, Doyle K, Matory A, et al. Detection of brain activation in unresponsive patients with acute brain injury. N Engl J Med 2019; 380: 2497–2505.
King JR, Sitt JD, Faugeras F, et al. Information sharing in the brain indexes consciousness in noncommunicative patients. Curr Biol 2013; 23: 1914–1919.
Goldfine AM, Bardin JC, Noirhomme Q, et al. Reanalysis of ‘Bedside detection of awareness in the vegetative state: a cohort study’. Lancet 2013; 381: 289–91.
Cruse D, Chennu S, Chatelle C, et al. Reanalysis of ‘Bedside detection of awareness in the vegetative state: a cohort study’ – authors’ reply. Lancet 2013; 381: 291–292.
Steppacher I, Eickhoff S, Jordanov T, et al. N400 predicts recovery from disorders of consciousness. Ann Neurol 2013; 73: 594–602.
Stoll J, Chatelle C, Carter O, et al. Pupil responses allow communication in locked-in syndrome patients. Curr Biol 2013; 23: R647–R648.
Vassilieva A, Olsen MH, Peinkhofer C, et al. Automated pupillometry to detect command following in neurological patients: a proof-of-concept study. PeerJ 2019; 7: e6929.
Trojano L, Moretta P, Masotta O, et al. Visual pursuit of one’s own face in disorders of consciousness: a quantitative analysis. Brain Inj 2018; 32: 1549–1555.
Melotte E, Maudoux A, Delhalle S, et al. Is oral feeding compatible with an unresponsive wakefulness syndrome? J Neurol 2018; 265: 954–961.
Blume C, Lechinger J, Santhi N, et al. Significance of circadian rhythms in severely braininjured patients. Neurology 2017; 88: 1933–1941.
Wilhelm B, Jordan M, Birbaumer N. Communicationin locked-in syndrome: effects of imagery on salivary pH. Neurology 2006; 67: 534–5.
Raimondo F, Rohaut B, Demertzi A, et al. Brain– heart interactions reveal consciousness in noncommunicating patients. Ann Neurol 2017; 82: 578–591.
Riganello F, Larroque SK, Bahri MA, et al. A heartbeat away from consciousness: heart rate variability entropy can discriminate disorders of consciousness and is correlated with resting-state fMRI brain connectivity of the central autonomic network. Front Neurol 2018; 9: 1–18.
Giacino JT, Katz DI, Schiff ND, et al. Practice guideline update recommendations summary: Disorders of consciousness. Neurology 2018; 91: 450–460.
Formisano R, Giustini M, Aloisi M, et al. An international survey on diagnostic and prognostic protocols in patients with disorder of consciousness. Brain Inj 2019; 33: 974– 984.