Hội đồng chuẩn mực lâm sàng (clinical standards committee – csc)
Hiệp hội siêu âm sản phụ khoa thế giới – ISUOG là một tổ chức khoa học với tiêu chí hoạt động là thúc đẩy việc thực hành an toàn, huấn luyện và nghiên cứu khoa học đạt tiêu chuẩn cao trong lĩnh vực chẩn đoán hình ảnh của nữ giới. Hội đồng chuẩn mực lâm sàng của ISUOG (Clinical Standards Committee – CSC) có thẩm quyền đưa ra các hướng dẫn thực hành cũng như các đồng thuận cho các bác sĩ /khi thực hành siêu âm chẩn đoán. ISUOG đã rất cố gắng để các hướng dẫn tại thời điểm lưu hành là đúng và cập nhật nhất, không một ai, dù là các hội viên hay các thành viên nào trong tổ chức ISUOG chấp nhận khả năng có sự sai sót trong các hướng dẫn, khuyến cáo hay dữ liệu được đưa ra bởi CSC. Các tài liệu được phát hành bởi CSC không nhằm mục đích xây dựng một chuẩn mực có tính pháp lý vì sự ứng dụng của các khuyến cáo và các hướng dẫn này có thể bị ảnh hưởng tùy từng cá thể, từng vùng miền, và nguồn lực sẵn có tại địa phương. Các hướng dẫn này được ISUOG cho phép lưu hành miễn phí (info@isuog.org).
Giới thiệu
Tăng huyết áp trong thai kì ảnh hưởng đến 10% thai phụ1 và tỉ suất mới mắc tiền sản giật (TSG) trên toàn cầu là 3%2. Sự khác biệt có ý nghĩa giữa các quốc gia đang phát triển và đã phát triển có thể có thật hoặc chỉ do sai lệch trong thu thập số liệu. TSG và các biến chứng góp phần chính vào bệnh suất và tử suất của mẹ và chu sinh trên toàn thế giới1,3. Việc chăm sóc kịp thời và hiệu quả được cho rằng có thể cải thiện kết cục của TSG3, do đó phát triển chiến lược dự đoán và tầm soát hiệu quả đã trở thành một mục tiêu chính của chăm sóc trước sinh và của các nghiên cứu.
TSG là một bệnh hệ thống đa cơ quan, bắt nguồn từ nhiều yếu tố: khiếm khuyết bánh nhau, stress oxy hóa, tự miễn, kích hoạt tiểu cầu và thrombin, viêm nội mạch, rối loạn nội mô, mất cân bằng trong quá trình tạo mạch và đáp ứng kém của hệ tim mạch người mẹ. Sự khiếm khuyết trong xâm nhập của gai nhau liên quan mật thiết với hầu hết các trường hợp TSG khởi phát sớm và nặng4. Ngược lại, sự khiếm khuyết này dường như ít ảnh hưởng đến những trường hợp TSG xuất hiện muộn, chẳng hạn sau 34 tuần. Khi so với các thai kì bị ảnh hưởng bởi bệnh khởi phát sớm, thì bất thường mô học bánh nhau có tần suất thấp hơn6 và các yếu tố từ mẹ (ví dụ tăng huyết áp mạn hoặc rối loạn chuyển hóa) có mối liên quan nhiều hơn một cách có ý nghĩa4. Khác biệt giữa TSG khởi phát sớm và muộn còn do yếu tố nguy cơ7, sự đáp ứng của hệ mạch mẹ8, thực hiện tầm soát9 và hiệu quả của việc dự phòng TSG10.
Sự hiểu biết ngày càng sâu sắc về sinh bệnh học của TSG được phản ánh qua chiến lược tầm soát đang thực hiện hiện nay, dựa trên bệnh sử, chủng tộc, chỉ dấu sinh học (bao gồm huyết áp động mạch) và Dopler động mạch tử cung11.
Hiện nay trên PubMed có hơn 10000 bài báo liên quan đến tầm soát TSG, chứng tỏ chủ đề này đang rất được quan tâm. Ít hơn 1/5 các tài liệu này bàn về tầm soát sớm TSG, đó chính là sự phát triển trong thập kỉ vừa qua. Mục đích chính của hướng dẫn này là giúp xem xét lại những chứng cứ mới nhất, cũng như cung cấp các khuyến cáo dựa trên bằng chứng về vai trò của siêu âm trong tầm soát và theo dõi TSG. Tài liệu này tập trung vào kỹ thuật và các đặc điểm lâm sàng trong việc tầm soát, không mở rộng đến các vấn đề chính sách, kinh tế y tế cũng như vấn đề chi phí – hiệu quả đem lại của việc tầm soát. Thêm vào đó, hướng dẫn này được phát triển với giả định rằng các nguồn lực cần thiết cho việc thực hiện tầm soát và theo dõi (công cụ thiết bị, người thực hiện, thẩm định chuyên môn) là sẵn có. Các bước tiến hành và quy trinh được mô tả trong hướng dẫn này không nhằm mục đích trở thành tiêu chuẩn pháp lý cho lâm sàng.
Thuật ngữ: tầm soát – dự đoán
Mặc dù các thuật ngữ ‘tầm soát’ và ‘dự đoán’ thường được sử dụng thay thế cho nhau, nhưng trên thực tế, tầm soát là quá trình rộng hơn, bắt đầu với việc đưa dân số tham gia vào và kết thúc bằng việc điều trị cho những cá nhân được xác định là có nguy cơ cao12. Dự đoán hay nói cách khác là tính toán nguy cơ mắc bệnh, là một thành tố không thể thiếu của quá trình tầm soát, nhưng nó không tương đương với tầm soát, nó cũng liên quan đến việc can thiệp sau này cho các cá nhân có nguy cơ cao và nhằm mục đích thay đổi diễn tiến của tình trạng được tầm soát, cuối cùng là cải thiện kết cục13. Tầm soát trong chăm sóc trước sinh thường được sử dụng để đưa ra lựa chọn chấm dứt thai kỳ kịp thời cho cha mẹ của thai có tình trạng mắc bệnh không thể điều trị. Với mục đích của hướng dẫn này thì thuật ngữ ‘tầm soát’ được ưu tiên và phù hợp hơn khi cần xác định các trường hợp có nguy cơ mắc bệnh, từ đó dự phòng sự nặng lên của bệnh, trong khi đó, ‘dự đoán’ là thuật ngữ được ưa dùng khi không có bằng chứng rằng việc xác định những phụ nữ có nguy cơ sẽ cải thiện được kết cục thai kỳ.
Các thông tin cần thu thập
Khuyến cáo
Nhân viên y tế tham gia tầm soát TSG cần phải cập nhật kiến thức mới về các yếu tố nguy cơ chính đối với TSG (GOOD PRACTICE POINT).
Sử dụng siêu âm trong tầm soát TSG không nên bị tách rời khỏi chương trình chăm sóc trước sinh. Người tiến hành tầm soát phải cập nhật kiến thức về các yếu tố nguy cơ và mục đích xác định chúng trong quá trình tầm soát. Có 4 nhóm nguy cơ chính, bao gồm: yếu tố nguy cơ của bản thân thai phụ (tuổi, chủng tộc, tiền căn nội khoa và sản khoa, biện pháp tránh thai đang sử dụng, hút thuốc lá), yếu tố nguy cơ về chuyển hóa (chỉ số khối cơ thể BMI, tiền căn đái tháo đường), yếu tố nguy cơ tim mạch (bệnh lý tim mạch có sẵn, huyết áp động mạch trung bình) và yếu tố bánh nhau (bao gồm Doppler động mạch tử cung và các chỉ dấu sinh học trong huyết thanh mẹ)11.
Siêu âm trong tầm soát tiền sản giật
Sự khiếm khuyết bánh nhau dẫn đến sự biến đổi không hoàn toàn các động mạch xoắn là cơ sở của việc sử dụng siêu âm như là công cụ để tầm soát/dự đoán TSG. Tổn thương mô bệnh học của mạch máu và gai nhau thường gặp ở những thai phụ có TSG gấp từ 4 đến 7 lần những trường hợp không14, và tổn thương này có liên quan với tăng trở kháng động mạch tử cung15. Do đó việc đo lường trở kháng dòng chảy động mạch tử cung qua siêu âm Doppler có thể diễn giải được mức độ biến đổi không hoàn toàn của các động mạch xoắn.
Chỉ số doppler nào được sử dụng
Khuyến cáo
Chỉ số mạch đập (PI) nên được sử dụng để đánh giá trở kháng động mạch tử cung trong tầm soát TSG (MỨC ĐỘ KHUYẾN CÁO: B).
Như đã mô tả trong hướng dẫn thực hành của ISUOG về việc sử dụng siêu âm Doppler trong sản khoa16, tỉ số S/D, chỉ số trở kháng (RI) và PI là ba chỉ số tốt nhất để mô tả vận tốc dạng sóng dòng chảy động mạch.
Trong đó PI thường được sử dụng nhất; chỉ số này vượt trội so với RI trong đánh giá dạng sóng Doppler của động mạch tử cung do PI tính toán được giá trị trung bình của tất cả vận tốc tối đa suốt chu chuyển tim, thay vì chỉ xác định hai điểm trong chu chuyển tim như chỉ số RI. Hơn nữa, PI ổn định hơn và vẫn xác định được trị số này khi có tình trạng mất hoặc đảo ngược sóng tâm trương16.
Khuyết notch động mạch tử cung cũng được sử dụng trong tầm soát TSG17, sự hiện diện khuyết notch hai bên có liên quan với dấu hiệu rối loạn chức năng nội mô của mẹ18. Mặc dù về mặt lý thuyết dùng khuyết notch làm chỉ dấu để tầm soát là hợp lý, nhưng khuyết notch hai bên không phải là không thường gặp trong ba tháng đầu của các thai kỳ bình thường, tỉ lệ này khoảng 43%, do đó độ đặc hiệu của nó bị giảm xuống. Tương tự như vậy, khuyết notch động mạch tử cung trong tam cá nguyệt hai có độ nhạy tương tự PI tăng, nhưng có tỉ lệ tầm soát dương tính cao hơn17, và có thể có chủ quan trong xác định khuyết notch, điểu này sẽ làm giới hạn giá trị tầm soát của dấu hiệu này.
Một phân tích gộp năm 2008 cho thấy tăng PI đơn độc hoặc kết hợp với khuyết notch là chỉ số tiên đoán TSG quan trọng nhất trên siêu âm Doppler20. Một số lượng đáng kể các tài liệu, chứng cứ được công bố đã chỉ ra sự ưu việt của PI trung bình động mạch tử cung trong tầm soát TSG, do đó đã trở thành chỉ số được ưa thích sử dụng cho tầm soát và dự phòng TSG trong 3 tháng đầu21 – 23.
Tam cá nguyệt một
Khuyến cáo
Siêu âm doppler động mạch tử cung từ 11 đến 13 tuần 6 ngày có thể thực hiện qua đường bụng hoặc âm đạo tùy thuộc vào cơ sở thực hành và công cụ sẵn có (GOOD PRACTICE POINT).
Lời khuyên về kỹ thuật
PI động mạch tử cung trong 3 tháng đầu > bách phân vị thứ 90 phát hiện được 48% thai phụ sẽ khởi phát TSG sớm và 26% thai phụ sau đó sẽ xuất hiện TSG (sớm hay muộn) trong thai kỳ, với tỉ lệ tầm soát dương là 10% (MỨC ĐỘ CHỨNG CỨ: 2++)
Kỹ thuật siêu âm doppler động mạch tử cung trong 3 tháng đầu: Siêu âm doppler động mạch tử cung trong 3 tháng đầu đã được nghiên cứu rộng rãi nhất trong giai đoạn từ 11 tuần đến 13 tuần 6 ngày. Đây là khoảng thời gian hợp lý vì nhiều quốc gia thường tiến hành siêu âm 3 tháng đầu vào lúc này. Đánh giá ở thời điểm sớm hơn không được nghiên cứu rộng rãi do nguyên bào nuôi chưa xâm nhập đủ để có thể đánh giá được.
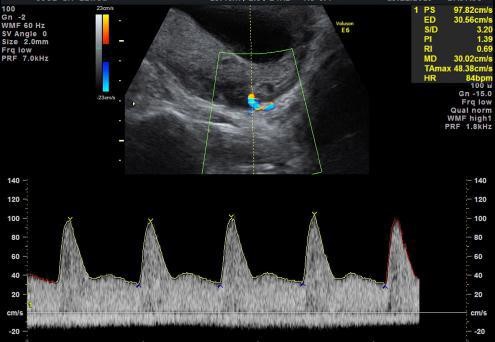
Đánh giá trở kháng động mạch tử cung trong tam cá nguyệt một được tiến hành trên siêu âm ngã bụng, trước tiên đặt đầu dò ở mặt cắt dọc giữa tử cung và cổ tử cung. Sử dụng chế độ Doppler màu, nghiêng nhẹ đầu dò sang hai bên để xác định động mạch tử cung là động mạch có dòng chảy tốc độ cao dọc theo hai bên cổ tử cung và tử cung (Hình 1). Cửa sổ Doppler xung nên được thu hẹp (cài đặt ở khoảng 2mm) và đặt ở một trong hai nhánh lên hoặc xuống của động mạch tử cung tại chỗ gần lỗ trong cổ tử cung nhất, với góc Doppler o24 (góc hợp bởi chùm tia siêu âm và trục dòng chảy). Để kiểm chứng có đúng là động mạch tử cung không thì vận tốc đỉnh tâm thu đo được phải > 60cm/s. Chỉ số PI được đo đạc khi thu hình được ít nhất ba dạng sóng giống nhau25,26. Phương pháp chi tiết hơn có thể tìm đọc ở phần kỹ thuật thực hành đã được đăng trong cuốn tạp chí này27. Khi thực hiện đúng theo hướng dẫn thì có thể đo đạc được PI động mạch tử cung ở hơn 95% các trường hợp25.
Hình 1: Siêu âm Doppler động mạch tử cung qua ngã bụng trong tam cá nguyệt một. Động mạch tử cung nằm cạnh bên lỗ trong cổ tử cung, ghi hình được ít nhất ba sóng giống nhau, chỉnh góc Doppler càng gần về 0o càng tốt.
Đánh giá trở kháng động mạch tử cung qua siêu âm ngã âm đạo cũng được thực hiện với nguyên tắc tương tự. Thai phụ nằm tư thế sản phụ khoa, bàng quang trống, đầu dò âm đạo đặt ở mặt cắt dọc giữa thấy được cổ tử cung. Di chuyển đầu dò dần về hai bên cho đến khi thấy được đám rối mạch máu quanh cổ tử cung, và động mạch tử cung được xác định ở ngang mức lỗ trong cổ tử cung. Lưu ý điều chỉnh góc Doppler o 28 khi đo đạc.
Khuyến cáo
Chuẩn hóa phương pháp, như đã được mô tả trong hướng dẫn này, để đánh giá đúng các chỉ số Doppler của động mạch tử cung (GOOD PRACTICE POINT).
Tuân thủ phương pháp được chuẩn hóa là điều cần thiết để đảm bảo các phép đo có độ tái lập (Ghi chú của người dịch: độ tái lập – Reproducibility, là giá trị đo đạc trên cùng một chủ thể ở các lần đo khác nhau với điều kiện đã bị thay đổi, điều kiện ở đây là thiết bị, phương pháp, người thực hiện hoặc khoảng cách thời gian dài). Các nghiên cứu đánh giá độ tái lập của kỹ thuật này cho thấy các hệ số tương quan nội bộ (intraclass correlation coefficient-ICC) hoặc hệ số tương quan Lin (concordance correlation coefficient) là 0,8 – 0,8529,30. Tuy nhiên, giới hạn của sự đồng thuận trong các nghiên cứu được ghi nhận chỉ cao khoảng ± 35% trong siêu âm ngã âm đạo và ± 40% trong siêu âm ngã bụng30. Do đó, độ tái lập chỉ được đánh giá ở mức thấp đến trung bình31. Bên cạnh những khác biệt do người thực hiện, các chỉ số doppler còn có thể thay đổi trong suốt thời gian đo đạc do các yếu tố như sự co bóp tử cung và thay đổi nhịp tim. Mặc dù không thể ngăn ngừa được tác động từ những yếu tố này, nhưng việc tuân thủ theo quy trình đã chuẩn hóa là điều bắt buộc để giảm thiểu nhiễu do người thực hiện, là lỗi hệ thống do đo đạc có thể ảnh hưởng đến tỉ lệ tầm soát dương32.
Lời khuyên về kỹ thuật
Bách phân vị thứ 95 của PI trung bình động mạch tử cung qua siêu âm ngã bụng ở tuổi thai 11 đến 13 tuần 6 ngày là 2,35 ( MỨC ĐỘ CHỨNG CỨ: 2+).
Trở kháng động mạch tử cung qua siêu âm ngã âm đạo cao hơn so với ngã bụng; bách phân vị thứ
95 của PI trung bình động mạch tử cung khi đo qua siêu âm âm đạo là 3,1 tương ứng với CRL ≤ 65mm, giá trị này giảm dần khi CRL càng tăng (MỨC ĐỘ CHỨNG CỨ: 2+).
PI động mạch tử cung có thể bị ảnh hưởng do các yếu tố từ mẹ như chủng tộc, BMI, tiền căn TSG trước đó (MỨC ĐỘ CHỨNG CỨ: 2++).
Khuyến cáo:
Các yếu tố từ mẹ được cho rằng có ảnh hưởng đến PI động mạch tử cung, do đó, bất cứ khi nào khả thi thì nên đưa chúng vào mô hình tầm soát kết hợp đa yếu tố, hơn là sử dụng chúng như một test độc lập với giá trị cut-off tuyệt đối (MỨC ĐỘ KHUYẾN CÁO: B).
Bách phân vị thứ 95 của PI trung bình động mạch tử cung qua siêu âm ngã bụng là khoảng 2,35 ứng với tuổi thai 11 đến 13 tuần 6 ngày25, trị số này không thay đổi25 hoặc chỉ giảm chút ít30 ở tuổi thai lớn hơn. Trong hai nghiên cứu so sánh30,33, siêu âm ngã âm đạo cho kết quả đo đạc cao hơn có ý nghĩa thống kê so với siêu âm ngã bụng, với giá trị PI trung bình là 1,98 so với 1,83333 và 1,6 so với 1,5230. Nguyên do có thể vì đầu dò âm đạo cho phép khoảng cách tiếp cận mạch máu gần hơn và góc Doppler nhỏ hơn30. Bách phân vị thứ 95 của PI trung bình động mạch tử cung qua siêu âm đầu dò âm đạo xấp xỉ 3,1 ứng với CRL≤ 65mm, giá trị này giảm dần tiệm cận với 2,36 ở CRL 84mm33.
Ở những thai phụ không biểu hiện TSG, PI động mạch tử cung có thể bị ảnh hưởng bởi các yếu tố từ mẹ, bao gồm chủng tộc (nguồn gốc châu Phi liên quan đến sự tăng trị số PI), BMI (giảm PI đi kèm với tăng BMI) và tiền căn TSG (liên quan với tăng PI)26. Mối liên quan giữa tăng BMI và giảm PI thì không rõ ràng; nguyên nhân tiềm ẩn có thể do tác dụng gây dãn mạch khi tăng nồng độ estrogen trong mạch máu tử cung ở những phụ nữ này26,34. Giá trị tuyệt đối của PI động mạch tử cung có thể không phản ánh chính xác trở kháng động mạch tử cung, do đó, các tác giả đề nghị rằng PI động mạch tử cung trong 3 tháng đầu thai kì nên được diễn đạt bằng giá trị trung vị MoM hơn là giá trị tuyệt đối35.
Khuyến cáo:
PI trung bình động mạch tử cung nên được chọn lựa là chỉ số Doppler để tầm soát ở tam cá nguyệt một (MỨC ĐỘ KHUYẾN CÁO: B).
Một trong những nghiên cứu sớm đã sử dụng phương pháp chuẩn để đánh giá Doppler động mạch tử cung trong 3 tháng đầu, PI trung bình > bách phân vị thứ 95 có độ nhạy phát hiện TSG là 27% và độ nhạy là 60% ở những trường hợp TSG cần chấm dứt thai kì trước 32 tuần25. Các nghiên cứu tiếp theo đã sử dụng giá trị thấp nhất của PI động mạch tử cung (tức là PI của bên động mạch có trở kháng nhỏ nhất) bởi vì các ước lượng điểm cho diện tích dưới đường cong (AUC) thì tốt hơn một chút khi sử dụng giá trị PI thấp nhất hơn là giá trị trung bình trong mô hình hồi qui (0,91 so với 0,90 cho TSG khởi phát sớm)36. Tuy nhiên, khoảng tin cậy cho các diện tích dưới đường cong thì bị trùng lấp, và ưu thế của giá trị PI thấp nhất cũng không được khẳng định bởi một nghiên cứu lớn nào khác (AUC là 0,79 với giá trị PI trung bình và 0,76 ở giá trị PI thấp nhất với kết cục là TSG khởi phát sớm)37. Cả hai kĩ thuật đều được chấp nhận, nhưng giá trị trung bình của PI động mạch tử cung là chỉ số được sử dụng nhiều nhất trong siêu âm Doppler ở tam cá nguyệt một và hai, và trở thành giá trị tham chiếu mặc định trên hầu hết các phần mềm thương mại đang được sử dụng.
Khuyết notch động mạch tử cung hai bên có liên quan với sự tăng 22 lần nguy cơ tiền sản giật và tăng gần gấp 9 lần nguy cơ thai nhỏ so với tuổi thai (SGA)38; tuy nhiên, nó cũng có thể được quan sát thấy ở khoảng 50% thai phụ ở 11 đến 13 tuần 6 ngày19,25,39. Do vậy, chỉ dấu này có độ đặc hiệu rất thấp đối với tiền sản giật.
Một phân tích gộp mới đây đã báo cáo rằng siêu âm Doppler động mạch tử cung ở tam cá nguyệt một có thể tiên đoán 47,8% các trường hợp TSG khởi phát sớm (tỉ lệ dương giả 7,9%), 39,2% trường hợp thai chậm tăng trưởng sớm (tỉ lệ dương giả 6,7%) và 26,4% trường hợp TSG ở bất kì tuổi thai (tỉ lệ dương giả 6,6%), khi sử dụng giá trị cut-off ở bách phân vị thứ 90 của PI hoặc RI40. Tuy nhiên, tầm soát kết hợp (bao gồm các yếu tố từ mẹ, huyết áp động mạch trung bình, Doppler động mạch tử cung và định lượng PlGF) có hiệu suất tiên đoán vượt trội hơn (sẽ được mô tả chi tiết ở phía sau), và nếu có thể thì nên được thực hiện hơn là chỉ tầm soát dựa trên siêu âm Doppler.
Tam cá nguyệt hai
Siêu âm Doppler động mạch tử cung ở tam cá nguyệt hai có thể tiến hành qua ngã bụng hoặc âm đạo tùy thuộc vào cơ sở thực hành và công cụ sẵn có (GOOD PRACTICE POINT).
Trở kháng động mạch tử cung có thể được đánh giá qua siêu âm ngã bụng hoặc âm đạo. Kĩ thuật tương tự như khi thực hiện ở tam cá nguyệt một, điểm khác biệt chủ yếu là hai động mạch tử cung trái và phải được xác định tại vị trí bắt chéo với các động mạch chậu ngoài, hơn là vùng cạnh cổ tử cung. Sau khi đã nhận diện đúng động mạch tử cung thì sử dụng Doppler xung để thu được ít nhất ba dạng sóng liên tiếp giống nhau, rồi đo PI và ghi nhận có hiện diện hay không khuyết notch đầu tâm trương41.
Ở kĩ thuật siêu âm qua ngã âm đạo, thai phụ nằm ở tư thế sản phụ khoa sau khi đã làm trống bàng quang. Đầu dò được đưa vào cùng đồ trước, xác định cổ tử cung trên mặt cắt doc giữa. Sau đó di chuyển đầu dò sang cùng đồ bên và sử dụng Doppler màu để xác định các động mạch tử cung ở vị trí cạnh lỗ trong cổ tử cung. Doppler xung dùng để thu ba dạng sóng giống nhau liên tiếp, đo PI và RI, ghi nhận có hiện diện hay không khuyết notch đầu tâm trương17. Việc thực hiện đúng kĩ thuật như trên thì có thể đánh giá được Doppler động mạch tử cung ở 99% phụ nữ42.
Cũng giống như khi thực hiện ở tam cá nguyệt một, cho dù là cách tiếp cận qua ngã bụng hay âm đạo thì vẫn phải đảm bảo góc Doppler o và vận tốc đỉnh tâm thu > 60cm/s để chắc chắn đó là động mạch tử cung chứ không phải các động mạch cung24.
Lời khuyên về kỹ thuật
Cũng tương tự tam cá nguyệt một, trở kháng động mạch tử cung ở tam cá nguyệt hai cao hơn khi đo qua siêu âm ngã âm đạo (MỨC ĐỘ CHỨNG CỨ: 2++).
Bách phân vị thứ 95 của PI trung bình động mạch tử cung là 1,44 qua siêu âm ngã bụng và 1,58 qua ngã âm đạo ở tuổi thai 23 tuần (MỨC ĐỘ CHỨNG CỨ: 2+).
Bách phân vị thứ 95 của PI trung bình động mạch tử giảm đi khoảng 15% ở giai đoạn 20 – 24 tuần và
Khuyến cáo
PI trung bình động mạch tử cung nên được sử dụng để tiên đoán TSG. Trong trường hợp bánh nhau nằm ở một bên, PI tăng một bên cũng không làm tăng nguy cơ TSG nếu PI trung bình nằm trong giới hạn bình thường (MỨC ĐỘ KHUYẾN CÁO: B).
Tương tự ở tam cá nguyệt một, khi khảo sát Doppler động mạch tử cung qua ngã âm đạo, giá trị PI đo được cao hơn so với khi tiếp cận qua ngã bụng. Trong một báo cáo loạt ca so sánh 96 thai phụ từ 20 đến 26 tuần,
PI trung bình động mạch tử cung là 1,07 trên siêu âm ngã âm đạo và 0,96 qua ngã bụng. Góc Doppler trung vị thấp hơn khi thực hiện siêu âm bằng ngã âm đạo (10,0o so với 17,5o); tuy nhiên, PI là một tỉ lệ, nhiều khả năng nguyên do của sự khác biệt giá trị trên siêu âm ngã bụng và âm đạo là do sự khác biệt về vị trí giải phẫu.
Cả hai kĩ thuật đều có độ tái lập tương tự nhau (hệ số tương hợp, 0,86 và 0,81; giới hạn của sự đồng thuận ± 35%)30.
Bách phân vị thứ 95 của PI trung bình động mạch tử cung ở 23 tuần khi đo qua ngã bụng là 1,4441, và qua ngã âm đạo là 1,5843. Bách phân vị thứ 95 của PI trung bình động mạch tử cung giảm đi khoảng 15% giữa 20 và 24 tuần, và giảm đi 44.
Trong trường hợp bánh nhau bám một bên, trở kháng dòng chảy động mạch tử cung ở phía đối bên thường tăng lên. Tuy vậy, sự tăng PI một bên có vẻ như không liên quan với nguy cơ TSG cao hơn nếu PI trung bình vẫn nằm trong giới hạn bình thường45.
Hiệu suất dự đoán TSG ở tam cá nguyệt hai.
Doppler động mạch tử cung có hiệu suất dự đoán tốt hơn đối với TSG khởi phát sớm; một nghiên cứu ở hơn 32000 thai phụ đã chỉ ra rằng, với tỉ lệ dương giả 10% thì chỉ riêng PI động mạch tử cung có thể tiên đoán được 85% TSG khởi phát sớm, so với 48% số ca TSG khởi phát muộn khi kết hợp với các yếu tố từ mẹ46. Hơn nữa, nguy cơ khởi phát sớm TSG có vẻ như tăng lên cùng với sự tăng trở kháng động mạch tử cung; PI trung bình 1,6 ứng với tỉ số khả dĩ dương (likelihood ratioLR+, là tỉ số giữa xác suất kết quả test dương ở nhóm bệnh và xác suất kết quả test dương ở nhóm không bệnh) là 3,07, PI trung bình 1,8 thì LR+ là 8,0 và PI trung bình 2,2 thì LR+ là 27,08 (đo qua ngã âm đạo)46. Nhìn chung, siêu âm Doppler động mạch tử cung có khuynh hướng dự đoán tốt hơn những ca bệnh nặng và có biến chứng. Chẳng hạn như, PI trung bình > 1,65(trên siêu âm ngã âm đạo) được chứng minh là dự đoán được 41% tất cả các trường hợp TSG, nhưng khi phân tích các nhóm nhỏ hơn thì tỉ lệ dự đoán là 69% cho TSG với thai chậm tăng trưởng và 24% TSG với thai phát triển bình thường17. Điều này có thể được giải thích bởi thực tế rằng sự khiếm khuyết của bánh nhau gây nên trở kháng cao của động mạch tử cung, đồng thời cũng ảnh hưởng xấu lên sự tăng trưởng của thai.
Khuyết notch tâm trương trên phổ Doppler của động mạch tử cung hai bên có liên quan với sự tăng nguy cơ TSG17,41,42,46,47. Tuy nhiên, với cùng tỉ lệ dương giả, thì PI động mạch tử cung có độ nhạy tốt hơn khuyết notch, nên không cần thiết diễn giải sự hiện diện thêm vào của chúng cho việc tầm soát42, dù không phải tất cả các nghiên cứu đều ủng hộ việc này47.
Về mặt sức khỏe của mẹ, một nghiên cứu trên 491 thai phụ được tiến hành siêu âm tim qua thành ngực vào thời điểm tầm soát TSG ở tam cá nguyệt hai cho thấy rằng, những thai phụ có PI trung bình động mạch tử cung > bách phân vị thứ 90 (trong nghiên cứu này là 1,25) thì có tỉ lệ khiếm khuyết chức năng tim mạch (4,4%) mà trước đó không được chẩn đoán, cao hơn so với nhóm có PI trung bình động mạch tử cung bình thường (0,3%). Tỉ lệ hiện mắc này đặc biệt cao ở nhóm thai phụ nhập cư48.
Tam cá nguyệt ba
Lời khuyên về kỹ thuật
Mặc dù Doppler động mạch tử cung có thể được đánh giá qua ngã âm đạo, nhưng phương thức đánh giá thường được sử dụng nhất trong tam cá nguyệt ba là qua siêu âm ngã bụng (MỨC ĐỘ CHỨNG CỨ: 4).
Bách phân vị thứ 95 của PI trung bình động mạch tử cung là 1,17 khi đo qua siêu âm ngã bụng ở 30 – 34 tuần (MỨC ĐỘ CHỨNG CỨ: 2+).
Khuyến cáo
Hiện tại không có thử nghiệm ngẫu nhiên có nhóm chứng nào về tác động của việc tầm soát TSG ở tam cá nguyệt ba lên kết cục của mẹ, thai và sơ sinh; do đó, việc tầm soát ở giai đoạn này thì chưa được khuyến cáo đưa vào thực hành lâm sàng thường quy (GOOD PRACTICE POINT).
PI trung bình động mạch tử cung nên được sử dụng để tiên đoán TSG, nếu được đề nghị thực hiện ở tam cá nguyệt ba (MỨC ĐỘ KHUYẾN CÁO: B).
Phương thức chuẩn để đánh giá Doppler động mạch tử cung trong tam cá nguyệt ba là siêu âm qua ngã bụng tương tự như ở tam cá nguyệt hai24,41.
Trong một nghiên cứu lớn đa trung tâm ở Anh, bách phân vị thứ 90 và 95 của PI trung bình động mạch tử cung từ 30 đến 34 tuần 6 ngày tương ứng là 1,03 và 1,1749. Chỉ riêng PI trung bình động mạch tử cung > bách phân vị thứ 95 (tỉ lệ dương giả 5%) có thể tiên đoán 54% trường hợp TSG khởi phát trước 37 tuần và 14% số ca TSG ≥ 37 tuần. Tỉ lệ tương ứng cho PI trung bình > bách phân vị thứ 90 (tỉ lệ dương giả 10%) là 68% và 14%49. Tương tự như vậy, khi đánh giá hiệu quả tầm soát ở giai đoạn 35 – 37 tuần, người ta nhận thấy rằng Doppler động mạch tử cung đơn độc là yếu tố tiên đoán TSG kém; ngay cả khi nó đã được kết hợp với các yếu tố từ mẹ, thì tỉ lệ phát hiện chỉ 26% với tỉ lệ dương giả 5% và 37% với dương giả 10%50.
Đảo ngược sóng tâm trương động mạch tử cung được báo cáo lẻ tẻ trong một số ca có tình trạng suy chức năng bánh nhau ở tam cá nguyệt ba, có liên quan với kết cục bất lợi, chẳng hạn như tiến triển thành sản giật hoặc thai chết lưu trong tử cung51,52.
Sự thay đổi các chỉ số doppler theo thời gian
Lời khuyên về kỹ thuật
Tăng trở kháng động mạch tử cung tồn tại kéo dài từ tam cá nguyệt một đến tam cá nguyệt hai có thể giúp xác định thai phụ có nguy cơ TSG cao nhất (MỨC ĐỘ CHỨNG CỨ: 2++).
Khuyến cáo
Các chiến lược phòng ngừa (chẳng hạn như dùng aspirin liều thấp) để giảm thiểu nguy cơ TSG có hiệu quả nếu sử dụng ngay từ tam cá nguyệt một, và nên bắt đầu càng sớm càng tốt ở những phụ nữ đã được xác định là có nguy cơ cao, không cần phải chờ đợi việc đánh giá sự tiến triển của Doppler ở tam cá nguyệt hai (GOOD PRACTICE POINT).
Cũng giống như phép đo các chỉ số Doppler cắt ngang ở một thời điểm, sự thay đổi của chúng theo thời gian đã được nghiên cứu về khả năng dự đoán TSG. Một nghiên cứu đánh giá Doppler động mạch tử cung tuần tự từ 11 – 14 tuần đến 19 – 22 tuần (n=870) đã báo cáo rằng 73% số ca có tăng PI ở tam cá nguyệt một đã trở lại bình thường vào tam cá nguyệt hai. Những thai phụ có tăng PI trong cả tam cá nguyệt một và hai thì có nguy cơ cao nhất (37,5%) có kết cục thai kì xấu, nghĩa là có thai chậm tăng trưởng hoặc tăng huyết áp thai kì. Ngược lại, các thai phụ có PI bình thường ở tam cá nguyệt một thì có 95% cơ hội cũng bình thường ở tam cá nguyệt hai, và nằm trong nhóm có tỉ lệ gặp kết cục bất lợi thấp nhất (5,3%)53.
Một chỉ số khác được kiểm nghiệm là sự khác biệt giữa PI động mạch tử cung ở tam cá nguyệt một và hai, cả hai đều được thể hiện bằng MoM để tương ứng với tuổi thai. Khoảng cách tăng lên của PI MoM động mạch tử cung giữa tam cá nguyệt một và hai, phản ánh sự khiếm khuyết trong biến đổi động mạch xoắn, có vẻ là yếu tố tiên đoán chính xác nhất đối với TSG khởi phát sớm (AUC, 0,85) và sinh non (AUC, 0,79)54. Một nghiên cứu khác trên 104 thai phụ có tăng PI động mạch tử cung ở 20 – 22 tuần báo cáo rằng những phát hiện bất thường tồn tại đến 26 – 28 tuần trong 59,6% trường hợp; những thai phụ có PI tăng kéo dài thì có nguy cơ cao hơn đối với TSG (16% so với 1%), thai nhỏ so với tuổi thai – SGA (32% so với 1%) và trẻ sơ sinh phải nhập ICU (26% so với 4%), khi so sánh với các thai phụ có PI bình thường55.
Một vấn đề đặt ra đối với việc đánh giá Doppler tuần tự theo tuổi thai là cửa sổ cơ hội cho điều trị dự phòng (tức là tuổi thai
Thể tích bánh nhau
Khuyến cáo
Mặc dù thể tích bánh nhau và các chỉ số mạch máu đã được đánh giá là những yếu tố tiên đoán TSG, nhưng không khuyến cáo sử dụng chúng cho mục đích tầm soát vì độ tái lập bị hạn chế, đòi hỏi trang thiết bị đặc biệt và khá tốn thời gian (GOOD PRACTICE POINT).
Ngay sau khi siêu âm ba chiều được giới thiệu thì đo thể tích bánh nhau ở tam cá nguyệt một đã được kiểm nghiệm như một yếu tố dự đoán tiềm năng cho TSG. Ở một trong số các nghiên cứu khởi đầu, thể tích bánh nhau đo lúc 12 tuần được so sánh với việc đánh giá Doppler động mạch tử cung ở 22 tuần; hiệu suất tiên đoán của cả hai phương thức tương ứng là: 20% và 28% đối với TSG không có tình trạng thai nhỏ; 31% và 46% với TSG có thai nhỏ; 50% và 50% với TSG khởi phát sớm56. Tương tự, hiệu suất dự đoán của thể tích bánh nhau có thể sánh ngang với PI trung bình động mạch tử cung ở tam cá nguyệt một đối với TSG (56% và 50%) và TSG cần chấm dứt thai kì trước 32 tuần (67% và 67%)57. Tuy nhiên, những điều này thì chưa được xác nhận lại bởi các nghiên cứu khác58,59. Các chỉ số phân bố mạch máu trên bánh nhau ba chiều cũng đã được đánh giá58-62; tuy vậy, chúng có thể bị ảnh hưởng bởi sự suy giảm độ sâu, giao diện bề mặt mô, việc sử dụng các cài đặt siêu âm khác nhau và sự thiếu độ tái lập (hệ số tương quan nội bộ tương ứng là 63, tất cả những điều này đã hạn chế khả năng áp dụng vào lâm sàng.
Mặc dù việc đo đạc thể tích bánh nhau có độ tái lập tốt64,65, các giá trị bình thường cũng có sự khác biệt đáng kể (thể tích bánh nhau đo ở tam cá nguyệt một thay đổi trong phạm vi từ 45 đến 74mL59,61,64-66). Hơn thế nữa, việc tính toán thể tích bánh nhau hiện tại không được thực hiện chủ động, thường quy, khá tốn thời gian67.
Chiến lược tầm soát kết hợp
Khuyến cáo
Sự kết hợp giữa các yếu tố từ mẹ, huyết áp động mạch mẹ, Doppler động mạch tử cung và lượng PIGF lúc 11 – 13 tuần là mô hình tầm soát có hiệu quả nhất nhằm xác định những phụ nữ có nguy cơ TSG (MỨC ĐỘ KHUYẾN CÁO: B).
Vì tầm soát kết hợp có tính ưu việt vượt trội nên nếu có thể thực hiện kết hợp được thì tránh sử dụng giá trị cut-offs của các trị số Doppler như là phương thức tầm soát độc lập (MỨC ĐỘ KHUYẾN CÁO: B).
Siêu âm qua ngã bụng được ưa chuộng để đánh giá yếu tố nguy cơ cùa bệnh nhân trong tam cá nguyệt 1, như hầu hết các thuật toán tầm soát khác cũng sử dụng ngã siêu âm này (GOOD PRACTICE POINT).
Các yếu tố nguy cơ của mẹ (tiền sử bệnh lý, nhân khẩu học, vấn đề tim mạch – chuyển hóa) và các chỉ dấu từ bánh nhau (trở kháng động mạch tử cung và dấu ấn sinh học) đối với sự tiến triển TSG cần phải được xác định. Khuynh hướng hiện tại trong tầm soát là kết hợp sự hiện diện hoặc không của nhiều yếu tố nguy cơ để từ đó tính toán ra mức nguy cơ của từng cá nhân riêng biệt, sau đó điều chỉnh việc quản lý cho thích hợp, cũng tương tự như trong tầm soát bất thường nhiễm sắc thể11. Mục đích của tầm soát kết hợp trong một cỡ mẫu nhất định là nhằm cải thiện độ nhạy của từng chỉ dấu đơn, đồng thời giảm tỉ lệ dương tính giả.
Tầm soát kết hợp là chủ đề của gần 400 bài báo đăng trên PubMed tính đến tháng tư năm 2018. Nhiều nghiên cứu đã chỉ ra rằng những phụ nữ tiếp tục tiến triển khởi phát TSG so với những phụ nữ không bị thì có huyết áp động mạch cao hơn68, nồng độ sFlt-1 cao hơn69,70 (một loại protein kháng tạo mạch máu hòa tan trong huyết thanh mẹ), nồng độ AFP cao hơn71, nồng độ PAPP-A72 và PIGF70,73 thấp hơn, cùng với trở kháng động mạch tử cung tăng lên74. Hiệu suất dự đoán của tất cả những yếu tố này đối với TSG khởi phát sớm tốt hơn so với TSG khởi phát muộn9,70, và tốt hơn khi được đánh giá ở thời điểm 11 – 13 tuần68-71,73-75.
Các dữ liệu thu thập được từ việc theo dõi gần 36000 phụ nữ mang đơn thai đã cho thấy rằng, ở tỉ lệ dương giả 10%, chỉ riêng các yếu tố từ mẹ (bao gồm tuổi, cân nặng, chủng tộc, tiên căn sản khoa nội khoa và thuốc lá) có thể tiên đoán 49% trường hợp TSG 9. Qui trình thực hiện tương tự được tiến hành trong thử nghiệm ASPRE21,76; trong thử nghiệm này, tầm soát kết hợp rồi theo dõi sau khi cho các đối tượng nguy cơ cao dùng ngẫu nhiên aspirin hoặc giả dược. Việc phối hợp các yếu tố của mẹ, huyết áp động mạch trung bình, trị số trung bình của PI động mạch tử cung và PlGF đạt tỉ lệ phát hiện TSG 77; tuy nhiên, tác động của chúng trong tầm soát tam cá nguyệt một thì chưa được đánh giá trong các nghiên cứu tiền cứu.
Tương tự như ở tam cá nguyệt một, tam cá nguyệt hai sử dụng mô hình phối hợp PI động mạch tử cung, các yếu tố từ mẹ (gồm BMI, chủng tộc, tiền sử sản khoa, hút thuốc lá, phương pháp ngừa thai, tiền sử nội khoa) và huyết áp động mạch trung bình có thể phát hiện gần như 100% những thai phụ sẽ khởi phát TSG sớm với tỉ lệ dương giả là 10%; độ nhạy đối với TSG muộn và tăng huyết áp thai kì tương ứng là 56,4% và 54,1%78.
Trong tam cá nguyệt ba, sự kết hợp các yếu tố từ mẹ và nồng độ sFlt-1 có thể dự đoán 83% và 38% TSG trước và sau 37 tuần, với tỉ lệ dương giả 5%; các con số tương ứng với tỉ lệ dương giả 10% là 94% và 51%79. Việc tầm soát trước ở tam cá nguyệt một và/hoặc tam cá nguyệt hai không làm cải thiện hơn nữa độ chính xác trong dự đoán so với việc thực hiện tầm soát đơn độc ở tam cá nguyệt ba79. Nguồn gốc chủng tộc có ảnh hưởng đến độ nhạy và tỉ lệ dương giả của việc dự đoán ở tam cá nguyệt ba, hai con số này đều cao hơn ở những phụ nữ gốc Phi sống tại vùng Caribbean80. Yếu tố từ mẹ và các dấu ấn sinh học trở nên quan trọng hơn trong dự đoán TSG muộn. Như vậy, trong số vài yếu tố tiềm năng thì huyết áp động mạch trung bình, PlGF và sFlt-1 là có liên quan với việc dự đoán TSG ở tuổi thai 30 – 34 tuần81 và 35 – 37 tuần82. Ngược lại, việc đánh giá thêm PI động mạch tử cung và các thông số về tim mạch của mẹ cũng không cải thiện được khả năng dự đoán TSG sau 35 – 36 tuần tuổi thai83. Tỉ số sFlt-1/PlGF được xem là một dấu ấn sinh học độc lập có thể tiên đoán hơn 75% số ca sẽ khởi phát TSG trong vòng 4 tuần tới, độ nhạy của tỉ số này thì cao hơn đáng kể ở tuổi thai 31 – 34 tuần so với 35 – 37 tuần (tỉ lệ dương giả 1,7% so với 9,6%)84.
Hiệu suất của mô hình tầm soát kết hợp được sử dụng trong thử nghiệm ASPRE (yếu tố của mẹ, huyết áp động mạch trung bình, trị số trung bình của PI động mạch tử cung, PlGF) thực chất cũng giống như khi áp dụng cho tập dữ liệu dùng cho thử nghiệm lâm sàng hiện thời9,76. Trên thực tế, mô hình tầm soát này được chứng minh là tiên đoán TSG sớm có hiệu quả hơn so với các phương thức tầm soát cũ trong quá khứ được đề xuất bởi Hội sản phụ khoa Hoa Kỳ và Viện chăm sóc sức khỏe vương quốc Anh22,86.
Đánh giá huyết động của thai phụ
Khuyến cáo
Mặc dù việc đánh giá huyết động của mẹ có thể có giá trị trong tiên đoán TSG, nhưng vẫn còn quá ít dữ liệu ủng hộ cho việc thực hiện thường quy trong thực hành lâm sàng như một xét nghiệm độc lập (GOOD PRACTICE POINT).
Sự đáp ứng của hệ thống tim mạch đóng một vai trò hết sức quan trọng khi có thay đổi huyết động ở những thai kì bình thường. Khi đáp ứng này thất bại, dù chỉ là những rối loạn chức năng tim mạch dưới lâm sàng không đủ biểu hiện thành triệu chứng, thì cũng có liên quan với nguy cơ tiến triển thành TSG87-89. Những phụ nữ bị TSG có các yếu tố nguy cơ về tim mạch trong thai kì, chứng tỏ độ cứng thành động mạch tăng lên và chức năng tim bị suy yếu tại thời điểm chẩn đoán, cũng như vài tuần trước khi xuất hiện triệu chứng bệnh lý trên lâm sàng và vài tháng sau khi có dấu hiệu có thai90-101. Những hệ lụy liên quan vấn đề tim mạch trong TSG xuất hiện và còn tiếp diễn trong một thời gian dài, biểu hiện bởi tình trạng suy yếu kéo dài chức năng tâm thu hai thất và chức năng nội mạc mạch máu, và bởi sự tăng nguy cơ mắc bệnh về tim mạch trong đời sống sau này104-106. Ở những phụ nữ mắc TSG/sản giật nặng thì tỉ lệ mắc các bệnh lý tim mạch nguy hiểm về sau cao hơn 5,4 lần105. Hơn thế nữa, khi so sánh với các phụ nữ không có bệnh tái phát, thì những phụ nữ khởi phát TSG ở lần mang thai kế tiếp có khuynh hướng thay đổi các thông số tim mạch giữa các thai kì, điều này có thể cản trở sự thích ứng bình thường của họ ở thai kì tiếp theo107.
Thông số huyết động đơn giản nhất được thiết lập trong mô hình tầm soát kết hợp chính là huyết áp động mạch trung bình9,76,78,108. Ngoài ra, độ cứng thành động mạch có thể được ước tính bằng siêu âm và thông số này có sự khác biệt có ý nghĩa giữa những thai phụ mắc TSG và những thai phụ bình thường. Trong tổng quan hệ thống y văn của 23 nghiên cứu đánh giá độ cứng thành mạch liên quan với bệnh lý tăng huyết áp thai kì90, cho thấy rằng, thai phụ mắc TSG có tăng độ cứng thành mạch cả trong và sau thời kì mang thai, và với mức độ cao hơn so với những người chỉ bị tăng huyết áp thai kì. TSG càng trầm trọng thì sự liên quan với độ cứng thành mạch càng lớn90. Phân tích vận tốc sóng mạch (ghi chú của người dịch: pulse-wave velocity, là vận tốc lan truyền của sóng áp lực dọc theo thành động mạch chủ và các động mạch lớn trong suốt chu chuyển tim, là tiêu chuẩn vàng đánh giá độ cứng thành mạch) thấy rằng chỉ số này cũng được ghi nhận thấy cao hơn trong giai đoạn dưới lâm sàng (sớm nhất là 11 tuần) ở những phụ nữ sẽ tiến triển đến TSG về sau91,92. Các nghiên cứu cắt ngang và dọc đã chứng minh rằng các chỉ số độ cứng thành mạch có thể được sử dụng như một test tầm soát sớm ngay từ tuổi thai 11 tuần, để dự đoán sự tiến triển tiếp theo của TSG khởi phát sớm hay muộn, đặc biệt là khi kết hợp với các yếu tố khác từ mẹ, chẳng hạn như áp suất tâm thu động mạch trung tâm91,92.
Cung lượng tim cao hơn một cách đáng kể tại thời điểm 11 – 13 tuần ở những phụ nữ có tăng huyết áp thai kì hoặc khởi phát TSG sau đó, so với những phụ nữ không có biến chứng nào trong thai kì94. Khi phối hợp với các yếu tố khác của mẹ, với tỉ lệ dương giả 10%, thì tỉ lệ phát hiện là 43,4% đối với tất cả các dạng TSG, 52% đối với TSG không kèm thai nhỏ và 23,3% đối với tăng huyết áp thai kì94. Ở những phụ nữ có biểu hiện TSG sau đó thì có bằng chứng cho thấy có hiện tượng tái cấu trúc trung tâm thất trái xảy ra vào giữa thai kì97.
Mặc dù thực tế là các yếu tố về huyết động của mẹ là những chỉ dấu tầm soát đầy hứa hẹn đối với TSG, nhưng một phương thức tiếp cận kết hợp có tính đến đặc điểm của mẹ và các dấu ấn sinh học thì rất cần thiết để đạt được một mô hình tiên đoán hữu ích cho lâm sàng. Trong lúc này, việc đánh giá huyết động của mẹ được thực hiện ngày càng nhiều trong các nghiên cứu về TSG, điều bắt buộc là các thiết bị và kĩ thuật liên quan cần được sử dụng thích hợp trong dân số các thai phụ111.
Quản lý thai kì sau khi tầm soát
Khuyến cáo
Có bằng chứng thuyết phục rằng việc sử dụng aspirin liều thấp có thể làm giảm một cách đáng kể nguy cơ khởi phát TSG sớm, việc chỉ định dùng thuốc nên bắt đầu sau khi tầm soát ở tam cá nguyệt một (MỨC ĐỘ KHUYẾN CÁO: A).
Tam cá nguyệt một
Hiện nay, Hội sản phụ khoa Hoa Kì (ACOG)112, Viện chăm sóc sức khỏe quốc gia Vương quốc Anh (NICE)113 và Hiệp hội sản phụ khoa Canada (SOGC)114, khuyến cáo chỉ định aspirin liều thấp bắt đầu trước tuần 16 đối với những thai phụ có nguy cơ suy giảm chức năng bánh nhau.
Các khuyến cáo hiện tại trong hầu hết các nghiên cứu đã phân loại các thai phụ là nguy cơ cao dựa theo tiền sử hoặc yếu tố y khoa khác, hơn là sử dụng các phương pháp tầm soát (chẳng hạn các yếu tố của mẹ, Doppler và chỉ số hóa sinh). Trong thử nghiệm ASPRE, 1776 thai phụ có nguy cơ cao TSG dựa trên tầm soát ở tam cá nguyệt một sẽ được chỉ định ngẫu nhiên aspirin (150mg mỗi ngày trước khi đi ngủ) hoặc giả dược, từ tuổi thai 11 – 14 tuần đến 36 tuần10. Liều dùng 150mg được chọn lựa với bằng chứng rằng một tỉ lệ đáng kể (10 – 30%) các bệnh nhân có đề kháng với những liều thấp 115, và dữ liệu in-vitro cho thấy rằng liều thuốc tối ưu để cải thiện chức năng nguyên bào nuôi là tương đương 150mg in vivo116. Dựa trên dữ liệu về tác dụng đáp ứng suốt một ngày của aspirin, thời điểm được chỉ định dùng thuốc để đạt hiệu quả tối ưu là khoảng thời gian buổi tối trước giờ đi ngủ117. Thử nghiệm ASPRE nhận thấy rằng aspirin làm giảm nguy cơ TSG trước 37 tuần đến 62% (từ 4,3% xuống 1,6%). Aspirin cũng làm giảm nguy cơ TSG trước 34 tuần đến 82%, nhưng tác dụng này chưa đạt mức ý nghĩa thống kê bởi tỉ lệ tuyệt đối thấp (0,4% so với 1,8%)10. Hiệu quả của aspirin còn phụ thuộc vào độ tuân thủ của người dùng, với mức giảm nguy cơ lớn nhất được quan sát thấy ở những phụ nữ tuân thủ dùng thuốc ≥ 90%118.
Tầm soát ở tam cá nguyệt một và can thiệp bằng aspirin dường như có hiệu quả về mặt kinh tế, kết hợp với phòng ngừa một tỉ lệ đáng kể các trường hợp khởi phát sớm sẽ tiết kiệm được chi phí cho hệ thống y tế119.
Tam cá nguyệt hai
Việc tiên đoán TSG ở tam cá nguyệt hai ít ra cũng có độ nhạy gần như ở tam cá nguyệt một70,78, nhưng giá trị thì bị hạn chế do không có sự can thiệp hiệu quả ở tuổi thai này. Trong khi aspirin bắt đầu dùng ở tam cá nguyệt một có vẻ giảm được sự hình thành TSG120,121, thì sự can thiệp tương tự dường như không hề có hiệu quả khi bắt đầu sau 20 tuần120. Mặc dù đã quá trễ để ngăn ngừa TSG sau khi dự đoán ở tam cá nguyệt hai, nhưng điều đó vẫn hữu ích cho việc theo dõi và quản lý các thai kì có nguy cơ122,123. Tuy vậy, việc tăng cường theo dõi trên lâm sàng vẫn chưa được cải thiện. Một thử nghiệm ngẫu nhiên có nhóm chứng tại Tây Ban Nha chia 11667 thai phụ có siêu âm định kì ở tam cá nguyệt hai thành hai nhóm có hoặc không thực hiện Doppler. Người ta nhận thấy rằng thực hiện Doppler giúp xác định 60% các thai phụ sẽ khởi phát TSG, thế nhưng, việc tăng cường chăm sóc họ không dẫn đến kết quả tốt hơn cho mẹ và cho kết cục chu sinh khi so sánh với những thai phụ không được tiến hành Doppler ở tam cá nguyệt hai124.
Tam cá nguyệt ba
Đánh giá ở tam cá nguyệt ba có thể xác định phần lớn các thai phụ sẽ khởi phát TSG trong vài tuần kế tiếp80,125. Nó được mô tả như một phần của kế hoạch đánh giá nguy cơ tập trung chủ yếu vào việc phát hiện sớm, bao gồm việc tầm soát chi tiết ở tam cá nguyệt một để phân tầng các biến chứng sản khoa lớn, rồi sau đó tầm soát lại dựa trên việc tái đánh giá nguy cơ ở mỗi lần thăm khám125,126. Chiến lược này là chủ đề của nghiên cứu đang được tiến hành.
Đa thai
Khuyến cáo
Do tình trạng khối lượng bánh nhau tăng lên trong song thai, dẫn đến kết quả trở kháng trung bình của động mạch tử cung thấp hơn, nên khi thực hiện Doppler thì nên sử dụng bảng tham chiếu chuyên biệt cho thai đôi nếu có thể (MỨC ĐỘ KHUYẾN CÁO: B).
Chiến lược tầm soát kết hợp (các yếu tố của mẹ, PI động mạch tử cung, huyết áp động mạch trung bình, PlGF) cho đơn thai cũng có thể sử dụng trong song thai và việc làm này có thể xác định hơn 95% thai phụ có nguy cơ khởi phát TSG. Tuy nhiên, người thực hiện tầm soát cần lưu ý rằng để đạt được điều này thì phải có tỉ lệ tầm soát dương (screen – positive rate) là 75% (MỨC ĐỘ KHUYẾN CÁO: B).
Song thai là một yếu tố nguy cơ cho các biến chứng sản khoa, trong đó có TSG127. Khối lượng bánh nhau tăng lên trong song thai đưa đến kết quả trở kháng trung bình động mạch tử cung thấp hơn so với trong đơn thai ở cùng tuổi thai128-131, điều này đã có thể quan sát được ngay từ tam cá nguyệt một128,132. Do đó, việc sử dụng bảng tham chiếu cho đơn thai, có giá trị cao hơn trong song thai, có thể làm giảm độ nhạy của Doppler. Một nghiên cứu đã tiến hành so sánh và đưa ra báo cáo rằng khi dùng bảng tham chiếu đôi cho trường hợp song thai thì kết quả độ nhạy là 36,4% với tỉ lệ dương giả 12%; còn nếu sử dụng trị số cut-offs tiêu chuẩn đơn thai thì độ nhạy sẽ là 18% với tỉ lệ dương giả 1,7%130.
Ngoại trừ những trường hợp có biến chứng truyền máu song thai, PI trung bình của động mạch tử cung trong tam cá nguyệt một cao hơn ở 46% song thai có TSG khởi phát sớm và 22% khởi phát muộn, khi so với những thai kì song thai không biến chứng128.
Trong một nghiên cứu các song thai hai bánh nhau từ 17 đến 38 tuần, bách phân vị thứ 95 của PI động mạch tử cung đo qua siêu âm ngã bụng là 1,21 ở 21 tuần, 1,16 ở 22 tuần, 1,13 ở 23 tuần và 1,09 ở 24 tuần133. Khi siêu âm qua ngã âm đạo, giá trị cut-offs của PI động mạch tử cung là 1,5 ở 22 – 24 tuần có độ nhạy phát hiện TSG là 33,3% với 3,3% dương tính giả (song thai một và hai bánh nhau)129.
Về mặt lý thuyết, bánh nhau có tác động lên mức độ thích ứng của tình trạng huyết động ở tử cung, bởi vì song thai một nhau và hai nhau thì có khối lượng và cấu trúc bánh nhau rất khác biệt. Thật vậy, một mô hình phân tích về thời gian sống còn đã tính toán được rằng, trên một cỡ mẫu dân số tham chiếu đã chuẩn hóa về các đặc tính của thai phụ, thì nguy cơ TSG 127. Một nghiên cứu tiến hành ở tam cá nguyệt một báo cáo trở kháng động mạch tử cung ở song thai một bánh nhau thì cao hơn ở song thai hai bánh nhau; trên thực tế thì song thai một bánh nhau có trở kháng tương tự như ở đơn thai132.
Cũng giống như ở đơn thai, việc thực hiện tầm soát kết hợp trong song thai sẽ tốt hơn là tiến hành riêng lẻ. Một nghiên cứu gần đây đánh giá việc tầm soát ở tam cá nguyệt một với các yếu tố từ mẹ, PI động mạch tử cung, huyết áp động mạch trung bình, PAPP-A và PlGF, nhận thấy rằng, khả năng phát hiện TSG trước 32 và 37 tuần lần lượt là 100% và 99% với ti lệ tầm soát dương là 75%. Việc sử dụng những bảng biểu riêng biệt cho song thai chỉ đem đến một sự gia tăng nhỏ trong hiệu suất của mô hình131.
Sử dụng siêu âm ở những bệnh nhân tiền sản giật
Tình trạng suy thai là một trong những chỉ định chấm dứt thai kì trong TSG; do đó, theo dõi chặt chẽ sức khỏe thai là việc làm hết sức cần thiết cho đến khi sanh134,135. Siêu âm là công cụ nền tảng cho việc đánh giá sức khỏe thai. Tuy nhiên, vì hiện vẫn chưa có bất kì một thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng nào; do đó, chiến lược theo dõi tối ưu và những tác động của nó lên kết cục thai kì thì cần được xác định lại. Ba thành phần của chiến lược theo dõi đánh giá sức khỏe thai trong thực hành lâm sàng là: (1) siêu âm B-mode, (2) Doppler và (3) đặt máy theo dõi tim thai136.
Khuyến cáo
Suy thai là một chỉ định chấm dứt thai kì ở thai phụ có TSG, vì thế tình trạng thai cần được đánh giá thường xuyên ở những bệnh nhân này (GOOD PRACTICE POINT).
Siêu âm theo dõi ở những thai phụ có TSG bao gồm đánh giá sự tăng trưởng của thai, trắc đồ sinh vật lý (biophysical profile-BPP), và các thông số Doppler (GOOD PRACTICE POINT).
Vì chưa có thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng, nên tần suất và tác động của việc theo dõi bằng siêu âm ở những thai kì bị TSG vẫn chưa được xác định (GOOD PRACTICE POINT).
Đánh giá sinh trắc học của thai, thể tích nước ối, động mạch tử cung, động mạch rốn, động mạch não giữa và chỉ số não rốn (CPR), cũng như kiểm tra bánh nhau để loại trừ nhau bong non, nên được xem xét ở thai phụ có biểu hiện đau đầu, đau bụng, xuất huyết và/hoặc giảm cử động thai (GOOD PRACTICE POINT).
Những test tương tự cũng cần được tiến hành ở các thai phụ nhập viện với chẩn đoán TSG hoặc nghi ngờ TSG, cũng như các trường hợp TSG nặng hoặc hội chứng HELLP (GOOD PRACTICE POINT).
TSG thường đi kèm tình trạng thai chậm tăng trưởng trong tử cung, các trường hợp này có khuynh hướng được chấm dứt thai kì sớm hơn và suy thai nhanh hơn so với thai chậm tăng trưởng ở các bà mẹ có tổng trạng bình thường137. Do đó, xác định và theo dõi thai chậm tăng trưởng là việc tối quan trọng để tối ưu hóa kết cục chu sinh trong TSG.
Siêu âm b-mode
Sinh trắc học.
Sinh trắc học của thai có thể được đánh giá để xác định tình trạng thai nhỏ và để tiên đoán em bé sơ sinh nhỏ thật sự138.
Chỉ số ối.
Lượng nước ối có thể được đánh giá bởi chỉ số ối (AFI) hoặc bởi khoang ối lớn nhất (MVP): MVP 139,140. Khi so sánh với AFI, việc đo đạc MVP có thể dẫn đến kết quả ít can thiệp hơn mà không làm tăng bất lợi cho kết cục chu sinh.
Cử động thai.
Là một phần của trắc đồ sinh vật lý (biophysical profile – BPP), cùng với cử động hô hấp của thai, cử động thân/tứ chi và trương lực cơ (ví dụ cử động co – duỗi của chi hoặc xòe – nắm của bàn tay) cần được quan sát142. Ba thành phần trên cùng với đánh giá thể tích nước ối và nhịp tim thai, cấu tạo thành trắc đồ sinh vật lý của thai. Mỗi yếu tố được tính giá trị là 2 điểm nếu có hiện diện, tổng điểm của BPP thay đổi từ 0 đến 10. BPP ≥ 8 điểm được xem là bình thường, thai có sức khỏe tốt. BPP = 6 điểm thì không kết luận được, và cần thực hiện lặp lại. BPP ≤ 4 là thai bất thường, chấm dứt thai kì nên được xem xét143,144. Trắc đồ sinh vật lý được sử dụng chủ yếu ở Mỹ, trong khi việc quản lý lâm sàng ở Châu Âu thì chủ yếu dựa vào siêu âm Doppler. Hiện chưa có dữ liệu nào so sánh hiệu quả kinh tế giữa hai phương pháp này.
Bánh nhau.
Quan sát kĩ bánh nhau trên siêu âm có thể giúp loại trừ những dấu hiệu gợi ý TSG nặng, chẳng hạn như bánh nhau dày với phản âm dày lan tỏa gợi ý nhiều nhất đến phù nhau, hoặc bánh nhau mỏng do giảm tưới máu145,146, hoặc những vùng dạng khối nang gợi ý nhồi máu hoặc tụ máu147,148. Những thai phụ bị TSG có nguy cơ nhau bong non một phần hay toàn bộ; do đó, việc đánh giá giao diện tử cung – nhau là rất quan trọng149,150. Các dấu hiệu trên siêu âm liên quan tình trạng nhau bong non bao gồm khối máu tụ sau nhau (tăng phản âm, đồng âm hoặc giảm phản âm), khối máu tụ mặt trước bánh nhau, tăng độ dày và độ phản âm của bánh nhau, tụ máu dưới màng đệm và tụ máu rìa/mép bánh nhau. Tuy nhiên, độ nhạy của siêu âm trong chẩn đoán nhau bong non khá thấp, gần 50 – 75% các trường hợp có thể bị bỏ sót trên siêu âm151,152. Nhau bong mạn tính có thể được quan sát thấy trên hình ảnh siêu âm là vùng phản âm trống ở mặt sau bánh nhau, và thiểu ối thường xuyên có thể biểu hiện ở các thai phụ TSG153.
Siêu âm doppler
Bốn vị trí mạch máu của thai và mẹ thường được đánh giá trên siêu âm Doppler là: (1) động mạch rốn (UA), (2) động mạch não giữa (MCA), (3) ống tĩnh mạch và (4) động mạch tử cung của mẹ.
Mất hoặc đảo ngược sóng tâm trương động mạch rốn có liên quan chặt chẽ với bệnh suất và tử suất chu sinh154,155. Giảm PI động mạch não giữa dưới bách phân vị thứ 10 là dấu hiệu của giãn mạch máu não và liên quan với việc mổ lấy thai khẩn cấp do tim thai suy vì thai chậm tăng trưởng156-158. Chỉ số não rốn CPR 159-161. Đảo ngược sóng a ống tĩnh mạch là một biểu hiện mạnh mẽ của suy tim thai, điều này có liên quan với nguy cơ cao tử vong chu sinh và bệnh lý sơ sinh trầm trọng162,163. Kết quả của thử nghiệm TRUFFLE cung cấp cái nhìn sâu sắc toàn diện về việc theo dõi thai chậm tăng trưởng trong TSG, vì hầu hết các thai phụ trong thử nghiệm đều có tình trạng TSG khi đăng kí tham gia thử nghiệm hoặc mới xuất hiện trong suốt thời gian theo dõi. Người ta nhận thấy rằng, kết cục dài hạn tối ưu cho thai chậm tăng trưởng có dòng chảy động mạch rốn bất thường sẽ đạt được khi trì hoãn việc chấm dứt thai kì cho đến khi xuất hiện đảo ngược sóng a ống tĩnh mạch, trừ khi có giảm dao động nội tại trên non-stress test thì phải lấy thai ra ngay lập tức137,164,165. Tăng trở kháng động mạch tử cung biểu thị sự biến đổi khiếm khuyết các động mạch xoắn và thật sự không hữu ích cho chỉ định chấm dứt thai kì.
Nhiều hướng dẫn về đánh giá Doppler thai đã được công bố trước đây16; việc đánh giá Doppler chi tiết như thế nào thì nằm ngoài phạm vi của những hướng dẫn này.
Lời khuyên về kỹ thuật
Chỉ định thuốc hạ áp không liên quan với những thay đổi đáng kể ở mẹ và các chỉ số Doppler thai (MỨC ĐỘ CHỨNG CỨ: 2+).
Sử dụng corticosteroids trước sinh có liên quan với sự giảm thoáng qua trở kháng động mạch rốn và ống tĩnh mạch (MỨC ĐỘ CHỨNG CỨ: 2+).
Các dữ liệu liên quan đến hiệu quả tiềm năng của magnesium sulfate trên mẹ và chỉ số Doppler thai vẫn chưa kết luận được (MỨC ĐỘ CHỨNG CỨ: 2-).
Việc sử dụng labetalol, nifedipine hoặc hydralazine chưa cho thấy có mối liên quan với sự thay đổi dạng sóng Doppler của động mạch tử cung hay động mạch rốn166-169. Tuy nhiên, Grzesiak cùng cộng sự170 và Lima cùng cộng sự171 báo cáo rằng có sự giảm nhẹ trở kháng động mạch não giữa sau khi dùng nifedipine mà không kèm thay đổi ở những mạch máu khác. Methyldopa cũng không có tác dụng lên trở kháng động mạch tử cung ở những bệnh nhân có bệnh lý tăng huyết áp thai kì172.
Tác dụng của corticosteroids lên tuần hoàn thai đã được ghi nhận rộng rãi. Sự giảm thoáng qua trở kháng mạch máu cũng như PI động mạch rốn và PI ống tĩnh mạch cũng thường được quan sát thấy. Mất hoặc đảo ngược vận tốc cuối tâm trương thường cải thiện sau khi sử dụng corticosteroids; hiệu quả này nhìn chung kéo dài khoảng 48 – 72 giờ, nhưng cũng có thể lâu hơn ở một số thai nhi. Vài tác giả cũng đã báo cáo rằng có sự giảm nhẹ PI động mạch não giữa; tuy nhiên, steroids không có tác dụng thay đổi dạng sóng Doppler của động mạch tử cung173-176.
Hiện chưa có sự đồng thuận về tác dụng của magnesium sulfate trên huyết động của thai. Một số nghiên cứu nhận thấy có tình trạng giảm PI hoặc RI của động mạch rốn, động mạch tử cung và động mạch não giữa sau khi dùng magnesium sulfate177-179, nhưng một số khác lại cho rằng không có tác dụng nào cả180.
Nghiên cứu trong tương lai
Khuyến cáo
Các nghiên cứu về Doppler cần phải đáp ứng các tiêu chí về chất lượng, bao gồm việc thu thập dữ liệu, xem xét cho phù hợp với mục đích nghiên cứu, lấy mẫu liên tiếp (MỨC ĐỘ KHUYẾN CÁO: C).
Siêu âm Doppler mạch máu mẹ và thai đã được sử dụng khoảng hai thập kỉ, với tác động tích cực lên sức khỏe của mẹ và thai một cách đáng kể. Tuy nhiên, cả những nghiên cứu về Doppler cũ hay mới đều có thể bị sai lệch thông tin vì nhiều lí do khác nhau. Các nghiên cứu cũ thì được thực hiện bởi máy siêu âm cũ với hình ảnh có độ phân giải thấp hơn so với những thế hệ máy mới hiện tại, và không chắc rằng liệu kết quả có tương tự không khi sử dụng công nghệ siêu âm mới tân tiến hơn. Các nghiên cứu mới hơn thì được tiến hành ở thời điểm mà giá trị của siêu âm Doppler đã được ghi nhận và điều này có thể đưa đến hai dạng sai lệch: thứ nhất là sai lệch cố ý điều trị, nghĩa là các dấu hiệu trên siêu âm Doppler có thể ảnh hưởng đến việc chẩn đoán và quản lý điều trị; thứ hai là sai lệch giá trị kì vọng, tức là vì các thông số Doppler đã có sẵn các khoảng giá trị bình thường, nên trong tiềm thức người thực hiện sẽ có thể cố thao tác điều chỉnh các đo đạc của họ hướng về phạm vi giá trị bình thường kì vọng đó, những dữ liệu này sẽ làm sai lệch các nghiên cứu hồi cứu sử dụng chúng. Một tổng quan hệ thống y văn gần đây181 chỉ ra rằng phần lớn các nghiên cứu về Doppler bị hạn chế về mặt phương pháp luận, và đề xuất nên áp dụng một bộ tiêu chuẩn trong các nghiên cứu chất lượng cao ở tương lai. Những tiêu chí này liên quan đến việc thu thập dữ liệu, xem xét cho phù hợp với mục đích nghiên cứu, lấy mẫu liên tiếp181.
Tóm tắt khuyến cáo
Thông tin liên quan phải được cung cấp cho người tham gia tầm soát
Nhân viên y tế tham gia tầm soát TSG cần phải cập nhật kiến thức mới về các yếu tố nguy cơ chính đối với TSG (GOOD PRACTICE POINT).
Sử dụng siêu âm trong tầm soát tsg
Chỉ số Doppler nào được sử dụng
Khi đo đạc trở kháng động mạch tử cung trong tầm soát TSG thì nên sử dụng chỉ số PI (MỨC ĐỘ KHUYẾN CÁO: B)
Tam cá nguyệt một
Siêu âm Doppler động mạch tử cung ở thời điểm thai 11 tuần đến 13 tuần 6 ngày có thể tiến hành qua ngã bụng hoặc âm đạo tùy thuộc vào cơ sở thực hành và công cụ sẵn có (GOOD PRACTICE POINT).
Chuẩn hóa phương pháp, như đã được mô tả trong hướng dẫn này, để đánh giá các chỉ số Doppler của động mạch tử cung (GOOD PRACTICE POINT).
PI trung bình động mạch tử cung nên được chọn lựa là chỉ số Doppler để tầm soát ở tam cá nguyệt một (MỨC ĐỘ KHUYẾN CÁO: B).
Các yếu tố từ mẹ được cho rằng có ảnh hưởng đến PI động mạch tử cung, do đó, bất cứ khi nào khả thi thì nên đưa chúng vào mô hình tầm soát kết hợp đa yếu tố, hơn là sử dụng chúng như một xét nghiệm độc lập với giá trị cut-off tuyệt đối (MỨC ĐỘ KHUYẾN CÁO: B).
Tam cá nguyệt hai
Siêu âm Doppler động mạch tử cung ở tam cá nguyệt hai có thể tiến hành qua ngã bụng hoặc âm đạo tùy thuộc vào cơ sở thực hành và công cụ sẵn có (GOOD PRACTICE POINT).
PI trung bình động mạch tử cung nên được sử dụng để tiên đoán TSG. Trong trường hợp bánh nhau nằm ở một bên, PI tăng một bên cũng không làm tăng nguy cơ TSG nếu PI trung bình nằm trong giới hạn bình thường (MỨC ĐỘ KHUYẾN CÁO: B).
Tam cá nguyệt ba
Hiện tại không có thử nghiệm ngẫu nhiên có nhóm chứng nào về tác động của việc tầm soát TSG ở tam cá nguyệt ba lên kết cục của mẹ, thai và sơ sinh; do đó, việc tầm soát ở giai đoạn này thì chưa được khuyến cáo đưa vào thực hành lâm sàng thường quy (GOOD PRACTICE POINT).
PI trung bình động mạch tử cung nên được sử dụng để tiên đoán TSG, nếu được đề nghị thực hiện ở tam cá nguyệt ba (MỨC ĐỘ KHUYẾN CÁO: B).
Sự thay đổi các chỉ số doppler theo thời gian
Các chiến lược phòng ngừa (chẳng hạn như dùng aspirin liều thấp) để giảm thiểu nguy cơ TSG có hiệu quả nếu sử dụng ngay từ tam cá nguyệt một, và nên bắt đầu càng sớm càng tốt ở những phụ nữ đã được xác định là có nguy cơ cao, không cần phải chờ đợi việc đánh giá sự tiến triển của Doppler ở tam cá nguyệt hai (GOOD PRACTICE POINT).
Thể tích bánh nhau
Mặc dù thể tích bánh nhau và các chỉ số mạch máu đã được đánh giá là những yếu tố tiên đoán TSG, nhưng không khuyến cáo sử dụng chúng cho mục đích tầm soát vì độ tái lập bị hạn chế, đòi hỏi trang thiết bị đặc biệt và khá tốn thời gian (GOOD PRACTICE POINT).
Chiến lược tầm soát kết hợp
Sự kết hợp giữa các yếu tố từ mẹ, huyết áp động mạch mẹ, Doppler động mạch tử cung và lượng PIGF lúc 11 – 13 tuần là mô hình tầm soát có hiệu quả nhất nhằm xác định những phụ nữ có nguy cơ TSG (MỨC ĐỘ KHUYẾN CÁO: B).
Vì tầm soát kết hợp có tính ưu việt vượt trội nên nếu có thể thực hiện kết hợp được thì tránh sử dụng giá trị cut-offs của các trị số Doppler như là phương thức tầm soát độc lập (MỨC ĐỘ KHUYẾN CÁO: B).
Siêu âm qua ngã bụng được ưa chuộng để đánh giá yếu tố nguy cơ cùa bệnh nhân trong tam cá nguyệt 1, như hầu hết các thuật toán tầm soát khác cũng sử dụng ngã siêu âm này (GOOD PRACTICE POINT).
Đánh giá huyết động học của mẹ
Mặc dù việc đánh giá huyết động của mẹ có thể có giá trị trong tiên đoán TSG, nhưng vẫn còn quá ít dữ liệu ủng hộ cho việc thực hiện thường quy trong thực hành lâm sàng như một test độc lập (GOOD PRACTICE POINT).
Quản lý thai kì sau tầm soát
Có bằng chứng thuyết phục rằng việc sử dụng aspirin liều thấp có thể làm giảm một cách đáng kể nguy cơ khởi phát TSG sớm, việc chỉ định dùng thuốc nên bắt đầu sau khi tầm soát ở tam cá nguyệt một (MỨC ĐỘ KHUYẾN CÁO: A).
Đa thai
Do tình trạng khối lượng bánh nhau tăng lên trong song thai, dẫn đến kết quả trở kháng trung bình của động mạch tử cung thấp hơn, nên khi thực hiện Doppler thì nên sử dụng bảng tham chiếu chuyên biệt cho thai đôi nếu có thể (MỨC ĐỘ KHUYẾN CÁO: B).
Chiến lược tầm soát kết hợp (các yếu tố của mẹ, PI động mạch tử cung, huyết áp động mạch trung bình, PlGF) cho đơn thai cũng có thể sử dụng trong song thai và việc làm này có thể xác định hơn 95% thai phụ có nguy cơ khởi phát TSG. Tuy nhiên, người thực hiện tầm soát cần lưu ý rằng để đạt được điều này thì phải có tỉ lệ tầm soát dương (screen – positive rate) là 75% (MỨC ĐỘ KHUYẾN CÁO: B).
Sử dụng siêu âm ở bệnh nhân đã được xác định tsg
Suy thai là một chỉ định chấm dứt thai kì ở thai phụ có TSG, vì thế tình trạng thai cần được đánh giá thường xuyên ở những bệnh nhân này (GOOD PRACTICE POINT).
Siêu âm theo dõi ở những thai phụ có TSG bao gồm đánh giá sự tăng trưởng của thai, trắc đồ sinh vật lý (biophysical profile-BPP), và các thông số Doppler (GOOD PRACTICE POINT).
Vì chưa có thử nghiệm lâm sàng ngẫu nhiên có nhóm chứng, nên tần suất và tác động của việc theo dõi bằng siêu âm ở những thai kì bị TSG vẫn chưa được xác định (GOOD PRACTICE POINT).
Đánh giá sinh trắc học của thai, thể tích nước ối, động mạch tử cung,động mạch rốn, động mạch não giữa và chỉ số não rốn (CPR), cũng như là kiểm tra bánh nhau để loại trừ nhau bong non, nên được xem xét ở thai phụ có biểu hiện đau đầu, đau bụng, xuất huyết và/hoặc giảm cử động thai (GOOD PRACTICE POINT).
Những test tương tự cũng cần được tiến hành ở các thai phụ nhập viện với chẩn đoán TSG hoặc nghi ngờ TSG, cũng như các trường hợp TSG nặng hoặc hội chứng HELLP (GOOD PRACTICE POINT).
Nghiên cứu trong tương lai
Các nghiên cứu về Doppler cần phải đáp ứng các tiêu chí về chất lượng, bao gồm việc thu thập dữ liệu, xem xét cho phù hợp với mục đích nghiên cứu, lấy mẫu liên tiếp (MỨC ĐỘ KHUYẾN CÁO: C).
Tác giả hướng dẫn
This guideline was produced by ISUOG CSC Preeclampsia Task Force.
A.Sotiriadis, Second Department of Obstetrics and Gynecology, Faculty of Medicine, Aristotle University of Thessaloniki, Thessaloniki, Greece
Hernandez-Andrade, Division of Maternal Fetal Medicine, Department of Obstetrics and Gynecology,
Hutzel Women Hospital, Wayne State University, Detroit, MI, USA
da Silva Costa, Department of Gynecology and Obstetrics, Ribeir ˜ao Preto Medical School, University of S˜ao Paulo, Ribeir ˜ao Preto, S˜ao Paulo, Brazil; and Department of Obstetrics and Gynaecology, Monash University, Melbourne, Australia T. Ghi, Obstetrics and Gynecology Unit, University of Parma, Parma, Italy
P.Glanc, Department of Radiology, University of Toronto, Toronto, Ontario, Canada
A.Khalil, Fetal Medicine Unit, St George’s University Hospitals NHS Foundation Trust, London, UK; and Vascular Biology Research Centre, Molecular and Clinical Sciences Research Institute, St George’s University of London, London, UK
W.P.Martins, SEMEAR Fertilidade, Reproductive Medicine and Ribeir ˜ao PretoMedical School, University of S˜ao Paulo, Ribeir ˜ao Preto, Brazil
A.O.Odibo, Department of Obstetrics and Gynecology, Morsani College of Medicine, University of South Florida, Tampa, FL, USA
A.T.Papageorghiou, Fetal Medicine Unit, St George’s University Hospitals NHS Foundation Trust, London, UK; and Nuffield Department of Obstetrics and Gynecology,
University of Oxford, Women’s Center, John Radcliffe Hospital, Oxford, UK
L.J.Salomon, Department of Obstetrics and Fetal Medicine, Hopital Necker-Enfants Malades, Assistance Publique-Hopitaux de Paris, Paris Descartes University,
Paris, France
B.Thilaganathan, Fetal Medicine Unit, St George’s University Hospitals NHS Foundation Trust, London, UK; and Vascular Biology Research Centre, Molecular and Clinical Sciences Research Institute, St George’s University of London, London, UK
Trích dẫn
These Guidelines should be cited as: ‘Sotiriadis A, Hernandez-Andrade E, da Silva Costa F, Ghi T, Glanc P, Khalil A, Martins WP, Odibo AO, Papageorghiou AT, Salomon LJ, Thilaganathan B. ISUOG Practice
Guidelines: role of ultrasound in screening for and follow-up of pre-eclampsia. Ultrasound Obstet Gynecol
- DOI: 10.1002/uog.20105’.
TÀI LIỆU THAM KHẢO
Duley L. The global impact of pre-eclampsia and eclampsia. Semin Perinatol 2009; 33: 130–137.
Dolea C, AbouZahr C. Global burden of hypertensive disorders of pregnancy in the year 2000. Evidence and Information for Policy (EIP). World Health Organization: Geneva, 2003.
http://www.who.int/healthinfo/statistics/bod_ hypertensivedisordersofpregnancy.pdf
WHO. WHO recommendations for prevention and treatment of pre-eclampsia and eclampsia. WHO: Geneva, Switzerland, 2011.
http://www.who.int/ reproductivehealth/publications/maternal_perinatal_health/9789241548335/en/
Chaiworapongsa T, Chaemsaithong P, Yeo L, Romero R. Pre-eclampsia part 1: current understanding of its pathophysiology. Nat Rev Nephrol 2014; 10: 466–480.
Melchiorre K, Sharma R, Thilaganathan B. Cardiovascular implications in preeclampsia: an overview. Circulation 2014; 130: 703–714.
Mifsud W, Sebire NJ. Placental pathology in early-onset and late-onset fetal growth restriction. Fetal Diagn Ther 2014; 36: 117–128.
Llurba E, Carreras E, Gratacos E, Juan M, Astor J, Vives A, Hermosilla E, Calero I, Millan P, Garcia-Valdecasas B, Cabero L. Maternal history and uterine artery Doppler in the assessment of risk for development of early- and late-onset preeclampsia and intrauterine growth restriction. Obstet Gynecol Int 2009; 2009: 275613.
Stergiotou I, Crispi F, Valenzuela-Alcaraz B, Bijnens B, Gratacos E. Patterns of maternal vascular remodeling and responsiveness in early- versus late-onset preeclampsia. Am J Obstet Gynecol 2013; 209: 558.e1–14.
O’Gorman N, Wright D, Syngelaki A, Akolekar R, Wright A, Poon LC, Nicolaides KH. Competing risks model in screening for preeclampsia by maternal factors and biomarkers at 11–13 weeks gestation. Am JObstet Gynecol 2016; 214: 103.e1–12.
Rolnik DL, Wright D, Poon LC, O’Gorman N, Syngelaki A, de Paco Matallana C, Akolekar R, Cicero S, Janga D, Singh M, Molina FS, Persico N, Jani JC, PlasenciaW, Papaioannou G, Tenenbaum-Gavish K, Meiri H, Gizurarson S,Maclagan K, Nicolaides KH. Aspirin versus placebo in pregnancies at high risk for preterm preeclampsia. N Engl J Med 2017; 377: 613–622.
Baschat AA. First-trimester screening for pre-eclampsia: moving from personalized risk prediction to prevention. Ultrasound Obstet Gynecol 2015; 45: 119–129.
World Health Organization. Screening for various cancers. Secondary screening for various cancers 2018. http: //www.who.int/cancer/detection/variouscancer/en/.
Public Health England. Guidance: Criteria for appraising the viability, effectiveness and appropriateness of a screening programme. Secondary guidance: criteria for appraising the viability, effectiveness and appropriateness of a screening programme
- https: //www.gov.uk/government/publications/evidencereview-criterianational-
screening-programmes/criteria-for-appraising-the-viabilityeffectivenessand- appropriateness-of-a-screening-programme.
FalcoML, Sivanathan J, Laoreti A, Thilaganathan B, Khalil A. Placental histopathology associated with pre-eclampsia: systematic review and metaanalysis. Ultrasound Obstet Gynecol 2017; 50: 295–301.
Orabona R, Donzelli CM, Falchetti M, Santoro A, Valcamonico A, Frusca T. Placental histological patterns and uterine artery Doppler velocimetry in pregnancies complicated by early or late pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47:580–585.
Bhide A, Acharya G, Bilardo CM, Brezinka C, Cafici D, Hernandez-Andrade E, Kalache K, Kingdom J, Kiserud T, Lee W, Lees C, Leung KY, Malinger G, Mari G, Prefumo F, Sepulveda W, Trudinger B. ISUOG Practice Guidelines: use of Doppler ultrasonography in obstetrics. Ultrasound Obstet Gynecol 2013; 41: 233–239.
Papageorghiou AT, Yu CK, Bindra R, Pandis G, Nicolaides KH, Fetal Medicine Foundation Second-Trimester Screening Group. Multicenter screening for pre-eclampsia and fetal growth restriction by transvaginal uterine artery Doppler at 23 weeks of gestation. Ultrasound Obstet Gynecol 2001; 18: 441–449.
Brodszki J, Lanne T, Laurini R, Strevens H, Wide-Swensson D, Marsal K. Vascular mechanical properties and endothelial function in pre-eclampsia with special reference to bilateral uterine artery notch. Acta Obstet Gynecol Scand 2008; 87:154–162.
Melchiorre K, Leslie K, Prefumo F, Bhide A, Thilaganathan B. First-trimester uterine artery Doppler indices in the prediction of small-for-gestational age pregnancy and intrauterine growth restriction. Ultrasound Obstet Gynecol 2009; 33: 524–529.
Cnossen JS, Morris RK, ter Riet G, Mol BW, van der Post JA, Coomarasamy A, Zwinderman AH, Robson SC, Bindels PJ, Kleijnen J, Khan KS. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: a systematic review and bivariable meta-analysis. CMAJ 2008; 178: 701–711.
Rolnik DL, Wright D, Poon LCY, Syngelaki A, O’Gorman N, de Paco Matallana C, Akolekar R, Cicero S, Janga D, Singh M, Molina FS, Persico N, Jani JC, Plasencia W, Papaioannou G, Tenenbaum-Gavish K, Nicolaides KH. ASPRE trial: performance of screening for preterm pre-eclampsia. Ultrasound Obstet Gynecol 2017; 50: 492–495.
TanMY, Wright D, Syngelaki A, Akolekar R, Cicero S, Janga D, SinghM, Greco E, Wright A, Maclagan K, Poon LC, Nicolaides KH. Comparison of diagnostic accuracy of early screening for pre-eclampsia by NICE guidelines and a method combining maternal factors and biomarkers: results of SPREE.Ultrasound Obstet Gynecol 2018; 51: 743–750.
Tan MY, Poon LC, Rolnik DL, Syngelaki A, de Paco Matallana C, Akolekar R, Cicero S, Janga D, Singh M, Molina FS, Persico N, Jani JC, Plasencia W, Greco E, Papaioannou G, Wright D, Nicolaides KH. Prediction and prevention of small-for-gestational-age neonates: evidence from SPREE and ASPRE. Ultrasound Obstet Gynecol 2018; 52: 52–59.
Tayyar A, Guerra L, Wright A, Wright D, Nicolaides KH. Uterine artery pulsatility index in the three trimesters of pregnancy: effects of maternal characteristics and medical history. Ultrasound Obstet Gynecol 2015; 45: 689–697. 25. Martin AM, Bindra R, Curcio P, Cicero S, Nicolaides KH. Screening for pre-eclampsia and fetal growth restriction by uterine artery Doppler at 11–14 weeks of gestation. Ultrasound Obstet Gynecol 2001; 18: 583– 586.
Plasencia W, Maiz N, Bonino S, Kaihura C, Nicolaides KH. Uterine artery Doppler at 11 + 0 to 13 + 6 weeks in the prediction of pre-eclampsia. Ultrasound Obstet Gynecol 2007; 30: 742–749.
Khalil A, Nicolaides KH. How to record uterine artery Doppler in the first trimester. Ultrasound Obstet Gynecol 2013; 42: 478–479.
Gomez O, Martinez JM, Figueras F, Del Rio M, Borobio V, Puerto B, Coll O, Cararach V, Vanrell JA. Uterine artery Doppler at 11–14 weeks of gestation to screen for hypertensive disorders and associated complications in an unselected population. Ultrasound Obstet Gynecol 2005; 26: 490–494.
Ridding G, Schluter PJ, Hyett JA, McLennan AC. Uterine artery pulsatility index assessment at 11–13 weeks’ gestation. Fetal Diagn Ther 2014; 36: 299–304.
Ferreira AE, Mauad Filho F, Abreu PS, Mauad FM, Araujo Junior E, Martins WP. Reproducibility of first- and second-trimester uterine artery pulsatility index measured by transvaginal and transabdominal ultrasound. Ultrasound Obstet Gynecol 2015; 46: 546–552.
Martins WP, Nastri CO. Interpreting reproducibility results for ultrasound measurements. Ultrasound Obstet Gynecol 2014; 43: 479–480.
Rolnik DL, da Silva Costa F, Sahota D, Hyett J, McLennan A. Quality assessment of uterine artery Doppler measurement in first-trimester combined screening for pre-eclampsia. Ultrasound Obstet Gynecol 2018. DOI: 10.1002/uog.19116.
Plasencia W, Barber MA, Alvarez EE, Segura J, Valle L, Garcia-Hernandez JA. Comparative study of transabdominal and transvaginal uterine artery Doppler pulsatility indices at 11–13 + 6 weeks. Hypertens Pregnancy 2011; 30: 414–420.
Resnik R, Killam AP, Battaglia FC, Makowski EL, Meschia G. The stimulation of uterine blood flow by various estrogens. Endocrinology 1974; 94: 1192–1196.
Poon LC, Nicolaides KH. Early prediction of preeclampsia. Obstet Gynecol Int 2014; 2014: 297397.
Poon LC, Staboulidou I, Maiz N, Plasencia W, Nicolaides KH. Hypertensive disorders in pregnancy: screening by uterine artery Doppler at 11–13 weeks. Ultrasound Obstet Gynecol 2009; 34: 142–148.
Napolitano R, Rajakulasingam R, Memmo A, Bhide A, Thilaganathan B. Uterine artery Doppler screening for pre-eclampsia: comparison of the lower, mean and higher first-trimester pulsatility indices. Ultrasound Obstet Gynecol 2011; 37: 534–537.
Harrington K, Carpenter RG, Goldfrad C, Campbell S. Transvaginal Doppler ultrasound of the uteroplacental circulation in the early prediction of preeclampsia and intrauterine growth retardation. Br J Obstet Gynaecol 1997; 104: 674–681.
Alves JA, Silva BY, de Sousa PC, Maia SB, Costa F da S. Reference range of uterine artery Doppler parameters between the 11th and 14th pregnancy weeks in a population sample from Northeast Brazil. Rev Bras Ginecol Obstet 2013; 35:357–362.
Velauthar L, PlanaMN, Kalidindi M, Zamora J,Thilaganathan B, Illanes SE, Khan KS, Aquilina J, Thangaratinam S. First-trimester uterine artery Doppler and adverse pregnancy outcome: a meta-analysis involving 55,974 women. Ultrasound Obstet Gynecol 2014; 43: 500–507.
Albaiges G, Missfelder-Lobos H, Lees C, Parra M, Nicolaides KH. One-stage screening for pregnancy complications by color Doppler assessment of the uterine arteries at 23 weeks’ gestation. Obstet Gynecol 2000; 96: 559– 564.
Papageorghiou AT, Yu CK, Erasmus IE, Cuckle HS, Nicolaides KH. Assessment of risk for the development of pre-eclampsia by maternal characteristics and uterine artery Doppler. BJOG 2005; 112: 703–709. 43. Yu CK, Khouri O, Onwudiwe N, Spiliopoulos Y, Nicolaides KH, Fetal Medicine Foundation Second-Trimester Screening Group. Prediction of pre-eclampsia by uterine artery Doppler imaging: relationship to gestational age at delivery and small-for-gestational age. Ultrasound Obstet Gynecol 2008; 31: 310–313.
Gomez O, Figueras F, Fernandez S, Bennasar M, Martinez JM, Puerto B, Gratacos E. Reference ranges for uterine artery mean pulsatility index at 11–41 weeks of gestation. Ultrasound Obstet Gynecol 2008; 32: 128–132.
Contro E, Maroni E, Cera E, Youssef A, Bellussi F, Pilu G, Rizzo N, Pelusi G, Ghi T. Unilaterally increased uterine artery resistance, placental location and pregnancy outcome. Eur J Obstet Gynecol Reprod Biol 2010; 153: 143– 147.
Yu CK, Smith GC, Papageorghiou AT, Cacho AM, nNicolaides KH, Fetal Medicine Foundation Second-Trimester Screening Group. An integrated model for the prediction of preeclampsia using maternal factors and uterine artery Doppler velocimetry in unselected low-risk women. Am J Obstet Gynecol 2005; 193: 429–436.
Espinoza J, Kusanovic JP, Bahado-Singh R, Gervasi MT, Romero R, Lee W, Vaisbuch E, Mazaki-Tovi S, Mittal P, Gotsch F, Erez O, Gomez R, Yeo L, Hassan SS. Should bilateral uterine artery notching be used in the risk assessment for
preeclampsia, small-for-gestational-age, and gestational hypertension? J Ultrasound Med 2010; 29: 1103–1115.
Melchiorre K, Sutherland GR, Liberati M, Bhide A, Thilaganathan B. Prevalence of maternal cardiac defects in women with high-resistance uterine artery Doppler indices. Ultrasound Obstet Gynecol 2011; 37: 310–316.
Tsiakkas A, Saiid Y, Wright A, Wright D, Nicolaides KH. Competing risks model in screening for preeclampsia by maternal factors and biomarkers at 30–34 weeks’ gestation. Am J Obstet Gynecol 2016; 215: 87.e1–17. 50. Andrietti S, Silva M, Wright A, Wright D, Nicolaides KH. Competing-risks model in screening for pre-eclampsia by maternal factors and biomarkers at 35–37 weeks’ gestation. Ultrasound Obstet Gynecol 2016; 48: 72–79.
Lau WL, Lam HS, Leung WC. Reversed diastolic flow in the uterine artery – a new Doppler finding related to placental insufficiency? Ultrasound Obstet Gynecol 2007; 29: 232–235.
Ekici E, Vicdan K, Dayan H, Danisman N, GokmenO. Reverse end-diastolic uterine artery velocity in a pregnant woman complicated by mild preeclampsia and severe growth retardation. Eur J Obstet Gynecol Reprod Biol 1996; 66: 79–82.
Gomez O, Figueras F, Martinez JM, del Rio M, Palacio M, Eixarch E, Puerto B, Coll O, Cararach V, Vanrell JA. Sequential changes in uterine artery blood flow pattern between the first and second trimesters of gestation in relation to pregnancy outcome. Ultrasound Obstet Gynecol 2006; 28: 802–808.
Napolitano R, Melchiorre K, Arcangeli T, Dias T, Bhide A, Thilaganathan B. Screening for pre-eclampsia by using changes in uterine artery Doppler indices with advancing gestation. Prenat Diagn 2012; 32: 180–184. 55. Ghi T, Contro E, Youssef A, Giorgetta F, Farina A, Pilu G, Pelusi G. Persistence of increased uterine artery resistance in the third trimester and pregnancy outcome. Ultrasound Obstet Gynecol 2010; 36: 577–581.
Hafner E, Metzenbauer M, Hofinger D, Stonek F, Schuchter K, Waldhor T, Philipp K. Comparison between three-dimensional placental volume at 12 weeks and uterine artery impedance/notching at 22 weeks in screening for pregnancy-induced hypertension, pre-eclampsia and fetal growth restriction in a low-risk population. Ultrasound Obstet Gynecol 2006; 27: 652–657.
Rizzo G, Capponi A, Cavicchioni O, Vendola M, Arduini D. First trimester uterine Doppler and three-dimensional ultrasound placental volume calculation in predicting pre-eclampsia. Eur J Obstet Gynecol Reprod Biol 2008; 138: 147–151.
Odeh M, Ophir E, Maximovsky O, Grinin V, Bornstein J. Placental volume and three-dimensional power Doppler analysis in prediction of preeclampsia and small for gestational age between week 11 and 13 weeks and 6 days of gestation. Prenat Diagn 2011; 31: 367–371.
Odibo AO, Goetzinger KR, Huster KM, Christiansen JK, Odibo L, Tuuli MG. Placental volume and vascular flow assessed by 3D power Doppler and adverse pregnancy outcomes. Placenta 2011; 32: 230–234. 60. Hafner E, Metzenbauer M, Stumpflen I, Waldhor T, Philipp K. First trimester placental and myometrial blood perfusion measured by 3D power Doppler in normal and unfavourable outcome pregnancies. Placenta 2010; 31: 756–763.
Plasencia W, Gonzalez-Davila E, Gonzalez Lorenzo A, Armas-Gonzalez M, Padron E, Gonzalez-Gonzalez NL. First trimester placental volume and vascular indices in pregnancies complicated by preeclampsia. Prenat Diagn 2015; 35: 1247–1254.
Demers S, Girard M, Roberge S, Tetu A, Giguere Y, Forest JC, Bujold E. First-trimester placental and myometrial blood perfusion measured by three-dimensional power Doppler in preeclampsia. Am J Perinatol 2015; 32:920–926.
Martins WP, Lima JC, Welsh AW, Araujo Junior E, Miyague AH, Filho FM, Raine-Fenning NJ. Three-dimensional Doppler evaluation of single spherical samples from the placenta: intra- and interobserver reliability. Ultrasound Obstet Gynecol 2012; 40: 200–206.
Burstein E, Sheiner E, Hershkovitz R. Three-dimensional placental volume measurements between 11 and 13 weeks’ gestation. Am J Perinatol 2009; 26: 169–171.
Cabezas Lopez E, Martinez-Payo C, Engels Calvo V, San Frutos Llorente L, Perez-Medina T. Reproducibility of first trimester threedimensional placental measurements. Eur J Obstet Gynecol Reprod Biol 2016; 201: 156–160.
Aye CY, Stevenson GN, Impey L, Collins SL. Comparison of 2-D and 3-D estimates of placental volume in early pregnancy. Ultrasound Med Biol 2015; 41: 734–740.
Martins WP, Ferriani RA, Ferreira AC, Spara P, Pinheiro Filho L, dos Reis RM, Filho FM. [The reproducibility of VOCAL endometrial volume measurement – importance of the step rotation]. Rev Bras Ginecol Obstet 2006; 28: 38–43.
Tayyar A, Krithinakis K, Wright A, Wright D, Nicolaides KH. Mean arterial pressure at 12, 22, 32 and 36 weeks’ gestation in screening for pre-eclampsia.
Ultrasound Obstet Gynecol 2016; 47: 573–579.
Tsiakkas A, Mendez O, Wright A, Wright D, Nicolaides KH. Maternal serum soluble fms-like tyrosine kinase-1 at 12, 22, 32 and 36 weeks’ gestation in screening for pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 478– 483.
Khalil A, Maiz N, Garcia-Mandujano R, Penco JM, Nicolaides KH. Longitudinal changes in maternal serum placental growth factor and soluble fms-like tyrosine kinase-1 in women at increased risk of pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 324–331.
Bredaki FE, Mataliotakis M, Wright A, Wright D, Nicolaides KH. Maternal serum alpha-fetoprotein at 12, 22 and 32 weeks’ gestation in screening for pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 466–471.
Spencer K, Cowans NJ, Nicolaides KH. Low levels of maternal serum PAPP-A in the first trimester and the risk of pre-eclampsia. Prenat Diagn 2008; 28: 7–10.
Tsiakkas A, Cazacu R, Wright A, Wright D, Nicolaides KH. Maternal serum placental growth factor at 12, 22, 32 and 36 weeks’ gestation in screening for pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 472–477.
O’Gorman N, Tampakoudis G, Wright A, Wright D, Nicolaides KH. Uterine artery pulsatility index at 12, 22, 32 and 36 weeks’ gestation in screening for pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 565–572.
Wright A, Guerra L, Pellegrino M, Wright D, Nicolaides KH. Maternal serum PAPP-A and free beta-hCG at 12, 22 and 32 weeks’ gestation in screening for pre-eclampsia. Ultrasound Obstet Gynecol 2016; 47: 762–767.
O’Gorman N,Wright D, Poon LC, Rolnik DL, Syngelaki A, Wright A, Akolekar R, Cicero S, Janga D, Jani J, Molina FS, de Paco Matallana C, Papantoniou N, Persico N, Plasencia W, Singh M, Nicolaides KH. Accuracy of competing risks model in screening for pre-eclampsia by maternal factors and biomarkers at 11–13 weeks’ gestation. Ultrasound Obstet Gynecol 2017; 49: 751–755.
Rolnik DL, da Silva Costa F, Lee TJ, Schmid M, McLennan AC. Association between fetal fraction on cell-free DNA testing and first-trimester markers for pre-eclampsia. Ultrasound Obstet Gynecol 2018. DOI: 10.1002/uog.18993.
Onwudiwe N, Yu CK, Poon LC, Spiliopoulos I, Nicolaides KH. Prediction of pre-eclampsia by a combination of maternal history, uterine artery Doppler and mean arterial pressure. Ultrasound Obstet Gynecol 2008; 32: 877–883.
Andrietti S, Carlucci S, Wright A, Wright D, Nicolaides KH. Repeat measurements of uterine artery pulsatility index, mean arterial pressure and serum placental growth factor at 12, 22 and 32 weeks in prediction of preeclampsia. Ultrasound Obstet Gynecol 2017; 50: 221–227.
Panaitescu A, Ciobanu A, Syngelaki A, Wright A, Wright D, Nicolaides KH. Screening for pre-eclampsia at 35–37 weeks’ gestation. Ultrasound Obstet Gynecol 2018; 52: 501–506.
Valino N, Giunta G, Gallo DM, Akolekar R, Nicolaides KH. Biophysical and biochemical markers at 30–34 weeks’ gestation in the prediction of adverse perinatal outcome. Ultrasound Obstet Gynecol 2016; 47: 194–202.
Valino N, Giunta G, Gallo DM, Akolekar R, Nicolaides KH. Biophysical and biochemical markers at 35–37 weeks’ gestation in the prediction of adverse perinatal outcome. Ultrasound Obstet Gynecol 2016; 47: 203–209.
Guy GP, Ling HZ, Garcia P, Poon LC, Nicolaides KH. Maternal cardiac function at 35–37 weeks’ gestation: prediction of pre-eclampsia and gestational hypertension. Ultrasound Obstet Gynecol 2017; 49: 61–66.
Dragan I, Wright D, Fiolna M, Leipold G, Nicolaides KH. Development of pre-eclampsia within 4 weeks of sFlt-1/PlGF ratio > 38: comparison of performance at 31–34 vs 35–37 weeks’ gestation. Ultrasound Obstet Gynecol 2017; 49: 209–212.
Oliveira N, Magder LS, Blitzer MG, Baschat AA. Firsttrimester prediction of pre-eclampsia: external validity of algorithms in a prospectively enrolled cohort. Ultrasound Obstet Gynecol 2014; 44: 279–285.
O’Gorman N, Wright D, Poon LC, Rolnik DL, Syngelaki A, de Alvarado M, Carbone IF, Dutemeyer V, Fiolna M, Frick A, Karagiotis N, Mastrodima S, de Paco Matallana C, Papaioannou G, Pazos A, Plasencia W, Nicolaides KH. Multicenter screening for pre-eclampsia by maternal factors and biomarkers at 11–13 weeks’ gestation: comparison with NICE guidelines and ACOG recommendations. Ultrasound Obstet Gynecol 2017; 49: 756–760.
Magnussen EB, Vatten LJ, Lund-Nilsen TI, Salvesen KA, Davey Smith G, Romundstad PR. Prepregnancy cardiovascular risk factors as predictors of pre-eclampsia: population based cohort study. BMJ 2007; 335: 978.
Hale SA, Badger GJ, McBride C, Magness R, Bernstein IM. Prepregnancy vascular dysfunction in women who subsequently develop hypertension during pregnancy. Pregnancy Hypertens 2013; 3: 140–145.
Mahendru AA, Everett TR, Wilkinson IB, Lees CC, McEniery CM. A longitudinal study of maternal cardiovascular function from preconception to the postpartum period. J Hypertens 2014; 32: 849–856.
Hausvater A, Giannone T, Sandoval YH, Doonan RJ, Antonopoulos CN, Matsoukis IL, Petridou ET, Daskalopoulou SS. The association between preeclampsia and arterial stiffness. J Hypertens 2012; 30: 17–33. 91. Khalil A, Akolekar R, Syngelaki A, Elkhouli M, Nicolaides KH. Maternal hemodynamics at 11–13 weeks’ gestation and risk of pre-eclampsia. Ultrasound Obstet Gynecol 2012; 40: 28–34.
Khalil A, Garcia-Mandujano R, Maiz N, Elkhouli M, Nicolaides KH. Longitudinal changes in maternal hemodynamics in a population at risk for pre-eclampsia. Ultrasound Obstet Gynecol 2014; 44: 197–204.
Valensise H, Vasapollo B, Gagliardi G, Novelli GP. Early and late preeclampsia: two different maternal hemodynamic states in the latent phase of the disease. Hypertension 2008; 52: 873–880.
De Paco C, Kametas N, Rencoret G, Strobl I, Nicolaides KH. Maternal cardiac output between 11 and 13 weeks of gestation in the prediction of preeclampsia and small for gestational age. Obstet Gynecol 2008; 111: 292–300.
Melchiorre K, Sutherland GR, Liberati M, Thilaganathan B. Preeclampsia is associated with persistent postpartum cardiovascular impairment. Hypertension 2011; 58: 709–715.
Melchiorre K, Sutherland GR, Baltabaeva A, Liberati M, Thilaganathan B. Maternal cardiac dysfunction and remodeling in women with preeclampsia at term. Hypertension 2011; 57: 85–93.
Melchiorre K, Sutherland G, Sharma R, Nanni M, Thilaganathan B.Mid-gestational maternal cardiovascular profile in preterm and term preeclampsia: a prospective study. BJOG 2013; 120: 496–504.
Stott D, Nzelu O, Nicolaides KH, Kametas NA. Maternal hemodynamics in normal pregnancy and in pregnancy affected by pre-eclampsia. Ultrasound Obstet Gynecol 2018; 52: 359–364.
Gagliardi G, Tiralongo GM, LoPresti D, Pisani I, Farsetti D, Vasapollo B, Novelli GP, Andreoli A, Valensise H. Screening for pre-eclampsia in the first trimester: role of maternal hemodynamics and bioimpedance in non-obese patients. Ultrasound Obstet Gynecol 2017; 50: 584–588.
Milic NM, Milin-Lazovic J, Weissgerber TL, Trajkovic G, White WM, Garovic VD. Preclinical atherosclerosis at the time of pre-eclamptic pregnancy and up to 10 years postpartum: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2017; 49: 110–115.
De Haas S, Ghossein-Doha C, Geerts L, van Kuijk SMJ, van Drongelen J, Spaanderman MEA. Cardiac remodeling in normotensive pregnancy and in pregnancy complicated by hypertension: systematic review and metaanalysis. Ultrasound Obstet Gynecol 2017; 50: 683–696.
Orabona R, Vizzardi E, Sciatti E, Bonadei I, Valcamonico A, Metra M, Frusca T. Insights into cardiac alterations after pre-eclampsia: an echocardiographic study. Ultrasound Obstet Gynecol 2017; 49: 124–133.
Breetveld NM, Ghossein-Doha C, van Neer J, Sengers M, Geerts L, van Kuijk SMJ, van Dijk AP, van der Vlugt MJ, Heidema WM, Brunner-La Rocca HP, Scholten RR, Spaanderman MEA. Decreased endothelial function and increased subclinical heart failure in women several years after pre-eclampsia. Ultrasound Obstet Gynecol 2018; 52: 196–204.
Bellamy L, Casas JP, Hingorani AD, Williams DJ. Preeclampsia and risk of cardiovascular disease and cancer in later life: systematic review and metaanalysis. BMJ 2007; 335: 974.
McDonald SD, Malinowski A, Zhou Q, Yusuf S, Devereaux PJ. Cardiovascular sequelae of preeclampsia/eclampsia: a systematic review and meta-analyses. Am Heart J 2008; 156: 918–930.
Brown MC, Best KE, Pearce MS, Waugh J, Robson SC, Bell R. Cardiovascular disease risk in women with pre-eclampsia: systematic review and meta-analysis. Eur J Epidemiol 2013; 28: 1–19.
Ghossein-Doha C, Spaanderman ME, Al Doulah R, Van Kuijk SM, Peeters LL. Maternal cardiac adaptation to subsequent pregnancy in formerly pre-eclamptic women according to recurrence of preeclampsia. Ultrasound Obstet Gynecol 2016; 47: 96–103.
Poon LC, Karagiannis G, Leal A, Romero XC, Nicolaides KH. Hypertensive disorders in pregnancy: screening by uterine artery Doppler imaging and blood pressure at 11–13 weeks. Ultrasound Obstet Gynecol 2009; 34: 497– 502.
Savvidou MD, Hingorani AD, Tsikas D, Frolich JC, Vallance P, Nicolaides KH. Endothelial dysfunction and raised plasma concentrations of asymmetric dimethylarginine in pregnant women who subsequently develop pre-eclampsia. Lancet 2003; 361: 1511–1517.
NooriM, Donald AE, Angelakopoulou A, Hingorani AD, Williams DJ. Prospective study of placental angiogenic factors and maternal vascular function before and after preeclampsia and gestational hypertension. Circulation 2010; 122: 478–487.
Foo FL, McEniery CM, Lees C, Khalil A, InternationalWorking Group on Maternal H. Assessment of arterial function in pregnancy: recommendations of the International Working Group on Maternal Hemodynamics. Ultrasound Obstet Gynecol 2017; 50: 324–331.
American College of Obstericians and Gynecologists. ACOG Committee Opinion No. 743: Low-dose aspirin use during pregnancy. Obstet Gynecol 2018; 132: e44–e52.
NICE. Clinical Guideline 107. Hypertension in pregnancy: diagnosis and management. Secondary Clinical Guideline 107. Hypertension in pregnancy: diagnosis and management 2011. https: //www.nice.org.uk/guidance/cg107/chapter/1-Guidance# reducing-the-risk-of-hypertensive-disorders-in-pregnancy.
Lausman A, McCarthy FP, Walker M, Kingdom J. Screening, diagnosis, and management of intrauterine growth restriction. J Obstet Gynaecol Can 2012; 34: 17–28.
Caron N, Rivard GE, Michon N, Morin F, Pilon D, Moutquin JM, Rey E. Low-dose ASA response using the PFA-100 in women with high-risk pregnancy. J Obstet Gynaecol Can 2009; 31: 1022–1027.
Panagodage S, Yong HE, Da Silva Costa F, Borg AJ, Kalionis B, Brennecke SP, Murthi P. Low-dose acetylsalicylic acid treatment modulates the production of cytokines and improves trophoblast function in an in vitro model of early-onset preeclampsia. Am J Pathol 2016; 186: 3217–3224.
Ayala DE, Ucieda R, Hermida RC. Chronotherapy with lowdose aspirin for prevention of complications in pregnancy. Chronobiol Int 2013; 30: 260–279.
Wright D, Poon LC, Rolnik DL, Syngelaki A, Delgado JL,Vojtassakova D, de Alvarado M, Kapeti E, Rehal A, Pazos A, Carbone IF, Dutemeyer V, Plasencia W, Papantoniou N, Nicolaides KH. Aspirin for evidence-based preeclampsia prevention trial: influence of compliance on beneficial effect of aspirin in prevention of preterm preeclampsia. Am J Obstet Gynecol 2017; 217: 685.e1–5
Ortved D, Hawkins TL, Johnson JA, Hyett J, Metcalfe A. Cost-effectiveness of first-trimester screening and early preventative use of aspirin in women at high risk of early-onset pre-eclampsia. Ultrasound Obstet Gynecol 2018. DOI: 10.1002/uog .19076.
Bujold E, Roberge S, Lacasse Y, Bureau M, Audibert F, Marcoux S, Forest JC, Giguere Y. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol 2010; 116: 402–414.
Roberge S, Demers S, Nicolaides KH, Bureau M, Cote S, Bujold E. Prevention of pre-eclampsia by low-molecular-weight heparin in addition to aspirin: a meta-analysis. Ultrasound Obstet Gynecol 2016; 47: 548–553.
Litwinska M, Wright D, Efeturk T, Ceccacci I, Nicolaides KH. Proposed clinical management of pregnancies after combined screening for preeclampsia at 19–24 weeks’ gestation. Ultrasound Obstet Gynecol 2017; 50: 367– 372.
Litwinska M, Syngelaki A, Wright A, Wright D, Nicolaides KH. Management of pregnancies after combined screening for pre-eclampsia at 19- 24 weeks’ gestation. Ultrasound Obstet Gynecol 2018; 52: 365–372.
Garcia B, Llurba E, Valle L, Gomez-Roig MD, Juan M, Perez-Matos C, Fernandez M, Garcia-Hernandez JA, Alijotas-Reig J, Higueras MT, Calero I, Goya M, Perez-Hoyos S, Carreras E, Cabero L. Do knowledge of uterine artery resistance in the second trimester and targeted surveillance improve maternal and perinatal outcome? UTOPIA study: a randomized controlled trial. Ultrasound Obstet Gynecol 2016; 47: 680–689.
Wright D, Dragan I, Syngelaki A, Akolekar R, Nicolaides KH. Proposed clinical management of pregnancies after combined screening for preeclampsia at 30–34 weeks’ gestation. Ultrasound Obstet Gynecol 2017; 49: 194– 200.
Nicolaides KH. Turning the pyramid of prenatal care. Fetal Diagn Ther 2011; 29: 183–196.
Francisco C, Wright D, Benko Z, Syngelaki A, Nicolaides KH. Hidden high rate of pre-eclampsia in twin compared with singleton pregnancy. Ultrasound Obstet Gynecol 2017; 50: 88–92.
Rizzo G, Pietrolucci ME, Aiello E, Capponi A, Arduini D. Uterine artery Doppler evaluation in twin pregnancies at 11 + 0 to 13 + 6 weeks of gestation. Ultrasound Obstet Gynecol 2014; 44: 557–561.
Yu CK, Papageorghiou AT, Boli A, Cacho AM, Nicolaides KH. Screening for pre-eclampsia and fetal growth restriction in twin pregnancies at 23 weeks of gestation by transvaginal uterine artery Doppler. Ultrasound Obstet Gynecol 2002; 20: 535–540.
Geipel A, Berg C, Germer U, Katalinic A, KrappM, Smrcek J, Gembruch U. Doppler assessment of the uterine circulation in the second trimester in twin pregnancies: prediction of pre-eclampsia, fetal growth restriction and birth weight discordance. Ultrasound Obstet Gynecol 2002; 20: 541–545.
Francisco C, Wright D, Benko Z, Syngelaki A, Nicolaides KH. Competing-risks model in screening for pre-eclampsia in twin pregnancy according to maternal factors and biomarkers at 11–13 weeks’ gestation. Ultrasound Obstet Gynecol 2017; 50: 589–595.
Svirsky R, Yagel S, Ben-Ami I, Cuckle H, Klug E, Maymon R. First trimester markers of preeclampsia in twins: maternal mean arterial pressure and uterine artery Doppler pulsatility index. Prenat Diagn 2014; 34: 956–960.
Geipel A, Hennemann F, Fimmers R, Willruth A, Lato K, Gembruch U, Berg C.
Reference ranges for Doppler assessment of uterine artery resistance and pulsatility indices in dichorionic twin pregnancies. Ultrasound Obstet Gynecol 2011; 37: 663–667.
Shear RM, Rinfret D, Leduc L. Should we offer expectant management in cases of severe preterm preeclampsia with fetal growth restriction? Am J Obstet Gynecol 2005; 192: 1119–1125.
Belghiti J, Kayem G, Tsatsaris V, Goffinet F, Sibai BM, Haddad B. Benefits and risks of expectant management of severe preeclampsia at less than 26 weeks gestation: the impact of gestational age and severe fetal growth restriction. Am J Obstet Gynecol 2011; 205: 465.e1–6.
American College of Obstericians and Gynecologists. ACOG Practice Bulletin No.Chronic hypertension in pregnancy. Obstet Gynecol 2012; 119: 396–407.
Lees C, Marlow N, Arabin B, Bilardo CM, Brezinka C, Derks JB, Duvekot J, Frusca T, Diemert A, Ferrazzi E, Ganzevoort W, Hecher K, Martinelli P, Ostermayer E, Papageorghiou AT, Schlembach D, Schneider KT, Thilaganathan B, Todros T, van Wassenaer-Leemhuis A, Valcamonico A, Visser GH, Wolf H, Group T. Perinatal morbidity and mortality in early-onset fetal growth restriction: cohort outcomes of the trial of randomized umbilical and fetal flow in Europe (TRUFFLE). Ultrasound Obstet Gynecol 2013; 42: 400–408.
Sovio U, White IR, Dacey A, Pasupathy D, Smith GC. Screening for fetal growth restriction with universal third trimester ultrasonography in nulliparous women in the Pregnancy Outcome Prediction (POP) study: a prospective cohort study. Lancet 2015; 386: 2089–2097.
Williams K. Amniotic fluid assessment. Obstet Gynecol Surv 1993; 48: 795–800.
Moise KJ, Jr. Toward consistent terminology: assessment and reporting of amniotic fluid volume. Semin Perinatol 2013; 37: 370–374.
Lim KI, Butt K, Naud K, Smithies M. Amniotic fluid: technical update on physiology and measurement. J Obstet Gynaecol Can 2017; 39: 52–58.
Manning FA. Fetal biophysical profile: a critical appraisal. Clin Obstet Gynecol 2002; 45: 975–985.
Chari RS, Friedman SA, O’Brien JM, Sibai BM. Daily antenatal testing in women with severe preeclampsia. Am J Obstet Gynecol 1995; 173: 1207–1210.
Ullah N, Usman M, Khan AR. Sonographic biophysical profile in detection of foetal hypoxia in 100 cases of suspected high risk pregnancy. J Ayub Med Coll Abbottabad 2010; 22: 77–80.
Predoi CG, Grigoriu C, Vladescu R, Mihart AE. Placental damages in preeclampsia– from ultrasound images to histopathological findings. J Med Life 2015; (8 Spec Issue): 62–65.
Chen CY, Wang KG, Chen CP. Alteration of vascularization in preeclamptic placentas measured by three-dimensional power Doppler ultrasound. J Matern Fetal Neonatal Med 2013; 26: 1616–1622.
Proctor LK, Whittle WL, Keating S, Viero S, Kingdom JC. Pathologic basis of echogenic cystic lesions in the human placenta: role of ultrasound-guided wire localization. Placenta 2010; 31: 1111–1115.
Aurioles-Garibay A, Hernandez-Andrade E, Romero R, Qureshi F, Ahn H, Jacques SM, Garcia M, Yeo L, Hassan SS. Prenatal diagnosis of a placental infarction hematoma associated with fetal growth restriction, preeclampsia and fetal death: clinicopathological correlation. Fetal Diagn Ther 2014; 36: 154– 161.
Ananth CV. Ischemic placental disease: a unifying concept for preeclampsia, intrauterine growth restriction, and placental abruption. Semin Perinatol 2014; 38: 131–132.
Minire A, Mirton M, Imri V, Lauren M, Aferdita M. Maternal complications of preeclampsia. Med Arch 2013; 67: 339–341.
Glantz C, Purnell L. Clinical utility of sonography in the diagnosis and treatment of placental abruption. J Ultrasound Med 2002; 21: 837–840.
Jha P, Melendres G, Bijan B, Ormsby E, Chu L, Li CS, McGahan J. Trauma in pregnant women: assessing detection of post-traumatic placental abruption on contrast-enhanced CT versus ultrasound. Abdom Radiol (NY) 2017; 42: 1062–1067.
Walker M, Whittle W, Keating S, Kingdom J. Sonographic diagnosis of chronic abruption. J Obstet Gynaecol Can 2010; 32: 1056–1058.
Hartung J, Kalache KD, Heyna C, Heling KS, Kuhlig M, Wauer R, Bollmann R, Chaoui R. Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates. Ultrasound Obstet Gynecol 2005; 25: 566–572.
Montenegro N, Santos F, Tavares E, Matias A, Barros H, Leite LP. Outcome of 88 pregnancies with absent or reversed end-diastolic blood flow (ARED flow) in the umbilical arteries. Eur J Obstet Gynecol Reprod Biol 1998; 79: 43–46.
Prior T,Mullins E, Bennett P, Kumar S. Prediction of intrapartum fetal compromise using the cerebroumbilical ratio: a prospective observational study. Am J Obstet Gynecol 2013; 208: 124.e1–6.
Cruz-Martinez R, Figueras F, Hernandez-Andrade E, Oros D, Gratacos E. Fetal brain Doppler to predict cesarean delivery for nonreassuring fetal status in term small-for-gestational-age fetuses. Obstet Gynecol 2011; 117: 618–626.
Eser A, Zulfikaroglu E, Eserdag S, Kilic S, Danisman N. Predictive value of middle cerebral artery to uterine artery pulsatility index ratio in preeclampsia. Arch Gynecol Obstet 2011; 284: 307–311.
Piazze J, Padula F, Cerekja A, Cosmi EV, Anceschi MM. Prognostic value of umbilical-middle cerebral artery pulsatility index ratio in fetuses with growth restriction. Int J Gynaecol Obstet 2005; 91: 233–237.
Mose JC. The role of maternal & fetal doppler in preeclampsia. Pregnancy Hypertens 2014; 4: 242.
Yalti S, Oral O, Gurbuz B, Ozden S, Atar F. Ratio of middle cerebral to umbilical artery blood velocity in preeclamptic & hypertensive women in the prediction of poor perinatal outcome. Indian J Med Res 2004; 120: 44–50.
Cruz-Lemini M, Crispi F, Van Mieghem T, Pedraza D, Cruz-Martinez R, Acosta-Rojas R, Figueras F, Parra-Cordero M, Deprest J, Gratacos E. Risk of perinatal death in early-onset intrauterine growth restriction according to gestational age and cardiovascular Doppler indices: a multicenter study. Fetal Diagn. Ther 2012; 32: 116–122.
Baschat AA. Ductus venosus Doppler for fetal surveillance in high-risk pregnancies. Clin Obstet Gynecol 2010; 53: 858–868.
Lees CC, Marlow N, van Wassenaer-Leemhuis A, Arabin B, Bilardo CM, Brezinka C, Calvert S, Derks JB, Diemert A, Duvekot JJ, Ferrazzi E, Frusca T, Ganzevoort W, Hecher K, Martinelli P, Ostermayer E, Papageorghiou AT, Schlembach D, Schneider KT, Thilaganathan B, Todros T, Valcamonico A, Visser GH, Wolf H, TRUFFLE study group. 2 year neurodevelopmental and intermediate perinatal outcomes in infants with very preterm fetal growth restriction (TRUFFLE): a randomised trial. Lancet 2015; 385: 2162–2172.
Bilardo CM, Hecher K, Visser GHA, Papageorghiou AT, Marlow N, Thilaganathan B, Van Wassenaer-Leemhuis A, Todros T, Marsal K, Frusca T, Arabin B, Brezinka C, Derks JB, Diemert A, Duvekot JJ, Ferrazzi E, Ganzevoort W, Martinelli P, Ostermayer E, Schlembach D, Valensise H, Thornton J, Wolf H, Lees C, Group T. Severe fetal growth restriction at 26–32 weeks: key messages from the TRUFFLE study. Ultrasound Obstet Gynecol 2017; 50: 285– 290.
Baggio MR, Martins WP, Calderon AC, Berezowski AT, Marcolin AC, Duarte G, Cavalli RC. Changes in fetal and maternal Doppler parameters observed during acute severe hypertension treatment with hydralazine or labetalol: a randomized controlled trial. Ultrasound Med Biol 2011; 37: 53–58.
Erkinaro T, Haapsamo M, Kavasmaa T,Makikallio K, Acharya G, Rasanen J. Fetal cardiac function after labetalol or pindolol for maternal hypertension in a sheep model of increased placental vascular resistance. Eur J Obstet Gynecol Reprod Biol 2013; 166: 18–22.
Ulubasoglu H, Ozmen Bayar U, Kaya C, Ungan B. The effect of nifedipine tocolysis on Doppler indices of the uterine and umbilical arteries. J Clin Ultrasound 2015; 43: 322–326.
de Heus R, Mulder EJ, Derks JB, Visser GH. The effects of the tocolytics atosiban and nifedipine on fetal movements, heart rate and blood flow. J Matern Fetal Neonatal Med 2009; 22: 485–490.
Grzesiak M, Ahmed RB, Wilczynski J. 48-hours administration of nifedipine in spontaneous preterm labor – Doppler blood flow assessment of placental and fetal circulation. Neuro Endocrinol Lett 2013; 34: 687–692.
Lima MM, Souza AS, Diniz C, Porto AM, Amorim MM, Moron AF. Doppler velocimetry of the uterine, umbilical and fetal middle cerebral arteries in pregnant women undergoing tocolysis with oral nifedipine. Ultrasound Obstet Gynecol 2009; 34: 311–315.
Khalil A, Harrington K, Muttukrishna S, Jauniaux E. Effect of antihypertensive therapy with alpha-methyldopa on uterine artery Doppler in pregnancies with hypertensive disorders. Ultrasound Obstet Gynecol 2010; 35: 688–694.
Thuring A, Malcus P, Marsal K. Effect of maternal betamethasone on fetal and uteroplacental blood flow velocity waveforms. Ultrasound Obstet Gynecol 2011; 37: 668–672.
Nozaki AM, Francisco RP, Fonseca ES, Miyadahira S, Zugaib M. Fetal hemodynamic changes following maternal betamethasone administration in pregnancies with fetal growth restriction and absent end-diastolic flow in the umbilical artery. Acta Obstet Gynecol Scand 2009; 88: 350–354.
Shojaei K, Mohammadi N. Comparing the effects of antenatal betamethasone on Doppler velocimetry between intrauterine growth restriction with and without preeclampsia. Glob J Health Sci 2015; 7: 344–350.
Piazze J, Dillon KC, Cerekja A. Betamethasone effects on umbilical arteries and ductus venosus Doppler velocity waveforms in growth-restricted fetuses. J Matern Fetal Neonatal Med 2012; 25: 1179–1182.
Souza AS, Amorim MM, Coutinho IC, Lima MM, Noronha Neto C, Figueroa JN. Effect of the loading dose of magnesium sulfate (MgSO4) on the parameters of Doppler flow velocity in the uterine, umbilical and middle cerebral arteries in severe preeclampsia. Hypertens Pregnancy 2010; 29: 123–134.
Souza AS, Amorim MM, Coelho IC, Lima MM, Noronha Neto C, Figueroa JN. [Doppler of the umbilical and fetal middle cerebral arteries after magnesium sulfate in preeclampsia]. Rev Assoc Med Bras (1992) 2008; 54: 232– 237.
Farshchian N, Rezavand N,Mohammadi S. Effect of magnesium sulfate on Doppler parameters of fetal umbilical and middle cerebral arteries in women with severe preeclampsia. J Clin Imaging Sci 2012; 2: 85.
Twickler DM, McIntire DD, Alexander JM, Leveno KJ. Effects of magnesium sulfate on preterm fetal cerebral blood flow using Doppler analysis: a randomized controlled trial. Obstet Gynecol 2010; 115: 21–25.
Oros D, Ruiz-Martinez S, Staines Urias E, Conde-Agudelo A, Villar J, Fabre E, Papageorghiou AT. Reference ranges for Doppler indices of umbilical and middle cerebral arteries and cerebroplacental ratio: a systematic review. Ultrasound Obstet Gynecol 2018. DOI: 10.1002/uog.20102