Giới thiệu
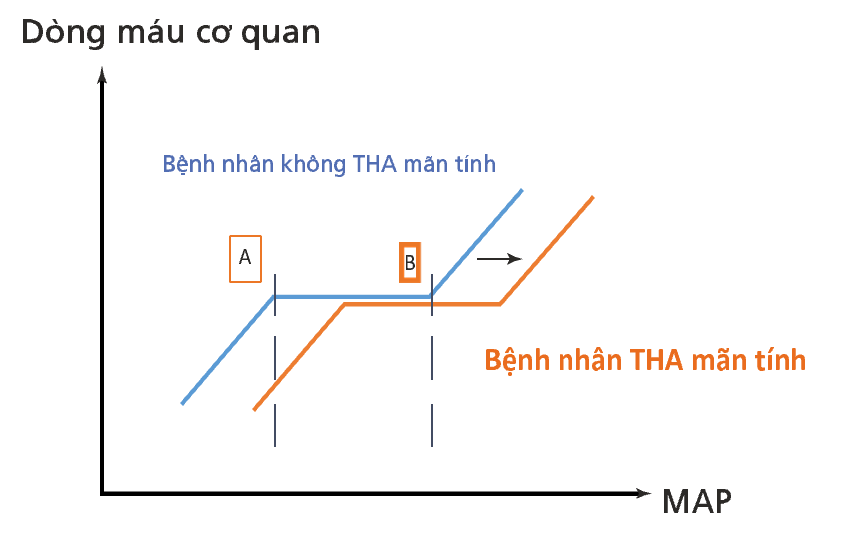
Sốc tuần hoàn được định nghĩa là sự mất cân bằng giữa cung cấp oxy và nhu cầu và có thể liên quan đến hạ huyết áp hệ thống (huyết áp tâm thu dưới 90 mm Hg hoặc áp lực động mạch trung bình dưới 70 mm Hg), dấu hiệu lâm sàng của giảm tưới máu mô, và sự gia tăng lactate máu động mạch [1]. Về mặt sinh lý, cung lượng tim và áp lực động mạch toàn thân là các hoạt động dạng xung. Vai trò sinh lý của giường động mạch là giải điều chế dòng chảy dạng xung qua kháng trở động mạch và giảm huyết áp động mạch để tưới máu mao mạch với áp lực nội mạch thấp nhất có thể chấp nhận được. Sự đầy đủ của huyết áp tưới máu ngoại biên và lưu lượng máu vi tuần hoàn chỉ được duy trì trong phạm vi áp lực động mạch trung bình sinh lý. Khi MAP giảm xuống dưới một giá trị ngưỡng quan trọng, lưu lượng máu các cơ quan trở nên phụ thuộc vào áp lực tưới máu. Điều này dẫn đến suy giảm chức năng cơ quan và sau đó là rối loạn chức năng tạng và cuối cùng là suy cơ quan. Một số cơ quan (tim, não và thận) có cơ chế thích nghi với các biến đổi huyết áp được gọi là tự điều hòa. Tự điều hòa là khả năng của các cơ quan để giữ cho lưu lượng máu đi vào cơ quan, bất kể áp lực tưới máu là gì, trên một loạt các giá trị gọi là “phạm vi tự điều hòa”[2]. Các mối quan hệ tự điều hòa được trình bày trong Hình 29.1. Giá trị ngưỡng tự điều hòa thay đổi giữa các cơ quan cũng như giữa các cá nhân [3, 5], ví dụ, tuần hoàn thận có giá trị ngưỡng tự điều hòa cao nhất [3]. Ngoài ra, ngưỡng tự điều hòa khác nhau tùy theo tình trạng bệnh đi kèm của bệnh nhân, đặc biệt là trong trường hợp tăng huyết áp mãn tính.
Cần phải nhấn mạnh rằng áp suất hệ thống thấp có liên quan đến giảm lưu lượng máu vi tuần hoàn và việc điều chỉnh MAP không nhất thiết cải thiện lưu lượng máu vi tuần hoàn, vì nhiều cơ chế khác có liên quan đến rối loạn lưu lượng máu vi tuần hoàn (rối loạn chức năng nội mô, rối loạn chức năng thông tin giữa các tế bào, thay đổi glycocalyx, bám dính và lăn các tế bào bạch cầu cũng như tiểu cầu và khả năng biến dạng tế bào hồng cầu thay đổi) [6].
Các yếu tố quyết định của MAP là cung lượng tim, sức cản động mạch toàn thân và hồi lưu tĩnh mạch. Trong quá trình sốc, một hoặc nhiều trong số các yếu tố quyết định này bị suy yếu và MAP giảm khi cơ chế bù trừ sinh lý bị áp đảo. MAP thường được chấp nhận như là một thay thế của áp lực tưới máu nội tạng và do đó là mục tiêu chính cho hồi sức huyết động. Để tăng MAP và có được MAP đích, cần truyền dịch (trong trạng thái sốc với tình trạng giảm hồi lưu tĩnh mạch) và thuốc vận mạch. Norepinephrine là thuốc vận mạch được khuyên dùng đầu tiên và kích thích thụ thể alpha và beta. Do đó, norepinephrine làm tăng cả kháng trở trở mạch máu toàn thân và cung lượng tim. Một mục tiêu cao của MAP đòi hỏi một lượng thuốc vận mạch cao hơn và có thể gây ra co mạch máu hệ thống quá mức, do đó có thể gây ra thiếu máu cục bộ.
Do đó, thách thức chính đối với bác sĩ lâm sàng trong giai đoạn hồi sức huyết động sớm của bệnh nhân bị sốc là đặt tốc độ truyền thuốc vận mạch để nhắm vào MAP trong phạm vi áp lực phù hợp để tránh áp lực tưới máu thấp và mặt khác, cao quá mức gây co mạch và các tác dụng phụ khác do thuốc vận mạch như rối loạn nhịp tim.
Hình 29.1 MAP, áp lực động mạch trung bình; A, giá trị tới hạn thấp hơn của MAP; B, giá trị tới hạn cao hơn của MAP. Vùng tự động nằm giữa các đường thẳng đứng. Khi MAP rơi vào áp lực tưới máu nghiêm trọng (điểm A), lưu lượng máu của cơ quan trở nên phụ thuộc vào mức độ áp lực và mối quan hệ này đã được báo cáo trong các cơ quan như tim, não và thận [2, 4]. Ở phía bên phải của khu vực tự điều hòa, lưu lượng máu của cơ quan phụ thuộc vào mức độ áp lực và được báo cáo trong tuần hoàn não [5]. Trong trường hợp tăng huyết áp mãn tính, mối quan hệ giữa MAP và lưu lượng máu được dịch chuyển sang phải, như được trình bày với mũi tên đen [5]
Hiện tại, để hồi sức sốc mất máu, không có dữ liệu có sẵn hỗ trợ các mục tiêu huyết áp cụ thể như được nêu trong các khuyến nghị [7, 8]. Thử nghiệm ngẫu nhiên có đối chứng duy nhất tập trung vào huyết áp tâm thu ở bệnh nhân bị sốc mất máu và không có chấn thương sọ não nhằm so sánh hồi sức tích cực sớm để duy trì huyết áp tâm thu trên 100 mm Hg so với trì hoãn truyền dịch để duy trì mức huyết áp tâm thu thấp trong mức cho phép cho đến khi chảy máu được kiểm soát. Chiến lược hồi sức truyền dịch tích cực có liên quan đến tỷ lệ tử vong cao hơn [9]. Do đó, các hướng dẫn của Châu Âu đề nghị dung nạp mức huyết áp thấp hơn ở những bệnh nhân chảy máu không kiểm soát được mà không bị chấn thương nặng ở đầu với khuyến nghị mức độ yếu với chất lượng bằng chứng thấp [8].
Trong bối cảnh sốc tim, cần nhấn mạnh rằng trong hiện tại, cho đến nay, chưa có nghiên cứu lâm sàng nào cố gắng đánh giá mức huyết áp tối ưu [8, 10]. Điều này có thể giải thích sự vắng mặt của các khuyến cáo chính thức.
Do đó, trong chương này, chúng ta sẽ tập trung vào các mục tiêu huyết áp trong hồi sức ban đầu của bệnh nhân bị sốc nhiễm trùng.
Mục tiêu map trong ổn định ban đầu: có ngưỡng thấp không?
Nhiều nghiên cứu hồi cứu, quan sát và can thiệp đã điều tra xem liệu mức độ MAP cụ thể có liên quan đến các kết quả chính như tử vong và / hoặc tổn thương thận cấp tính.
Mối quan hệ giữa ngưỡng map thấp và tỷ lệ tử vong
Trong một nghiên cứu hồi cứu dựa trên các bản ghi MAP liên tục trong 48 giờ đầu tiên hồi sức ở bệnh nhân bị sốc nhiễm trùng, Varpula et al. báo cáo rằng ngưỡng 65 mm Hg là tốt nhất để dự đoán tỷ lệ tử vong vào ngày 30. Thời gian dưới ngưỡng này càng dài, tỷ lệ tử vong càng cao [11]. Tương tự, trong một nghiên cứu hồi cứu khác dựa trên cùng một thiết kế, tỷ lệ tử vong ở ngày 28 cao hơn khi MAP dưới ngưỡng 60 mm Hg. Thật thú vị, có một mối quan hệ tuyến tính giữa thời gian dưới ngưỡng này và tỷ lệ tử vong [12]. Ngược lại, nhắm mục tiêu giá trị MAP từ 70 mm Hg trở lên không liên quan đến khả năng sống sót được cải thiện [13].
Để đánh giá liệu việc tăng mục tiêu MAP có cải thiện khả năng sống sót hay không, một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm (thử nghiệm SEPSISPAM) đã so sánh mục tiêu MAP là 65 – 70 mmHg (nhóm mục tiêu thấp) với 80 – 85 mmHg (nhóm mục tiêu cao). Nghiên cứu thực tế này đã không cho thấy bất kỳ sự khác biệt về tỷ lệ tử vong giữa hai nhóm ở ngày 28 (điểm cuối chính) và vào ngày 90 [14].
Trong thử nghiệm thử nghiệm ngẫu nhiên có đối chứng OVATION [15], MAP mục tiêu 60 – 65 mmHg được so sánh với MAP mục tiêu 75 – 80 mmHg không có sự khác biệt về tỷ lệ tử vong ở ngày 28. Điều thú vị là, trong nhóm bệnh nhân từ 75 tuổi trở lên , một mục tiêu MAP thấp hơn có liên quan đến việc giảm tỷ lệ tử vong.
Mối quan hệ giữa ngưỡng map thấp và chức năng thận
Trong tà liệu y văn, tác động của MAP mục tiêu đến chức năng cơ quan chỉ được nghiên cứu thông qua việc đánh giá chức năng thận. Một nghiên cứu hồi cứu cho thấy rằng một mục tiêu MAP cao hơn có thể là bắt buộc để ngăn ngừa tổn thương thận cấp tính (AKI) [12].
|
Bảng 29.1 Các nghiên cứu tiền cứu đánh giá tác động tăng MAP lên chức năng thận |
||||||
|
NC |
BN (n) |
MAP mục tiêu (mmHg) |
Thời gian thử nghiệm (h) |
ClCr |
Nước tiểu |
Chỉ số kháng trở thận |
|
Ledoux [19] |
10 |
Tăng dần từ 65,75,85 mmHg |
3*1h45 |
NA |
Không đổi |
NA |
|
Bourgoin [20] |
2×14 |
65 vs 85 mmHg trong hai nhóm |
8 h |
Không đổi |
Không đổi |
NA |
|
Deruddre [18] |
11 |
Tăng dần từ 65,75,85 mmHg |
3*2 h |
Không đổi |
65 ->75: ↑ 75 ->85: NA |
65->75: ↓ 75->85: NA |
Tác động của mức độ MAP trong những giờ đầu tiên của hồi sức liên quan đến sự xuất hiện của suy thận là một điểm quan trọng. Hai nghiên cứu quan sát đã báo cáo rằng ở những bệnh nhân bị sốc nhiễm trùng với AKI sớm, những người trải qua AKI dai dẳng hoặc xấu đi có MAP thấp hơn trong quá trình điều trị huyết động ban đầu [16, 17].
Ba nghiên cứu tiền cứu, tất cả chỉ tuyển dụng một số ít bệnh nhân, đã thử nghiệm tác động lên chức năng thận của ngưỡng tăng dần của MAP, đạt được bằng cách tăng truyền norepinephrine. MAP đã tăng từ 65 lên 75 và sau đó 85 mm Hg. Không có nghiên cứu nào chứng minh bất kỳ tác dụng có lợi nào đối với chức năng thận. Cần lưu ý rằng trong các nghiên cứu này, thời gian can thiệp không được đề cập và do đó, không thể loại trừ can thiệp chậm sau khi ổn định ban đầu (truyền dịch và truyền thuốc vận mạch) [18 – 20]. Kết quả của các nghiên cứu này được trình bày trong Bảng 29.1
Tỷ lệ suy thận là kết quả thứ yếu trong thử nghiệm SEPSISPAM. Không có sự khác biệt về kết quả thận (yêu cầu điều trị thay thế thận, tăng gấp đôi nồng độ creatinine huyết thanh) giữa các nhóm mục tiêu thấp và cao [14]. Trong nhóm phụ được xác định trước là nhóm bệnh nhân tăng huyết áp mãn tính, nhóm mục tiêu cao ít phải thay thế thận hơn so với bệnh nhân mục tiêu MAP thấp. Ngược lại với các nghiên cứu ngắn hạn đã đề cập ở trên, thử nghiệm SEPSISPAM đã tuyển dụng bệnh nhân từ rất sớm trong vòng 6 giờ đầu sau khi bắt đầu truyền norepinephrine. Điều này có thể đã tác động tốt đến suy thận và có thể gợi ý một phần đảo ngược của rối loạn chức năng thận trong giai đoạn đầu của sốc nhiễm trùng.
Mục tiêu map trong ổn định ban đầu: có ngưỡng cao không?
Một phân tích chính xác về các thử nghiệm ngẫu nhiên có đối chứng, trong đó MAP được báo cáo ở những bệnh nhân bị sốc nhiễm trùng, cho thấy MAP tăng tới 80 mm Hg trong các nghiên cứu nhằm so sánh thuốc vận mạch ở bệnh nhân bị sốc nhiễm trùng (CATS, so sánh epinephrine so với mối liên quan của dobutamine và norepinephrine [21]; VASST, so sánh vasopressin với norepinephrine [22]; SOAP2, so sánh dopamine so với norepinephrine [23]). Không có nghiên cứu nào báo cáo tỷ lệ mắc thiếu máu cục bộ quá mức.
Ngược lại vào năm 2004, Lopez và cộng sự báo cáo kết quả của một thử nghiệm ngẫu nhiên có đối chứng nhằm so sánh L-NMMA, một chất ức chế tổng hợp oxit nitric, so với norepinephrine, ở những bệnh nhân bị sốc nhiễm trùng. Thử nghiệm đã bị dừng sớm vì vượt quá tỷ lệ tử vong ở những bệnh nhân được điều trị bằng L-NMMA. Điều thú vị là, bệnh nhân được điều trị bằng L-NMMA có MAP cao hơn và 25% bệnh nhân thậm chí có giá trị MAP cao hơn 90 mm Hg. Có hay không tỷ lệ tử vong cao hơn có liên quan đến mức độ MAP cao và / hoặc do thuốc mỗi vẫn còn để ngõ.
Việc so sánh trực tiếp hai mức độ MAP ở bệnh nhân bị sốc nhiễm trùng trong các thử nghiệm SEPSISPAM và OVATION không báo cáo lợi ích đáng kể có lợi cho các mục tiêu MAP cao hơn. Ngược lại, tăng MAP ở bệnh nhân bị sốc nhiễm trùng có liên quan đến rối loạn nhịp tim thường xuyên hơn đáng kể, ví dụ, rung nhĩ mới xuất hiện. Đổi lại, rung nhĩ mới được báo cáo là có liên quan đến tỷ lệ tử vong cao hơn ở những bệnh nhân nhiễm trùng huyết nặng [24]. Trong nghiên cứu đó, Walkey et al. đánh giá tác động của rung nhĩ khởi phát mới trong điều trị nhiễm trùng huyết nặng: trên 49.082 bệnh nhân nhiễm trùng trong nghiên cứu này, rung nhĩ mới xảy ra ở 5,9% bệnh nhân và có tỷ lệ tử vong cao hơn đáng kể (56% so với 36%).
Mục tiêu map trong ổn định ban đầu: cách tiếp cận cá nhân cho mục tiêu map?
Phiên bản gần đây của Hướng dẫn chiến dịch Sống còn Nhiễm trùng huyết khuyên bạn nên điều chỉnh mục tiêu MAP phù hợp với điều kiện bệnh nhân, sử dụng phương pháp tiếp cận trên từng cá nhân [8, 25]. Tuy nhiên, trong cuộc sống hàng ngày, phương pháp này có thể là thách thức đối với các bác sĩ lâm sàng.
Đầu tiên, bên ngoài các trường hợp thuộc đơn vị chăm sóc đặc biệt, thử nghiệm ngẫu nhiên có kiểm chứng SPRINT đã so sánh mục tiêu tối đa là 120 mmHg (điều trị tích cực) đối với áp lực động mạch tâm thu (SAP) với mục tiêu 140 mmHg (điều trị chuẩn) ở bệnh nhân không đái tháo đường mắc bệnh tim mạch . Kết cục chính là tổng hợp các biến cố tim mạch quan trọng (nhồi máu cơ tim, đột quỵ, suy tim và / hoặc tử vong do nguyên nhân tim mạch). Mặc dù kết quả tổng hợp chính và tỷ lệ tử vong thấp hơn ở nhóm điều trị tích cực, các tác dụng phụ nghiêm trọng xảy ra thường xuyên hơn ở những bệnh nhân này và đặc biệt là AKI xảy ra thường xuyên hơn [26]. Bên ngoài đơn vị chăm sóc tích cực, huyết áp thấp hơn rõ ràng có lợi khi liên quan đến kết quả và tỷ lệ tử vong của tim mạch, nhưng chiến lược điều trị này vẫn có nguy cơ đối với chức năng thận. Nhìn chung, kết quả của các thử nghiệm SPRINT và SEPSISPAM cho thấy chức năng thận có thể được hưởng lợi từ phạm vi huyết áp cao hơn ở những bệnh nhân bị tăng huyết áp mãn tính. Tuy nhiên, một hồi sức “THẬN là trung tâm” phải được cân bằng với các tác dụng phụ như rối loạn nhịp tim cũng như kết quả sống sót liên quan đến thời gian truyền norepinephrine. Thật vậy, phân tích tổng hợp dữ liệu bệnh nhân cá nhân gần đây nhất cho thấy rằng việc tăng MAP sau 6 giờ bắt đầu truyền norepinephrine có liên quan đến tỷ lệ tử vong cao hơn đáng kể và do đó xác nhận tỷ lệ tác dụng phụ của tim cao hơn trong nhóm mục tiêu MAP cao [27].
Do đó, việc cá nhân hóa các mục tiêu huyết áp là phức tạp. Tuổi [15], tăng huyết áp mãn tính [14] và trì hoãn bắt đầu dùng thuốc vận mạch [27] đã được báo cáo ảnh hưởng đến tỷ lệ tử vong và kết quả thận. Các đặc điểm lâm sàng này phải được cân bằng với nguy cơ rối loạn nhịp tim khởi phát mới (vui lòng tham khảo Bảng 29.2).
|
Bảng 29.2 Tác động của mục tiêu MAP cao theo bệnh nhân và đặc điểm lâm sàng |
|
|
Đặc điểm cơ bản được báo cáo để kết quả tác động |
Hiệu quả của mục tiêu MAP cao |
|
Tuổi trên 75 |
Tăng tử vong [15] |
|
Tăng huyết áp mãn tính |
Giảm suy thận [14] |
|
Bắt đầu thuốc vận mạch > 6 h |
Tăng tử vong [27] |
|
Tác dụng phụ |
Tỷ lệ rối loạn nhịp cao hơn[14, 15] |
Ở giai đoạn đầu của quản lý huyết động ở bệnh nhân bị sốc nhiễm trùng, theo dữ liệu có sẵn cũng như các hướng dẫn gần đây nhất, mục tiêu MAP là 65 mm Hg được khuyến nghị [8, 25].
Trong tình huống cụ thể, ví dụ, tăng huyết áp mãn tính, mục tiêu MAP cao hơn có thể được xem xét nhưng yêu cầu tải thuốc vận mạch cao hơn có thể liên quan đến tác dụng phụ tim mạch. Do đó, việc tăng mục tiêu MAP trên 65 mm Hg phải được cân nhắc thận trọng.
Kết luận
Cho đến nay, mục tiêu huyết áp vẫn là một chủ đề gây tranh cãi trong quá trình hồi sức ban đầu của bệnh nhân bị sốc nhiễm trùng. Nên sử dụng mục tiêu MAP là 65 mm Hg. Một số bệnh nhân có thể được hưởng lợi từ các mục tiêu cao hơn, nhưng sự gia tăng MAP như vậy có thể liên quan đến tải lượng thuốc vận mạch cao hơn và tác dụng phụ tim thường xuyên hơn.
Thông tin mang về
Trong hồi sức ban đầu, mục tiêu huyết áp có liên quan là MAP.
Mục tiêu của hồi sức là khôi phục MAP vào phạm vi tự điều hòa.
Trong thực hành lâm sàng, mục tiêu MAP là 65 mmHg.
Mục tiêu MAP nên được cá nhân hóa có tính đến tỷ lệ rủi ro lợi ích của tải lượng thuốc vận mạch cao.
Tài liệu tham khảo
Finfer SR, Vincent J-L, Vincent J-L, De Backer D. Circulatory shock. N Engl J Med. 2013;369:1726–34.
Johnson PC. Autoregulation of blood flow. Circ Res. 1986;59:483–95.
Bellomo R, Wan L, May C. Vasoactive drugs and acute kidney injury. Crit Care Med. 2008;36:S179–86.
Cupples WA, Braam B. Assessment of renal autoregulation. Am J Physiol Renal Physiol. 2007;292: F1105–23.
Strandgaard S, Olesen J, Skinhoj E, Lassen NA. Autoregulation of brain circulation in severe arterial hypertension. Br Med J. 1973;1:507–10.
De Backer D, Donadello K, Taccone F, Ospina-Tascon G, Salgado D, Vincent J-L. Microcirculatory alterations: potential mechanisms and implications for therapy. Ann Intensive Care. 2011;1:27.
Rochwerg B, Hylands M, Møller MH, et al. CCCS-SSAI WikiRecs clinical practice guideline: vasopressor blood pressure targets in critically ill adults with hypotension and vasopressor use in early traumatic shock. Intensive Care Med. 2017;43:1062–4.
Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014;40:1795–815.
Bickell WH, Wall MJ, Pepe PE, Martin RR, Ginger VF, Allen MK, Mattox KL. Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med. 1994;331:1105–9.
O’Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST- elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013;127:e362–425.
Varpula M, Tallgren M, Saukkonen K, Voipio-Pulkki L-M, Pettilä V. Hemodynamic variables related to outcome in septic shock. Intensive Care Med. 2005;31:1066–71.
Dünser MW, Takala J, Ulmer H, Mayr VD, Luckner G, Jochberger S, Daudel F, Lepper P, Hasibeder WR, Jakob SM. Arterial blood pressure during early sepsis and outcome. Intensive Care Med. 2009;35: 1225–33.
Dünser MW, Ruokonen E, Pettilä V, Ulmer H, Torgersen C, Schmittinger CA, Jakob S, Takala J. Association of arterial blood pressure and vasopressor load with septic shock mortality: a post hoc analysis of a multicenter trial. Crit Care. 2009;13:R181.
Asfar P, Meziani F, Hamel J-F, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med. 2014;370:1583–93.
Canadian Critical Care Trials Group, Lamontagne F, Meade MO, et al. Higher versus lower blood pressure targets for vasopressor therapy in shock: a multicentre pilot randomized controlled trial. Intensive Care Med. 2016;42:542–50.
Badin J, Boulain T, Ehrmann S, et al. Relation between mean arterial pressure and renal function in the early phase of shock: a prospective, explorative cohort study. Crit Care. 2011;15:R135.
Poukkanen M, Wilkman E, Vaara ST, et al. Hemodynamic variables and progression of acute kidney injury in critically ill patients with severe sepsis: data from the prospective observational FINNAKI study. Crit Care Lond Engl. 2013;17:R295.
Deruddre S, Cheisson G, Mazoit J-X, Vicaut E, Benhamou D, Duranteau J. Renal arterial resistance in septic shock: effects of increasing mean arterial pressure with norepinephrine on the renal resistive index assessed with Doppler ultrasonography. Intensive Care Med. 2007;33:1557–62.
LeDoux D, Astiz ME, Carpati CM, Rackow EC. Effects of perfusion pressure on tissue perfusion in septic shock. Crit Care Med. 2000;28:2729–32.
Bourgoin A, Leone M, Delmas A, Garnier F, Albanèse J, Martin C. Increasing mean arterial pressure in patients with septic shock: effects on oxygen variables and renal function*. Crit Care Med. 2005;33:780–6.
Annane D, Vignon P, Renault A, et al. Norepinephrine plus dobutamine versus epinephrine alone for management of septic shock: a randomised trial. Lancet Lond Engl. 2007;370:676–84.
Russell JA, Walley KR, Singer J, et al. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008;358:877–87.
De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010;362:779–89.
Walkey AJ, Wiener RS, Ghobrial JM, Curtis LH, Benjamin EJ. Incident stroke and mortality associated with new-onset atrial fibrillation in patients hospitalized with severe Sepsis. JAMA. 2011; https://doi. org/10.1001/jama.2011.1615.
Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43:304–77.
The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med. 2015;373:2103–16.
Lamontagne F, Day AG, Meade MO, et al. Pooled analysis of higher versus lower blood pressure targets for vasopressor therapy septic and vasodilatory shock. Intensive Care Med. 2018;44:12–21.