Tommaso Mauri, Elena Spinelli, Eleonora Scotti, Giulia Colussi, Maria Cristina Basile, Stefania Crotti, Daniela Tubiolo, Paola Tagliabue, Alberto Zanella, Giacomo Grasselli, Antonio Pesenti
Crit Care Med 2020; XX:00–00. DOI: 10.1097/CCM.0000000000004386
Dịch tóm tắt: BS. Đặng Thanh Tuấn
Tóm tắt
Mục tiêu: Các trường hợp nặng của bệnh coronavirus 2019 phát triển hội chứng nguy kịch hô hấp cấp tính, cần phải nhập viện ICU. Nghiên cứu này nhằm mô tả các đặc điểm sinh lý bệnh lý cụ thể của hội chứng nguy kịch hô hấp cấp tính từ bệnh coronavirus 2019.
Thiết kế: Nghiên cứu sinh lý chéo tiền cứu.
Bối cảnh: ICU của một bệnh viện liên kết đại học từ miền bắc Italy dành riêng cho việc chăm sóc bệnh nhân được chẩn đoán xác định mắc bệnh coronavirus 2019.
Bệnh nhân: Mười bệnh nhân được đặt nội khí quản với hội chứng nguy kịch hô hấp cấp tính và chẩn đoán xác định bệnh coronavirus 2019.
Can thiệp: Chúng tôi đã thực hiện thử nghiệm áp lực dương cuối thì thở ra hai bước với thay đổi 10 cm H2O theo thứ tự ngẫu nhiên.
Các phép đo và kết quả chính: Ở mỗi mức áp lực dương cuối thì thở ra, chúng tôi đã đánh giá khí máu động mạch, cơ học hô hấp, sự không đồng nhất thông khí và khả năng huy động phổi bằng chụp cắt lớp trở kháng điện. Khả năng huy động phổi được mô tả gần đây đánh giá bởi tỷ lệ huy động so với bơm phồng (Tỷ lệ R/I). Trong một nhóm nhỏ gồm bảy bệnh nhân dùng thuốc giãn cơ, chúng tôi cũng đo được sự không tương xứng thông khí-tưới máu ở áp lực dương cuối thì thở ra thấp hơn bằng chụp cắt lớp trở kháng điện. Ở áp lực dương cuối thì thở ra cao hơn, cơ học hô hấp không thay đổi đáng kể: độ giãn nở vẫn tương đối cao với áp lực đẩy thấp. Sự không đồng nhất oxygen hóa và thông khí được cải thiện nhưng CO2 động mạch tăng mặc dù tần số thở và thể tích khí lưu thông không thay đổi. Tỷ lệ huy động so với bơm phồng thể hiện giá trị trung bình cao hơn so với báo cáo trước đây ở bệnh nhân hội chứng nguy kịch hô hấp cấp tính nhưng có độ biến thiên lớn (trung vị, 0,79 [0,53 1,08]; phạm vi, 0,16-1,40). FiO2 cần thiết để có được oxygen hóa khả thi ở áp lực dương cuối thì thở ra thấp có mối tương quan đáng kể với tỷ lệ huy động so với bơm phồng (r = 0,603; p = 0,05). Sự không tương xứng thông khí-tưới máu đã tăng lên (trung bình, 34% [32-45%] đơn vị phổi) và, trong sáu trên bảy bệnh nhân, các đơn vị không được sử dụng thông khí chiếm tỷ lệ lớn hơn nhiều so với các đơn vị không được tưới máu.
Kết luận: Ở những bệnh nhân mắc hội chứng suy hô hấp cấp do bệnh coronavirus 2019, khả năng huy động phổi có sự thay đổi lớn, trong khi tỷ lệ khoảng chết tăng cao có thể là một đặc điểm sinh lý bệnh cụ thể. Những phát hiện này có thể hướng dẫn lựa chọn các thiết lập thông khí cơ học cá nhân.
Theo báo cáo từ Trung Quốc, khoảng 20% bệnh nhân nhập viện (1,2) và tới 70% bệnh nhân bị bệnh nặng (2) mắc bệnh coronavirus mới 2019 (COVID-19) phát triển hội chứng nguy kịch hô hấp cấp tính (ARDS), làm tăng đáng kể nguy cơ tử vong (3). Phần lớn bệnh nhân mắc ARDS do COVID-19 yêu cầu đặt nội khí quản và thở máy xâm lấn (1-3). Mặc dù lượng bệnh nhân quá nhiều do sự bùng phát và nhu cầu cách ly bệnh nhân đã hạn chế việc áp dụng các quy trình chẩn đoán tinh tế (4), việc xác định đặc điểm bệnh lý tại giường của ARDS là rất cần thiết để thông báo cho việc quản lý những bệnh nhân nguy kịch này (5). Dữ liệu có sẵn dường như chỉ ra rằng ARDS do COVID-19 có thể có các đặc điểm không đồng nhất. Hình thái phổi được đặc trưng bởi các dấu hiệu cùng tồn tại của tổn thương phế nang và tổn thương mô kẽ: hình kính mờ có hoặc không có đông đặc và dày lên là những phát hiện phổ biến trên hình ảnh CT (6). Hơn nữa, sự tiến triển của tổn thương phổi được đặc trưng bởi sự thay đổi cụ thể của cây mạch máu phổi, với sự gia tăng động trong kích thước của các mạch máu (7, 8).
Trong nghiên cứu này, chúng tôi đã đánh giá cơ học hô hấp, trao đổi khí, sự không đồng nhất thông khí, khả năng huy động phổi và không tương xứng thông khí/tưới máu bằng chụp cắt lớp trở kháng điện (EIT) trong một nhóm bệnh nhân được đặt nội khí quản với ARDS từ COVID19. Giả thuyết nghiên cứu là những phát hiện không rõ ràng có thể chỉ ra sự cần thiết phải điều trị cá nhân hóa và các biện pháp sinh lý ở áp lực dương cuối thì thở ra (PEEP) thấp có thể mang lại hướng dẫn hữu ích.
Nguyên liệu và phương pháp dân số học
Chúng tôi đã tiến hành một nghiên cứu sinh lý tiền cứu trên 10 bệnh nhân được đặt nội khí quản nhập viện ICU tổng quát của Bệnh viện Maggiore Policlinico, Milan, Ý. Tiêu chí bao gồm là: bệnh nhân được đặt nội khí quản với nhiễm coronavirus mới 2019 (hội chứng hô hấp cấp tính nặng coronavirus-2) và chẩn đoán ARDS vào ngày nghiên cứu, dự kiến trải qua thử nghiệm PEEP vì lý do lâm sàng. Tiêu chí loại trừ là: tuổi dưới 18, không ổn định huyết động, tiền sử bệnh phổi tắc nghẽn mạn tính nặng, mang thai, chống chỉ định sử dụng EIT (ví dụ, sự hiện diện của máy tạo nhịp tim hoặc băng vết thương phẫu thuật ngực). Ủy ban đạo đức của bệnh viện đã phê duyệt nghiên cứu (tham khảo 239_2020) và có được sự đồng ý theo quy định của địa phương.
Thu thập dữ liệu
Sau khi đăng ký, chúng tôi đã thu thập giới tính, tuổi tác, chỉ số khối cơ thể, tình trạng hôn mê, ngày đặt nội khí quản, điểm đánh giá SOFA, mức độ PEEP lâm sàng và mức độ nghiêm trọng của ARDS.
Giám sát eit
Chúng tôi đặt một đai chuyên dụng EIT chứa 16 điện cực quanh ngực bệnh nhân ở khoảng liên sườn thứ năm hoặc thứ sáu và kết nối nó với máy theo dõi EIT (PulmoVista 500; Dräger Medical GmbH, Lzigeck, Đức). Dữ liệu EIT được tạo ra bằng cách áp dụng các dòng điện xoay chiều nhỏ xoay quanh bệnh nhân lồng ngực, liên tục được đăng ký ở tần số 50 Hz trong tất cả các giai đoạn nghiên cứu và được lưu trữ để phân tích ngoại tuyến.
Đề cương nghiên cứu
Bệnh nhân được kết nối với máy thở (Servo I; Getinge AB, Göteborg, Thụy Điển) và chế độ thông khí (7 thông khí kiểm soát thể tích, 3 thông khí hỗ trợ áp lực), thể tích khí lưu thông (VT), hỗ trợ áp lực và nhịp thở (RR) được lựa chọn bởi các bác sĩ tham dự trong toàn bộ nghiên cứu. Tất cả các bệnh nhân được an thần sâu và giữ ở tư thế nằm ngửa, bảy bệnh nhân thở máy có kiểm soát cũng dùng thuốc giãn cơ.
Nghiên cứu bao gồm hai bước chéo (tức là tất cả các bệnh nhân trải qua cả hai giai đoạn) được thực hiện theo thứ tự ngẫu nhiên trong 15 phút:
1) PEEP đặt ở mức 5 cm H2O (PEEP thấp)
2) PEEP đặt ở 15 cm H2O (PEEP cao)
Vì lý do an toàn, ở một bệnh nhân có PEEP lâm sàng 18 cm H2O, PEEP thấp được đặt ở mức 10 cm H2O và PEEP cao ở mức 20 cm H2O. FIO2 trong mỗi giai đoạn nghiên cứu đã được chuẩn độ để thu được độ bão hòa oxy ngoại vi lớn hơn hoặc bằng 88%.
Dữ liệu trao đổi khí và thông khí
Trong những phút cuối của mỗi giai đoạn, chúng tôi đã thu thập phân tích khí máu động mạch và chúng tôi đã thực hiện các thủ thuật ngưng cuối thì hít vào và cuối thì thở ra để đo áp lực cao nguyên (Pplat) và tổng PEEP (PEEPtot), kiểm tra cẩn thận cơ bắp thư giãn trong bệnh nhân hỗ trợ áp lực (9). VT như giá trị trung bình từ 10 hơi thở cũng được thu thập. Sau đó, chúng tôi tính toán:
Áp lực đẩy (DP) là (Pplat – PEEPtot)
Độ giãn nở tĩnh hệ thống hô hấp (Crs) là VT/DP
Tỷ lệ thông khí, như được mô tả trước đây, với các giá trị cao hơn cho thấy độ thanh thải CO2 kém hiệu quả hơn (10)
Giám sát thông khí khu vực bằng eit
Chúng tôi chia theo chiều ngang các hình ảnh EIT thành hai vùng quan tâm (regions of interests) liền kề có cùng kích thước: không phụ thuộc từ phân nửa trở lên và phụ thuộc từ phân nửa trở xuống. Sau đó, từ các phân tích ngoại tuyến về dữ liệu EIT thu được trong những phút cuối của mỗi giai đoạn nghiên cứu, chúng tôi đã đo:
Thông khí ở mức pixel tương đối (Vpixel)
Tỷ lệ VT vùng phụ thuộc phổi ở mỗi cấp PEEP (phần mặt lưng của thông khí), với các giá trị gần hơn 50% cho thấy sự phân phối thông khí đồng nhất hơn (11)
Chỉ số đồng nhất toàn thể (GI), với các giá trị cao hơn cho thấy thông khí đồng nhất ít hơn (12)
Thay đổi thể tích phổi thở ra ở PEEP cao hơn (EELV) (13)
Huy động phổi ở PEEP cao hơn (RECREIT) khi mức tăng EELV được đo bằng EIT trừ đi sự thay đổi trong EELV được dự đoán từ mức độ giãn nở của hệ thống hô hấp được đo tại PEEPlow (RECREIT = ΔEELVEIT – ΔEELVCrs = ΔEELVEIT – [Crs ở PEEPlow × ΔPEEP]) (13)
Tỷ lệ huy động so với bơm phồng (R/I), được tính bằng độ giãn nở của phổi được huy động (CRECR = RECREIT/ΔPEEP) chia cho độ giãn nở của phổi em bé (Crs ở PEEP 5 cm H2O). Giá trị cao hơn của tỷ lệ R/I cho thấy khả năng huy động phổi lớn hơn (14, 15)
Giám sát tưới máu khu vực bằng eit
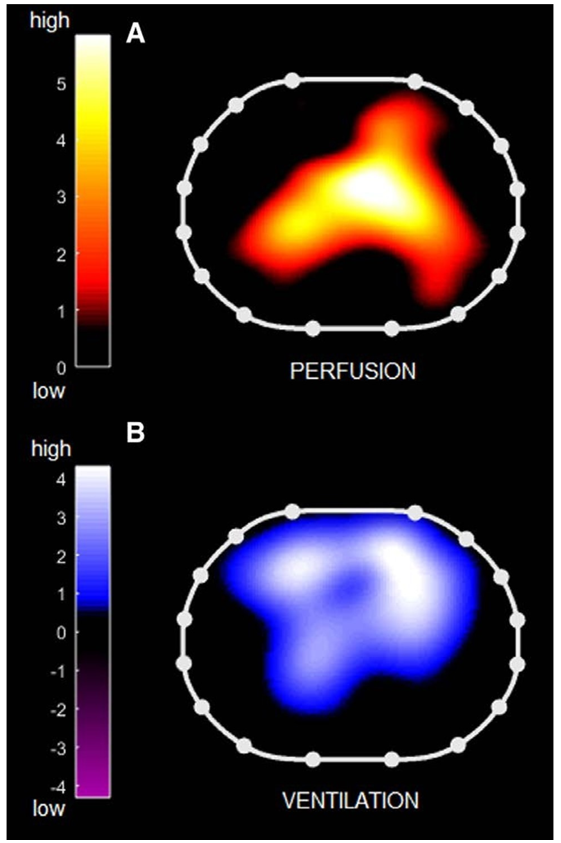
Ở những bệnh nhân dùng thuốc giãn cơ (n = 7), trong bước PEEP 5 cm nước, sau khi đánh giá cơ học phổi, chúng tôi đã thực hiện tắc nghẽn cuối thì hít vào lần thứ hai kéo dài 20 giây và, 2 giây sau khi bắt đầu, chúng tôi đã tiêm một liều 10 ml dung dịch NaCl 5% qua ống thông tĩnh mạch trung tâm. Sau đó, từ phân tích ngoại tuyến dữ liệu EIT được ghi lại trong quá trình tiêm bolus nước muối, chúng tôi đã đo (Hình 1):
Tưới máu phổi theo vùng tương đối ở mức pixel (Qpixel): vùng tim được loại bỏ khỏi hình ảnh và độ dốc của độ lệch tín hiệu EIT trong quá trình tiêm bolus nước muối vào từng pixel được chuẩn hóa thành tín hiệu được phát hiện chung, mang lại Qpixel tương đối (16)
Không tương xứng thông khí-tưới máu (V/Q): nếu số lượng của Vpixel hoặc Qpixel nhỏ hơn hoặc bằng 10% giá trị mức pixel cao nhất được đo ở bệnh nhân đó cho bước nghiên cứu đó, sau đó pixel được phân loại tương ứng là không thông khí hoặc không tưới máu. Sau đó, sự không tương xứng của V/Q được định lượng bằng tỷ lệ phần trăm pixel được phân loại là thông khí nhưng không được tưới máu (tỷ lệ khoảng chết) cộng với tỷ lệ phần trăm của những phần được tưới máu nhưng không được thông khí (tỷ lệ shunt). Theo cách này, sự không tương xứng của V/Q nằm trong khoảng từ 0% đến 100%, với các giá trị cao hơn biểu thị sự không tương xứng hơn.
Hình 1. Sự không tương xứng thông khí-tưới máu khu vực được đo bằng chụp cắt lớp trở kháng điện. Phân bố của thông khí (B) và tưới máu (A) được đo bằng chụp cắt lớp trở kháng điện ở bệnh nhân đại diện: lưu ý sự khác biệt giữa phân bố vùng phổi thông khí và tưới máu.
Để định lượng sự đóng góp tương đối của khoảng chết so với tỷ lệ shunt cho sự không tương xứng của V/Q, chúng tôi đã tính toán tỷ lệ khoảng chết cho tỷ lệ shunt là tỷ lệ khoảng chết chia cho tỷ lệ shunt. Các giá trị cao hơn 1 cho thấy vai trò nồi bật hơn của khoảng chết trong việc xác định sự không tương xứng của V/Q và ngược lại
Phân tích thống kê
Cỡ mẫu tương tự như các nghiên cứu sinh lý trước đây (13, 17). So sánh giữa hai mức PEEP của các biến phân phối thông thường được thực hiện bằng phép đo t lặp lại, trong khi các biến không phân phối thông thường được so sánh bằng kiểm tra xếp hạng của Wilcoxon. Bình thường đã được kiểm tra bằng thử nghiệm Shapiro-Wilk. Liên kết giữa hai biến được đánh giá bằng hệ số hồi quy Spearman. Một mức giá trị p nhỏ hơn 0,05 (hai đuôi) được coi là có ý nghĩa thống kê. Thông thường dữ liệu phân phối được biểu thị là trung bình ± SD, trong khi phạm vitrung bình và liên dải được sử dụng để báo cáo các biến không phân phối thông thường. Phân tích thống kê được thực hiện bởi SigmaPlot 11.0 (Phần mềm Systat, San Jose, CA).
Các kết quả
Đặc điểm bệnh nhân
Bệnh nhân trung bình là 57 tuổi (54 – 64 tuổi), bốn người béo phì nhưng bệnh nhân mắc bệnh đi kèm rất ít. Bệnh nhân được nghiên cứu 5 ngày (1-11 ngày) sau khi đặt nội khí quản và trong điều kiện lâm sàng, ba bệnh nhân bị ARDS nhẹ, năm bệnh nhân ARDS trung bình và hai ARDS nặng (Bảng 1).
BẢNG 1. Đặc điểm chính của dân số nghiên cứu
|
Patient |
Sex |
Age (yr) |
BMI (kg/m2) |
SOFA Score |
Comorbidities |
Mechanical Ventilation Days (n) |
Clinical PEEP (cm H2O) |
ARDS severity |
|
1 |
Male |
58 |
39 |
7 |
Hypertension |
5 |
18 |
Moderate |
|
2 |
Male |
50 |
26 |
3 |
None |
4 |
14 |
Severe |
|
3 |
Male |
60 |
28 |
5 |
Hypertension |
13 |
12 |
Mild |
|
4 |
Male |
66 |
29 |
5 |
Hypertension, dyslipidemia |
14 |
12 |
Moderate |
|
5 |
Male |
81 |
22 |
6 |
None |
12 |
12 |
Severe |
|
6 |
Female |
65 |
33 |
8 |
None |
1 |
12 |
Moderate |
|
7 |
Female |
41 |
22 |
1 |
None |
1 |
10 |
Mild |
|
8 |
Male |
55 |
31 |
4 |
None |
2 |
12 |
Moderate |
|
9 |
Male |
56 |
25 |
4 |
None |
6 |
15 |
Mild |
|
10 |
Female |
53 |
40 |
1 |
Asthma |
1 |
15 |
Moderate |
|
Median |
7 male
|
57 |
29 |
5 |
— 5 |
(1–11) |
12 (12–15) |
Mild 3 |
|
3 female |
(54–64) |
(25–33) |
(4–6) |
|
|
|
Moderate 5 |
|
|
|
|
|
|
|
|
|
Severe 2 |
BẢNG 2. Sinh lý hô hấp và Tính đồng nhất thông khí được đo bằng Chụp cắt lớp điện trở ở áp lực dương cuối thì thở ra cao so với áp lực dương cuối thì thở ra thấp
|
Variable |
PEEPlow at 5 cm H2O (n = 10) |
PEEPhigh at 15 cm H2O (n = 10) |
pa |
|
Tidal volume (mL/kg predicted body weight) |
7.4 (6.1–7.7) |
7.4 (6.1–8.6) |
0.75 |
|
Total PEEP (cm H2O) |
5 (5–6) |
15 (15–16) |
|
|
Respiratory rate (breaths/min) |
22 (19–25) |
23 (18–25) |
1.00 |
|
Plateau pressure (cm H2O) |
16 ± 3 |
28 ± 3 |
|
|
Driving pressure (cm H2O) |
10 ± 2 |
12 ± 2 |
0.07 |
|
Respiratory system compliance (mL/cm H2O) |
47 ± 8 |
43 ± 11 |
0.11 |
|
PaO2/FiO2 |
99 (69–145) |
116 (97–196) |
|
|
Ph |
7.38 ± 0.07 |
7.37 ± 0.06 |
0.35 |
|
PaCO2 (mm Hg) |
50.6 ± 7.5 |
55.4 ± 9.3 |
|
|
Ventilatory ratio |
2.1 ± 0.5 |
2.3 ± 0.6 |
0.03 |
|
Dorsal fraction of ventilation (%) |
30 ± 10 |
39 ± 15 |
|
|
Global inhomogeneity index (%) |
70 ± 11 |
59 ± 10 |
0.001 |
BẢNG 3. Kết hợp thông khí và tưới máu được đo bằng Chụp cắt lớp điện trở
|
Patient |
Ventilation/Perfusion Mismatch (% of Pixels) |
Dead Space Fraction (% of Pixels) |
Shunt Fraction (% of Pixels) |
Dead Space to Shunt Ratio |
|
2 |
46 |
41 |
5 |
8.2 |
|
3 |
43 |
6 |
37 |
0.2 |
|
5 |
49 |
35 |
15 |
2.3 |
|
6 |
32 |
20 |
13 |
1.5 |
|
8 |
34 |
22 |
13 |
1.7 |
|
9 |
26 |
18 |
8 |
2.3 |
|
10 |
32 |
27 |
5 |
5.4 |
|
Median (interquartile range) |
34 (32–45) |
22 (19–31) |
13 (7–14) |
2.3 (1.6–3.9) |
Tác dụng sinh lý của peep và khả năng huy động phổi
Khi xem xét các giá trị trung bình, tăng PEEP thêm 10 cm H2O không ảnh hưởng đến cơ học hô hấp: độ giãn nở của hệ hô hấp vẫn tương đối cao, giữ DP dưới ngưỡng an toàn mặc dù VT trung gian (Bảng 2).
Ở PEEP cao, quá trình oxygen hóa được cải thiện, mặc dù ở mức độ nhỏ (Bảng 2) và PaCO2 tăng đáng kể mặc dù VT và RR hằng định (Bảng 2) do khoảng chết tăng đáng kể khi được đánh giá theo tỷ lệ thông khí (Bảng 2). Các trị số thông khí không đồng nhất bằng EIT cũng được cải thiện: phần phía sau của thông khí trở nên gần hơn với 50% và chỉ số GI giảm (Bảng 2).
Tại PEEP cao, sự gia tăng toàn thể về thể tích phổi (EELVEIT) là 800 mL (618 – 987 mL), trong đó có 309 mL (260 – 487 mL) là do huy động (RECREIT). Khả năng huy động phổi được đo bằng EIT thông qua tỷ lệ R/I cho thấy giá trị trung bình tương đối cao là 0,79 (0,53 – 1,08), nhưng với độ biến thiên cực lớn, được biểu thị trong khoảng 0,16 đến 1,40.
Tỷ lệ R/I không tương quan với số ngày thông khí (r = 0,079; p = 0,81), trong khi chúng tôi tiết lộ mối tương quan đáng kể giữa tỷ lệ R/I và FIO2 tại PEEP thấp (r = 0,603; p = 0,05).
Không tương xứng Thông khí-tưới máu khu vực
Bảng 3 tóm tắt các giá trị thông khí và tưới máu ở cấp độ bệnh nhân được đo bằng EIT tại PEEP thấp ở 7 bệnh nhân dùng thuốc giãn cơ. Tỷ lệ phần trăm pixel có sự không tương xứng V/Q là 34% (32 – 45%): 6 trong số bảy bệnh nhân có sự không tương xứng V/Q khá lớn với giá trị cao hơn 30%. Tỷ lệ khoảng chết có liên quan nhiều hơn so với tỷ lệ shunt ở tất cả trừ một bệnh nhân và tỷ lệ khoảng chết trên shunt thực sự là 2.3 (1.6 – 3.9) (Bảng 3).
Thảo luận
Nghiên cứu những phát hiện chính có thể được tóm tắt như sau: trong 10 bệnh nhân mắc ARDS từ COVID-19, khả năng huy động phổi thể hiện mức độ biến động giữa các cá nhân cao; Giá trị tỷ lệ R/I cao hơn hoặc FiO2 cao hơn cần thiết để duy trì oxygen hóa khả thi ở PEEP thấp hơn có thể được sử dụng để xác định bệnh nhân có khả năng huy động phổi lớn hơn; ARDS từ COVID-19 được đặc trưng bởi sự không tương xứng thông khí-tưới máu cao, với tỷ lệ lớn hơn của các đơn vị phổi thông khí không được tưới máu (khoảng chết) so với các đơn vị tưới máu không được thông khí (shunt).
Khả năng huy động phổi có thể là một trị số vật lý quan trọng ở bệnh nhân ARDS (18) vì hai lý do chính. Từ góc độ lâm sàng, các nghiên cứu trước đây cho thấy khả năng huy động phổi cao hơn là một yếu tố độc lập gây tử vong trong ARDS (18). Từ quan điểm sinh lý học, việc áp dụng mức PEEP cao hơn ở những bệnh nhân có khả năng huy động lớn hơn có thể tăng cường bảo vệ phổi thông qua giảm atelectrauma (19). Tuy nhiên, tương tự như nhiều đặc điểm sinh lý bệnh lý khác (ví dụ, tình trạng tăng viêm so với tình trạng giảm viêm) (20), các quan sát trước đây cho thấy khả năng huy động phổi có thể thay đổi cao trong ARDS, có thể xác định các kiểu hình phụ ARDS cụ thể với mức độ huy động cao hơn so với thấp hơn (18). Dân số bệnh nhân COVID-19 mắc ARDS của chúng tôi đã xác nhận rằng biến đổi sinh lý và nhu cầu điều trị cá nhân hóa là đặc điểm nổi bật của ARDS (21). Khả năng huy động phổi trong dân số của chúng tôi dao động từ 0,16 (có nghĩa là kích thước phổi của bé chỉ tăng 16% với mức thay đổi PEEP là 10 cm H2O) lên 1,40 (với mức tăng của phổi bé là 140%). Những dữ liệu này tạo ra giả thuyết rằng các đặc điểm mô bệnh học của ARDS từ COVID-19 có thể rất không đồng nhất về các tổn thương đại diện nhất (ví dụ, phù mô kẽ so với phế nang, giảm sục khí so với xơ hóa). Sự thay đổi này có thể là hậu quả của tải lượng virus, của phản ứng viêm nhiễm riêng lẻ hoặc kết hợp cả hai. Dữ liệu của chúng tôi cho thấy rằng nên đánh giá khả năng huy động phổi ở mỗi bệnh nhân với ARDS từ COVID-19, ví dụ, để hướng dẫn phương pháp PEEP được cá nhân hóa. Tỷ lệ R/I có thể được tính toán ở đầu giường bằng EIT hoặc bằng các phương pháp đơn giản hơn và ít tốn kém hơn (14, 15). Ngoài ra, suy giảm oxygen hóa được đo ở mức PEEP thấp có thể được sử dụng để dự đoán khả năng huy động.
Các tác động sinh lý trung bình của PEEP cao hơn trong dân số này có phần mâu thuẫn: tỷ lệ R/I cao hơn so với báo cáo trước đây ở bệnh nhân ARDS (15), sự không đồng nhất thông khí giảm và oxygen hóa được cải thiện, nhưng đồng thời, tỷ lệ thông khí tăng lên, cho thấy khoảng chết cao hơn. PEEP cao hơn thường làm xấu đi sự thanh thải CO2 bằng cách gây ra tình trạng quá căng khu vực và chuyển hướng tưới máu từ các khu vực đã được thông khí. Đáng chú ý, quá căng và huy động cùng tồn tại đến một mức độ không thể đoán trước trong ARDS (22). Sự hiện diện giãn mạch của mạch máu phổi (7) và huyết khối vi mô có thể làm phức tạp thêm động lực tái phân phối tưới máu ở PEEP cao hơn. Chèn ép các mạch máu bị giãn ở các vùng phổi bị ảnh hưởng có thể là một giải pháp thay thế cho huy động để giải thích sự cải thiện oxygen hóa do PEEP gây ra. Hơn nữa, PEEP cao hơn có thể làm suy yếu chức năng tim phải, làm giảm cung lượng tim và giảm shunt (23), cải thiện oxygen hóa hơn nữa. Do đó, tác động trung bình của PEEP cao hơn trong dân số này có thể gợi ý một số ưu thế của bất lợi (tăng khoảng chết, quá tải, chức năng tim phải kém) so với các tác dụng sinh lý có thể có lợi (huy động, đồng nhất được cải thiện).
Rối loạn trong trao đổi khí trong ARDS được gây ra bởi sự không tương xứng khu vực giữa thông khí và tưới máu. Trong nhóm bệnh nhân COVID-19 này, tình trạng thông khí/tưới máu bị tăng lên và chủ yếu là do các đơn vị không được tưới máu nhưng được thông khí (tỷ lệ khoảng chết). Những quan sát này bổ sung cho những nghiên cứu trước đây cho thấy rằng Ddimers tăng là một yếu tố dự báo độc lập về tỷ lệ tử vong (3) và các mạch máu được giãn rộng (7) ở bệnh nhân COVID-19 bị ARDS. Vi huyết khối lan tỏa do viêm dẫn đến tăng D-dimers, sức cản mạch máu phổi cao hơn và tỷ lệ khoảng chết lớn hơn có thể là cơ chế cơ bản của các thay đổi quan sát được, do đó đại diện cho một đặc điểm sinh lý bệnh học chính của ARDS từ COVID-19. Các phương pháp điều trị cụ thể hạn chế tác động bất lợi của thông khí khoảng chết và vi huyết khối lan tỏa (ví dụ, hít CO2 5% hoặc thuốc giãn mạch máu phổi) (24) có thể được thử nghiệm ở những bệnh nhân này.
Nghiên cứu này có một vài hạn chế: đầu tiên, dân số nhỏ, nhưng chúng tôi đã thực hiện nhiều biện pháp sinh lý tinh tế và đưa ra sự lan truyền nhanh chóng của các trường hợp COVID19 trên toàn thế giới, chúng tôi muốn trình bày kết quả sớm để hỗ trợ đưa ra các giả thuyết lâm sàng và nghiên cứu vững chắc hơn . Thứ hai, thời gian chúng tôi để lại bệnh nhân ở mỗi cấp độ PEEP là ngắn, mặc dù tương tự như các nghiên cứu trước đây (13) và dài hơn so với nghiên cứu đầu tiên báo cáo phương pháp luận để đánh giá tỷ lệ R/I (15). Thứ ba, bệnh nhân được nghiên cứu tại các thời điểm khác nhau trong quá trình lâm sàng của họ, và điều này có thể tương ứng với các giai đoạn khác nhau của quá trình viêm, làm tăng thêm sự không đồng nhất. Tuy nhiên, khả năng huy động phổi không tương quan với ngày đặt nội khí quản, có khả năng chỉ ra rằng đặt nội khí quản có thể không phải là ước tính chính xác về mức độ cao nhất đạt được của hội chứng này. Thứ tư, mặc dù các biện pháp EIT thay đổi thể tích phổi, huy động và sự không tương xứng thông khí – tưới máu đã được xác nhận (13, 16), chỉ một nửa nhu mô phổi nằm trong khu vực hình ảnh thấy được (25). Thứ năm, chúng tôi đã không thực hiện siêu âm tim để đánh giá chính xác chức năng tim phải và cung lượng tim ở hai mức PEEP, do đó để lại phần suy đoán cho những phát hiện của chúng tôi.
Kết luận
Khả năng huy động phổi ở bệnh nhân ARDS từ COVID-19 rất khác nhau và ước tính khả năng huy động tại giường đơn giản nên hướng dẫn cài đặt thông khí cơ học cá nhân. Sự không tương xứng thông khí-tưới máu cao do tỷ lệ khoảng chết cao có thể là một đặc điểm cụ thể của hội chứng này và đây là thông tin cho sự phát triển của các phương pháp điều trị hiệu quả hơn.
References
Wang D, Hu B, Hu C, et al: Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020; 323:1061–1069
Yang X, Yu Y, Xu J, et al: Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: A single-centered, retrospective, observational study. Lancet Respir Med 2020. Feb 24. [online ahead of print]
Zhou F, Yu T, Du R, et al: Clinical course and risk factors for mortality of adult in patients with COVID19 in Wuhan, China: A retrospective cohort study. Lancet 2020; 395:1054–1062
Holshue ML, DeBolt C, Lindquist S, et al; Washington State 2019-nCoV Case Investigation Team: First case of 2019 novel coronavirus in the United States. N Engl J Med 2020; 382:929–936
Spinelli E, Grieco DL, Mauri T: A personalized approach to the acute respiratory distress syndrome: Recent advances and future challenges. J Thorac Dis 2019; 11:5619–5625
Shi H, Han X, Jiang N, et al: Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: A descriptive study. Lancet Infect Dis 2020; 20:425–434
Albarello F, Pianura E, Di Stefano F, et al; COVID 19 INMI Study Group: 2019-novel Coronavirus severe adult respiratory distress syndrome in two cases in Italy: An uncommon radiological presentation. Int J Infect Dis 2020; 93:192–197
Li Y, Xia L: Coronavirus disease 2019 (COVID-19): Role of chest CT in diagnosis and management. AJR Am J Roentgenol 2020; 4:1–7
Bellani G, Grassi A, Sosio S, et al: Plateau and driving pressure in the presence of spontaneous breathing. Intensive Care Med 2019; 45:97–98
Sinha P, Calfee CS, Beitler JR, et al: Physiologic analysis and clinical performance of the ventilatory ratio in acute respiratory distress syndrome. Am J Respir Crit Care Med 2019; 199:333–341
Yoshida T, Piraino T, Lima CAS, et al: Regional ventilation displayed by electrical impedance tomography as an incentive to decrease positive end-expiratory pressure. Am J Respir Crit Care Med 2019; 200:933–937
Zhao Z, Möller K, Steinmann D, et al: Evaluation of an electrical impedance tomography-based Global Inhomogeneity Index for pulmonary ventilation distribution. Intensive Care Med 2009; 35:1900–1906
Mauri T, Eronia N, Turrini C, et al: Bedside assessment of the effects of positive end-expiratory pressure on lung inflation and recruitment by the helium dilution technique and electrical impedance tomography. Intensive Care Med 2016; 42:1576–1587
Chen L, Chen GQ, Shore K, et al: Implementing a bedside assessment of respiratory mechanics in patients with acute respiratory distress syndrome. Crit Care 2017; 21:84
Chen L, Del Sorbo L, Grieco DL, et al: Potential for lung recruitment estimated by the recruitment-toinflation ratio in acute respiratory distress syndrome. A clinical trial. Am J Respir Crit Care Med 2020; 201:178–187
Bluth T, Kiss T, Kircher M, et al: Measurement of relative lung perfusion with electrical impedance and positron emission tomography: An experimental comparative study in pigs. Br J Anaesth 2019; 123:246–254
Mauri T, Bellani G, Confalonieri A, et al: Topographic distribution of tidal ventilation in acute respiratory distress syndrome: Effects of positive end-expiratory pressure and pressure support. Crit Care Med 2013; 41:1664–1673
Gattinoni L, Caironi P, Cressoni M, et al: Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med 2006; 354:1775–1786
Caironi P, Cressoni M, Chiumello D, et al: Lung opening and closing during ventilation of acute respiratory distress syndrome. Am J Respir Crit Care Med 2010; 181:578–586
Sinha P, Delucchi KL, McAuley DF, et al: Development and validation of parsimonious algorithms to classify acute respiratory distress syndrome phenotypes: A secondary analysis of randomised controlled trials. Lancet Respir Med 2020; 8:247–257
Constantin JM, Jabaudon M, Lefrant JY, et al; AZUREA Network: Personalised mechanical ventilation tailored to lung morphology versus low positive end-expiratory pressure for patients with acute respiratory distress syndrome in France (the LIVE study): A multicentre, single-blind, randomised controlled trial. Lancet Respir Med 2019; 7:870–880
Puybasset L, Gusman P, Muller JC, et al: Regional distribution of gas and tissue in acute respiratory distress syndrome. III. Consequences for the effects of positive end-expiratory pressure. CT Scan ARDS Study Group. Adult Respiratory Distress Syndrome. Intensive Care Med 2000; 26:1215–1227
Lynch JP, Mhyre JG, Dantzker DR: Influence of cardiac output on intrapulmonary shunt. J Appl Physiol 1979; 46:315–321
Kolobow T, Spragg RG, Pierce JE: Massive pulmonary infarction during total cardiopulmonary bypass in unanesthetized spontaneously breathing lambs. Int J Artif Organs 1981; 4:76–81
Spinelli E, Mauri T, Fogagnolo A, et al: Electrical impedance tomography in perioperative medicine: Careful respiratory monitoring for tailored interventions. BMC Anesthesiol 2019; 19:140