Patrick M. Honore1*, Eric Hoste2, Zsolt Molnár3, Rita Jacobs4, Olivier JoannesBoyau5, Manu L. N. G. Malbrain4,6 and Lui G. Forni7,8
Tóm tắt
Cho dù đạt được nhiều tiến bộ trong chiến lược điều trị và nhận thức của quốc tế tăng lên nhưng tỷ lệ tử vong do sốc nhiễm trùng vẫn còn cao. Kết quả là, nhiều nỗ lực đã tập trung vào các chiến lược điều trị thay thế để cố gắng cải thiện kết quả. Việc áp dụng các biện pháp thanh lọc máu để cải thiện và cân bằng nội môi miễn dịch đã được đề nghị như là một phương pháp như vậy, nhưng các phương thức này, chẳng hạn như lọc máu liên tục với thể tích lớn hoặc loại bỏ cytokine và / hoặc endotoxin, cho đến nay vẫn không mấy thành công. Gần đây, việc sử dụng các kỷ thuật hấp thụ đã thu hút nhiều sự chú ý. Những chất hấp phụ này có hiệu quả cao trong việc loại bỏ các chất trung gian gây viêm, đặc biệt là các cytokine ra khỏi máu. Đánh giá tổng quan hẹp này là bản tóm tắt của các cuộc họp được tổ chức trong suốt Những ngày Dịch truyền Quốc tế lần thứ 6 tại Antwerp, Bỉ (ngày 23 tháng 11 năm 2017), tập trung vào sự hiểu biết hiện tại về việc sử dụng các chất hấp phụ như vậy ở người bị sốc nhiễm trùng. Chúng tôi đã theo cách tiếp cận Delphi cải tiến liên quan đến sự kết hợp đánh giá bằng chứng cùng với ý kiến chuyên gia để đạt được các khuyến cáo cho thực hành và quan trọng hơn là những hướng nghiên cứu trong tương lai.
Từ khóa: Thanh lọc máu, Cytokines, Nhiễm trùng huyết, sốc nhiễm trùng, Lọc máu hấp phụ, Cytosorb, Chất hấp phụ, cột lọc, Điều hòa miễn dịch, DAMPS, PAMPS
Giới thiệu
Sinh bệnh học của nhiễm trùng máu: máu như là “mẫu sinh thiết” của mô viêm.
Sốc nhiễm khuẩn tiếp tục có tỷ lệ tử vong đáng kể [1]. Sinh lý bệnh cơ bản là phức tạp, với cả yếu tố gây bệnh và vật chủ: PAMPs (Pathogen-associated molecular patterns) và DAMPs (damageassociated molecular patterns), chúng đóng vai trò quan trọng trong sự tiến triển bệnh và kết cuộc sau đó [2]. Tuy nhiên, sự không đồng nhất của sốc nhiễm trùng làm cho đặc điểm của bệnh nhân trở nên không điển hình và có thể cản trở (các) can thiệp lâm sàng tiếp theo. Nhiễm trùng huyết và sốc nhiễm trùng ảnh hưởng đến bất cứ nơi nào, tỷ lệ mắc từ 100 đến 1000 trên 100.000 người-năm và 19 trên 100.000 người-năm tùy thuộc vào đoàn hệ được nghiên cứu [3 – 6], với tỷ lệ tử vong được báo cáo nằm trong khoảng từ 20 đến 50% [7 – 11]. Hơn nữa, tỷ lệ mắc bệnh được báo cáo đang gia tăng, mặc dù điều này có thể được quy cho sự sai lệch báo cáo trong cái gọi là cơ sở dữ liệu dựa trên thông tin bảo hiểm y tế, vì phân tích dữ liệu trên hồ sơ sức khỏe điện tử không thể xác nhận xu hướng này [12 – 15]. Do đó, không có gì ngạc nhiên khi việc điều trị nhiễm trùng huyết đã trở thành một vấn đề sức khỏe toàn cầu quan trọng. Thật vậy, tại Hoa Kỳ trong năm 2011 nhiễm trùng huyết chiếm hơn 5% tổng chi phí điều trị tương ứng với 20 tỷ đô la [16].
Vai trò của thanh lọc máu
Bệnh nhân nhiễm trùng huyết thường được điều trị trong các khoa chăm sóc đặc biệt với sự theo dõi chặt chẽ và hỗ trợ điều trị mạnh mẽ là cần thiết [17]. Điều trị sớm bao gồm sử dụng kháng sinh kịp thời, thích hợp, truyền dịch, điều trị oxy cũng như dùng thuốc vận mạch và hỗ trợ điều trị bằng thuốc tăng co bóp khi cần thiết. Các phương pháp điều trị bổ sung khác bao gồm trao đổi màng ngoài cơ thể hay còn gọi là kỹ thuật lọc máu (BPT) cũng đã được thử nghiệm [18]. Những kỹ thuật này bao gồm (trong số những kỹ thuật khác nhau): lọc máu, lọc máu hấp phụ, lọc máu không liên tục hoặc liên tục với thể tích cao (HVHF), lọc huyết tương hoặc hấp phụ. Lý do đằng sau một loạt cách tiếp cận như vậy là để đạt được “cân bằng nội môi miễn dịch”, về mặt lý thuyết làm giảm thiệt hại nặng nề do rối loạn điều hòa đáp ứng của vật chủ với nhiễm trùng. Điều này có thể được báo trước bởi sự gia tăng dữ dội của các chất trung gian gây viêm bao gồm các cytokine góp phần vào các tác động toàn thân của nhiễm trùng huyết, chủ yếu là sốc nhiễm trùng [9, 19]. Định nghĩa đồng thuận Sepsis 3.0 được cập nhật gần đây nói rằng nhiễm trùng huyết là một bệnh nhiễm trùng kèm theo rối loạn chức năng cơ quan đe dọa tính mạng gây ra bởi đáp ứng của vật chủ bị mất điều hòa [20]. Do vai trò quan trọng của việc sản xuất cytokine trong nhiễm trùng huyết, theo đó việc loại bỏ các chất này, thông qua BPT như vậy, có thể làm giảm phản ứng đặc biệt trong giai đoạn đầu của nhiễm trùng huyết [21]. Một số giả thuyết đã được đề xuất với các cơ chế chính củng cố lợi ích của biện pháp. Chúng bao gồm các lý thuyết gây độc tế bào bao gồm giả thuyết nồng độ đỉnh, theo đó tất cả các chất trung gian gây viêm được loại bỏ theo một tỷ lệ nhất định, phụ thuộc vào BPT được sử dụng và giả sử chúng thật sự được lọc [21 – 24]. Ngoài ra, giả thuyết động học cytokine đề xuất rằng các cytokine được loại bỏ, do đó tạo ra một gradient cytokine giữa dòng máu và các mô cho phép tăng cường lưu chuyển [25]. Trong cùng một dòng máu, nồng độ cytokine cũng có thể được xem là người mang thông tin để nói chuyện với các tế bào, huy động một số tế bào, làm suy yếu tế bào này và giảm chuyển hóa tế bào khác [22]. Mặc dù có nhiều hứa hẹn sớm, nhưng không có nghiên cứu lâm sàng ngẫu nhiên có đối chứng đa trung tâm nào chứng minh được lợi ích sống còn bao gồm cả việc sử dụng HVHF với thể tích cao hơn có thể dẫn đến việc loại bỏ cytokine như đã được thử nghiệm (giả thuyết điều hòa miễn dịch ở ngưỡng độc tế bào) [26 – 28].
Các phương pháp điều trị lọc máu qua màng ngoài cơ thể khác cũng đã thất bại với các dữ liệu nhiều đáng kể về kết quả đã công bố là không có phương pháp điều trị nào chứng minh lợi ích sống sót trong bất kỳ nghiên cứu ngẫu nhiên có đối chứng nào [29-31]. Quan điểm nhận xét quá đơn giản này có tính đến một số khái niệm mới. Thật vậy, nồng độ các chất trung gian trong máu (nhiều hơn cytokine) cho thấy sự bão hòa các chất này trong khoang kẽ và các thành phần của tế bào có mặt trong máu. Nó được gọi là phần nổi của lý thuyết tảng băng trôi [31]. Lý thuyết này rất giống với “lý thuyết điều hòa miễn dịch đạt ngưỡng” [23]. Ngoài ra, nồng độ các chất trung gian trong huyết tương phụ thuộc vào một số yếu tố: cường độ sản xuất, số lượng thụ thể tế bào, độ thanh thải của các chất trung gian đó, ái lực của các thụ thể đối với các chất trung gian đó. Ví dụ, thụ thể interleukin (IL) -6 là một chất chủ vận, khác với thụ thể yếu tố hoại tử khối u (TNF) và các thụ thể IL-1 là các thụ thể ức chế; hậu quả là mức IL-6 thấp với mức độ thụ thể cao gây ra phản ứng tế bào nhiều hơn mức IL-6 cao với mức độ thụ thể thấp [22]. Vấn đề rất quan trọng này đang chỉ ra rằng một cấp độ IL-6 có thể không được dự đoán nhiều về phản ứng trong tương lai của sinh vật. Các DAMP cũng đang đóng một vai trò quan trọng và đặc biệt là các DAMP nội sinh được loại bỏ thông qua BPT và có khả năng gây tổn thương tế bào và chết theo chương trình [32]. Điều này có thể giải thích các kết quả thử nghiệm quan sát ban đầu là tích cực với HVHF. Sự cải thiện được báo cáo về tình trạng huyết động liên quan đến việc giảm hay không giảm lactate máu có thể chủ yếu là kết quả của liệu pháp dịch thay thế được sử dụng với một lượng lớn tinh thể chứa chất đệm cao. Kết quả là, sự gia tăng pH gây ra có thể đã thay đổi ái lực với catecholamine với các thụ thể làm cải thiện hạ huyết áp [28, 30].
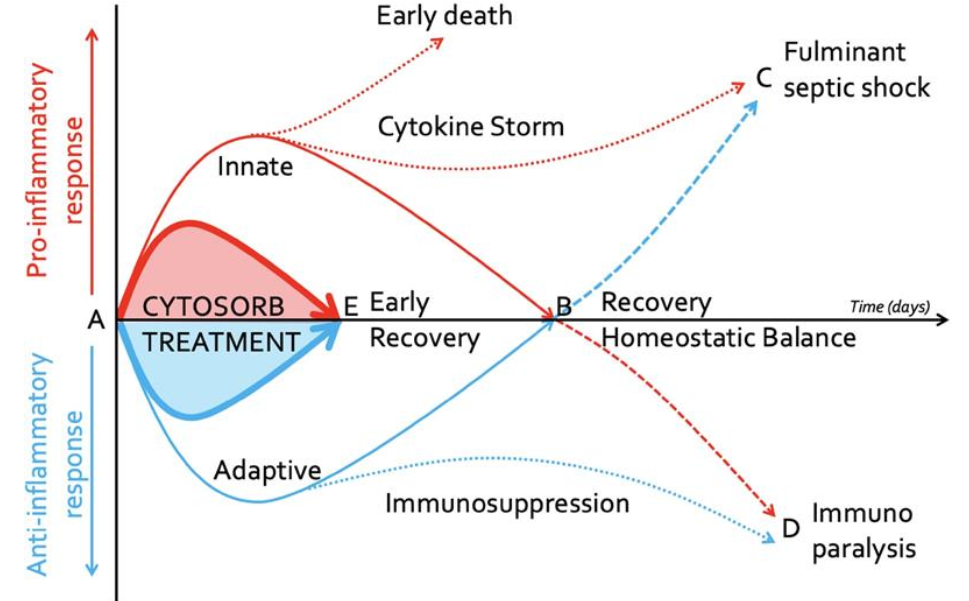
Hình 1. Phản ứng Cytokine sau khi nhiễm trùng huyết. Phản ứng miễn dịch bình thường và bất thường sau khi tổn thương (nhiễm trùng) (A). Phục hồi với việc lấy lại cân bằng nội môi xảy ra khi các chất trung gian tiền viêm (đường màu đỏ đậm) và chất chống viêm (đường màu xanh lam) trở lại mức nền. Tử vong sớm hoặc sốc nhiễm trùng tối cấp(C) có thể xảy ra sau đáp ứng tiền viêm tăng sớm (cơn bão cytokine, đường đỏ chấm) hoặc sau khi ức chế miễn dịch thích nghi ban đầu (đường màu xanh nét đứt). Liệt miễn dịch (D) có thể xảy ra sau đáp ứng dung nạp chống viêm tăng sớm (ức chế miễn dịch, đường màu xanh chấm) hoặc sau đáp ứng tiền viêm ban đầu (đường màu đỏ). Lọc máu hấp phụ với Cytosorb có thể làm giảm phản ứng tiền viêm ban đầu (đường màu đỏ đậm) và phản ứng chống viêm (đường màu xanh đậm) dẫn đến phục hồi sớm (E)
Tác động lên tử vong
Lọc máu hấp phụ bằng Polymyxin B (PMXHP) đã cho thấy sự cải thiện rối loạn chức năng nội tạng và lợi ích sống còn trong các nghiên cứu nhỏ [33] bao gồm một thử nghiệm ngẫu nhiên nhỏ [34], trong khi các thử nghiệm lớn hơn không xác nhận những phát hiện này [35, 36]. Đánh giá việc sử dụng PMX-HP trong một thử nghiệm ngẫu nhiên có đối chứng người trưởng thành có nhiễm độc nội độc tố và sốc nhiễm trùng (nghiên cứu EUPHRATE) bao gồm các bệnh nhân bị sốc nhiễm trùng dai dẳng mặc dù đã hồi sức đầy đủ và điều trị bằng thuốc vận mạch [37]. Một xét nghiệm hoạt động nội độc tố (EAA) được áp dụng. Không có sự khác biệt về tỷ lệ tử vong được ghi nhận trong dân số trên theo protocol, (n = 244, điểm số rối loạn chức năng đa cơ quan (MODS)> 9, EAA ≥ 0,6). Tuy nhiên, trong số các bệnh nhân bị sốc kháng trị với MODS hơn 9 và EAA trong khoảng 0,6 đến 0,9, giảm đáng kể 10,7% tỷ lệ tử vong trong 28 ngày trong phân tích hậu kiểm đã được công nhận sau khi nhận được hai lần lọc PMX-B-HP [ 38]. Phân tích hậu kiểm cho thấy giảm đáng kể tỷ lệ tử vong khi EAA bị giới hạn ở mức dưới 0,9, điều này có thể gợi ý giới hạn trên đối với mức nội độc tố trước điều trị trong những bệnh lý này [38]. Một phân tích tổng hợp gần đây của 17 thử nghiệm đã chứng minh rằng điều trị PMX-B-HP có thể làm giảm tỷ lệ tử vong ở bệnh nhân nhiễm trùng huyết nặng và sốc nhiễm trùng. Các nghiên cứu bao gồm được phân tầng thành ba nhóm dựa trên tỷ lệ tử vong của nhóm điều trị thông thường: nhóm có nguy cơ thấp (tỷ lệ tử vong 0,6). Tỷ lệ rủi ro với khoảng tin cậy (CI) 95% cho phân tích phân tầng tử vong giữa PMX-HP và các nhóm điều trị thông thường đã được tính toán và trình bày dưới dạng thống kê tóm tắt. Đây là một phân loại đến sau có thể được coi là một cảnh báo chính của phân tích tổng hợp này. Ngoài ra tỷ lệ tử vong không phản ánh nồng độ và tải lượng cytokine và do đó không phải là yếu tố dự báo đáp ứng với việc loại bỏ cytokine. Phân nhóm mức độ nghiêm trọng của bệnh cho thấy giảm đáng kể nguy cơ tử vong chung ở nhóm có nguy cơ trung bình (tỷ lệ tử vong 0,3 – 0,6) và nhóm có nguy cơ cao (tỷ lệ tử vong> 0,6), nhưng không thuộc nhóm có nguy cơ thấp (tỷ lệ tử vong
Bão cytokine và rò rỉ mao mạch
Rò rỉ mao mạch là tình trạng không thích nghi và sự di chuyển không mong muốn của dịch, điện giải có hoặc không có protein vào mô kẽ tạo ra hiện tượng phù mô và phù nội tạng làm rối loạn chức năng cơ quan và suy [42]. Hội chứng tăng tính thấm toàn bộ (GIPS) được định nghĩa là sự cân bằng dịch dương tích lũy và rối loạn / suy chức năng cơ quan mới xuất hiện được mô tả ở những bệnh nhân có đáp ứng viêm toàn thân kéo dài dẫn đến rò rỉ albumin xuyên mao mạch. GIPS có thể là giai đoạn thứ ba liên tục sau cơn bão cytokine ban đầu và tổn thương sau tái tưới máu thiếu máu cục bộ và có thể là một dấu hiệu mạnh mẻ để bắt đầu BPT [43]
Chứng cứ của các câu trả lời
Trọng tâm của cuộc gặp đồng thuận này là xác định liệu có thể giảm mức cytokine hay không thông qua việc sử dụng công nghệ hấp thụ bằng cách sử dụng thiết bị CytoSorb® (Cytosorbents, Corporation, New Jersey, USA). Nó bao gồm một cột hấp thụ máu sử dụng một lần có thể được sử dụng với máy bơm máu chuẩn, giống như những máy RRT hoặc thông qua một thiết bị lọc máu [44-46]. Cột CytoSorb là thiết bị duy nhất hiện có chứng nhận CE để liên tục lấy các cytokine quá mức trong nhiễm trùng huyết nặng. Cột chứa đầy các hạt hấp thụ được làm từ một loại polymer xốp hấp phụ và thu giữ các cytokine khi máu đi qua thiết bị. Quá trình này phụ thuộc vào nồng độ, và do đó nồng độ các cytokine trong máu càng cao thì mức độ giảm càng nhanh. Mặc dù liệu pháp CytoSorb đã được mô tả cho các chỉ định khác, bao gồm nhiễm độc, tiêu cơ vân, tăng bilirubin máu, v.v., chúng tôi đã chọn tập trung vào nghiên cứu ở người trong nhiễm trùng huyết và sốc nhiễm trùng.
Quá trình đồng thuận
Cuộc họp đồng thuận này đã diễn ra trong Ngày Quốc tế về Dịch truyền (IFAD) lần thứ 6 được tổ chức tại Antwerp, Bỉ, vào cuối tháng 11 (23 tháng 11, 26 tháng 11 năm 2017). Chúng tôi đã theo cách tiếp cận Delphi cải tiến bao gồm kết hợp việc thẩm định các chứng cứ cùng với ý kiến chuyên gia để đạt được các khuyến cáo cho thực hành và nghiên cứu trong tương lai. Một nhóm các bác sĩ lâm sàng hồi sức đặc biệt, gây mê và hồi sức thận học quan trọng từ châu Âu đã được triệu tập để thảo luận về các vấn đề liên quan đến sự hấp thu của cytokine bằng cách sử dụng CytoSorb® hoặc các thiết bị khác ở người bị nhiễm trùng huyết và sốc nhiễm trùng. Những người tham gia được giao nhiệm vụ tóm tắt các tài liệu ở người từ trước cho đến nay, làm nổi bật các khoảng trống hiểu biết và đề xuất các lĩnh vực nghiên cứu tiềm năng. Tổng quan các tài liệu đã được thực hiện trước cuộc họp với một bài thuyết trình cho những người tham gia và đã đạt được sự đồng thuận. Các tìm kiếm EDLINE® và PubMed đã được thực hiện bằng cách sử dụng các thuật ngữ tìm kiếm: “cytosorb”, “haemofiltration”, “haemoadsorption”, “haemoperfusion” và ” sepsis OR septic shock OR critical care OR critical illness”. Danh sách tài liệu tham khảo của các bài báo được sàng lọc để xác định các bài viết liên quan khác. Khi cần thiết, các cuộc thảo luận thêm đã được thực hiện sau cuộc họp. Mặc dù các đại diện từ ngành công nghiệp chế tạo đã có mặt, họ không đóng góp cho cuộc thảo luận trừ khi được hỏi cụ thể và không đóng vai trò trong việc chuẩn bị bản thảo. Bài viết này phục vụ như là Tóm tắt điều hành cuối cùng của cuộc họp.
Sinh bệnh học
Như đã thảo luận, tình trạng viêm liên quan đến nhiễm trùng huyết dẫn đến giải phóng vào tuần hoàn nhiều chất trung gian gây viêm từ đó gây ra các tác dụng toàn thân nguy hiểm [44]. Mặc dù hiệu ứng này một phần có thể được sửa đổi thông qua các chất trung gian chống viêm, nhưng nếu tác dụng kéo dài có thể dẫn đến liệt miễn dịch tương đối [47, 48]. Khái niệm này rất quan trọng với quan điểm cho rằng nhiễm trùng huyết có liên quan đến việc giải phóng đáng kể các chất trung gian gây viêm và điều chỉnh những điều này sẽ dẫn đến kết quả cải thiện bệnh nhân [21]. Do đó, mong muốn về một liệu pháp có mục tiêu cụ thể hơn nhắm đến phản ứng viêm quá mức, thay vì chỉ áp dụng các kỹ thuật thay thế thận liên tục chuẩn, có thể dẫn đến rối loạn điều hòa các con đường chống viêm và mục đích cân bằng nội môi miễn dịch có thể bị cản trở thông qua việc làm xấu đi đáp ứng của vật chủ (Hình 1, 2). Thật vậy, sự rối loạn như vậy có thể được nhìn thấy ở những bệnh nhân nhiễm trùng huyết chuyển sang kiểu hình chống viêm muộn được gọi là ức chế miễn dịch liên quan đến nhiễm trùng huyết (SAI) [49 – 51]. Quá trình này liên quan đến việc giảm sản xuất các chất trung gian gây viêm cùng với các tác động trực tiếp đến hoạt động trình bày kháng nguyên. Đổi lại, điều này có thể dẫn đến tăng cường khả năng dung nạp miễn dịch với những thay đổi thể hiện trong các tế bào miễn dịch lưu hành và trong các mô [52]. Sau khi bị thương hoặc nhiễm trùng, có sự kích hoạt các yếu tố thể dịch như bổ thể sau đó kích hoạt các tế bào trình diện kháng nguyên (APCs) giải phóng một loạt các chất trung gian bao gồm cả cytokine. Đổi lại, những thứ này thu hút và, do đó, kích hoạt nhiều APC và bạch cầu trung tính hơn. Di chuyển đến các mạch bạch huyết dẫn lưu từ đó kích thích hoạt động miễn dịch thích nghi hơn nữa. Theo sau các quá trình này là các đáp ứng chống viêm, theo đó có sự giảm bớt phản ứng của vật chủ do tác động của các cytokine chống viêm như IL-10 được sản xuất. Trong trường hợp nguy kịch, điều này có thể dẫn đến ức chế miễn dịch như được mô tả [47, 48]. Cytokine đóng một vai trò quan trọng trong sự tiến triển của phản ứng nhiễm trùng huyết. Trong nhiễm trùng huyết sớm, TNFa, một cytokine tiền viêm do bạch cầu đơn nhân và đại thực bào sản xuất, là chất chỉ điểm của nhiễm trùng huyết sớm và tăng cường đáp ứng miễn dịch thích nghi [53]. Một số nghiên cứu đã chứng minh mối liên quan giữa tỷ lệ tử vong và TNF-α tăng cao mặc dù giá trị của TNF-α như là một yếu tố dự báo tỷ lệ tử vong vẫn còn hoài nghi [54]. IL-6, chủ yếu được sản xuất bởi các tế bào đơn nhân và đại thực bào, gây ra kích hoạt tế bào T, tăng sinh tế bào B và kích thích phản ứng giai đoạn cấp tính, tất cả dẫn đến tăng đáp ứng miễn dịch [55]. Nồng độ các chất viêm trong tuần hoàn tăng nhanh sau khi nhiễm với mức cao nhất gần 2 giờ sau khi bị tổn thương, mức tăng này có liên quan đến kết cuộc kém. Tuy nhiên, cytokine cũng có thể sản xuất từ các tế bào không miễn dịch và có tốc độ thanh thải thay đổi và do đó có thể không phản ánh chức năng tế bào miễn dịch trong mọi trường hợp [56]. Hơn nữa, IL-6 có cảm ứng tương đối nhanh cùng với thời gian bán hủy ngắn và những đặc điểm này làm cho nó phù hợp để theo dõi bệnh nhân mặc dù cho đến nay hầu hết các phòng thí nghiệm không thường xuyên thực hiện định lượng nó. Liên quan đến các cytokine chống viêm, IL-10 được nghiên cứu nhiều nhất và có động lực học tương tự IL-6. Tuy nhiên, không giống như IL-6, IL-10 gây ra dung nạp kháng nguyên, tăng cường SAI và có thể tiên lượng tử vong [57]. Rõ ràng, coi IL-6 là mục tiêu tiềm năng vẫn còn thú vị, nhưng hồ sơ về động lực học IL-6 ở bệnh nhân bệnh nặng có thể không đồng nhất và bị ảnh hưởng bởi một số yếu tố. Thật vậy, trong nghiên cứu abdomix, một số bệnh nhân có và không có nồng độ IL-6 cao cũng nằm trong nhóm đối chứng [35, 36].
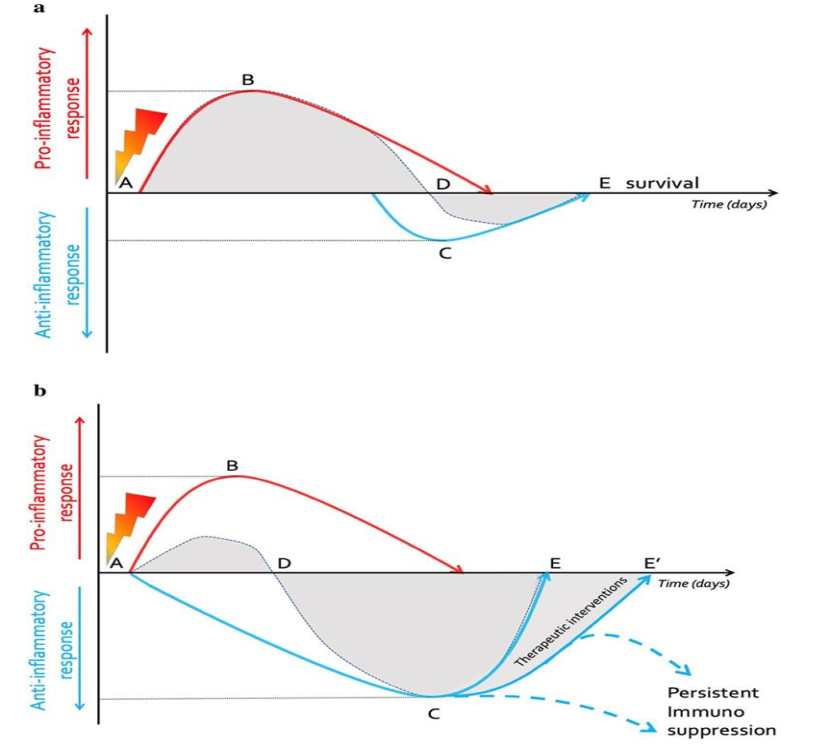
Hình 2. Cân bằng giữa các trung gian tiền viêm và chống viêm. a Theo sau một tổn thương ban đầu (nhiễm trùng) (A), thông thường sau khi điều trị (kháng sinh) đúng cách, các tác động đối kháng của tiền viêm(B) và chống viêm (C) lấy lại được sự cân bằng nội môi (duy trì) D), điều đó sẽ dẫn đến sự phục hồi và sống sót (E). Lấy từ Pfortmueller et al. với sự cho phép (Open Access CC BY License 4.0) Intensive Care Medicine Experimental (2017) 5:49 https://doi.org/10.1186/s40635-017-0163-0. b Sau một sự thương tổn (nhiễm trùng) (A), một đáp ứng của vật chủ bị mất điều hòa, nồng độ các chất tiền viêm (B) ban đầu áp đảo các chất chống viêm (C) dẫn đến mất cân bằng (D), sau đó là ức chế miễn dịch và gia tăng các chất trung gian chống viêm ( khu vực màu xám cho thấy mức độ chống viêm). Với các biện pháp can thiệp điều trị khác nhau (E) có thể phục hồi hoặc trì hoãn (E’) hoặc bệnh nhân có thể tiến triển thành tình trạng suy giảm miễn dịch kéo dài hoặc tê liệt. Lấy từ Pfortmueller et al.với sự cho phép (Open Access CC BY License 4.0) Intensive Care Medicine Experimental (2017) 5:49 https://doi.org/10.1186/s40635-017-0163-0
Lý do cho việc thải bỏ cytokine
Lý do
Phản ứng viêm quá mức thấy trong sốc nhiễm trùng có liên quan đến tỷ lệ tử vong cao [57, 58] tương quan với việc sản xuất các chất trung gian chống viêm và kháng viêm [57] hơn là mất cân bằng giữa các chất trung gian chống viêm và kháng viêm [59] (Hình 3). Điều này đã kích thích nhiều nỗ lực hướng đến làm suy giảm tác động của phản ứng này, đặc biệt khi các nghiên cứu ban đầu cho rằng việc lọc máu tĩnh mạch liên tục (CVVH) có thể làm giảm nồng độ cytokine [60]. Tuy nhiên, như đã thảo luận, những quan sát ban đầu này chưa thể chuyển biến thành lợi ích lâm sàng. Phân tích tổng hợp cho thấy BPT duy nhất có khả năng hiệu quả trong điều trị nhiễm trùng huyết là thay huyết tương hoặc hấp thu đặc biệt với Polymyxin B [2, 39]. Mặc dù kết quả ban đầu sử dụng lọc máu hấp phụ Polymyxin B cho thấy hứa hẹn [31], nhưng điều này đã không được đưa ra bởi các thử nghiệm lâm sàng ngẫu nhiên tiếp theo [32]. Với các công nghệ hấp thụ, chúng tôi đã chọn tập trung vào việc sử dụng CytoSorb như một thiết bị hấp thụ máu. Chất hấp phụ có bề mặt khoảng 45.000 m2 so với máy lọc máu thông thường có bề mặt 1111 m2 với mức cắt phân tử khoảng 60 kDa loại bỏ các cytokine cũng như các chất độc và thuốc khác. Kết quả là, CytoSorb không hấp thụ nội độc tố có trọng lượng phân tử 100 kDa. CytoSorb có thể bão hòa về sự hấp phụ trong môi trường lâm sàng (chủ yếu là sau 8 giờ) được chứng minh bằng sự tăng trở lại của liều thuốc vận mạch, nhưng có thể điều chỉnh khi thay quả CytoSorb. Cho đến nay, các nghiên cứu in vitro chưa đánh giá được về quá trình bão hòa hấp phụ của chất hấp phụ. Đây có thể là một lĩnh vực thú vị cho nghiên cứu trong tương lai. Nhiều nghiên cứu tiền lâm sàng sử dụng mô hình động vật nhiễm trùng huyết đã chứng minh giảm các cytokine và chemokine lưu hành khác nhau, giảm tổn thương nội tạng và cải thiện khả năng sống còn [61 .64].
Tác động lên những cytokine khác nhau
Trong một nghiên cứu, việc loại bỏ các cytokine đã được xác nhận với tỷ lệ chiết xuất cytokine đạt gần 30% [65]. Trong nghiên cứu này, nồng độ trong huyết tương của cả IL-6 và TNF-α, nhưng không phải IL-10, đã giảm đáng kể sau giờ điều trị đầu tiên [65]. Loại bỏ tổng thể là lớn nhất đối với IL-6, 28% (p = 0,006) và ít nhất đối với yếu tố hoại tử khối u, 8,5% (p = 0,13). Tuy nhiên, nồng độ trong huyết tương của cả ba cytokine đều tăng theo thời gian và ở trên mức cơ bản khi kết thúc can thiệp (4 giờ). Trong một nghiên cứu gần đây hơn, nhóm Antoine Schneider [66] đã tiến hành thử nghiệm ngẫu nhiên đơn trung tâm, thử nghiệm ở 30 bệnh nhân trải qua phẫu thuật tim chương trình và được coi là có nguy cơ xuất hiện biến chứng. Bệnh nhân được phân bổ ngẫu nhiên theo chăm sóc chuẩn (n=15) hoặc hấp thu máu CytoSorb® (n = 15) trong phẫu thuật bắc cầu tim phổi (CPB). Kết cục chính là sự khác biệt giữa hai nhóm về nồng độ cytokine (IL-1a, IL-1b, IL-2, IL-4, IL-5, IL-6, IL-10, TNFα, interferon gamma (IFN- ), protein hóa trị đơn bào-1 (MCP-1) được đo khi gây mê, vào cuối CPB, 6 và 24 giờ sau khởi đầu CPB. Tuy nhiên, can thiệp không liên quan đến việc giảm các cytokine tiền viêm hoặc chống viêm cũng như không có sự cải thiện nào về kết quả lâm sàng có liên quan [66].
Những kết quả này là mâu thuẫn, và đây rõ ràng là một mối quan tâm lớn về kỹ thuật mới này. Khả năng kỹ thuật này có thể hứa hẹn, chúng tôi đã xem xét dữ liệu có sẵn với mục đích tạo ra các tuyên bố đồng thuận hiện tại và chỉ ra hướng nghiên cứu thêm [67 – 69].
Hình 3. Lý do loại bỏ hàng loạt cytokine trong cơn bão cytokine. Khi cân bằng nội môi là bình thường, các chất tiền viêm (vòng tròn trắng) và các chất trung gian chống viêm (vòng tròn xanh xám) cân bằng, các phân tử có mặt đồng đều như thể hiện trong bảng đầu tiên của hình (a). Khi các phân tử được hấp phụ trong bệnh cảnh này, tốc độ loại bỏ của cả hai sẽ tương tự nhau. Tuy nhiên, nếu một thành phần trong tình trạng quá mức, đó là trường hợp xảy ra trong cơn bão cytokine (b), thì tốc độ loại bỏ phải cao hơn tương ứng chất trung gian có mặt số lượng lớn. Điều này cho thấy lý do tại sao loại bỏ số lượng lớn cytokine trong cơn bão cytokine có thể giúp lấy lại cân bằng cân bằng nội môi
Việc sử dụng liệu pháp hấp thu cytosorb ở bệnh nhân nhiễm trùng huyết hay sốc nhiễm trùng có chứng minh được lợi ích lâm sàng nào không?
Mặc dù có rất nhiều bằng chứng thực nghiệm hỗ trợ cho việc sử dụng hấp thụ máu với CytoSorb trong sốc nhiễm trùng, nhưng có rất ít bằng chứng từ các nghiên cứu ở người. Có hơn 100 nghiên cứu loạt ca mô tả việc sử dụng CytoSorb trong nhiều tình huống lâm sàng và nói chung, việc điều trị được dung nạp tốt, nhưng các nghiên cứu lâm sàng nói chung là loạt ca bệnh nhỏ [70 – 72]. Nghiên cứu lớn nhất cho đến nay, một nghiên cứu ngẫu nhiên, nhãn mở đã thu nhận bệnh nhân từ 10 địa điểm nghiên cứu của Đức trong giai đoạn 2008 – 2012 [73, 74]. Tổng cộng có 582 bệnh nhân được sàng lọc trong nghiên cứu này, trong đó 100 bệnh nhân thở máy bị nhiễm trùng huyết nặng hoặc sốc nhiễm trùng cùng với tổn thương phổi cấp hoặc hội chứng suy hô hấp cấp tính đã được tuyển dụng. Phân tích cuối cùng được giới hạn ở 97 ca. Đáng chú ý, không có dữ liệu nào liên quan đến các chỉ số huyết động như chỉ số tim hoặc sức cản mạch hệ thống được ghi lại. Bệnh nhân ban đầu được chọn ngẫu nhiên trên cơ sở 1: 1 bằng cách sử dụng phong bì dán kín, nhưng do nghi ngờ có sự bất thường, hệ thống này đã được thay đổi sau khi 32 bệnh nhân được tuyển dụng vào một hệ thống điện tử sử dụng block 6. Nhóm điều trị đã nhận được 6 giờ lọc máu CytoSorb ngày cho đến 7 ngày so với chăm sóc chuẩn. Biến số kết cuộc chính là đạt được mức độ bình thường hóa chứ không phải là các mức IL-6 tuyệt đối với các mức IL-6 sau điều trị chia cho nồng độ IL-6 ban đầu của từng bệnh nhân. Thật không may, trong 22 bệnh nhân, không có biến số kết cuộc nào thích hợp, và chỉ có 75 bệnh nhân được đưa vào đoàn hệ cuối cùng. Các biến số kết cuộc thứ cấp bao gồm một loạt các cytokine khác, thời gian thở máy, tử vong trong 28 ngày và điểm MOD. Kết quả của nghiên cứu này là âm tính. Việc sử dụng hấp thụ máu không liên quan đến việc giảm nồng độ IL-6. Sau khi điều chỉnh với bệnh đi kèm (tuổi, giới tính và RRT), không có mối liên quan nào điều trị với hấp thu máu và tử vong hoặc bất kỳ biến số kết cuộc thứ cấp nào. Điều đã được ghi nhận là có một số lượng lớn bệnh nhân có ý nghĩa lâm sàng cần RRT trong nhóm điều trị (31,9% so với 16,3%). Mặc dù ứng dụng của cột CytoSorb đã dẫn đến việc loại bỏ IL6 có thể thấy được (5-18%) trong suốt thời gian 6 giờ, nhưng điều này không làm giảm kết cuộc chung so với kiểm soát. Điều này có vẻ không nhất quán vì ảnh hưởng của điều trị đối với IL-6 giữa các nhóm được đo ở ngày thứ 2 và không phải trong khoảng thời gian được sử dụng để đánh giá loại bỏ IL-6 (lần lượt là 15, 60, 180 và 360 phút) [73, 74].
Mặc dù đây có thể được coi là thử nghiệm ngẫu nhiên có kiểm soát (RCT) đầu tiên sử dụng kỹ thuật CytoSorb trong nhiễm trùng huyết, nhưng kết quả không cung cấp bất kỳ bằng chứng nào cho thấy việc điều trị dẫn đến kết cục lâm sàng có lợi. Nghiên cứu chỉ cung cấp được sự an toàn và hiệu quả của việc loại bỏ IL-6. Dân số bệnh nhân trong nghiên cứu cũng nhẹ hơn trong loạt ca bệnh được báo cáo gần đây [75], cho thấy kể từ năm 2008, CytoSorb đã được sử dụng ở nhóm dân số bệnh nặng hơn. Tương tự, một thử nghiệm đối chứng ngẫu nhiên tiến cứu ở những bệnh nhân trải qua phẫu thuật tim cũng không tìm thấy tác động đáng kể đến nồng độ cytokine mặc dù nghiên cứu này không được thực hiện trong nhiễm trùng huyết [76]. Trong một nghiên cứu hồi cứu phù hợp với xu hướng gần đây trên 32 bệnh nhân, ảnh hưởng của sự hấp phụ cytokine ở nhóm bệnh nhân có sốc dẫn mạch trong giai đoạn chu phẫu, đáp ứng viêm và kết quả trong quá trình ghép tim đã được nghiên cứu [77]. Điều trị CytoSorb trong phẫu thuật có liên quan đến việc giảm nhu cầu thuốc vận mạch và RRT ít thường xuyên hơn, không có sự khác biệt về thời gian thở máy và thời gian nằm ICU [78]. Một loạt ca khác ở bệnh nhân nhiễm trùng huyết chỉ ra việc giảm liều thuốc vận mạch, có thể được coi là một kết cuộc chính có liên quan, mặc dù đây không phải là nghiên cứu ngẫu nhiên [68 – 70]. Phân tích tạm thời thứ ba của CytoSorb Registry [75] trong số 135 bệnh nhân bị sốc nhiễm trùng và có điểm đánh giá Sinh lý cấp tính và sức khỏe mãn tính II (APACHE-II) dự đoán tỷ lệ tử vong là 78% có tỷ lệ tử vong quan sát được là 65% với cả PCT và mức IL-6 giảm rõ rệt sau 24 giờ [75]. Tỷ lệ tử vong dự đoán cao như vậy (78%) có thể được giải thích bằng nhiều lý do. Đầu tiên, khuyến cáo chỉ nên sử dụng phương pháp hấp thu máu Cytosorb ở những bệnh nhân có điểm APACHE-II trên 25. Thứ hai, các bác sĩ lâm sàng chỉ bắt đầu điều trị như một liệu pháp cứu cánh, muộn trong quá trình điều trị bệnh. Rõ ràng, với một số khảo sát, bạn không thể kiểm soát các tiêu chuẩn đủ điều kiện. Gần đây, thử nghiệm lâm sàng ngẫu nhiên đầu tiên trên CytoSorb dưới dạng điều trị độc lập (tức là không có CRRT) ở bệnh nhân bị sốc nhiễm trùng, thử nghiệm ACESS (Adsorption of Cytokines Early in Septic Shock: Hấp phụ Cytokine sớm trong Sốc nhiễm khuẩn) đã được công bố [78, 79]. Đây là một bằng chứng về nghiên cứu thí điểm trên 20 bệnh nhân được chọn ngẫu nhiên vào CytoSorb và một nhóm điều trị chuẩn, với sự hấp phụ cytokine được bắt đầu trong vòng 24 giờ đầu tiên sau khi bắt đầu sốc nhiễm trùng. Việc điều trị được chứng minh là an toàn và giúp giảm đáng kể lượng norepinephrine đòi hỏi.
Các kết quả của cuộc gặp đồng thuận
Cho đến nay, không có đủ dữ liệu để cung cấp bất kỳ loại khuyến cáo dựa trên bằng chứng nào cho việc sử dụng các công nghệ hấp thụ, nhưng các điểm sau đây được hội đồng coi là câu hỏi chưa được trả lời quan trọng nhất có thể hỗ trợ thêm cho các khuyến cáo.
Tiêu điểm 1: bệnh nhân nào có lợi ít nhiều nhất từ việc loại bỏ cytokine?
Mục đích của bất kỳ phương pháp điều trị nào là chỉ chọn những bệnh nhân có xác suất lợi ích cao từ can thiệp. Cho đến nay, hầu hết các loạt ca bao gồm các bệnh nhân có tỷ lệ tử vong dự đoán cao khi bị sốc nhiễm trùng mặc dù ít bệnh nhân được ước tính nồng độ cytokine [64, 71]. Trong trường hợp được ghi lại, có sự khác biệt đáng kể về nồng độ IL-6, và do đó, người ta có thể kết luận rằng một số bệnh nhân được điều trị, lợi ích sẽ không đáng kể nếu thực sự mức [IL-6] có thể dự đoán đáp ứng với điều trị. Do đó, bất kỳ nghiên cứu nào trong tương lai nên cố gắng làm phong phú dân số nghiên cứu thông qua đo lường cytokine hoặc một dấu hiệu khác của đáp ứng trị liệu như PCT [70]. Nồng độ PCT ngưỡng có thể nên được đưa vào như một yếu tố kết luận trong các nghiên cứu trong tương lai. Ngoài ra, lựa chọn bệnh nhân có thể tập trung vào những người cần dùng thuốc vận mạch liều cao để duy trì tưới máu cơ quan đầy đủ vì việc giảm các thuốc này là kết quả lâm sàng có ý nghĩa có thể chuyển thành các lợi ích khác [78, 79].
Tiêu điểm 2: khi nào bắt đầu tiến hành loại bỏ cytokine ở bệnh nhân nhiễm khuẩn huyết?
Thời điểm điều trị vẫn là một vấn đề trong nhiều khía cạnh của y học hồi sức, không chỉ những vấn đề liên quan đến điều trị với các màng ngoài cơ thể. Một số loạt ca báo cáo một kết quả ít thuận lợi hơn ở những người bắt đầu điều trị muộn hơn 24 giờ sau khi chẩn đoán [70]. Dữ liệu của thử nghiệm ACESS cũng hỗ trợ khái niệm bắt đầu điều trị trong vòng 24 giờ [78, 79]. Theo đó, bất kỳ khuyến nghị nào về thời gian điều trị sẽ phụ thuộc vào dân số bệnh nhân và cách lựa chọn các bệnh nhân tương lai. Trong đó kết cuộc chính là giảm thuốc vận mạch, thì thời gian sẽ tương đối dễ xác định, trong khi mức cytokine có thể ít rõ ràng hơn đặc biệt là do sự khác biệt về động học. Chắc chắn, lý do cho bất kỳ liệu pháp lọc máu nào sẽ yêu cầu bắt đầu điều trị sớm trong quá trình bệnh để tối đa hóa lợi ích. Có lẽ nên bắt đầu điều trị trực tiếp trong phòng mổ trong khi phẫu thuật cho bệnh nhân viêm phúc mạc đã bị rối loạn huyết động và sử dụng catecholamine nên được xem xét cho các nghiên cứu trong tương lai. Tuy nhiên, thời gian để can thiệp có thể còn phức tạp hơn, đặc biệt là khi suy giảm miễn dịch do nhiễm trùng huyết được tính đến. Sự ức chế này là điều cần thiết để hạn chế hậu quả lên trên các mô chủ của đáp ứng vật chủ do nhiễm trùng (tức là duy trì chu trình viêm -sửa chữa – làm lành). Đặc điểm của ức chế miễn dịch này có thể là một trong những chỉ số tốt nhất để quyết định khi nào nên sử dụng kỹ thuật hấp phụ để giảm viêm[22].
Tiêu điểm 3: liệu pháp thải bỏ cytokine kéo dài bao lâu và bao lâu thì nên được tiếp tục?
Thời gian điều trị tối ưu vẫn chưa được quyết định. Hơn nữa, thời gian điều trị ban đầu cũng không rõ ràng. Schadler và cộng sự, bệnh nhân được điều trị trong 6 giờ một ngày trong 7 ngày [73, 74], trong khi các nghiên cứu được báo cáo khác không mô tả thời gian điều trị hoặc sử dụng quả lọc trong 24 giờ [70, 71]. Không có bằng chứng cho đến nay về thời gian điều trị hấp phụ thích hợp hoặc thời gian cần cho điều trị ban đầu. Một lần nữa, điều này có thể được định hướng trong các nghiên cứu trong tương lai bằng cách sử dụng IL-6 hay PCT thay thế cho việc loại bỏ hoàn toàn cytokine và giảm mức độ toàn thân cùng với cải thiện lâm sàng có thể là nơi hợp lý để bắt đầu đánh giá khoảng thời gian điều trị. Ngoài ra, không biết liệu trị liệu ban đầu nên trong 12 hay 24 giờ. Một lần nữa, một cách tiếp cận thực tế có thể được định hướng bằng ước tính nồng độ cytokine. Nghiên cứu của Schadler [73, 74] có thể cung cấp một số câu trả lời. Mặc dù việc điều trị kéo 6 giờ không dẫn đến giảm IL-6 tổng thể so với các biện pháp kiểm soát trong khoảng thời gian 24 giờ, nhưng đã loại bỏ IL-6 tăng lên khi sử dụng phương pháp hấp phụ máu [73, 74]. Theo sau, nếu mục đích của điều trị là làm giảm nồng độ cytokine, thì thời gian điều trị kéo dài sẽ liên quan đến việc giảm nồng độ toàn thân. Tuy nhiên, việc loại bỏ các cytokine này có thể bị giảm tác dụng do sự chuyển dịch cytokine từ kẽ vào khoang máu do đó phủ nhận mọi tác động tổng thể [22, 68, 69]. Do đó, các nghiên cứu dược động học về độ thanh thải cytokine trong tương lai sẽ cực kỳ hữu ích để phân định rõ hơn thời gian điều trị của hấp phụ máu liên quan đến lợi ích cho bệnh nhân bị bão cytokine.
Tiêu điểm 4: nhóm quần thể bệnh nhân nào nên được nghiên cứu trong tương lai?
Các nghiên cứu trong tương lai nên đặt mục tiêu bao gồm các đoàn hệ đồng nhất của bệnh nhân sốc nhiễm trùng, đặc biệt là những người có nhu cầu thuốc vận mạch rất cao. Một dân số thú vị khác để nghiên cứu có thể là bệnh nhân mắc hội chứng suy hô hấp cấp tính (ARDS). Tỷ lệ tử vong của ARDS vẫn còn cao trong khoảng từ 30 đến 50% [80]. ARDS là một hội chứng không đồng nhất, được đặc trưng bởi sự tăng tính thấm mao mạch phổi [81]. Chính sự tích tụ chất lỏng giàu protein bên trong phế nang sẽ gây ra tổn thương cho lớp nội mô mao mạch và biểu mô phế nang dẫn đến giải phóng các cytokine, tạo ra tổn thương phế nang lan tỏa [82]. Oxy hóa màng ngoài cơ thể (ECMO) có thể phục vụ như một liệu pháp cứu cánh với thử nghiệm CESAR đã dẫn đến việc sử dụng tăng cường liệu pháp này [83]. Một số báo cáo ca đề cập đến hiệu quả tích cực của việc kết hợp trị liệu CysoSorb đối với suy hô hấp do ARDS, sử dụng liệu pháp ECMO và CytoSorb. Việc sử dụng CytoSorb dường như giúp giải quyết tình trạng giảm bạch cầu trung tính nhanh chóng, đảo ngược trạng thái sốc độc tố và giảm liều nhanh khi truyền thuốc vận mạch liều cao và giảm có ý nghĩa nồng độ của các chất trung gian gây viêm lưu hành trong tuần hoàn [84 .88].
Tiêu điểm 5: mức độ nghiêm trọng của nhiễm trùng huyết như thế nào là thích hợp nhất để đưa vào nghiên cứu loại bỏ cytokine ở bệnh nhân nhiễm trùng huyết?
Can thiệp có nhiều khả năng mang lại lợi ích cho bệnh nhân có bệnh nặng nghiêm trọng (ví dụ: APACHE-II lớn hơn 25) [75]. Sốc kháng trị buộc phải sử dụng liều cao thuốc vận mạch và suy đa tạng sớm với một số bằng chứng về cơn bão cytokine (tức là: PCT cao) nên được ưu tiên [70, 71, 79].
Tiêu điểm 6: những dấu ấn sinh học nào là phù hợp nhất để đưa vào nghiên cứu loại bỏ cytokine ở bệnh nhân bị sốc nhiễm trùng?
Không rõ liệu nồng độ cytokine có thể xác định bệnh nhân lý tưởng để điều trị hay không. Phát hiện cơn bão cytokine dai dẳng, mặc dù hồi sức và kiểm soát nguồn nhiễm khuẩn đầy đủ có thể là một tín hiệu báo động rằng việc loại bỏ cytokine có thể có lợi. PCT là một trong những dấu ấn sinh học gây viêm được nghiên cứu nhiều nhất trong nhiễm trùng huyết có thể được thêm vào như một dấu ấn sinh học để xác định bệnh nhân nào bắt đầu trị liệu [87, 88].
Thật khó để xác định các giá trị trên của ngưỡng tuyệt đối nào để có thể chỉ định loại bỏ cytokine, nhưng có một số bằng chứng cho thấy động lực học của PCT, tức là việc PCT không giảm hoặc tăng nhanh mức độ có thể giúp xác định cơn bão cytokine kéo dài [89]. Thực tế là trọng lượng phân tử của PCT là khoảng 13 kDa và PCT có thể được loại bỏ bởi chất hấp phụ. Do đó, PCT là một dấu ấn sinh học tốt để quyết định khi nào bắt đầu nhưng không dùng theo dõi đáp ứng với trị liệu cũng như quyết định khi nào nên dừng lại. IL-6 cũng có thể là một dấu ấn sinh học đầy triển vọng, nhưng hiện tại, người ta biết rất ít về động lực học IL-6 và phản ứng của nó đối với việc điều trị thích hợp hoặc không phù hợp, cần nghiên cứu thêm. Tuy nhiên, các dấu ấn sinh học để mô tả tình trạng viêm không thể được tóm tắt bằng cách giới hạn IL-6 liên quan và PCT: chúng ta cũng cần phải có được thông tin về chức năng tế bào (miễn dịch và mô) [22].
Tiêu điểm 7: các khuyến cáo nghiên cứu tương lai.
Dựa trên các nghiên cứu trên, các nghiên cứu trong tương lai phải xác định dân số nghiên cứu theo các thông số sinh lý (APACHE-II) hoặc SOFA [90], nhu cầu vận mạch, v.v. có thể sử dụng các dấu ấn sinh học như mức IL-6 hoặc PCT. Thứ hai, các biến số kết cuộc liên quan đến lâm sàng nên được lựa chọn. Trong trường hợp đầu tiên, đây cũng có thể là liều thuốc vận mạch dưới sự hướng dẫn và tuân thủ nghiêm ngặt protocol. Trong mọi trường hợp, phải theo dõi huyết động xâm lấn bao gồm cung lượng tim và các biến số xuất phát và dữ liệu được ghi lại, để hiểu rõ hơn về tác dụng sinh lý bệnh của viêc loại bỏ cytokine. Liên quan đến thời gian điều trị, điều này nên được hướng dẫn bằng các phương pháp điều trị khác cũng như theo dõi sự thay đổi các dấu ấn sinh học nếu có thể.
Về các biến số kết cuộc của nghiên cứu, hội đồng đồng thuận đã đồng ý rằng nên đánh giá các biến số kết cục khác thay vì tỷ lệ tử vong nên được chọn trong tương lai để kiểm tra hiệu quả thực tế của liệu pháp này. Theo dõi rối loạn chức năng nội tạng bằng các công cụ có khả năng đo lường như điểm số SOFA có thể là một lựa chọn tốt hơn, để hiểu được tác dụng sinh lý của điều trị CytoSorb. Hơn nữa, một biến số kết cuộc chính là các biến số liên quan đến huyết động như thay đổi nhu cầu thuốc vận mạch cũng có thể được áp dụng, trong khi đó tỷ lệ tử vong, thời gian lưu lại ICU, thời gian thở máy, phụ thuộc lọc máu, v.v., làm biến số kết cuộc thứ cấp. Cuối cùng, các tác dụng phụ tiềm ẩn cũng cần được đánh giá như loại bỏ kháng sinh, và đặc biệt là kháng sinh có tính ái mỡ [91].
Các kết luận
Cho đến nay, có rất ít dữ liệu xung quanh việc sử dụng các liệu pháp hấp phụ máu trong điều trị sốc nhiễm trùng. Mặc dù các tuyên bố đồng thuận có thể có vẻ không chắc chắn, nhưng chúng phản ánh trạng thái hiểu biết hiện tại của chúng tôi. Tuy nhiên, chúng tôi hy vọng rằng bài viết đồng thuận hiện tại cũng cung cấp một khuôn khổ cho các lĩnh vực cần được giải quyết trong tương lai thay vì tiếp tục phụ thuộc vào các báo cáo loạt ca đơn trung tâm.
Hiện tại, kết quả lâm sàng với việc sử dụng các liệu pháp hấp phụ cytokine là khan hiếm và khá thất vọng. Cần có nhiều nghiên cứu hơn để có hiểu biết chính xác về các tính chất hấp phụ (động học, độ bão hòa, giải phóng các chất trung gian, loại bỏ thuốc….) của chất hấp phụ. Nồng độ cytokine huyết tương trước và sau khi điều trị của các loại cytokine khác nhau nên được cung cấp để chứng minh rõ ràng các tính chất hấp phụ. Chỉ thông qua các nghiên cứu lâm sàng ngẫu nhiên có đối chứng được tiến hành với các tiêu chuẩn lựa chọn bệnh nhân phù hợp và biến số kết cuộc liên quan đến sinh lý, chúng ta mới biết liệu các kỹ thuật hấp thu máu có phải là một liệu pháp tương lai cho nhiễm trùng huyết hay không.
Abbreviations
APACHEII: acute physiology and chronic health evaluation II; ARDS: acute respiratory distress syndrome; APCs: antigenpresenting cells; BPT: blood purification techniques; CPB: cardiopulmonary bypass; CRRT : continuous renal
replacement therapies; CVVH: continuous venovenous haemofiltration; CMT: cytokine modulatory techniques; CHT: CytoSorb®, cytokine haemoadsorption techniques; DAMPs: damageassociated molecular patterns; EAA: endotoxin activity assay; ECMO: extracorporeal membrane oxygenation; GIPS: global increased permeability syndrome; HVHF: highvolume haemofiltration; ICU: intensive care unit; IFNγ: interferon gamma; IL: interleukin; IFNγ: interferon gamma; IFAD: international fluid academy day; MCP1: monocyte chemotactic protein1; MODS: multiple organ dysfunction score; PAMPs: pathogenassociated molecular patterns; PMXHP: polymyxin B haemoperfusion; PCT: procalcitonin; PRCT : prospective randomized control trial; RCT : randomized control trial; RRT : renal replacement therapies; SAI: sepsisassociated immunosuppression; TNFalpha: tumour necrosis factor alpha.
Acknowledgements
This article is endorsed by the International Fluid Academy (IFA). The mission statement of the IFA is to foster education, promote research on fluid management and hemodynamic monitoring, and thereby improve survival of critically ill by bringing together physicians, nurses, and others from throughout the world and from a variety of clinical disciplines. The IFA is integrated within the notforprofit charitable organization iMERiT, International Medical Education and Research Initiative, under Belgian law. The IFA website (http://www.fluid acade my.org) is now an official SMACC affiliated site (Social Media and Critical Care) and its content is based on the philosophy of FOAM (Free Open Access Medical education—#FOAMed). The site recently received the HONcode quality label for medical education (https ://www.healt honne t.org/HONco de/ Condu ct.html?HONCo nduct 51973 9). The consensus meeting was supported by an unrestricted educational grant by Cytosorbents that covered the costs for the travel and stay of the participants of the consensus meeting during the 6th IFAD. No extra fees nor honoraria were paid. The company was not involved during the writing process of this executive summary.
Authors’ contributions
PMH, LF, EH and ZM designed the paper and wrote the first draft. All authors participated in drafting and reviewing. All authors read and approved the final manuscript.
Funding
None.
Availability of data and materials
Not applicable.
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
Patrick M. Honore has served as consultant for Baxter, Gambro, Nikkiso and Asahi. He received honoraria for lectures from Baxter, Gambro, Nikkiso, Asahi,
BBraun and Cytosorbents. Manu L.N.G. Malbrain is inaugural President of WSACS The Abdominal Compartment Society, http://www.wsacs .org) and current Treasurer. He is also cofounder of WSACS. He is also member of the medical advisory Board of Getinge (Pulsion Medical Systems) and Serenno Medical. He consults for Baxter, Maltron, ConvaTec, Acelity, Spiegelberg and Holtech Medical. He is cofounder of the International Fluid Academy (IFA, http://www.fluid acade my.org). Zolt Molnar recived honoratia for lectures from Cytosorbents. Olivier JoannesBoyau has served as a consultant to BBraun and Baxter. Received honoraria or travel expenses for lectures from Baxter, Fresenius and BBraun.Rita Jacobs has no conflicts of interest with this paper. Eric Hoste has no conflicts of interest with this paper. Lui Forni has no conflict of interests with this paper.
Author details
1Intensive Care Department, CHU Brugmann University Hospital, 4, Place Arthur Van Gehuchtenplein, 1020 Brussels, Belgium. 2Intensive Care Department, Ghent University Hospital, Ghent, Belgium. 3Department of Anaesthesiology and Intensive Therapy, Faculty of Medicine, University of Szeged, Szeged, Hungary. 4Intensive Care Department, University Hospital Brussels (UZB), Jette, Belgium. 5Département d’AnesthésieRéanimation SUD, CHU Bordeaux, 33000 Bordeaux, France. 6Faculty of Medicine and Pharmacy, Vrije Universiteit Brussel (VUB), Brussels, Belgium. 7Department of Critical Care, Royal Surrey County Hospital, NHS Foundation Trust, Guildford, UK. 8Department of Clinical and Experimental Medicine, Faculty of Health Sciences, University of Surrey, Guildford, UK.
Received: 30 January 2019 Accepted: 7 May 2019
References
Rhee C, Dantes R, Epstein L, CDC prevention epicenter program, et al. Incidence and trends of sepsis in US Hospitals using clinical vs claims data, 2009–2014. JAMA. 2017;318:1241–9.
Rimmer E, Houston BL, Kumar A, et al. The efficacy and safety of plasma exchange in patients with sepsis and septic shock: a systematic review and metaanalysis. Crit Care. 2014;18:699.
Stoller J, Halpin L, Weis M, et al. Epidemiology of severe sepsis: 2008– 2012. J Crit Care. 2016;31(1):58–62.
Machado FR, Cavalcanti AB, Bozza FA, SPREAD Investigators; Latin American Sepsis Institute Network, et al. The epidemiology of sepsis in Brazilian intensive care units (the Sepsis PREvalence Assessment Database, SPREAD): an observational study. Lancet Infect Dis. 2017;17:1180–9.
ShankarHari M, Ambler M, Mahalingasivam V, Jones A, Rowan K, Rubenfeld GD. Evidence for a causal link between sepsis and longterm mortality: a systematic review of epidemiologic studies. Crit Care. 2016;20:101.
Harrison AM, Gajic O, Pickering BW, Herasevich V. Development and implementation of sepsis alert systems. Clin Chest Med. 2016;37:219–29.
Gaieski DF, Edwards JM, Kallan MJ, Carr BG. Benchmarking the incidence and mortality of severe sepsis in the United States. Crit Care Med. 2013;41:1167–74.
Kaukonen KM, Bailey M, Suzuki S, Pilcher D, Bellomo R. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000–2012. JAMA. 2014;311:1308–16.
Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013;369:840–51.
Hotchkiss RS, Monneret G, Payen D. Sepsisinduced immunosuppression: from cellular dysfunctions to immunotherapy. Nat Rev Immunol. 2013;13:862–74.
Iskander KN, Osuchowski MF, StearnsKurosawa DJ, et al. Sepsis: multiple abnormalities, heterogeneous responses, and evolving understanding. Physiol Rev. 2013;93:1247–88.
Dreiher J, Almog Y, Sprung CL, SEPSISISR Group, et al. Temporal trends in patient characteristics and survival of intensive care admissions with sepsis: a multicenter analysis. Crit Care Med. 2012;40(3):855–60.
Kadri SS, Rhee C, Strich JR, et al. Estimating tenyear trends in septic shock incidence and mortality in United States academic medical centers using clinical data. Chest. 2017;151:278–85.
Stevenson EK, Rubenstein AR, Radin GT, Wiener RS, Walkey A. Two decades of mortality trends among patients with severe sepsis: a comparative metaanalysis. Crit Care Med. 2014;42:625–31.
Iwashyna TJ, Cooke CR, Wunsch H, Kahn JM. Population burden of longterm survivorship after severe sepsis in older Americans. J Am Geriatr Soc. 2012;60:1070–7.
Torio CM, Andrews RM. National inpatient hospital costs: the most expensive conditions by payer, 2011: statistical brief #160 Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Rockville (MD); 2006.
Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013;39:165–228.
Zhou F, Peng Z, Murugan R, Kellum JA. Blood purification and mortality in sepsis: a metaanalysis of randomized trials. Crit Care Med. 2013;41:2209–20.
Callard R, George AJ, Stark J. Cytokines, chaos, and complexity. Immunity. 1999;11:507–13.
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis3). JAMA. 2016;315(8):801–10. https ://doi.org/10.1001/jama.2016.0287.
Ronco C, Tetta C, Mariano F, et al. Interpreting the mechanisms of continuous renal replacement therapy in sepsis: the peak concentration hypothesis. Artif Organs. 2003;27(9):792–801.
van der Poll T, van de Veerdonk FL, Scicluna BP, Netea MG. The immunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol. 2017;17(7):407–20. https ://doi.org/10.1038/nri.2017.36.
Honoré PM, Matson JR. Extracorporeal removal for sepsis: acting at the tissue level–the beginning of a new era for this treatment modality in septic shock. Crit Care Med. 2004;32(3):896–7.
Di Carlo JV, Alexander SR. Hemofiltration for cytokinedriven illnesses: the mediator delivery hypothesis. Int J Artif Organs. 2005;28:777–86.
Peng ZY, Bishop JV, Wen XY, et al. Modulation of chemokine gradients by apheresis redirects leukocyte trafficking to different compartments during sepsis, studies in a rat model. Crit Care. 2014;18:R141.
Lukaszewicz AC, Payen D. Purification methods: a way to treat severe acute inflammation related to sepsis? Crit Care. 2013;17:159.
Cole L, Bellomo R, Journois D, Davenport P, Baldwin I, Tipping P. Highvolume haemofiltration in human septic shock. Intensive Care Med. 2001;27:978–86.
Honore PM, Jamez J, Wauthier M, et al. Prospective evaluation of shortterm, highvolume isovolemic hemofiltration on the hemodynamic course and outcome in patients with intractable circulatory failure resulting from septic shock. Crit Care Med. 2000;28:3581–7.
JoannesBoyau O, Honore PM, Perez P, et al. Highvolume versus standardvolume haemofiltration for septic shock patients with acute kidney injury (IVOIRE study): a multicentre randomized controlled trial. Intensive Care Med. 2013;39:1535–46.
Clark E, Molnar AO, JoannesBoyau O, Honore PM, Sikora L, Bagshaw SM. Highvolume hemofiltration for septic acute kidney injury: a systematic review and metaanalysis. Crit Care. 2014;18:R7.
Cavaillon JM, Munoz C, Fitting C, Misset B, Carlet J. Circulating cytokines: the tip of the iceberg? Circ Shock. 1992;38(2):145–52.
Sun S, Sursal T, Adibnia Y, Zhao C, Zheng Y, Li H, LE Otterbein, et al. Mitochondrial DAMPs increase endothelial permeability through neutrophil dependent and independent pathways. PLoS ONE. 2013;8(3):e59989. https ://doi.org/10.1371/journ al.pone.00599 89.
Vincent JL, Laterre PF, Cohen J, et al. A pilotcontrolled study of a polymyxin Bimmobilized hemoperfusion cartridge in patients with severe sepsis secondary to intraabdominal infection. Shock. 2005;23:400–5.
Cruz DN, Antonelli M, Fumagalli R, et al. Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. JAMA. 2009;301:2445–52.
Payen DM, Guilhot J, Launey Y, ABDOMIX Group, et al. Early use of polymyxin B hemoperfusion in patients with septic shock due to peritonitis: a multicenter randomized control trial. Intensive Care Med. 2015;41:975–84.
Coudroy R, Payen D, Launey Y, ABDOMIX group, et al. Modulation by polymyxinB hemoperfusion of inflammatory response related to severe peritonitis. Shock. 2017;47:93.
Dellinger RP, Bagshaw SM, Antonelli M, Foster DM, Klein DJ, Marshall JC, et al. Effect of targeted polymyxin B hemoperfusion on 28day mortality in patients with septic shock and elevated endotoxin level: the EUPHRATES randomized clinical trial. JAMA. 2018;320(14):1455–63. https ://doi. org/10.1001/jama.2018.14618.
Iba T, Fowler L. Is polymyxin Bimmobilized fiber column ineffective for septic shock? A discussion on the press release for EUPHRATES trial. J Intensive Care. 2017;5:40.
Chang T, Tu YK, Lee CT, et al. Effects of polymyxin B hemoperfusion on mortality in patients with severe sepsis and septic shock: a systemic review, metaanalysis update, and disease severity subgroup metaanalysis. Crit Care Med. 2017;45:e858–64.
Payen D. Haemoperfusion with polymyxin B membrane: recent results for an old debate! Anaesth Crit Care Pain Med. 2019;38(1):3–4. https ://doi. org/10.1016/j.accpm .2018.12.010.
Pickkers P, Russell JA. Treatment with a polymyxin B filter to capture endotoxin in sepsis patients: is there a signal for therapeutic efficacy? Intensive Care Med. 2019;45(2):282–3. https ://doi.org/10.1007/s0013 40185481 5.
Duchesne JC, Kaplan LJ, Balogh ZJ, Malbrain MNLG. Role of permissive hypotension, hypertonic resuscitation and the global increased permeability syndrome in patients with severe haemorrhage: adjuncts to damage control resuscitation to prevent intraabdominal hypertension. Anaesthesiol Intensive Ther. 2015;47:143–55.
Malbrain MLNG, Van Regenmortel N, Saugel B, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8(1):66. https ://doi.org/10.1186/s1361 30180402.
Gruda MC, Ruggeberg KG, O’Sullivan P, et al. Broad adsorption of sepsisrelated PAMP and DAMP molecules, mycotoxins, and cytokines from ® whole blood using CytoSorb sorbent porous polymer beads. PLoS ONE. 2018;13:e0191676.
Malbrain ML, Marik PE, Witters I, et al. Fluid overload, deresuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anaesthesiol Intensive Ther. 2014;46(5):361–80. https ://doi.org/10.5603/ait.2014.0060.
Kobe Y, Oda S, Matsuda K, Nakamura M, Hirasawa H. Direct hemoperfusion with a cytokineadsorbing device for the treatment of persistent or severe hypercytokinemia: a pilot study. Blood Purif. 2007;25:446–53.
Pfortmueller CA, Meisel C, Fux M, Schefold JC. Assessment of immune organ dysfunction in critical illness: utility of innate immune response markers. Intensive Care Med Exp. 2017;5:49.
Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach. Lancet Infect Dis. 2013;13:260–8.
Monneret G, Venet F, Pachot A, Lepape A. Monitoring immune dysfunctions in the septic patient: a new skin for the old ceremony. Mol Med. 2008;14:64–78.
Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure. JAMA. 2011;306:2594–605.
Schefold JC. Measurement of monocytic HLA DR (mHLADR) expression in patients with severe sepsis and septic shock: assessment of immune organ failure. Intensive Care Med. 2010;36:1810–2.
Leentjens J, Kox M, Koch RM, et al. Reversal of immunoparalysis in humans in vivo: a double blind, placebocontrolled, randomized pilot study. Am J Respir Crit Care Med. 2012;186:838–45.
Drewry AM, Ablordeppey EA, Murray ET, et al. Comparison of monocyte human leukocyte antigenDR expression and stimulated tumor necrosis factor alpha production as outcome predictors in severe sepsis: a prospective observational study. Crit Care. 2016;20:334.
Quinto BM, Iizuka IJ, Monte JC, et al. TNFα depuration is a predictor of mortality in critically ill patients under continuous venovenous hemodiafiltration treatment. Cytokine. 2015;71(2):255–60. https ://doi. org/10.1016/j.cyto.2014.10.024.
Van Snick J. Interleukin6: an overview. Annu Rev Immunol. 1990;8:253–78.
Venet F, Lukaszewicz AC, Payen D, Hotchkiss R, Monneret G. Monitoring the immune response in sepsis: a rational approach to administration of immunoadjuvant therapies. Curr Opin Immunol. 2013;25:477–83.
Monneret G, Finck ME, Venet F, et al. The antiinflammatory response dominates after septic shock: association of low monocyte HLADR expression and high interleukin10 concentration. Immunol Lett. 2004;95:193–8.
Frencken JF, van Vught LA, Peelen LM, et al. An unbalanced inflammatory cytokine response is not associated with mortality following sepsis: a prospective cohort study. Crit Care Med. 2017;45:e493–9.
Kellum JA, Kong L, Fink MP, et al. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the genetic and inflammatory markers of sepsis (GenIMS) study. Arch Intern Med. 2007;167:1655–63.
De Vriese AS, Colardyn FA, Philippe JJ, Vanholder RC, De Sutter JH, Lameire NH. Cytokine removal during continuous hemofiltration in septic patients. J Am Soc Nephrol. 1999;10:846–53.
Kellum JA, Song M, Venkataraman R. Hemoadsorption removes tumor necrosis factor, interleukin6, and interleukin 10, reduces nuclear factorkappaB DNA binding, and improves shortterm survival in lethal endotoxemia. Crit Care Med. 2004;32:801–5.
Namas RA, Namas R, Lagoa C, et al. Hemoadsorption reprograms inflammation in experimental gramnegative septic peritonitis: insights from in vivo and in silico studies. Mol Med. 2012;18:1366–74.
Peng ZY, Carter MJ, Kellum JA. Effects of hemoadsorption on cytokine removal and shortterm survival in septic rats. Crit Care Med. 2008;36:1573–7.
Peng ZY, Wang HZ, Carter MJ, et al. Acute removal of common sepsis mediators does not explain the effects of extracorporeal blood purification in experimental sepsis. Kidney Int. 2012;81:363–9.
Kellum JA, Venkataraman R, Powner D, Elder M, Hergenroeder G, Carter M. Feasibility study of cytokine removal by hemoadsorption in braindead humans. Crit Care Med. 2008;36:268–72.
Poli EC, Alberio L, BauerDoerries A, Marcucci C, Roumy A, Kirsch M, et al. ® Cytokine clearance with C ytoSorb during cardiac surgery: a pilot randomized controlled trial. Crit Care. 2019;23(1):108. https ://doi.org/10.1186/ s1305 401923994.
Sathe PSP, Kumar S, Choudhary S. Clinical experience of using a novel extracorporeal cytokine adsorption column for treatment of septic shock with multiorgan failure. Crit Care (London, England). 2015;19(Suppl 1):P130.
Honoré PM, Matson JR. Hemofiltration, adsorption, sieving and the challenge of sepsis therapy design. Crit Care. 2002;6:394–6 (Epub 2002 Sep 4. Review).
Matson J, Zydney A, Honoré PM. Blood filtration: new opportunities and the implications of systems biology. Crit Care Resusc. 2004;6:209–17.
DA Laddomada T, Balicco B. Case series of patients with severe sepsis and septic shock treated with a new extracorporeal sorbent. Crit care (London, England). 2016;20:P193.
Kogelmann K, Jarczak D, Scheller M, Druner M. Hemoadsorption by CytoSorb in septic patients: a case series. Crit Care. 2017;21:74.
Friesecke S, Stecher SS, Gross S, Felix SB, Nierhaus A. Extracorporeal cytokine elimination as rescue therapy in refractory septic shock: a prospective singlecenter study. J Artif Organs. 2017;20:252–9.
Schädler D, Porzelius C, Jörres A, et al. A multicenter randomized controlled study of an extracorporeal cytokine hemoadsorption device in septic patients. Crit Care. 2013;17(Suppl 2):P62.
Schadler D, Pausch C, Heise D, et al. The effect of a novel extracorporeal cytokine hemoadsorption device on IL6 elimination in septic patients: a randomized controlled trial. PLoS ONE. 2017;12:e0187015.
Friesecke S, Träger K, Schittek GA, et al. International registry on the use of ® the CytoSorb adsorber in ICU patients: study protocol and preliminary results. Med Klin Intensivmed Notfmed. 2017. https ://doi.org/10.1007/ s0006 301703425.
Bernardi MH, Rinoesl H, Dragosits K, et al. Effect of hemoadsorption during cardiopulmonary bypass surgery—a blinded, randomized, controlled pilot study using a novel adsorbent. Crit Care. 2016;20:96.
Nemeth E, Kovacs E, Racz K, et al. Impact of intraoperative cytokine adsorption on outcome of patients undergoing orthotopic heart transplantation—an observational study. Clin Transpl. 2018. https ://doi. org/10.1111/ctr.13211.
Öveges N, Hawchar F, László I, et al. Early cytokine adsorption in septic shock (ACESStrial): results of a proof concept, pilot study. Crit Care. 2018;22(Suppl 1):82.
Hawchar F, Lazlo I, Oveges N, Trasy D, Molnar Z. Extracorporeal cytokine adsorption in septic shock: a proof of concept randomized, controlled pilot study. J Crit Care. 2018. https ://doi.org/10.1016/j.jcrc.2018.11.003.
Bellani G, Laffey JG, Pham T, LUNG SAFE Investigators; ESICM Trials Group, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315(8):788–800.
Umbrello M, Formenti P, Bolgiaghi LU, Chiumello D. Current concepts of ARDS: a narrative review. Int J Mol Sci. 2017;18:64.
Martin TR. Lung cytokines and ARDS: Roger S Mitchell lecture. Chest. 1999;116(1 Suppl):2S–8S.
Peek GJ, Mugford M, Tiruvoipati R. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009;374:1351–63.
Lees NJ, Rosenberg A, HurtadoDoce AI, et al. Combination of ECMO and cytokine adsorption therapy for severe sepsis with cardiogenic shock and ARDS due to PantonValentine leucocidinpositive Staphylococcus aureus pneumonia and H1N1. J Artif Organs. 2016;19(4):399–402.
Traeger K, Schuetz C, Fischer G, et al. Cytokine reduction in the setting of an ARDSassociated inflammatory response with multiple organ failure. In: Case reports in critical care.
Bruenger F, Kizner L, Weile J, Morshuis M, Gummert JF. First successful combination of ECMO with cytokine removal therapy in cardiogenic septic shock: a case report. Int J Artif Organs. 2015;30:113–6.
Becze Z, Molnar Z, Fazakas J. Can procalcitonin levels indicate the need for adjunctive therapy in sepsis? Int J Antimicrob Agents. 2015;46(Suppl 1):S13–8.
Pupelis G, Drozdova N, Mukans M, Malbrain ML. Serum procalcitonin is a sensitive marker for septic shock and mortality in secondary peritonitis. Inflammation. 2014;37(1):223–34. https ://doi.org/10.1007/s1075 301397339.
Trásy D, Tánczos K, Németh M, EProK study group, et al. Early procalcitonin kinetics and appropriateness of empirical antimicrobial therapy in critically ill patients: a prospective observational study. J Crit Care. 2016;34:50–5. https ://doi.org/10.1016/j.jcrc.2016.04.007.
Vincent JL, de Mendonça A, Cantraine F, et al. Use of the SOFA score to assess the incidence of organ dysfunction/failure in intensive care units: results of a multicenter, prospective study. Working group on “sepsisrelated problems” of the European Society of Intensive Care Medicine. Crit Care Med. 1998;26:1793–800.
Poli EC, Simoni C, André P, Buclin T, Longchamp D, Perez MHet al. Clinda® mycin clearance during C ytosorb hemoadsorption: a case report and pharmacokinetic study. Int J Artif Organs. 2019;391398819831303. https ://doi.org/10.1177/03913 98819 83130 3 [Epub ahead of print].
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.