Journal of the American Heart Association 2019,
https://doi.org/10.1161/JAHA.118.010440
Giới thiệu
Bệnh tim mạch (CVD) vẫn là một nguyên nhân rất phổ biến về tỷ lệ mắc bệnh và tử vong, cả ở Hoa Kỳ và trên toàn thế giới. Song song với việc phát triển và cải tiến các trị liệu mới cho CVD đã biết như BMV hoặc suy tim (HF), đã có sự tập trung gia tăng vào việc điều chỉnh các yếu tố nguy cơ tim mạch cho cả phòng ngừa tiên phát và thứ phát, phản ánh sự hiểu biết hơn nữa về CVD như một quá trình mang tính hệ thống với đa yếu tố quyết định.
Ngưng thở lúc ngủ do tắc nghẽn (OSA) có liên quan đến nhiều dạng bệnh lý tim mạch khác nhau bao gồm tăng huyết áp, đột quỵ não, suy tim, bệnh mạch vành và rung nhĩ.1 Người lớn mắc OSA không chỉ có nguy cơ mắc bệnh CVD mà còn xấu đi dự hậu liên quan với CVD. OSA rất phổ biến, ước tính ảnh hưởng đến 34% nam giới và 17% phụ nữ trong dân số2 và 40% đến 60% bệnh nhân mắc CVD.3 Ngoài ra, tỷ lệ này ngày càng tăng, với những con số này tăng 30% so với 2 thập kỷ trước,2 khả năng liên quan đến gia tăng đáng kể bệnh béo phì cũng như dân số già hóa.
Mặc dù có mối liên quan rõ ràng giữa CVD và OSA, các thử nghiệm ngẫu nhiên đã không chứng minh được rằng điều trị ngưng thở khi ngủ giúp cải thiện kết quả tim mạch cứng ở bệnh nhân CVD.5 Tuy nhiên, lĩnh vực này vẫn còn gây tranh cãi, vì các thử nghiệm ngẫu nhiên được thực hiện cho đến nay vẫn còn hạn chế về số lượng cũng như thiết kế, nhấn mạnh sự cần thiết phải nghiên cứu thêm vào.6 Hơn nữa, tài liệu hiện tại cho thấy tác động của chẩn đoán và điều trị OSA khác nhau giữa các tiến trình bệnh lý tim mạch cụ thể, cho nên cần hiểu biết sâu sắc hơn và cách tiếp cận lâm sàng khác nhau về vấn đề này. Trong bài viết này, chúng tôi xem xét các tài liệu liên quan đến OSA ở bệnh nhân CVD. Ngoài ra, chúng tôi cung cấp một cách tiếp cận lâm sàng thực tế để đánh giá và quản lý BN nghi ngờ hoặc đã chẩn đoán OSA ở bệnh nhân mắc CVD bao gồm các khuyến cáo được tổng hợp từ một số hướng dẫn thực hành ở các nơi khác nhau kết hợp với một số đề xuất của chúng tôi về các vấn đề chưa được giải quyết theo Guideline hiện hành, dựa trên kinh nghiệm lâm sàng riêng và y văn tốt nhất có sẵn.
Tổng quan về ngưng thở lúc ngủ
Định nghĩa
Ngưng thở khi ngủ được đặc trưng bởi các cơn ngưng thở lặp đi lặp lại trong khi ngủ.
Ngưng thở được định nghĩa là ngừng luồng khí hô hấp kéo dài từ 10 giây trở lên, trong khi thuật ngữ giảm thở liên quan đến việc giảm luồng khí hô hấp (ít nhất 30%) kéo dài 10 giây trở lên khi gây giảm độ bão hòa oxy hoặc đánh thức khi ngủ.7
Các bước cần thiết cho một chu kỳ hô hấp thành công bao gồm kích hoạt tín hiệu từ trung tâm điều hòa ở thân não, truyền tín hiệu qua các dây thần kinh ngoại biên, kích hoạt các cơ hô hấp để tạo ra áp lực xâm nhập âm tính và đường thở thông thoáng.
Cơ chế gây ngưng thở hoặc giảm thở có thể gây bởi tắc nghẽn, trong đó tắc nghẽn đường hô hấp trên gây ngừng luồng khí mặc dù có nỗ lực hô hấp hoặc trung ương, trong đó không có cả luồng khí và nỗ lực hô hấp. Thuật ngữ rối loạn nhịp thở lúc ngủ (SDB) bao gồm OSA, trung ương (CSA) và ngưng thở hỗn hợp, cái mà cho thấy nỗ lực hô hấp vắng mặt ban đầu và sau đó nỗ lực rõ ràng với tắc nghẽn và chấm dứt ngưng thở hỗn hợp.
Các yếu tố nguy cơ quan trọng đối với OSA bao gồm béo phì, bất thường về giải phẫu sọ mặt hoặc miệng hậu (oropharyngeal), nam giới và hút thuốc.8 Trong khi ngủ, có sự giảm trương lực của các cơ mũi liên quan đến việc duy trì sự thông khí đường thở. Đặc biệt, sự thư giãn của cơ cằm-lưỡi cho phép lưỡi rơi xuống phía sau hầu họng, tạo điều kiện cho sự tắc nghẽn ở những người nhạy cảm.9
Các yếu tố giải phẫu bao gồm béo phì dẫn đến hẹp đường dẫn khí tương đối làm tăng khả năng tắc nghẽn. Quan sát cho thấy rằng OSA cũng ảnh hưởng đến bệnh nhân không béo phì và không có bất thường về giải phẫu có thể thấy được chỉ ra các cơ chế không giải phẫu cũng quan trọng. Ví dụ bao gồm mất ổn định kiểm soát thông khí10 và giảm ngưỡng kích thích trong giấc ngủ.11 Sự góp phần tương đối từ các quá trình này khác nhau giữa từng bệnh nhân, với ý nghĩa tiềm năng cho điều trị. Hiểu rõ hơn về các cơ chế của OSA có thể tạo điều kiện cho các chiến lược điều trị cá nhân hóa hơn trong tương lai.
CSA là kết quả của sự thất bại thoáng qua của các trung tâm kiểm soát hô hấp ở tủy để khởi kích hô hấp. Cơ chế chính được cho là sự điều hòa bất thường của ngưỡng ngưng thở, áp suất riêng phần của CO2 dưới mức hô hấp bị ức chế, mặc dù tùy thuộc vào nguyên nhân cơ bản, bệnh nhân CSA có thể là tăng CO2, CO2 bình thường hoặc giảm CO2.9 Suy tim là một trong những nguyên nhân hàng đầu của CSA, đặc biệt liên quan đến thở Cheyne ‐ Stokes, được đặc trưng bởi các cơn nỗ lực tăng dần – giảm dần hô hấp và giảm CO2 máu.12
Đánh giá và chẩn đoán
Việc đánh giá ngưng thở lúc ngủ bắt đầu bằng đánh giá giấc ngủ toàn diện, bao gồm khai thách bệnh sử về các triệu chứng hoặc dấu chứng lâm sàng, chẳng hạn như buồn ngủ ban ngày quá mức, đau đầu buổi sáng, ngủ ngáy, chứng kiến ngưng thở khi ngủ, hoặc khó tập trung, khám thực thể và đánh giá tiền sử y tế cho các bệnh đi kèm có liên quan và các yếu tố nguy cơ khác13 (Bảng 1).
Bệnh nhân nghi ngờ ngưng thở lúc ngủ sau đánh giá này nên được thực hiện test chẩn đoán, tiêu chuẩn chẩn hóa là dùng PSG. Điều trị OSA thường được dành riêng cho những người có chỉ số giảm thở -ngưng thở (AHI; số lần ngưng thở và giảm thở được quan sát mỗi giờ) ≥ 5 đo trong suốt khảo sát giấc ngủ ở các bệnh nhân có triệu chứng/dấu chứng của ngưng thở lúc ngủ hoặc liên quan với tình trạng y khoa (gồm tăng huyết áp, HF, bệnh động mạch vành, rối loạn nhịp tim đáng kể và các dạng CVD khác). Ngoài ra, AHI ≥15 thường được điều trị như OSA ngay cả khi không có triệu chứng, dấu chứng hoặc các tình trạng y tế liên quan.14 Mức độ nặng cũng được xác định dựa vào AHI, với 5-14 được coi là mức độ nhẹ, 15-30 mức trung bình và > 30 mức nặng. Sự thay đổi có ý nghĩa giữa đêm và đêm của AHI đã được quan sát thấy trong các nghiên cứu về PSG ban đêm liên tiếp, với 7% đến 25% bệnh nhân đáp ứng các tiêu chuẩn chẩn đoán cho OSA trung bình đến nặng vào đêm thứ hai mặc dù kết quả âm tính vào tối hôm trước.15 Hiện tại do đó, hướng dẫn khuyên bạn nên lặp lại PSG ở bệnh nhân có nghiên cứu ban đầu âm tính khi nghi ngờ lâm sàng về OSA vẫn còn cao.16
Bảng 1. Triệu chứng và dấu chứng của OSA
|
Ngáy |
|
Ngưng thở được chứng kiến bởi người ngủ cùng |
|
Các đợt ngột thở hoặc thở ngáp trong lúc ngủ |
|
Mất ngủ với các lần thức giấc lặp lại |
|
Buồn ngủ ban ngày quá mức |
|
Ngủ không ngon giấc |
|
Đau đầu vào buổi sáng |
|
Khó tập trung |
|
Giảm trí nhớ |
|
Kích thích và/hoặc thay đổi tính tình |
|
Tiểu đêm |
|
Giảm libido và/hoặc rối loạn cương dương |
Thử nghiệm ngưng thở lúc ngủ tại nhà (HSAT) bằng thiết bị theo dõi di động là một chiến lược thử nghiệm thay thế hợp lý. Hiện tại có vài loại HSAT, tất cả đều đo tần số tim và đo oxy có một số loại cũng đo áp lực mũi, đo thể tích ngực và bụng, và/hoặc đo huyết áp động mạch ngoại biên. So với PSG, độ chính xác chẩn đoán của HSAT thấp hơn và quan trọng là khác nhau tùy thuộc vào dân số được nghiên cứu và tiêu chuẩn chẩn đoán được sử dụng.17
Mặc dù có những lưu ý này, HSAT đưa ra một giải pháp thay thế khả thi cho PSG trong các trường hợp chọn lọc và được khuyến cáo chẩn đoán OSA ở những bệnh nhân không biến chứng với nguy cơ OSA trung bình đến nặng.7 Do độ nhạy giới hạn và hậu quả có thể của kết quả âm tính giả, các trường hợp âm tính hoặc không chẩn đoán nên được đánh giá với PSG. Hơn nữa, bệnh nhân có nguy cơ ngưng thở khi ngủ trung ương hoặc hỗn hợp (bệnh tim phổi đang kể, sử dụng opioid mãn tính, tiền sử đột quỵ não hoặc rối loạn thần kinh cơ có liên quan đến cơ hô hấp) hoặc các rối loạn giấc ngủ không hô hấp khác cần được đánh giá PSG thay vì HSAT,16 vì chẩn đoán chính xác với HSAT cho ngưng thở trung ương chưa được phê duyệt.
Bởi vì một đêm HSAT ít tốn tài nguyên hơn nguyên-đêm với PSG, chi phí giảm đã được trích dẫn là một lợi ích tiềm năng của việc tăng sử dụng HSAT trong chẩn đoán OSA. Một số phân tích so sánh hiệu quả chi phí của HSAT với PSG nguyên-đêm hoặc phần-đêm ở người lớn nghi ngờ OSA từ trung bình đến nặng thay vì đánh giá PSG nguyên-đêm là phương thức thử nghiệm được ưu chuộng.20
Tăng chi phí liên quan đến kiểm tra lặp lại và HSAT âm tính tính đến trong các kết quả này. Một lưu ý chính của các phân tích này là khả năng xảy ra lỗi liên quan đến sự thiếu sót trong mô hình của lộ trình chẩn đoán lâm sàng và những hạn chế về chất lượng của dữ liệu thực tế có sẵn để hiệu chỉnh mô hình của họ. Chỉ có 1 nghiên cứu được công bố cho đến nay đã phân tích hiệu quả chi phí tương đối của các phương thức chẩn đoán khác nhau bằng cách sử dụng phép đo sử dụng tài nguyên thế giới thực trong bối cảnh thử nghiệm ngẫu nhiên có kiểm soát (RCT).
Sử dụng dữ liệu từ thử nghiệm HomePAP, Kim và cộng sự đã phát hiện ra rằng trong 373 bệnh nhân có nguy cơ mắc OSA từ trung bình đến nặng, lộ trình thử nghiệm tại nhà dẫn đến chi phí thấp hơn đáng kể cho bệnh nhân so với PSG tại phòng đo giấc ngủ ($ 1575 so với $ 1840 , P = 0,02).22 Do đó, việc sử dụng HSAT ở những BN được lựa chọn phù hợp với nghi ngờ OSA có thể có khả năng giảm chi phí; tuy nhiên, các nhân viên y tế phải nhận ra rằng việc mở rộng sử dụng HSAT cho nhóm dân số khác, đặc biệt là những bệnh nhân có nguy cơ thấp, có thể thực sự làm tăng chi phí chung do thử nghiệm thường xuyên hơn.
Một vài bảng câu hỏi lâm sàng và các công cụ dự đoán đã được phát triển để hỗ trợ cho việc đánh giá OSA, chẳng hạn như bảng câu hỏi STOP BANG, Thang điểm giấc ngủ Epworth và Bảng câu hỏi Berlin (Bảng 2). Những công cụ lâm sàng này được thiết kế để cung cấp một phương pháp đánh giá tiêu chuẩn có thể được thực hiện tương đối nhanh chóng trong tình huống ngoại trú, tại trung tâm giấc ngủ hoặc tại các phòng khám chăm sóc ban đầu. Mặc dù mang lại lợi thế là nhanh chóng, thuận tiện và không tốn kém, các nghiên cứu đánh giá độ chính xác chẩn đoán của các công cụ lâm sàng này so với PSG hoặc HSAT đã chứng minh không đủ nhạy và đặc hiệu.7 Theo đó, các công cụ dự đoán đánh giá lâm sàng hiện không được khuyến cáo để chẩn đoán OSA trong trường hợp không có PSG hoặc HSAT. Tuy nhiên, họ có thể đóng một vai trò hữu ích như các công cụ bổ trợ trong quá trình sàng lọc hoặc hỗ trợ đánh giá hiệu quả điều trị trong thời gian dài theo dõi bệnh nhân mắc OSA.
Bảng 2. Tổng kết bảng câu hỏi ngưng thở lúc ngủ lâm sàng
|
Bảng câu hỏi |
Tổng kết nội dung bảng câu hỏi |
Độ chính xác chẩn đoán so với AHI (>15 biến cố/giờ)16 |
|
Berlin |
10 câu hỏi phụ thuộc vào 3 triệu chứng/dấu chứng: Ngáy Buồn ngủ ban ngày Tăng huyết áp Bệnh nhân có thể phân loại bởi thang điểm thành nhóm nguy cơ thấp hoặc nguy cơ cao có chứng OSA |
Độ nhạy. 0.77 (073-0.81) Độ đặc hiệu. 0.44 (0.38-0.51) |
|
STOP |
4 câu hỏi liên quan với các triệu chứng/dấu chứng Ngáy Buồn ngủ Ngưng thở được quan sát thấy hoặc ngột thở Tăng huyết áp |
Độ nhạy. 0.89 (0.81-0.94) Độ đặc hiệu. 0.32 (0.19-0.48) |
|
STOP-BANG |
4 câu hỏi liên quan với triệu chứng/triệu chứng + 4 yếu tố lâm sàng góp phần Ngáy Buồn ngủ Ngưng thở được quan sát thấy hoặc ngột thở Tăng huyết áp Béo phì (BMI > 35kg/m2) >50 tuổi o Kích cỡ của cổ Giới tính BN được phân loại thành nguy cơ thấp, trung bình, cao có chứng OSA |
Độ nhạy. 0.90 (0.86-0.93) Độ đặc hiệu. 0.36 (0.29-0.44) |
|
Epworth |
8 câu hỏi để hỏi BN tỉ lệ khả năng vào giấc ngủ trong các tình huống ban ngày khác nhau Bệnh nhân được phân loại có giấc ngủ bình thường, buồn ngủ mức trung bình, hoặc nặng và có thể buồn ngủ bệnh lý |
Độ nhạy.0.47 (0.35-0.59) Độ đặc hiệu 0.62 (0.56-0.68) |
Điều trị
Quản lý hiệu quả OSA đòi hỏi phải đánh giá toàn diện về kiểu hình của từng bệnh nhân cũng như đánh giá và theo dõi lâu dài. Các lựa chọn hành vi, y tế, nha khoa và phẫu thuật hiện có để điều trị chứng ngưng thở khi ngủ.
Điều trị bằng áp lực đường thở dương tính (PAP) là liệu pháp đầu tay cho tất cả các bệnh nhân được chẩn đoán mắc chứng ngưng thở khi ngủ tắc nghẽn và đã được chứng minh là làm giảm AHI23 và cải thiện tình trạng buồn ngủ và chất lượng cuộc sống được báo cáo.24 Về chi phí hiệu quả, ước tính gia tăng tỷ lệ chi phí-hiệu quả là 15.915 đô la đạt được chất lượng sống điều chỉnh theo năm.20 Cơ chế điều trị của PAP là giữ luồng khí nén ở đường thở trên, do đó làm giảm tắc nghẽn đường thở và các biến cố ngưng thở. Hai chế độ PAP chính là áp lực đường thở dương liên tục (CPAP) và thông khí với hai ngưỡng áp lực dương (BiPAP). CPAP là phương thức đầu tiên được ưa chuộng cho hầu hết các bệnh nhân OSA, trong khi thông khí với hai ngưỡng áp lực dương thường dành cho bệnh nhân mắc OSA kèm theo hội chứng giảm thông khí, mặc dù nó cũng có thể được sử dụng ở những BN OSA đơn độc không dung nạp với CPAP và một số trường hợp CSA. Các thiết lập tối ưu được xác định một cách lý tưởng thông qua điều chỉnh thủ công PAP trong suốt quá trình PSG toàn đêm để có áp lực giúp loại bỏ tắc nghẽn đường thở trên và vẫn có thể chịu được cho bệnh nhân. Ngoài ra, một số bệnh nhân trải qua một khảo sát phân chia-đêm, trong đó điều chỉnh PAP được thực hiện theo phần chẩn đoán của PSG. Một khảo sát phân chia-đêm đòi hỏi phải chẩn đoán kết luận OSA từ trung bình đến nặng với ít nhất 3 giờ còn lại trong test để tiến hành điều chỉnh PAP.
Tự động điều chỉnh CPAP (APAP) là một tùy chọn khác mang lại ưu điểm cho việc thực hiện điều chỉnh tại nhà hơn là trong phòng đo giấc ngủ. Với APAP, bác sĩ lâm sàng lập trình một phạm vi áp lực, và mức PAP được quản lý sẽ tự động được điều chỉnh suốt đêm đến áp suất thấp nhất cần thiết để duy trì mức độ ổn định đường thở trên bằng phần mềm phát hiện sự kiện độc quyền. Một số thử nghiệm ngẫu nhiên so sánh CPAP cố định với APAP cho thấy không có sự khác biệt hoặc, trong một số trường hợp, một lợi thế nhỏ của APAP liên quan đến tỷ lệ tuân thủ, giảm AHI và cải thiện tình trạng buồn ngủ ở nhóm OSA không biến chứng.25 Đáng chú ý, BN suy tim, COPD hoặc một dạng bệnh phổi đáng kể khác, hội chứng giảm thông khí do béo phì và SDB liên quan đến bệnh lý thần kinh cơ đã được loại trừ khỏi các nghiên cứu này và các hướng dẫn hiện tại khuyến cáo không nên sử dụng APAP để điều chỉnh áp suất hoặc điều trị ở những bệnh nhân này.27
Điều trị PAP là một điều trị hiệu quả của OSA; tuy nhiên, hiệu quả có thể bị hạn chế do không tuân thủ điều trị của bệnh nhân, điều này không phải là không phổ biến và có thể do nhiều yếu tố khác nhau.28 Chiến lược có thể hiệu quả đối với một số bệnh nhân trong việc cải thiện tuân thủ điều trị bao gồm thay đổi giao diện mặt nạ (khả năng dung nạp cao của giao diện mũi đã được đưa ra), thêm độ ẩm cho hệ thống PAP (hiệu quả có thể được giới hạn ở những người bị nghẹt mũi), thêm dây buộc cằm (chinstrap) vào mặt nạ (cũng có thể làm giảm rò rỉ không khí và AHI tồn dư), 29 và sử dụng chế độ APAP.24 Trị liệu hành vi nhận thức nhằm cải thiện hiệu quả của bệnh nhân đối với sức khỏe của họ đã được chứng minh là tăng sự tuân thủ trong một số nghiên cứu.28 Đánh giá sớm và khắc phục kịp thời mọi vấn đề là cực kỳ quan trọng sau khi bắt đầu điều trị, vì sử dụng trong 2 tuần đầu tiên dự đoán tuân thủ dài hạn với trị liệu.23
Các điều trị hành vi cho chứng ngưng thở lúc ngủ bao gồm giảm cân, điều trị tư thế ngủ và tránh thức uống có cồn hoặc các thuốc an thần khác (Bảng 3). Giảm cân làm giảm mức độ nghiêm trọng của OSA ở hầu hết bệnh nhân thừa cân, với mối tương quan đáng kể giữa mức độ giảm cân và giảm AHI.30 Giảm cân có thể là nội khoa hoặc phẫu thuật.33 Điều chỉnh lối sống tích cực và giảm cân có thể làm giảm nguy cơ các biến cố tim mạch trong tương lai bao gồm tử vong ở bệnh nhân thừa cân/béo phì thông qua các cơ chế không liên quan đến OSA34 và do đó nên được khuyến cáo cho tất cả những bệnh nhân OSA cùng với các phương pháp điều trị khác.36 Phẫu thuật Bariatric có hiệu quả giảm cân và giảm AHI và do đó giảm cân nên được xem xét ở những bệnh nhân béo phì chọn lọc kèm OSA.37 Mặc dù giảm cân có thể làm giảm AHI, nhưng hầu hết bệnh nhân sẽ cần một số hình thức trị liệu OSA bổ sung, bởi vì chỉ 10% đến 30% bệnh nhân đạt được AHI 33
Bảng 3: Điều trị hành vi cho ngưng thở lúc ngủ do tắc nghẽn
|
Điều trị |
Chọn bệnh nhân |
|
Giảm cân |
Tất cả BN thừa cân béo nên khuyến khích giảm cân, như thêm vào với điều trị đầu tay (primary) |
|
Điều trị tư thế |
Có thể được sử dụng như điều trị hàng hai (secondary) hoặc điều trị thêm vào ở các BN với giảm ý nghĩa ở tư thế khôngnằm ngửa so với nằm ngửa Có thể được xem xét điều trị đầu tay ở các trường hợp chọn lọc khi AHI bình thường ở tư thế không-nằm ngửa đã được chứng minh bởi PSG và tuân thủ có thể được đảm bảo |
|
Tránh thức uống có cồn hoặc các chất khác |
BN nên được khuyến khích để hạn chế tối thiểu thức uống cồn Bác sĩ nên theo dõi và tránh chỉ định thuốc có khả năng làm nặng thêm tình trạng ngưng thở lúc ngủ, như benzodiazepines, thuốc opiates, hoặc ức chế hệ thần kinh trung ương khác. |
Điều trị tư thế ngủ liên quan đến việc sử dụng một thiết bị định vị để duy trì một vị trí khác ngoài nằm ngửa trong khi ngủ, vì tư thế nằm ngửa có liên quan đến việc giảm kích thước đường thở nhiều hơn. Vai trò của điều trị tư thế ngủ chủ yếu là điều trị hàng hai (secondary), nhưng nó có thể được sử dụng như một trị liệu chính ở những bệnh nhân được chứng minh là có ‐ AHI thấp khi ở tư thế không nằm ngửa.39 Ước tính >50% tất cả bệnh nhân có AHI> 5 biến cố/giờ có tư thế giấc ngủ ảnh hưởng ngưng thở lúc ngủ.40
Các dụng cụ đặt ở miệng, chẳng hạn như một dụng cụ đẩy hàm dưới và các dụng cụ giữ lưỡi, hoạt động bằng cách mở rộng cơ học đường hô hấp trên bằng cách di chuyển lưỡi về phía trước và giảm khả năng thu gọn của nó trong khi ngủ,41 mô phỏng kĩ thuật Jaw-Thrust được sử dụng bởi bác sĩ gây mê để mở đường thở cho bệnh nhân gây mê. Cả dụng cụ đẩy hàm dưới và các dụng cụ giữ lưỡi đều làm tăng diện tích mặt cắt ngang của đường thở ở cấp độ của khẩu cái-hầu (velopharynx) và khẩu hầu (oropharynx), mặc dù sự thay đổi đường kính lớn hơn với các thiết bị giữ lưỡi so với dụng cụ nâng hàm dưới.42 Dụng cụ đặt ở miệng có hiệu quả trong việc giảm AHI ở bệnh nhân mắc OSA43 nhưng kém hiệu quả hơn liệu pháp PAP.41 AHI cơ bản ≥30 và áp lực CPAP điều trị tối đa> 12 mm Hg được dự đoán là thất bại điều trị dụng cụ đặt ở miệng (thành công được xác định bằng cách đạt được AHI 50% so với ban đầu), và do đó, các đặc điểm lâm sàng này cần được xem xét khi lựa chọn bệnh nhân điều trị bằng dụng cụ đặt ở miệng.44 Dụng cụ đặt ở miệng được khuyên dùng để điều trị ngáy tiên phát mà không mắc OSA, và trong điều trị OSA nhẹ – trung bình trong trường hợp bệnh nhân rất muốn thử dùng dụng cụ hơn trị liệu PAP. Chúng cũng được ưu chuộng so với việc không điều trị ở các BN ngáy tiên phát mà không có OSA hoặc OSA ở bất kỳ mức độ nghiêm trọng nào ở những bệnh nhân không dung nạp hoặc không muốn thử trị liệu PAP.43
Phẫu thuật đường hô hấp trên được thiết kế để giải quyết tắc nghẽn về giải phẫu đường thở ở đường hô hấp trên và bao gồm nhiều kỹ thuật khác nhau. Các thủ thuật phẫu thuật riêng lẻ có thể được phân loại là mũi, hầu họng, hầu họng hoặc toàn bộ đường hô hấp trên tùy thuộc vào vị trí giải phẫu mà tại đó tắc nghẽn là mục tiêu. Nhiều bệnh nhân đã giải phẫu tắc nghẽn tại nhiều vị trí và yêu cầu nhiều phẫu thuật chỉnh sửa, trong đó nhiều phẫu thuật được thực hiện đồng thời hoặc qua nhiều lần phẫu thuật. Phẫu thuật có thể được coi là trị liệu chính cho bệnh nhân ngáy tiên phát kèm OSA, ở bệnh nhân mắc OSA nhẹ đến trung bình, trong đó họ có thể không phải dụng cụ đặt ở miệng, và trong trường hợp giải phẫu tắc nghẽn trong đó phẫu thuật sẽ được coi là hiệu quả cao và là trị liệu thứ cấp cho bệnh nhân OSA gặp phải đáp ứng không đầy đủ hoặc không thể chịu đựng được liệu pháp PAP.
Phẫu thuật là một lựa chọn quản lý hiệu quả để điều trị OSA, với tỷ lệ thành công về PSG được báo cáo (thường được định nghĩa là giảm ≥50% trong AHI xuống giá trị AHI ≤20) từ 35% đến 83% trong y văn.45 Giới hạn của báo cáo hiệu quả trong tài liệu bao gồm sự không đồng nhất đáng chú ý của kỹ thuật phẫu thuật cũng như lựa chọn bệnh nhân dựa trên đặc điểm giải phẫu cá nhân và ưu chuộng của bác sĩ phẫu thuật. Tổng quan về các loại phẫu thuật khác nhau được sử dụng để điều trị OSA cùng với hiệu quả được báo cáo của từng kỹ thuật được trình bày trong Bảng 4.50 Một hình thức phẫu thuật đặc biệt, kích thích thần kinh hạ thiệt (12th), có tài liệu phát triển hỗ trợ hiệu quả của nó. Thử nghiệm STAR đã thu nhận 126 bệnh nhân mắc chứng OSA từ đến ‐ nặng, gặp khó khăn trong việc tuân thủ CPAP và phẫu thuật cấy simulator thần kinh hạ thiệt.51 Sau 18 tháng, trung vị AHI đã giảm 68% cũng như cải thiện điểm số trên thang điểm giấc ngủ Epworth và bảng câu hỏi giấc ngủ FOSQ với chỉ 2 sự kiện bất lợi nghiêm trọng được báo cáo trong suốt thử nghiệm.52
Bảng 4. Tổng quan về phẫu thuật cho OSA
|
Vùng giải phẫu |
Phẫu thuật cụ thể |
Dự hậu |
|
Mũi
|
Chỉnh hình cuốn mũi Chỉnh hình vách ngăn mũi Phẫu thuật valve mũi Chỉnh hình mũi (Rhinoplasty) Cắt poly mũi Cắt bỏ hạch vòm họng |
Giảm 2.66cm H20 có ý nghĩa trong áp lực CPAP (KTC 95% 1.67-3.56;P45 |
|
Hầu trên |
Phẫu thuật tạo hình lưỡi gà, vòm miệng,họng (UPPP:uvulopalatopharyngoplasty) Uvolopalatal flap Nhiều dạng khác của UPPP được sử dụng Cắt amiđan
|
Tỉ lệ thành công PSG kết hợp 50% cho UPPP trong phân tích gộp; tuy nhiên, tỉlệ từ các nghiên cứu riêng lẻ khác nhau có ý nghĩa, với tỉ lệ thành công lên đến83% trong đoàn hệ chọn lọc hơn50 |
|
Hầu dưới |
Phẩu thuật giảm lưỡi (tongue reduction) Phẫu thuật nâng/ổn định lưỡi (togue advancement/stabilization) Phẫu thuật thanh thiệt (Epiglottis) |
Tỉ lệ thành công PSG từ 35% đến 62%tùy nghiên cứu của phẫu thuật hạ hầu(hypopharyngeal)48 |
|
Phẫu thuật toàn bộ đường hô hâp trên |
Nâng cao xương hàm tối đa (MMA) Mở khí quản Kích thích đường hô hấp trên
|
Hiệu quả kết hợp từ phân tích gộp cho mỗi loại phẫu thuật MMA: tỉ lệ thành công* 86% và tỉ lệ chữa khỏi 43%49 Mở khí quản: giảm có ý nghĩa AHI trung bình 78.82 biến cố/giờ (KTC95% 63.7-95.9,P46 Kích thích hạ thiệt: giảm ý nghĩaAHI trung bình 17.51 biến cố/giờ (KTC 95% 20.7-14.3)47 |
aPSG thành công được định nghĩa là giảm ≥50% mức AHI ban đầu and AHIsau phẫu thuật
btỉ lệ chữa khỏi được định nghĩa AHIsau phẫu thuật
Nguy cơ của phẫu thuật đường thở trên bao gồm những nguy cơ vốn có của bất kỳ phẫu thuật nào như chảy máu, nhiễm trùng và các biến chứng liên quan đến gây mê. Loại thứ hai là các biến chứng tim mạch chu phẫu được biết là cao hơn ở những bệnh nhân mắc OSA so với dân số phẫu thuật nói chung.53 Nguy cơ thêm vào khác nhau tùy theo kỹ thuật phẫu thuật cụ thể được sử dụng và bao gồm, nhưng không giới hạn, tổn thương đường thở, khó thở, gây tê tại chỗ hoặc liệt, thay đổi giọng nói, cảm giác vướng họng và thay đổi vị giác.55
Tình trạng tim mạch liên quan với osa
Tăng huyết áp kháng trị
Trong tất cả các tiến trình bệnh tim mạch liên quan đến OSA, mối quan hệ với tăng huyết áp là mối quan hệ đã được xác nhận rõ nhất. Nhiều nghiên cứu quan sát đã chứng minh mối liên hệ này,56 và một nghiên cứu có ảnh hưởng của Peppard và cộng sự, theo dõi 709 bệnh nhân ở trong đoàn hệ WSC, đã tìm thấy mối quan hệ phụ thuộc-liều lượng tuyến tính, giữa mức độ nghiêm trọng của OSA tại thời điểm ban đầu và nguy cơ phát triển tăng huyết áp trong thời gian theo dõi.58 Mối quan hệ đặc biệt mạnh mẽ giữa OSA và tăng huyết áp kháng trị, thường được xác định là không có khả năng kiểm soát huyết áp đầy đủ mặc dù đã sử dụng 3 thuốc chống tăng huyết áp bao gồm thuốc lợi tiểu hoặc kiểm soát huyết áp đầy đủ cần ≥4 thuốc. Ví dụ, 1 nghiên cứu cho thấy tỷ lệ mắc OSA là 71% ở BN tăng huyết áp kháng trị so với 38% ở những người bị tăng huyết áp vô căn.59
Một số thử nghiệm ngẫu nhiên có đối chứng đã chứng minh giảm mức huyết áp hệ thống ở những bệnh nhân được điều trị bằng CPAP. Một phân tích gộp gần đây của 5 thử nghiệm ngẫu nhiên trên 457 bệnh nhân đã tìm thấy sự giảm đáng kể huyết áp trong 24 giờ (4,78 mm Hg [95% KTC 1,61-7,95] tâm thu và 2,95 mm Hg [95% KTC 0,53-5.37] tâm trương) cũng như huyết áp tâm trương trung bình về đêm (1,53 mm Hg [95% KTC, 0-3.07]) ở những bệnh nhân được điều trị bằng CPAP.60 Trong khi mức độ giảm này tương đối khiêm tốn, nó đã được chứng minh là thậm chí giảm ít trong mức huyết áp vẫn tạo ra giảm nguy cơ biến cố tim mạch bất lợi.61 Dựa trên những dữ liệu này, chúng tôi tin rằng test chẩn đoán OSA là hợp lý ở tất cả các BN bị tăng huyết áp kháng trị, kể cả những người không có dấu hiệu hoặc triệu chứng rõ ràng của OSA.
Tăng áp phổi
OSA liên quan chặt chẽ với tăng huyết áp phổi (TAP) và có thể giữ vai trò nguyên nhân trong sinh lý bệnh của nó. Trong khi 10% đến 20% bệnh nhân mắc OSA từ TB đến nặng có TAP cùng tồn tại,62 tỷ lệ OSA ở bệnh nhân TAP được chẩn đoán bằng thông tim phải được ước tính là 70% đến 80%.63 Cả tăng CO2 máu và các đợt thiếu oxy ban đêm có thể kích hoạt co thắt động mạch phổi dẫn đến tăng áp lực động mạch phổi cấp tính, có thể đảo ngược. Các con đường truyền tín hiệu liên quan đến sự co mạch do thiếu oxy trong TAP bao gồm oxit nitric, endothelin, angiopoietin 1, serotonin và NADPH‐oxidease.64
Sự thiếu oxy mãn tính kích hoạt con đường viêm thêm vào dẫn đến tái cấu trúc mạch máu phổi và, thậm chí, tăng không hồi phực trở kháng mạch máu phổi (PVR).65Các cơ chế được đưa ra góp phần thêm vào TAP bao gồm tăng tiền tải tim mạch bên phải do áp lực âm lồng ngực trong giai đoạn tắc nghẽn đường thở, tạo ra các loại oxy hoạt hóa (ROS) cũng như rối loạn chức năng nội mô mạch máu phổi.66 Bằng chứng trên siêu âm tim của tái cấu trúc và rối loạn chức năng thất phải cũng đã được thấy trong mối liên quan với OSA.67 Thêm vào cơ chế trực tiếp liên quan với mạch máu phổi.67 Ngoài các cơ chế trực tiếp liên quan đến mạch máu phổi, OSA có thể dẫn đến TAP một cách gián tiếp thông qua việc góp phần vào suy tim trái liên quan với TAP hậu mao mạch như ở BN tăng huyết áp kháng trị
Tăng huyết áp phổi nếu chỉ do OSA nói chung là nhẹ; tuy nhiên, OSA có thể làm tăng thêm độ nặng của áp lực động mạch phổi và trở kháng mạch máu phổi khi TAP còn liên quan đến các nguyên nhân cơ bản khác. Điều quan trọng là sự hiện diện của OSA ở những bệnh nhân bị PH nặng có liên quan đến tăng tỷ lệ tử vong.68 Liên quan với hiệu quả điều trị OSA ở các BN TAP, y văn hiện tại, vẫn còn giới hạn bởi cỡ mẫu nhỏ và lượng nhỏ của thử nghiệm ngẫu nhiên, đưa ra về lợi ích. Nghiên cứu quan sát đã chứng minh giảm PVR ở các BN điều trị với CPAP.69 Trong thử nghiệm ngẫu nhiên cho đến nay, điều trị OSA bằng CPAP có liên quan đến việc giảm đáng kể áp lực tâm thu động mạch phổi (28,9 mm Hg so với 24 mm Hg) khi so với placebo.70
Do tác dụng bất lợi của ngưng thở lúc ngủ ở bệnh nhân TAP và bằng chứng hạn chế về tác dụng có lợi của CPAP, chúng tôi khuyên nên sàng lọc lâm sàng tất cả các bệnh nhân TAP về ngưng thở lúc ngủ bằng đánh giá giấc ngủ toàn diện. Ngoài ra, chúng tôi tin rằng việc thực hiện một số test chẩn đoán liên quan giấc ngủ ở tất cả bệnh nhân TAP là hợp lý. Bệnh nhân nghi ngờ ngưng thở lúc ngủ dựa trên sự hiện diện của các triệu chứng SDB hoặc các yếu tố nguy cơ, cũng như bệnh nhân bị giảm oxy máu về đêm khi test tại nhà, nên được chỉ định PSG. Cách tiếp cận này phù hợp với các khuyến cáo được cung cấp bởi Tài liệu đồng thuận chuyên gia của ACCF / AHA 2009 về Tăng áp phổi71 cũng như Hướng dẫn ESC/ERS 2015 để chẩn đoán và điều trị tăng áp phổi.72
Suy tim
Ngưng thở khi ngủ rất phổ biến ở bệnh nhân mắc bệnh HF, với các nghiên cứu cho thấy tỷ lệ hiện hành từ 50% đến 70%.73 Đáng chú ý, CSA chiếm khoảng 2/3 số ca ngưng thở khi ngủ ở dân số này, trong khi OSA chiếm số ít đáng kể. Một mối quan hệ nghịch đảo tồn tại giữa tỷ lệ CSA và cả phân suất tống máu thất trái và mức độ nặng của HF trên lâm sàng.73 CSA và OSA có thể cùng tồn tại với một tỷ lệ đáng kể, một trong chúng đóng vai trò là kiểu hình nổi trội ở phần lớn bệnh nhân.73 Vì HSAT chưa được xác thực để chẩn đoán CSA, các hướng dẫn hiện tại khuyến cáo PSG ưu chuộng để chẩn đoán cho bệnh nhân HF.16 Một nghiên cứu duy nhất trên 53 bệnh nhân nội trú với HF mất bù tìm thấy sự phù hợp cao giữa AHI, được phân loại là tắc nghẽn hoặc trung tâm, được đo trong khi đồng thời PSG và theo dõi HSAT, với các hệ số tương quan là 0,91 (KTC 95%, 0,84-0,95) và 0,98 (KTC 95%, 0,96-0,99),75 cho thấy tiềm năng của HSAT đối với vai trò đánh giá bệnh nhân có nguy cơ SDB phức tạp trong tương lai đang chờ điều tra thêm.
Ngưng thở khi ngủ phổ biến ở những bệnh nhân bị rối loạn chức năng thất trái không có triệu chứng cũng như những BN HF biểu hiện lâm sàng, với 1 nghiên cứu chẩn đoán ngưng thở khi ngủ từ trung bình đến nghiêm trọng ở 66% bệnh nhân mắc chứng ngưng thở khi ngủ hiện tại.76 Ngưng thở lúc ngủ cùng tồn tại liên quan với tăng nguy cơ dự hậu xấu, bao gồm tử vong, ở các BN suy tim.77 Một số quá trình sinh lý bệnh xuất phát trực tiếp từ các biến cố ngưng thở có thể giải thích mối liên quan này, bao gồm kích hoạt hệ thống thần kinh giao cảm79 cũng như tăng tiền tải và hậu tải từ đảo lộn áp lực trong lồng ngực trong quá trình hít vào chống lại đường thở tắc nghẽn.80 Các cơ chế thêm và bởi ngưng thở lúc ngủ có thể làm tệ đi dự hậu ở các bệnh nhân suy tim bao gồm làm nặng lên tình trạng tăng huyết áp,81 tăng nguy cơ rối loạn nhịp bao gồm đột tử do tim, 82 và tăng nguy cơ biến cố mạch vành.83
Các nghiên cứu tìm kiếm các lợi ích tiềm năng của PAP liên quan đến suy tim nền ở nhóm bệnh nhân này đã cho ra mâu thuẫn và kết quả thất vọng. Một số nghiên cứu nhìn vào điểm cuối thay thế cho thấy tác dụng có lợi liên quan đến liệu pháp PAP ở bệnh nhân ngưng thở khi ngủ với HF. Giảm tín hiệu hệ thống thần kinh giao cảm đã được quan sát thấy ở những bệnh nhân OSA và CSA được điều trị bằng CPAP.84 CPAP cũng làm giảm tình trạng tiền rối loạn nhịp tim liên quan đến OSA, đã được chứng minh là làm giảm ngoại tâm thu thất86 cũng như nguy cơ tái phát RN.87 Hơn nữa, CPAP cho kết quả huyết động thuận lợi, bao gồm cải thiện tâm thu thất trái89 và chức năng tâm trương90 ở bệnh nhân OSA có áp lực động mạch phổi bít cao.
Những nghiên cứu ban đầu đầy hứa hẹn này đã thúc đẩy RCT lớn hơn tìm kiếm các kết cục lâm sàng cứng, đặc biệt ở những bệnh nhân có CSA chiếm ưu thế. Thử nghiệm CANPAP đã đánh giá hiệu quả của điều trị CPAP ở bệnh nhân mắc bệnh HF và CSA. Không thấy lợi ích ở những bệnh nhân được điều trị bằng CPAP; tuy nhiên, một phân tích post hoc cho thấy giảm tỷ lệ tử vong ở những bệnh nhân điều trị bằng CPAP dẫn đến cải thiện đáng kể AHI (đến 91 Trong khi CPAP có hiệu quả trong việc làm giảm các biến cố tắc nghẽn, nhiều bệnh nhân HF vẫn tồn tại ngưng thở trung ương và giảm thở mặc dù điều trị bằng CPAP đã được thích hợp.
Thở ASV (Adaptive servoventilation) là một hình thức điều trị áp lực đường thở dương hai mức độ, trong đó mức độ hỗ trợ áp lực (chênh lệch giữa áp lực hô hấp và hô hấp) khác nhau giữa các chu kỳ hô hấp để duy trì thông khí phút ổn định. Một tỷ lệ dự phòng được lập trình để kích hoạt thở trong thời gian ngưng thở trung tâm. Do đó, chế độ này mang lại lợi thế về mặt lý thuyết ở bệnh nhân HF có thở Cheyne ‐ Stokes, được đặc trưng bởi các giai đoạn tăng thông khí, giảm thông khí và ngưng thở trung tâm.92 Thử nghiệm SAVIOR ‐ C đã không cho thấy sự cải thiện về phân suất tống máu hoặc mức peptide natriuretic não (BNP) sau 24 tuần điều trị ASV ở những bệnh nhân mắc bệnh HF và CSA nhưng đã cho thấy những cải thiện về chất lượng cuộc sống và tình trạng lâm sàng.93 Thử nghiệm SERVE ‐ HF được thiêt kế để kiểm tra hiệu quả ASV đến tỷ lệ tử vong ở bệnh nhân có phân suất tống máu thất trái ≤45% và chủ yếu là ngưng thở khi ngủ trung tâm. Mặc dù làm giảm AHI một cách hiệu quả, ASV không mang lại lợi ích sống còn và thực sự có liên quan đến sự gia tăng tỷ lệ tử vong do tim mạch (29,9% so với 24%).94 Các cơ chế được đưa ra cho phát hiện này bao gồm giảm cung lượng tim liên quan đến PAP ở mức cao hơn khi dùng chế độ ASV, cũng như giả thuyết rằng CSA thực sự là một cơ chế bù trừ ở những bệnh nhân bị HF nặng với các đặc tính có lợi bị suy giảm khi điều trị ASV.
Ngoài ra, thuật toán riêng được sử dụng trong SERVE ‐ HF đã được chứng minh là gây ra các đợt tăng thông khí đáng kể ở một số bệnh nhân, mà một số nghi ngờ có thể liên quan đến sự gia tăng tỷ lệ tử vong.95 Câu hỏi về việc liệu các phát hiện của SERVE ‐ HF có đại diện cho hiệu quả của hiệu quả nhóm ASV so với 1 thuật toán cụ thể có thể được trả lời bằng thử nghiệm ADVENT HF đang thực hiện, nghiên cứu về hiệu quả của liệu pháp ASV đối với tỷ lệ tử vong và bệnh tật ở bệnh nhân HF (trái phân suất tống máu thất ≤45%) với SDB bằng thuật toán đã cập nhật.96 Cho kết quả này, điều trị ASV chống chỉ định ở bệnh nhân mắc bệnh HF và CSA. Ngược lại với CSA, các thử nghiệm ngẫu nhiên lớn xem xét hiệu quả của liệu pháp CPAP trên các tiêu chí chính cứng ở bệnh nhân HF bị ngưng thở khi ngủ chủ yếu là tắc nghẽn còn thiếu. Do tác dụng có lợi của CPAP đối với các điểm cuối thay thế đã thảo luận ở trên, trong bối cảnh sự gia tăng quan sát thấy các tác dụng phụ bao gồm tử vong liên quan đến OSA cũng như không có nghiên cứu cho thấy tác hại, chúng tôi đề nghị thử nghiệm chẩn đoán ở bệnh nhân HF bị nghi ngờ ngưng thở khi ngủ dựa trên triệu chứng về đêm và/hoặc các yếu tố nguy cơ được phát hiện trong quá trình đánh giá giấc ngủ toàn diện.
Rung nhĩ
Tương tự như OSA, AF là phổ biến trong dân số nói chung, với tỷ lệ mắc từ 1% đến 2%.97 Ở bệnh nhân mắc OSA, tỷ lệ mắc AF là ≈5%, 98 trong khi đáng chú ý là tỷ lệ mắc OSA ở bệnh nhân được chẩn đoán mắc AF đã được báo cáo cao tới 32% đến 39%.99 Một mối liên quan độc lập có ý nghĩa giữa 2 rối loạn và tồn tại ngay cả sau khi kiểm soát các tình trạng gây nhiễu như tăng huyết áp, béo phì và suy tim.101 Trong khi nhiều cơ chế đã được đưa ra để giải thích mối liên quan này, quan trọng nhất dường như là sự tăng vọt về đêm trương lực giao cảm, tăng huyết áp hệ thống và tái cấu trúc, đặc biệt là tâm nhĩ. Sự thay đổi trong điều hòa hệ thống giao cảm và đối giao cảm được quan sát thấy ở BN OSA.79 Trong giai đoạn ngưng thở, xung ly tâm phó giao cảm tăng, gây nhịp chậm thoáng qua cũng như rút ngắn thời gian trơ hiệu quả của tâm nhĩ với hậu quả nhạy cảm với kích thích bên ngoài, một hiệu quả phục vụ cho việc giúp hồi phục với atropine hoặc cắt thần kinh phó giao cảm. Trong các mô hình động vật của OSA, tình trạng thiếu oxy trong máu dẫn đến tăng kích thích hệ thần kinh giao cảm cũng như kích hoạt hệ thống angiotensin renin, giảm ngưỡng cho cảm ứng RN.102 Quan sát rằng sự triệt đốt thần kinh thận và khối hạch giao cảm cung cấp sự bảo vệ đáng kể nhưng không hoàn toàn bảo vệ chống lại RN liên quan với ngưng thở lúc ngủ cho thấy các cơ chế bổ sung ngoài kích hoạt tế bào thần kinh có liên quan.103
Theo thời gian, OSA thúc đẩy tái cấu trúc của cả tâm thất và tâm nhĩ, cung cấp thêm một cơ chế gây rối loạn nhịp tim. Sự dao động quá mức áp lực trong lồng ngực, như đã thấy trong các thời gian ngưng thở, đã được chứng minh là gây ra sự giãn nở tâm nhĩ cấp tính cũng như tăng tần số ngoại tâm thu ngay cả ở những người khỏe mạnh.106 Biến cố ngưng thở lặp đi lặp lại mãn tính có liên quan đến sự giãn nở nhĩ trái và xơ hóa108 cũng như phì đại tâm thất trái và rối loạn chức năng tâm trương.110 Các nghiên cứu điện sinh lý của tâm nhĩ trái bị giãn sau các biến cố ngưng thở lặp đi lặp lại đã cho thấy giảm dẫn truyền nhĩ, giảm biên độ điện tâm đồ và các điện tâm nhĩ phân đoạn phức tạp cung cấp hỗ trợ cơ học cho tái cấu trúc nhĩ ở BN RN liên quan với OSA.109 Giảm dẫn truyền nhĩ cũng xảy ra trong quá trình tăng CO2 máu, ngay cả khi không bị thiếu oxy.111 Tính nhạy cảm với RN ở bệnh nhân OSA có thể phản ánh tác động kết hợp của các cơ chế khác nhau này, với sự kích hoạt tế bào thần kinh và tăng CO2 máu được kích hoạt bởi các biến cố ngưng thở cấp tính được đặt lên trên cơ chất dễ bị tổn thương của trái tim đã bị trái cấu trúc.
Ngoài mối liên hệ dịch tễ học rõ ràng giữa hai tình trạng, ngày càng có nhiều bằng chứng cho thấy vai trò quan trọng của OSA trong RN tái phát và/hoặc điều trị RN trơ với điều trị. Trong nghiên cứu ORBIT ‐ AF, bao gồm > 10 000 bệnh nhân bị RN, các BN OSA cùng tồn tại có triệu chứng RN nặng nề hơn và có nhiều khả năng cần điều trị kiểm soát nhịp tim.87
Nguy cơ tăng cao hơn của RN tái phát sau một đợt biến cố xãy ra (incident)88 và kết quả xấu tệ hơn sau khi cắt đốt qua catheter112 đã được quan sát thấy ở những bệnh nhân OSA. Điều quan trọng, có bằng chứng cho thấy việc điều trị OSA có thể thay đổi những nguy cơ này này. Trong nhóm nghiên cứu ORBIT ‐ AF, bệnh nhân OSA được điều trị bằng CPAP ít hơn có ý nghĩa khả năng tiến triển thành RN vĩnh viễn so với bệnh nhân OSA không dùng CPAP.87
Ngoài ra, nhiều nghiên cứu quan sát đã chứng minh giảm đáng kể nguy cơ RN tái phát sau cắt đốt qua catheter ở các bệnh nhân OSA được điều trị bằng CPAP so với bệnh nhân OSA không được điều trị.112 Một phân tích gộp của các nghiên cứu này cho thấy ở những bệnh nhân OSA được điều trị bằng CPAP, nguy cơ tái phát AF sau cắt đốt qua catheter không khác biệt đáng kể so với nhóm đối chứng không có OSA, trong khi bệnh nhân OSA không được điều trị bằng CPAP có nguy cơ tái phát cao hơn 57% (P 113 Những hạn chế quan trọng của các nghiên cứu này bao gồm thiết kế quan sát, chẩn đoán ngưng thở khi ngủ qua bệnh sử lâm sàng và/hoặc bảng câu hỏi chuẩn hóa thay cho test đánh giá giấc ngủ chính thức trong phần lớn các trường hợp và xác định sử dụng CPAP thông qua tự báo cáo.
Nhìn chung, y văn hiện tại trong lĩnh vực này cho thấy lợi ích có thể có của việc điều trị OSA bằng CPAP liên quan đến gánh nặng RN và nguy cơ tái phát trong quá trình kiểm soát nhịp, đặc biệt là sau khi cắt đốt bằng catheter. Trên cơ sở các dữ liệu này, chúng tôi đề nghị thực hiện test chẩn đoán với HSAT hoặc PSG ở những bệnh nhân nghi ngờ ngưng thở lúc ngủ sau khi đánh giá giấc ngủ toàn diện dựa trên các triệu chứng về đêm và/hoặc các yếu tố nguy cơ khi cắt đốt qua catheter được lên kế hoạch. Khuyến cáo này phù hợp với Hướng dẫn Đồng thuận của Chuyên gia HRS năm 2017 về RN qua catheter hoặc phẫu thuật.118
Ngoài ra, chúng tôi tin rằng các bác sĩ lâm sàng hợp lý khi xem xét test chẩn đoán ở những bệnh nhân nghi ngờ chứng ngưng thở lúc ngủ được quản lý thông qua các chiến lược kiểm soát nhịp khác hơn là cắt đốt, mặc dù hiện tại không đủ bằng chứng để cung cấp các tiêu chí lâm sàng cụ thể hướng dẫn chọn lọc từ trong nhóm bệnh nhân lớn và không đồng nhất này. Do đó, các bác sĩ phải áp dụng phán đoán lâm sàng cá nhân hóa trong việc lựa chọn bệnh nhân để test HSAT hoặc PSG, lưu ý rằng bệnh nhân có các đặc điểm nguy cơ cao hơn (tiền sử RN tái phát sau chuyển nhịp, thất bại do thuốc chống loạn nhịp, v.v.) có nhiều khả năng nhận được lợi ích từ việc phát hiện và điều trị OSA. Bệnh nhân bị RN phát hiện có triệu chứng SDB và có nguy cơ mắc OSA từ đến trung bình ‐ nặng trong khi đánh giá giấc ngủ toàn diện nên được chỉ định để test chẩn đoán, tương tự như bệnh nhân không có không có RN kèm theo.
Rối loạn nhịp khác
Ngoài RN, OSA có liên quan với nhiều loại rối loạn nhịp tim khác cũng như đột tử do tim.
Simantirakis và cộng sự báo cáo tỉ lệ hiện hành 22% khoảng ngưng dài và nhịp chậm ở các BN với OSA mức độ TB đến nặng những người được theo dõi lâu dài với ILR (implanted loop recorder).119 BN có thể được xem xét có “hội chứng nhịp nhanh nhịp chậm” khi xen kẽ với RN hoặc các dạng nhịp nhanh trên thất khác. Nguy cơ rối loạn nhịp thất cũng có vẻ cao hơn ở những bệnh nhân OSA.
Nghiên cứu của Mehra và cộng sự đã tìm thấy tỷ lệ nhịp tim nhanh thất không kéo dài cao hơn đáng kể (5,3% so với 1,2%, P = 0,004) ở những bệnh nhân OSA nặng so với nhóm chứng.98 Tương tự, OSA nặng có nguy cơ ngoại tâm thu thất phức tạp cao hơn đáng kể, được định nghĩa là nhịp nhanh thất không kéo dài, ngoại tâm thu thất cặp đôi, cặp ba, cặp bốn (25% so với 14,5%, P = 0,002). Quan trọng, tăng nguy cơ đột tử do tim đã được báo cáo ở những bệnh nhân OSA nặng, đặc biệt ở các BN có SpO2 ban đêm 120 Có dữ liệu hạn chế cho thấy tác dụng có lợi của liệu pháp CPAP trong việc giảm rối loạn nhịp ở bệnh nhân với OSA119; tuy nhiên, nghiên cứu bổ sung là cần thiết thêm vào cùng với các nghiên cứu nhỏ này và chủ yếu là nghiên cứu quan sát.
Bệnh ĐM vành, bệnh mạch máu não, hoặc bệnh nhân không có bệnh lý tim mạch trước đó nhưng có nguy cơ cao biến cố tim mạch bất lợi trong tương lai
Đã xác định có mối liên quan giữa OSA và các dạng CVD khác ngoài các mô tả ở trên, đặc biệt là bệnh động mạch vành (CAD) 58 và bệnh mạch máu não.124 Trong số các cơ chế sinh lý bệnh liên quan giữa OSA với CAD và bệnh mạch máu não là một số trong các mô tả ở trên, bao gồm tăng hoạt động của hệ thần kinh giao cảm, stress oxi hóa, và sự ưu chuộng riêng đối với tăng HA kháng trị và/hoặc kiểm soát kém. Các cơ chế bổ sung cũng đã được xác định, bao gồm rối loạn chức năng nội mô,125 thúc đẩy trạng thái tiền đông máu,127 và rối loạn chuyển hóa đặc trưng bởi kháng insulin.128 Điều trị OSA bằng CPAP đã được chứng minh là giảm thiểu các quá trình này,127 đưa ra một cơ chế hợp lý OSA có thể ảnh hưởng đến dự hậu tim mạch.
Hỗ trợ hiệu quả của điều trị OSA trong việc cải thiện dự hậu tim mạch đến từ các nghiên cứu quan sát trước đây. Một phân tích tiền cứu trên 54 bệnh nhân CAD và OSA đã biết cho thấy giảm đáng kể tiêu chí chính cộng gộp đối với tử vong tim mạch, hội chứng mạch vành cấp tính, nhập viện vì HF, hoặc cần tái thông mạch vành (tỷ số rủi ro (HR) 0,24; KTC 95%, 0,090,62; P 132 Một nghiên cứu quan sát theo dõi 223 bệnh nhân trong 5 năm sau đột quỵ cho thấy nguy cơ tử vong tăng hơn ở bệnh nhân không thể dung nạp CPAP so với những người dung nạp CPAP (tỷ số HR 1,58; KTC 95%, 1,01-2,49; P = 0,04).133 Tương tự, một nhóm bệnh nhân gồm 444 bệnh nhân được điều trị bằng CPAP, giảm cân hoặc phẫu thuật đã tìm thấy một lượng đáng kể giảm tỷ lệ tử vong liên quan đến từng phương thức điều trị riêng lẻ so với bệnh nhân không được điều trị. Khi so sánh với dân số chung sử dụng dữ liệu sinh tồn có nguồn gốc từ điều tra dân số, bệnh nhân không được điều trị có tỷ lệ tử vong cao hơn đáng kể, trong khi tỷ lệ tử vong không khác biệt đáng kể giữa bệnh nhân được điều trị và dân số nói chung.134
Tương tự, một nghiên cưu trên 444 bệnh nhân được điều trị bằng CPAP, giảm cân hoặc phẫu thuật đã tìm thấy sự giảm đáng kể tỷ lệ tử vong liên quan đến từng phương thức điều trị riêng lẻ so với bệnh nhân không được điều trị. Khi so sánh với dân số chung sử dụng dữ liệu sống còn nguồn gốc từ điều tra dân số, bệnh nhân không được điều trị có tỷ lệ tử vong cao hơn đáng kể, trong khi tỷ lệ tử vong không khác biệt đáng kể giữa bệnh nhân được điều trị và dân số chung.134
Mặc dù thất vọng, không có thử nghiệm ngẫu nhiên nào điều tra tác động của liệu pháp PAP đến kết quả tim mạch đã cho thấy một lợi ích rõ ràng đối với dự hậu tim mạch. Ở những bệnh nhân có tiền sử đột quỵ não, nghiên cứu Hsu và cộng sự cho thấy không có giảm các biến cố mạch máu não tái phát ở những bệnh nhân OSA được điều trị bằng liệu pháp PAP.135 Peker et al đã chọn ngẫu nhiên 244 bệnh nhân không có vấn đề buồn ngủ có CAD sau khi tái thông mạch và điều trị OSA ở mức độ trung bình với APAP so với không điều trị PAP và không tìm thấy sự khác biệt nào trong dự hậu biến cố tim mạch tổng hợp sau thời gian theo dõi trung vị 57 tháng.136
Thử nghiệm SAVE là RCT lớn nhất được thiết kế để trả lời câu hỏi liệu điều trị OSA bằng CPAP có thể cải thiện dự hậu tim mạch ở bệnh nhân CVD.5 Nghiên cứu SAVE phân ngẫu nhiên với 2717 bệnh nhân OSA trung bình đến nặng có CAD hoặc bệnh mạch máu não điều trị với CPAP cộng với chăm sóc thông thường hoặc chăm sóc thông thường một mình và theo dõi trong khoảng thời gian trung bình là 3,7 năm. Thử nghiệm không chứng minh được sự giảm đáng kể ở tiêu chí chính (tử vong tim mạch cộng gộp, nhồi máu cơ tim, đột quỵ não, nhập viện vì đau thắt ngực không ổn định, suy tim hoặc cơn thiếu máu não thoáng qua) ở những bệnh nhân được điều trị bằng CPAP thêm vào chăm sóc thông thường (tỷ số HR 1,10; KTC 95%, 0,91-1,32; P = 0,34). Trong số các tiêu chí phụ, CPAP có liên quan đến việc giảm đáng kể chứng ngáy và buồn ngủ ban ngày, cải thiện chất lượng cuộc sống và tâm trạng liên quan đến sức khỏe và nghỉ làm ít hơn vì sức khỏe kém.
Mặc dù các nghiên cứu này bao gồm các bệnh nhân CVD đã chẩn đoán trước đây, còn vai trò của trị liệu PAP trong phòng ngừa tiên phát ở bệnh nhân OSA mà chưa xác định có CVD cũng cần đước xác minh. Barbé và cộng sự đã ghi nhận 725 bệnh nhân không có vấn đề giấc ngủ với OSA từ TB đến ‐ nặng nhưng không có tiền sử CVD trước đó và chọn ngẫu nhiên họ thành CPAP so với không điều trị. Sau trung bình 4 năm, không có sự khác biệt về tỷ lệ tăng huyết áp hệ thống hoặc các biến cố tim mạch bao gồm tử vong do tim mạch, nhồi máu cơ tim hoặc đột quỵ, TIA hoặc HF.137 Một phân tích tổng hợp 10 RCT năm 2017 (trong đó có 6 nghiên cứu có CVD được yêu cầu để ghi danh) bởi Yu và cộng sự cho thấy không có mối liên quan nào giữa liệu pháp PAP và các biến cố tim mạch lớn (tỷ lệ nguy hiểm 0,77; KTC 95%, 0,531,13; P = 0,19).138
Mặc dù liệu pháp PAP dường như có hiệu quả trong việc giảm các triệu chứng của OSA, nhưng kết quả của các thử nghiệm ngẫu nhiên này không hỗ trợ hiệu quả của nó trong việc giảm nguy cơ biến cố tim mạch bất lợi ở bệnh nhân mắc OSA. Một số hạn chế tiềm tàng đối với các bằng chứng sẵn có đã được trích dẫn.6Đầu tiên, việc tuân thủ PAP dưới mức tối ưu là phổ biến, với thời gian trung bình 138 Trong nghiên cứu SAVE lớn nhất trong tất cả các thử nghiệm về vấn đề này đến nay, thời gian sử dụng PAP trung bình là 3,3 giờ mỗi đêm và chưa đến một nửa (42%) trong số những người trong nhóm CPAP đạt được sự tuân thủ tốt, có nghĩa là ≥4 giờ sử dụng CPAP mỗi đêm.5 Phân tích tổng hợp của Yu cho thấy trong 4 RCT đạt được tuân thủ điều trị trung bình > 4 giờ/đêm, liệu pháp PAP có liên quan đến nguy cơ biến cố tim mạch thấp hơn đáng kể (nguy cơ tương đối 0,58; KTC 95%, 0,34-0,99); tuy nhiên, ý nghĩa của kết quả này là không chắc chắn do không có mối liên hệ tương tự trong phân tích phân nhóm bệnh nhân từ tất cả 10 RCT với tuân thủ PAP tốt bằng cách sử dụng hồi quy gộp, có thể gây nhiễu vì sự khác biệt không phân ngẫu nhiên giữa bệnh nhân tuân thủ và không tuân thủ và giới hạn vốn có của phân tích dưới nhóm và post-hoc.Thứ hai, những bệnh nhân có triệu chứng ngưng thở khi ngủ nghiêm trọng (thang điểm Epworth (ESS) > 10) đã bị loại trừ khỏi một số thử nghiệm ngẫu nhiên, và một số tác giả đã đưa ra giả thuyết rằng lợi ích của liệu pháp PAP trong việc ngăn ngừa dự hậu bất lợi về tim mạch có thể bị hạn chế ở những bệnh nhân có nguy cơ cao hơn có OSA nặng. Thứ ba, tất cả các bệnh nhân tham gia thử nghiệm SAVE đều được chẩn đoán mắc OSA khi sử dụng HSAT, mặc dù các hướng dẫn khuyến cáo sử dụng PSG để sử dụng cho BN có bệnh tim phổi có ý nghĩa, là một trong những tiêu chí đưa vào nghiên cứu này. Do đó, có khả năng một tỷ lệ đáng kể dân số tuyển vào có thể bị ảnh hưởng bởi thở Cheyne Stokes hoặc các dạng ngưng thở hỗn hợp khác sẽ không có lợi ích tương tự từ liệu pháp PAP như ở bệnh nhân bị ngưng thở do tắc nghẽn hoàn toàn.6
Mặc dù những hạn chế này có thể đưa ra các chủ đề quan tâm cho các đánh giá trong tương lai, bằng chứng tốt nhất hiện có không hỗ trợ việc sử dụng liệu pháp PAP đặc biệt cho mục đích giảm nguy cơ các biến cố bất lợi trong tương lai tại thời điểm này. Do đó, chúng tôi đề nghị test chẩn đoán cho bệnh nhân mắc CAD, bệnh mạch máu não hoặc nguy cơ tim mạch tăng cao trong trường hợp ngưng thở khi ngủ được nghi ngờ trên lâm sàng vì các dấu hiệu hoặc triệu chứng được phát hiện trong quá trình đánh giá giấc ngủ lâm sàng.
Nguy cơ chu phẫu
OSA kèm theo có liên quan đến việc quản lý tiền phẫu cho bệnh nhân CVD có kế hoạch phẫu thuật. OSA không chỉ làm tăng nguy cơ biến chứng hô hấp, mà một số nghiên cứu đã báo cáo tăng nguy cơ RN sau phẫu thuật và các biến chứng tim khác.53 Tỷ lệ cao OSA không được chẩn đoán cao kết hợp với quan sát cho thấy các biến chứng sau phẫu thuật là phổ biến hơn ở những bệnh nhân OSA chưa được chẩn đoán139 đã thúc đẩy nhiều trung tâm kết hợp sàng lọc OSA như một phần thường quy của đánh giá trước phẫu thuật. Các bảng câu hỏi về giấc ngủ khác nhau đã được sử dụng trong vai trò này, thang điểm STOP BANG được xác nhận rộng rãi nhất trong dân số bệnh nhân phẫu thuật. Điểm STOP BANG ≥3 xác định bệnh nhân có nguy cơ mắc OSA và có liên quan độc lập với tăng nguy cơ biến chứng phẫu thuật.54 Ở bệnh nhân mắc OSA được chẩn đoán trước đó, đánh giá trước phẫu thuật nên bao gồm đánh giá kết quả nghiên cứu giấc ngủ trước đó để xác nhận loại và mức độ nặng của ngưng thở khi ngủ cũng như đánh giá sự tuân thủ của họ với PAP và/hoặc các liệu pháp khác.
Xác định bệnh nhân đã được chẩn đoán xác định hoặc có nguy cơ cao OSA trong quá trình đánh giá trước phẫu thuật tạo cơ hội cho các can thiệp có mục tiêu có thể làm giảm nguy cơ biến chứng tim phổi do phẫu thuật. Các vấn đề quản lý cụ thể cần được xem xét bao gồm xác định nhu cầu đánh giá và tối ưu h óa cho tình trạng tim phổi trước phẫu thuật, lựa chọn chiến lược gây mê phù hợp, cường độ và thời gian theo dõi sau phẫu thuật và điều kiện trị liệu PAP sau phẫu thuật. Năm 2016, Hiệp hội Gây mê và Y học giấc ngủ (SASM) về Sàng lọcvà Đánh giá trước phẫu thuật cho BN trưởng thành bị ngưng thở khi ngủ do tắc nghẽn đưa ra những hướng dẫn liên quan đến những câu hỏi này.53 Sơ đồ đánh giá trước phẫu thuật của hướng dẫn này được biểu thị trong Hình 1.
*Quy trình cụ thể theo dõi BN trong và sau phẫu thuật với chẩn đoán đã biết hoặc nguy cơ cao OSA khác nhau tùy bệnh viện và khác nhau từng BN dựa vào đặc tính lâm sàng mỗi BN
Hình 1 Sơ đồ đánh giá OSA tiền phẫu. Quy trình cụ thể theo dõi trong và sau thủ thuật phẫu thuật ở BN với đã chẩn đoán hoặc nguy cơ cao OSA khác nhau tùy viện và bệnh nhân với bệnh nhân dựa trên đặc tính lâm sàng của từng cá nhân.
Tổng kết các khuyến cáo
Đánh giá
Do tỷ lệ ngưng thở khi ngủ cao ở bệnh nhân mắc CVD đã biết, chúng tôi khuyên các bác sĩ lâm sàng nên thực hiện sàng lọc thường quy các triệu chứng SDB ở bệnh nhân mắc CVD.
Các chiến lược thích hợp để sàng lọc bao gồm tập trung vào các câu hỏi được thực hiện bởi nhân viên y tế cũng như sử dụng các câu hỏi đã được chuẩn hóa như STOPBANG, ESS hoặc bảng câu hỏi Berlin.
Bệnh nhân nếu có khai bất kỳ triệu chứng nào nên được đánh giá giấc ngủ một cách toàn diện.
Sàng lọc OSA nên được đưa vào đánh giá trước phẫu thuật thường quy và đặc biệt chúng tôi khuyên bạn nên sử dụng các công cụ như STOP BANG cho mục đích này.
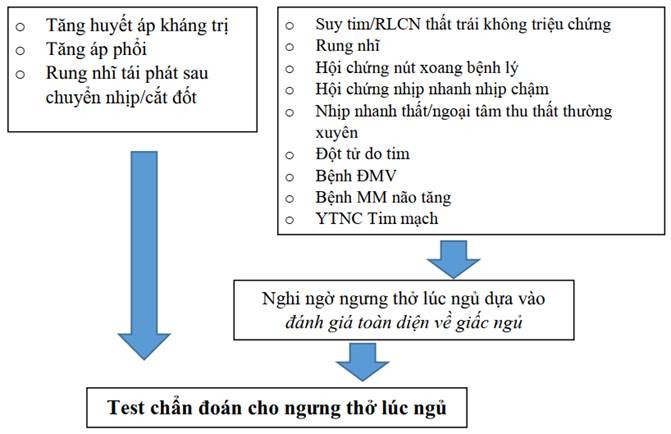
Cách tiếp cận của chúng tôi trong việc lựa chọn bệnh nhân để thực hiện test chẩn đoán giấc ngủ sau khi đánh giá giấc ngủ toàn diện khác nhau dựa trên bệnh nền tim mạch kèm theo (Hình 2):
Chúng tôi đề nghị test chẩn đoán cho tất cả bệnh nhân, kể cả những người không có triệu chứng SDB, với các dạng CVD sau:
Tăng huyết áp kháng trị, được định nghĩa là huyết áp được kiểm soát không đầy đủ mặc dù điều trị bằng ≥3 thuốc hạ áp đường uống bao gồm thuốc lợi tiểu hoặc kiểm soát huyết áp đầy đủ với ≥ 4 thuốc.
Tăng huyết áp phổi.
AF tái phát sau khi điều trị chuyển nhịp hoặc cắt đốt.
Chúng tôi đề nghị test chẩn đoán cho những bệnh nhân nghi ngờ hoặc đã có bệnh lý tim mạch mà nghi ngờ có ngưng thở lúc ngủ sau khi đánh giá giấc ngủ toàn diện:
HF có triệu chứng (NYHA II ‐ IV) hoặc rối loạn chức năng thất trái (phân suất tống máu
RN, đặc biệt ở những bệnh nhân có triệu chứng dai dẳng, thách thức kiểm soát tần số bằng thuốc hoặc chiến lược kiểm soát nhịp sẽ được theo đuổi.
Hội chứng nút xoang bệnh lý
Hội chứng nhịp nhanh nhịp chậm
Nhịp tim nhanh thất hoặc ngoại tâm thu thất thường xuyên.
Những người sống sót sau cái chết tim đột ngột.
Bệnh động mạch vành.
Bệnh mạch máu não.
Bệnh nhân có nguy cơ cao đối với các biến cố tim mạch trong tương lai.
Kiểm tra định kỳ các triệu chứng ban đêm của SDB nên được lặp lại theo các khoảng thời gian xác định trong thời gian dài theo dõi ở bệnh nhân CVD hoặc các yếu tố nguy cơ quan trọng khác không được chuyển để test chẩn đoán sau khi đánh giá giấc ngủ toàn diện ban đầu.
Hình 2 Sơ đồ chọn lọc bệnh nhân để thực hiện test chẩn đoán giấc ngủ dựa vào tình trạng bệnh nền tim mạch
Chiến lược test chẩn đoán: Chúng tôi đồng ý với các khuyến cáo sau đây của Viện Y học Giấc ngủ Hoa Kỳ 2017 về chẩn đoán OSA:
Không nên sử dụng các công cụ lâm sàng, bảng câu hỏi và thuật toán dự đoán để chẩn đoán OSA trong trường hợp không thực hiện đo đa kí giấc ngủ (PSG) hoặc test ngưng thở tại nhà (HSAT).
Có thể sử dụng phương pháp PSG hoặc HSAT để chẩn đoán OSA ở bệnh nhân không biến chứng.
Những người có HSAT âm tính hoặc không kết luận nên thực hiện PSG.
Đối với những người có xác suất tiền nghiệm cao và PSG âm tính, có thể xem xét một lặp lại PSG.
PSG nên được sử dụng chứ không phải HSAT ở những bệnh nhân phức tạp, được định nghĩa là những BN có bệnh tim phổi nền quan trọng, yếu cơ hô hấp tiềm ẩn do rối loạn thần kinh cơ, bằng chứng giảm thông khí lúc thức hoặc nghi ngờ giảm thông khí liên quan giấc ngủ, sử dụng thuốc gây nghiện mãn tính, đột quỵ não, mất ngủ nghiêm trọng hoặc nghi ngờ rối loạn vận động liên quan đến giấc ngủ như hội chứng chân không yên.
Điều trị:
Chúng tôi đồng ý với các khuyến cáo từ ban soạn thảo Ngưng thở khi Ngủ ở Người lớn năm 2009 của Viện Y học Giấc ngủ Hoa Kỳ về việc điều trị OSA:
Tương quan lâm sàng là cần thiết để xác định liệu bệnh nhân không nạp-CPAP nên được chuyển đến phẫu thuật đường hô hấp trên hoặc điều trị bằng đặt dụng cụ ở miệng. Một cách tiếp cận đa ngành trong quản lý OSA nên được sử dụng phù hợp với từng bệnh nhân, bao gồm sự tham gia của các bác sĩ được đào tạo về y học giấc ngủ, phẫu thuật tai mũi họng-phẫu thuật đầu và cổ, bác sĩ tim mạch, phẫu thuật maxillofacial và nha sĩ được đào tạo về nha khoa giấc ngủ.
Tất cả bệnh nhân OSA được chẩn đoán nên được đề nghị điều trị.
Theo dõi với test giấc ngủ nên được thực hiện để đánh giá hiệu quả của các liệu pháp không-PAP như là một phần của kế hoạch theo dõi thường xuyên bên cạnh việc đánh giá các triệu chứng và các thông số lâm sàng khác.
Đối với những bệnh nhân gặp khó khăn trong việc dung nạp CPAP, nên cố gắng điều chỉnh phương pháp điều trị để cải thiện sự tuân thủ.
Mode ASV không nên được sử dụng ở những bệnh nhân bị HF và phân suất tống máu thấp, do có bằng chứng gây hại.
Dụng cụ đặt ở miệng (OAs):
Chúng tôi đồng ý với các khuyến cáo năm 2015 từ AASM và AADSM liên quan đến OAs.
OAs có thể được điều trị như là liệu pháp chính ở bệnh nhân chủ yếu với ngáy mà không ngưng thở khi ngủ.
OAs có thể được cung cấp như là liệu pháp chính ở những bệnh nhân mắc OSA nhẹ đến vừa phải, những người rất thích để tránh điều trị CPAP.
Bệnh nhân không đáp ứng/dung nạp PAP có thể được xem xét dùng OAs.
OAs có thể được thêm vào với PAP trong các trường hợp được chọn lọc.
OAs tùy chỉnh được cung cấp bởi một nha sĩ được đào tạo ưu chuộng hơn các OAs không tùy chỉnh ở bất cứ khi nào thực hiện được. Bệnh nhân được điều trị bằng OAs nên theo dõi thường xuyên bởi nha khoa đã qua đào tạo để đánh giá hiệu quả và các tác dụng phụ tiềm ẩn.
Phẫu thuật đường hô hấp trên
Phẫu thuật đường thở trên có thể được cung cấp trị liệu cho bệnh nhân chủ yếu với ngáy mà không ngưng thở khi ngủ.
Bệnh nhân không đáp ứng/dung nạp PAP có thể được xem xét phẫu thuật đường hô hấp trên.
Phẫu thuật đường hô hấp trên có thể được coi là bổ sung cho PAP hoặc OAs trong các trường hợp chọn lọc.
Giảm cân:
Tất cả bệnh nhân thừa cân và béo phì bị OSA nên được khuyến cáo giảm cân. Bệnh nhân CVD có thể đạt được lợi ích lớn hơn từ việc giảm cân và nên được giới thiệu đến một chương trình giảm cân chính thức, với sự cho phép về nguồn lực.
Tài liệu tham khảo
1Shahar E, Whitney CW, Redline S, Lee ET, Newman AB, Nieto FJ, O’Connor GT, Boland LL, Schwartz JE, Samet JM. Sleep‐disordered breathing and cardiovascular disease: cross‐sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med. 2001; 163:19–25.
2Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep‐disordered breathing in adults. Am J Epidemiol. 2013; 177:1006–1014.
3Johnson KG, Johnson DC. Frequency of sleep apnea in stroke and TIA patients: a meta‐analysis. J Clin Sleep Med. 2010; 6:131–137.
4Worsnop CJ, Naughton MT, Barter CE, Morgan TO, Anderson AI, Pierce RJ. The prevalence of obstructive sleep apnea in hypertensives. Am J Respir Crit Care Med. 1998; 157:111–115.
5McEvoy RD, Antic NA, Heeley E, Luo Y, Ou Q, Zhang X, Mediano O, Chen R, Drager LF, Liu Z, Chen G, Du B, McArdle N, Tripathi M, Billot L, Li Q, Lorenzi‐Filho G, Barbe F, Redline S, Wang J, Arima H, Neal B, White DP, Grunstein RR, Zhong N, Anderson CS. CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med. 2016; 375:919– 931.
6Bahammam AS, Pandi‐Perumal SR, Spence DW, Moscovitch A, Streiner DL. The SAVE Trial: has the importance of CPAP for preventing cardiovascular events been discounted?Sleep Vigil. 2017; 1:47–48.
7Bibbins‐Domingo K, Grossman DC, Curry SJ, Davidson KW, Epling JW, Garcia FA, Herzstein J, Kemper AR, Krist AH, Kurth AE, Landefeld CS, Mangione CM, Phillips WR, Phipps MG, Pignone MP, Silverstein M, Tseng CW. Screening for obstructive sleep apnea in adults: US Preventive Services Task Force recommendation statement. JAMA. 2017; 317:407– 414.
8Jordan AS, McSharry DG, Malhotra A. Adult obstructive sleep apnoea. Lancet. 2014; 383:736–747.
9Dempsey JA, Veasey SC, Morgan BJ, O’Donnell CP. Pathophysiology of sleep apnea. Physiol Rev. 2010; 90:47–112. 10Wellman A, Jordan AS, Malhotra A, Fogel RB, Katz ES, Schory K, Edwards JK, White DP. Ventilatory control and airway anatomy in obstructive sleep apnea. Am J Respir Crit Care Med. 2004; 170:1225–1232.
11Eckert DJ, Owens RL, Kehlmann GB, Wellman A, Rahangdale S, Yim‐Yeh S, White DP, Malhotra A. Eszopiclone increases the respiratory arousal threshold and lowers the apnoea/hypopnoea index in obstructive sleep apnoea patients with a low arousal threshold. Clin Sci. 2011; 120:505–514.
12Javaheri S, Barbe F, Campos‐Rodriguez F, Dempsey JA, Khayat R, Malhotra A, Martinez‐Garcia MA, Mehra R, Pack AI, Polotsky VY, Redline S, Somers VK. Sleep apnea: types, mechanisms, and clinical cardiovascular consequences. J Am Coll Cardiol. 2017; 69:841–858.
13Malhotra A, White DP. Obstructive sleep apnoea. Lancet. 2002; 360:237–245.
14Sateia MJ. International classification of sleep disorders‐third edition: highlights and modifications. Chest. 2014; 146:1387–1394.
15Ahmadi N, Shapiro GK, Chung SA, Shapiro CM. Clinical diagnosis of sleep apnea based on single night of polysomnography vs. two nights of polysomnography. Sleep Breath. 2009; 13:221–226.
16Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, Harrod CG. Clinical practice guideline for diagnostic testing for adult obstructive sleep apnea: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med. 2017; 13:479–504.
17Zeidler MR, Santiago V, Dzierzewski JM, Mitchell MN, Santiago S, Martin JL. Predictors of obstructive sleep apnea on polysomnography after a technically inadequate or normal home sleep test. J Clin Sleep Med. 2015; 11:1313–1318. 18Rosen CL, Auckley D, Benca R, Foldvary‐Schaefer N, Iber C, Kapur V, Rueschman M, Zee P, Redline S. A multisite randomized trial of portable sleep studies and positive airway pressure autotitration versus laboratory‐based polysomnography for the diagnosis and treatment of obstructive sleep apnea: the HomePAP study. Sleep. 2012; 35:757–767.
19de Oliveira ACT, Martinez D, Vasconcelos LFT, Cadaval Gonçalves S, do Carmo Lenz M, Costa Fuchs S, Gus M, de Abreu‐Silva EO, Beltrami Moreira L, Danni Fuchs F. Diagnosis of obstructive sleep apnea syndrome and its outcomes with home portable monitoring. Chest. 2009; 135:330–336.
20Pietzsch JB, Garner A, Cipriano LE, Linehan JH. An integrated health‐economic analysis of diagnostic and therapeutic strategies in the treatment of moderate‐to‐severe obstructive sleep apnea. Sleep. 2011; 34:695–709.
21Deutsch PA, Simmons MS, Wallace JM. Cost‐effectiveness of split‐night polysomnography and home studies in the evaluation of obstructive sleep apnea syndrome. J Clin Sleep Med. 2006; 2:145–153.
22Kim RD, Kapur VK, Redline‐Bruch J, Rueschman M, Auckley DH, Benca RM, Foldvary‐Schafer NR, Iber C, Zee PC, Rosen CL, Redline S, Ramsey SD. An economic evaluation of home versus laboratory‐based diagnosis of obstructive sleep apnea. Sleep. 2015; 38:1027–1037.
23Gay P, Weaver T, Loube D, Iber C; Positive Airway Pressure Task Force . Evaluation of positive airway pressure treatment for sleep related breathing disorders in adults. Sleep. 2006; 29:381–401.
24Kushida CA, Littner MR, Hirshkowitz M, Morgenthaler TI, Alessi CA, Bailey D, Boehlecke B, Brown TM, Coleman J, Friedman L, Kapen S, Kapur VK, Kramer M, Lee‐Chiong T, Owens J, Pancer JP, Swick TJ, Wise MS. Practice parameters for the use of continuous and bilevel positive airway pressure devices to treat adult patients with sleep‐related breathing disorders. Sleep. 2006; 29:375–380
25Xu T, Li T, Wei D, Feng Y, Xian L, Wu H, Xu J. Effect of automatic versus fixed continuous positive airway pressure for the treatment of obstructive sleep apnea: an up‐to‐date meta‐analysis. Sleep Breath. 2012; 16:1017–1026.
26Bloch KE, Huber F, Furian M, Latshang TD, Lo Cascio CM, Nussbaumer‐Ochsner Y, Senn O, Russi EW, Kohler M, Schoch OD, Turk A, Imhof E, Laube I, Matthews F, Thurnheer R. Autoadjusted versus fixed CPAP for obstructive sleep apnoea: a multicentre, randomised equivalence trial. Thorax. 2018; 73:174–184. 27Morgenthaler TI, Aurora RN, Brown T, Zak R, Alessi C, Boehlecke B, Chesson AL, Friedman L, Kapur V, Maganti R, Owens J, Pancer J, Swick TJ; Standards of Practice Committee of the American Academy of Sleep Medicine . Practice parameters for the use of autotitrating continuous positive airway pressure devices for titrating pressures and treating adult patients with obstructive sleep apnea syndrome: an update for 2007. An American Academy of Sleep Medicine report. Sleep. 2008; 31:141–147.
28Wozniak DR, Lasserson TJ, Smith I. Educational, supportive and behavioural interventions to improve usage of continuous positive airway pressure machines in adults with obstructive sleep apnoea. Cochrane Database Syst Rev. 2014:CD007736.
29Knowles SR, O’Brien DT, Zhang S, Devara A, Rowley JA. Effect of addition of chin strap on PAP compliance, nightly duration of use, and other factors. J Clin Sleep Med. 2014; 10:377–383.
30Johansson K, Hemmingsson E, Harlid R, Trolle Lagerros Y, Granath F, Rössner S, Neovius M. Longer term effects of very low energy diet on obstructive sleep apnoea in cohort derived from randomised controlled trial: prospective observational follow‐up study. BMJ. 2011; 342:d3017
31Foster GD, Borradaile KE, Sanders MH, Millman R, Zammit G, Newman AB, Wadden TA, Kelley D, Wing RR, Pi‐Sunyer FX, Reboussin D, Kuna ST. A randomized study on the effect of weight loss on obstructive sleep apnea among obese patients with type 2 diabetes: the Sleep AHEAD study. Arch Intern Med. 2009; 169:1619–1626.
32Kuna ST, Reboussin DM, Borradaile KE, Sanders MH, Millman RP, Zammit G, Newman AB, Wadden TA, Jakicic JM, Wing RR, Pi‐Sunyer FX, Foster GD; Sleep AHEAD Research Group . Long‐term effect of weight loss on obstructive sleep apnea severity in obese patients with type 2 diabetes. Sleep. 2013; 36:641–649.
33Greenburg DL, Lettieri CJ, Eliasson AH. Effects of surgical weight loss on measures of obstructive sleep apnea: a metaanalysis. Am J Med. 2009; 122:535–542
34Horvath K, Jeitler K, Siering U, Stich AK, Skipka G, Gratzer TW, Siebenhofer A. Long‐term effects of weight‐reducing interventions in hypertensive patients: systematic review and meta‐analysis. Arch Intern Med. 2008; 168:571–580. 35Poobalan AS, Aucott LS, Smith WC, Avenell A, Jung R, Broom J. Long‐term weight loss effects on all cause mortality in overweight/obese populations. Obes Rev. 2007; 8:503–513.
36Morgenthaler TI, Kapen S, Lee‐Chiong T, Alessi C, Boehlecke B, Brown T, Coleman J, Friedman L, Kapur V, Owens J, Pancer J, Swick T; Standards of Practice Parameters of the American Academy of Sleep Medicine . Practice parameters for the medical therapy of obstructive sleep apnea. Sleep. 2006; 29:1031–1035.
37Ashrafian H, Toma T, Rowland SP, Harling L, Tan A, Efthimiou E, Darzi A, Athanasiou T. Bariatric surgery or nonsurgical weight loss for obstructive sleep apnoea? A systematic review and comparison of meta‐analyses. Obes Surg. 2015; 25:1239–1250
38Pevernagie DA, Stanson AW, Sheedy PF, Daniels BK, Shepard JW. Effects of body position on the upper airway of patients with obstructive sleep apnea. Am J Respir Crit Care Med. 1995; 152:179–185
39Epstein LJ, Kristo D, Strollo PJ, Friedman N, Malhotra A, Patil SP, Ramar K, Rogers R, Schwab RJ, Weaver EM, Weinstein MD; Adult Obstructive Sleep Apnea Task Force of the American Academy of Sleep Medicine . Clinical guideline for the evaluation, management and long‐term care of obstructive sleep apnea in adults. J Clin Sleep Med. 2009; 5:263–276.
40Ravesloot MJL, White D, Heinzer R, Oksenberg A, Pépin JL. Efficacy of the new generation of devices for positional therapy for patients with positional obstructive sleep apnea: a systematic review of the literature and meta‐analysis. J Clin Sleep Med. 2017; 13:813–824.
41Ferguson KA, Cartwright R, Rogers R, Schmidt‐Nowara W. Oral appliances for snoring and obstructive sleep apnea: a review. Sleep. 2006; 29:244–262.
42Sutherland K, Deane SA, Chan AS, Schwab RJ, Ng AT, Darendeliler MA, Cistulli PA. Comparative effects of two oral appliances on upper airway structure in obstructive sleep apnea. Sleep. 2011; 34:469–477.
43Ramar K, Dort LC, Katz SG, Lettieri CJ, Harrod CG, Thomas SM, Chervin RD. Clinical practice guideline for the treatment of obstructive sleep apnea and snoring with oral appliance therapy: an update for 2015. J Clin Sleep Med. 2015; 11:773–827
44Storesund A, Johansson A, Bjorvatn B, Lehmann S. Oral appliance treatment outcome can be predicted by continuous positive airway pressure in moderate to severe obstructive sleep apnea. Sleep Breath. 2018; 22:385–392.
45Camacho M, Riaz M, Capasso R, Ruoff CM, Guilleminault C, Kushida CA, Certal V. The effect of nasal surgery on continuous positive airway pressure device use and therapeutic treatment pressures: a systematic review and metaanalysis. Sleep. 2015; 38:279–286.
46Camacho M, Certal V, Brietzke SE, Holty JE, Guilleminault C, Capasso R. Tracheostomy as treatment for adult obstructive sleep apnea: a systematic review and meta‐analysis. Laryngoscope. 2014; 124:803–811.
47Certal VF, Zaghi S, Riaz M, Viera AS, Pinheiro CT, Kushida C, Capasso R, Camacho M. Hypoglossal nerve stimulation in the treatment of obstructive sleep apnea: a systematic review and meta‐analysis. Laryngoscope. 2015; 125:1254–1264.
48Kezirian EJ, Goldberg AN. Hypopharyngeal surgery in obstructive sleep apnea: an evidence‐based medicine review. Arch Otolaryngol Head Neck Surg. 2006; 132:206–213.
49Holty JE, Guilleminault C. Maxillomandibular advancement for the treatment of obstructive sleep apnea: a systematic review and meta‐analysis. Sleep Med Rev. 2010; 14:287–297.
50Stuck BA, Ravesloot MJL, Eschenhagen T, de Vet HCW, Sommer JU. Uvulopalatopharyngoplasty with or without tonsillectomy in the treatment of adult obstructive sleep apnea—a systematic review. Sleep Med. 2018; 50:152–165.
51Strollo PJ, Soose RJ, Maurer JT, de Vries N, Cornelius J, Froymovich O, Hanson RD, Padhya TA, Steward DL, Gillespie MB, Woodson BT, Van de Heyning PH, Goetting MG, Vanderveken OM, Feldman N, Knaack L, Strohl KP; STAR Trial Group . Upper‐airway stimulation for obstructive sleep apnea. N Engl J Med. 2014; 370:139–149.
52Strollo PJ, Gillespie MB, Soose RJ, Maurer JT, de Vries N, Cornelius J, Hanson RD, Padhya TA, Steward DL, Woodson BT, Verbraecken J, Vanderveken OM, Goetting MG, Feldman N, Chabolle F, Badr MS, Randerath W. Upper airway stimulation for obstructive sleep apnea: durability of the treatment effect at 18 months. Sleep. 2015; 38:1593–1598.
53Chung F, Memtsoudis SG, Ramachandran SK, Nagappa M, Opperer M, Cozowicz C, Patrawala S, Lam D, Kumar A, Joshi GP, Fleetham J, Ayas N, Collop N, Doufas AG, Eikermann M, Gali B, Gay P, Hernandez AV, Kaw R, Kezirian EJ, Malhotra A, Mokhlesi B, Parthasarathy S, Stierer T, Wappler F, Hillman DR, Auckley D. Society of anesthesia and sleep medicine guidelines on preoperative screening and assessment of adult patients with obstructive sleep apnea. Anesth Analg. 2016; 123:452–473.
54Corso RM, Petrini F, Buccioli M, Nanni O, Carretta E, Trolio A, De Nuzzo D, Pigna A, Di Giacinto I, Agnoletti V, Gambale G. Clinical utility of preoperative screening with STOP‐Bang questionnaire in elective surgery. Minerva Anestesiol. 2014; 80:877–884.
55MacKay SG, Chan L. Surgical approaches to obstructive sleep apnea. Sleep Med Clin. 2016; 11:331–341.
56Nieto FJ, Young TB, Lind BK, Shahar E, Samet JM, Redline S, D’Agostino RB, Newman AB, Lebowitz MD, Pickering TG. Association of sleep‐disordered breathing, sleep apnea, and hypertension in a large community‐based study. Sleep Heart Health Study. JAMA. 2000; 283:1829–1836.
57Marin JM, Agusti A, Villar I, Forner M, Nieto D, Carrizo SJ, Barbé F, Vicente E, Wei Y, Nieto FJ, Jelic S. Association between treated and untreated obstructive sleep apnea and risk of hypertension. JAMA. 2012; 307:2169–2176.
58Peppard PE, Young T, Palta M, Skatrud J. Prospective study of the association between sleep‐disordered breathing and hypertension. N Engl J Med. 2000; 342:1378–1384.
59Gonçalves SC, Martinez D, Gus M, de Abreu‐Silva EO, Bertoluci C, Dutra I, Branchi T, Moreira LB, Fuchs SC, de Oliveira AC, Fuchs FD. Obstructive sleep apnea and resistant hypertension: a case‐control study. Chest. 2007; 132:1858– 1862.
60Liu L, Cao Q, Guo Z, Dai Q. Continuous positive airway pressure in patients with obstructive sleep apnea and resistant hypertension: a meta‐analysis of randomized controlled trials. J Clin Hypertens (Greenwich). 2016; 18:153–158.
61Turnbull F; Collaboration BPLTT . Effects of different blood‐pressure‐lowering regimens on major cardiovascular events: results of prospectively‐designed overviews of randomised trials. Lancet. 2003; 362:1527–1535.
62Yamakawa H, Shiomi T, Sasanabe R, Hasegawa R, Ootake K, Banno K, Wakayama H, Katada M, Kobayashi T. Pulmonary hypertension in patients with severe obstructive sleep apnea. Psychiatry Clin Neurosci. 2002; 56:311–312.
63Jilwan FN, Escourrou P, Garcia G, Jaïs X, Humbert M, Roisman G. High occurrence of hypoxemic sleep respiratory disorders in precapillary pulmonary hypertension and mechanisms. Chest. 2013; 143:47–55.
64Kholdani C, Fares WH, Mohsenin V. Pulmonary hypertension in obstructive sleep apnea: is it clinically significant? A critical analysis of the association and pathophysiology. Pulm Circ. 2015; 5:220–227.
65Weitzenblum E. Chronic cor pulmonale. Heart. 2003; 89:225–230.
66Wong HS, Williams AJ, Mok Y. The relationship between pulmonary hypertension and obstructive sleep apnea. Curr Opin Pulm Med. 2017; 23:517–521.
67Sajkov D, McEvoy RD. Obstructive sleep apnea and pulmonary hypertension. Prog Cardiovasc Dis. 2009; 51:363–370.
68Minai OA, Ricaurte B, Kaw R, Hammel J, Mansour M, McCarthy K, Golish JA, Stoller JK. Frequency and impact of pulmonary hypertension in patients with obstructive sleep apnea syndrome. Am J Cardiol. 2009; 104:1300–1306.
69Sajkov D, Wang T, Saunders NA, Bune AJ, Mcevoy RD. Continuous positive airway pressure treatment improves pulmonary hemodynamics in patients with obstructive sleep apnea. Am J Respir Crit Care Med. 2002; 165:152–158.
70Arias MA, García‐Río F, Alonso‐Fernández A, Martínez I, Villamor J. Pulmonary hypertension in obstructive sleep apnoea: effects of continuous positive airway pressure: a randomized, controlled cross‐over study. Eur Heart J. 2006; 27:1106–1113.
71McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Linder JR, Mathier MA, McGoon MD, Park MH, Rosenson RS, Rubin LJ, Tapson VF, Varga J. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J Am Coll Cardiol. 2009; 53:1573–1619.
72Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, Simonneau G, Peacock A, Vonk Noordegraaf A, Beghetti M, Ghofrani A, Gomez Sanchez MA, Hansmann G, Klepetko W, Lancellotti P, Matucci M, McDonagh T, Pierard LA, Trindade PT, Zompatori M, Hoeper M. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2016; 69:177.
73Oldenburg O, Lamp B, Faber L, Teschler H, Horstkotte D, Töpfer V. Sleep‐disordered breathing in patients with symptomatic heart failure: a contemporary study of prevalence in and characteristics of 700 patients. Eur J Heart Fail. 2007; 9:251–257.
74Oldenburg O, Teerlink JR. Screening for sleep‐disordered breathing in patients hospitalized for heart failure. JACC Heart Fail. 2015; 3:732–733.
75Aurora RN, Patil SP, Punjabi NM. Portable sleep monitoring for diagnosing sleep apnea in hospitalized patients with heart failure. Chest. 2018; 154:91–98.
76Lanfranchi PA, Somers VK, Braghiroli A, Corra U, Eleuteri E, Giannuzzi P. Central sleep apnea in left ventricular dysfunction: prevalence and implications for arrhythmic risk. Circulation. 2003; 107:727–732. 77Oldenburg O, Wellmann B, Buchholz A, Bitter T, Fox H, Thiem U, Horstkotte D, Wegscheider K. Nocturnal hypoxaemia is associated with increased mortality in stable heart failure patients. Eur Heart J. 2016; 37:1695–1703.
78Khayat R, Jarjoura D, Porter K, Sow A, Wannemacher J, Dohar R, Pleister A, Abraham WT. Sleep disordered breathing and post‐discharge mortality in patients with acute heart failure. Eur Heart J. 2015; 36:1463–1469.
79Leung RS. Sleep‐disordered breathing: autonomic mechanisms and arrhythmias. Prog Cardiovasc Dis. 2009; 51:324–338.
80Bradley TD, Hall MJ, Ando S, Floras JS. Hemodynamic effects of simulated obstructive apneas in humans with and without heart failure. Chest. 2001; 119:1827–1835.
81Logan AG, Tkacova R, Perlikowski SM, Leung RS, Tisler A, Floras JS, Bradley TD. Refractory hypertension and sleep apnoea: effect of CPAP on blood pressure and baroreflex. Eur Respir J. 2003; 21:241–247.
82Gami AS, Olson EJ, Shen WK, Wright RS, Ballman KV, Hodge DO, Herges RM, Howard DE, Somers VK. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10,701 adults. J Am Coll Cardiol. 2013; 62:610– 616.
83Peker Y, Carlson J, Hedner J. Increased incidence of coronary artery disease in sleep apnoea: a long‐term follow‐up. Eur Respir J. 2006; 28:596–602.
84Usui K, Bradley TD, Spaak J, Ryan CM, Kubo T, Kaneko Y, Floras JS. Inhibition of awake sympathetic nerve activity of heart failure patients with obstructive sleep apnea by nocturnal continuous positive airway pressure. J Am Coll Cardiol. 2005; 45:2008–2011.
85Hall AB, Ziadi MC, Leech JA, Chen SY, Burwash IG, Renaud J, de Kemp RA, Haddad H, Mielniczuk LM, Yoshinaga K, Huo A, Chen L, Walter O, Garrard L, Da Silva JN, Floras JS, Beanlands RS. Effects of short‐term continuous positive airway pressure on myocardial sympathetic nerve function and energetics in patients with heart failure and obstructive sleep apnea: a randomized study. Circulation. 2014; 130:892–901.
86Javaheri S. Effects of continuous positive airway pressure on sleep apnea and ventricular irritability in patients with heart failure. Circulation. 2000; 101:392–397.
87Holmqvist F, Guan N, Zhu Z, Kowey PR, Allen LA, Fonarow GC, Hylek EM, Mahaffey KW, Freeman JV, Chang P, Holmes DN, Peterson ED, Piccini JP, Gersh BJ; ORBIT‐AF Investigators . Impact of obstructive sleep apnea and continuous positive airway pressure therapy on outcomes in patients with atrial fibrillation—results from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT‐AF). Am Heart J. 2015; 169:647–654.e642.
88Kanagala R, Murali NS, Friedman PA, Ammash NM, Gersh BJ, Ballman KV, Shamsuzzaman AS, Somers VK. Obstructive sleep apnea and the recurrence of atrial fibrillation. Circulation. 2003; 107:2589–2594.
89Kaneko Y, Floras JS, Usui K, Plante J, Tkacova R, Kubo T, Ando S, Bradley TD. Cardiovascular effects of continuous positive airway pressure in patients with heart failure and obstructive sleep apnea. N Engl J Med. 2003; 348:1233–1241.
90Arias MA, García‐Río F, Alonso‐Fernández A, Mediano O, Martínez I, Villamor J. Obstructive sleep apnea syndrome affects left ventricular diastolic function: effects of nasal continuous positive airway pressure in men. Circulation. 2005; 112:375–383.
91Bradley TD, Logan AG, Kimoff RJ, Sériès F, Morrison D, Ferguson K, Belenkie I, Pfiefer M, Fleetham J, Hanly P, Smilovitch M, Tomlinson G, Floras JS; CANPAP Investigators . Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med. 2005; 353:2025–2033.
92Sharma BK, Bakker JP, McSharry DG, Desai AS, Javaheri S, Malhotra A. Adaptive servoventilation for treatment of sleepdisordered breathing in heart failure: a systematic review and meta‐analysis. Chest. 2012; 142:1211–1221.
93Momomura S, Seino Y, Kihara Y, Adachi H, Yasumura Y, Yokoyama H, Wada H, Ise T, Tanaka K; SAVIOR‐C Investigators . Adaptive servo‐ventilation therapy for patients with chronic heart failure in a confirmatory, multicenter, randomized, controlled study. Circ J. 2015; 79:981–990.
94Cowie MR, Woehrle H, Wegscheider K, Angermann C, d’Ortho MP, Erdmann E, Levy P, Simonds AK, Somers VK, Zannad F, Teschler H. Adaptive servo‐ventilation for central sleep apnea in systolic heart failure. N Engl J Med. 2015; 373:1095– 1105.
95Javaheri S, Brown LK, Randerath W, Khayat R. SERVE‐HF: more questions than answers. Chest. 2016; 149:900–904.
96Lyons OD, Floras JS, Logan AG, Beanlands R, Cantolla JD, Fitzpatrick M, Fleetham J, John Kimoff R, Leung RS, Lorenzi Filho G, Mayer P, Mielniczuk L, Morrison DL, Ryan CM, Series F, Tomlinson GA, Woo A, Arzt M, Parthasarathy S, Redolfi S, Kasai T, Parati G, Delgado DH, Bradley TD; ADVENT‐HF Investigators . Design of the effect of adaptive servoventilation on survival and cardiovascular hospital admissions in patients with heart failure and sleep apnoea: the ADVENTHF trial. Eur J Heart Fail. 2017; 19:579–587.
97Go AS, Hylek EM, Phillips KA, Chang Y, Henault LE, Selby JV, Singer DE. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001; 285:2370–2375.
98Mehra R, Benjamin EJ, Shahar E, Gottlieb DJ, Nawabit R, Kirchner HL, Sahadevan J, Redline S. Association of nocturnal arrhythmias with sleep‐disordered breathing: the Sleep Heart Health Study. Am J Respir Crit Care Med. 2006; 173:910– 916.
99Albuquerque FN, Calvin AD, Sert Kuniyoshi FH, Konecny T, Lopez‐Jimenez F, Pressman GS, Kara T, Friedman P, Ammash N, Somers VK, Caples SM. Sleep‐disordered breathing and excessive daytime sleepiness in patients with atrial fibrillation. Chest. 2012; 141:967–973.
100Bitter T, Langer C, Vogt J, Lange M, Horstkotte D, Oldenburg O. Sleep‐disordered breathing in patients with atrial fibrillation and normal systolic left ventricular function. Dtsch Arztebl Int. 2009; 106:164–170.
101Gami AS, Pressman G, Caples SM, Kanagala R, Gard JJ, Davison DE, Malouf JF, Ammash NM, Friedman PA, Somers VK. Association of atrial fibrillation and obstructive sleep apnea. Circulation. 2004; 110:364–367.
102May AM, Van Wagoner DR, Mehra R. OSA and cardiac arrhythmogenesis: mechanistic insights. Chest. 2017; 151:225– 241.
103Ghias M, Scherlag BJ, Lu Z, Niu G, Moers A, Jackman WM, Lazzara R, Po SS. The role of ganglionated plexi in apnearelated atrial fibrillation. J Am Coll Cardiol. 2009; 54:2075–2083.
104Linz D, Mahfoud F, Schotten U, Ukena C, Neuberger HR, Wirth K, Böhm M. Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillation in a model for sleep apnea. Hypertension. 2012; 60:172–178.
105Linz D, Hohl M, Khoshkish S, Mahfoud F, Ukena C, Neuberger HR, Wirth K, Böhm M. Low‐level but not high‐level baroreceptor stimulation inhibits atrial fibrillation in a pig model of sleep apnea. J Cardiovasc Electrophysiol. 2016; 27:1086–1092.
106Orban M, Bruce CJ, Pressman GS, Leinveber P, Romero‐Corral A, Korinek J, Konecny T, Villarraga HR, Kara T, Caples SM, Somers VK. Dynamic changes of left ventricular performance and left atrial volume induced by the mueller maneuver in healthy young adults and implications for obstructive sleep apnea, atrial fibrillation, and heart failure. Am J Cardiol. 2008; 102:1557–1561.
107Camen G, Clarenbach CF, Stöwhas AC, Rossi VA, Sievi NA, Stradling JR, Kohler M. The effects of simulated obstructive apnea and hypopnea on arrhythmic potential in healthy subjects. Eur J Appl Physiol. 2013; 113:489–496.
108Drager LF, Bortolotto LA, Pedrosa RP, Krieger EM, Lorenzi‐Filho G. Left atrial diameter is independently associated with arterial stiffness in patients with obstructive sleep apnea: potential implications for atrial fibrillation. Int J Cardiol. 2010; 144:257–259.
109Dimitri H, Ng M, Brooks AG, Kuklik P, Stiles MK, Lau DH, Antic N, Thorton A, Saint DA, McEvoy D, Antic R, Kalman JM, Sanders P. Atrial remodeling in obstructive sleep apnea: implications for atrial fibrillation. Heart Rhythm. 2012; 9:321–327.
110Cioffi G, Russo TE, Stefenelli C, Selmi A, Furlanello F, Cramariuc D, Gerdts E, de Simone G. Severe obstructive sleep apnea elicits concentric left ventricular geometry. J Hypertens. 2010; 28:1074–1082.
111Stevenson IH, Roberts‐Thomson KC, Kistler PM, Edwards GA, Spence S, Sanders P, Kalman JM. Atrial electrophysiology is altered by acute hypercapnia but not hypoxemia: implications for promotion of atrial fibrillation in pulmonary disease and sleep apnea. Heart Rhythm. 2010; 7:1263–1270.
112Naruse Y, Tada H, Satoh M, Yanagihara M, Tsuneoka H, Hirata Y, Ito Y, Kuroki K, Machino T, Yamasaki H, Igarashi M, Sekiguchi Y, Sato A, Aonuma K. Concomitant obstructive sleep apnea increases the recurrence of atrial fibrillation following radiofrequency catheter ablation of atrial fibrillation: clinical impact of continuous positive airway pressure therapy. Heart Rhythm. 2013; 10:331–337.
113Li L, Wang ZW, Li J, Ge X, Guo LZ, Wang Y, Guo WH, Jiang CX, Ma CS. Efficacy of catheter ablation of atrial fibrillation in patients with obstructive sleep apnoea with and without continuous positive airway pressure treatment: a metaanalysis of observational studies. Europace. 2014; 16:1309–1314.
114Ng CY, Liu T, Shehata M, Stevens S, Chugh SS, Wang X. Meta‐analysis of obstructive sleep apnea as predictor of atrial fibrillation recurrence after catheter ablation. Am J Cardiol. 2011; 108:47–51.
115Fein AS, Shvilkin A, Shah D, Haffajee CI, Das S, Kumar K, Kramer DB, Zimetbaum PJ, Buxton AE, Josephson ME, Anter E. Treatment of obstructive sleep apnea reduces the risk of atrial fibrillation recurrence after catheter ablation. J Am Coll Cardiol. 2013; 62:300–305.
116Neilan TG, Farhad H, Dodson JA, Shah RV, Abbasi SA, Bakker JP, Michaud GF, van der Geest R, Blankstein R, Steigner M, John RM, Jerosch‐Herold M, Malhotra A, Kwong RY. Effect of sleep apnea and continuous positive airway pressure on cardiac structure and recurrence of atrial fibrillation. J Am Heart Assoc. 2013; 2:e000421.
117Patel D, Mohanty P, Di Biase L, Shaheen M, Lewis WR, Quan K, Cummings JE, Wang P, Al‐Ahmad A, Venkatraman P, Nashawati E, Lakkireddy D, Schweikert R, Horton R, Sanchez J, Gallinghouse J, Hao S, Beheiry S, Cardinal DS, Zagrodzky J, Canby R, Bailey S, Burkhardt JD, Natale A. Safety and efficacy of pulmonary vein antral isolation in patients with obstructive sleep apnea: the impact of continuous positive airway pressure. Circ Arrhythm Electrophysiol. 2010; 3:445–451.
118Calkins H, Hindricks G, Cappato R, Kim YH, Saad EB, Aguinaga L, Akar JG, Badhwar V, Brugada J, Camm J, Chen PS, Chen SA, Chung MK, Nielsen JC, Curtis AB, Davies DW, Day JD, d’Avila A, de Groot NMSN, Di Biase L, Duytschaever M, Edgerton JR, Ellenbogen KA, Ellinor PT, Ernst S, Fenelon G, Gerstenfeld EP, Haines DE, Haissaguerre M, Helm RH, Hylek
E, Jackman WM, Jalife J, Kalman JM, Kautzner J, Kottkamp H, Kuck KH, Kumagai K, Lee R, Lewalter T, Lindsay BD, Macle L, Mansour M, Marchlinksi FE, Michaud GF, Makagawa H, Natale A, Nattel S, Okumura K, Packer D, Pokushalov E, Reynolds MR, Sanders P, Scanavacca M, Schilling R, Tondo C, Tsao HM, Verma A, Wilber DJ, Yamane T. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: executive summary. J Arrhythm. 2017; 33:369–409.
119Simantirakis EN, Schiza SI, Marketou ME, Chrysostomakis SI, Chlouverakis GI, Klapsinos NC, Siafaksas NS, Vardas PE. Severe bradyarrhythmias in patients with sleep apnoea: the effect of continuous positive airway pressure treatment: a long‐term evaluation using an insertable loop recorder. Eur Heart J. 2004; 25:1070–1076.
120Patel N, Donahue C, Shenoy A, Patel A, El‐Sherif N. Obstructive sleep apnea and arrhythmia: a systemic review. Int J Cardiol. 2017; 228:967–970.
121Grimm W, Koehler U, Fus E, Hoffmann J, Menz V, Funck R, Peter JH, Maisch B. Outcome of patients with sleep apneaassociated severe bradyarrhythmias after continuous positive airway pressure therapy. Am J Cardiol. 2000; 86:688–692, A689.
122Ryan CM, Usui K, Floras JS, Bradley TD. Effect of continuous positive airway pressure on ventricular ectopy in heart failure patients with obstructive sleep apnoea. Thorax. 2005; 60:781–785.
123Gottlieb DJ, Yenokyan G, Newman AB, O’Connor GT, Punjabi NM, Quan SF, Redline S, Resnick HE, Tong EK, DienerWest M, Shahar E. Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure: the Sleep Heart Health Study. Circulation. 2010; 122:352–360.
124Redline S, Yenokyan G, Gottlieb DJ, Shahar E, O’Connor GT, Resnick HE, Diener‐West M, Sanders MH, Wolf PA, Geraghty EM, Ali T, Lebowitz M, Punjabi NM. Obstructive sleep apnea‐hypopnea and incident stroke: the Sleep Heart Health Study. Am J Respir Crit Care Med. 2010; 182:269–277.
125Patt BT, Jarjoura D, Haddad DN, Sen CK, Roy S, Flavahan NA, Khayat RN. Endothelial dysfunction in the microcirculation of patients with obstructive sleep apnea. Am J Respir Crit Care Med. 2010; 182:1540–1545.
126Phillips SA, Olson EB, Morgan BJ, Lombard JH. Chronic intermittent hypoxia impairs endothelium‐dependent dilation in rat cerebral and skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 2004; 286:H388–H393. 127Phillips CL, McEwen BJ, Morel‐Kopp MC, Yee BJ, Sullivan DR, Ward CM, Tofler GH, Grunstein RR. Effects of continuous positive airway pressure on coagulability in obstructive sleep apnoea: a randomised, placebo‐controlled crossover study. Thorax. 2012; 67:639–644.
128Ip MS, Lam B, Ng MM, Lam WK, Tsang KW, Lam KS. Obstructive sleep apnea is independently associated with insulin resistance. Am J Respir Crit Care Med. 2002; 165:670–676.
129Botros N, Concato J, Mohsenin V, Selim B, Doctor K, Yaggi HK. Obstructive sleep apnea as a risk factor for type 2 diabetes. Am J Med. 2009; 122:1122–1127.
130Schwarz EI, Puhan MA, Schlatzer C, Stradling JR, Kohler M. Effect of CPAP therapy on endothelial function in obstructive sleep apnoea: a systematic review and meta‐analysis. Respirology. 2015; 20:889–895.
131Iftikhar IH, Hoyos CM, Phillips CL, Magalang UJ. Meta‐analyses of the association of sleep apnea with insulin resistance, and the effects of CPAP on HOMA‐IR, adiponectin, and visceral adipose fat. J Clin Sleep Med. 2015; 11:475– 485.
132Milleron O, Pillière R, Foucher A, de Roquefeuil F, Aegerter P, Jondeau G, Raffstin BG, Dubourg O. Benefits of obstructive sleep apnoea treatment in coronary artery disease: a long‐term follow‐up study. Eur Heart J. 2004; 25:728–734.
133Martínez‐García MA, Soler‐Cataluña JJ, Ejarque‐Martínez L, Soriano Y, Román‐Sánchez P, Illa FB, Canal JM, DuránCantolla J. Continuous positive airway pressure treatment reduces mortality in patients with ischemic stroke and obstructive sleep apnea: a 5‐year follow‐up study. Am J Respir Crit Care Med. 2009; 180:36–41.
134Marti S, Sampol G, Muñoz X, Torres F, Roca A, Lloberes P, Sagalés T, Quesada P, Morell F. Mortality in severe sleep apnoea/hypopnoea syndrome patients: impact of treatment. Eur Respir J. 2002; 20:1511–1518.
135Hsu CY, Vennelle M, Li HY, Engleman HM, Dennis MS, Douglas NJ. Sleep‐disordered breathing after stroke: a randomised controlled trial of continuous positive airway pressure. J Neurol Neurosurg Psychiatry. 2006; 77:1143–1149.
136Peker Y, Glantz H, Eulenburg C, Wegscheider K, Herlitz J, Thunström E. Effect of positive airway pressure on cardiovascular outcomes in coronary artery disease patients with nonsleepy obstructive sleep apnea. The RICCADSA randomized controlled trial. Am J Respir Crit Care Med. 2016; 194:613–620.
137Barbé F, Durán‐Cantolla J, Sánchez‐de‐la‐Torre M, Martínez‐Alonso M, Carmona C, Barceló A, Chiner E, Masa JF, Gonzalez M, Marín JM, Garcia‐Rio F, Diaz de Atauri J, Terán J, Mayos M, de la Peña M, Monasterio C, del Camp F, Montserrat JM; Spanish Sleep and Breathing Network . Effect of continuous positive airway pressure on the incidence of hypertension and cardiovascular events in nonsleepy patients with obstructive sleep apnea: a randomized controlled trial. JAMA. 2012; 307:2161–2168.
138Yu J, Zhou Z, McEvoy RD, Anderson CS, Rodgers A, Perkovic V, Neal B. Association of positive airway pressure with cardiovascular events and death in adults with sleep apnea: a systematic review and meta‐analysis. JAMA. 2017; 318:156– 166.
139Kaw R, Michota F, Jaffer A, Ghamande S, Auckley D, Golish J. Unrecognized sleep apnea in the surgical patient: implications for the perioperative setting. Chest. 2006; 129:198–205.