Tóm tắt
Coronaviruses (CoVs) là một họ lớn gồm các virus RNA có vỏ bao, chuỗi đơn, có nguồn gốc động vật. Bốn CoV thường lưu hành ở người: HCoV2-229E, -HKU1, -NL63 và -OC43. Tuy nhiên, CoV có thể đột biến và tái tổ hợp dẫn đến các CoV mới có thể lây lan từ động vật sang người. CoVs mới gây hội chứng hô hấp cấp tính nặng coronavirus (SARS-CoV) xuất hiện năm 2002 và hội chứng hô hấp Trung Đông coro-navirus (MERS-CoV) năm 2012. Coronavirus 2019 mới (SARS-CoV-2) hiện đang gây ra một đợt bùng phát nghiêm trọng bệnh (gọi là COVID-19) ở Trung Quốc và nhiều quốc gia khác, đe dọa gây ra đại dịch toàn cầu. Ở người, CoV chủ yếu gây ra các triệu chứng về đường hô hấp và đường tiêu hóa. Biểu hiện lâm sàng bao gồm từ cảm lạnh thông thường đến bệnh nặng hơn như viêm phế quản, viêm phổi, hội chứng suy hô hấp cấp tính nặng, suy đa tạng và thậm chí tử vong. SARS-CoV, MERS-CoV và SARS-CoV-2 dường như ít ảnh hưởng đến trẻ em và gây ra ít triệu chứng và bệnh ít nghiêm trọng hơn ở nhóm tuổi này so với người lớn và có liên quan đến tỷ lệ tử vong thấp hơn nhiều. Bằng chứng sơ bộ cho thấy trẻ em cũng giống như người lớn bị nhiễm SARS-CoV-2 nhưng ít có khả năng bị triệu chứng hoặc phát triển các triệu chứng nghiêm trọng. Tuy nhiên, tầm quan trọng của trẻ em trong việc truyền virut vẫn chưa chắc chắn. Trẻ em thường có các triệu chứng tiêu hóa so với người lớn. Hầu hết trẻ em bị SARS-CoV đều bị sốt, nhưng đây không phải là trường hợp của các CoV mới khác. Nhiều trẻ em bị ảnh hưởng bởi MERS-CoV không có triệu chứng. Phần lớn trẻ em bị nhiễm CoV mới được ghi nhận có liên hệ gia đình, thường biểu hiện các triệu chứng trước chúng. Ngược lại, người lớn thường tiếp xúc với nguồn lây nhiễm bệnh viện. Trong tổng quan này, chúng tôi tóm tắt các kết quả dịch tễ học, lâm sàng và chẩn đoán, cũng như các lựa chọn điều trị và phòng ngừa đối với các bệnh nhiễm trùng CoVs lưu hành và mới ở người tập trung vào nhiễm trùng ở trẻ em.
Các coronavirus (CoV) bao gồm một họ lớn các virut ARN có vỏ bao, chuỗi đơn, thuộc họ coronaviridae, loại Nidovirales (Hình 1).1 Chúng có thể lây nhiễm nhiều loại động vật (bao gồm cả gia súc, động vật và chim), Trong đó chúng có thể gây ra các bệnh nghiêm trọng về hô hấp, đường ruột, tim mạch và thần kinh.2,3 Ở người, CoV chủ yếu gây ra các triệu chứng hô hấp và đường tiêu hóa từ cảm lạnh thông thường đến bệnh nặng hơn như viêm phế quản, viêm phổi, hội chứng suy hô hấp cấp tính nặng (ARDS), rối loạn đông máu, suy đa tạng và tử vong.4-8 Coronavirus ở người (HCoVs) cũng có liên quan đến các đợt cấp của bệnh phổi tắc nghẽn mạn tính,9 xơ nang10 và hen suyễn.11,12
CoV được phân loại thành Alphacoronaviruses và Beta-coronaviruses (chủ yếu được tìm thấy ở động vật có vú như dơi, động vật gặm nhấm, cầy hương và người) và Gammacoronaviruses và Delta-coronaviruses (chủ yếu được tìm thấy ở chim).8,13,14 Bốn loại CoV thường lưu hành ở người: HCoV2-229E, -HKU1, -NL63 và -OC43.15,16 Những virus này được cho là có nguồn gốc từ dơi (NL63, 229E),17,18 con lạc đà (229E)19 và gia súc (OC43).20 Nguồn gốc của HCoV-HKU1 vẫn chưa được biết. Một số CoV được biết là lưu hành ở động vật (với dơi đóng vai trò là ổ chứa chính) nhưng không liên quan đến nhiễm trùng ở người.3,21,22 CoV có khả năng đột biến và tái tổ hợp nhanh chóng dẫn đến CoV mới có thể lây lan từ động vật sang người. Điều này xảy ra ở Trung Quốc vào năm 2002 khi CoV mới gây hội chứng hô hấp cấp tính nặng coronavirus (SARS-CoV) xuất hiện, được cho là đã được truyền từ mèo cầy hoặc dơi sang người. 22-25 Một loại CoV mới khác xuất hiện ở Ả Rập Saudi vào năm 2012, Hội chứng hô hấp Trung Đông coronavirus (MERS-CoV), được truyền từ lạc đà đến người.26,27 CoV mới 2019 (SARS-CoV2), có nguồn gốc từ Trung Quốc và hiện đang gây ra dịch bệnh trên toàn cầu, là một virus mới Betacoronavirus thuộc dòng dõi B hoặc subarus sarbecovirus, bao gồm SARS-CoV.28 Trình tự cho thấy bộ gen có liên quan chặt chẽ nhất (87-89% nucleotide nhận dạng) với CoV liên quan đến SARS được tìm thấy trong dơi móng ngựa Trung Quốc (bat-SL-CoVZC45).28,29 Sự bùng phát của
SARS-CoV-2 bắt đầu tại thành phố Vũ Hán, tỉnh Hồ Bắc, Trung Quốc, nơi Ủy ban Y tế tỉnh Hồ Bắc lần đầu tiên công bố một nhóm người lớn bị viêm phổi do nguyên nhân không rõ nguyên nhân vào ngày 31 tháng 12 năm 2019. Một chợ hải sản và động vật địa phương đã được xác định là một nguồn tiềm năng. Tuy nhiên, nguyên nhân chính của sự bùng phát là những người có triệu chứng và không có triệu chứng bị nhiễm SARS-CoV-2 mà virus có thể lây sang người khác qua các giọt bắn hô hấp hoặc tiếp xúc trực tiếp.28 Từ thành phố Vũ Hán SARS-CoV-2 đã lan sang các thành phố khác của Trung Quốc và quốc tế, đe dọa gây ra đại dịch toàn cầu. Thuật ngữ COVID-19 được sử dụng cho bệnh lâm sàng do SARS-CoV-2.30
Trong tổng quan này, chúng tôi tóm tắt các kết quả dịch tễ học, lâm sàng và chẩn đoán, cũng như các lựa chọn điều trị và phòng ngừa đối với các bệnh nhiễm trùng CoVs lưu hành và mới ở người tập trung vào nhiễm trùng ở trẻ em.
Dịch tễ học
Hcov lưu hành phổ biến
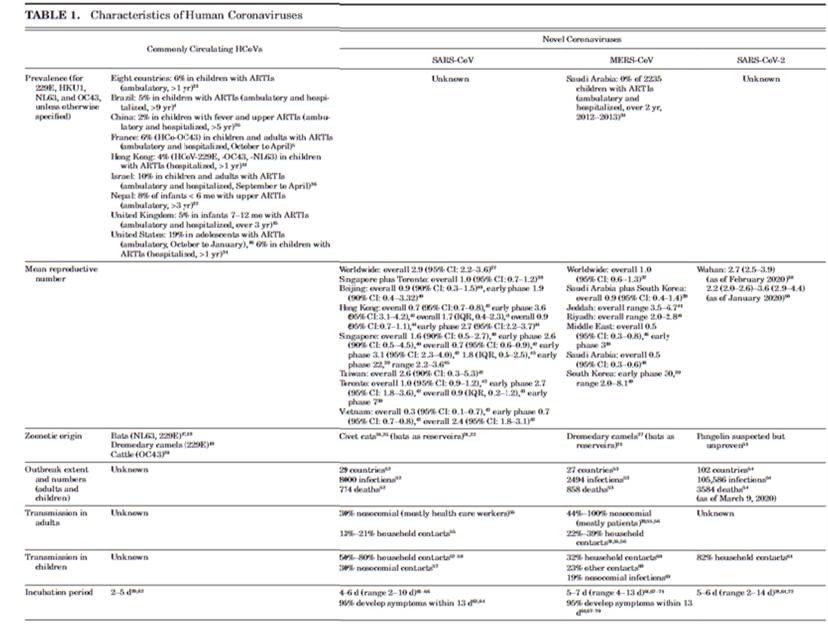
Các HCoV lưu hành thông thường có thể được phân lập từ 4% đến 6% trẻ nhập viện vì nhiễm trùng đường hô hấp cấp11,15,31 và từ 8% trẻ em trong môi trường ngoại trú (Bảng 1).15,32,33
Trẻ em dưới 3 tuổi và trẻ em mắc bệnh tim thường xuyên bị ảnh hưởng nhất.4,15,35,36 Tái nhiễm sau này trong đời là phổ biến 32,115,116 mặc dù thực tế là hầu hết các cá nhân chuyển đổi huyết thanh thành HCoV trong thời thơ ấu.117-120 Ngược lại đối với các virut đường hô hấp khác [ví dụ, virut hợp bào hô hấp (RSV)], không có sự giảm tỷ lệ nhiễm HCoV tương đối khi tăng tuổi.4,5,15,36
Trong 11-46% các trường hợp, các HCoV lưu hành phổ biến được tìm thấy là đồng nhiễm với các virus đường hô hấp khác như adeno-, boca-, rhino-, RSV, cúm hoặc parainfluenza. 5,15,16,31-33,36,79,81,121,122 Trẻ em có triệu chứng chỉ có virus hô hấp có thể phát hiện được là HCoV được báo cáo là có khả năng mắc một bệnh mạn tính tiềm ẩn so với trẻ em bị nhiễm virut hô hấp khác.31
Trong số 4 HCoV lưu hành phổ biến, NL63 và OC43 là những loài bị phân lập thường xuyên nhất.4,11,15,35,36 Các mô hình chu kỳ đã được quan sát thấy ở 229E và OC43, với các vụ dịch xảy ra cứ sau 2-4 năm.4,15,32,35,82,116,119 Mô hình theo mùa cũng đã được quan sát: ở Bắc bán cầu, các HCoV lưu hành phổ biến chủ yếu gây nhiễm trùng ở người trong khoảng thời gian từ tháng 12 đến tháng 5 và ở Nam bán cầu giữa tháng 3 và tháng 11 với đỉnh điểm vào cuối mùa đông/đầu mùa xuân cho 229E và OC43 và vào mùa thu cho NL63.4,5,11,15,32,123 HCoV-HKU1 đã được báo cáo chủ yếu xảy ra vào mùa xuân và mùa hè ở Hồng Kông,11,124 nhưng vào mùa đông và mùa xuân ở Vương quốc Anh và Brazil.4,15
Sars-cov và mers-cov
SARS-CoV là một nhóm mới 2b Betacoronavirus xuất hiện ở tỉnh Quảng Đông, miền nam Trung Quốc vào năm 2002,23 sau đó lan sang Hồng Kông và từ đó nhanh chóng đến nhiều quốc gia khác.125 Nó gây nhiễm trùng đường hô hấp dưới nghiêm trọng với tỷ lệ mắc bệnh nghiêm trọng và tỷ lệ tử vong cao (gần 50% ở những người trên 60 tuổi, tổng thể là 10%). Lây truyền từ người sang người của SARS-CoV đã được thiết lập. Vi-rút này đã lan rộng ra 29 quốc gia và ước tính đã gây ra hơn 8000 ca nhiễm trùng và 774 ca tử vong trên toàn thế giới (Bảng 1).52
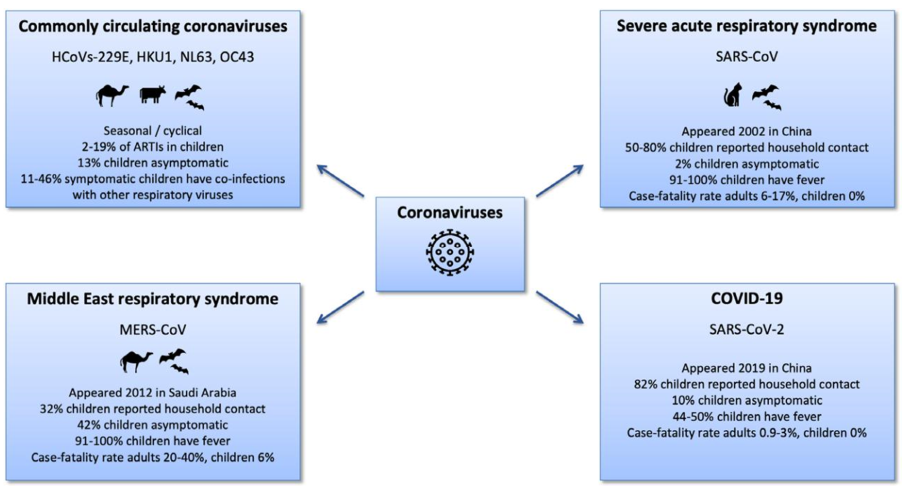
HÌNH 1. Tóm tắt các bệnh coronavirus. COVID-19 là bệnh coronavirus 2019.
MERS-CoV là một nhóm mới 2c Betacoronavirus xuất hiện lần đầu tiên ở Ả Rập Saudi vào năm 2012.26,27,127 Nó có thể lây từ người sang người128 và có thể gây nhiễm trùng đường hô hấp dưới nghiêm trọng với tỷ lệ tử vong từ 20% đến 40%.67,106,108-112 Ngoài việc là đặc hữu ở Trung Đông, đã có một đợt bùng phát bệnh MERS-CoV tại Hàn Quốc vào năm 2014, liên quan đến 16 bệnh viện và 186 bệnh nhân, do một bác sĩ y khoa trở về từ Trung Đông.49,68 MERSCoV lây lan sang 27 quốc gia gây ra ước tính 2494 ca nhiễm và 858 ca tử vong (Bảng 1).53
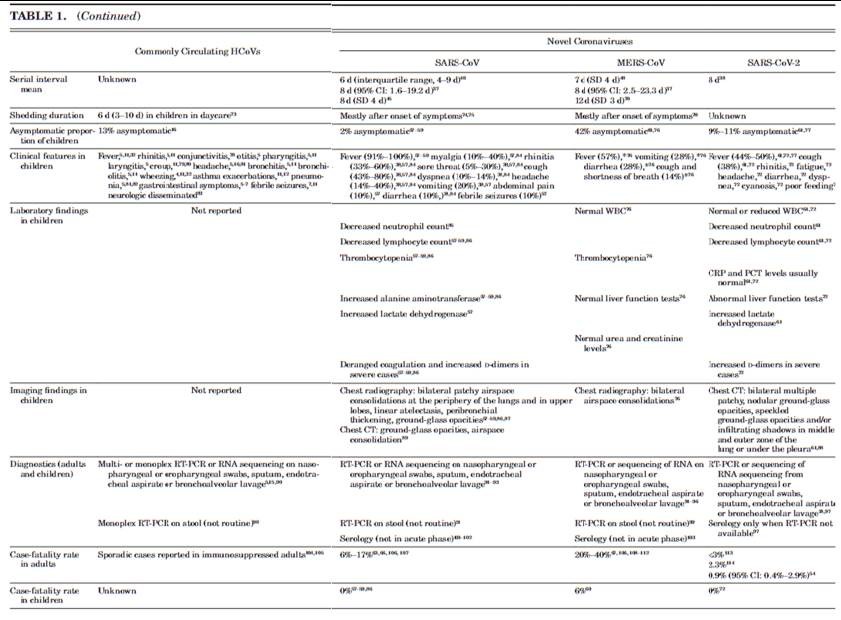
Số sinh tổng thể (R0) (overall reproductive number) cho SARS-CoV được ước tính là 0,32,937,39,40,42,43,47 và đối với MERS-CoV là 0,5-3,5 (Bảng 1).39,46,48 R0 phụ thuộc vào vị trí địa lý, giai đoạn bùng phát và chỉ bao gồm lây truyền trong bệnh viện so với lây truyền chung. Cả hai loại virut này đều có liên quan đến các sự kiện siêu lây lan sớm với R0 lên đến 22 đối với SARS- CoV39,40,43 và lên đến 30 đối với MERS-CoV.39,49 Những số lượng lớn các trường hợp nhiễm trùng thứ hai này chủ yếu liên quan đến đợt bùng phát trong bệnh viện: 30% trong số tất cả các trường hợp SARS-CoV (chủ yếu là nhân viên y tế) và 44100% của tất cả các trường hợp MERS-CoV (chủ yếu là bệnh nhân) xảy ra do lây truyền trong bệnh viện.39,55,56 Những sự kiện siêu lây lan này là tiếp theo là giảm sự lây lan ở các thế hệ vi rút sau với mức giảm R0 xuống còn 0,8 đối với SARSCoV39 và 0,7 đối với MERS-CoV (Bảng 1).128 Do đó, cả SARS-CoV và MERS-CoV đều có tiềm năng thấp trong thời gian dài lây truyền cộng đồng bền vững. Không phát hiện nhiễm SARS-CoV ở người kể từ tháng 7 năm 2003. Tuy nhiên, virus tương tự SARS-CoV có thể được tìm thấy ở dơi, được biết là có thể lây nhiễm tế bào người mà không cần thích nghi, khiến SARS-CoV có thể tái phát lại84 (như hiện đã xảy ra với SARS-CoV-2).
Việc truyền MERS-CoV từ động vật sang người đã được tiếp tục, do vai trò của lạc đà một bướu như một nguồn dự trữ và sự tiếp xúc gần gũi của chúng với con người (trái ngược với tương tác giữa người và dơi).21
Sars-cov-2
Trong đợt bùng phát SARS-CoV-2, người ta đã chứng minh rằng lây truyền từ người sang người là nguyên nhân chính.28 R0 cho SARS-CoV2 hiện được ước tính là 2,7.38 Thời gian ủ bệnh được ước tính là 5-6 ngày, tương tự như đối với SARS-CoV và MERS-CoV.38,63-65,67-72 Khoảng thời gian nối tiếp được ước tính là 8 ngày, cũng tương tự như các CoV mới khác (Bảng 1).38,45,48,70 Đến tháng 3 năm 2020, Tổ chức Y tế Thế giới báo cáo rằng SARS-CoV-2 đã lan rộng đến hơn 100 quốc gia và gây ra hơn 100.000 ca nhiễm trùng và hơn 3500 ca tử vong.54 Vào thời điểm đó, tỷ lệ tử vong không chắc chắn nhưng ước tính 0,9-3%, 54,113,114 thấp hơn nhiều so với SARS-CoV và MERS-CoV (lần lượt là 6-17% và 20-40%).63,67,106-112
Triệu chứng
Hcov thông thường
Ở trẻ em, các HCoV lưu hành phổ biến có thể gây ra các triệu chứng cảm lạnh thông thường như sốt,5,11,32 viêm mũi,5,11 viêm tai giữa,5 viêm họng,5,11 viêm thanh quản5 và đau đầu, 5,16,81 nhưng cũng có thể bị viêm phế quản,5,11 viêm tiểu phế quản,5,11 khò khè,4,11,32 viêm phổi, 5,81,82 và trong tối đa 57% các trường hợp, các triệu chứng tiêu hóa (thường gặp ở trẻ em hơn người lớn).5-7 Trong một nghiên cứu bao gồm trẻ em và người lớn, mệt mỏi, đau đầu, đau cơ và đau họng là phổ biến hơn ở những bệnh nhân nhiễm HCoV so với bệnh nhân nhiễm RSV, trong khi sốt, ho và khó thở thường gặp hơn ở những người sau đó. những người bị nhiễm RSV hoặc cúm.36
Ở trẻ em, HCoV-NL63 có liên quan đến viêm kết mạc,78 viêm thanh khí phế quản cấp,11,79,80 hen suyễn,11,12 cơn co giật do sốt11 và HCoV-HKU1 với co giật do sốt.7 Trường hợp hiếm với bệnh lý thần kinh đã được mô tả (phát hiện HCoV trong dịch não tủy ở trẻ có biểu hiện viêm não lan tỏa cấp tính83 hoặc trong dịch não tủy của người lớn mắc bệnh đa xơ cứng.)129,130 Một mối nghi ngờ giữa HCoVs và bệnh Kawasaki không thể được xác định.131,132 HcoV thông thường có thể được phân lập từ người không triệu chứng.16 Trong thời gian bị nhiễm, tải lượng virus cao trong 2 ngày đầu và giảm sau đó. 29 Mối tương quan giữa tải lượng virus và mức độ nghiêm trọng của bệnh không được quan sát.29 Điều này trái ngược với SARS-CoV có tải lượng virus ban đầu cao hơn với tiên lượng xấu hơn, bao gồm tỷ lệ tử vong trường hợp cao hơn.133,134 Các phần tử virus có thể được phân lập từ dịch tiết mũi họng đến 14 ngày sau khi khởi phát nhiễm trùng.135
Sars-cov
Có 3 loạt trường hợp báo cáo tổng cộng 41 trẻ em bị ảnh hưởng bởi SARS-CoV.57-59 Vi-rút có liên quan đến bệnh nhẹ ở trẻ em so với người lớn và không có trường hợp tử vong nào được báo cáo ở trẻ em.57-59,86 Trẻ có triệu chứng nhiễm SARS-CoV được báo cáo là bị sốt (91-100%),57-59 đau cơ (10-40%),57,58 viêm mũi (33-60%),57-59 viêm họng (5- 30%),57-59 ho (43-80%),57-59 khó thở (10-14%),38-84 đau đầu (14-40%)57-59 và, ít gặp hơn, nôn (20%),57,59 đau bụng (10%),57 tiêu chảy (10%)58,59 và co giật do sốt (10%).57 Tổng cộng, 50-80% trẻ em có các thành viên khác trong gia đình bị nhiễm57-59 và 30% có tiếp xúc bệnh viện với SARS-CoV.57 Hầu hết trẻ em phục hồi nhanh chóng sau khi bị nhiễm SARS-CoV.86 Tuy nhiên, những bất thường trên CT ngực có thể tồn tại trong vài tháng (ví dụ, bẫy khí và hình mờ).136
Không có bằng chứng nào cho thấy SARSCoV có thể lây truyền theo chiều dọc sang thai nhi.137 Tuy nhiên, nhiễm SARS-CoV khi mang thai có liên quan đến sẩy thai, chậm phát triển trong tử cung và sinh non.137,138
Mers-cov
Hầu hết các trường hợp bệnh nhân nhiễm MERS-CoV báo cáo tỷ lệ thấp (0,1-4%) trẻ em.34,76,109,110,139,140 Trong một loạt trường hợp lớn 2235 trẻ bị nhiễm trùng đường hô hấp cấp tính được đưa đến bệnh viện đại học ở Ả Rập Saudi trong thời gian dịch MERS-CoV (20122013), không có xét nghiệm dương tính với MERS-CoV (Bảng 1).34 Có 2 loạt trường hợp nhỏ trẻ bị nhiễm MERS-CoV: một trong số đó có 31 trẻ em ở độ tuổi trung bình 10 tuổi60 và 1 loạt trường hợp khác chỉ có 7 trẻ.76 Ở cả hai nghiên cứu, 42% trẻ em không có triệu chứng.60,76 Trong loạt trường hợp 7 đứa trẻ, 57% bị sốt, 28% có nôn và tiêu chảy và 14% có ho và khó thở.76 Hai trẻ cần thở oxy và một thở máy.76 Trong loạt trường hợp khác, 2 trẻ tử vong (6%).60 Nguồn lây nhiễm MERS-CoV chính ở trẻ em là hộ gia đình (32%) và các tiếp xúc khác (23 %), tiếp theo là lây truyền bệnh viện (19%).60
Tám trường hợp nhiễm trùng mẹ MERSCoV trong thời kỳ tiền sản đã được báo cáo (xảy ra trong khoảng từ 20 đến 28 tuần của thai kỳ), ba trong số các trẻ sơ sinh bị ảnh hưởng đã chết.141-144
Sars-cov-2
Các định nghĩa trường hợp khác nhau cho các trường hợp COVID-19 ở người lớn và trẻ em từ các nguồn có thẩm quyền tính đến tháng 3 năm 2020 được trình bày chi tiết trong Bảng 2. Trẻ em ít bị ảnh hưởng bởi SARS-CoV-2, Trung tâm kiểm soát và phòng ngừa dịch bệnh Trung Quốc báo cáo về 72.314 Các trường hợp được báo cáo vào ngày 11 tháng 2 năm 2020, chỉ có 2% ở những người dưới 19 tuổi.114 Có 3 loạt các trường hợp trẻ bị nhiễm SARS-CoV-2,61,72,77 Đầu tiên bao gồm 20 trẻ cho đến ngày 31 tháng 1 năm 2020, tại tỉnh Chiết Giang,72 loạt các trường hợp trẻ em thứ hai trong khoảng thời gian từ ngày 19 tháng 1 năm 2020 đến ngày 7 tháng 2 năm 2020 tại tỉnh Thâm Quyến,61 và loạt 9 trẻ em thứ ba từ các tỉnh khác nhau ở Trung Quốc.77 Chuỗi trường hợp với 34 trẻ em cung cấp các chi tiết lâm sàng nhất: không có trẻ nào mắc bệnh tiềm ẩn, 65% có các triệu chứng hô hấp thông thường, 26% bị bệnh nhẹ và 9% không có triệu chứng.61 Các triệu chứng phổ biến nhất là sốt (50%) và ho (38%).61 Trong loạt trường hợp 20 trẻ em, xuất hiện với sốt nhẹ đến trung bình hoặc không sốt, viêm mũi, ho, mệt mỏi, nhức đầu, tiêu chảy và trong trường hợp nặng hơn, khó thở, tím tái và cho ăn kém, nhưng số lượng không được chỉ định.72 Trong loạt 9 trẻ nhũ nhi, chỉ có 4 người được báo cáo là bị sốt. Một trẻ sơ sinh không có triệu chứng.77 Trẻ em không có triệu chứng khác bị nhiễm SARS-CoV-2 bên ngoài các trường hợp này cũng đã được mô tả (ví dụ, một đứa trẻ 10 tuổi không có triệu chứng nhưng có hình mờ trên CT ngực).28 Hầu hết trẻ bị nhiễm đều hồi phục 1 – 2 tuần sau khi xuất hiện triệu chứng và không có trường hợp tử vong do SARS-CoV-2 đã được báo cáo vào tháng 2 năm 2020.72
Từ loạt bài này, có vẻ như trẻ em có các triệu chứng lâm sàng nhẹ hơn so với người lớn61,72 (như đã được báo cáo về nhiễm SARSCoV và MERS-CoV),57-60,76,86 có nghĩa là trẻ em có thể không được xét nghiệm SARS- CoV-2 thường xuyên như người lớn. Do đó, người ta cho rằng trẻ em không có triệu chứng hoặc có triệu chứng nhẹ có thể truyền bệnh.147 Tuy nhiên, phần lớn trẻ em bị nhiễm SARS-CoV-2 cho đến nay là một phần của đợt bùng phát gia đình [100% trong loạt trẻ nhũ nhi, trong đó thành viên khác trong gia đình có triệu chứng trước trẻ nhũ nhi trong mọi trường hợp; 82% trong loạt trường hợp gồm 34 trẻ em,61 và phần lớn trong nhóm có 20 trẻ em (số chính xác không được nêu rõ).72 Điều này tương tự với SARS-CoV, trong đó 50-80% 57-59 trẻ em được báo cáo có một liên hệ gia đình60 và MERS-CoV với 32%.60
Một nghiên cứu được công bố vào đầu tháng 3 năm 2020 cho thấy trẻ em cũng giống như người lớn bị nhiễm SARS-CoV-2 nhưng ít có triệu chứng hoặc phát triển các triệu chứng ít nghiêm trọng.246 Tuy nhiên, tầm quan trọng của trẻ em trong việc truyền virut vẫn chưa chắc chắn.
Từ một loạt trường hợp nhỏ gồm 9 bà mẹ bị nhiễm SARS-CoV-2, cho đến nay, không có bằng chứng nào cho thấy SARS-CoV-2 có thể truyền theo chiều dọc cho trẻ sơ sinh.148
Kết quả xét nghiệm
Kết quả xét nghiệm ở trẻ em tương tự như nhiễm trùng do các CoV mới khác (Bảng 1). Số lượng bạch cầu thường bình thường hoặc giảm khi giảm bạch cầu trung tính85 và/hoặc lympho.57-59,72,86 Giảm tiểu cầu có thể xảy ra.5759,76,86 CRP và procalcitonin thường là bình thường.72 Trường hợp nặng, men gan tăng cao, 57-59,72,86 nồng độ lactate dehydrogenase,57 cũng như đông máu bất thường và tăng D-dimers đã được báo cáo.57-59,72,86
|
Người lớn: Định nghĩa trường hợp ban đầu từ CDC38 Trung Quốc Một trường hợp nghi ngờ hoặc có thể xảy ra được xác định là một trường hợp đáp ứng: (1) ba tiêu chuẩn lâm sàng hoặc (2) hai tiêu chuẩn lâm sàng và một tiêu chuẩn dịch tễ học Tiêu chuẩn lâm sàng: Sốt Bằng chứng X quang viêm phổi hoặc hội chứng suy hô hấp cấp tính Số lượng bạch cầu thấp hoặc bình thường hoặc số lượng tế bào lympho thấp Tiêu chuẩn dịch tễ học: Sống ở Vũ Hán hoặc lịch sử du lịch đến Vũ Hán trong vòng 14 ngày trước khi xuất hiện triệu chứng Tiếp xúc với bệnh nhân bị sốt và các triệu chứng nhiễm trùng đường hô hấp trong vòng 14 ngày trước khi xuất hiện triệu chứng Liên kết với bất kỳ trường hợp được xác nhận hoặc cụm trường hợp nghi ngờ |
|
Người lớn: Định nghĩa trường hợp từ CDC Hoa Kỳ (ngày 13 tháng 2 năm 2020)145 Sốt hoặc dấu hiệu/triệu chứng của bệnh hô hấp dưới (ví dụ, ho hoặc khó thở) VÀ tiếp xúc gần gũi với bệnh nhân SARS-CoV-2 được xác nhận trong phòng xét nghiệm trong vòng 14 ngày kể từ khi khởi phát triệu chứng Sốt và các dấu hiệu/triệu chứng của bệnh hô hấp dưới (ví dụ: ho hoặc khó thở) VÀ tiền sử du lịch từ tỉnh Hồ Bắc, Trung Quốc trong vòng 14 ngày kể từ khi xuất hiện triệu chứng Sốt hoặc các dấu hiệu/triệu chứng của bệnh hô hấp dưới (ví dụ ho hoặc khó thở) cần nhập viện VÀ tiền sử từ Trung Quốc đại lục trong vòng 14 ngày kể từ khi xuất hiện triệu chứng |
|
Người lớn: Định nghĩa trường hợp từ Tổ chức Y tế Thế giới (WHO) (27 tháng 2 năm 2020), cũng là cơ sở cho định nghĩa của Trung tâm phòng chống và kiểm soát dịch bệnh châu Âu (ECDC)146 Trường hợp nghi ngờ Bệnh nhân bị nhiễm trùng đường hô hấp cấp tính [sốt và ít nhất một dấu hiệu/triệu chứng của bệnh hô hấp (ví dụ: ho, khó thở)] VÀ không có nguyên nhân nào khác giải thích đầy đủ về biểu hiện lâm sàng VÀ tiền sử đi lại hoặc cư trú tại quốc gia/khu vực hoặc lãnh thổ báo cáo lây truyền COVID-19 tại địa phương trong 14 ngày trước khi khởi phát triệu chứng; HOẶC LÀ Một bệnh nhân mắc bất kỳ bệnh hô hấp cấp tính VÀ đã tiếp xúc với trường hợp COVID-19 được xác nhận hoặc có thể xảy ra trong 14 ngày qua trước khi xuất hiện các triệu chứng; HOẶC LÀ Một bệnh nhân bị nhiễm trùng đường hô hấp cấp tính nặng (như trên) VÀ phải nhập viện VÀ không có nguyên nhân nào khác giải thích đầy đủ về biểu hiện lâm sàng. |
|
Trẻ em: Định nghĩa trường hợp của Trung tâm nghiên cứu lâm sàng quốc gia về sức khỏe trẻ em, Đại học Y khoa Chiết Giang (điều chỉnh từ Chen et al72) Một trường hợp nghi ngờ hoặc có thể xảy ra được xác định là một trường hợp đáp ứng: hai tiêu chuẩn lâm sàng và một tiêu chuẩn dịch tễ học Tiêu chuẩn lâm sàng: Sốt, mệt mỏi, ho khan; một số bệnh nhi có thể không bị sốt Bệnh nhân có kết quả chẩn đoán hình ảnh ngực sau: nhiều hình ảnh lốm đốm nhỏ và thay đổi mô kẽ, chủ yếu ở ngoại vi phổi, hình mờ hai bên, hình ảnh thâm nhiễm, đông đặc phổi trên X quang phổi hoặc hình mờ mặt kính, đông đặc phổi hai bên, đặc biệt là ở ngoại vi trên CT ngực Số lượng bạch cầu là bình thường hoặc giảm, hoặc với số lượng tế bào lympho giảm Tiêu chuẩn dịch tễ học: Trẻ em có tiền sử đi lại hoặc cư trú tại Thành phố Vũ Hán và các khu vực lân cận hoặc các khu vực khác có lây truyền tại địa phương trong vòng 14 ngày trước khi phát bệnh Trẻ em có tiền sử tiếp xúc với bệnh nhân bị sốt hoặc có triệu chứng hô hấp có tiền sử đi lại hoặc cư trú tại thành phố Vũ Hán và các khu vực lân cận, hoặc ở các khu vực khác có lây truyền tại chỗ liên tục trong vòng 14 ngày trước khi khởi phát bệnh Trẻ em có tiền sử tiếp xúc với các trường hợp nghi ngờ đã được xác nhận hoặc nghi ngờ nhiễm SARS-CoV-2 trong vòng 14 ngày trước khi khởi phát bệnh Trẻ em có liên quan đến dịch cụm: ngoài bệnh nhân này, còn có những bệnh nhân khác bị sốt hoặc có triệu chứng hô hấp, bao gồm các trường hợp nghi ngờ hoặc được xác nhận nhiễm SARS-CoV-2 Trẻ sơ sinh được sinh ra bởi các bà mẹ nghi ngờ hoặc được xác nhận nhiễm SARS-CoV-2 Một trường hợp được xác nhận được xác định là một trường hợp đáp ứng bất kỳ tiêu chuẩn nào sau đây: Mẫu bệnh phẩm họng, đờm, phân hoặc mẫu máu xét nghiệm dương tính với axit nucleic SARS-CoV-2 sử dụng RT-PCR Trình tự di truyền của bệnh phẩm họng, đờm, phân hoặc mẫu máu rất tương đồng với SARS-CoV-2 đã biết Các phần tử SARS-CoV-2 được phân lập bằng nuôi cấy từ phết tăm bông, đờm, phân hoặc mẫu máu |
Sars-cov-2
Những phát hiện trong phòng xét nghiệm tương tự đã được quan sát ở những trẻ bị nhiễm SARS-CoV-2.61 Trong loạt trường hợp 34 trẻ, số lượng bạch cầu là bình thường ở 83%, giảm bạch cầu và giảm bạch cầu được tìm thấy trong 1 trường hợp (3%). Nồng độ lactate dehydrogenase tăng trong 30% trường hợp.61 Mức CRP và procalcitonin chỉ tăng trong 1 trường hợp (3%).
Dấu hiệu x-quang
Tương tự như các phát hiện trong phòng xét nghiệm, các phát hiện X quang từ trẻ em cũng tương tự trên các bệnh nhiễm trùng với các CoV mới khác (Bảng 1). Trên X quang lồng ngực, trẻ em chủ yếu cho thấy sự kết hợp đông đặc khoảng khí lốm đốm hai bên thường ở ngoại vi phổi, khoảng quanh phế quản dày lên và hình mờ mặt kính.57-59,76,86,87 CT ngực chủ yếu cho thấy sự kết hợp đông đặc khoảng khí và hình mờ mặt kính.89
Sars-cov-2
Những thay đổi CT quan sát thấy ở trẻ em bị nhiễm SARS-CoV-2 bao gồm nhiều hình tổn thương lốm đốm hai bên, hình mờ thủy tinh dạng nốt, hình mờ mặt kính và/hoặc bóng thâm nhiễm ở khu vực giữa và ngoài phổi hoặc dưới màng phổi61,88 Những phát hiện này là không đặc hiệu và nhẹ hơn so với những người ở người lớn.88
Chẩn đoán
Cơ sở chính để chẩn đoán nhiễm HCoV là phản ứng chuỗi polymerase thời gian thực (RTPCR) trên dịch tiết đường hô hấp trên hoặc dưới.5,15,90-96 Đối với SARS-CoV, MERS-CoV và SARS-CoV-2, tải lượng virus cao hơn đã được phát hiện trong các mẫu từ đường hô hấp dưới so với đường hô hấp trên.28,149 Do đó, trong các trường hợp nghi ngờ lâm sàng có kết quả âm tính ban đầu trên phết mũi họng hoặc phết họng, xét nghiệm lại các mẫu đường hô hấp trên hoặc tốt nhất là xét nghiệm mẫu đường hô hấp dưới nên được thực hiện. RT-PCR trên mẫu phân có thể dương tính với HCoV nhưng không được sử dụng để chẩn đoán thông thường.91,98,99 Đối với SARSCoV và SARS-CoV-2, các trường hợp hiếm gặp với PCR dương tính trong máu đã được báo cáo.28,150 Serology đã được sử dụng để chẩn đoán nhiễm trùng SARS-CoV và MERS-CoV, nhưng không hữu ích trong giai đoạn cấp tính của nhiễm trùng.100103 Phản ứng chéo giữa các kháng thể chống SARS-CoV và CoV thông thường đã được quan sát.151
Sars-cov-2
Toàn bộ trình tự bộ gen cho phép phát triển nhanh các xét nghiệm chẩn đoán phân tử đối với SARS-CoV-2.28 RT-PCR đối với các gen mã hóa RNA polymerase phụ thuộc RNA và glycoprotein surface spike thường được sử dụng.28
Điều trị
Điều trị hỗ trợ bao gồm đủ lượng dịch và lượng calo, và bổ sung oxy nên được sử dụng trong điều trị trẻ em bị nhiễm HCoV. Mục đích là để ngăn ngừa ARDS, suy nội tạng và nhiễm trùng bệnh viện thứ phát. Nếu nghi ngờ nhiễm vi khuẩn có thể sử dụng kháng sinh phổ rộng như cephalosporin thế hệ thứ hai hoặc thứ ba.
Sars-cov
Trong trường hợp không có thuốc kháng vi-rút cụ thể đối với CoV, các thuốc chống vi-rút phổ rộng, như interferon alpha và beta hoặc ribavirin đã được sử dụng để điều trị SARS-CoV, kể cả ở trẻ em.57-59 Ribavirin sau đó không có hiệu quả hoặc thậm chí có hại vì nó có thể gây thiếu máu tán huyết hoặc rối loạn chức năng gan.152 Ở người lớn, dùng interferon-alpha đơn thuần hoặc cùng với ribavirin cũng không cải thiện kết quả.152,153 Có một số bằng chứng cho thấy corticosteroid tiêm tĩnh mạch dẫn đến cải thiện lâm sàng và X quang ở SARS-CoV cá nhân.58 Tuy nhiên, một đánh giá có hệ thống cho thấy bằng chứng cho điều này là không thuyết phục và corticosteroid cũng có thể có hại (chậm thanh thải virus, hoại tử vô mạch, loãng xương, khởi phát mới của tiểu đường). Một số bằng chứng trên nghiên cứu ở người lớn cho thấy lopinavir/ritonavir (Kaletra) bắt đầu sớm trong khi nhiễm trùng có liên quan đến kết quả lâm sàng được cải thiện (giảm đặt nội khí quản, ARDS và tỷ lệ tử vong).154,155 Tuy nhiên, một tổng quan hệ thống đã tìm thấy kết quả không thuyết phục khi sử dụng lopinavir/ritonavir vì có thể có sự sai lệch lựa chọn trong nhiều nghiên cứu.152 Kết quả không xác định cũng được tìm thấy đối với các globulin miễn dịch tiêm tĩnh mạch vì các nghiên cứu không giải thích được bệnh đi kèm, giai đoạn bệnh và hiệu quả của các phương pháp điều trị khác.152 Không có bằng chứng về việc sử dụng kháng thể đơn dòng chống lại yếu tố hoại tử khối u alpha.156
Mers-cov
Không có nghiên cứu về kết quả điều trị MERS-CoV ở trẻ em. Ở người trưởng thành, như đối với SARS-CoV, interferon hoặc ribavirin đơn độc hoặc phối hợp chưa được chứng minh là có lợi ích rõ ràng.157-159 Mycophenolate mofetil, ức chế tổng hợp guanine (và do đó RNA), được xác định là có khả năng chống tổng hợp guanine (và do đó RNA), được xem như là một thuốc tiềm năng chống MERS-CoV in vitro.160 Tuy nhiên, các nghiên cứu trên động vật cho thấy loại thuốc này dẫn đến kết quả tồi tệ hơn với tải lượng virus cao hơn ở các mô phổi và ngoài phổi.161 Phù hợp với điều này, bệnh nhân ghép thận có sử dụng mycophenolate mofetil đã được báo cáo là nghiêm trọng và đôi khi nhiễm trùng MERS-CoV gây tử vong.162
Sars-cov-2
Cho đến khi kết quả của các thử nghiệm lâm sàng đang diễn ra trở nên khả dụng, không có bằng chứng rõ ràng nào về việc điều trị căn bản cho bệnh nhân nhiễm SARS-CoV-2. Khuyến cáo điều trị duy nhất cho trẻ em, được công bố bởi Đại học Y khoa Chiết Giang, cho thấy việc sử dụng interferon alpha-2b và lopinavir/ritonavir đường uống cùng với corticosteroid để điều trị các biến chứng (ARDS, viêm não, hội chứng tan máu hoặc nhiễm trùng huyết) trường hợp nặng.72
Tuy nhiên, vì không có liệu pháp nào trong số các liệu pháp này cho thấy lợi ích rõ ràng trong điều trị các CoV mới khác, nên có câu hỏi liệu chúng có lợi trong điều trị SARS-CoV-2 hay không. Cả Tổ chức Y tế Thế giới và CDC Hoa Kỳ đều không khuyến nghị điều trị cụ thể ở trẻ em hoặc người lớn.97,163 Mặc dù vậy, trong loạt trường hợp được đề cập trước đây trong số 34 trẻ bị nhiễm SARS-CoV-2, 59% đã được điều trị lopinavir/ritonavir.61 Không ai trong số các trẻ em được dùng glucocorticoids hoặc immuno- globulin.61
Các lựa chọn trị liệu khác
Kháng thể đơn dòng
Mặc dù sự đa dạng của chúng, CoV chia sẻ nhiều protein giữa các loài khác nhau, rất hữu ích cho việc thiết kế các loại thuốc mới. Một trong số đó là glycoprotein S tăng đột biến cấu trúc bề mặt, chịu trách nhiệm cho sự tương tác giữa tế bào virus.164 Kháng thể đơn dòng (từ huyết tương người, huyết tương động vật hoặc được sản xuất) chống lại glycoprotein S tăng đột biến đã được chứng minh là có khả năng ức chế phản ứng tổng hợp CoV với tế bào người và để giảm tỷ lệ tử vong ở bệnh nhân nhiễm SARS-CoV.165-171 Một loại protein cũng ức chế glycoprotein S tăng đột biến, mặc dù nó không phải là kháng thể đơn dòng, đã được phân lập từ một loại tảo đỏ có tên là Griffithsia.172 Tuy nhiên cho đến ngày nay nó chỉ được thử nghiệm trong nghiên cứu động vật.172
Enzyme chuyển đổi angiotensin 2, dipeptidyl peptidase 4, aminopeptidase N, axit sialic O-acetylated là những thụ thể tiếp theo cho HCoV và kháng thể đơn dòng chống lại các protein này có thể hữu ích trong điều trị nhiễm trùng.173-176 Tuy nhiên, đột biến nhanh chóng của CoV đặt ra một vấn đề tiềm năng, có thể được giảm bớt bằng cách sử dụng một số kháng thể đơn dòng nhắm vào các epitopes khác nhau.166
Chất ức chế protease
Có thể làm giảm sự xâm nhập của virus có thể nội bào và không có thể nội bào (endosomal and nonendosomal) vào các tế bào bằng cách ức chế các protease tương ứng.177-179 Các protease giống Papain (PLpro) có liên quan đến sự nhân lên của virus trong CoV và là mục tiêu tiềm năng tiếp theo để điều trị. Nhiều chất ức chế PLpro đã được xác định. Tuy nhiên, không ai trong số chúng được xác nhận trong các nghiên cứu in vivo.180,181 Ngoài ra, các enzyme PLpro khác nhau giữa các loài CoV, làm cho thuốc ức chế PLpro thuốc chống vi rút phổ hẹp chống lại CoVs.182
Một protein nữa liên quan đến sự nhân lên của virus là protein chính CoV, bị ức chế bởi lopinavir. Tuy nhiên, như đã đề cập trước đây, lopinavir (cộng với ritonavir) đã được chứng minh là có hiệu quả chống lại CoV trong các nghiên cứu trên động vật và không thương mại ở người nhiễm SARS-CoV.154,161 Tuy nhiên, như đã đề cập trước đây, những kết quả này được coi là không thuyết phục vì sai lệch lựa chọn tiềm năng. 152
Thuốc chloroquine
Chloroquine, thường được sử dụng để chống lại bệnh sốt rét và các bệnh tự miễn, làm tăng pH nội sinh do đó ức chế phản ứng tổng hợp tế bào vi rút, và do đó là một loại thuốc chống vi rút phổ rộng tiềm năng.183 Nó cũng can thiệp vào quá trình glycosyl hóa các thụ thể của tế bào SARS-CoV.184 Ngoài ra, các nghiên cứu in vitro cho thấy chloroquine ức chế giai đoạn xâm nhập và hậu xâm nhập của SARS-CoV-2 vào tế bào.185 Ngoài ra, chloroquine có hoạt tính điều chỉnh miễn dịch, có thể tăng cường tác dụng chống vi rút của nó trên vivo.185
Ức chế tổng hợp RNA
Như đã đề cập trước đây, ribavirin, một chất tương tự guanosine đã được chứng minh là không hiệu quả hoặc thậm chí có hại đối với SARS-CoV152 và MERS-CoV.157-159 Immucillin-A, một chất tương tự adenosine mới được phát triển gần đây, ức chế RNA polymerase của virus. một loạt các virus RNA, bao gồm SARS-CoV và MERS-CoV,186 và có thể hữu ích trong điều trị các HCoV khác. Hơn nữa, các chất ức chế helicase (là protein tách RNA sợi đôi thành chuỗi đơn trong quá trình sao chép) có thể hữu ích trong điều trị các chất ức chế tổng hợp RNA CoVs.187 Chất ức chế sinh tổng hợp RNA, làm giảm sự hình thành các túi màng kép, một dấu hiệu của sự sao chép CoV2, được xác định là thuốc kháng vi rút tiềm năng.188,189 Một oligomeizer chuỗi hoạt hóa RNA chuỗi đôi (DRACO) nhắm vào RNA chuỗi kép virus dài và gây ra apoptosis của các tế bào bị nhiễm bệnh, nhưng có thể giúp ích cho việc điều trị CoVs.190
Vaccines
Một số vắc-xin chống lại HCoV đang được phát triển với mục đích ngăn ngừa nhiễm trùng, giảm mức độ nghiêm trọng của bệnh và sự phát tán của virus. Các kháng nguyên chính cho sự phát triển vắc-xin là glycoprotein S tăng đột biến cấu trúc hoặc miền liên kết với thụ thể của nó (RBD).191 Tuy nhiên, xu hướng của CoVs để nhanh chóng biến đổi và tái tổ hợp đặt ra một vấn đề tiềm năng cho sự phát triển vắc-xin.192-194 Hơn nữa, tăng cường bệnh sau khi thử thách virus sau tiêm chủng đã được quan sát thấy trên các mô hình động vật sau một số loại vắc-xin khác nhau.195-197
Vắc xin sống giảm độc lực
Ưu điểm của vắc-xin suy yếu là chúng sử dụng một phản ứng miễn dịch mạnh mẽ và lâu dài, bao gồm miễn dịch tế bào và dịch thể đối với nhiều loại kháng nguyên khác nhau. Trong các nghiên cứu trên động vật SARS-CoV, các đột biến suy yếu với việc xóa gen E cấu trúc đã được chứng minh là tạo ra các kháng thể trung hòa, giảm tải lượng virus và bảo vệ khỏi các triệu chứng lâm sàng của nhiễm SARS-CoV.198-200 Ngược lại, việc xóa các khung đọc mở ít hoặc không ảnh hưởng đến tải lượng virus trong ống nghiệm và in vivo.201 Các chiến lược khác đang được phát triển đối với vắc-xin sống làm suy yếu đối với CoV là sắp xếp lại bộ gen hoặc loại bỏ gen.202-204 Những ưu điểm này là virus vắc-xin không thể tái tổ hợp với virus dại.
Vắc xin bất hoạt
Trong mô hình chuột, vắc-xin bất hoạt đã tạo thành công miễn dịch tế bào và dịch thể (với nhiều kháng thể trung hòa khác nhau) chống lại SARS-CoV191,205-207 và miễn dịch dịch thể chống lại MERS-CoV.208,209 Trong thử nghiệm pha 1 ở người, vắc-xin bất hoạt chống SARS-CoV được dung nạp tốt và bộc lộ kháng thể trung hòa.210 Tuy nhiên, không có nghiên cứu thử thách nào được thực hiện ở người, và trong các nghiên cứu về thử thách khỉ, không có sự bảo vệ rõ ràng nào được đưa ra mặc dù đã gây ra phản ứng mạnh mẽ của miễn dịch tế bào và thể dịch.211 Hơn nữa, những lo ngại đã được đặt ra rằng vắc-xin bất hoạt chống lại SARS-CoV và MERS-CoV có thể dẫn đến các phản ứng miễn dịch và/hoặc viêm có hại sau thử thách.195,209
Vắc xin tiểu đơn vị và tái tổ hợp
Vắc-xin tiểu đơn vị là kháng nguyên tinh khiết, thường được kết hợp với tá dược và là phương pháp phổ biến nhất trong việc phát triển vắc-xin chống lại CoV mới. Đối với SARS-CoV và MERS-CoV, chúng hầu hết được phát triển từ glycoprotein S, RBD hoặc nucleocapsid protein tăng đột biến.212-216 Một số nghiên cứu cho thấy rằng vắc-xin tiểu đơn vị được tiêm vào bên trong có thể tạo ra phản ứng miễn dịch mạnh hơn và miễn dịch niêm mạc.217 Một số vắc-xin tiểu đơn vị đã cho thấy thành công trong các nghiên cứu thử thách trên động vật. 218-220
Trong một nghiên cứu trên khỉ, protein RBD tái tổ hợp đã được sử dụng để giảm thành công tải lượng virus ở phổi và hầu họng và để ngăn ngừa viêm phổi MERS-CoV.218 Ở chuột, kết quả tương tự đã đạt được khi sử dụng vắc-xin protein RBD tái tổ hợp từ SARS-CoV.221
Vắc-xin vec tơ virut
Các vec tơ dựa trên Adenovirus mã hóa protein SARS (ví dụ, protein nucleocapsid, glycoprotein S và các protein màng khác) đã được chứng minh là có khả năng miễn dịch ở chuột và khỉ maca mà chúng tạo ra các đáp ứng vắc-xin dịch thể và tế bào.222,223 Vắc-xin dựa trên Adenovirus mang các bộ phận MERS-CoV đã được chứng minh là làm giảm tỷ lệ mắc bệnh và tử vong (không thể phát hiện hoặc giảm tải lượng virus phổi) trong các mô hình chuột.196,224 Ban đầu, xuất huyết phổi đã được quan sát thấy thách thức sau khi tiêm virut.196 Tuy nhiên, việc thêm một phối tử CD40 vào khả năng miễn dịch và tăng cường miễn dịch vắc-xin bệnh lý phổi vô tình, làm cho vắc-xin này là một chiến lược đầy hứa hẹn.196 Tuy nhiên, miễn dịch từ trước đối với adenovirus có thể làm giảm hiệu quả. Điều này có thể được giải quyết bằng cách tiêm vắc-xin dựa trên vi-rút, sau đó là vắc-xin tái tổ hợp làm thuốc tăng cường.225 Vắc-xin MERS-CoV dựa trên adenovirus đã chuyển sang thử nghiệm lâm sàng giai đoạn I.226
Một nghiên cứu, so sánh vắc-xin SARSCoV bất hoạt với vắc-xin dựa trên adenovirus chống lại SARS-CoV, đã phát hiện ra rằng lần đầu tiên dẫn đến đáp ứng miễn dịch cao hơn.227 Vắcxin dựa trên Adenovirus được dùng đường mũi dẫn đến sản xuất kháng thể immunoglobulin A bảo vệ tốt hơn khỏi sự nhân lên của virus trong phổi.227 Điều này cho thấy rằng việc đo kháng thể trung hòa trong huyết thanh có thể không phải là một cách đủ để đánh giá hiệu quả vắc-xin đối với HCoV vì khả năng miễn dịch niêm mạc có thể quan trọng hơn.
Đối với SARS-CoV, poxvirus cũng đã được sử dụng như một vec tơ cho vắc-xin trong mũi và tiêm bắp. Loại kháng thể trung hòa do vắc-xin này và giảm tải lượng virus trong đường hô hấp của chuột bị thử thách.228 Tuy nhiên, một loại vắc-xin tương tự được sử dụng trong chồn sương đã dẫn đến tăng tổn thương gan sau thử thách SARS-CoV.197
Vắc-xin vectơ tiếp theo cho SARS-CoV đã được thử nghiệm trên động vật dựa trên vi-rút parainfluenza tái tổ hợp,229,230 vi-rút sởi tái tổ hợp sống suy giảm,231 vi-rút bệnh dại suy giảm 232 và Salmonella suy giảm.233
Vắc xin dna
Vắc-xin chứa DNA mã hóa glycoprotein tăng đột biến dường như tạo ra phản ứng mạnh mẽ hơn về kháng thể trung hòa chống lại MERSCoV so với vắc-xin chỉ chứa protein RBD. Chúng đã được chứng minh là bảo vệ khỉ maca khỏi bệnh viêm phổi MERS-CoV.234,235 Ba loại vắc-xin DNA chống lại MERS-CoV đã tiến hành thử nghiệm lâm sàng.236-238
Các chiến lược khác để kiểm soát coronavirus khẩn cấp
Sau khi nhanh chóng lan rộng trên toàn cầu, SARS-CoV vào năm 2003 đã tạo một đáp ứng sức khỏe cộng đồng toàn cầu có hiệu quả cao. Điều này nhấn mạnh nhu cầu cấp thiết cho các chiến lược kiểm soát nhiễm trùng nhanh chóng và hiệu quả. Một trong những thách thức chính với CoV mới là khả năng lây truyền bệnh viện cao.239 Bối cảnh chăm sóc sức khỏe dường như làm tăng nguy cơ lây truyền virut do các thủ tục tạo khí dung như đặt nội khí quản và nội soi phế quản.
Do đó, thực hành vệ sinh bệnh viện phù hợp là rất quan trọng để hạn chế sự bùng phát bệnh viện. Mục đích chính là để phân loại hiệu quả bệnh nhân bị sốt, triệu chứng hô hấp và tiền sử tiếp xúc240 và áp dụng các biện pháp kiểm soát nhiễm trùng nghiêm ngặt như cách ly bệnh nhân và cách ly tiếp xúc càng sớm càng tốt. Lý tưởng nhất, mỗi bệnh nhân được đặt trong một phòng áp lực âm duy nhất. Nếu điều này là không thể, bệnh nhân và nhân viên y tế nên được phối hợp.241 Thiết bị bảo vệ nên bao gồm áo choàng chống nước, găng tay dùng một lần, khẩu trang và kính bảo hộ N95 hoặc tấm chắn mặt.240 Ống hút đàm và mặt nạ cơ học có hệ thống mạch kín và nên sử dụng bộ lọc virus.240 Ngược lại, không nên sử dụng máy phun khí dung, mặt nạ oxy hoặc hệ thống áp lực đường thở dương liên tục ở mũi trên một khu vực mở.240,241 Không cần phải nói, cần phải vệ sinh tay nghiêm ngặt và nên tránh người thăm viếng giới hạn ở mức tối thiểu. Các HCoV đã được chứng minh tồn tại trên bề mặt khô trong tối đa 9 ngày.242-244 Sự tồn tại phụ thuộc vào nhiệt độ (thời gian ngắn hơn ở 30-40° C) và độ ẩm (dài hơn ở độ ẩm cao hơn).245 HCoV, bao gồm cả CoV mới, có thể bị bất hoạt bằng cách đun nóng đến 56°C trong 30 phút hoặc sử dụng các dung môi lipid như ethanol (> 75%), isopropanol (> 70%), formaldehyd (> 0,7%), povidoneiodine (> 0,23%), natri hypochlorite (> 0,21%), hydro peroxide (> 0,5%), nhưng không phải chlorhexidine.72,244
Tóm lược
Nhiễm SARS-CoV, MERS-CoV và SARSCoV-2 dường như ít ảnh hưởng đến trẻ em và ít nghiêm trọng hơn so với người lớn. Điều này có thể là do trẻ em ít tiếp xúc với các nguồn lây truyền chính (mà cho đến nay vẫn là lây truyền trong bệnh viện) hoặc do chúng ít tiếp xúc với động vật. Tuy nhiên, cũng có thể là trẻ em ít có triệu chứng hoặc có các triệu chứng ít nghiêm trọng hơn và do đó ít được kiểm tra hơn, dẫn đến việc đánh giá thấp con số thực sự bị nhiễm bệnh. Liên quan đến SARS-CoV-2, một nghiên cứu được công bố vào đầu tháng 3 năm 2020 cho thấy trẻ em cũng giống như người lớn bị nhiễm vi-rút này nhưng ít có khả năng có triệu chứng hoặc phát triển các triệu chứng ít nghiêm trọng.246 Tuy nhiên, tầm quan trọng của trẻ em trong việc truyền virus vẫn chưa chắc chắn. Phần lớn trẻ em bị nhiễm CoV mới được báo cáo cho đến nay được ghi nhận có liên hệ gia đình, thường biểu hiện các triệu chứng trước chúng, cho thấy khả năng trẻ em không phải là nguồn dự trữ quan trọng đối với CoV mới. Các đặc điểm lâm sàng, xét nghiệm và X quang ở trẻ em tương tự nhau đối với tất cả các CoV mới, ngoại trừ nhiều trẻ bị nhiễm SARS-CoV bị sốt so với SARS-CoV-2 hoặc MERS-CoV. Cho đến nay, không có trường hợp tử vong ở trẻ em nào được báo cáo về SARS-CoV hoặc SARS-CoV-2, ngoại trừ (trong trường hợp trước đây) đối với trẻ sơ sinh của các bà mẹ bị nhiễm bệnh trong thai kỳ.
References
Fehr AR, Perlman S. Coronaviruses: an overview of their replication and pathogenesis. Methods Mol Biol. 2015;1282:1–23.
Amer HM. Bovine-like coronaviruses in domestic and wild ruminants. Anim Health Res Rev. 2018;19:113–124.
Saif LJ. Animal coronaviruses: what can they teach us about the severe acute respiratory syndrome? Rev Sci Tech. 2004;23:643–660.
Cabeça TK, Granato C, Bellei N. Epidemiological and clinical features of human coronavirus infections among different subsets of patients. Influenza Other Respir Viruses. 2013;7:1040–1047.
Vabret A, Mourez T, Gouarin S, et al. An outbreak of coronavirus OC43 respiratory infection in Normandy, France. Clin Infect Dis. 2003;36:985–989.
Esper F, Ou Z, Huang YT. Human coronaviruses are uncommon in patients with gastrointestinal illness. J Clin Virol. 2010;48:131–133.
Vabret A, Dina J, Gouarin S, et al. Detection of the new human coronavirus HKU1: a report of 6 cases. Clin Infect Dis. 2006;42:634–639.
Woo PC, Lau SK, Chu CM, et al. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol. 2005;79:884–895.
Gorse GJ, O’Connor TZ, Hall SL, et al. Human coronavirus and acute res-piratory illness in older adults with chronic obstructive pulmonary disease. J Infect Dis. 2009;199:847–857.
da Silva Filho LV, Zerbinati RM, Tateno AF, et al. The differential clinical impact of human coronavirus species in children with cystic fibrosis. J Infect Dis. 2012;206:384–388.
Chiu SS, Chan KH, Chu KW, et al. Human coronavirus NL63 infection and other coronavirus infections in children hospitalized with acute respiratory disease in Hong Kong, China. Clin Infect Dis. 2005;40:1721–1729.
McIntosh K, Ellis EF, Hoffman LS, et al. The association of viral and bacte-rial respiratory infections with exacerbations of wheezing in young asth-matic children. J Pediatr. 1973;82:578–590.
Woo PC, Lau SK, Lam CS, et al. Discovery of seven novel Mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronavi-ruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavi-rus. J Virol. 2012;86:3995–4008.
Lau SK, Woo PC, Li KS, et al. Discovery of a novel coronavirus, China Rattus coronavirus HKU24, from Norway rats supports the murine origin of Betacoronavirus 1 and has implications for the ancestor of Betacoronavirus lineage A. J Virol. 2015;89:3076–3092.
Gaunt ER, Hardie A, Claas EC, et al. Epidemiology and clinical presen-tations of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method. J Clin Microbiol. 2010;48:2940–2947.
Davis BM, Foxman B, Monto AS, et al. Human coronaviruses and other respiratory infections in young adults on a university campus: prevalence, symptoms, and shedding. Influenza Other Respir Viruses. 2018;12:582–590.
Huynh J, Li S, Yount B, et al. Evidence supporting a zoonotic origin of human coronavirus strain NL63. J Virol. 2012;86:12816–12825.
Pfefferle S, Oppong S, Drexler JF, et al. Distant relatives of severe acute respiratory syndrome coronavirus and close relatives of human coronavirus 229E in bats, Ghana. Emerg Infect Dis. 2009;15:1377–1384.
Corman VM, Eckerle I, Memish ZA, et al. Link of a ubiquitous human corona-virus to dromedary camels. Proc Natl Acad Sci U S A. 2016;113:9864–9869.
Vijgen L, Keyaerts E, Moës E, et al. Complete genomic sequence of human coronavirus OC43: molecular clock analysis suggests a relatively recent zoonotic coronavirus transmission event. J Virol. 2005;79:1595–1604.
de Wit E, van Doremalen N, Falzarano D, et al. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14:523–534.
Shi Z, Hu Z. A review of studies on animal reservoirs of the SARS corona-virus. Virus Res. 2008;133:74–87.
Drosten C, Günther S, Preiser W, et al. Identification of a novel corona-virus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;348:1967–1976.
Wang M, Yan M, Xu H, et al. SARS-CoV infection in a restaurant from palm civet. Emerg Infect Dis. 2005;11:1860–1865.
Luk HKH, Li X, Fung J, et al. Molecular epidemiology, evolution and phy-logeny of SARS coronavirus. Infect Genet Evol. 2019;71:21–30.
de Groot RJ, Baker SC, Baric RS, et al. Middle East respiratory syndrome coronavirus (MERS-CoV): announcement of the Coronavirus Study Group. J Virol. 2013;87:7790–7792.
Ommeh S, Zhang W, Zohaib A, et al. Genetic evidence of Middle East res-piratory syndrome coronavirus (MERSCov) and widespread seropreva-lence among camels in Kenya. Virol Sin. 2018;33:484–492.
Chan JF, Yuan S, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020;395:514–523.
Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382:727–733.
World Health Organization. Coronavirus disease 2019 (COVID-19) Situation Report – 32. 2020. Available at: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200221-sitrep-32-covid-19. pdf?sfvrsn=4802d089_2. Accessed March 2, 2020.
Kuypers J, Martin ET, Heugel J, et al. Clinical disease in children associated with newly described coronavirus subtypes. Pediatrics. 2007;119:e70–e76.
Uddin SMI, Englund JA, Kuypers JY, et al. Burden and risk factors for coronavirus infections in infants in rural Nepal. Clin Infect Dis. 2018;67:1507–1514.
Taylor S, Lopez P, Weckx L, et al. Respiratory viruses and influenza-like illness: epidemiology and outcomes in children aged 6 months to 10 years in a multi-country population sample. J Infect. 2017;74:29–41.
Fagbo SF, Garbati MA, Hasan R, et al. Acute viral respiratory infections among children in MERS-endemic Riyadh, Saudi Arabia, 2012-2013. J Med Virol. 2017;89:195–201.
Zhang SF, Tuo JL, Huang XB, et al. Epidemiology characteristics of human coronaviruses in patients with respiratory infection symptoms and phyloge-netic analysis of HCoV-OC43 during 2010-2015 in Guangzhou. PLoS One. 2018;13:e0191789.
Friedman N, Alter H, Hindiyeh M, et al. Human coronavirus infections in Israel: epidemiology, clinical symptoms and summer seasonality of HCoV-HKU1. Viruses. 2018;10:1–9.
Peak CM, Childs LM, Grad YH, et al. Comparing nonpharmaceutical inter-ventions for containing emerging epidemics. Proc Natl Acad Sci U S A. 2017;114:4023–4028.
Wu JT, Leung K, Leung GM. Nowcasting and forecasting the potential domestic and international spread of the 2019nCoV outbreak originating in Wuhan, China: a modelling study. Lancet. 2020;395:689–697.
Chowell G, Abdirizak F, Lee S, et al. Transmission characteristics of MERS and SARS in the healthcare setting: a comparative study. BMC Med. 2015;13:210.
Lloyd-Smith JO, Schreiber SJ, Kopp PE, et al. Superspreading and the effect of individual variation on disease emergence. Nature. 2005;438:355–359.
Majumder MS, Rivers C, Lofgren E, et al. Estimation of MERS-coronavirus reproductive number and case fatality rate for the spring 2014 Saudi Arabia outbreak: insights from publicly available data. PLoS Curr. 2014;6:1–20.
Wallinga J, Teunis P. Different epidemic curves for severe acute respira-tory syndrome reveal similar impacts of control measures. Am J Epidemiol. 2004;160:509–516.
Chowell G, Castillo-Chavez C, Fenimore PW, et al. Model parameters and outbreak control for SARS. Emerg Infect Dis. 2004;10:1258–1263.
Riley S, Fraser C, Donnelly CA, et al. Transmission dynamics of the etio-logical agent of SARS in Hong Kong: impact of public health interventions. Science. 2003;300:1961–1966.
Lipsitch M, Cohen T, Cooper B, et al. Transmission dynamics and control of severe acute respiratory syndrome. Science. 2003;300:1966–1970.
Kucharski AJ, Althaus CL. The role of superspreading in Middle East res-piratory syndrome coronavirus (MERSCoV) transmission. Euro Surveill. 2015;20:14–18.
Chen SC, Chang CF, Liao CM. Predictive models of control strategies involved in containing indoor airborne infections. Indoor Air. 2006;16:469–481.
Cauchemez S, Nouvellet P, Cori A, et al. Unraveling the drivers of MERS-CoV transmission. Proc Natl Acad Sci U S A. 2016;113:9081–9086.
Park JE, Jung S, Kim A, et al. MERS transmission and risk factors: a sys-tematic review. BMC Public Health. 2018;18:574.
Zhao S, Lin Q, Ran J, et al. Preliminary estimation of the basic reproduction number of novel coronavirus (2019nCoV) in China, from 2019 to 2020: a data-driven analysis in the early phase of the outbreak. Int J Infect Dis. 2020;92:214–217.
Cyranoski D. Mystery deepens over animal source of coronavirus. 2020. Accessed March 4, 2020. Available at: https://www.nature.com/articles/ d41586-020-00548-w.
World Health Organization. Summary of probable SARS cases with onset of illness from 1 November 2002 to 31 July 2003. 2004. Available at: https:// www.who.int/csr/sars/country/table2004_04_21/en/. Accessed March 5, 2020.
Middle East respiratory syndrome coronavirus (MERS-CoV), MERS Monthly Summary, November 2019. https://www.who.int/emergencies/ mers-cov/en/. Accessed March 5, 2020.
World Health Organization. Coronavirus disease 2019 (COVID-19) Situation Report – 48. 2020. Available at:
https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200308-sitrep-48-covid-19. pdf?sfvrsn=16f7ccef_4. Accessed March 9, 2020.
Zhong NS, Zheng BJ, Li YM, et al. Epidemiology and cause of severe acute respiratory syndrome (SARS) in Guangdong, People’s Republic of China, in February, 2003. Lancet. 2003;362:1353–1358.
Hunter JC, Nguyen D, Aden B, et al. Transmission of Middle East respira-tory syndrome coronavirus infections in healthcare settings, Abu Dhabi. Emerg Infect Dis. 2016;22:647–656.
Hon KL, Leung CW, Cheng WT, et al. Clinical presentations and outcome of severe acute respiratory syndrome in children. Lancet. 2003;361:1701–1703.
Chiu WK, Cheung PC, Ng KL, et al. Severe acute respiratory syndrome in children: experience in a regional hospital in Hong Kong. Pediatr Crit Care Med. 2003;4:279–283.
Bitnun A, Allen U, Heurter H, et al; Other Members of the Hospital for Sick Children SARS Investigation Team. Children hospitalized with severe acute respiratory syndrome-related illness in Toronto. Pediatrics. 2003;112:e261.
Al-Tawfiq JA, Kattan RF, Memish ZA. Middle East respiratory syndrome coronavirus disease is rare in children: an update from Saudi Arabia. World J Clin Pediatr. 2016;5:391–396.
Wang XF, Yuan J, Zheng YJ, et al. [Clinical and epidemiological character-istics of 34 children with 2019 novel coronavirus infection in Shenzhen]. Zhonghua Er Ke Za Zhi. 2020;58:E008.
Lessler J, Reich NG, Brookmeyer R, et al. Incubation periods of acute respiratory viral infections: a systematic review. Lancet Infect Dis. 2009;9:291–300.
Leung GM, Hedley AJ, Ho LM, et al. The epidemiology of severe acute respiratory syndrome in the 2003 Hong Kong epidemic: an analysis of all 1755 patients. Ann Intern Med. 2004;141:662–673.
Jiang X, Rayner S, Luo MH. Does SARS-CoV-2 has a longer incubation period than SARS and MERS? J Med Virol. 2020:1–3. [Epub ahead of print]
Lau EH, Hsiung CA, Cowling BJ, et al. A comparative epidemiologic analysis of SARS in Hong Kong, Beijing and Taiwan. BMC Infect Dis. 2010;10:50.
Chan-Yeung M, Xu RH. SARS: epidemiology.Respirology.2003;8(suppl):S9–S14.
Assiri A, Al-Tawfiq JA, Al-Rabeeah AA, et al. Epidemiological, demo-graphic, and clinical characteristics of 47 cases of Middle East respira-tory syndrome coronavirus disease from Saudi Arabia: a descriptive study. Lancet Infect Dis. 2013;13:752–761.
Korea Centers for Disease Control and Prevention. Middle East respira-tory syndrome coronavirus outbreak in the republic of Korea, 2015. Osong Public Health Res Perspect. 2015;6:269–278.
Zumla A, Hui DS, Perlman S. Middle East respiratory syndrome. Lancet.2015;386:995–1007.
Cowling BJ, Park M, Fang VJ, et al. Preliminary epidemiological assessment of MERS-CoV outbreak in South Korea, May to June 2015. Euro Surveill. 2015;20:7–13.
Virlogeux V, Fang VJ, Park M, et al. Comparison of incubation period dis-tribution of human infections with MERSCoV in South Korea and Saudi Arabia. Sci Rep. 2016;6:35839.
Chen ZM, Fu JF, Shu Q, et al. Diagnosis and treatment recommendations for pediatric respiratory infection caused by the 2019 novel coronavirus. World J Pediatr. 2020. [Epub ahead of print]
Martin ET, Fairchok MP, Stednick ZJ, et al. Epidemiology of multiple res-piratory viruses in childcare attendees. J Infect Dis. 2013;207:982–989.
Anderson RM, Fraser C, Ghani AC, et al. Epidemiology, transmission dynamics and control of SARS: the 2002-2003 epidemic. Philos Trans R Soc Lond B Biol Sci. 2004;359:1091–1105.
Peiris JS, Chu CM, Cheng VC, et al; HKU/UCH SARS Study Group. Clinical progression and viral load in a community outbreak of cor-onavirus-associated SARS pneumonia: a prospective study. Lancet. 2003;361:1767–1772.
Alfaraj SH, Al-Tawfiq JA, Altuwaijri TA, et al. Middle East respiratory syn-drome coronavirus in pediatrics: a report of seven cases from Saudi Arabia. Front Med. 2019;13:126–130.
Wei M, Yuan J, Liu Y, et al. Novel coronavirus infection in hospitalized infants under 1 year of age in China. JAMA. 2020. [Epub ahead of print]
van der Hoek L, Pyrc K, Jebbink MF, et al. Identification of a new human coronavirus. Nat Med. 2004;10:368–373.
van der Hoek L, Sure K, Ihorst G, et al. Croup is associated with the novel coronavirus NL63. PLoS Med. 2005;2:e240.
Pyrc K, Berkhout B, van der Hoek L. The novel human coronaviruses NL63 and HKU1. J Virol. 2007;81:3051–3057.
Greenberg SB. Update on human rhinovirus and coronavirus infections. Semin Respir Crit Care Med. 2016;37:555–571.
McIntosh K, Kapikian AZ, Turner HC, et al. Seroepidemiologic studies of coronavirus infection in adults and children. Am J Epidemiol. 1970;91:585– 592.
Yeh EA, Collins A, Cohen ME, et al. Detection of coronavirus in the cen-tral nervous system of a child with acute disseminated encephalomyelitis. Pediatrics. 2004;113(1 pt 1):e73–e76.
Ge XY, Li JL, Yang XL, et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature. 2013;503:535–538.
Cheng FW, Ng PC, Chiu WK, et al. A case-control study of SARS versus community acquired pneumonia. Arch Dis Child. 2005;90:747–749.
Leung CW, Kwan YW, Ko PW, et al. Severe acute respiratory syndrome among children. Pediatrics. 2004;113:e535–e543.
Babyn PS, Chu WC, Tsou IY, et al. Severe acute respiratory syn-drome (SARS): chest radiographic features in children. Pediatr Radiol. 2004;34:47–58.
Feng K, Yun YX, Wang XF, et al. [Analysis of CT features of 15 chil-dren with 2019 novel coronavirus infection]. Zhonghua Er Ke Za Zhi. 2020;58:E007.
Li AM, Ng PC. Severe acute respiratory syndrome (SARS) in neonates and children. Arch Dis Child Fetal Neonatal Ed. 2005;90:F461–F465.
Vabret A, Mouthon F, Mourez T, et al. Direct diagnosis of human respira-tory coronaviruses 229E and OC43 by the polymerase chain reaction. J Virol Methods. 2001;97:59–66.
Cheng PK, Wong DA, Tong LK, et al. Viral shedding patterns of corona-virus in patients with probable severe acute respiratory syndrome. Lancet. 2004;363:1699–1700.
Chim SS, Chiu RW, Lo YM. Genomic sequencing of the severe acute res-piratory syndrome-coronavirus. Methods Mol Biol. 2006;336:177–194.
Chim SS, Tong YK, Hung EC, et al. Genomic sequencing of a SARS cor-onavirus isolate that predated the Metropole Hotel case cluster in Hong Kong. Clin Chem. 2004;50:231–233.
Lee JS, Ahn JS, Yu BS, et al. Evaluation of a Real-Time Reverse Transcription-PCR (RT-PCR) assay for detection of Middle East Respiratory Syndrome Coronavirus (MERS-CoV) in clinical samples from an outbreak in South Korea in 2015. J Clin Microbiol. 2017;55:2554–2555.
Kim MN, Ko YJ, Seong MW, et al. Analytical and clinical validation of six commercial Middle East respiratory syndrome coronavirus RNA detec-tion kits based on real-time reverse-transcription PCR. Ann Lab Med. 2016;36:450– 456.
Al Johani S, Hajeer AH. MERS-CoV diagnosis: an update. J Infect Public Health. 2016;9:216–219.
World Health Organization. WHO interim guidance on clinical manage-ment of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected. 2020. Available at: https://apps.who.int/iris/handle/10665/330893. Accessed March 5, 2020.
Jevšnik M, Steyer A, Zrim T, et al. Detection of human coronaviruses in simultaneously collected stool samples and nasopharyngeal swabs from hospitalized children with acute gastroenteritis. Virol J. 2013;10:46.
Zhou J, Li C, Zhao G, et al. Human intestinal tract serves as an alternative infection route for Middle East respiratory syndrome coronavirus. Sci Adv. 2017;3:eaao4966.
Chen X, Zhou B, Li M, et al. Serology of severe acute respiratory syndrome: implications for surveillance and outcome. J Infect Dis. 2004;189:1158–1163.
Bermingham A, Heinen P, Iturriza-Gómara M, et al. Laboratory diagnosis of SARS. Philos Trans R Soc Lond B Biol Sci. 2004;359:1083–1089.
Zhao LQ, Qian Y, Zhu RN, et al. [Serological analysis of SARS coronavirus in children diagnosed clinically as severe acute respiratory syndrome cases dur-ing SARS epidemic in Beijing]. Zhonghua Er Ke Za Zhi. 2006;44:262–266.
Müller MA, Meyer B, Corman VM, et al. Presence of Middle East respira-tory syndrome coronavirus antibodies in Saudi Arabia: a nationwide, cross-sectional, serological study. Lancet Infect Dis. 2015;15:559–564.
Oosterhof L, Christensen CB, Sengeløv H. Fatal lower respiratory tract disease with human corona virus NL63 in an adult haematopoietic cell transplant recipient. Bone Marrow Transplant. 2010;45:1115–1116.
Cabeça TK, Bellei N. Human coronavirus NL-63 infection in a Brazilian patient suspected of H1N1 2009 influenza infection: description of a fatal case. J Clin Virol. 2012;53:82–84.
Munster VJ, Koopmans M, van Doremalen N, et al. A novel coronavirus emerging in China – key questions for impact assessment. N Engl J Med. 2020;382:692–694.
Jia N, Feng D, Fang LQ, et al. Case fatality of SARS in mainland China and associated risk factors. Trop Med Int Health. 2009;14(suppl 1):21–27.
Nassar MS, Bakhrebah MA, Meo SA, et al. Middle East respiratory syndrome coronavirus (MERS-CoV) infection: epidemiology, patho-genesis and clinical characteristics. Eur Rev Med Pharmacol Sci. 2018;22:4956–4961.
Aleanizy FS, Mohmed N, Alqahtani FY, et al. Outbreak of Middle East respiratory syndrome coronavirus in Saudi Arabia: a retrospective study. BMC Infect Dis. 2017;17:23.
Alhamlan FS, Majumder MS, Brownstein JS, et al. Case characteris-tics among Middle East respiratory syndrome coronavirus outbreak and non-outbreak cases in Saudi Arabia from 2012 to 2015. BMJ Open. 2017;7:e011865.
World Health Organization. Disease outbreak news. 24 February 2020. Middle East respiratory syndrome coronavirus (MERS-CoV) – The Kingdom of Saudi Arabia. Available at: https://www.who.int/csr/don/24-february-2020-mers-saudiarabia/en/. Accessed March 5, 2020.
Oh MD, Park WB, Park SW, et al. Middle East respiratory syndrome: what we learned from the 2015 outbreak in the Republic of Korea. Korean J Intern Med. 2018;33:233–246.
National Health Commission of the People’s Republic of China. 2020. Available at: http://www.nhc.gov.cn/xcs/yqtb/202002/6c305f6d70f545d59 548ba17d79b8229.shtml. Accessed February 15 2020.
Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese center for disease control and pre-vention. JAMA. 2020. [Epub ahead of print]
Isaacs D, Flowers D, Clarke JR, et al. Epidemiology of coronavirus respira-tory infections. Arch Dis Child. 1983;58:500–503.
Monto AS, Lim SK. The Tecumseh study of respiratory illness. VI. Frequency of and relationship between outbreaks of coronavirus infection. J Infect Dis. 1974;129:271–276.
Dijkman R, Jebbink MF, El Idrissi NB, et al. Human coronavirus NL63 and 229E seroconversion in children. J Clin Microbiol. 2008;46:2368–2373.
Hasony HJ, Macnaughton MR. Prevalence of human coronavirus antibody in the population of southern Iraq. J Med Virol. 1982;9:209–216.
Kaye HS, Marsh HB, Dowdle WR. Seroepidemiologic survey of corona-virus (strain OC 43) related infections in a children’s population. Am J Epidemiol. 1971;94:43–49.
Leung TF, Li CY, Lam WY, et al. Epidemiology and clinical presenta-tions of human coronavirus NL63 infections in hong kong children. J Clin Microbiol. 2009;47:3486–3492.
Jin Y, Zhang RF, Xie ZP, et al. Newly identified respiratory viruses associ-ated with acute lower respiratory tract infections in children in Lanzou, China, from 2006 to 2009. Clin Microbiol Infect. 2012;18:74–80.
Wu PS, Chang LY, Berkhout B, et al. Clinical manifestations of human coro-navirus NL63 infection in children in Taiwan. Eur J Pediatr. 2008;167:75–80.
Lina B, Valette M, Foray S, et al. Surveillance of community-acquired viral infections due to respiratory viruses in Rhone-Alpes (France) during win-ter 1994 to 1995. J Clin Microbiol. 1996;34:3007–3011.
Lau SK, Woo PC, Yip CC, et al. Coronavirus HKU1 and other coronavirus infections in Hong Kong. J Clin Microbiol. 2006;44:2063–2071.
Guan Y, Peiris JS, Zheng B, et al. Molecular epidemiology of the novel coronavirus that causes severe acute respiratory syndrome. Lancet. 2004;363:99–104.
Tsang KW, Ho PL, Ooi GC, et al. A cluster of cases of severe acute respira-tory syndrome in Hong Kong. N Engl J Med. 2003;348:1977–1985.
Mackay IM, Arden KE. MERS coronavirus: diagnostics, epidemiology and transmission. Virol J. 2015;12:222.
Breban R, Riou J, Fontanet A. Interhuman transmissibility of Middle East respiratory syndrome coronavirus: estimation of pandemic risk. Lancet. 2013;382:694–699.
Cristallo A, Gambaro F, Biamonti G, et al. Human coronavirus polyade-nylated RNA sequences in cerebrospinal fluid from multiple sclerosis patients. New Microbiol. 1997;20:105–114.
Dessau RB, Lisby G, Frederiksen JL. Coronaviruses in spinal fluid of patients with acute monosymptomatic optic neuritis. Acta Neurol Scand. 1999;100:88–91.
Shimizu C, Shike H, Baker SC, et al. Human coronavirus NL63 is not detected in the respiratory tracts of children with acute Kawasaki disease. J Infect Dis. 2005;192:1767–1771.
Chang LY, Chiang BL, Kao CL, et al; Kawasaki Disease Research Group. Lack of association between infection with a novel human coronavi-rus (HCoV), HCoV-NH, and Kawasaki disease in Taiwan. J Infect Dis. 2006;193:283–286.
Chu CM, Poon LL, Cheng VC, et al. Initial viral load and the outcomes of SARS. CMAJ. 2004;171:1349–1352.
Chen WJ, Yang JY, Lin JH, et al. Nasopharyngeal shedding of severe acute respiratory syndrome-associated coronavirus is associated with genetic polymorphisms. Clin Infect Dis. 2006;42:1561–1569.
van Elden LJ, van Loon AM, van Alphen F, et al. Frequent detection of human coronaviruses in clinical specimens from patients with respiratory tract infection by use of a novel real-time reverse-transcriptase polymerase chain reaction. J Infect Dis. 2004;189:652–657.
Li AM, So HK, Chu W, et al. Radiological and pulmonary function out-comes of children with SARS. Pediatr Pulmonol. 2004;38:427–433.
Shek CC, Ng PC, Fung GP, et al. Infants born to mothers with severe acute respiratory syndrome. Pediatrics. 2003;112:e254.
Wong SF, Chow KM, Leung TN, et al. Pregnancy and perinatal outcomes of women with severe acute respiratory syndrome. Am J Obstet Gynecol. 2004;191:292–297.
Saeed AA, Abedi GR, Alzahrani AG, et al. Surveillance and testing for Middle East respiratory syndrome coronavirus, Saudi Arabia, April 2015-February 2016. Emerg Infect Dis. 2017;23:682–685.
Memish ZA, Al-Tawfiq JA, Makhdoom HQ, et al. Screening for Middle East respiratory syndrome coronavirus infection in hospital patients and their healthcare worker and family contacts: a prospective descriptive study. Clin Microbiol Infect. 2014;20:469–474.
Payne DC, Iblan I, Alqasrawi S, et al; Jordan MERS-CoV Investigation Team. Stillbirth during infection with Middle East respiratory syndrome coronavirus. J Infect Dis. 2014;209:1870–1872.
Alserehi H, Wali G, Alshukairi A, et al. Impact of Middle East respiratory syndrome coronavirus (MERS-CoV) on pregnancy and perinatal outcome. BMC Infect Dis. 2016;16:105.
Malik A, El Masry KM, Ravi M, et al. Middle East respiratory syndrome coronavirus during pregnancy, Abu Dhabi, United Arab Emirates, 2013. Emerg Infect Dis. 2016;22:515–517.
Assiri A, Abedi GR, Al Masri M, et al. Middle East respiratory syndrome coronavirus infection during pregnancy: a report of 5 cases from Saudi Arabia. Clin Infect Dis. 2016;63:951–953.
Centers for Disease Control and Prevention CfDCaP. Evaluating and reporting persons under investigation (PUI). 2020. Available at: https://www.cdc.gov/ coronavirus/2019-nCoV/hcp/clinical-criteria.html. Accessed March 5, 2020.
World Health Organization. Global Surveillance for human infection with novel coronavirus (2019-nCoV). 2020.
Available at: https://www. who.int/publications-detail/global-surveillance-for-human-infection-with-novel-coronavirus(2019-ncov) and
https://www.ecdc.europa.eu/en/case-definition-and-european-surveillance-human-infection-novelcoronavirus-2019-ncov. Accessed March 5, 2020.
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020.
Chen H, Guo J, Wang C, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. The Lancet. 2020:1–7. [Epub ahead of print]
Memish ZA, Al-Tawfiq JA, Makhdoom HQ, et al. Respiratory tract sam-ples, viral load, and genome fraction yield in patients with Middle East respiratory syndrome. J Infect Dis. 2014;210:1590–1594.
Hung IF, Cheng VC, Wu AK, et al. Viral loads in clinical specimens and SARS manifestations. Emerg Infect Dis. 2004;10:1550–1557.
Che XY, Qiu LW, Liao ZY, et al. Antigenic cross-reactivity between severe acute respiratory syndrome-associated coronavirus and human coronavi-ruses 229E and OC43. J Infect Dis. 2005;191:2033–2037.
Stockman LJ, Bellamy R, Garner P. SARS: systematic review of treatment effects. PLoS Med. 2006;3:e343.
Cheng VC, Chan JF, To KK, et al. Clinical management and infection con-trol of SARS: lessons learned. Antiviral Res. 2013;100:407–419.
Chan KS, Lai ST, Chu CM, et al. Treatment of severe acute respiratory syn-drome with lopinavir/ritonavir: a multicentre retrospective matched cohort study. Hong Kong Med J. 2003;9:399–406.
Chu CM, Cheng VC, Hung IF, et al; HKU/UCH SARS Study Group. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clini-cal findings. Thorax. 2004;59:252–256.
Ng PC, Lam CW, Li AM, et al. Inflammatory cytokine profile in children with severe acute respiratory syndrome. Pediatrics. 2004;113(1 pt 1):e7– e14.
Omrani AS, Saad MM, Baig K, et al. Ribavirin and interferon alfa-2a for severe Middle East respiratory syndrome coronavirus infection: a retro-spective cohort study. Lancet Infect Dis. 2014;14:1090–1095.
Shalhoub S, Farahat F, Al-Jiffri A, et al. IFN-α2a or IFN-β1a in combina-tion with ribavirin to treat Middle East respiratory syndrome coronavirus pneumonia: a retrospective study. J Antimicrob Chemother. 2015;70:2129– 2132.
Al-Tawfiq JA, Momattin H, Dib J, et al. Ribavirin and interferon therapy in patients infected with the Middle East respiratory syndrome coronavirus: an observational study. Int J Infect Dis. 2014;20:42–46.
Chan JF, Chan KH, Kao RY, et al. Broad-spectrum antivirals for the emerg-ing Middle East respiratory syndrome coronavirus. J Infect. 2013;67:606– 616.
Chan JF, Yao Y, Yeung ML, et al. Treatment with lopinavir/ritonavir or interferon-β1b improves outcome of MERSCoV infection in a nonhuman primate model of common marmoset. J Infect Dis. 2015;212:1904–1913.
AlGhamdi M, Mushtaq F, Awn N, et al. MERS CoV infection in two renal transplant recipients: case report. Am J Transplant. 2015;15:1101–1104.
Centers for Disease Control and Prevention CfDCaP. Interim clinical guidance for management of patients with confirmed 2019 novel coro-navirus (2019-nCoV) infection. 2020. Available at: https://www.cdc.gov/ coronavirus/2019ncov/hcp/clinical-guidance-management-patients.html. Accessed February 21, 2010.
Zumla A, Chan JF, Azhar EI, et al. Coronaviruses – drug discovery and therapeutic options. Nat Rev Drug Discov. 2016;15:327–347.
Cheng Y, Wong R, Soo YO, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis. 2005;24:44– 46.
Jiang L, Wang N, Zuo T, et al. Potent neutralization of MERS-CoV by human neutralizing monoclonal antibodies to the viral spike glycoprotein. Sci Transl Med. 2014;6:234ra59.
Ying T, Du L, Ju TW, et al. Exceptionally potent neutralization of Middle East respiratory syndrome coronavirus by human monoclonal antibodies. J Virol. 2014;88:7796–7805.
Tang XC, Agnihothram SS, Jiao Y, et al. Identification of human neutral-izing antibodies against MERS-CoV and their role in virus adaptive evolu-tion. Proc Natl Acad Sci U S A. 2014;111:E2018–E2026.
Channappanavar R, Lu L, Xia S, et al. Protective effect of intrana-sal regimens containing peptidic Middle East respiratory syndrome coronavirus fusion inhibitor against MERS-CoV infection. J Infect Dis. 2015;212:1894–1903.
Soo YO, Cheng Y, Wong R, et al. Retrospective comparison of convalescent plasma with continuing high-dose methylprednisolone treatment in SARS patients. Clin Microbiol Infect. 2004;10:676–678.
Pang H, Liu Y, Han X, et al. Protective humoral responses to severe acute respiratory syndrome-associated coronavirus: implications for the design of an effective protein-based vaccine. J Gen Virol. 2004;85(pt 10):3109–3113.
Barton C, Kouokam JC, Lasnik AB, et al. Activity of and effect of subcutaneous treatment with the broad -spectrum antiviral lectin grif-fithsin in two laboratory rodent models. Antimicrob Agents Chemother. 2014;58:120–127.
Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426:450–454.
Raj VS, Mou H, Smits SL, et al. Dipeptidyl peptidase 4 is a functional recep-tor for the emerging human coronavirus-EMC. Nature. 2013;495:251–254.
Huang X, Dong W, Milewska A, et al. Human coronavirus HKU1 spike protein uses O-acetylated sialic acid as an attachment receptor determi-nant and employs hemagglutinin-esterase protein as a receptor-destroying enzyme. J Virol. 2015;89:7202–7213.
Vijgen L, Keyaerts E, Zlateva K, et al. Identification of six new polymor-phisms in the human coronavirus 229E receptor gene (aminopeptidase N/ CD13). Int J Infect Dis. 2004;8:217–222.
Shirato K, Kawase M, Matsuyama S. Middle East respiratory syndrome coronavirus infection mediated by the transmembrane serine protease TMPRSS2. J Virol. 2013;87:12552–12561.
Zhou Y, Vedantham P, Lu K, et al. Protease inhibitors targeting coronavirus and filovirus entry. Antiviral Res. 2015;116:76–84.
Kawase M, Shirato K, van der Hoek L, et al. Simultaneous treatment of human bronchial epithelial cells with serine and cysteine protease inhibitors prevents severe acute respiratory syndrome coronavirus entry. J Virol. 2012;86:6537– 6545.
Báez-Santos YM, St John SE, Mesecar AD. The SARS-coronavirus papain-like protease: structure, function and inhibition by designed antiviral com-pounds. Antiviral Res. 2015;115:21–38.
Ratia K, Pegan S, Takayama J, et al. A noncovalent class of papain-like pro-tease/deubiquitinase inhibitors blocks SARS virus replication. Proc Natl Acad Sci U S A. 2008;105:16119–16124.
Lee H, Lei H, Santarsiero BD, et al. Inhibitor recognition specificity of MERS-CoV papain-like protease may differ from that of SARS-CoV. ACS Chem Biol. 2015;10:1456–1465.
Savarino A, Di Trani L, Donatelli I, et al. New insights into the antiviral effects of chloroquine. Lancet Infect Dis. 2006;6:67–69.
Vincent MJ, Bergeron E, Benjannet S, et al. Chloroquine is a potent inhibi-tor of SARS coronavirus infection and spread. Virol J. 2005;2:69.
Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020:269–271. [Epub ahead of print]
Warren TK, Wells J, Panchal RG, et al. Protection against filovirus dis-eases by a novel broad-spectrum nucleoside analogue BCX4430. Nature. 2014;508:402–405.
Adedeji AO, Singh K, Kassim A, et al. Evaluation of SSYA10-001 as a replication inhibitor of severe acute respiratory syndrome, mouse hepatitis, and Middle East respiratory syndrome coronaviruses. Antimicrob Agents Chemother. 2014;58:4894–4898.
Lundin A, Dijkman R, Bergström T, et al. Targeting membrane-bound viral RNA synthesis reveals potent inhibition of diverse coronaviruses including the Middle East respiratory syndrome virus. PLoS Pathog. 2014;10:e1004166.
Rappe JCF, de Wilde A, Di H, et al. Antiviral activity of K22 against mem-bers of the order Nidovirales. Virus Res. 2018;246:28–34.
Rider TH, Zook CE, Boettcher TL, et al. Broad-spectrum antiviral thera-peutics. PLoS One. 2011;6:e22572.
He Y, Li J, Du L, et al. Identification and characterization of novel neutral-izing epitopes in the receptor-binding domain of SARS-CoV spike protein: revealing the critical antigenic determinants in inactivated SARS-CoV vac-cine. Vaccine. 2006;24:5498–5508.
Su S, Wong G, Shi W, et al. Epidemiology, genetic recombination, and pathogenesis of coronaviruses. Trends Microbiol. 2016;24:490–502.
Kim DW, Kim YJ, Park SH, et al. Variations in spike glycoprotein gene of MERS-CoV, South Korea, 2015. Emerg Infect Dis. 2016;22:100–104.
Sohrab SS, Azhar EI. Genetic diversity of MERS-CoV spike protein gene in Saudi Arabia. J Infect Public Health. 2019. [Epub ahead of print]
He Y, Zhou Y, Siddiqui P, et al. Inactivated SARS-CoV vaccine elicits high titers of spike protein-specific antibodies that block receptor binding and virus entry. Biochem Biophys Res Commun. 2004;325:445–452.
Hashem AM, Algaissi A, Agrawal AS, et al. A highly immunogenic, protec-tive, and safe adenovirus-based vaccine expressing Middle East respiratory syndrome coronavirus S1-CD40L fusion protein in a transgenic human dipeptidyl peptidase 4 mouse model. J Infect Dis. 2019;220:1558–1567.
Czub M, Weingartl H, Czub S, et al. Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets. Vaccine. 2005;23:2273–2279.
DeDiego ML, Alvarez E, Almazán F, et al. A severe acute respiratory syn-drome coronavirus that lacks the E gene is attenuated in vitro and in vivo. J Virol. 2007;81:1701–1713.
Lamirande EW, DeDiego ML, Roberts A, et al. A live attenuated severe acute respiratory syndrome coronavirus is immunogenic and efficacious in golden Syrian hamsters. J Virol. 2008;82:7721–7724.
Dediego ML, Pewe L, Alvarez E, et al. Pathogenicity of severe acute respir-atory coronavirus deletion mutants in hACE-2 transgenic mice. Virology. 2008;376:379–389.
Yount B, Roberts RS, Sims AC, et al. Severe acute respiratory syndrome coronavirus group-specific open reading frames encode nonessential func-tions for replication in cell cultures and mice. J Virol. 2005;79:14909– 14922.
de Haan CA, Masters PS, Shen X, et al. The group-specific murine coro-navirus genes are not essential, but their deletion, by reverse genetics, is attenuating in the natural host. Virology. 2002;296:177–189.
Almazán F, DeDiego ML, Sola I, et al. Engineering a replication-compe-tent, propagation-defective Middle East respiratory syndrome coronavirus as a vaccine candidate. mBio. 2013;4:e00650–e00613.
Menachery VD, Gralinski LE, Mitchell HD, et al. Middle East respiratory syndrome coronavirus nonstructural protein 16 is necessary for interferon resistance and viral pathogenesis. mSphere. 2017;2:e00346–e00417.
Xiong S, Wang YF, Zhang MY, et al. Immunogenicity of SARS inactivated vaccine in BALB/c mice. Immunol Lett. 2004;95:139–143.
Takasuka N, Fujii H, Takahashi Y, et al. A subcutaneously injected UV-inactivated SARS coronavirus vaccine elicits systemic humoral immu-nity in mice. Int Immunol. 2004;16:1423–1430.
Spruth M, Kistner O, Savidis-Dacho H, et al. A double-inactivated whole virus candidate SARS coronavirus vaccine stimulates neutralising and pro-tective antibody responses. Vaccine. 2006;24:652–661.
Deng Y, Lan J, Bao L, et al. Enhanced protection in mice induced by immu-nization with inactivated whole viruses compare to spike protein of Middle East respiratory syndrome coronavirus. Emerg Microbes Infect. 2018;7:60.
Agrawal AS, Tao X, Algaissi A, et al. Immunization with inactivated Middle East respiratory syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus. Hum Vaccin Immunother. 2016;12:2351–2356.
Lin JT, Zhang JS, Su N, et al. Safety and immunogenicity from a phase I trial of inactivated severe acute respiratory syndrome coronavirus vaccine. Antivir Ther. 2007;12:1107–1113.
Zhou J, Wang W, Zhong Q, et al. Immunogenicity, safety, and protective efficacy of an inactivated SARS-associated coronavirus vaccine in rhesus monkeys. Vaccine. 2005;23:3202–3209.
Jaume M, Yip MS, Kam YW, et al. SARS CoV subunit vaccine: anti-body-mediated neutralisation and enhancement. Hong Kong Med J. 2012;18(suppl 2):31–36.
Du L, He Y, Zhou Y, et al. The spike protein of SARS-CoV–a target for vaccine and therapeutic development. Nat Rev Microbiol. 2009;7:226–236.
Adney DR, Wang L, van Doremalen N, et al. Efficacy of an adjuvanted Middle East respiratory syndrome coronavirus spike protein vaccine in dromedary camels and alpacas. Viruses. 2019;11:E212.
Wang Y, Tai W, Yang J, et al. Receptor-binding domain of MERS-CoV with optimal immunogen dosage and immunization interval protects human transgenic mice from MERS-CoV infection. Hum Vaccin Immunother. 2017;13:1615–1624.
Tai W, Zhao G, Sun S, et al. A recombinant receptor-binding domain of MERS-CoV in trimeric form protects human dipeptidyl peptidase 4 (hDPP4) transgenic mice from MERS-CoV infection. Virology. 2016;499:375–382.
Ma C, Li Y, Wang L, et al. Intranasal vaccination with recombinant receptor-binding domain of MERS-CoV spike protein induces much stronger local mucosal immune responses than subcutaneous immuniza-tion: implication for designing novel mucosal MERS vaccines. Vaccine. 2014;32:2100–2108.
Lan J, Yao Y, Deng Y, et al. Recombinant receptor binding domain pro-tein induces partial protective immunity in rhesus macaques against Middle East respiratory syndrome coronavirus challenge. EBioMedicine. 2015;2:1438–1446.
Jiaming L, Yanfeng Y, Yao D, et al. The recombinant N-terminal domain of spike proteins is a potential vaccine against Middle East respiratory syn-drome coronavirus (MERS-CoV) infection. Vaccine. 2017;35:10–18.
Zhang N, Channappanavar R, Ma C, et al. Identification of an ideal adjuvant for receptor-binding domain-based subunit vaccines against Middle East respiratory syndrome coronavirus. Cell Mol Immunol. 2016;13:180–190.
Chen WH, Du L, Chag SM, et al. Yeast-expressed recombinant protein of the receptor-binding domain in SARSCoV spike protein with degly-cosylated forms as a SARS vaccine candidate. Hum Vaccin Immunother. 2014;10:648–658.
Zakhartchouk AN, Viswanathan S, Mahony JB, et al. Severe acute respira-tory syndrome coronavirus nucleocapsid protein expressed by an adeno-virus vector is phosphorylated and immunogenic in mice. J Gen Virol. 2005;86(pt 1):211– 215.
Gao W, Tamin A, Soloff A, et al. Effects of a SARS-associated coronavirus vaccine in monkeys. Lancet. 2003;362:1895–1896.
Munster VJ, Wells D, Lambe T, et al. Protective efficacy of a novel simian adenovirus vaccine against lethal MERSCoV challenge in a transgenic human DPP4 mouse model. NPJ Vaccines. 2017;2:28.
Rocha CD, Caetano BC, Machado AV, et al. Recombinant viruses as tools to induce protective cellular immunity against infectious diseases. Int Microbiol. 2004;7:83–94.
Hill, A. Safety and immunogenicity of a candidate MERS-CoV vaccine (MERS001). 2018. Available at: https://clinicaltrials.gov/ct2/show/study/ NCT03399578. Accessed February 22, 2020.
See RH, Zakhartchouk AN, Petric M, et al. Comparative evaluation of two severe acute respiratory syndrome (SARS) vaccine candidates in mice challenged with SARS coronavirus. J Gen Virol. 2006;87(pt 3):641–650.
Bisht H, Roberts A, Vogel L, et al. Severe acute respiratory syndrome coro-navirus spike protein expressed by attenuated vaccinia virus protectively immunizes mice. Proc Natl Acad Sci U S A. 2004;101:6641–6646.
Buchholz UJ, Bukreyev A, Yang L, et al. Contributions of the structural proteins of severe acute respiratory syndrome coronavirus to protective immunity. Proc Natl Acad Sci U S A. 2004;101:9804–9809.
Bukreyev A, Lamirande EW, Buchholz UJ, et al. Mucosal immunisation of African green monkeys (Cercopithecus aethiops) with an attenuated parainfluenza virus expressing the SARS coronavirus spike protein for the prevention of SARS. Lancet. 2004;363:2122–2127.
Liniger M, Zuniga A, Tamin A, et al. Induction of neutralising antibodies and cellular immune responses against SARS coronavirus by recombinant measles viruses. Vaccine. 2008;26:2164–2174.
Faber M, Lamirande EW, Roberts A, et al. A single immunization with a rhabdovirus -based vector expressing severe acute respiratory syndrome coronavirus (SARS-CoV) S protein results in the production of high levels of SARSCoV-neutralizing antibodies. J Gen Virol. 2005;86(pt 5):1435–1440.
Luo F, Feng Y, Liu M, et al. Type IVB pilus operon promoter controlling expression of the severe acute respiratory syndrome-associated coro-navirus nucleocapsid gene in Salmonella enterica Serovar Typhi elicits full immune response by intranasal vaccination. Clin Vaccine Immunol. 2007;14:990–997.
Wang L, Shi W, Joyce MG, et al. Evaluation of candidate vaccine approaches for MERS-CoV. Nat Commun. 2015;6:7712.
Muthumani K, Falzarano D, Reuschel EL, et al. A synthetic consensus anti-spike protein DNA vaccine induces protective immunity against Middle East respiratory syndrome coronavirus in nonhuman primates. Sci Transl Med. 2015;7:301ra132.
236.Modjarrad, K. Phase I, open label dose ranging safety study of GLS-5300 in healthy volunteers. 2016. Available at:
https://clinicaltrials.gov/ct2/ show/NCT02670187?term=GLS-5300. Accessed February 22, 2020.
Maslow, J. Evaluate the safety, tolerability and immunogenicity study of GLS-5300 in healthy volunteers. 2018. Available at: https://clinicaltrials. gov/ct2/show/NCT03721718. Accessed February 22, 2020.
Addo, M. Safety, tolerability and immunogenicity of vaccine candidate MVA-MERS-S. 2018. Available at: https://clinicaltrials.gov/ct2/show/ NCT03615911#outcomemeasures. Accessed February 22, 2020.
Bin SY, Heo JY, Song MS, et al. Environmental contamination and viral shedding in MERS patients during MERSCoV outbreak in South Korea. Clin Infect Dis. 2016;62:755–760.
Ng PC, So KW, Leung TF, et al. Infection control for SARS in a tertiary neonatal centre. Arch Dis Child Fetal Neonatal Ed. 2003;88:F405–F409.
Leung TF, Ng PC, Cheng FW, et al. Infection control for SARS in a tertiary paediatric centre in Hong Kong. J Hosp Infect. 2004;56:215–222.
Dowell SF, Simmerman JM, Erdman DD, et al. Severe acute res-piratory syndrome coronavirus on hospital surfaces. Clin Infect Dis. 2004;39:652–657.
Otter JA, Donskey C, Yezli S, et al. Transmission of SARS and MERS coronaviruses and influenza virus in healthcare settings: the possible role of dry surface contamination. J Hosp Infect. 2016;92:235–250.
Kampf G, Todt D, Pfaender S, et al. Persistence of coronaviruses on inani-mate surfaces and its inactivation with biocidal agents. J Hosp Infect. 2020:246-251. [Epub ahead of print]
Ijaz MK, Brunner AH, Sattar SA, et al. Survival characteristics of airborne human coronavirus 229E. J Gen Virol. 1985;66(pt 12):2743–2748.
Bi Q, Wu Y, Mei S, et al. Epidemiology and transmission of COVID-19 in Shenzhen China: analysis of 391 cases and 1,286 of their close contacts. medRxiv 2020. Available at: https://doi.org/10.1101/2020.03.03.20028423. Accessed March 4, 2020.