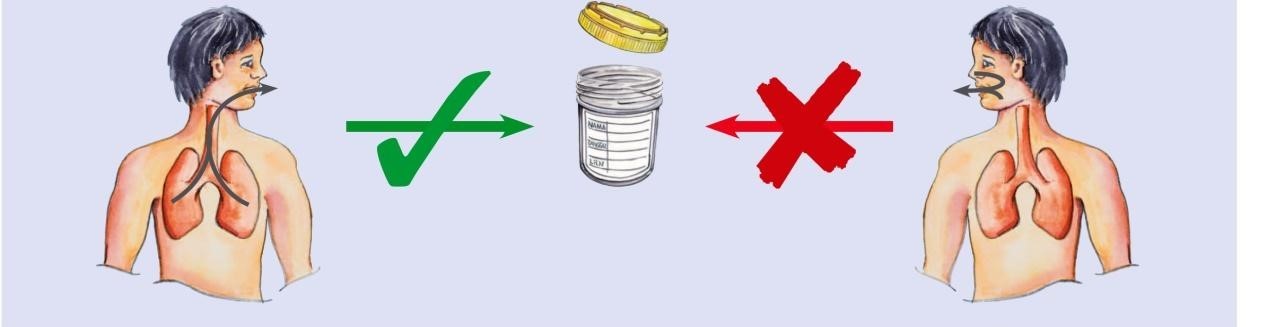
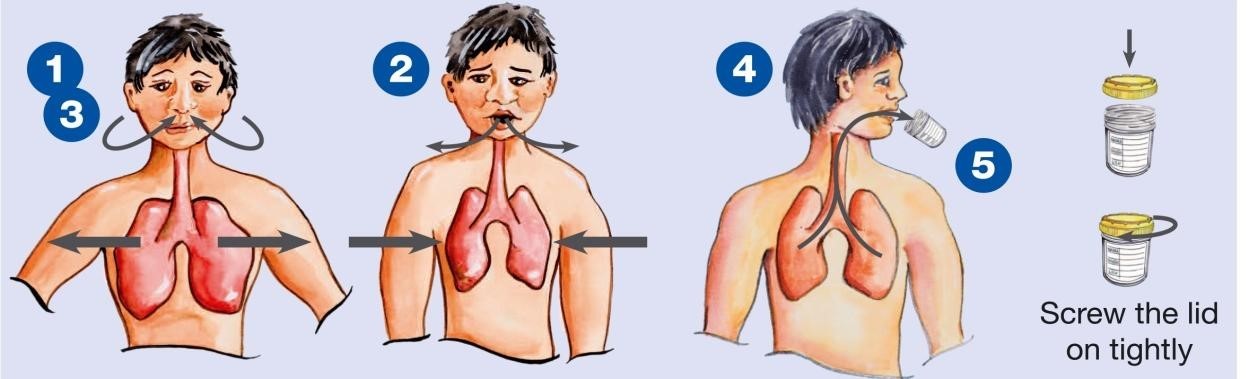
Phụ lục 1 – hướng dẫn lấy đờm làm xét nghiệm
Đờm lấy từ tổn thương trong phổi Không khạc đờm từ mũi hoặc miệng
Hít vào thật sâu
Thở ra thật mạnh
Hít vào thật sâu, thở ra thật mạnh (lần 2)
Hít sâu, thở mạnh lần 3, ho khạc thật sâu từ trong phổi
Đặt cốc đờm (đã mở nắp) vào sát miệng, nhổ đờm vào đáy cốc. Vặn chặt nắp.
Nộp cốc đờm và phiếu xét nghiệm cho người hướng dẫn (NVYT). Không đặt cốc đờm lên phiếu xét nghiệm.
Lưu ý: Nếu lượng đờm quá ít (

|
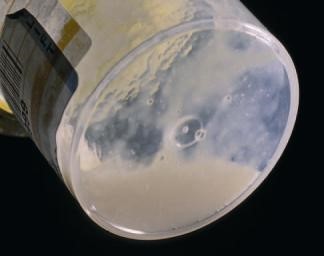
Bệnh phẩm đờm đạt tiêu chuẩn |
Bệnh phẩm đờm đạt tiêu chuẩn |
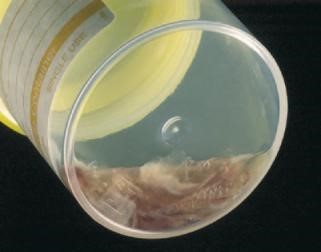
Bệnh phẩm đờm không đạt tiêu chuẩn |
Đờm đạt tiêu chuẩn sẽ chẩn đoán bệnh chính xác!
Phụ lục 2
thường…) còn tồn tại. Không sử dụng nhóm Fluoquinolone vì nhóm thuốc này có tác dụng với vi khuẩn lao do vậy không phân biệt được giữa viêm do lao hay vi khuẩn khác. Nếu đã quyết định điều trị lao cần điều trị hết công thức và đủ thời gian tuân thủ nguyên tắc có kiểm soát trực tiếp.
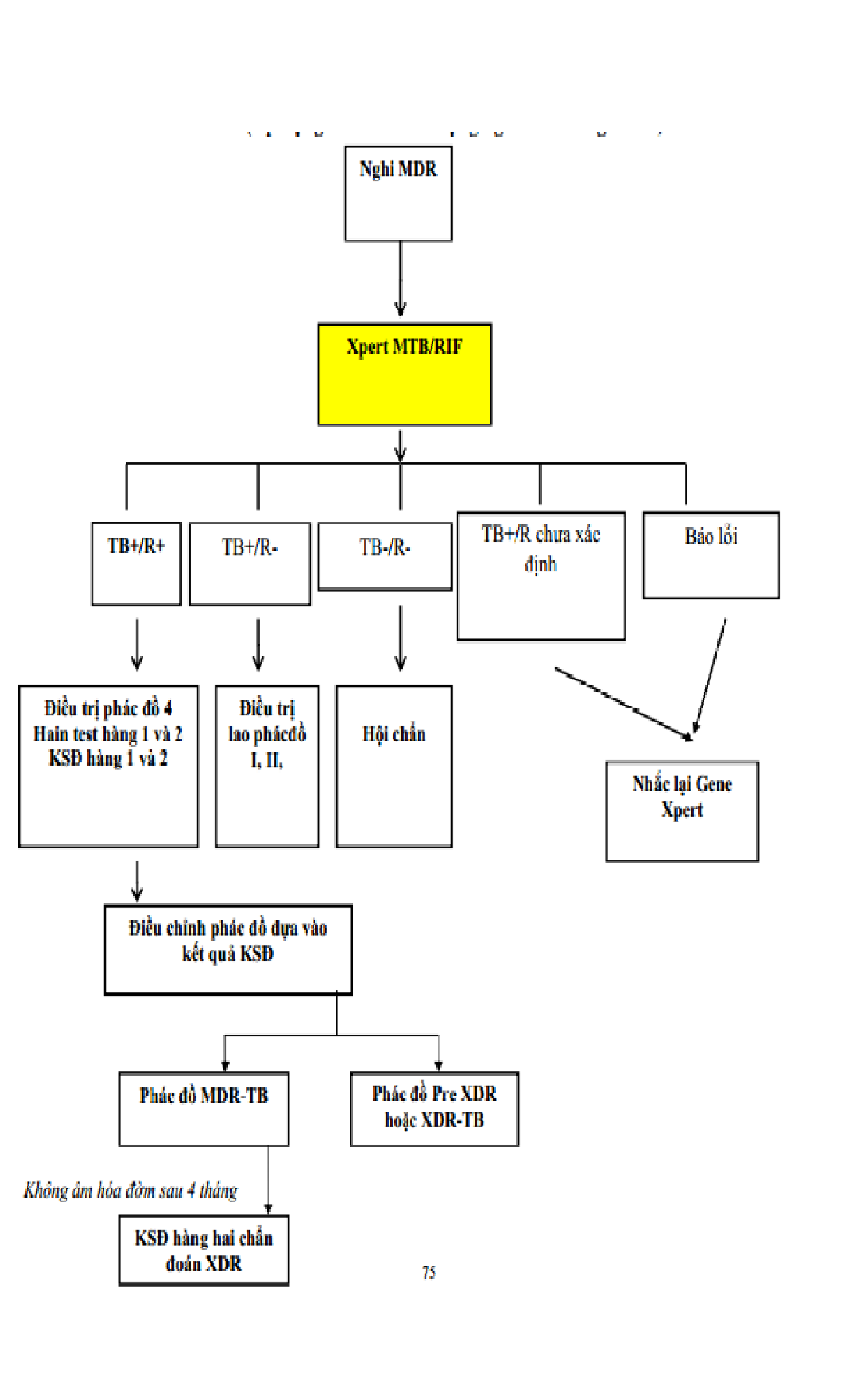
Phụ lục 3 – sơ đồ chẩn đoán lao kháng thuốc
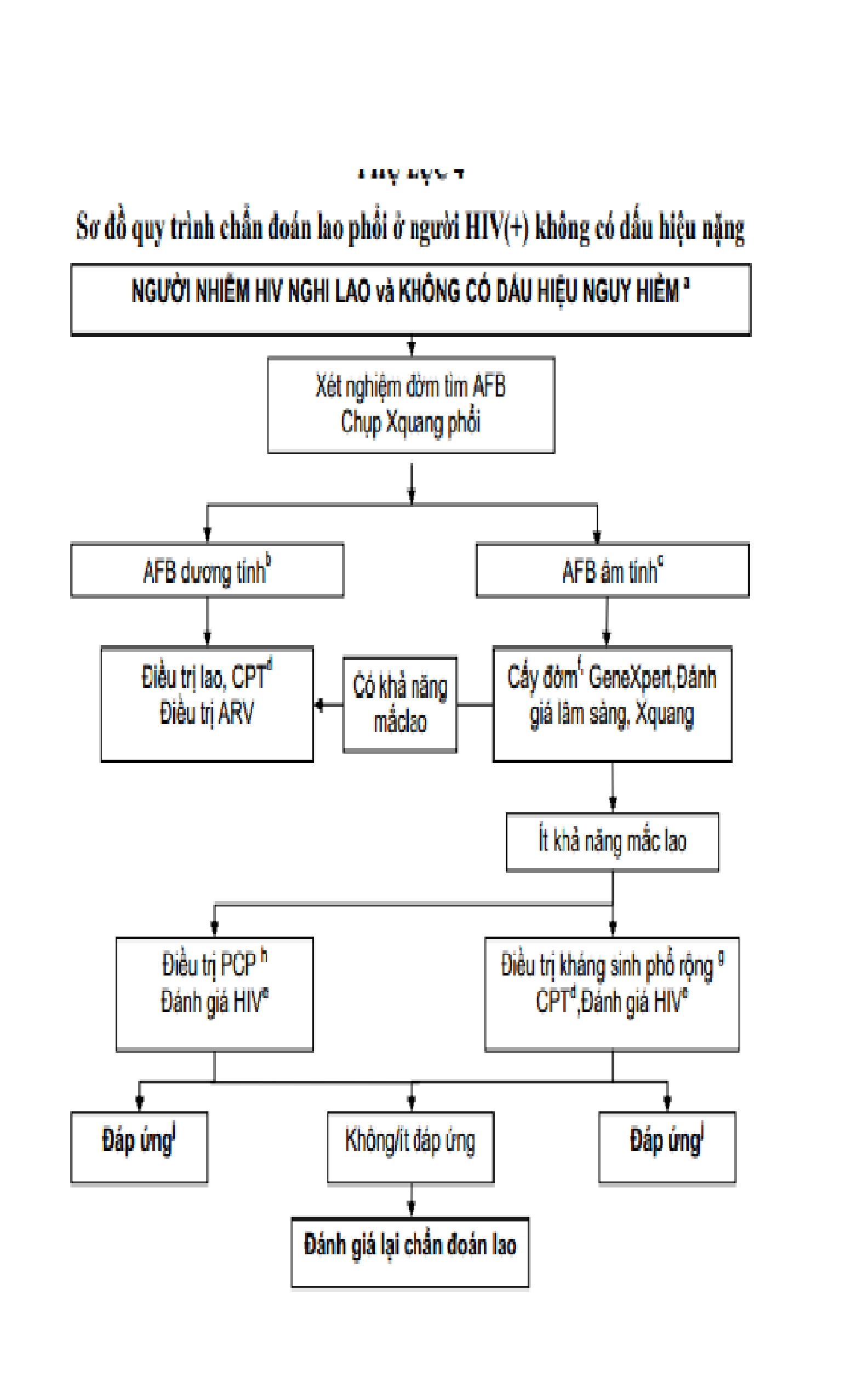
Phụ lục 4
Chú thích
Người bệnh đến không có dấu hiệu nặng (tự đi lại được, không khó thở, không sốt cao, mạch dưới 120/phút).
Lao phổi AFB(+) khi có ít nhất một lần dương tính, c AFB âm tính khi có ≥ 2 mẫu đờm AFB(-). d CPT: Điều trị dự phòng bằng Cotrimoxazol. e Đánh giá HIV bao gồm: phân loại lâm sàng, xét nghiệm đếm CD4 và xem xét điều trị HIV/AIDS (bao gồm cả ART).
Chỉ một số nơi có điều kiện nuôi cấy. Phim chụp X-quang đã sẵn có từ lần khám đầu tiên, nếu có phim chụp các lần trước đây để so sánh càng tốt. Người bệnh được đánh giá kỹ về lâm sàng và X-quang phổi để chẩn đoán xác định hoặc loại trừ.
Kháng sinh phổ rộng (trừ nhóm Quinolon) h PCP: Viêm phổi do Pneumocystis carinii còn gọi là Pneumocystis jirovec
Đánh giá lại theo quy trình nếu triệu chứng tái xuất hiện.
Phụ lục 5 -sơ đồ quy trình chẩn đoán lao phổi ở người hiv (+) có dấu hiệu nặng
Dấu hiệu nguy hiểm bao gồm một trong các dấu hiệu sau: nhịp thở >30/phút, sốt >39oC, mạch >120/phút và không tự đi lại được.
Kháng sinh phổ rộng trừ nhóm Quinolon.
Các xét nghiệm này cần được thực hiện sớm để tăng tốc độ chẩn đoán.
AFB dương tính được xác định khi có ít nhất một lần dương tính, AFB âm tính – khi có 2 hay nhiều hơn các mẫu AFB âm tính.
Lượng giá lại lao bao gồm xét nghiệm AFB và lượng giá lâm sàng.
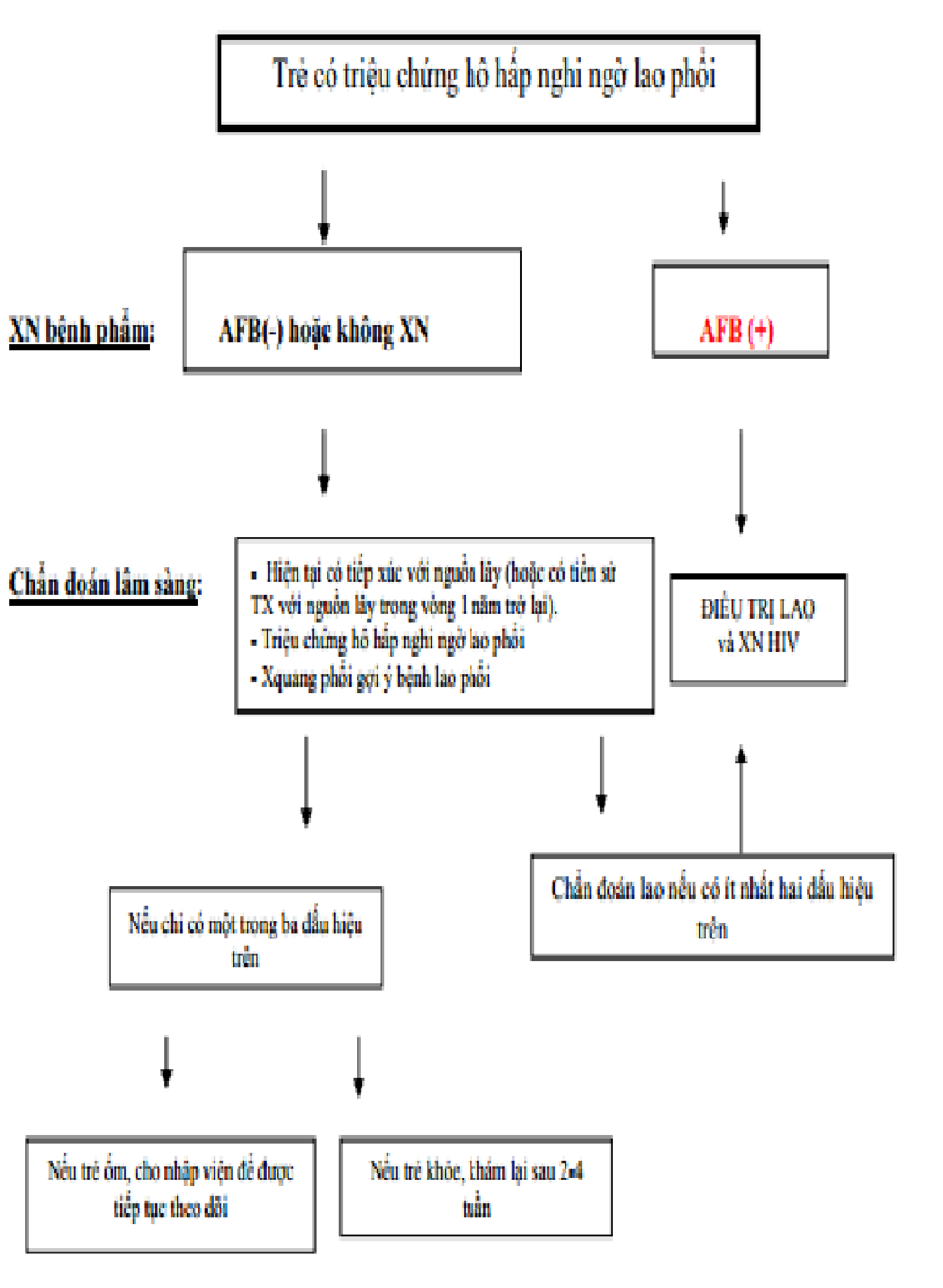
Phụ lục 6 -sơ đồ hướng dẫn quy trình chẩn đoán bệnh lao phổi trẻ em
Tuyến quận/huyện có thể áp dụng sơ đồ này để chẩn đoán bệnh lao trẻ em
Phụ lục 7 -sơ đồ hướng dẫn quy trình chẩn đoán
Các dấu hiệu cần nhập viên
Các thể lao phổi và lao ngoài phổi nặng (Lao kê, lao màng não, lao màng tim…).
Suy dinh dưỡng nặng.
Các bệnh kết hợp khác như thiếu máu nặng, viêm gan, suy thân.
Suy hô hấp, hôn mê.
Cần xem xét chuyển người bệnh nếu:
Không chắc chắn với chẩn đoán,.
Cần được chăm sóc liên quan đến HIV.
Người bệnh nặng lên hoặc có biến chứng do lao hoặc do thuốc.
Phụ lục 8 -liều lượng thuốc chống lao
Bảng 1. Liều lựợng các thuốc chống lao theo cân nặng
|
Loại Thuốc |
Hàng ngày cho người lớn |
Hàng ngày cho trẻ em (*) |
|
Liều lượng (khoảng cách liều) tính theo mg/kg cân nặng |
Liều lượng (khoảng cách liều) tính theo mg/kg cân nặng |
|
|
Isoniazid |
5 (4-6) Tối đa 300mg |
10 (10–15) Tối đa 300mg |
|
Rifampicin |
10 (8-12) |
15 (10–20) |
|
Pyrazinamid |
25 (20-30) |
35 (30–40) |
|
Ethambutol |
15 (15-20) |
20 (15–25) |
|
Streptomycin |
15 (12-18) |
|
(*) Trẻ em có cân nặng từ 25kg trở lên dùng thuốc theo thang cân nặng của người lớn
Bảng 2. Số lƯợng viên, lọ thuốc đơn lẻ dùng hàng ngày cho ngƯời lớn theo cân nặng
|
|
Cân nặng của người bệnh (kg) |
|||
|
25-39 |
40-54 |
55-70 |
>70 |
|
|
Giai đoạn tấn công hàng ngày |
Số lượng viên hoặc lọ |
|
||
|
H 100 mg (viên) |
2 |
3 |
3 |
3 |
|
R 150 mg (viên) |
2 |
3 |
4 |
5 |
|
Z 400 mg (viên) |
2 |
3 |
4 |
5 |
|
E 400 mg (viên) |
2 |
2 |
3 |
4 |
|
S 1g (lọ) |
0,5 |
0,75 |
1 |
1 |
|
Giai đoạn duy trì hàng ngày |
|
|||
|
H 100mg (viên) |
2 |
3 |
3 |
3 |
|
R 150 mg (viên) |
2 |
3 |
4 |
5 |
|
E 400 mg(viên) |
2 |
2 |
3 |
4 |
|
Giai đoạn duy trì tuần 3 lần |
|
|||
|
H 300 mg(viên) |
1 |
2 |
2 |
3 |
|
R 150 mg(viên) |
2 |
3 |
4 |
5 |
|
E 400mg(viên) |
2 |
4 |
6 |
6 |
Bảng 3. Số viên hỗn hợp liều cố định dùng hàng ngày cho ngƯời lớn theo cân nặng
|
Thuốc hỗn hợp liều cố định |
|
Cân nặng (kg) |
|
|
|
|
|
|
|
|
|
|
25-39 kg |
40-54 kg |
55-70 kg |
>70 kg |
|
Giai đoạn tấn công hàng ngày |
|
Số viên |
|
|
|
HRZE (viên) (75mg+150mg+400mg+275mg) HRZ (viên) (75mg+150mg+400mg) |
2
2
|
3
3
|
4
4
|
5
5
|
|
Giai đoạn duy trì hàng ngày |
|
|
|
|
|
HR (75mg+150mg), viên HE (150mg + 400mg), viên |
2 1,5 |
3 2 |
4 3 |
5 3 |
|
Giai đoạn duy trì – tuần 3 lần |
|
|
|
|
|
HR (150mg + 100mg) (viên) HR (150mg + 150mg) (viên) |
2 |
3 |
4 |
5 |
Phụ lục 9 -phân loại mức độ nghiêm trọng và hướng xử trí tác dụng không mong muốn của thuốc lao
|
ADR |
Thông số cận lâm sàng |
Mức độ 1 ( nhẹ )
Các biểu hiện thoáng qua hoặc nhẹ, hoạt động của người bệnh không bị hạn chế, không đòi hỏi phải can thiệp hoặc điều trị bằng thuốc |
Mức độ 2 (vừa)
Hoạt động của người bệnh có bị hạn chế từ nhẹ đến trung bình, có thể cần đến một vài sự trợ giúp, không yêu cầu can thiệp điều trị, hoặc can thiệp và điều trị ở mức tối thiểu |
Mức độ 3 (nặng)
Hoạt động của người bệnh bị hạn chế đáng kể, thường cần đến sự trợ giúp, đòi hỏi can thiệp hoặc điều trị bằng thuốc, có thể phải nhập viện |
Mức độ 4 (nặng đe tính mạng) Giới hạn hoạt động của người bệnh rất nghiêm trọng, có sự hỗ trợ đáng kể can thiệp y tế / liệu pháp điều trị đáng kể, yêu cầu phải nhậ p viện hoặc điều trị cấp cứu, tích cực. |
|
Giảm tiểu cầu, thiếu máu tán huyết, giảm bạch cầu, rối loạn đông máu |
Hgb |
80-94 g/l |
70-79 g/l |
65-69g/l |
|
|
Giảm tiểu cầu |
100.000 – 124.999/mm |
50.000 – 99.999/mm |
25.000 – 49.999/mm |
||
|
Giảm bạch cầu |
2.000 – 2.500/mm |
1.500 – 1.999/mm |
1.000 – 1.400/mm |
||
|
Giảm fibrinogen |
1 -2 g/l |
0,75 – 0,99 g/l |
0,5 – 0,74 g/l |
||
|
Giảm Prothrombin (PT) |
1,1 – 1,25 lần bình thường |
1,26- 1,5 lần bình thường |
1,51 – 3,0 lần bình thường |
>3,0 lần bình thường |
|
|
Tăng AST |
AST (SGOT) |
1,25-2,5 lần giới hạn bình thường |
>2,5-5, 0 lần giới hạn bình thường |
>5,0-10,0 lần giới hạn bình thường |
>10,0 lần giới hạn bình thường |
|
Tăng ALT |
ALT (SGPT) |
1,25-2,5 lần giới hạn bình thường |
>2,5-5, 0 lần giới hạn bình thường |
>5,0-10,0 lần giới hạn bình thường |
>10,0 lần giới hạn bình thường |
|
Tăng GGT |
GGT |
1,25-2,5 lần giới hạn bình thường |
>2,5-5, 0 lần giới hạn bình thường |
>5,0-10,0 lần giới hạn bình thường |
>10,0 lần giới hạn bình thường |
|
Tăng bilirubin huyết thanh |
Bilirubin |
>1,0-1,5 lần giới hạn bình thường |
>1,5-2,5 lần giới hạn bình thường |
>2,5-5 lần giới hạn bình thường |
>5,0 lần giới hạn bình thường |
|
Tăng creatinine |
Creatinine |
>1,0-1,5 lần giới hạn bình thường |
>1,5-3,0 lần giới hạn bình thường |
>3,0-6,0 lần giới hạn bình thường |
>6,0 lần giới hạn bình thường |
|
Hạ Kali máu |
Kali |
3,0-3,4 meq/l hoặc 3,0-3,4 mmol/l |
2,5-2,9 meq/l hoặc 2,5-2,9 mmol/l |
2,0-2,4 meq/l hoặc 2,0-2,4 mmol/l |
|
|
ADR |
Thông số lâm sàng |
Mức độ 1 ( nhẹ )
|
Mức độ 2 (vừa)
|
Mức độ 3 (nặng)
|
Mức độ 4 (nặng đe tính mạng)
|
|
Tiêu hóa |
Buồn nôn |
Nhẹ hoặc thoáng qua, duy trì lượng nước vào hợp lý |
Khó chịu vừa phải, lượng nước vào giảm đáng kể, hạn chế một số hoạt động |
Lượng nước đầu vào không đáng kể, yêu cầu truyền dịch tĩnh mạch |
Yêu cầu nhập viện |
|
Nôn |
1 lần trong 24h |
2-5 lần trong 24h |
>6 lần trong 24h hoặc cần truyền dịch tĩnh mạch |
Hậu quả sinh lý yêu cầu nhập viện hoặc yêu cầu dinh dưỡng ngoài ruột |
|
|
Tiêu chảy |
Nhẹ hoặc thoáng qua: 34 lần, phân lỏng/ngày hoặc tiêu chảy nhẹ kéo dài |
Vừa phải hoặc dai dẳng: 5-7 lần, phân lỏng/ngày hoặc tiêu chảy kéo dài trên 1 tuần |
>7 lần, phân lỏng/ngày hoặc tiêu chảy máu hoặc hạ huyết áp tư thế hoặc mất cân bằng điện giải hoặc yêu cầu truyền dịch tĩnh mạch > 2 lần |
Sốc hạ huyết áp hoặc hậu quả sinh lý, yêu cầu nhập viện |
|
|
Tâm thần |
Bệnh tâm thần |
Lo âu nhẹ hoặc trầm cảm |
Lo âu vừa phải hoặc trầm cảm, yêu cầu điều trị, thay đổi trong sinh hoạt bình thường |
Thay đổi tâm trạng nặng, yêu cầu điều trị, hoặc ý định tự tử, ý định gây gổ |
Rối loạn tâm thần cấp tính, yêu cầu nhập viện, hoặc cử chỉ/cố gắng tự tử hoặc ảo giác |
|
XƯơng khớp |
Đau khớp |
Đau nhẹ không gây ảnh hưởng tới chức năng |
Đau vừa phải, mất cảm giác và/hoặc đau ảnh hưởng tới chức năng nhưng không ảnh hưởng tới hoạt động sống thường ngày |
Đau nặng, đau và/hoặc mất cảm giác làm ảnh hưởng tới hoặt động sống thường ngày |
Đau không làm gì được |
|
|
Đau nhẹ với viêm, ban đỏ |
Đau vừa phải với viêm, ban đỏ hoặc |
Đau nặng với viêm, ban đỏ hoặc |
Cứng và/hoặc mất khả năng vận |
|
|
|
Viêm khớp |
hoặc sưng khớp nhưng không ảnh hưởng tới chức năng |
sưng khớp, ảnh hưởng tới chức năng nhưng không ảnh hưởng tới hoạt động sống thường ngày |
sưng khớp, ảnh hưởng tới hoạt động sống thường ngày |
động khớp. |
|
Phản ứng dị ứng |
Phản ứng của da- nổi ban |
Ban chấm khu trú |
Ban chấm, nốt sẩn rải rác hoặc ban dạng sởi |
Ban chấm, nốt sẩn rải rác hoặc ban dạng sởi với các nốt phồng nước hoặc tổn thương loét bề mặt của niêm mạc giới hạn tại một vị trí |
Các tổn thương lan rộng hoặc toàn thân hoặc hội chứng Stevens- Jhonson, hoặc hội chứng Lyell, DRESS, AGEP… |
|
Phản ứng dị ứng toàn thân cấp tính |
Nổi mày đay khu trú nhưng không cần chỉ định can thiệp y khoa |
Nổi mày đay khu trú nhưng cần chỉ định can thiệp y khoa hoặc phù mạch nhẹ không cần chỉ định can thiệp y khoa |
Nổi mày đay toàn thân hoặc phù mạch cần chỉ định can thiệp y khoa hoặc bị co thắt phế quản nhẹ |
Shock phản vệ hoặc co thắt phế quản nặng đe dọa tính mạng hoặc phù thanh quản, tổn thương viêm cầu thận/ hội chứng thận hư, viên mạch, Lupus |
|
|
Sốt |
37,70C- 38,60C |
38,8 0C – 39,30C |
39,40C – 40,50C |
>40,50C |
Phụ lục 10 -nhận dạng thuốc gây tác dụng không mong muốn và giải mẫn cảm
Nhận dạng thuốc gây adr:
Bắt đầu sử dụng lại từng thuốc mỗi 4 ngày (cân nhắc tham khảo liều thử thách theo khuyến cáo ở bảng1)
Bảng 1:
|
|
Hướng dẫn thử thách liều |
|
|
Thuốc |
Liều thử thách |
|
|
|
Ngày 1 |
Ngày 2 |
|
Isoniazid |
50mg |
300mg |
|
Rifampicin |
75mg |
300mg |
|
Pyrazinamid |
250mg |
1g |
|
Ethionamid |
125mg |
375mg |
|
Cycloserin |
125mg |
250mg |
|
Ethambutol |
100mg |
500mg |
|
PAS |
1g |
5g |
Bắt đầu với INH liều 50mg sử dụng trong ngày đầu, nếu các biểu hiện ADR nặng lên thì bắt đầu thay đổi liều bằng 1/10 liều của ngày 1 như liệt kê ở bảng 1 (ví dụ: INH 5mg).
Nếu ADR không xảy ra sau sử dụng liều ở ngày đầu tiên thì tăng liều INH lên 300mg ở ngày thứ 2.
Nếu ADR không xảy ra sau ngày dùng thuốc thứ 2 thì tiếp tục sử dụng INH liều 300mg mỗi ngày tiếp theo.
Tiếp tục thêm các thuốc khác theo nguyên tắc và liều lý thuyết như ở bảng 1 sau mỗi 4 ngày.
Nếu các triệu chứng ADR nặng lên, bắt đầu liều thay đổi bằng 1/10 liều của ngày 1 như liệt kê ở bảng 1.
Nếu liều ở ngày thứ 2 thấp hơn liều khuyến cáo dựa trên cân nặng của người bệnh thì tăng liều tương đương ở ngày thứ 3.
Nếu như ADR vẫn xảy ra trong suốt quá trình thay đổi liều và thuốc gây ADR không thể tiếp tục dùng, thì việc giải mẫn cảm thuốc là cần thiết. Với thuốc chống lao tiêm việc giải mẫn cảm chỉ thực hiện sau khi nhận biết thuốc gây dị ứng bằng test kích thích (Drug Provocation Test: DPT).
Giải mẫn cảm chỉ nên cân nhắc sau khi đánh giá giữa yếu tố nguy cơ/ lợi ích và đặc biệt lưu ý yếu tố cá thể trên từng người bệnh.
Chỉ định:
Thuốc gây dị ứng là thuốc không thể thay thế bằng thuốc khác trong quá trình điều trị (điều trị đặc hiệu).
Thuốc gây dị ứng là thuốc có hiệu quả tốt nhất cho lựa chọn liệu pháp điều trị (first line) ví dụ: Thuốc điều trị lao, Cotrimoxazol cho người bệnh HIV).
Chống chỉ định:
Người bệnh có nguy cơ cao bệnh phối hợp: Hen phế quản (FEV1
Chống chỉ định tuyệt đối ở người bệnh nặng, phản ứng độc tế bào miễn dịch nặng hoặc đe dọa mạng sống (hội chứng Steven – Jhonson), hội chứng Lyell, Dress.
Phương pháp giải mẫn cảm:
Liều khởi đầu thấp hơn 1/10 liều điều trị hoặc thấp hơn liều thấp nhất gây phản ứng dị ứng.
Thông thường là 1/10.000 – 1/100 liều điều trị.
Đối với người bệnh có tiền sử Hen phế quản: 1/1.000.000 – 1/10.000.
Tăng liều gấp đôi sau mỗi 15 – 20 phút, kéo dài vài giờ cho đến khi đạt liều điều trị.
Một số cách giải mẫn cảm thường được sử dụng hiện nay:
Cách thông dụng:
Khởi đầu với liều như liều ngày thứ nhất được liệt kê trong Bảng 1.
Nếu có phản ứng xảy ra trong ngày đầu tiên sau sử dụng thuốc này thì bắt đầu giải mẫn cảm với liều bằng 1/10 liều ngày đầu.
Mỗi ngày tăng liều lên gấp đôi (dùng 2 lần/ngày) cho đến khi đạt được liều khuyến cáo sử dụng.
Duy trì liều khuyến cáo (2 lần/ngày) này trong 3 ngày, sau đó sử dụng tổng liều là 1 lần/ngày (ví dụ: duy trì 3 ngày liều INH 150mg x 2 lần/ngày x 3 ngày, sau đó tiếp tục điều trị các ngày sau là 300mg/1 lần mỗi ngày).
Nếu phản ứng phát triển trong suốt thời gian giải mẫn cảm thì giảm liều đến liều cao nhất trước kia mà không gây ra phản ứng và bắt đầu tăng dần từng lượng nhỏ liều.
Giải mẫn cảm nhanh:
Tạo ra tình trạng dung nạp thuốc tạm thời với thuốc gây ra phản ứng quá mẫn. Nhắc lại từng liều nhỏ và tăng dần liều dị nguyên gây dị ứng và sau mỗi khoảng thời gian cố định và thực hiện liều và khoảng cách tăng liều dựa trên lượng giá triệu chứng ở từng cá thể người bệnh. Giải mẫn cảm chỉ nên thực hiện theo mô hình một (một y tá, một BN), có kinh nghiệm cấp cứu và đầy đủ phương tiện cấp cứu.
Giải mẫn cảm nhanh với INH tham khảo theo bảng dưới, thực hiện liều và khoảng cách tăng liều dựa trên lượng giá triệu chứng ở từng cá thể người bệnh.
|
|
Thời gian |
Liều (mg) |
|
Sáng |
8:00 |
0.1 |
|
8:15 |
0.5 |
|
|
8:30 |
1.0 |
|
|
8:45 |
2.0 |
|
|
9:00 |
4.0 |
|
|
9:30 |
8.0 |
|
|
10:00 |
16 |
|
|
10:30 |
32 |
|
|
11:30 |
50 |
|
|
Chiều |
1:30 |
100 |
|
2:30 |
150 |
|
|
3:00 |
150 |
|
|
Ngày tiếp theo |
Tiếp tục 150mg mỗi 12h |
|
Giải mẫn cảm nhanh với Rifampicin và Ethambutol tham khảo theo bảng dưới, thực hiện liều và khoảng cách tăng liều dựa trên lượng giá triệu chứng ở từng cá thể người bệnh.
|
Thời gian bắt đầu sử dụng |
Rifampicin (mg) |
Ethambutol (mg) |
|
8:00 |
0.1 |
0.1 |
|
8:45 |
0.5 |
0.5 |
|
9:30 |
1.0 |
1.0 |
|
10:15 |
2.0 |
2.0 |
|
11:00 |
4.0 |
4.0 |
|
11:45 |
8.0 |
8.0 |
|
12:30 |
16 |
16 |
|
13:15 |
32 |
32 |
|
14:00 |
50 |
50 |
|
14:45 |
100 |
100 |
|
15:30 |
150 |
200 |
|
16:00 |
300 |
400 |
|
Ngày tiếp theo (6:00 sáng) |
300 hai lần/ngày |
400 ba lần/ngày |
Corticoid có thể được sử dụng nếu việc giải mẫn cảm là cấp bách, cụ thể:
Lao nặng.
ADR nặng.
Quá mẫn với nhiều hơn một thuốc.
Người bệnh nên sử dụng liều hàng ngày sau khi hoàn tất quá trình giải mẫn cảm (không sử dụng phác đồ 2 lần mỗi tuần hoặc 3 lần mỗi tuần).
Phụ lục 11- quy trình chụp phổi thẳng
Mục tiêu:
Chuẩn bị được dụng cụ và người bệnh.
Thao tác kỹ thuật đúng quy trình và đánh giá được phim chụp đạt tiêu chuẩn kỹ thuật.
Các bước tiến hành:
Chuẩn bị dụng cụ và người bệnh
Kiểm tra tình trạng hoạt động của máy xquang.
Dùng phim, cassette cỡ 30 x 40 cm hoặc 35 x 35cm.
Giá giữ phim.
Họ tên người bệnh, dấu phải trái, ngày tháng năm.
Gọi người bệnh vào phòng chụp, tiếp xúc, giải thích, hướng dẫn người bệnh bộc lộ vùng cần chụp, tháo đồ trang sức vùng cổ nếu có.
Tiến hành kỹ thuật
Phim đặt dọc trên giá giữ phim, cố định phần dọc của tia X vào giữa phim theo chiều dọc.
Hướng dẫn người bệnh đứng trước giá giữ phim, mặt người bệnh quay về phía giá giữ phim, ngực người bệnh áp sát phim, hai bàn tay người bệnh chống hông, khủy tay gấp, dùng sức xoay 2 vai và khủy tay về phía trước để mặt trước của vai và khủy tay sát phim.
Mặt người bệnh hơi ngửa và tỳ lên mặt trên của cassette, chỉnh cạnh trên của cassette cao hơn mặt trên của vai 5cm, chỉnh trục cột sống lưng vào giữa phim theo chiều dọc. – Bóng Xquang chiếu ngang, vuông góc với phim.
Tia trung tâm khu trú vào điểm ngang đốt sống lưng D6, đường ngang của tia X qua đường nối hai bờ trên của hõm nách. Đối với phụ nữ, người bệnh to béo tia trung tâm có thể khu trú ngang D8.
Khoảng cách bóng Xquang đến phim là 1,5m, khu trú trùm tia X, đặt tên người bệnh, dấu P hoặc T, ngày tháng năm.
Căn dặn người bệnh đứng im, giữ nguyên tư thế.
Tiêu chuẩn chụp: ( chỉ mang tính chất tham khảo).
|
Máy Xquang |
KV |
mAs |
FFD ( cm) |
LƯới |
|
Cao tần |
65 – 70 |
8 |
150 – 180 |
có |
|
Cao tần |
65 – 70 |
5 |
150 – 180 |
không |
Kiểm tra lại công thức, quan sát người bệnh, hô người bệnh hít sâu hết cỡ nín thở sau đó ấn nút phát tia.
Hướng dẫn người bệnh ra khỏi phòng chụp và đưa phim đi tráng.
Đánh giá kết quả
Lấy được toàn bộ hai trường phổi, trục cột sống lưng vào giữa phim theo chiều dọc, khớp ức đòn hai bên cân đối, đầu trong của hai xương đòn phải đối xứng qua gai sau của cột sống lưng, cơ hoành bên phải nằm dưới đầu trong xương sườn thứ 6 phía trước.
Hai xương bả vai được tách ra khỏi lồng ngực, thấy rõ được 3 đốt sống ngực đầu tiên trên phim.
Phim có độ nét, độ tương phản, phim sạch, không bị xước.
Phim có họ tên người bệnh, dấu phải hoặc trái, ngày tháng năm chụp.
Phụ lục 12 -quy trình chụp phổi nghiêng
Mục tiêu:
Chuẩn bị được dụng cụ và người bệnh.
Thao tác kỹ thuật đúng quy trình và đánh giá được phim chụp đạt tiêu chuẩn kỹ thuật.
Các bước tiến hành:
Chuẩn bị dụng cụ và người bệnh
Kiểm tra tình trạng hoạt động của máy xquang.
Dùng phim, cassette cỡ 30 x 40 cm hoặc 35 x 35cm.
Giá giữ phim.
Họ tên người bệnh, dấu phải trái, ngày tháng năm.
Gọi người bệnh vào phòng chụp, tiếp xúc, giải thích, hướng dẫn người bệnh bộc lộ vùng cần chụp, tháo đồ trang sức vùng cổ nếu có.
Tiến hành kỹ thuật
Phim đặt dọc trên giá giữ phim, cố định phần dọc của tia X vào giữa phim theo chiều dọc. – Hướng dẫn người bệnh đứng nghiêng hoàn toàn trước giá giữ phim, hai tay người bệnh ôm đầu, đặt thành ngực bên cần chụp sát phim, cằm người bệnh hơi ngửa.
Chỉnh mặt phẳng lưng vuông góc với phim, chỉnh cạnh trên của cassette cao hơn mặt trên của vai 5cm.
Bóng Xquang chiếu vuông góc với phim.
Tia trung tâm khu trú vào điểm ngang đốt sống lưng 6, đường dọc của tia X đi theo đường nách sau và cách da lưng độ 4 khoát ngón tay, đối với phụ nữ, người lùn và to béo tia trung tâm có thể khu trú vào ngang D8.
Khoảng cách bóng Xquang đến phim là 1,5m, khu trú trùm tia X, đặt tên người bệnh, dấu P hoặc T, ngày tháng năm.
Căn dặn người bệnh đứng im, giữ nguyên tư thế.
Tiêu chuẩn chụp: ( chỉ mang tính chất tham khảo).
|
Máy Xquang |
KV |
mAs |
FFD ( cm) |
LƯới |
|
Cao tần |
75 – 80 |
15 |
150 |
có |
|
Cao tần |
75 – 80 |
8 |
150 |
không |
Kiểm tra lại công thức, quan sát người bệnh, hô người bệnh hít sâu hết cỡ nín thở sau đó ấn nút phát tia.
Hướng dẫn người bệnh ra khỏi phòng chụp và đưa phim đi tráng.
Đánh giá kết quả
Các cung sau của xương sườn chồng lên nhau.
Các vòm hoành ở phía trước nằm ngang với cung trước của xương sườn thứ 6.
Hai vòm hoành phải rõ nét và đều.
Phim có độ nét, độ tương phản, phim sạch, không bị xước.
Phim có họ tên người bệnh, dấu phải hoặc trái, ngày tháng năm chụp.
Phụ lục 13 -quy trình chụp phổi tư thế đỉnh phổi ưỡn tư thế lordotique
( người bệnh đứng, tia chiếu trước sau, chếch bóng lên phía trên)
Mục tiêu:
Chuẩn bị được dụng cụ và người bệnh.
Thao tác kỹ thuật đúng quy trình và đánh giá được phim chụp đạt tiêu chuẩn kỹ thuật.
Các bước tiến hành:
Chuẩn bị dụng cụ và người bệnh
Kiểm tra tình trạng hoạt động của máy xquang.
Dùng phim, cassette cỡ 30 x 40 cm hoặc 35 x 35cm.
Giá giữ phim.
Họ tên người bệnh, dấu phải trái, ngày tháng năm.
Gọi người bệnh vào phòng chụp, tiếp xúc, giải thích, hướng dẫn người bệnh bộc lộ vùng cần chụp, tháo đồ trang sức vùng cổ nếu có.
Tiến hành kỹ thuật
Phim đặt dọc trên giá giữ phim, cố định phần dọc của tia X vào giữa phim theo chiều dọc.
Hướng dẫn người bệnh đứng thẳng trước giá giữ phim, mặt quay về phía bóng Xquang, lưng áp sát phim.
Hai tay người bệnh ôm gáy, hai khủy tay gấp và đưa vào trong tối đa.
Cằm người bệnh hơi ngửa, chỉnh cạnh trên của cassette cao hơn mặt trên vai 5 – 10cm, chỉnh trục cột sống lưng vào giữa phim theo chiều dọc.
Bóng Xquang chiếu chếch lên phía trên 1 góc từ 300 đến 400 so với phương nằm ngang
Tia trung tâm khu trú vào điểm giữa thân xương ức.
Khoảng cách bóng Xquang đến phim là 1,5m, khu trú trùm tia X, đặt tên người bệnh, dấu P hoặc T, ngày tháng năm.
Căn dặn người bệnh đứng im, giữ nguyên tư thế.
Tiêu chuẩn chụp: ( chỉ mang tính chất tham khảo).
|
Máy Xquang |
KV |
mAs |
FFD ( cm) |
LƯới |
|
Cao tần |
70 |
12 |
150 |
có |
|
Cao tần |
70 |
8 |
150 |
không |
Kiểm tra lại công thức, quan sát người bệnh, hô người bệnh hít sâu hết cỡ nín thở sau đó ấn nút phát tia.
Hướng dẫn người bệnh ra khỏi phòng chụp và đưa phim đi tráng.
Đánh giá kết quả
Xương đòn được đẩy lên cao ra khỏi lồng ngực.
Thấy rõ đỉnh phổi, thùy giữa và chân rãnh liên thùy.
Trục cột sống lưng vào giữa phim theo chiều dọc.
Phim có độ nét, độ tương phản, phim sạch, không bị xước.
Phim có họ tên người bệnh, dấu phải hoặc trái, ngày tháng năm chụp.
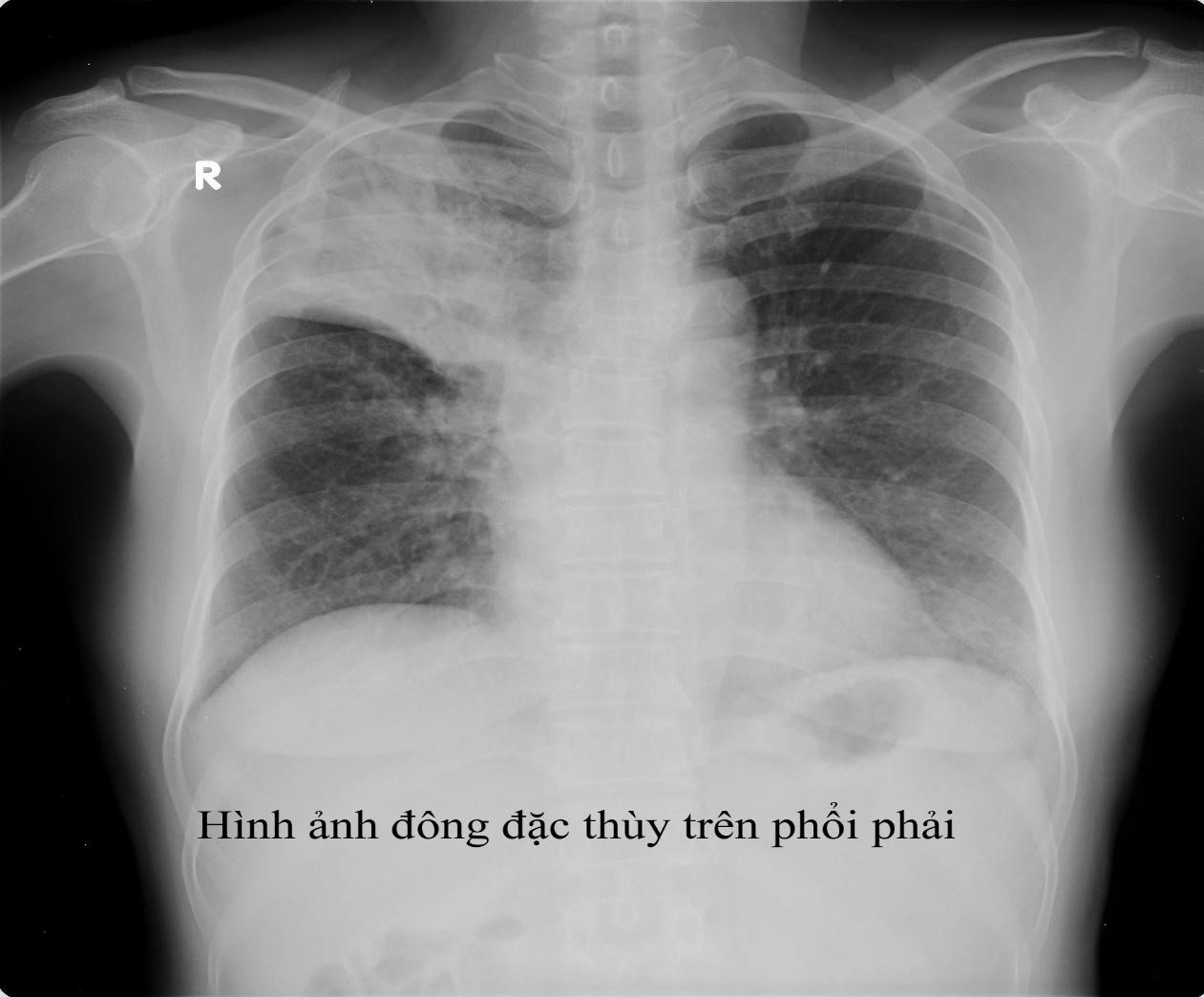
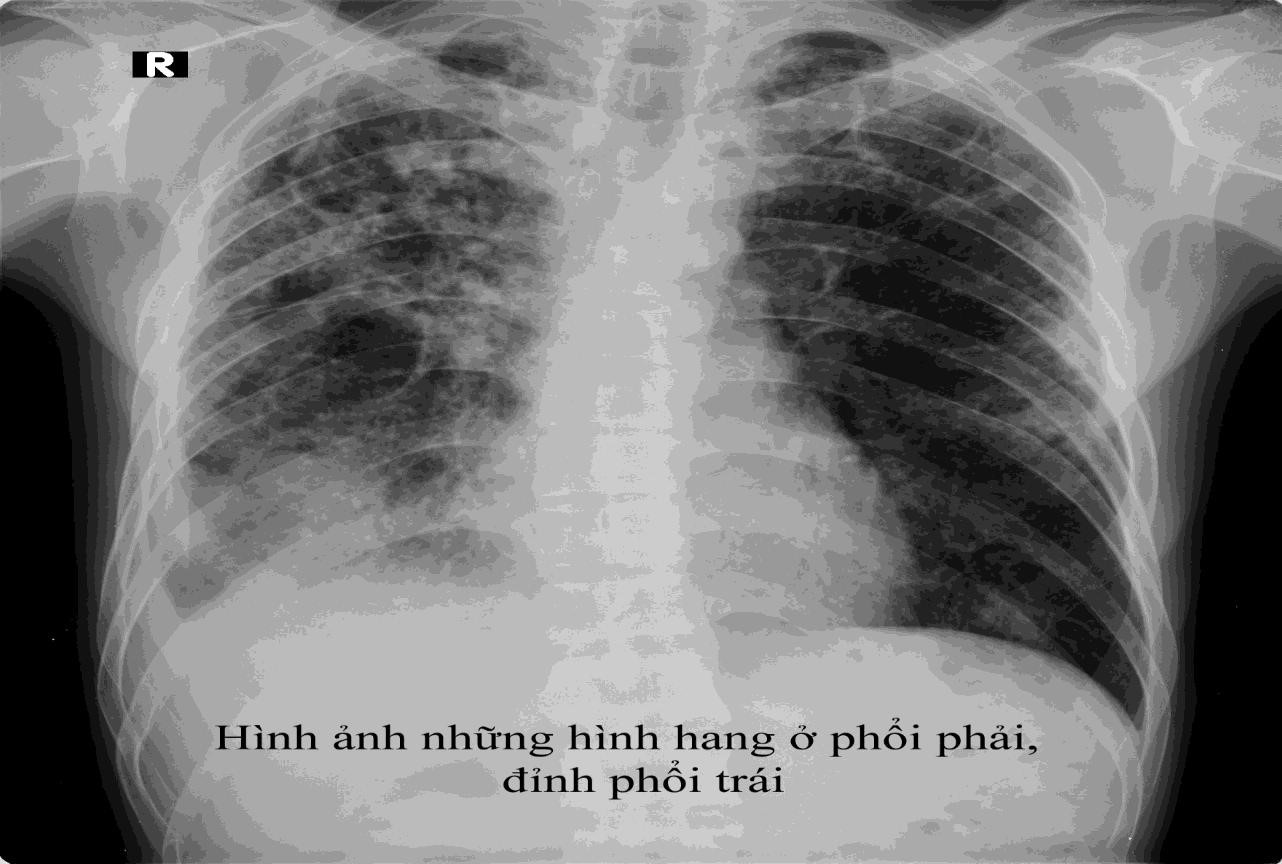
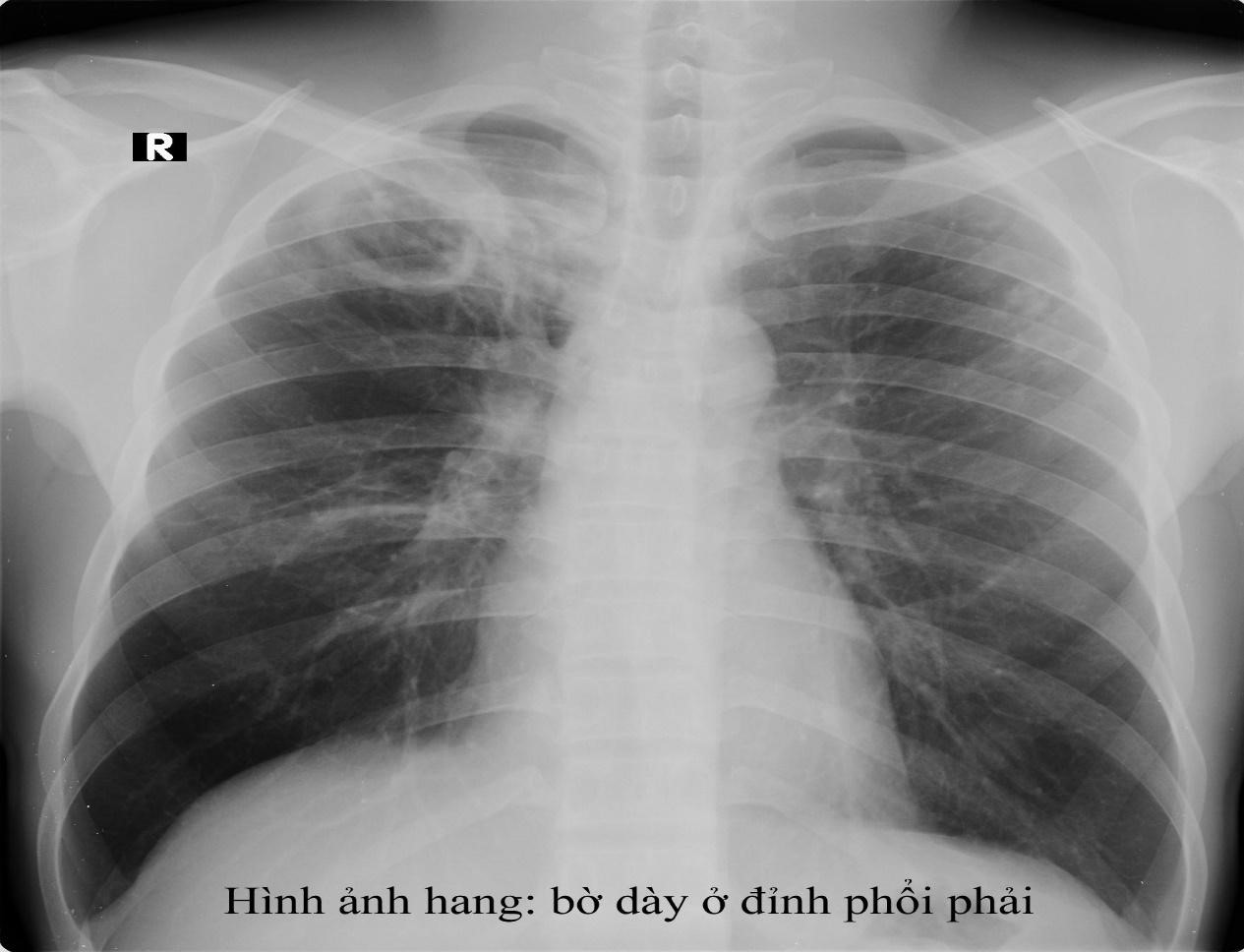
Phụ lục 14- hình ảnh của các hình thái tổn thương lao
Nốt:
Thâm nhiễm:
Hang:
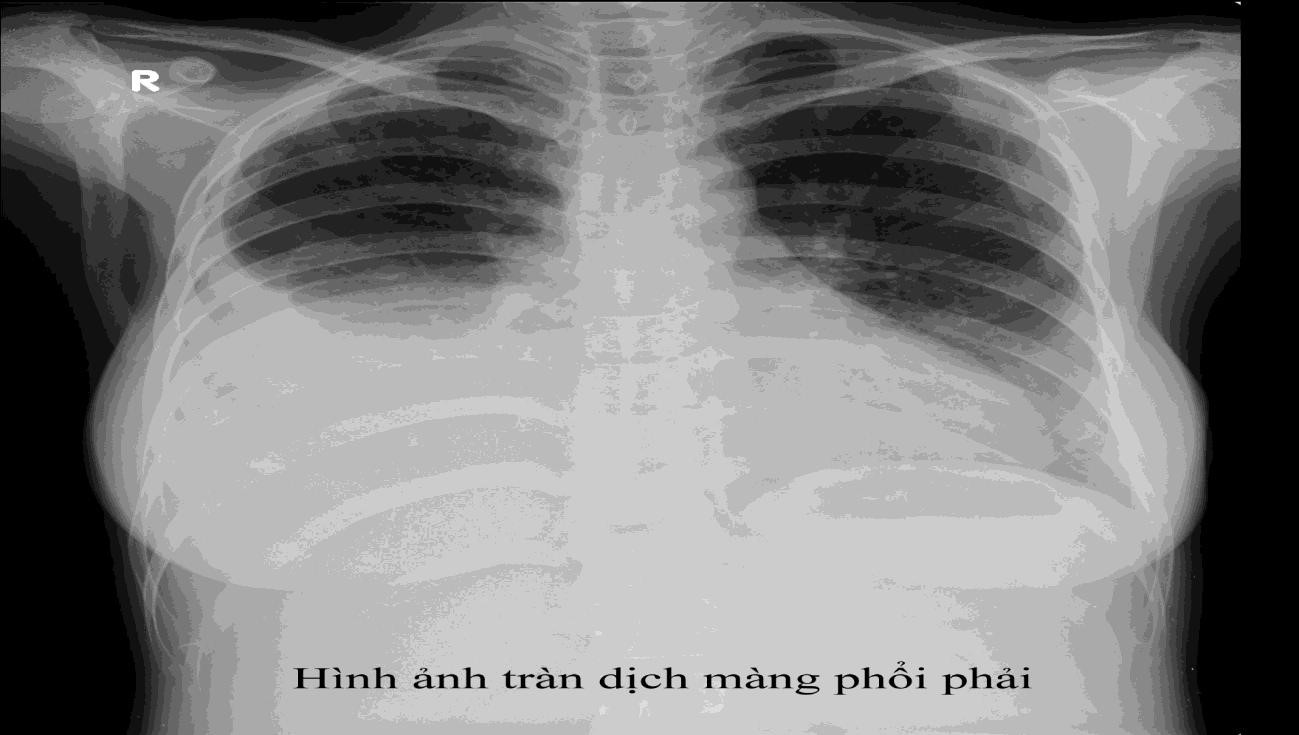
Hình mờ do tràn dịch màng phổi
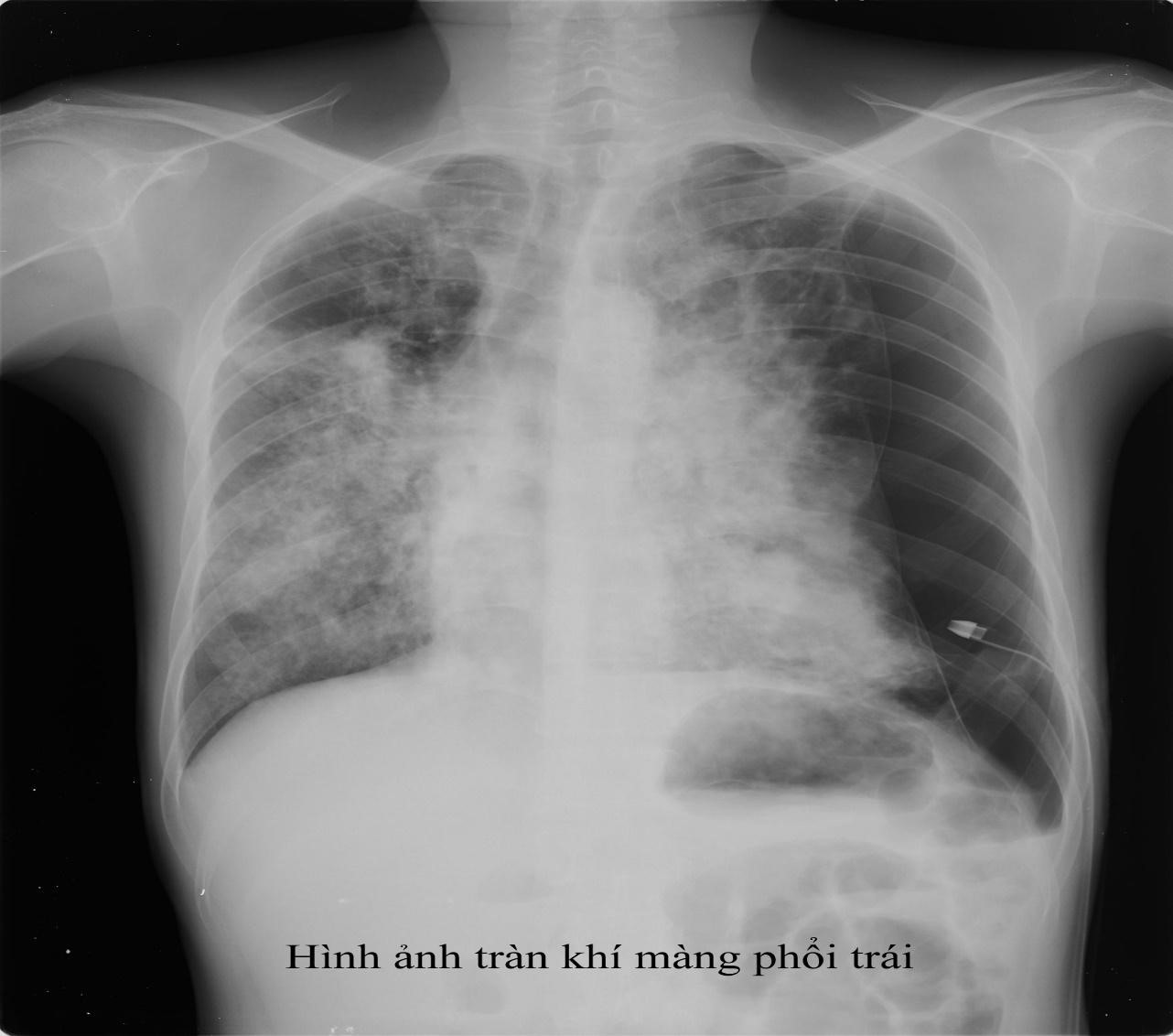
Hình ảnh tràn khí màng phổi
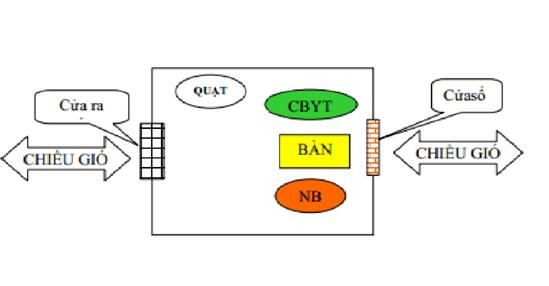
Phụ lục 15 – sơ đồ buồng khám bệnh lao
|
|
|
|
||
|
|
Yêu cầu: |
(1) Diện tích tối thiểu 12m2 |
||
|
|
|
(2) Đảm bảo thông khí tối thiểu 12 chu kỳ trao đổi khí/giờ. |
||
|
|
|
(3) Thầy thuốc ngồi cách người bệnh tối thiểu 1m. |
||
|
|
Ghi chú: |
CBYT: Cán bộ Y tế |
||
|
|
|
NB: Người bệnh
|
||
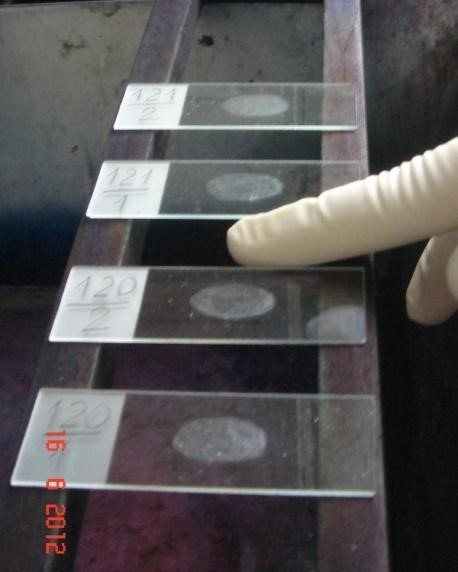
Phụ lục 16 – hình ảnh mô tả các bước nhuộm huỳnh quang bằng hóa chất tự pha (nhuộm bằng bộ kit lưu ý chỉ nhỏ thuốc nhuộm kín vết dàn, tẩy màu và nhuộm nền chung 1 bước)
Đặt tiêu bản lên giá nhuộm. Xếp các tiêu bản cách nhau ít nhất 1 cm
Phủ đầy dung dịch Auramine 0,1%. Để 15 phút
Rửa tiêu bản bằng nước thường, nghiêng để ráo nước
Phủ dung dịch cồn HCl 0,5%. Để 2 phút
Rửa nước rồi nghiêng tiêu bản để ráo nước
Phủ đầy dung dịch xanh methylen 0,3%. Để 1 – 2 phút
Rửa nước rồi nghiêng tiêu bản để ráo nước
Để khô tự nhiên hoặc đặt lên máy sấy tiêu bản
Tài liệu tham khảo
American Thoracic Society, CDC, Infectious Diseases Society of America. Treatment of tuberculosis, Am J Respir Crit Care Med Vol 167.pp 603-662, 2003.
Aberer & Kranke. Immunol Allergy Clin N Am 29. 567-584, 2009.
Australian Society for Microbiology (2004). Guidelines for Assuring Quality of Solid Media used in Australis for the Cultivation of Medicallly Important Mycobacteria.
Van Deaun, A. Martin, J.C. Palomino (2010). Diagnosis of drug-resistant tuberculosis: reliability and rapidity of detection. Int J Tuberc Lung Dis 14(2): 131 – 140.
Bộ Y tế – Chương trình chống lao Quốc gia Việt Nam. Hướng dẫn quản lí bệnh lao. Nhà xuất bản Y học, 2009.
Chương trình chống lao Quốc gia Việt Nam. Hướng dẫn kỹ thuật trong chẩn đoán và điều trị bệnh lao kháng đa thuốc. Năm 2010.
Chương trình chống lao Quốc gia. Hướng dẫn qui trình thực hành chuẩn xét nghiệm vi khuẩn lao, 2012.
Chương trình chống lao Quốc gia. Hướng dẫn duy tu bảo dưỡng trang thiết bị phòng xét nghiệm lao, 2010.
Chương trình chống lao Quốc gia – MSH. Qui trình chuyển mẫu cho quản lý và điều trị bệnh lao, 2011.
CDC. TB Program evaluation handbook, 2006.
Demonstration Project iLED. Training manual for Fluorescente – Base AFB microscopy, 2008.
Guidelines EAACI. Allergy 2014;69:1026-45.
Hanscheid T, Ribeiro CM, Shapiro HM, Perlmutter NG. Fluorescence microscopy for tuberculosis diagnosis. Lancet Infect Dis 2007; 7: 236-7.
International Union Agaist Tuberculosis and Lung Disease (IUATLD) technical guide:
sputum examination for tuberculosis by direct microscopy in low income countries. 5th ed.Paris: IUATLD, 2006.
K.D. Mc carthy, * B. Metchock, * P. Monkongdee et al (2008). Mornitoring the performance of mycobacteriologies laboratories: a proposal for standardized indicators. Int J Tuberc Lung Dis 12(9): 1015 – 1020.
Nigeria NTP (2009). National standard operating procedure for laboratories, Nigeria
Naga P. Chalasani, et al on behalf of the Practice Parameters Committee of the American College of Gastroenterology. Am J Gastroenterol 2014; 109:950–966;American journal and respiratory cristical care medecine vol 174 2006. An Official ATS Statement:
Hepatotoxicity of Antituberculosis Therapy
Procedure for culture of Mycobacteria using MGIT 960 technique, 2007.
Lawrence Flick Memorial Tuberculosis Clinic Philadelphia Tuberculosis Control Program; November, 1998.
World Health Organization. 1998. Laboratory Service in tuberculosis Control: Part II, Microscopy. WHO/TB/98.258.
WHO. Services in tuberclosis control. Part II: Microscopy. 1998.
WHO. Treatment of Tuberculosis Guidelines Fourth Edition. 2009.
WHO. Guidelines for the programmatic management of drug-resistant tuberculosis: emergency update 2008, Geneva, 2008.
WHO (2003), “WHO Toxicity Grading Scale of Determining The Severity of Adverse Events”.
Tổ chức Y tế Thế giới khu vực Tây Thái Bình Dương. Đảm bảo chất lượng xét nghiệm đờm trực tiếp trong chiến lược DODS, 2003.
Toman K. Toman’s tuberculosis case detection, treatment and monitoring, WHO, 2004.
Temple R. Hy’s law: predicting serious hepatotoxicity. Pharmacoepidemiol Drug Saf 2006;15:241–243.