Người dịch: BS Huỳnh Thanh Phương Thảo
Hiệu chỉnh: BS Hà Tố Nguyên
Giới thiệu
Siêu âm là phương tiện hình ảnh tối ưu nhất để đánh giá tử cung. Siêu âm nên được chỉ định đầu tiên khi bệnh nhân có những triệu chứng gợi ý bất thường ở tử cung hoặc các cơ quan lân cận. Siêu âm tử cung có thể thực hiện qua ngã bụng hoặc ngã âm đạo, việc lựa chọn chỉ định dựa vào bệnh lý của tử cung. Ngoại trừ các khối u tử cung to vượt ra khỏi vùng chậu thì siêu âm ngã âm đạo được ưa chuộng hơn vì có độ phân giải cao và gần với các cơ quan vùng chậu hơn, giúp hiển thị hình ảnh giải phẫu siêu âm của tử cung tốt hơn. Hơn nữa, siêu âm với đầu dò âm đạo cho phép tiếp xúc trực tiếp với các mô vùng chậu, vì vậy có thể phát hiện cảm giác đau hoặc khó chịu của bệnh nhân trong quá trình thăm khám, từ đó liên hệ các triệu chứng lâm sàng của bệnh nhân với các dấu hiệu trên siêu âm. Khi không thể thực hiện siêu âm ngã âm đạo được thì có thể dùng ngã trực tràng (transrectal) hoặc ngã môi bé (translabial). Trong chương này sẽ thảo luận và minh họa về các phương thức siêu âm tử cung không mang thai bình thường, các dị dạng tử cung và nội mạc tử cung thường gặp nhất.
Chuẩn bị bệnh nhân
Siêu âm đánh giá tử cung phần lớn được thực hiện qua ngã âm đạo vì vậy bệnh nhân nên đi tiểu sạch trước khi siêu âm để bàng quang trống. Bệnh nhân nằm tư thế sản khoa với hai chân co lại và tầng sinh môn nằm sát mép dưới bàn siêu âm để người thực hiện có thể thao tác dễ dàng với đầu dò âm đạo. Hình ảnh được hiển thị ở chế độ thời gian thực. Cần có sự hiện diện của người thứ 3 trong suốt quá trình siêu âm. Khi thực hiện siêu âm ngã bụng, bàng quang bệnh nhân phải căng để đẩy ruột non ra khỏi vùng cần khảo sát. Cần có phiếu chỉ định siêu âm cung cấp đầy đủ các thông tin lâm sàng cần thiết để việc thực hiện siêu âm chính xác và phù hợp (1). Xem chương 13 để biết thêm chi tiết về kỹ thuật siêu âm qua ngã âm đạo. Các chỉ định siêu âm vùng chậu được liệt kê trong Bảng 11.1.
|
Bảng 11.1. Các chỉ định siêu âm vùng chậu [Có sửa đổi dưới sự cho phép của Viện siêu âm y khoa Mỹ (1)] |
|
Đau vùng chậu Thống kinh Vô kinh Rong kinh Rong huyết Xuất huyết tử cung bất thường Theo dõi bất thường đã phát hiện trước đó Đánh giá, theo dõi, và/hoặc điều trị vô sinh Dậy thì muộn, dậy thì sớm, hoặc xuất huyết âm đạo ở trẻ chưa dậy thì – Xuất huyết hậu mãn kinh Thăm khám vùng chậu bằng tay có bất thường hoặc hạn chế Có triệu chứng viêm nhiễm vùng chậu Đánh giá sâu hơn những bất thường ở vùng chậu được ghi nhận trên các phương pháp khảo sát hình ảnh khác Đánh giá các dị dạng tử cung bẩm sinh Chảy máu nặng, đau hoặc triệu chứng nhiễm trùng sau phẫu thuật vùng chậu, sau sanh hoặc sẩy thai Xác định vị trí dụng cụ tử cung Tầm soát bệnh ác tính ở những bệnh nhân nguy cơ cao Tiểu không kiểm soát hoặc sa tạng chậu Dẫn đường cho các can thiệp hoặc thủ thuật |
Kỹ thuật khảo sát
Siêu âm tử cung qua ngã âm đạo thường được bắt đầu bằng mặt cắt dọc giữa (midsagittal). Hình ảnh thu được bằng cách đưa đầu dò vào vòm trên âm đạo với điểm đánh dấu ở vị trí 12 giờ (Hình 11.1). Trong hình Hình 11.2, chúng ta quan sát được đáy, eo và cổ tử cung và đo chiều dài tử cung từ đáy đến lỗ ngoài cổ tử cung. Tương tự, bề dày (bề cao) của tử cung (đường kính trước sau) được đo từ thành trước đến thành sau tử cung vuông góc với chiều dài tử cung (Hình 11.2). Mặt cắt dọc giữa này cũng cho phép đánh giá và đo nội mạc tử cung. Cần lưu ý bề dày nội mạc, các bất thường khu trú và sự hiện diện của dịch trong lòng tử cung. Đo nội mạc bao gồm phần trước và phần sau trừ đi lớp dịch trong lòng tử cung (nếu có) (Hình 11.3). Đánh giá và đo nội mạc chính xác đặc biệt quan trọng trong trường hợp có xuất huyết tử cung. Khi đo nội mạc dày trên siêu âm, cần phải đo ở mặt phẳng dọc giữa, toàn bộ đường nội mạc quan sát được từ vùng đáy tử cung đến cổ trong, đo phần dày nhất, hình ảnh được phóng to và rõ ràng (Hình 11.3). Xoay đầu dò 90 độ ngược chiều kim đồng hồ (nhằm duy trì định hướng chính xác) cho phép hiển thị trục ngang của tử cung. Người thực hiện siêu âm nên quét đầu dò theo hướng từ trên xuống dưới cho đến khi thu được hình ảnh tử cung rộng nhất theo trục ngang (Hình 11.4). Từ mặt cắt ngang rộng nhất có thể đo được bề rộng lớn nhất của tử cung (Hình 11.4)
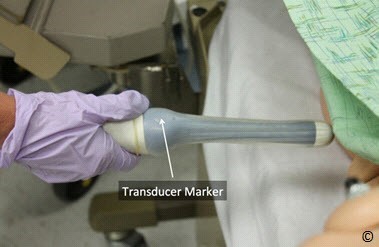
Hình 11.1: Bước đầu tiên trong siêu âm qua ngã âm đạo. Lưu ý rằng đầu dò được đưa vào âm đạo với điểm đánh dấu (transducer marker) ở vị trí 12 giờ. Mô hình được sử dụng để minh họa.
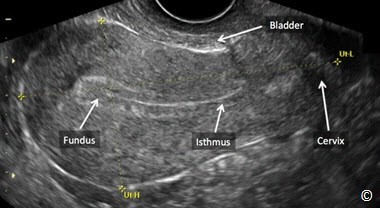
Hình 11.2: Mặt cắt dọc giữa tử cung cho thấy đáy (Fundus), eo (Isthmus), cổ tử cung (Cervix) và bàng quang (Bladder) xẹp ở phía trước. Ở mặt cắt này đo được chiều dài tử cung (Ut-L) và chiều cao tử cung Ut-H).
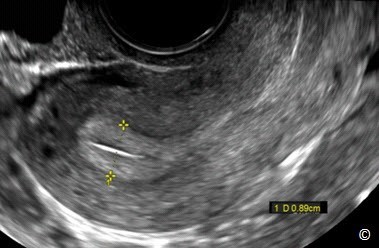
Hình 11.3: Đo bề dày nội mạc tử cung. Lưu ý rằng bề dày nội mạc được đo ở chỗ dày nhất và ở mặt cắt dọc giữa (Midsagittal plane) tử cung.
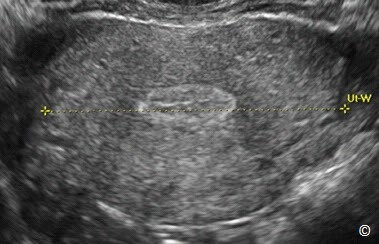
Hình 11.4: Mặt cắt ngang tử cung ở vị trí có đường kính rộng nhất. Ở mặt cắt này đo được chiều rộng tử cung (Ut-W).
Trong mỗi lần siêu âm, nên đánh giá kích thước tử cung (bao gồm cả nội mạc), hình dạng và chiều hướng tử cung. Các bất thường của cổ tử cung, nội mạc và cơ tử cung nên được đánh giá và ghi nhận lại. Các phương thức hình ảnh hỗ trợ như Doppler xung và Doppler màu có thể giúp phát hiện thêm những dấu hiệu bất thường. Đẩy nhẹ nhàng đầu dò kết hợp với ấn trên bụng bệnh nhân theo hướng ngược lại để tìm các triệu chứng gợi ý viêm nội mạc tử cung, lạc nội mạc tử cung hoặc viêm nhiễm vùng chậu. Động tác này cũng cho phép đánh giá độ di động của tử cung trong trường hợp dính hoặc sẹo. Siêu âm bơm nước buồng tử cung (Sonohysterography, Hydrosonography) có thể giúp đánh giá lòng tử cung trong trường hợp nghi ngờ có bất thường (2) (Hình 11.5). Siêu âm bơm nước buồng tử cung được thực hiện bằng cách đưa một catheter nhựa vô trùng mỏng (catheter bơm tinh trùng hoặc ống nuôi ăn nhỏ), có gắn ống tiêm chứa nước muối vô trùng, đưa ống thông vào buồng tử cung qua kênh cổ tử cung (Hình 11.6). Các tác giả khuyến cáo thực hiện thủ thuật trong giai đoạn tăng sinh của chu kỳ để tránh tử cung có thai và nội mạc tử cung mỏng. Một số khuyến cáo khác bao gồm lau lỗ ngoài cổ tử cung bằng dung dịch sát khuẩn trước khi đưa catheter vào buồng tử cung nhằm hạn chế nguy cơ nhiễm trùng và rửa catheter bằng nước muối để tránh bơm khí vào buồng tử cung làm che khuất tầm nhìn. Catheter được đưa dễ dàng qua lỗ trong cổ tử cung trong hầu hết các trường hợp, tuy nhiên khi gặp cổ tử cung chít hẹp thì dùng kẹp (tenaculum) kéo thẳng cổ tử cung và nong bằng ống nhỏ giúp mở rộng kênh cổ tử cung. Các tác dụng phụ của siêu âm bơm nước lòng tử cung rất hiếm xảy ra bao gồm: nguy cơ viêm nội mạc tử cung khoảng 1%, co thắt và đau bụng 1-5% (3). Cho bệnh nhân uống Ibuprofen 1 giờ trước thủ thuật giúp hạn chế co thắt tử cung.
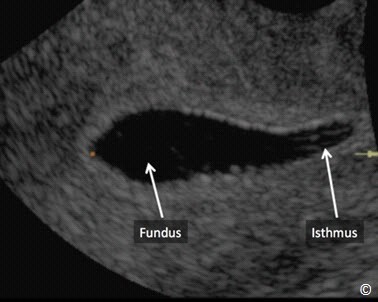
Hình 11.5: Hình ảnh buồng tử cung bình thường trên siêu âm bơm nước buồng tử cung cho thấy đáy (Fundus) và eo (Isthmus)
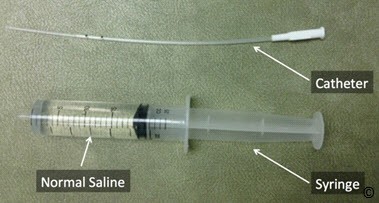
Hình 11.6: Dụng cụ cần thiết trong siêu âm bơm nước buồng tử cung bao gồm một ống tiêm (Syringe) chứa nước muối sinh lý (Normal Saline) và một catheter nhựa vô trùng (Catheter)
Khía cạnh kỹ thuật để thu được mặt phẳng trán (mid-coronal plane) của tử cung trên siêu âm 3 chiều sẽ được thảo luận trong chương này ở phần bất thường bẩm sinh ống Müller.
Đặc điểm siêu âm của tử cung bình thường
Tử cung là một tạng cơ nằm trong tiểu khung giữa bàng quang ở phía trước và đại-trực tràng ở phía sau. Khoảng giữa tử cung và đại-trực tràng là túi cùng sau (posterior cul-de-sac) hay còn gọi là túi cùng Douglas, đây là nơi thấp nhất của ổ phúc mạc mà các dịch trong ổ bụng thường đọng ở đó. Trong độ tuổi sinh sản, nội mạc tử cung trải qua những thay đổi giải phẫu dưới tác dụng của hormon sinh dục trong suốt chu kỳ kinh nguyệt.
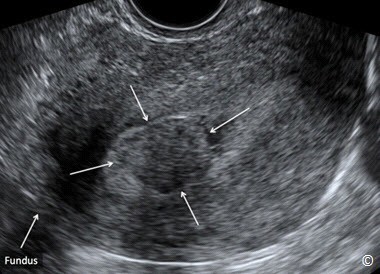
Như đã trình bày trong phần kỹ thuật siêu âm, chúng ta có thể đánh giá nội mạc trên mặt phẳng dọc giữa tử cung. Mặt phẳng này cho phép quan sát vùng đáy tử cung, phần lớn cơ tử cung, nội mạc tử cung, cổ tử cung, túi cùng, trực tràng và bàng quang (Hình 11.7). Việc đo đạc chiều dài, chiều sâu (cao) và chiều rộng của tử cung là một phần trong siêu âm vùng chậu. Chiều dài bình thường của tử cung ở phụ nữ chưa sanh từ 6 – 8,5 cm và 8 – 10,5 cm ở phụ nữ sanh nhiều lần (4). Chiều sâu (cao) bình thường của tử cung ở phụ nữ chưa sanh từ 2 – 4 cm và 4 – 6 cm ở phụ nữ sanh nhiều lần (4). Cắt ngang tử cung ở chỗ rộng nhất đo được từ 3 – 5 cm ở phụ nữ chưa sanh và 4 – 6 cm ở phụ nữ sanh nhiều lần (4).
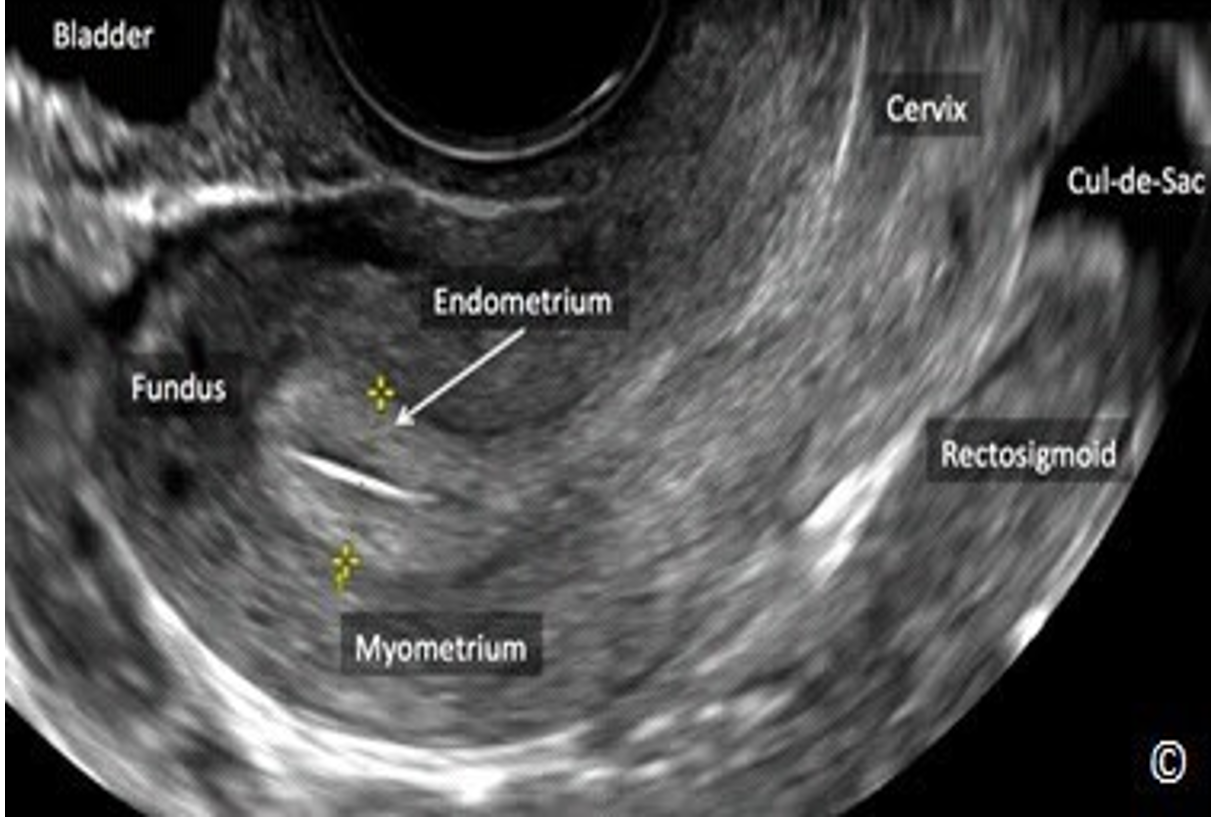
Hình 11.7: Mặt phẳng đứng dọc giữa qua tử cung cho thấy đáy tử cung (Fundus), cơ tử cung (Myometrium), nội mạc tử cung (Endometrium), cổ tử cung (Cervix), túi cùng (Cul-de-sac), trực tràng (Rectosigmoid) và bàng quang (Bladder). Lưu ý rằng cơ tử cung (Myometrium) có hồi âm kém hơn nội mạc tử cung.
Một phần quan trọng trong siêu âm là mô tả hướng tử cung, điều này giúp ích trong trường hợp cần đo buồng tử cung. Hướng tử cung được mô tả ở mặt phẳng đứng dọc giữa và bệnh nhân nằm ngửa. Hai thuật ngữ dùng để mô tả hướng tử cung trong khung chậu là gập (flexion) và ngã (version). Gập là sự uốn cong của tử cung, vì vậy tử cung được gọi là gập khi có một góc giữa đoạn cổ/đoạn dưới (đoạn eo) tử cung với phần đáy tử cung. Tử cung gập trước có đoạn eo và phần đáy tạo với nhau một góc nhọn hoặc tù (Hình 11.8). Tử cung gập sau có đoạn eo và phần đáy tử cung tạo với nhau một góc phản (>180 độ)và phần đáy tử cung sát với trực tràng (Hình 11.9). Nếu giữa đoạn eo và phần đáy tử cung không tạo góc thì tử cung được mô tả bằng từ “ngã” nghĩa là tử cung hướng toàn bộ về phía trước hoặc phía sau. Tử cung ngã trước là tử cung có phần đáy sát với bàng quang (Hình 11.10) và tử cung ngã sau là tử cung có phần đáy sát với trực tràng (Hình 11.11)
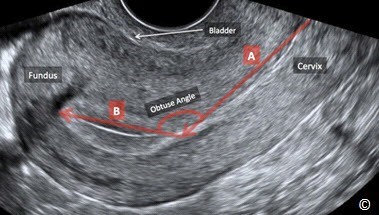
Hình 11.8: Hình ảnh siêu âm qua ngã âm đạo của tử cung gập trước. Lưu ý góc tù (Obtuse Angle) (
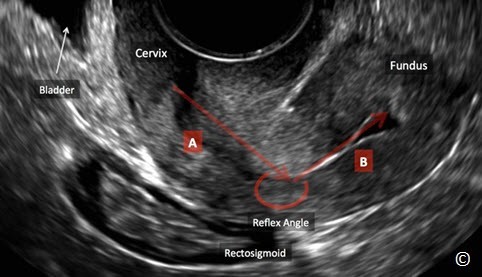
Hình 11.9: Hình ảnh siêu âm qua ngã âm đạo của tử cung gập sau. Lưu ý các góc phản

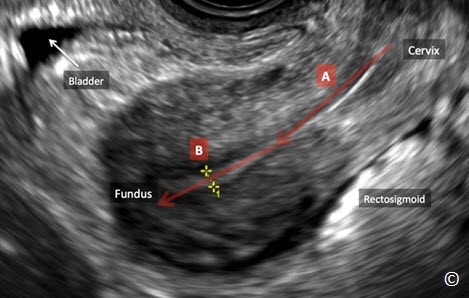
Hình 11.10: Hình ảnh siêu âm qua ngã âm đạo của tử cung ngã trước. Lưu ý sự vắng mặt của góc hợp bởi đoạn dưới tử cung (eo)/cổ (Cervix) (A) và phần đáy tử cung (Fundus) (B). Đáy tử cung nằm sát bàng quang (Baldder).
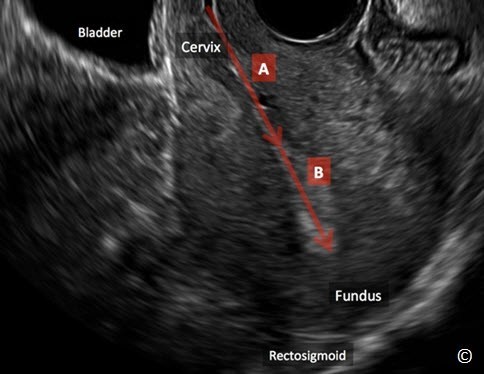
Hình 11.11: Hình ảnh siêu âm qua ngã âm đạo của tử cung ngã sau. Lưu ý sự vắng mặt của góc hợp bởi đoạn dưới tử cung (eo)/cổ (Cervix) (A) và phần đáy tử cung (B). Đáy tử cung (Fundus) nằm sát trực tràng (Rectosigmoid). Chú ý vị trí của bàng quang (Bladder).
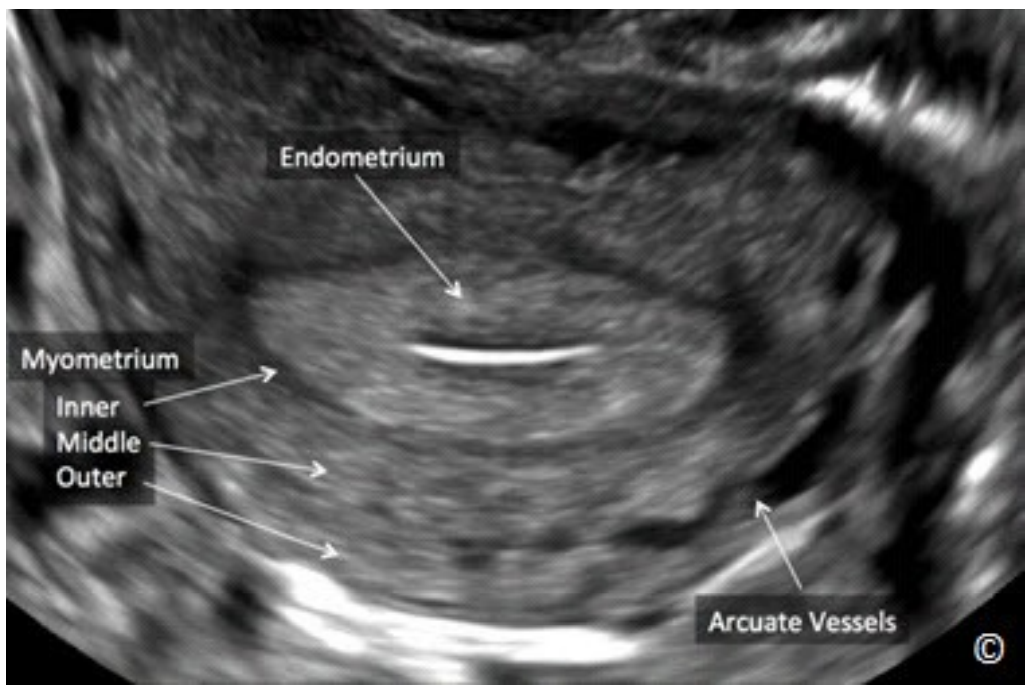
Cơ tử cung được cấu tạo bởi một lớp cơ trơn đồng nhất và các mạch máu. Trên siêu âm cơ tử cung bình thường có hồi âm kém hơn so với nội mạc tử cung (Hình 11.7). Cơ tử cung có thể được chia thành 3 lớp; lớp trong cùng còn gọi là lớp chuyển tiếp (junctional layer) tiếp giáp với nội mạc tử cung, hồi âm kém và mỏng, lớp giữa dày và đồng nhất và lớp ngoài cùng hồi âm kém và mỏng (Hình 11.12). Các mạch máu hình cung nằm giữa lớp ngoài và lớp giữa cơ tử cung.
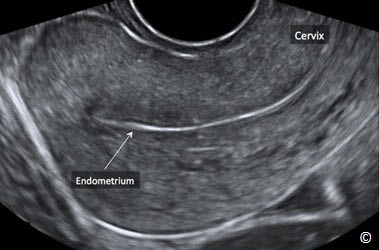
Nội mạc tử cung có sự thay đổi đáng kể trong suốt chu kỳ kinh nguyệt (5,6). Về phương diện giải phẫu, nội mạc tử cung được chia thành 2 lớp: lớp chức năng ở trong sẽ bong ra khi hành kinh và lớp đáy ở ngoài tiếp giáp với lớp chuyển tiếp của cơ tử cung. Về phương diện siêu âm, ở giai đoạn ngay sau khi hành kinh, nội mạc tử cung xuất hiện dưới dạng một đường hồi âm mỏng từ 3 – 8mm (Loại A) (Hình 11.13). Dưới sự ảnh hưởng của nồng độ estrogen ngày càng tăng được tiết ra từ các nang noãn, nội mạc tử cung tăng sinh và dày lên. Siêu âm nội mạc tử cung ở giai đoạn này cho hình ảnh 3 lớp với lớp trước và lớp sau hồi âm kém ngăn cách bởi một đường hồi âm dày ở giữa (Loại B). Ở cuối giai đoạn tăng sinh gần thời điểm rụng trứng, nội mạc tử cung dày khoảng 8 – 12mm với hình ảnh 3 lớp đặc trưng (Loại C), (Hình 11.14). Sau khi rụng trứng, dưới sự ảnh hưởng của progesterone tiết ra từ hoàng thể nội mạc tử cung mất đi hình ảnh 3 lớp đặc trưng và có hồi âm dày đồng nhất (Loại D) (Hình 11.15).
Hình 11.12: Siêu âm đầu dò âm đạo cắt ngang tử cung cho thấy 3 lớp cơ tử cung (Myometrium). Lưu ý lớp trong (Inner) mỏng và hồi âm kém tiếp giáp với lớp giữa (Middle) dầy đồng âm và lớp ngoài (Outer) thì hồi âm tương đối kém so với lớp giữa. Lưu ý các mạch máu hình cung (Arcuate Vessels) nằm giữa lớp ngoài và lớp giữa cơ tử cung.
Hình 11.13: Siêu âm đầu dò âm đạo mặt cắt dọc tử cung ở giai đoạn ngay sau khi hành kinh.
Lưu ý nội mạc tử cung (Endometrium) mỏng. Cổ tử cung (Cervix) được gắn nhãn để định hướng hình ảnh. Hình ảnh do BS Bernard Benoit cung cấp.
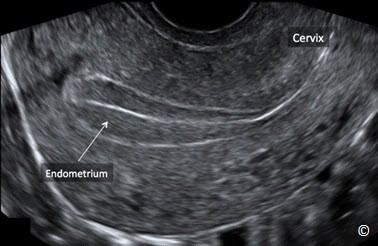
Hình 11.14: Siêu âm đầu dò âm đạo mặt cắt dọc tử cung ở cuối giai đoạn tăng sinh, gần giai đoạn rụng trứng của chu kỳ kinh nguyệt. Lưu ý nội mạc tử cung (Endometrium) dày với 3 lớp rõ rệt. Cổ tử cung (Cervix) được gắn nhãn để định hướng hình ảnh. Hình ảnh do BS Bernard Benoit cung cấp.
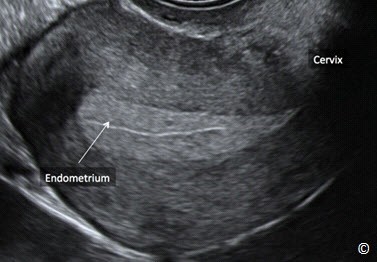
Hình 11.15: Siêu âm đầu dò âm đạo mặt cắt dọc tử cung ở giai đoạn sau rụng trứng của chu kỳ kinh nguyệt. Lưu ý toàn bộ nội mạc tử cung (Endometrium) hồi âm dày đồng nhất mất cấu trúc 3 lớp. Cổ tử cung (Cervix) được gắn nhãn để định hướng hình ảnh. Hình ảnh do BS Bernard Benoit cung cấp.
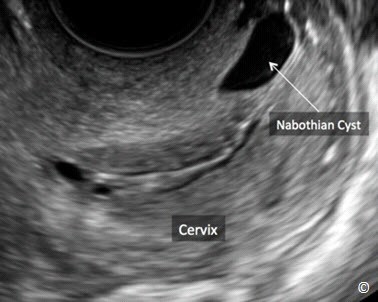
Cổ tử cung có thể chia thành phần trong âm đạo hay cổ ngoài (ectocervix), kênh cổ (endocervix canal) và cổ trong (endocervix). Cổ tử cung được đánh giá tốt nhất với siêu âm qua ngã âm đạo. Để hiển thị hình ảnh đầy đủ thực hiện lát cắt đứng dọc giữa và kéo lui nhẹ nhàng đầu dò cho đến khi thấy được toàn bộ cổ tử cung. Tránh ấn đầu dò vì động tác này sẽ làm cổ tử cung méo mó. Trên siêu âm, mô cổ tử cung đồng nhất giống như cơ tử cung và không chịu ảnh hưởng bởi sự thay đổi của nội tiết (7). Thỉnh thoảng có thể thấy những nang Naboth cổ tử cung (Hình 11.6).

Lạc nội mạc trong cơ tử cung (adenomyosis)
Lạc nội mạc trong cơ tử cung là một bệnh lý phổ biến gây ảnh hưởng chủ yếu ở những phụ nữ trong giai đoạn muộn của độ tuổi sinh sản. Tần suất khoảng 30% phụ nữ nói chung và có khi đến 70% mẫu mô cắt tử cung tùy vào định nghĩa (8). Lạc nội mạc trong cơ tử cung được định nghĩa là sự hiện diện của tuyến nội mạc tử cung và chất nền trong cơ tử cung gây phản ứng phì đại và tăng sản mô cơ tử cung xung quanh.
Phần lớn bệnh nhân không có triệu chứng. Các triệu chứng của lạc nội mạc trong cơ tử cung bao gồm thống kinh, đau khi giao hợp, đau vùng chậu mạn tính và rong kinh rong huyết. Lạc nội mạc trong cơ tử cung hầu hết lan tỏa toàn bộ tử cung (Hình 11.17) nhưng cũng có thể biểu hiện khu trú ở một vùng của tử cung được gọi là u lạc nội mạc tử cung trong cơ (adenomyoma) (Hình 11.18). Lạc nội mạc trong cơ tử cung đôi khi kết hợp với các bệnh lý khác của tử cung như u xơ tử cung và polyp nội mạc tử cung. Chẩn đoán lâm sàng khó khăn do triệu chứng mơ hồ. Tử cung to đồng nhất (hình cầu) khi khám phụ khoa gợi ý chẩn đoán (Hình 11.17).
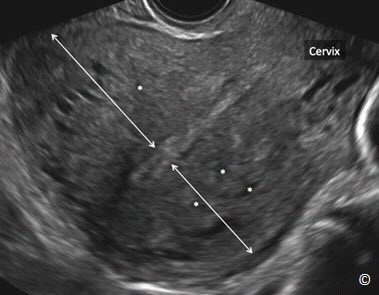
Hình 11.17: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc cho thấy hình ảnh lạc nội mạc trong cơ tử cung lan tỏa. Lưu ý tử cung phì đại hình cầu, thành trước và thành sau dày không đều (mũi tên) và nhiều khoảng echo trống trong cơ tử cung (dấu hoa thị). Cổ tử cung (Cervix) được gắn nhãn để định hướng. Xem chi tiết ở Bảng 11.2
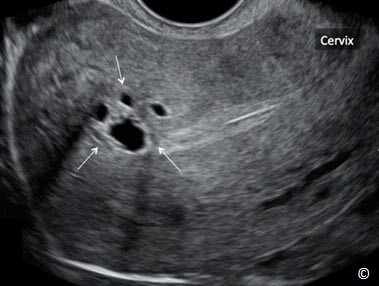
Hình 11.18: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc cho thấy hình ảnh lạc nội mạc trong cơ tử cung khu trú (mũi tên). Lưu ý rằng có nhiều khoảng echo trống trong cơ tử cung. Xem thêm Bảng 11.2. Cổ tử cung (Cervix) được gắn nhãn để định hướng hình ảnh. Hình ảnh do Dr. Bernard Benoit cung cấp.
Đặc điểm siêu âm của lạc nội mạc trong cơ tử cung đã được mô tả trong y văn (9) và được liệt kê trong Bảng 11.2. Hình 11.17 đến Hình 11.19 minh họa những đặc điểm siêu âm thường gặp của lạc nội mạc trong cơ tử cung. Chẩn đoán lạc nội mạc trong cơ tử cung bằng siêu âm có ý nghĩa đặc biệt quan trọng ở những bệnh nhân có triệu chứng lâm sàng và tốt nhất nên được thực hiện qua ngã âm đạo. Trong một số trường hợp khó chẩn đoán phân biệt giữa lạc nội mạc trong cơ tử cung với u xơ tử cung, sử dụng Doppler màu hoặc Doppler xung có thể giúp ích trong chẩn đoán (10,11).
|
BẢNG 11.2: Đặc Điểm Siêu Âm Của Lạc Nội Mạc Trong Cơ Tử cung |
|
Tử cung phì đại hình cầu Khoảng echo trống trong cơ tử cung Thành trước và thành sau tử cung dày không đều Những đường hồi âm dày hướng từ nội mạc vào lớp cơ tử cung Cấu trúc echo không đồng nhất Ranh giới giữa nội mạc và cơ tử cung không rõ ràng Vùng chuyển tiếp dày lên |
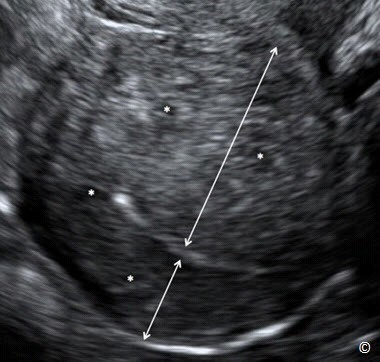
Hình 11.19: Siêu âm tử cung qua ngã âm đạo cho thấy hình ảnh lạc nội mạc trong cơ tử cung lan tỏa. Lưu ý tử cung phì đại hình cầu, thành trước và thành sau dày không đều (mũi tên), có sự hiện diện nhiều khoảng echo trống trong lớp cơ (dấu hoa thị) và cấu trúc không đồng nhất. Xem chi tiết ở Bảng 11.2
Các dị dạng bẩm sinh của tử cung
Tỷ lệ thực sự của dị tật bẩm sinh đường sinh dục nữ chưa rõ ràng (12), có thể khoảng 8 – 10% ở những phụ nữ sẩy thai liên tiếp (13). Dị dạng bẩm sinh tử cung có liên quan đến tăng nguy cơ vô sinh, sẩy thai, sanh non, thai lưu, ngôi bất thường và mổ lấy thai (14,15). Chẩn đoán chính xác loại bất thường tử cung rất quan trọng trong lâm sàng để tiên lượng và cân nhắc khả năng phẫu thuật. Theo phân loại của Hiệp hội sinh sản Hoa Kỳ (1988) có 7 nhóm chính dựa vào sự phát triển của ống Muller và mối quan hệ với khả năng sinh sản: (1) Bất sản và thiểu sản tử cung (agenesis and hypoplasia), (2) tử cung một sừng (unicornuate uteri), (3) tử cung đôi (didelphyls uteri), (4) tử cung 2 sừng (bicornuate uteri), (5) tử cung có vách ngăn (septate uteri), (6) tử cung hình cung (arcuate uteri), (7) các dị dạng liên quan đến hội chứng phơi nhiễm diethylstilbestrol (16). Trong phân loại này, những bất thường âm đạo, cổ tử cung, vòi trứng, buồng trứng và hệ niệu được mô tả riêng.
Mặt dù siêu âm 2D qua ngã âm đạo được chứng minh là một công cụ sàng lọc tốt các dị dạng tử cung với độ nhạy đến 90% (17,18), tuy nhiên vẫn còn những hạn chế trong việc chẩn đoán chính xác loại bất thường tử cung (19). Sự phát triển của siêu âm 3D giúp khảo sát tử cung ở mặt phẳng trán, điều này cho phép đánh giá chính xác nội mạc và thanh mạc vùng đáy tử cung ở nhiều mặt phẳng khác nhau nhằm phân biệt chính xác các loại dị tật tử cung (Hình 11.20).Trên siêu âm 3D ở mặt phẳng giữa trán (midcoronal plane), chúng ta có thể nhìn rõ chỗ lồi lõm của thanh mạc và nội mạc vùng đáy tử cung và đo được khoảng cách từ giữa đáy tử cung đến đường nối giữa 2 lỗ trong của 2 ống dẫn trứng (Hình 11.21). Bảng 11.3 liệt kê tiêu chí được các tác giả dùng để phân loại dị tật bẩm sinh tử cung trên siêu âm 3D.
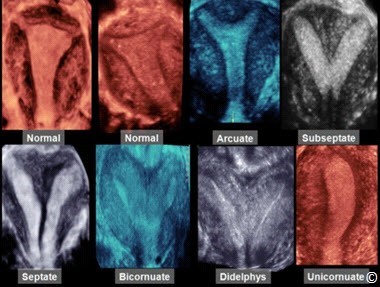
Hình 11.20: Hình ảnh tử cung bình thường và bất thường ở mặt phẳng giữa trán trên siêu âm 3D. Lưu ý hình ảnh rõ ràng của thanh mạc và nội mạc vùng đáy cũng như đoạn dưới tử cung giúp phân biệt các dị tật ống Muller khác nhau. Xem thêm Bảng 11.3. Chỉnh sửa được sự cho phép của Viện Siêu âm Y khoa Mỹ (18).
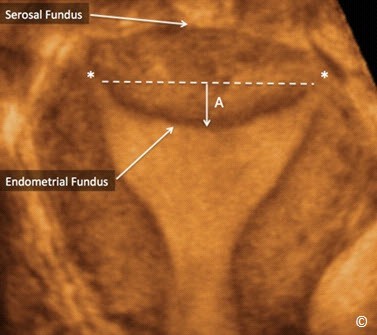
Hình 11.21: Hình ảnh tử cung ở mặt phẳng giữa trán trên siêu âm 3D cho thấy thanh mạc vùng đáy tử cung (Serosal fundus), nội mạc vùng đáy tử cung (Endometrial Fundus) và vị trí của 2 lỗ trong vòi trứng (hoa thị). Lưu ý rằng chỗ lõm của nội mạc vùng đáy tử cung (A) được đo từ trung điểm đường nối 2 lỗ trong vòi trứng đến điểm giữa nội mạc vùng đáy tử cung (mũi tên A). Xem thêm Bảng 11.3. Hình ảnh do Dr. Bernard Benoit cung cấp.
|
Bảng 11.3. Phân Loại Bất Thường Ống Muller Trên Siêu Âm 3D |
||
|
Hình dạng tử cung |
Nội mạc đáy tử cung |
Thanh mạc đáy tử cung |
|
Bình thường |
Thẳng hoặc hơi lổi |
Cong đều hoặc lõm |
|
Hình cung (Arcuate) |
Nội mạc đáy lõm với góc đo được ở điểm giữa là góc tù (>90°) – hoặc lõm |
Cong đều hoặc lõm |
|
Vách ngăn không hoàn toàn (Subseptate) |
Hiện diện vách ngăn nhưng chưa đến cổ tử cung, góc đo được ở điểm giữa là góc nhọn (90°) – hoặc lõm > 10mm |
Cong đều hoặc lõm |
|
Vách ngăn hoàn toàn (Septate) |
Hiện diện vách ngăn hoàn toàn chia buồng tử cung từ đáy đến cổ tử cung |
Cong đều hoặc lõm |
|
Hai sừng (Bicornuate) |
2 sừng – 2 buồng tử cung thường thông nhau ở đoạn thân/cổ tử cung |
Đáy lõm >10 mm chia thành 2 sừng |
|
Tử cung đôi (Didelphys) |
2 sừng – 2 buồng tử cung tách rời và không thông nhau |
Đáy lõm >10 mm chia thành 2 sừng |
|
Tử cung một sừng có hoặc không có sừng sơ khai (Unicornuate) |
1 buồng tử cung với 1 đoạn kẽ của vòi trứng và đường viền đáy lõm |
Đáy lõm >10 mm chia thành 2 sừng nếu có sừng sơ khai |
Chúng tôi đã mô tả một kỹ thuật đơn giản trong siêu âm 3D tử cung ở mặt phẳng giữa trán (midcoronal plane) (21). Kỹ thuật này được gọi là kỹ thuật Z, dễ thực hiện, giảm thiểu sự phụ thuộc vào người thực hiện và tăng độ chính xác trong chẩn đoán của siêu âm 3D trong việc phát hiện các bất thường ống Muller. Bảng 11.4 tương ứng từ Hình 11.22 đến 11.26 cho thấy các bước hiển thị tử cung ở mặt phẳng giữa trán từ siêu âm 3D sử dụng kỹ thuật Z.
|
Bảng 11.4 .Kỹ thuật Z: Các bước dựng lại hình ảnh tử cung ở mặt phẳng giữa trán trên siêu âm 3D [Chỉnh sửa được Viện Siêu âm Y khoa Hoa Kỷ (21) chấp nhận] |
|
Bước 1. Đặt điểm tham chiếu/xoay ở khoảng giữa của lớp nội mạc tử cung trên mặt cắt dọc (Hình 11.22) Bước 2. Dùng nút xoay Z để chỉnh trục dọc của nội mạc tử cung nằm ngang ở mặt cắt dọc của tử cung (Hình 11.23) Bước 3. Đặt điểm tham chiếu/xoay ở khoảng giữa của lớp nội mạc tử cung ở mặt cắt ngang (Hình 11.24) Bước 4. Dùng nút xoay Z để chỉnh trục dọc của nội mạc tử cung nằm ngang ở mặt cắt ngang của tử cung (Hình 11.25) Bước 5. Sau bước 4, mặt cắt giữa trán của tử cung hiển thị ở mặt phẳng C (Hình 11.25), dùng nút xoay Z trên mặt cắt C để hiển thị mặt cắt giữa trán theo hướng ‘truyền thống’ (Hình 11.26) |
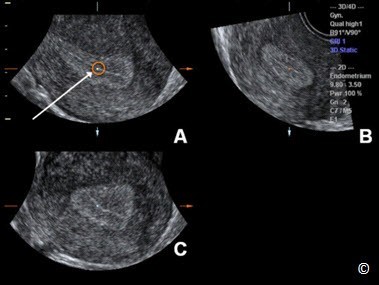
Hình 11.22: Hình ảnh tử cung ở nhiều mặt phẳng khác nhau trên siêu âm 3D.
Mặt phẳng A hiển thị mặt cắt tham chiếu (trường hợp này là mặt cắt dọc) và các mặt phẳng B và C hiển thị 2 mặt cắt vuông góc. Bước đầu tiên trong kỹ thuật Z là đặt điểm tham chiếu ở khoảng giữa của nội mạc tử cung trên mặt phẳng A (vòng tròn và mũi tên).
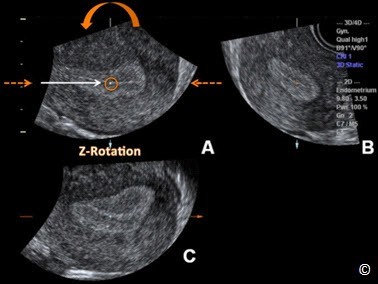
Hình 11.23: Hình ảnh tử cung ở nhiều mặt phẳng khác nhau trên siêu âm 3D (tương tự Hình 11.22).
Bước thứ 2 trong kỹ thuật Z là chỉnh trục dọc của nội mạc tử cung nằm ngang ở mặt phẳng A (mũi tên đứt đoạn) bằng cách xoay mặt phẳng A theo trục Z (mũi tên cong). Mũi tên trắng và vòng tròn thể hiện điểm tham chiếu.
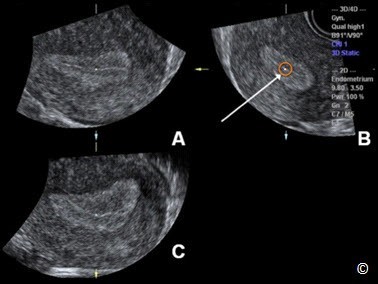
Hình 11.24: Hình ảnh tử cung ở nhiều mặt phẳng khác nhau trên siêu âm 3D (tương tự Hình 11.22). Bước thứ 3 trong kỹ thuật Z là đặt điểm tham chiếu ở khoảng giữa nội mạc tử cung trên mặt cắt ngang (mặt phẳng B). Mũi tên trắng và vòng tròn thể hiện điểm tham chiếu ở mặt phẳng B.
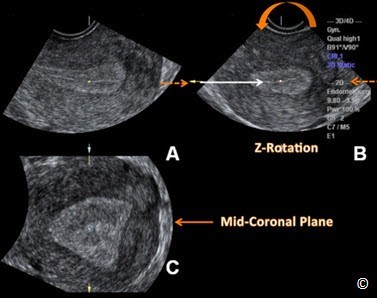
Hình 11.25: Hình ảnh tử cung ở nhiều mặt phẳng khác nhau trên siêu âm 3D (tương tự Hình 11.22). Bước thứ 4 trong kỹ thuật Z là chỉnh trục dọc của nội mạc tử cung nằm ngang ở mặt phẳng B (mũi tên đứt đoạn) bằng cách xoay mặt phẳng B theo trục Z (mũi tên cong). Lưu ý rằng mặt cắt giữa trán (Mid-Coronal Plane) được hiển thị ở mặt phẳng C. Mũi tên trắng chỉ điểm tham chiếu ở mặt phẳng B.
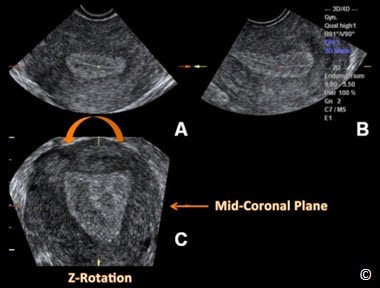
Hình 11.26: Hình ảnh tử cung ở nhiều mặt phẳng khác nhau trên siêu âm 3D (tương tự Hình 11.22).
Bước cuối cùng (bước 5) của kỹ thuật Z là dùng nút xoay Z trên mặt phẳng C để hiển thị mặt cắt giữa trán theo hướng ‘truyền thống’. Hình ảnh được chỉnh sửa dưới sự cho phép của Viện Siêu âm Y khoa Hoa Kỳ (21).
Nhiều tác giả báo cáo độ chính xác cao của siêu âm 3D khi so sánh với kết quả phẫu thuật trong chẩn đoán bất thường tử cung (22,23), một vài nghiên cứu còn cho thấy độ chính xác tương đương với MRI (24). Chúng tôi khuyến cáo sử dụng siêu âm 3D trên bệnh nhân có nghi ngờ bất thường tử cung vì giá thành thấp, không có bức xạ ion, không sử dụng chất tương phản và khả năng chẩn đoán vượt trội, tránh chỉ định nội soi ổ bụng không cần thiết trong những trường hợp chắc chắn (25).
U xơ tử cung
U xơ tử cung (Leiomyomas, Fibroids) là những khối u lành tính thường gặp nhất trong phụ khoa chiếm khoảng 20 – 30% ở phụ nữ trên 35 tuổi (26). Ở độ tuổi 50, khoảng 70% phụ nữ da trắng và hơn 80% phụ nữ da đen có ít nhất một u xơ tử cung và 15-30% trong số đó có triệu chứng (26,27). Về mặt mô học, u xơ tử cung bao gồm cơ trơn và mô liên kết, sự phát triển của u phụ thuộc vào estrogen. Sự hiện diện của sarcoma cơ tử cung (leiomyosarcoma) trong u xơ tử cung hiếm gặp, chiếm khoảng 0,2% các trường hợp. U xơ tử cung gặp nhiều hơn ở phụ nữ da đen (26), mặc dù u xơ tử cung phụ thuộc estrogen nhưng chỉ có khoảng 50% khối u có tăng kích thước trong thai kỳ. Ở phụ nữ hậu mãn kinh, u xơ tử cung thường giảm kích thước và hiếm khi gây triệu chứng lâm sàng. U xơ tử cung có vỏ bao giả (pseudocapsules) do sự chèn ép cơ tử cung xung quanh. U xơ tử cung thường nhiều u và hầu hết không có triệu chứng, được phát hiện khi khám phụ khoa định kỳ sờ thấy khối u hoặc tử cung to ra. Một số trường hợp, u xơ gây xuất huyết tử cung hoặc đau vùng chậu.
U xơ tử cung xuất phát từ lớp cơ tử cung và có thể nằm ở các vị trí giải phẫu khác nhau trong tử cung hoặc các cấu trúc xung quanh. Bảng 11.5 liệt kê các vị trí khác nhau của u xơ tử cung về mặt giải phẫu. Mức độ phát triển của u xơ vào lòng tử cung có ý nghĩa lâm sàng quan trọng giúp xác định khả năng cắt bỏ u xơ qua nội soi buồng tử cung. Thông thường, nếu u xơ tử cung nhô vào lòng tử cung từ 50% trở lên thì có thể nội soi buồng tử cung để cắt u. Hình 11.27 là sơ đồ các loại u xơ tử cung và Hình 11.28 đến 11.31 cho thấy các loại u xơ tử cung trên siêu âm.
|
BẢNG11.5: Các Vị Trí Giải Phẫu Của U Xơ Tử Cung (Hình 11.27) |
|
Trong cơ (Intramural): U xơ nằm trong cơ không đội vào thanh mạc / nội mạc tử cung hoặc đội ít Dưới thanh mạc (Subserosal): Phần lớn u xơ đội ra bề mặt thanh mạc Dưới niêm mạc (Submucosal): Phần lớn u xơ đội vào khoang nội mạc tử cung Có cuống (Pedunculated): U xơ nằm bên ngoài tử cung và có cuống dính vào tử cung Trong lòng tử cung (Intracavitary): U xơ nằm trong buồng tử cung và có cuống dính vào lớp cơ tử cung Cạnh tử cung (Parasitic): U xơ nằm bên ngoài tử cung được cấp máu chủ yếu từ các cấu trúc lân cận tử cung |
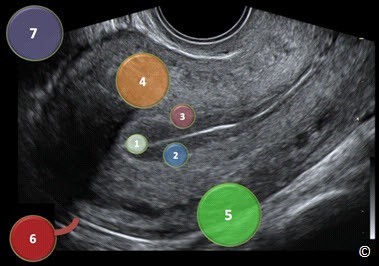
Hình 11.27: Siêu âm qua ngã âm đạo, tử cung ở mặt cắt dọc giữa với sơ đồ hình vẽ để mô tả các vị trí giải phẫu của u xơ tử cung. 1:trong lòng tử cung (intracavitary), 2:dưới niêm mạc (submucosal) >50% nhô vào lòng tử cung, 3:dưới niêm mạc (submucosal)
Hình 11.28: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc giữa cho thấy u xơ trong lòng tử cung (intracavitary leiomyoma) (mũi tên). Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh. Xem Bảng 11.6 về đặc điểm siêu âm.
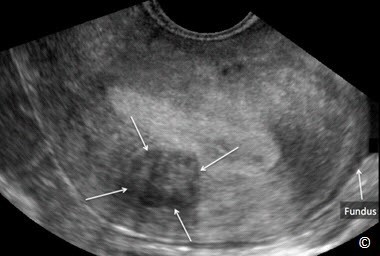
Hình 11.29: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc giữa cho thấy u xơ trong cơ tử cung (intramural leiomyoma) (mũi tên). Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh. Xem Bảng 11.6 về đặc điểm siêu âm.
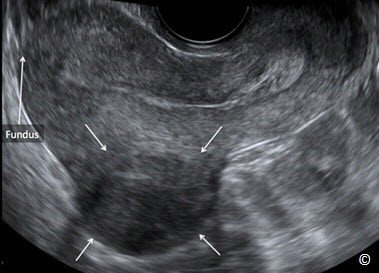
Hình 11.30: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc giữa cho thấy u xơ dưới thanh mạc (subserosal leiomyoma) (mũi tên). Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh. Xem Bảng 11.6 về đặc điểm siêu âm
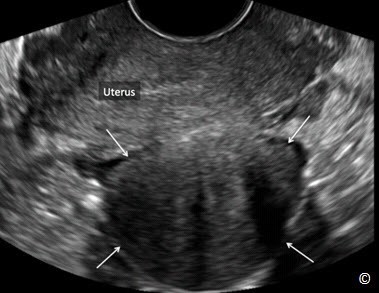
Hình 11.31: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc giữa cho thấy u xơ có cuống (pendunculated leiomyoma) (mũi tên) ở thành sau tử cung. Xem Bảng 11.6 về đặc điểm siêu âm.
Đặc điểm siêu âm của u xơ tử cung được liệt kê trong Bảng 11.6 và các dạng thoái hóa của u xơ tử cung được liệt kê trong Bảng 11.7. Thoái hóa Hyaline là thường gặp nhất và cho hình ảnh một vùng echo trống ở trung tâm khối u xơ (Hình 11.32).
|
BẢNG 11.6: Các Đặc Điểm Siêu Âm Của U Xơ Tử Cung |
|
Khối echo đặc xuất phát từ lớp cơ tử cung Giới hạn rõ (vỏ bao giả – pseudocapsule) Dạng xoắn ốc do cơ trơn và mô liên kết sắp xếp đồng tâm Làm suy giảm đáng kể chùm tia siêu âm Bóng lưng sọc vằn (venetain blind shadowing) (Hình 11.33) Tưới máu ít đến trung bình trên Doppler màu U xơ tử cung có cuống thường di chuyển cùng với tử cung và tách biệt với buồng trứng (Clip 11.1) Trong một vài trường hợp u xơ tử cung có cuống, siêu âm Doppler màu giúp xác định cuống nối với tử cung. |
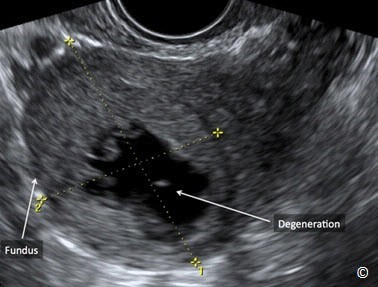
Hình 11.32: Siêu âm qua ngã âm đạo, hình ảnh thoái hóa Hyaline của một u xơ tử cung trong cơ (Degeneration). Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh.
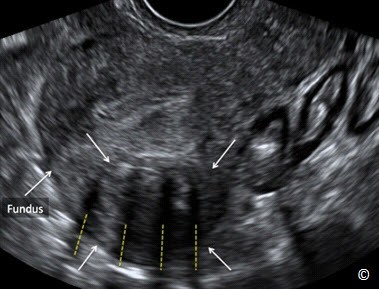
Hình 11.33: Siêu âm tử cung qua ngã âm đạo ở mặt cắt dọc giữa cho thấy u xơ tử cung dưới thanh mạc (mũi tên). Lưu ý bóng lưng sọc vằn điển hình (venetain blinds shadowing) (đường thẳng đứt đoạn). Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh.
|
BẢNG 11.7: Các Dạng Thoái Hóa Của U Xơ Tử Cung |
|
Teo (Atrophic) Hyaline Thoái hóa đỏ (Red/Carneous) Dạng nhầy (Myxoid) Vôi hóa (Calcific) Dạng nang (Cystic) Xuất huyết (Hemorrhagic) |
Bất thường nội mạc tử cung
Xuất huyết tử cung bất thường
Xuất huyết tử cung bất thường (Abnormal Uterine Bleeding – AUB) là một thuật ngữ mô tả sự ra huyết âm đạo ngoài chu kỳ kinh có nguồn gốc từ tử cung ở phụ nữ trong độ tuổi sinh sản. XHTCBT có lượng máu mất, thời gian, tần số và quy luật khác với chu kỳ kinh bình thường. Để chuẩn hóa việc chẩn đoán và điều trị XHTCBT, Tổ chức Sản phụ khoa Quốc tế (The International Federation of Gynecology and Obstetrics – FIGO) năm 2011 đã đưa ra một phân loại mới của XHTCBT được viết tắt là PALM-COEIN đại diện cho polyps, adenomyosis (lạc nội mạc trong cơ tử cung), leiomyoma (u xơ tử cung), malignancy (bệnh ác tính) (tăng sản nội mạc tử cung-hyperplasia), coagulopathy (rối loạn đông máu), ovulatory dysfusion (rối loạn chức năng rụng trứng), endometrial iatrogenic (do điều trị) và not yet classification (chưa phân loại được) (28). Hiệp hội Sản phụ khoa Hoa Kỳ (ACOG) đã ủng hộ áp dụng phân loại này trên tạp chí thực hành chẩn đoán XHTCBT ở phụ nữ trong độ tuổi sinh sản (29). Thuật ngữ XHTCBT do rối loạn chức năng (dysfunctional uterine bleeding) thường dùng để chỉ xuất huyết tử cung bất thường nên bỏ đi (28,29).
Việc đánh giá bệnh nhân XHTCBT nằm ngoài phạm vi của sách này nhưng thông thường bao gồm bệnh sử, khám lâm sàng, các xét nghiệm và hình ảnh học, sinh thiết nội mạc tử cung nếu có chỉ định, tùy thuộc vào độ tuổi của bệnh nhân có triệu chứng. Không đủ bằng chứng để khuyến cáo sử dụng siêu âm qua ngã âm đạo để đánh giá nội mạc tử cung dày ở phụ nữ XHTCBT trong độ tuổi sinh sản nếu không có các yếu tố nguy cơ của ung thư nội mạc tử cung (endometrial carcinoma). Siêu âm qua ngã âm đạo được dùng như một phương pháp sàng lọc giúp đánh giá lòng tử cung để phát hiện u xơ tử cung và polyp. Ở phụ nữ mãn kinh, siêu âm qua ngã âm đạo cho thấy nội mạc tử cung đồng dạng và mỏng từ 4mm trở xuống giúp loại trừ khả năng ác tính. Điều này sẽ được bàn sâu trong chương này.
Polyp nội mạc và u xơ tử cung dưới niêm
Tổn thương khu trú nội mạc tử cung thường gặp bao gồm polyp nội mạc và u xơ tử cung dưới niêm lần lượt chiếm khoảng 30% và 10% các trường hợp xuất huyết hậu mãn kinh (3). Siêu âm bơm nước buồng tử cung là một phương pháp chẩn đoán hình ảnh vượt trội so với siêu âm ngã âm đạo đơn thuần trong việc đánh giá các tổn thương nội mạc lòng tử cung như polyp (Hình 11.34) và u xơ tử cung (31). Hiệu quả của siêu âm bơm nước buồng tử cung trong chẩn đoán polyp nội mạc và u xơ tử cung dưới niêm đã được chứng minh tương đương với nội soi buồng tử cung trong nhiều nghiên cứu (32).
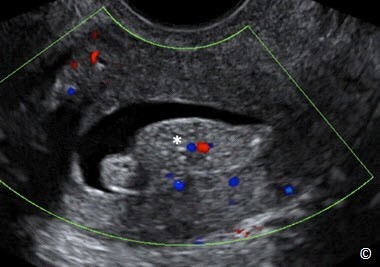
Hình 11.34: Siêu âm bơm nước buồng tử cung qua ngã âm đạo với Doppler màu ở mặt cắt dọc giữa tử cung cho thấy một polyp nội mạc tử cung (dấu hoa thị). Lưu ý hồi âm của polyp cao hơn mô cơ tử cung.
Polyp nội mạc tử cung trên siêu âm bơm nước buồng tử cung có hồi âm cao hơn cơ tử cung xung quanh, nằm hoàn toàn trong buồng tử cung không lấn vào lớp cơ, có hồi âm đồng nhất với phần đáy hẹp dính với cơ tử cung (Hình 11.34). Siêu âm Doppler màu giúp xác định một cuống mạch máu nằm ở phần đáy của polyp trong đa số các trường hợp (Hình 11.35 và 11.36). Đôi khi có những biến đổi dạng nang bên trong polyp. Polyp cũng có thể xuất hiện ở đoạn eo của khoang nội mạc (Hình 11.36) và kênh cổ tử cung. U xơ tử cung dưới niêm mạc trên siêu âm bơm nước buồng tử cung có hồi âm thấp hơn cơ tử cung xung quanh, đáy rộng và đội nội mạc tử cung khi chúng phát triển vào khoang nội mạc với các mức độ khác nhau (Hình 11.37). U xơ tử cung dưới niêm mạc xuất phát từ lớp cơ tử cung dưới niêm mạc nên một phần u xơ tử cung kéo dài đến lớp cơ tử cung, đây là một đặc điểm phân biệt với polyp nội mạc tử cung. Một đặc điểm quan trọng khác để phân biệt với polyp nội mạc là u xơ tử cung dưới niêm thường có bóng lưng trên siêu âm (Hình 11.37). Bảng 11.8 liệt kê các đặc điểm phân biệt giữa polyp và u xơ dưới niêm. Mức độ phát triển của u xơ dưới niêm vào lòng tử cung có liên quan với lâm sàng. U xơ tử cung đội vào khoang nội mạc trên 50% cho phép nội soi buồng tử cung cắt u.
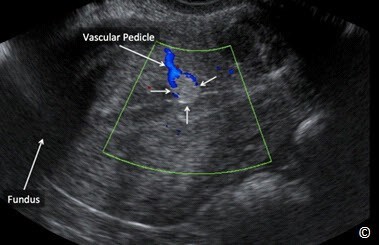
Hình 11.35: Siêu âm qua ngã âm đạo với Doppler màu ở mặt cắt dọc giữa tử cung cho thấy một polyp nội mạc tử cung nhỏ (mũi tên). Lưu ý hồi âm của polyp cao hơn so với cơ tử cung và sự hiện diện của cuống mạch máu ( Vascular Pedicile) trên Doppler màu. Đáy tử cung (Fundus) được dán nhãn để định hướng hình ảnh.
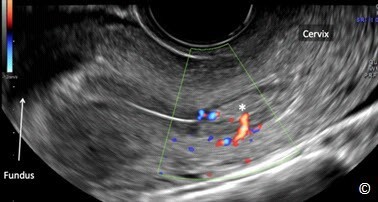
Hình 11.36: Siêu âm qua ngã âm đạo với Doppler màu ở mặt cắt dọc giữa tử cung cho thấy một polyp nội mạc tử cung (dấu hoa thị) ở đoạn eo của khoang nội mạc. Lưu ý sự hiện diện của cuốn mạch máu trên Doppler màu. Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh.
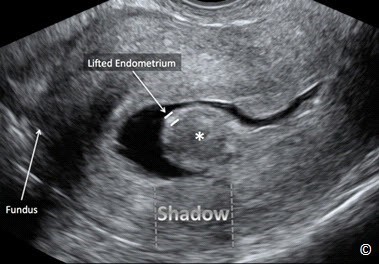
Hình 11.37: Siêu âm qua ngã âm đạo với Doppler màu ở mặt cắt dọc giữa tử cung cho thấy một u xơ tử cung dưới niêm mạc (dấu hoa thị). Lưu ý hồi âm của u xơ tử cung dưới niêm tương đượng với cơ tử cung. Nội mạc tử cung bị đội lên (dấu bằng) bao quanh u xơ trong khoang nội mạc. Chú ý bóng lưng (shadow-mũi tên đứt đoạn) của u xơ tử cung. Đáy tử cung (Fundus) được gắn nhãn để định hướng hình ảnh.
|
BẢng 11.8: Các đặc điểm siêu âm giúp phân biệt Polyp nội mạc tử cung và u xơ tử cung dưới niêm mạc |
|
Polyp nằm hoàn toàn trong khoang nội mạc tử cung trong khi u xơ tử cung kéo dài đến lớp cơ tử cung Độ hồi âm của polyp tương tự lớp nội mạc tử cung trong khi độ hồi âm của u xơ tử cung tương tự cơ tử cung (kém hơn) Polyp thường có một cuống mạch máu nhìn thấy được trên Doppler màu và cấu trúc echo đồng nhất U xơ tử cung đội vào lớp nội mạc tử cung U xơ tử cung thường có bóng lưng |
Dính lòng tử cung và sót thai sót nhau
Một số bệnh lý khác của nội mạc có thể chẩn đoán bằng siêu âm bơm nước buồng tử cung bao gồm dính lòng tử cung (intrauterine adhesions) và sót thai sót nhau (retained products of conception-RPOC). Dính lòng tử cung thấy rõ trên siêu âm bơm nước buồng tử cung như một dải echo dày (kích thước dày hoặc mỏng) bám vào thành nội mạc (Hình 11.38). Siêu âm bơm nước buồng tử cung là phương tiện hình ảnh tốt nhất để chẩn đoán dính lòng tử cung (33) được cân nhắc ở những bệnh nhân có can thiệp dụng cụ vào buồng tử cung trước đó. Sót thai sót nhau có hình ảnh là một khối echo dày trong lòng tử cung (Hình 11.39). Thường gặp ở những phụ nữ sau phá thai, sẩy thai hoặc sau sanh.
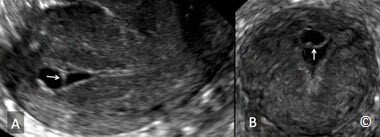
Hình 11.38: Siêu âm bơm nước buồng tử cung ở một bệnh nhân nghi ngờ có dính buồng tử cung. Lưu ý sự hiện diện của lớp màng mỏng trong mặt phẳng dọc (mũi tên A) và ngang (mũi tên B). Các mặt phẳng này có được từ siêu âm 3D thể tích.
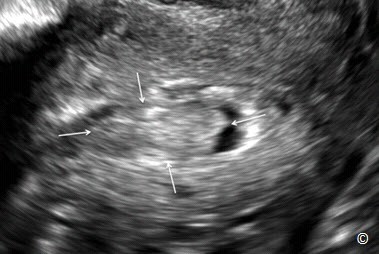
Hình 11.39: Siêu âm bơm nước buồng tử cung ở mặt phẳng dọc giữa cho thấy một khối echo dày (mũi tên) nghi ngờ sót thai hoặc sót nhau. Bệnh nhân này sanh khó 5 tuần trước.
Tăng sản nội mạc tử cung và ung thư
Ung thư nội mạc tử cung (endometrial cancer) là loại ung thư phụ khoa thường gặp nhất ở Mỹ với triệu chứng thường gặp nhất là xuất huyết âm đạo (34,35). Khi phụ nữ mãn kinh có xuất huyết âm đạo, cần tiếp cận một cách hệ thống để lọai trừ ung thư nội mạc tử cung và tăng sản nội mạc tử cung (hyperplasia). Nếu nội mạc tử cung dày từ 4mm trở xuống trên siêu âm qua ngã âm đạo ở phụ nữ xuất huyết hậu mãn kinh có thể giúp loại trừ ung thư nội mạc tử cung và không cần tiến hành các phương pháp đánh giá nội mạc sâu hơn. Do đó, siêu âm qua ngã âm đạo là phương pháp tiếp cận đầu tiên để đánh giá và theo dõi chảy máu sau mãn kinh. Nếu nội mạc tử cung dày trên 4mm, cần thực hiện những phương pháp đánh giá nội mạc tử cung sâu hơn bao gồm: sinh thiết nội mạc, siêu âm bơm nước buồng tử cung và nội soi buồng tử cung. Nếu sinh thiết nội mạc được thực hiện đầu tiên nhưng mẫu mô không đủ để chẩn đoán thì có thể kết hợp siêu âm qua ngã âm đạo và nếu nội mạc tử cung dày 4mm ở phụ nữ không triệu chứng không có ý nghĩa rõ ràng và không nên làm gì thêm nếu bệnh nhân không nằm trong nhóm nguy cơ cao ung thư nội mạc tử cung (37). Điều quan trọng cần lưu ý là chỉ nên đo độ dày nội mạc ở mặt phẳng dọc giữa tử cung (midsagital plane) với nội mạc từ vùng đáy đến vùng thân/cổ tử cung được quan sát rõ (Hình 11.13). Nếu không cắt được mặt phẳng này hoặc không thể quan sát rõ bề dày của nội mạc tử cung thì siêu âm qua ngã âm đạo không được dùng để đánh giá nội mạc ở phụ nữ xuất huyết hậu mãn kinh và phải thay thế bằng phương pháp khác. Giá trị của việc sử dụng siêu âm qua ngã âm đạo như một phương pháp sàng lọc ung thư nội mạc tử cung chưa được chứng minh vì vậy không nên áp dụng trên lâm sàng.
Tăng sản nội mạc tử cung (Hyperplasia) có thể lan tỏa hoặc khu trú. Trên siêu âm bơm nước buồng tử cung, tăng sản nội mạc lan tỏa biểu hiện là sự dày lên của nội mạc tử cung. Trong khi đó tăng sản nội mạc tử cung khu trú biểu hiện là một khối echo dày có đáy rộng nhưng không gây biến dạng vùng chuyển tiếp nội mạc-cơ tử cung. Đôi khi khó hẩn đoán phân biệt giữa tăng sản nội mạc tử cung khu trú và polyp nội mạc tử cung. Ung thư nội mạc tử cung có các đặc điểm siêu âm tương tự tăng sản nội mạc tử cung hoặc một polyp lớn, tuy nhiên ung thư có xâm lấn cơ tử cung và một số trường hợp có thể nhìn thấy trên siêu âm. Hình 11.40 đến 11.42 cho thấy hình ảnh siêu âm của ung thư nội mạc và tử cung.
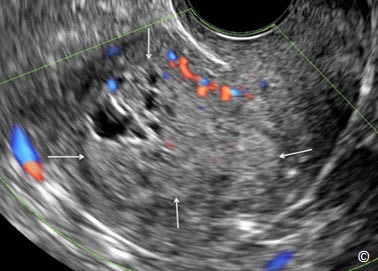
Hình 11.40: Siêu âm tử cung qua ngã âm đạo tử cung với mặt phẳng đứng dọc ở bệnh nhân ung thư nội mạc tử cung. Lưu ý nội mạc tử cung dày và không đồng nhất (mũi tên).
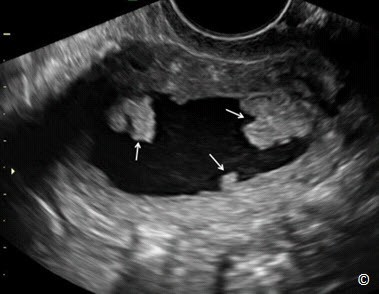
Hình 11.41: Siêu âm bơm nước buồng tử cung với mặt phẳng đứng dọc ở bệnh nhân ung thư nội mạc tử cung. Lưu ý có nhiều chồi trong khoang nội mạc tử cung (mũi tên).
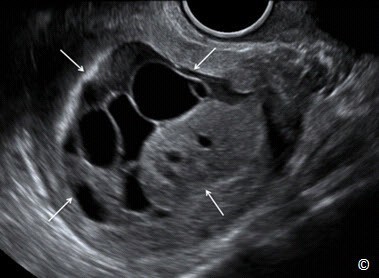
Hình 11.42: Siêu âm bơm nước buồng tử cung với mặt phẳng đứng dọc ở bệnh nhân có khối u tử cung. Lưu ý bệnh học của khối hỗn hợp (mũi tên) là sarcoma tử cung
Dị dạng động tĩnh mạch
Dị dạng động tĩnh mạch tử cung (AVM-ateriovenous malformations) khi có sự thông nối trực tiếp giữa hệ thống động mạch và tĩnh mạch tử cung và là một bất thường hiếm gặp. Thường xảy ra sau các can thiệp dụng cụ vào buồng tử cung (hay gặp trong sẩy thai hoặc sanh non). Đôi khi, chúng có liên quan đến bệnh lý ác tính, nhiễm trùng hoặc sót thai sót nhau trong thai trứng (38,39). AVM cũng có thể bẩm sinh, dạng nảy ít gặp hơn và ít triệu chứng hơn dạng mắc phải (40).
Biểu hiện lâm sàng thường gặp của AVM là xuất huyết âm đạo nhiều ở bệnh nhân có can thiệp dụng cụ vào buồng tử cung sau khi mang thai. Các triệu chứng khác ít gặp hơn bao gồm đau vùng chậu (pelvic pain) và đau khi giao hợp (dyspareunia). Chẩn đoán AVM tốt nhất qua siêu âm ngã âm đạo với Doppler màu hoặc Doppler xung. Trên siêu âm thang xám, AVM là những vùng phản âm trống (anechoic), bờ không đều, thường nằm trong cơ tử cung gần vùng chuyển tiếp với nội mạc tử cung (Hình 11.43). Trên siêu âm Doppler màu cho hình ảnh dòng chảy xoáy (turbulent flow) bên trong những vùng phản âm trống (Hình 11.44) và Doppler xung cho thấy dòng chảy có vận tốc cao, trở kháng thấp (Figure 11.45). Siêu âm Doppler màu và Doppler xung hữu ích trong việc chẩn đoán AVM và giúp phân biệt với giả phình mạch (pseudoaneurysm). Giả phình mạch cũng có thể xuất hiện sau can thiệp dụng cụ vào buồng tử cung, có dòng máu xoáy bên trong động mạch, có vận tốc cao và trở kháng cao trên siêu âm Doppler màu và Doppler xung (41).
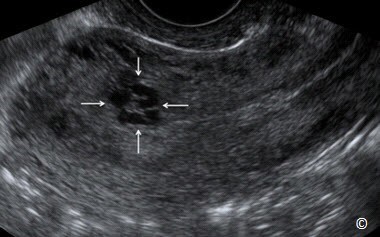
Hình 11.43: Siêu âm qua ngã âm đạo ở mặt cắt dọc tử cung cho thấy dị dạng động tĩnh mạch (AVM-ateriovenous malformations) (mũi tên). Lưu ý hình ảnh siêu âm của AVM là những vùng echo trống có bờ không đều nằm trong cơ tử cung gần vùng chuyển tiếp với nội mạc tử cung.
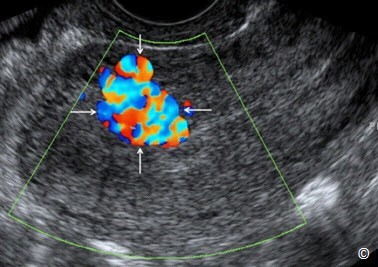
Hình 11.44: Siêu âm Doppler màu qua ngã âm đạo ở mặt cắt dọc tử cung dị dạng động tĩnh mạch ở Hình 11.43 (mũi tên). Lưu ý sự hiện diện của dòng máu xoáy bên trong AVM.
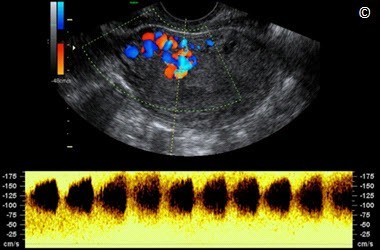
Hình 11.45: Siêu âm qua ngã âm đạo phổ Doppler màu và Doppler xung ở mặt cắt dọc tử cung dị dạng động tĩnh mạch ở Hình 11.43 (mũi tên). Lưu ý dạng sóng dòng chảy có trở kháng thấp, vận tốc cao (100 cm/giây).
AVM nên được điều trị bảo tồn nếu bệnh nhân không ra máu nhiều và tình trạng thiếu máu không đáng kể. Theo kinh nghiệm của chúng tôi và một số chuyên gia khác đề nghị điều trị bảo tồn bệnh nhân có AVM với thời gian từ 2 – 5 tháng (42). Thuyên tắc động mạch qua catheter là phương pháp được ưa chuộng nếu điều trị bảo tồn thất bại hoặc trong trường hợp ra máu nhiều. Thuyên tắc động mạch qua catheter được báo cáo thành công với tỷ lệ 50 – 70% (43). Tiên lượng lâu dài tốt (khả năng có thai) ở những phụ nữ AVM thoái triển sau điều trị bảo tồn hoặc thuyên tắc động mạch (44).
Tài liệu tham khảo:
AIUM practice guideline for the performance of pelvic ultrasound examinations. American Institute of Ultrasound in Medicine. J Ultrasound Med. 2010;29 (1):166-72.
AIUM practice guideline for ultrasonography in reproductive medicine. American Institute of Ultrasound in Medicine; Society for Reproductive Endocrinology and Infertility; American Society of Reproductive Medicine. J Ultrasound Med. 2009;28(1):128-37.
Bonnamy L, Marret H, Perrotin F, Body G, Berger C, Lansac J. Sonohysterography: a prospective survey of results and complications in 81 patients. Eur J Obstet Gynecol Reprod Biol 2002;102:42-47.
Merz E, Miric-Tesanic D, Bahlmann F, Weber G, Wellek S. Sonographic size of uterus and ovaries in pre- and postmenopausal women. Ultrasound Obstet Gynecol. 1996;7(1):38-42.
Fleischer AC, Kalemeris GC, Entman SS. Sonographic depiction of the endometrium during normal cycles. Ultrasound Med Biol. 1986;12(4):271-7.
Santolaya-Forgas J. Physiology of the menstrual cycle by ultrasonography. J Ultrasound Med. 1992;11(4):139-42.
Duijkers IJ, Klipping C.Ultrasonographic assessment of endocervix and cervical mucus in ovulatory menstrual cycles. Eur J Obstet Gynecol Reprod Biol. 2000;93(1):13-7.
R Azziz. Adenomyosis: current perspectives. Obstet Gynecol Clin North Am 1989;16:221-35.
Sakhel K, Abuhamad A. Sonography of Adenomyosis. J Ultrasound Med 2012 May;31(5):805-8.
Botsis D, Kassanos D, Antoniou G, Pyrgiotis E, Karakitsos P, Kalogirou D. Adenomyoma and leiomyoma: differential diagnosis with transvaginal sonography. J Clin Ultrasound. 1998;26(1):21-5.
Chiang CH, Chang MY, Hsu JJ. Tumor vascular pattern and blood flow impedance in the differential diagnosis of leiomyoma and adenomyosis by color Doppler sonography. J Assist Reprod Genet. 1999;16(5):268-75.
Acien P, Acien M, Sanchez-Ferrer ML. Complex malformations of the female genital tract. New types and revision of classification. Hum Reprod 2004; 19:2377-2384
Raga F, Bauset C, Remohi J, Bonilla-Musoles F, Simon C, Pellicer A. Reproductive impact of congenital Mullerian anomalies. Hum Reprod 1997;12(10):2277-2281
Rock JA and Schlaff WD. The obstetric consequences of uterovaginal anomalies. Fertil Steril 1985; 43:681
Ludmir J, Samuels P, Brooks S. Pregnancy outcome of patients with uncorrected uterine anomalies managed in a high risk obstetric setting. Obstet Gynecol 1990; 75:906
The American Fertility Society. The American Fertility Society classifications on adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, Mullerian anomalies and intrauterine adhesions. Fertil Steril 1988;49:944-955.
Pellerito JS,McCarthy SM, Doyle MB, Glickman MG, DeCherney AH. Diagnosis of uterine anomalies: relative accuracy of MR imaging, endovaginal ultrasound, and hysterosalpingography. Radiology 1992; 183:795-800.
Bocca SM, Abuhamad AZ. Use of 3-dimensional sonography to assess uterine anomalies. J Ultrasound in Medicine2013;32:1.
Randolph J, Ying Y, Maier D, Schmidt C, Riddick D. Comparison of real time ultrasonography, hysterosalpingography, and laparoscopy/hysteroscopy in the evaluation of uterine abnormalities and tubal patency. Fertil Steril 1986; 5:828-832.
Salim R, Woelfer B, Backos M, Regan L, Jurkovic D. Reproducibility of three- dimensional ultrasound diagnosis of congenital uterine anomalies.Ultrasound Obstet Gynecol 2003; 21:578–582.
Abuhamad A, Singleton S, Zhao Y, Bocca S. The Z technique: an easy approach to the display of the mid-coronal plane of the uterus in volume sonography. J Ultrasound Med 2006; 25:607-612.
Deutch T, Bocca S, Oehninger S, et al. Magnetic resonance imaging versus three- dimensional transvaginal ultrasound for the diagnosis of Mullerian anomalies. Fertil Steril 2006;86:S308
Bocca S, Abuhamad A. Use of 3-Dimensional Sonography to Assess Uterine Anomalies. J Ultrasound Med 2013;32:1-6.
Deutch TD, Abuhamad AZ. The role of 3-dimensional ultrasonography and magnetic resonance imaging tin the diagnosis of mullerian duct anomalies: a review of the literature. J Ultrasound Med 2008;27(3):413-23.
Bocca SM, Oehninger S, Stadtmauer L, Agard J, Duran H, Sarhan A, Horton S,
Abuhamad A. Prospective study to evaluate the costs, accuracy, risks and benefits of 3D ultrasound compared to other imaging modalities in women with intrauterine lesions. J Ultrasound Med 2012;31:81-85.
Baird DD, Dunson DB, Hill MC, Cousins D, Schectman JM. High cumulative incidence of uterine leiomyoma in black and white women: ultrasound evidence. Am J Obstet Gynecol 2003;188:100-7.
Catherino WH, Parrott E, Segars J. Proceedings from the National Institute of Child
Health and Human Development conference on the Uterine Fibroid Research Update Workshop. Fertil Steril 2011;95:9-12
Munro MG, Critchley HO, Broder MS, Fraser IS. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. FIGO Working Group on Menstrual Disorders. Int J Gynaecol Obstet 2011;113:3–13.
ACOG Practice Bulletin on Diagnosis of Abnormal Uterine Bleeding in Reproductive-Aged Women. Number 128, July 2012.
N O’Connoll LP, Fries MH, Aeringue E, Brehm W. Triage of abnormal postmenopausal bleeding: a comparison of endometrial biopsy and transvaginal sonohysterography versus fractional curettage with hysteroscopy. Am J Obstet Gynecol 1998;178:956-61.
Schwarzler P, Concin H, Bosch H, Berlinger A, Wohlgenannt K, Collins WP, et al. An evaluation of sonohysterography and diagnostic hysteroscopy for the assessment of
Kelekci S, Kaya E, Alan M, Alan Y, Bilge U, Mollamahmutoglu L. Comparison of transvaginal sonography, saline infusion sonography, and office hysteronscopy in reproductive-aged women with or without abnormal uterine bleeding. Fertil Steril 2005;84:682–6.
Soares SR, Barbosa dos Reis MM, Camargos AF, Diagnostic accuracy of sonohysterography, transvaginal sonography, and hysterosalpingography in patients with uterine cavity diseases. Fertil Steril 2000;73:406-11.
American Cancer Society: Cancer Facts and Figures 2008. Atlanta, Georgia ACS: 2008. www.cancer.org/STT/2008CAFFFinalSecured.pdf
Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R et al.
Evaluation of the woman with postmenopausal bleeding. Society of Radiologists in
Ultrasound-Sponsored consensus conference statement. J Ultrasound Med 2001;20:1025-36
Bakour SH, Khan KS, Gupta JK. Controlled analysis of factors associated with insufficient samples on outpatient endometrial biopsy. BJOG 2000; 107:1312-4.
Fleischer AC, Wheeler JE, Lindsay I, Hendrix SL, Grabill S, Kravitz B. An assessment of the value of ultrasonographic screening for endometrial disease in postmenopausal women without symptoms. A J Obstet Gynecol 2001; 184:70-5.
Kwon JH, Kim GS. Obstetric iatrogenic arterial injuries of the uterus: diagnosis with US and treatment with transcatheter arterial embolization. Radiographics 2002; 22:35–46.
Yahi-Mountasser H, Collinet P, Nayama M, Boukerrou M, Robert Y, Deruelle P. Les malformations artério-veineuses intra-utérines. À propos de 4 cas. J Gynecol Obstet Biol Reprod (Paris) 2006; 35:614–20.
Bauer V, Briex M, De Meeus JB, Drouineau J, Ferrie JC, Magnin G. Malformation artérioveineuse congénitale de l’artère iliaque interne découverte au cours de la grossesse. J Gynecol Obstet Biol Reprod (Paris) 1993; 22:312–6.
S. Sanguin, S. Lanta-Delmas, A. Le Blanche, E. Grardel-Chambenoit, P. Merviel, J. Gondry, R. Fauvet. Diagnostic et traitement des malformations artério-veineuses utérines (MAVU) en 2011
Timmerman D, Van Den Bosch T, Peeraer K, Debrouwere E, Van Schoubroeck D, Stockx L, et al. Vascular malformations in the uterus: ultrasonographic diagnosis and conservative management. Eur J Obstet Gynecol Reprod Biol 2000; 92:171–8.
Kwon JH, Kim GS,: Obstetric iatrogenic arterial injuries of the uterus: Diagnosis with US and treatment with transcatheter arterial embolization. Radiographics 2002;22:35.
Delotte J, Chevallier P, Benoit B, Castillon JM, Bongain A. Pregnancy after embolization therapy for uterine arteriovenous malformation. Fertil Steril 2006;85:228.
Nguồn: “Siêu âm trong phụ khoa và sản khoa: một cách tiếp cận thực tế”
Tác giả : Rabih Chaoui, MDPhilippe Jeanty, MD Dario Paladini, MD