Cân bằng acid-base và hệ đệm
Độ pH của dịch cơ thể phản ánh nồng độ ion hydro ([H+]): sự thay đổi pH 0,1 cho thấy sự thay đổi 10 lần trong [H+]. Độ pH động mạch thường được giữ trong phạm vi hẹp bởi tác động của bộ đệm, bao gồm Hb và albumin. Phosphate (H2PO4–/H2PO42-) đóng một vai trò nhỏ, với cặp đệm carbonic (yếu) axit/bicarbonate có tầm quan trọng lớn hơn nhiều:
H+ + HCO3– H2CO3 H2O + CO2
Nếu sự đệm của H+ do chuyển hóa là không đủ, pH sẽ trở nên bất thường (“nhiễm toan chuyển hóa”). Phản ứng đầu tiên là sự gia tăng thông khí phút (tần số thở và thể tích khí lưu thông), “tăng thải” CO2 và do đó “kéo” H+ từ phía bên trái của phương trình. Nếu bệnh nhân được thông khí bắt buộc, thì bạn có thể làm điều này cho họ. Trong thời gian dài hơn (thường là nhiều ngày), bù trừ thận xảy ra: nhiễm toan đường hô hấp (trong COPD, ví dụ) có thể được bù đắp bằng cách giữ bicarbonat do thận.
Kiềm dư (BE, Base excess, thông thường –2 đến +2) là giá trị được tính toán, và đại diện cho số lượng mEq của bộ đệm cần phải được thêm vào một lít máu để khôi phục pH đến 7,4 ở nhiệt độ 37°C và pCO2 là 5,3 kPa. Nếu con số này là âm (tức là BE 8), thì 8mEq sẽ cần phải được thêm vào để khôi phục pH – và máu của bệnh nhân là “quá axit”.
Toan chuyển hóa
Điều này có thể là do:
Quá ít bicarbonate
mất bicarbonate dư thừa (ví dụ, mất thận, hoặc mất từ ruột non fi stulae) giảm sản xuất bicarbonate (ví dụ:suy thận).
Quá nhiều axit
sản xuất axit dư thừa (ví dụ, sản xuất axit lactic bởi khối u hoặc từ thiếu máu cục bộ hoặc toàn cầu; ketoacids trong nhiễm độc ketoacid) giảm độ thanh thải axit (ví dụ:suy gan), hoặc ăn quá nhiều axit (bất thường nhất!).
Khi phải đối mặt với một toan chuyển hóa, do đó, nên xác định rằng:
Đường huyết là bao nhiêu và bình thường không (để loại trừ nhiễm toan keto-acide do tiểu đường)
Lactate là bình thường (để loại trừ nhiễm toan lactic)
Chức năng thận bình thường (hoặc, nếu không, có thể không phải là nguyên nhân duy nhất gây ra nhiễm toan)
Clorua là bình thường. Tính trung lập điện phải được duy trì trong máu. Nếu các dung dịch giàu Cl được đưa ra (như nước muối sinh lý và nhiều loại dung dịch keo), mức Cl sẽ tăng lên. Để duy trì tính trung lập điện, nồng độ bicarbonate sẽ giảm, và với pH.
Hãy suy nghĩ về nước muối sinh lý (NS, Normal saline) 0,9%. Nó chứa 154mEq/L Na+ – chỉ cao hơn 10% nồng độ Na+ trong máu của bạn (140mEq/L). Nhưng nồng độ clorua trong NS cũng là 154mEq/L – cao hơn 54% so với trong máu của bạn (thường có lẽ là 100mEq/L). Ba lít NS do đó làm tăng [Na+] của bạn một chút … và tăng [Cl–] của bạn rất nhiều … mức bicarbonate sẽ giảm … và pH sẽ giảm.
Nếu tất cả những điều này là bình thường, hãy kiểm tra khoảng trống anion – sự khác biệt giữa nồng độ các anion được đo thường xuyên và các cation, (Na++ K+) – (Cl– + HCO3–) – thường là 8-12mEq/l.
Vì vậy, toan chuyển hóa tăng clo máu có một khoảng cách anion bình thường, và lactic – và keto-acidosis (không đo được) một khoảng cách anion lớn hơn. Nếu không có nguyên nhân nào trong số này là nguyên nhân, thì có thể một số axit ngoại sinh (ví dụ aspirin) nằm trong máu (xem Bảng 1, dưới đây).
|
Anion gap tăng |
Anion gap bình thường |
|
Uống các chất có tính acid: ngộ độc salicylate, ethanol và methanol |
Mất bicarbonate qua đường tiêu hóa: tiêu chảy, ileostomy |
|
Lactic – và keto-acidosis |
Vấn đề thận: toan hóa ống thận |
|
Không có khả năng bài tiết acid: suy thận |
|
Toan hô hấp
Điều này xảy ra khi thanh thải CO2 không đủ so với sản xuất. Những tình huống này được thảo luận trong chương 2 (Suy hô hấp).
Kiềm chuyển hóa
Kiềm chuyển hóa được đặc trưng bởi sự gia tăng bicarbonate có hoặc không có sự gia tăng bù trừ CO2. Nó có thể xảy ra từ:
Mất axit quá mức (chẳng hạn như hẹp môn vị).
Uống quá nhiều kiềm (hiếm).
Giữ bicarbonate do thận (hiếm).
Do hậu quả của hạ kali máu (gây ra sự dịch chuyển H+).
Kiềm hô hấp
Nhiễm kiềm hô hấp xảy ra khi tăng thể tích và/hoặc tần số thông khí gây ra sự sụt giảm trong PaCO2. Sự thông khí tăng lên như vậy thường đáp ứng với sự đau đớn, lo âu, thiếu oxy hoặc sốt – hoặc khi bệnh nhân thở máy bắt buộc là “thông khí quá mức”.
Phân tích khí động mạch (abg)
Một mẫu ABG có thể được lấy từ một catheter động mạch có sẳn, hoặc từ một “chích lấy máu động mạch”. Các nơi phổ biến nhất được sử dụng là động mạch quay, mặc dù cũng có thể sử dụng động mạch cánh tay, động mạch đùi, hoặc thậm chí động mạch mu chân. ABG là cách nhanh nhất để xác định chính xác mức độ giảm oxy máu thực sự. Nó cũng sẽ cho bạn biết tình trạng axit-base, và giúp bạn xác định nguyên nhân gây rối loạn (cho bạn biết PaCO2 và HCO3–, lactate, clorua và mức glucose). Những thay đổi đe dọa tính mạng của K+ cũng sẽ được phát hiện và cho biết cả Hb. Do đó, đôi khi bạn sẽ thực hiện ABG khi bạn không quan tâm đến ‘các loại khí’ (xem Bảng 2).
|
Normal values |
|
|
pH |
7,35- 7,45 |
|
PaCO2 |
4,5- 6 (35-50 mmHg) |
|
PaO2 |
11- 14 kPa (83- 105 mmHg) |
|
Standard bicarbonate |
22- 28 mmol/l |
|
Base deficite/excess |
+/-2 |
|
Chloride |
98- 107 mmol/l |
Phân tích
Bạn nên đưa ra kế hoạch của riêng mình, nhưng trình tự sau đây thường hữu ích:
Nhìn vào K+, Hb và glucose. Bây giờ bạn sẽ không bỏ lỡ mức kali/glucose đe dọa tính mạng, hoặc thiếu máu nặng.
Nhìn vào PaO2 và bão hòa oxy động mạch xác định bệnh nhân bị thiếu oxy máu như thế nào. Lưu ý FiO2 là bao nhiêu! (tức là PaO2 là 12kPa, hoặc bão hòa oxy 95% với thở oxy 80% là KHÔNG tốt! Như một “quy tắc ngón tay cái” PaO2 dự kiến – trong trường hợp không có bất thường oxy hóa – nên khoảng 10 kPa ít hơn so với FiO2, tức là 40% FiO2 sẽ dẫn đến PaO2 là 30 kPa)
Nhìn vào độ pH: nhiễm toan ( 7,45) ?
PaCO2 có bất thường không ? Nếu vậy, nó có thay đổi theo hướng mà thay đổi độ pH không?
HCO3– bất thường không ? Nếu có, sự thay đổi trong cùng hướng với độ pH?
Trong bệnh nhân “không phải thở máy”:
Nhiễm kiềm với bicarbonate thấp và PaCO2 thấp phản ánh nhiễm kiềm đường hô hấp nguyên phát với bù trừ chuyển hóa không hoàn toàn.
Nhiễm toan với bicarbonat cao và PaCO2 cao là nhiễm toan hô hấp nguyên phát với bù trừ chuyển hóa không hoàn toàn.
Nhiễm kiềm với bicarbonat cao và PaCO2 cao phản ánh nhiễm kiềm chuyển hóa nguyên phát với bù trừ hô hấp không hoàn toàn.
Nhiễm toan với bicarbonat thấp và PCO2 cao là nhiễm toan chuyển hóa nguyên phát với bù trừ hô hấp không hoàn toàn.
pH bình thường với PaCO2 cao và bicarbonat cao có thể phản ánh: một nhiễm kiềm chuyển hóa nguyên phát với bù trừ hô hấp hoàn toàn, hoặc nhiễm toan hô hấp nguyên phát với bù trừ chuyển hóa hoàn toàn.
Vấn đề đi kèm với hỗ trợ thông khí cơ học, làm thay đổi mức độ PaCO2. Khi đó phải áp dụng sự nhạy bén lâm sàng: nếu, ví dụ, bình thường hóa PaCO2 gây ra một nhiễm kiềm đáng kể, và bicarbonate là cao, một nhiễm toan đường hô hấp chuyển hóa chuyển hóa hoặc một alkalosis chuyển hóa bù hô hấp, đã có mặt. Cuộc gọi của bạn như vậy!
Đo khoảng cách anion (anion gap).
Kết quả không mong đợi
Máy phân tích ABG sử dụng một lượng nhỏ máu và thực hiện một loạt các xét nghiệm tương đối rộng. Kết quả sai lệch có thể thu được từ từng thời điểm. Một bong bóng khí bị kẹt trong ống tiêm có thể không được chú ý, do đó tăng PO2, và mức độ Hb hoặc kali tương tự có thể bị giảm đáng kể so với các lần đọc trước đó. Những sự không chắc chắn này thường được xử lý tốt nhất ngay lập tức bằng cách lặp lại phép đo bằng một mẫu mới – một cái gì đó dễ dàng được thực hiện với một đường động mạch có sẳn. Nếu mối quan tâm vẫn tồn tại, hãy lặp lại việc phân tích bằng máy khác nếu có thể.
Ngộ độc khí carbon monoxide
Carbon monoxit thường xuất phát từ các nồi hơi bị lỗi, hít phải khói của đám cháy hoặc tự tử từ bằng cách hít khí thải từ xe hơi không có bộ chuyển đổi. Nó gây ra tình trạng thiếu oxy vì ái lực của nó đối với Hb lớn gấp 240 lần so với O2.
Tuy nhiên, pulse oximeter không biết sự khác nhau giữa oxyhaemoglobin và carboxyhaemoglobin (COHb). Do đó, một bệnh nhân thiếu oxy có thể có độ bão hòa oxy ‘bình thường’. Ngoài ra, sự hiện diện của carbon monoxide làm giảm lượng O2 ly giải từ máu, vì nó thay đổi đường cong phân ly O2 sang trái.
May mắn là hầu hết các máy phân tích ABG sẽ kiểm tra nồng độ COHb – và thường là
Độ bão hòa oxy động mạch và hàm lượng oxy động mạch
Giảm oxy máu có thể được phát hiện bằng phân tích ABG. Ngoài ra, đo oxy qua pulse oximeter thường được sử dụng để theo dõi độ bão hòa oxy (SaO2 – phần trăm độ bão hòa của Hb bởi oxy).
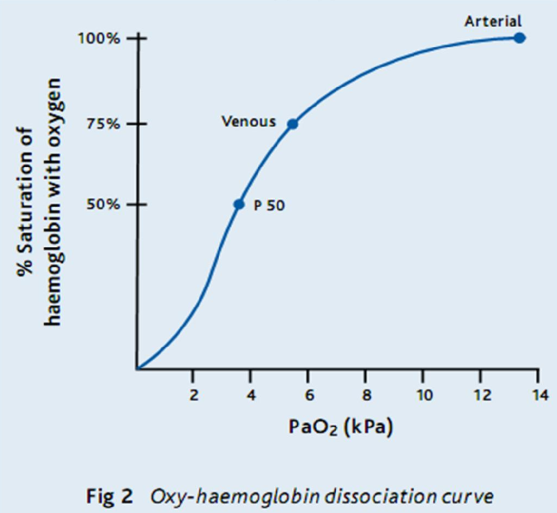
Biểu đồ SaO2 tương ứng với áp lực của O2 (tính bằng kPa) tạo ra đường phân ly oxy-hemoglobin – phần trăm độ bão hòa của Hb với O2 ở các áp lực riêng biệt khác nhau của O2 hòa tan trong huyết tương. Đường cong có thể thay đổi theo nhiều yếu tố khác nhau. Sự dịch chuyển sang “trái” nghĩa là, đối với cùng một PaO2, SaO2 sẽ cao hơn; tức là, Hb lấy và giữ O2 dễ dàng hơn, và ít sẵn sàng giải phóng oxy hơn. Sự dịch chuyển sang “phải” nghĩa là độ bão hòa thấp hơn ở bất kỳ áp lực riêng phần nào của O2: Hb lấy và giữ O2 ít dễ dàng hơn và sẵn sàng giải phóng oxy (Hình 2).
1g Hb có thể mang 1,34mL O2. Hàm lượng O2 động mạch (CaO2) của 1 lít máu – phần lớn được thực hiện bởi Hb (được đo bằng g/L), và không phải hòa tan trong dung dịch – là:
O2 content = SaO2 x 1,34 x Hb
Khi Hb là 150 g/L và máu 100% bão hòa, CaO2 là khoảng 200 mL O2 mỗi lít máu (100 x 1.34 x 150).
Việc cung cấp O2 đến các mô trong một phút sẽ là lượng oxy trong mỗi lít x lượng tim (lít/phút). CO có thể được tính theo diện tích bề mặt cơ thể (CI) và thường là 2,5-3,5 L/phút/m2 da.
Chỉ số cung cấp oxy (Oxygen delivery index) DO2I = CI x CaO2
Giả sử CI = 3 l/phút/m2 và Hb 140g/l, và SaO2 98%, thì
DO2I = 3 x (1,34 x Hb x SaO2)
DO2I = 3 x (1,34 x 140 x 0,98)
DO2I = 550 ml/phút/m2
Các mẹo hàng đầu về độ bão hòa o2
Oxy hóa là một biện pháp đo thông khí rất kém. Do đó việc theo dõi SaO2 ở Guillain-Barre, hoặc hen suyễn nặng, hoặc tổn thương tủy sống cho bạn biết rất ít về mức độ thông khí của nó. Vào thời điểm SaO2 giảm, bệnh nhân có thể nhanh chóng bị mất bù.
Tìm hiểu một vài điểm chính trên đường cong phân ly O2: 99% SaO2 lên tới 11 kPa. Dưới 8 kPa, SaO2 bắt đầu giảm nhanh (từ khoảng 90%) cho một sự thay đổi nhỏ trong PaO2. 80% SaO2 là khoảng 6 kPa.
Luôn luôn nghĩ về SaO2 trong bối cảnh của FiO2 (không khí là 21% O2, vì vậy FiO2 là 0,21). Theo nguyên tắc chung, PaO2 = FiO2 (%) trừ 10. Bạn hít thở không khí, vì vậy bạn mong đợi PaO2 của bạn là khoảng 11 kPa. Vì vậy, nếu ai đó thở 60% FiO2 bằng mặt nạ, bạn sẽ mong đợi PaO2 là ~ 50 kPa. Nếu SaO2 là 94%, thì PaO2 có lẽ chỉ ~ 9 kPa (khi cần ~ 50 kPa). Một cái gì đó là sai khủng khiếp với phổi, và bệnh nhân nghiêm trọng hơn nhiều so với họ có thể thấy!
Capnography
Capnometry (được thực hiện bởi capnograph) đo CO2 trong khí thở ra (phổ biến nhất là do hấp thụ hồng ngoại). Có hai loại capnography:
Hệ thống dòng bên (Sidestream systems) (phổ biến nhất) liên tục hút khí từ bộ dây máy thở qua một ống mao dẫn. Bộ cảm biến và phân tích CO2 được đặt trong thiết bị chính cách xa đường thở. Ưu điểm: nó có thể được sử dụng trên bệnh nhân tỉnh táo, và với O2 cung cấp thông qua thở oxy ngạnh mũi (cannula).
Trong các hệ thống dòng chính (mainstream systems) (cồng kềnh hơn), cảm biến CO2 nằm giữa mạch thở và ống nội khí quản. Ưu điểm: không cần lấy mẫu khí, và không chậm trễ trong quá trình ghi.
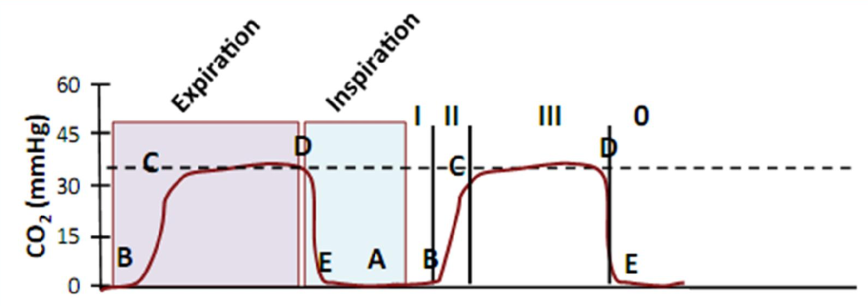
Nồng độ CO2 đo được thường được vẽ theo thời gian, biểu đồ thu được hiển thị ba pha riêng biệt:
Giai đoạn I xảy ra vào lúc bắt đầu thở ra khi khoảng chết giải phẫu còn trống (nơi không có sự trao đổi khí giữa khí hít vào và máu).
Giai đoạn II là sự gia tăng ban đầu của CO2 do sự pha trộn của khí phế nang với khí của khoảng chết.
Giai đoạn III hầu như luôn là cao nguyên tăng chậm và kết thúc với CO2 cuối thì thở ra (end-tidal, ETCO2). Giá trị này thường là 35-38 mmHg (4,5-5 kPa).
Sau khi giai đoạn III được hoàn thành, capnogram xuống nhanh chóng đến đường cơ sở (giai đoạn 0). Điều này thể hiện giai đoạn hít vào nơi hít khí không có CO2. (Hình 3)
Ứng dụng lâm sàng
Capnography phản ánh sự sản xuất (chuyển hóa), vận chuyển (lưu thông) và loại bỏ CO2. Do đó, đường biểu diễn sẽ bị thay đổi bởi các thay đổi trong:
Chuyển hóa tế bào
Do đó, nồng độ có thể tăng theo nhiệt độ tăng (ví dụ như tăng thân nhiệt ác tính) hoặc hoạt động cơ bắp (ví dụ như run rẩy, co giật) hoặc tăng acid đệm (thiếu máu cục bộ – tái tưới máu, dùng bicarbonate);
Vận chuyển CO2
CO2 cuối khí lưu thông sẽ giảm nếu CO giảm với thông khí liên tục (ví dụ:tắc mạch phổi hoặc không khí] hoặc suy tim đột ngột);
Thông khí
Đường biểu diễn có thể xác định vị trí nội khí quản, và có thể được sử dụng như một đại diện cho phân tích ABG. Giảm đột ngột trong ETCO2 có thể hướng tới tắc nghẽn hoàn toàn hoặc tuột ống nội khí quản tình cờ.
Hình 3: Capnogram
Trong thì hít vào, CO2 là số không và do đó hít vào được hiển thị tại đường cơ sở bằng không. Giai đoạn I xảy ra khi bắt đầu thở ra (A-B). Vào lúc bắt đầu thở ra, việc thiếu khí CO2 thải ra đại diện cho khí thở ra trong đường dẫn khí (không có CO2). Trong giai đoạn II tăng nhanh ở nồng độ CO2 (B-C) khi khoảng chết giải phẫu được thay thế bằng khí phế nang, dẫn đến giai đoạn III (C-D) tất cả khí đi qua cảm biến CO2 là khí phế nang gây ra capnograph là một đường dẹt nằm ngang. Điều này thường được gọi là Cao nguyên phế nang. CO2 cuối thì thở ra là giá trị ở giai đoạn cuối thì thở ra. Giai đoạn 0 là thì hít vào và được đánh dấu bằng một hướng xuống nhanh của capnograph (D-E). Giảm xuống này tương ứng với khí tươi không có carbon dioxide (trừ trường hợp thở lại). Capnograph sau đó sẽ vẫn ở mức zero cơ sở trong suốt thì hít vào.
Capnography thường được sử dụng để đảm bảo vị trí chính xác của ống nội khí quản (pha thở có CO2 không nhìn thấy nếu đặt nội khí quản vào thực quản). Các phép đo capnography cũng có thể hoạt động như một đại diện cho PaCO2. Khi trao đổi khí phổi bình thường, CO2 cuối thì thở ra chỉ thấp hơn so với PCO2 động mạch 2 đến 3 mmHg (0,2 – 0,4 kPa). Tuy nhiên, khi trao đổi khí trong phổi bị suy yếu, ETCO2 giảm tương đối so với PaCO2 (Hình 3).
Nguyên nhân của tăng (PaCO2 – ETCO2) gradient:
Tăng khoảng chết giải phẫu:
Bộ dây máy thở bị hở
Thở yếu
Tăng khoảng chết sinh lý:
Bệnh phổi tắc nghẽn
Cung lượng tim thấp
Trong một số trường hợp, ETCO2 có thể cao hơn CO2 động mạch. Điều này là có thể khi sản xuất CO2 cao và có thể tích hít vào thấp hoặc cung lượng tim (CO) cao Nhưng điều này thực sự rất không phổ biến.
Khi trao đổi khí là bất thường và PaCO2 cao hơn ETCO2, vẫn có thể theo dõi những thay đổi trong ETCO2 như một thước đo thay đổi trong PaCO2. Tuy nhiên, điều quan trọng là phải cài đặt gradient ETCO2 – PaCO2 cần được kiểm tra lại sau mỗi lần thay đổi cài đặt máy thở, vì điều này có thể ảnh hưởng đến độ chênh lệch.
Trong trường hợp tăng áp lực nội sọ, capnography được sử dụng để điều chỉnh thông khí nhằm duy trì ETCO2 mong muốn. Trong cài đặt này, gradient ETCO -PaCO2 cần được theo dõi chặt chẽ để duy trì ETCO ở mức PaCO mục tiêu.