Quy tắc cơ bản
Các bác sĩ mới thường hoảng sợ khi ‘có điều gì không đúng’ trong một bệnh nhân thông khí cơ học. Nói chung, một cách tiếp cận hợp lý và có hệ thống giải quyết hầu hết các vấn đề và ‘thuật toán cơ bản’ được học theo thời gian. Để tăng tốc mọi thứ, chúng tôi sẽ cung cấp cho bạn quan điểm của chúng tôi tại đây. Nhưng các quy tắc cơ bản vẫn áp dụng:
Hãy nhớ (giả sử vấn đề là với bệnh nhân chứ không phải là máy !!):
Đường thở (ống nối khí quản hoặc ống ET có bị dịch chuyển hay bị nghẹt không? Máy thở có bị ngắt kết nối không?).
Nhịp thở (Có tràn khí màng phổi không? Đờm trong phế quản? Mất nỗ lực hít vào của bệnh nhân đang thở hỗ trợ áp lực?
Tuần hoàn (Mất lưu lượng mạch máu phổi có ảnh hưởng đến trao đổi khí không? Có một sự kiện hô hấp gây ra thay đổi tuần hoàn không? Có một ‘cơn bão nhiễm trùng’ ảnh hưởng đến cả tuần hoàn và thông khí không?).
Gọi trợ giúp sớm nếu không chắc chắn. Đừng tự hào.
Hầu hết ‘rắc rối’ được chẩn đoán bằng cách kiểm tra lâm sàng nhanh chóng, với sự xác nhận của X quang phổi. Nhưng nếu bệnh nhân đang hấp hối, đừng chờ đợi X quang. Hãy hành động!
Tương tự như vậy, hầu hết các “rắc rối” đều được xử trí bằng các thao tác lâm sàng đơn giản: tự bóp bòng giúp thở cho bệnh nhân, hoặc thậm chí rút bỏ một NKQ/ống mở khí quản và sử dụng thông khí qua bóng và mặt nạ trên 100% O2 thường có thể giúp bạn thoát khỏi rắc rối.
Mất bão hòa và thiếu oxy mô (desaturation and hypoxia)
Mất độ bão hòa thường được gây ra bởi sự gia tăng đột ngột trong bất tương xứng V:Q. Trong khi một số khu vực của phổi thông khí có thể không còn được tưới máu (ví dụ như sau khi bị thuyên tắc phổi), thì vấn đề phổ biến nhất là các khu vực tưới máu tốt đột nhiên không còn thông khí nữa. Giảm PaO2 thường được xử trí bằng cách tăng FiO2. Tuy nhiên, sự nếu giảm oxy hóa máu nhiều hơn và kéo dài hơn cần chẩn đoán và can thiệp nhanh chóng.
Hoạt động
Chú ý đến bệnh nhân kịp thời.
Tăng FiO2 một cách thích hợp (đến 100% O2 nếu cần thiết, trong thời gian tìm kiếm và xử lý nguyên nhân).
Bệnh nhân có thông khí không? Kiểm tra chuyển động của thành ngực trực quan trong khi nhìn vào máy thở (đối với các báo động thể tích khí lưu thông thấp / áp lực cao).
Nếu thông khí không đầy đủ, ngắt kết nối với máy thở và bóp bóng giúp thở bằng tay trên 100% O2. Sau đó, xác định nguyên nhân nào có khả năng xảy ra nhất và điều trị:
Ống nội khí quản bị tắc hoặc di chuyển sẽ làm cho bóp bóng thấy cứng. Ống hút đàm có thể đưa vào qua ống NKQ không? Nếu không có thời gian, hoặc nghi ngờ, rút ống ra và thông khí bóng mask (che lỗ mở khí quản nếu cần).
Tràn khí màng phổi có áp lực sẽ khiến cho việc “bóp bóng” trở nên khó khăn. Tràn khí màng phổi đơn giản có thể vẫn dễ dàng bóp bóng. Nếu lâm sàng nghi ngờ tràn khí có áp lực, nên thực hiện chọc dò màng phổi giải áp bằng kim. Lưu ý rằng, trong ARDS, tràn khí màng phổi khu trú thường xảy ra và có thể nhiều ổ. Do đó, một ống dẫn lưu ngực vẫn có thể sủi bọt tốt, điều này không loại trừ sự xuất hiện của tràn khí màng phổi khác trên cùng một bên! Tìm kiếm tràn khí màng phổi ở phổi đã bị tràn khí trước (cùng một bên phổi – ‘phổi sáng’ hơn so với phổi kia trên XQ? Có hình ảnh nào không rõ hãy yêu cầu chụp phim ngực nghiêng bên. Các nhà chụp X quang ghét làm điều này, nhưng đôi khi nó là cách duy nhất để chẩn đoán nhanh chóng an toàn. Sau khi ổn định nếu muốn, bạn có thể cần một CT.
Nút nhày làm tắc phế quàn chính/phế quản phân thùy lớn. Bóp bóng (có hoặc không có nước muối 5-10ml bơm xuống NKQ) với kỹ thuật viên vật lý trị liệu ngực (cùng với bạn và y tá sẽ làm việc như một nhóm) có thể làm sạch nó. Khi ‘an toàn’, có thể cần soi phế quản);
Nội khí quản đi sâu vào phế quản. NKQ vào quá sâu và ở trong phế quản gốc bên phải;
Phù phế nang cấp tính (ARDS nặng, xuất huyết phổi, hoặc phù phổi). Điều này thường là hiển nhiên khi thấy đàm bọt hồng xuất hiện trong NKQ. Với ‘ARDS’, nên kết nối lại với máy thở, tăng PEEP và xử trí một cách thích hợp là tốt nhất. Nếu có nguồn gốc tim mạch, thì dùng các loại thuốc thích hợp (nitrate đường tĩnh mạch, lấy dịch dư nếu đang lọc máu liên tục) cần được chỉ định.
Nói chung, bóp bóng giúp thở cho đến khi khôi phục độ bão hòa – và quay trở lại máy thở với PEEP cao hơn có thể hạn chế sự xẹp phổi và cải thiện độ giãn nở, trong khi XQ cứu cấp được thực hiện để giúp xác định nguyên nhân.
Theo quy tắc chung, bắt đầu với mức PEEP xấp xỉ 1/5 của FiO2 yêu cầu duy trì PaO2 ở 8 kPa. ARDSNet cung cấp thang đo PEEP/FiO2 có thể được sử dụng khi bắt đầu thông khí cơ học.
Thủ thuật huy động phế nang
PEEP hoạt động như một giá đỡ đối với các đường dẫn khí xa và đối trọng với lực nén tạo ra bởi sự đàn hồi của phổi và thành ngực/bụng. Ngoài việc ngăn ngừa tình trạng xẹp phổi, PEEP cũng có thể mở phế nang bị xẹp và đảo ngược xẹp phổi. Do đó, PEEP có thể được sử dụng trong các thủ thuật huy động cụ thể để mang các vùng phế nang bị xẹp ‘trở lại hoạt động’ – cho phép phế nang đã bị xẹp tham gia vào trao đổi khí.
Nhiều phương pháp đã được mô tả – bao gồm cả ‘giữ’ áp lực hít vào ở áp lực 30-40 cmH2O trong 30-40 giây. Trong quá trình huy động, áp lực cao có thể gây ra ảnh hưởng xấu lên huyết động học. Điều này sẽ làm ngừng thủ thuật. Khi phổi đã được huy động, PEEP cần phải được áp dụng để giữ cho phổi đã huy động được mở: duy trì PEEP nâng cao hơn và tránh ngắt kết nối máy thở (ví dụ như phun khí dung).
Hiệu quả của PEEP đối với việc huy động phổi có thể được theo dõi bằng tỷ lệ PaO2/FiO2, là thước đo hiệu quả của trao đổi O2 qua phổi. Nếu PEEP có tác dụng thuận lợi và chuyển đổi các khu vực xẹp phổi thành các đơn vị phế nang – mao mạch chức năng, sẽ có sự gia tăng tỷ lệ PaO2/FiO2 (cải thiện oxy hóa). PEEP có cùng sự ảnh hưởng trên các yếu tố quyết định hiệu suất của tim như thông khí áp lực dương, nhưng khả năng giảm tiền tải của thất thường trở nên nổi bật hơn với PEEP.
Paco2 tăng- hypercapnia
Độ thanh thải CO2 sẽ giảm nếu thể tích phút phế nang giảm. Điều này có thể xảy ra do:
Tần số thở thấp;
Thể tích khí lưu thông thấp;
Khoảng chết giải phẫu hoặc sinh lý tăng.
Sự gia tăng PaCO2 có thể gây bất lợi: áp lực nội sọ có thể tăng lên, O2 phế nang có thể bị ‘pha loãng’ bởi CO2 làm cho nồng độ O2 (và do đó ở động mạch) bắt đầu giảm và bệnh nhân có thể trở nên hôn mê. Ngoài ra, có rất ít dữ liệu cho thấy mức độ nhiễm toan hô hấp nặng có hại trực tiếp ở bệnh nhân đặt nội khí quản. Thật vậy, cố gắng “tăng hoạt động phổi” để làm sạch CO2 có thể gây hại nhiều hơn. Mức độ ổn định của CO2 cho độ pH là 7.25 hoặc thậm chí ít hơn thường được chấp nhận. Với thời gian, chức năng thận (bình thường) sẽ bù lại bằng cách giữ lại bicarbonate, khôi phục pH đến gần bình thường hơn.
Tình huống phổ biến nhất là thể tích khí lưu thông giảm trong quá trình thông khí kiểm soát áp lực.
Ở đây, cần phân tích tình trạng thiếu oxy do nguyên nhân gì: máy thở làm việc không? Ống NKQ/tracheostomy có bị tắc toàn bộ/một phần không? Nếu bạn đang ở trên một chế độ kiểm soát áp lực, độ giãn nở có giảm, do đó giảm thể tích khí lưu thông? phế quản có bị tắc không? Có tràn khí màng phổi không? Một tràn khí màng phổi có áp lực? Hoặc là vấn đề do thở nhanh. Nếu được chẩn đoán và xử lý một cách thích hợp, thì thể tích khí lưu thông sẽ được phục hồi. Một khi bạn đã ‘thực hiện tốt nhất bạn có thể’ để có được thể tích khí lưu thông bạn cần, thì bạn có thể vẫn cần tăng tần số thở ở các tình trạng nhạy cảm (với khí máu lặp lại sau mỗi thay đổi 20 phút hoặc với theo dõi CO2 end-tidal nếu liên quan). Tuy nhiên, có một số tình huống đặc biệt trong đó điều này có thể không lý tưởng, chẳng hạn như trong bệnh hen suyễn nặng. Ở đây, một tỷ lệ chậm (+/- thể tích khí lưu thông thấp) là trụ cột của liệu pháp. Tương tự như vậy, COPD có thể khó khăn để quản lý. Hãy tưởng tượng rằng thể tích khí lưu thông thấp. Toan máu xảy ra khi PaCO2 tăng:
Bạn tăng tần số thở từ 24 lên 28.
Mọi thứ trở nên tồi tệ hơn.
Bạn tăng tần số thở một lần nữa.
Tệ hơn nữa.
Cần làm gì?
Rất thường gặp, vấn đề ở đây là ‘nhịp thở xếp chồng’ (breath stacking), còn được gọi là ‘bẫy khí’ (gas trapping’) hoặc ‘căng phổi động’ (dynamic hyperinfation), kết quả từ việc chấm dứt sớm thì thở ra thụ động trước khi thể tích phổi đạt đến dung tích cặn chức năng: không có đủ thời gian không khí đã đẩy ‘vào’ kịp thoát ‘ra’. Mức PEEP nội sinh (PEEPi) do đó tăng lên làm giảm lưu lượng máu phổi và làm tăng khoảng chết với kết quả là phần lớn lượng khí lưu thông được cung cấp không góp phần giải phóng CO2. Điều này có thể là do giai đoạn thở ra ngắn (thông khí tỷ lệ đảo ngược), một lưu lượng thở ra chậm (hen suyễn) hoặc cả hai.
Kỳ lạ thay, cách tiếp cận đầu tiên đôi khi là làm chậm tần số xuống. Sau đó nhìn vào biểu đồ dạng sóng. Nếu có bẫy khí (tức là lưu lượng không đạt đến số không khi thở ra), bạn có thể ngắt kết nối máy thở và nhấn vào ngực – và nghe thấy tiếng thở dài “chậm” khi khí thoát ra. Khi kết nối lại, thể tích khí lưu thông thường được phục hồi. Điều chỉnh tần số (và, trong PCV, thời gian thở ra liên quan đến hít vào) sao cho bẫy khí được giảm thiểu là việc then chốt. Lưu ý, tuy nhiên, bạn có thể phải chấp nhận một PaCO2 hơi tăng. Cuối cùng, nếu PEEP nội sinh hoặc ‘tự động’ rất cao, đôi khi bạn có thể khắc phục điều này (và cho phép giải phóng bẫy khí mà không ngắt kết nối) bằng
cách tăng PEEP lên 80-90% autoPEEP. Ví dụ, nếu auto-PEEP là 10 cmH2O, việc áp dụng PEEP bên ngoài là 8 cmH2O có thể cải thiện việc làm trống phế nang. Ứng dụng thường quy của phương pháp này cần đánh giá cẩn thận về auto-PEEP và cần điều chỉnh thường xuyên vì đây là hiện tượng động mà nếu không được kiểm soát có thể dẫn đến tác dụng xấu trên huyết động học nghiêm trọng. Những tình huống này rất khó để quản lý và yêu cầu trợ giúp cấp cao!
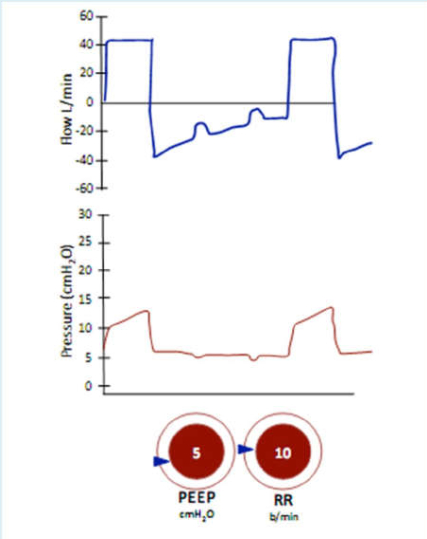
Thở nhanh
Điều trị thở nhanh ở bệnh nhân trên các phương thức hỗ trợ áp lực thông khí (và liệu điều trị có được bảo đảm hay không) phụ thuộc vào nguyên nhân (Bảng 7). Điều trị nên được hướng dẫn theo nguyên nhân. Xử trí thể tích khí lưu thông thấp phần lớn được đề cập ở trên (trang 131). Tuy nhiên, đôi khi, tần số thở nhanh (có lẽ do lo lắng) có thể gây ra bẫy khí (hoặc giảm thông khí phế nang hiệu quả) ở những người bị bệnh phổi, và do đó làm giảm thể tích khí lưu thông xuống. Ở đây, đánh giá đáp ứng với bolus thuốc giảm đau/giảm lo âu có thể vừa là chẩn đoán vừa điều trị.
Không đồng bộ bệnh nhân – máy thở
Điều này đề cập đến một tình huống mà máy thở đang cố gắng cung cấp nhịp thở khi bệnh nhân đang cố gắng thở ra – và/hoặc ngược lại.
Tương tác của máy thở bệnh nhân có thể được mô tả như là mối quan hệ giữa 2 máy bơm hô hấp:
hệ thống phổi của bệnh nhân, được kiểm soát bởi hệ thống thần kinh cơ và bị ảnh hưởng bởi các đặc tính cơ học của phổi và ngực, và
máy thở, được kiểm soát bởi cài đặt máy thở và chức năng của các van lưu lượng.
Khi chức năng bơm 2 đồng bộ, mọi giai đoạn của nhịp thở đều hoàn toàn phù hợp. Bất cứ điều gì làm rối loạn sự hài hòa giữa 2 máy bơm dẫn đến sự không đồng bộ và gây khó chịu cho bệnh nhân và tăng công thở không cần thiết.
Sự không đồng bộ xảy ra khi có sự khác biệt giữa bệnh nhân và máy thở trong một hoặc nhiều giai đoạn thở:
Cơ chế kích hoạt (tức là bắt đầu hít vào), được cài đặt bởi cài đặt kích hoạt – độ nhạy, nỗ lực của bệnh nhân và đáp ứng van (hình 24, 25).
Giai đoạn hít vào. Trong cả thông khí kiểm soát thể tích và kiểm soát áp lực, nhu cầu của bệnh nhân cần được đánh giá cẩn thận, sử dụng các dạng sóng áp lực và lưu lượng để chẩn đoán.
Chấm dứt nhịp thở (cuối giai đoạn hít vào). Máy thở chấm dứt lưu lượng hít vào đồng bộ với thời gian thần kinh của bệnh nhân, nhưng thường thì máy thở ngừng hít vào sớm hơn hoặc muộn hơn thời gian thần kinh của bệnh nhân.
Trong quá trình thông khí kiểm soát thể tích, chúng tôi có thể điều chỉnh các biến có ảnh hưởng đến thời gian hít vào (ví dụ, lưu lượng đỉnh, thể tích khí lưu thông). Trong quá trình thông khí hỗ trợ áp lực hoặc kiểm soát áp lực, chúng tôi có thể điều chỉnh các biến có ảnh hưởng đến thời điểm lưu lượng hít vào chấm dứt (ví dụ: thời gian hít vào, độ nhạy thở ra).
Giai đoạn thở ra. Sự có mặt của PEEP tự động có thể dẫn đến khó khăn khi kích hoạt máy thở. Trong hỗ trợ áp lực hoặc chế độ IMV đồng bộ, điều này thường là do độ nhạy trigger cần điều chỉnh. Nếu đặt độ nhạy quá thấp, và bệnh nhân cố gắng hít vào’ trên máy thở, và chỉ tạo ra đủ áp lực hoặc lưu lượng để kích hoạt nhịp thở vào phút cuối – khi bệnh nhân chuẩn bị thở ra. Điều này cũng có thể là một vấn đề ở những người bị suy yếu cơ hô hấp/phổi và thể tích khí lưu thông nhỏ, tắc nghẽn đường thở đáng kể (ngăn chặn sự truyền áp lực đường thở) hoặc hạn chế (làm cho thể tích khí lưu thông nhỏ). Cài đặt độ nhạy quá cao, và các rung động nhỏ/run rẩy/cử động gây ra một nhịp thở, mà không được đồng bộ với nỗ lực nhịp thở thực sự. Do đó, sự không đồng bộ của máy thở phổ biến hơn ở những người có thể tích khí lưu thông thấp và/hoặc tần số thở cao – và đôi khi được giải quyết bằng cách dùng thuốc để hạ thấp tần số đó (ví dụ, trong điều trị lo âu/không dung nạp ống NKQ/đau).
Nếu trao đổi khí bị suy giảm, và vấn đề không thể giải quyết được, sự an thần sâu hơn thường được ưu tiên hơn, với việc chuyển sang thông khí bắt buộc (có hoặc không có phong tỏa thần kinh cơ) nếu cần.
Các chế độ thông khí khác có thể có vấn đề, với các chế độ bắt buộc đôi khi ít được dung nạp tốt hơn so với SIMV/PS. Tương tự, tỷ lệ I:E gần với tỷ lệ thở bình thường (1:2) thường được dung nạp tốt hơn so với tỷ lệ ‘I:E’ đảo ngược.
Chế độ kích hoạt nhịp thở cũng có thể là một vấn đề: nếu áp lực âm gây ra có thể được tạo ra không đủ để kích hoạt nhịp thở, các kích hoạt lưu lượng là thích hợp hơn. Mức PEEP nội sinh cao là nguyên nhân phổ biến của sự không đồng bộ, vì nó ngăn chặn nhịp thở được kích hoạt. PEEP bên ngoài sẽ cải thiện kích hoạt trong tình huống này (hình 24).
Ngoài ra, máy thở có thể cung cấp nhịp thở không được kích hoạt vì bộ kích hoạt đặt quá nhạy hoặc có rò rỉ bộ dây thở hoặc quanh ống NKQ (hình 25).
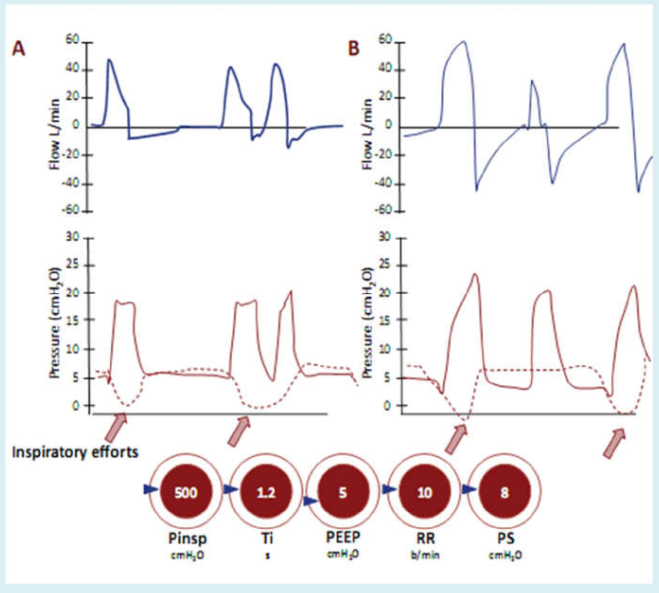
Hình 24 Kích hoạt không hiệu quả (Ineffective triggering)
Lưu ý: hai thay đổi về áp lực (độ lệch âm) và lưu lượng (độ lệch dương). Chúng đại diện cho những nỗ lực hô hấp mà không kích hoạt máy thở. Cài đặt mức kích hoạt quá cao hoặc sự hiện diện của PEEP nội sinh có thể gây ra sự kích hoạt không hiệu quả.
Hình 25 Chu kỳ kép và tự động kích hoạt (Double cycle and autotriggering)
Chu kỳ kép: Hai chu kỳ máy thở xảy ra trong 1 nỗ lực hô hấp của một bệnh nhân
Tự động kích hoạt: máy thở cung cấp một nhịp thở mà không được kích hoạt (mong muốn) – bởi bệnh nhân. Sự không đồng bộ này có thể xảy ra khi kích hoạt hít vào quá nhạy cảm hoặc có sự rò rỉ. ‘Chu kỳ tự động’ không cho thấy sự giảm áp lực đường thở ban đầu.
Áp lực đường thở cao
Máy thở đo áp lực đường thở. Áp lực đường thở phát sinh từ việc cung cấp nhịp thở ở bệnh nhân thụ động được kiểm soát bằng phương trình chuyển động đơn giản cho hệ hô hấp:
Airway Pressure = (Lưu lượng x sức cản đường thở) + (Thể tích khí lưu thông x 1/độ giãn nở) + PEEP tổng
Kiến thức về dạng sóng áp lực rất hữu ích khi cố gắng xác định nguyên nhân gây áp lực đường thở cao. Trong thông khí kiểm soát áp lực, áp lực tăng lên đến đỉnh cao đặt trước, và sau đó áp lực đẩy được giữ. Các phổi có độ giãn nở tốt sẽ tiếp tục mở rộng, và lưu lượng khí tiếp tục trong thời gian này. Áp lực cao nguyên có thể đo được ở những bệnh nhân ngưng thở hoặc liệt cơ bằng cách nhấn phím ngưng thở tạm thời cuối thì hít vào. Tại thời điểm này không có lưu lượng (từ công thức trên) áp lực đường thở sẽ tương đương với áp lực phế nang.
Trong thông khí kiểm soát thể tích, áp lực đường thở đỉnh với cao nguyên thấp hơn nhiều cho thấy sự gia tăng sức cản đường thở – bao gồm cả tắc nghẽn đường thở. Nếu đột ngột, NKQ có thể bị nghẽn với đàm; đầu NKQ có thể bị tắc do thoát vị bóng chèn; khí quản với mô hạt.
Áp lực cao nguyên tăng cho thấy độ giãn nở phổi thấp. Có thể do đặt nội khí quản vào phế quản gốc; tràn khí màng phổi; phù phổi/xuất huyết; bẫy khí; chướng bụng gây chèn ép cơ hoành; xẹp phổi/thùy phổi.
Thể tích khí lưu thông thấp
Thể tích khí lưu thông không hiệu quả có thể gây ra sự thông khí không đầy đủ, và do đó ứ CO2. Nguyên nhân làm giảm lượng khí lưu thông (và xử trí chúng được trình bày ở trên.
Tuy nhiên, một lời cảnh báo: hầu hết các máy thở đều đo thể tích khí lưu thông khi trở về máy thở. Do đó, nếu có rò rỉ ở đâu đó trong bộ dây máy thở, thì thể tích khí lưu thông được ghi lại sẽ không đại diện cho thể tích khí lưu thông thực sự bơm vào phổi của bệnh nhân. Một bệnh nhân với một ống dẫn lưu màng phổi có thể được thông khí tốt – nhưng không khí thoát qua ống dẫn lưu sẽ không được ghi lại. Tương tự, các máy phun khí dung cung cấp khí đẩy, và có thể làm tăng thể tích khí lưu thông đo được, và độ ẩm trên các cảm biến khiến chúng đọc kết quả sai.
Bẫy khí /peep nội sinh
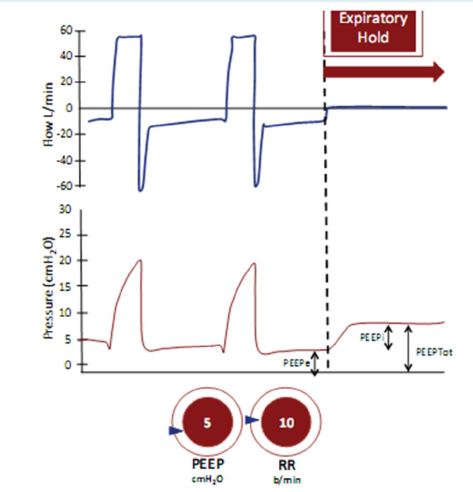
Có thể nhận dạng xu hướng bẫy khí bằng cách quan sát đường cong lưu lượng – thời gian, như được thể hiện trong hình 26: (a), lưu lượng khí thở ra ngừng trước khi bắt đầu phát hiện hít vào, cho thấy tất cả khí hít vào đều được thở ra; (b), lưu lượng thở ra tiếp tục phát triển ngay cho đến khi nhịp thở tiếp theo bắt đầu, cho thấy rằng không phải tất cả khí hít vào đều được thở ra. Điều này sẽ làm PEEP nội sinh (tự động) tăng lên và có thể đo PEEP tự động bằng cách thực hiện ngưng cuối thì thở ra ở bệnh nhân ngưng thở, như hình 26. Bẫy khí có thể bị hạn chế bằng cách xử lý đầy đủ co thắt phế quản, đảm bảo đủ điều kiện thời gian thở ra bằng cách tăng phần thở ra của tỷ lệ I:E và đảm bảo rằng tần số thở không quá cao, và đảm bảo thể tích khí lưu thông được cung cấp không quá lớn.
Hình 26: Ước lượng PEEP nội sinh trong quá trình ngưng cuối thì thở ra
PEEP nội sinh (PEEPi) có thể được tính bằng cách lấy PEEP tổng (PEEPtot) trừ PEEP cài bên ngoài (PEEPTot)
Ngưng thở
Trừ khi máy thở hư hỏng, hoặc các bộ dây máy thở bị tắc, ngưng thở không thể xảy ra với các chế độ thông khí bắt buộc vì tần số cài đặt của nhịp thở luôn luôn phải được cung cấp. Ngưng thở có thể xảy ra ở các chế độ hỗ trợ thông khí nếu không có tần số thở bắt buộc dự phòng. Ngưng thở có thể có nguồn gốc não (bệnh lý tại não, tác dụng của thuốc an thần) hoặc nguồn gốc tủy sống/ngoại biên (bệnh thần kinh cơ) – các thuốc gây liệt cơ, bệnh thần kinh cơ nghiêm trọng, Guillain-Barre hoặc hội chứng cắt ngang tủy. Cả hai sự giảm thông khí và tăng thông khí đều có thể dẫn đến ức chế hô hấp và ngưng thở. Sự giảm thông khí dẫn đến sự tích lũy CO2 và suy giảm ý thức. Tuy nhiên, thường bệnh nhân COPD (những người có thể là những người bị ứ CO2) sợ nhất là ‘thông khí quá mức’ và trở nên kiềm hóa máu. Trong trạng thái này (ngay cả khi PaCO2 là 8 kPa!), trung khu hô hấp sẽ bị ức chế và bệnh nhân ngưng thở. Mặc dù tương đối không phổ biến, những bệnh nhân có ứ CO2 mạn tính có thể dựa vào tình trạng thiếu oxy để kiểm soát hô hấp: ở những bệnh nhân này, việc cung cấp quá nhiều O2 sẽ làm giảm khả năng hô hấp.
Thông khí phút thấp
Việc duy trì thông khí đầy đủ là rất cần thiết để đảm bảo thanh thải CO2 và tất cả các máy thở có báo động thông khí phút thở ra. Máy thở cũng đo thể tích khí lưu thông hít vào và thở ra liên tục. Một số tình huống có thể dẫn đến thông khí thấp bao gồm: thay đổi cơ học phổi (tăng sức đề kháng hoặc giảm độ giãn nở) hạn chế thể tích khí lưu thông, ngắt kết nối, rò rỉ trong bộ dây thở hoặc giảm nhịp thở/ngưng thở ở bệnh nhân thở tự nhiên. Bởi vì máy thở giám sát thể tích khí lưu thông hít vào và thở ra, chúng thường sẽ phát hiện nếu có sự khác biệt đáng kể và báo cáo sự hiện diện của rò rỉ trong bộ dây. Như với tất cả các báo động, nếu nguyên nhân là không rõ ràng và ngay lập tức điều trị được điều đầu tiên cần làm là ngắt kết nối bệnh nhân với máy thở và bắt đầu thông khí bằng tay với bóng giúp thở.
Rò rỉ có thể gây ra hiện tượng thông khí phút thấp. Bạn sẽ nghe thấy tiếng khí thoát ra từ đường thở. Hãy cảnh giác với việc phản ứng với điều này bằng cách đơn giản là bơm bóng chèn. Ống nội khí quản hiện đại hiếm khi phát triển rò rỉ từ bóng chèn. Cho đến nay, lý do phổ biến nhất cho một ‘rò rỉ cuff’ là do dịch chuyển ra ngoài của ống nội khí quản với kết quả là bóng chèn không kín vì nó đang thoát vị trên dây thanh âm. Luôn kiểm tra vị trí của bóng chèn bằng đèn soi thanh quản ở bệnh nhân phát triển rò rỉ bóng chèn và chuẩn bị để đưa ống tiếp tục vào đường thở hoặc đặt lại ống với ống dài hơn nếu cần.
Báo động áp lực cao
Khi báo động áp lực cao được kích hoạt, máy thở sẽ ngay lập tức ngừng hít vào và chuyển sang thì thở ra. Nếu báo động tiếp tục được kích hoạt, thông khí phút sẽ giảm nhanh chóng do đó báo động này cần phải được trả lời ngay lập tức. Báo động áp lực cao có nhiều khả năng được kích hoạt trong chế độ thể tích, bởi vì áp lực đường thở được đặt trước trong chế độ áp lực. Sự gia tăng đáng kể sức cản đường thở hoặc giảm độ giãn nở có thể dẫn đến sự gia tăng đáng kể áp lực đường thở và kích hoạt báo động trong quá trình thông khí thể tích. Các nguyên nhân khác bao gồm kích động, ho và tắc ống nội khí quản. Nguyên nhân phổ biến nhất của tắc ống là do bệnh nhân cắn.