John N.Cronin
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Phát hiện mới
Chủ đề của bài đánh giá này là gì?
Tổng quan này trình bày các khái niệm cơ bản về sinh lý học hô hấp và sinh lý bệnh, đặc biệt đề cập đến cơ học phổi và kiểu hình phổi liên quan đến hội chứng hô hấp nặng do nhiễm coronavirus 2 (SARSCoV-2) và bệnh viêm phổi do coronavirus 2019 (COVID-19) tiếp theo.
Nó làm nổi bật những tiến bộ nào?
Tổng quan cung cấp một bản tóm tắt quan trọng về các khía cạnh sinh lý chính cần được xem xét để thở máy an toàn và hiệu quả ở bệnh nhân COVID19 nặng trong phòng chăm sóc đặc biệt.
Tóm tắt
Suy hô hấp nặng do bệnh viêm phổi do coronavirus 2019 (COVID-19) không đáp ứng với hỗ trợ hô hấp không xâm nhập cần thở máy. Mặc dù thở máy có thể là một liệu pháp cứu sống, nhưng nó có thể gây thêm tổn thương phổi nếu áp lực đường thở và lưu lượng và thời gian của chúng không phù hợp với cơ học hệ hô hấp của từng bệnh nhân. Sinh lý bệnh của hội chứng hô hấp cấp tính do nhiễm coronavirus 2 (SARS-CoV-2) có thể dẫn đến một kiểu tổn thương phổi ở những bệnh nhân bị viêm phổi COVID-19 nặng thường liên quan đến hai kiểu hình riêng biệt, dọc theo một chuỗi thời gian và sinh lý bệnh, có đặc điểm là khác nhau mức độ đàn hồi, tỷ lệ thông khí-tưới máu, shunt phải-trái, trọng lượng phổi và khả năng huy động. Việc hiểu rõ sinh lý bệnh cơ bản, thời gian xuất hiện các triệu chứng, đặc điểm X quang và cơ học phổi ở từng bệnh nhân là rất quan trọng để lựa chọn cơ sở thở máy phù hợp nhằm tối ưu hóa sự trao đổi khí và ngăn ngừa tổn thương phổi thêm. Bằng các phân tích quan trọng của y văn, chúng tôi đề xuất các tiêu chí cơ bản về sinh lý và cơ học để lựa chọn cài đặt thông khí cho bệnh nhân COVID-19 trong các đơn vị chăm sóc đặc biệt. Đặc biệt, việc lựa chọn thể tích khí lưu thông phải dựa trên việc áp lực đẩy 2O, đảm bảo tránh tình trạng giảm thông khí ở những bệnh nhân độ giãn nở phổi còn bảo tồn và căng thẳng quá mức ở những bệnh nhân có thể tích phổi nhỏ hơn và độ giãn nở của phổi thấp hơn. Mức áp lực dương cuối kỳ thở ra (PEEP) nên được điều chỉnh bằng cách đo lường khả năng huy động phổi, trong đó những bệnh nhân có khả năng huy động cao hơn có thể được hưởng lợi từ mức PEEP cao hơn. Vị trí nằm sấp thường có lợi và cần được xem xét sớm. Cơ sở lý luận cho các tiêu chí cài đặt thông khí cơ học được đề xuất được trình bày và thảo luận.
Giới thiệu
Tại thời điểm viết bài, > 4 triệu người ở Vương quốc Anh đã có kết quả xét nghiệm dương tính với nhiễm vi rút coronavirus 2 (SARS-CoV-2) cấp tính nghiêm trọng (Dong và cộng sự, 2020), nhưng
Trong quá trình hít vào, phổi sẽ nở ra do áp lực xuyên phổi dương. Trong thông khí tự phát, độ dốc này được tạo ra bởi áp lực màng phổi âm do các cơ hô hấp, chủ yếu là cơ hoành tạo ra. Ngược lại, thở máy có kiểm soát phụ thuộc vào áp lực đường thở dương dẫn khí vào phổi, với gradient xuyên phổi dương phụ thuộc vào áp lực phế nang tăng và chuyển động thụ động của thành ngực. Các thông số cơ bản của máy thở có thể được thiết lập là áp lực đường thở và lưu lượng và thời gian của chúng, cần phải phù hợp với sức cản và sự đàn hồi của hệ thống hô hấp của bệnh nhân (ngược lại với độ giãn nở). Tại mỗi thời điểm trong khi hít vào, áp lực đường thở được xác định bằng phương trình chuyển động và bằng tổng áp lực phế nang cuối kỳ thở ra, là tích số của lưu lượng và sức cản đối với lưu lượng, và tích của thể tích khí lưu thông và độ đàn hồi của hệ hô hấp. Thở máy có thể được thực hiện ở chế độ bắt buộc hoặc ở chế độ hỗ trợ để hỗ trợ thở tự phát. Trong phương thức thứ hai, nỗ lực hít vào của bệnh nhân kích hoạt việc cung cấp hơi thở (Pham và cộng sự, 2017), công thở được chia sẻ theo tỷ lệ khác nhau giữa cơ hô hấp và máy thở cơ học, và áp lực xuyên phổi được tạo ra bởi sự kết hợp áp lực màng phổi âm và áp lực phế nang dương.
Sự hỗ trợ thở máy này có thể cần thiết để duy trì sự sống trong giai đoạn cấp tính của bệnh trong khi hệ thống miễn dịch chống lại sự lây nhiễm virus, nhưng có thể gây hại cho bệnh nhân nếu mức áp lực dương không phù hợp với cơ học phổi liên quan (chấn thương phổi do máy thở gây ra). Tổn thương phổi do thở máy được nghiên cứu kỹ trong ARDS cổ điển, một hội chứng liên quan đến một thực thể mô bệnh học riêng biệt được gọi là tổn thương phế nang lan tỏa (DAD). Tổn thương phế nang lan tỏa là một phản ứng viêm lan rộng, không đồng nhất bao gồm thâm nhiễm phế nang với bạch cầu và lắng đọng protein, tổn thương phế nang phế nang, màng đáy và nội mô, và các vùng xuất huyết lốm đốm (Nash và cộng sự, 1967; Ware & Matthay, 2000). Hiểu được những thay đổi cấu trúc vi mô trong các quá trình bệnh là điều kiện cần thiết để quản lý thông khí hiệu quả, với các thử nghiệm lâm sàng quy mô lớn hỗ trợ việc sử dụng thể tích khí lưu thông thấp (ARDSnet, 2000) và áp lực đẩy (Amato và cộng sự, 2015) để giảm nguy cơ kéo căng hoặc tổn thương quá áp đối với nhu mô phổi vốn đã bị tổn thương, mỏng manh (Slutsky & Ranieri, 2013). Không rõ liệu những hướng dẫn này về thông khí cho bệnh nhân ARDS có được áp dụng cho việc quản lý bệnh nhân viêm phổi COVID-19 hay không và có thể chứng minh một dạng tổn thương riêng biệt.
Sinh lý học của giảm oxy máu ở viêm phổi do covid-19
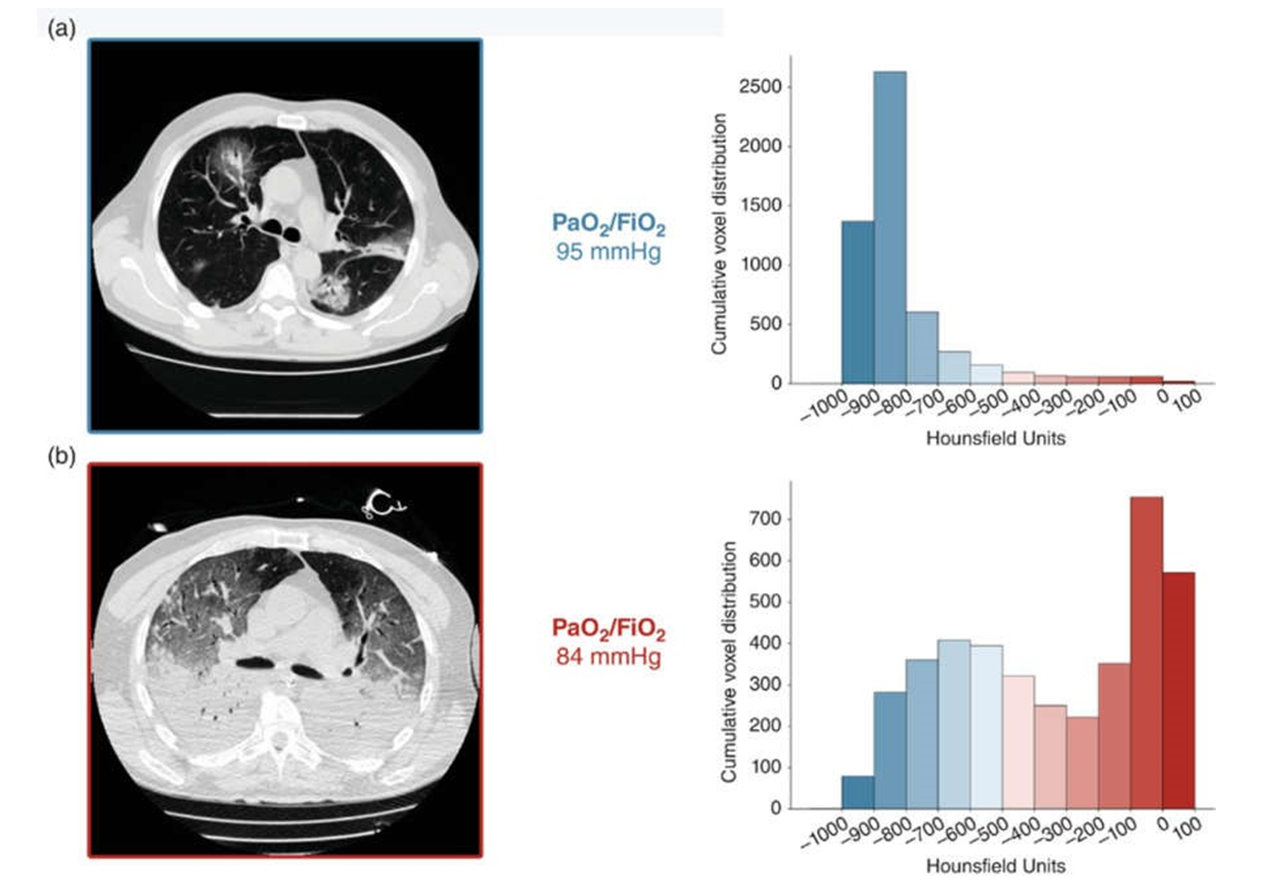
Viêm phổi COVID-19 giai đoạn đầu là một quá trình chủ yếu ảnh hưởng đến ngoại vi của cả hai phổi (Fox và cộng sự, 2020; Shi và cộng sự, 2020). Việc không có xẹp phổi, đông đặc phổi đáng kể trong bệnh viêm phổi COVID-19 giai đoạn đầu giải thích sự không đáp ứng với tăng PEEP trong nhóm này (Ball và cộng sự, 2021; Chiumello và cộng sự, 2020 ), tuy nhiên, người đã chứng minh sự giảm đáng kể oxy hóa (Gattinoni, Chiumello, Caironi và cộng sự, 2020; Hình 1). Bệnh tiến triển với sự phát triển của hình kính mờ hai bên rải rác và cuối cùng, xẹp phổi phù hợp với ARDS (Shi và cộng sự, 2020), và các nghiên cứu sau khi khám nghiệm tử thi ở những bệnh nhân tử vong do viêm phổi COVID-19 đã xác định tổn thương phế nang tương tự. hoặc giống với DAD, ngay cả ở những bệnh nhân không được thở máy xâm nhập (Fox và cộng sự, 2020; Konopka và cộng sự, 2020; Menter và cộng sự, 2020).
HÌNH 1 Chụp cắt lớp vi tính (CT) cho thấy các mức độ đông đặc phổi khác nhau liên quan đến mức độ oxy hóa động mạch tương tự ở những bệnh nhân mắc bệnh coronavirus 2019 (COVID-19). (a) Chụp CT thu được trong quá trình thở tự phát và kết hợp với các giá trị đơn vị Hounsfield thấp, cho thấy các ngăn được thông khí tốt. (b) Chụp CT được thực hiện trong quá trình thở máy có kiểm soát, với PEEP 5 cmH2O, và kết hợp với tỷ lệ rõ rệt của các giá trị đơn vị Hounsfield cao, cho thấy các ngăn không có thông khí. Sao chép với sự cho phép của Gattinoni, Chiumello, Caironi, và cộng sự (2020)
Tất cả các nghiên cứu khám nghiệm tử thi sau khi chết, theo định nghĩa của họ đều bao gồm những bệnh nhân không qua khỏi, có thể xác định một tỷ lệ sai lệch liên quan với bệnh giai đoạn cuối. Tuy nhiên, sinh thiết từ những bệnh nhân còn sống trước đó trong quá trình bệnh cho thấy một số khác biệt quan trọng so với mô học ARDS cổ điển, bao gồm không có các đặc điểm DAD, sự tăng sản của các tế bào phế cầu loại 2 và sự gia tăng số lượng và kích thước của cả mao mạch kẽ và tiểu tĩnh mạch sau mao mạch (Doglioni và cộng sự, 2021).
Một loạt khám nghiệm tử thi nhỏ, xem xét những bệnh nhân chết trước đó trong quá trình bệnh, cũng cho thấy một số khác biệt so với DAD cổ điển, với thâm nhiễm phế nang lympho bào trong giai đoạn đầu, sau đó là sự tiến triển đến lắng đọng fibrin trong lòng phế nang và tổn thương vi mạch (Copin và cộng sự, 2020). Phát hiện sau này về tổn thương vi mạch nghiêm trọng liên quan đến vi khuẩn mao mạch phổi cũng xuất hiện trong loạt bài khác (Fox và cộng sự, 2020; Menter và cộng sự, 2020).
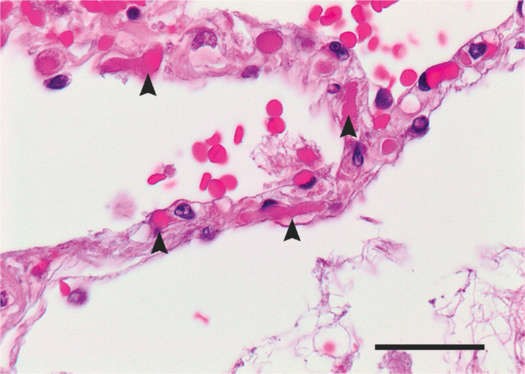
Cơ chế bệnh sinh của những vi khuẩn này có thể liên quan đến tổn thương tế bào nội mô phổi trực tiếp do nhiễm SARS-CoV-2, ngoài ra chứng huyết khối miễn dịch lan rộng được kích hoạt bởi phản ứng miễn dịch rối loạn điều hòa lan rộng (‘bão cytokine’) (Gupta và cộng sự, 2020). Các protein tăng đột biến của SARS-CoV-2, tương tự như các protein trên SARS-CoV-1 ban đầu, tương tác với thụ thể men chuyển 2 (ACE2) (Hoffmann và cộng sự, 2020; Li và cộng sự, 2003). Thụ thể ACE2 được biểu hiện rất nhiều trên các tế bào phế cầu loại 2 và trên các tế bào nội mô (Hamming và cộng sự, 2004), và người ta cho rằng các phần tử virut tương tác với thụ thể này dẫn đến nội bào của phức hợp SARS-CoV-2/ACE2 và sau đó viêm phổi và phản ứng tiền viêm, tiền huyết khối cục bộ. Tổn thương nội mô này tương tự như viêm nội mạc liên quan đến việc thải ghép cơ quan rắn qua trung gian tế bào T (Ackermann, Mentzer, và cộng sự, 2020; Varga và cộng sự, 2020) và có liên quan đến huyết khối mao mạch phế nang và tĩnh mạch sau mao mạch thành một mức độ lớn hơn gấp 9 lần so với mức được thấy ở các bệnh phổi do virus khác, chẳng hạn như viêm phổi H1N1 (Ackermann, Verleden, và cộng sự, 2020; Hình 2). Tân sinh mạch máu, đặc biệt là lồng ruột, cũng được thấy sớm trong quá trình bệnh ở viêm phổi COVID-19 (Ackermann, Verleden, và cộng sự, 2020).
HÌNH 2 Vách ngăn giữa phế nang của một bệnh nhân nam 78 tuổi tử vong do bệnh coronavirus 2019 (COVID-19), cho thấy thành phế nang hơi giãn ra và nhiều vi sợi (đầu mũi tên) trong mao mạch phế nang. Thanh chia độ: 50 μm. Sao lại với sự cho phép của Ackermann, Verleden, và cộng sự (2020), Bản quyền: Hiệp hội Y khoa Massachusetts
Sử dụng nhiều phương pháp hình ảnh bao gồm bản đồ i-ốt từ chụp cắt lớp vi tính năng lượng kép (CT) và chụp cắt lớp phát xạ positron/chụp cắt lớp vi tính phát xạ photon đơn (PET/SPECT), các nhóm khác nhau đã xác nhận sự đồng tồn tại của tình trạng thiếu hụt tưới máu phổi lan rộng có và không có huyết khối nhìn thấy trên X quang (Grillet và cộng sự, 2020; Patel và cộng sự, 2020; Ramos và cộng sự, 2021; Ridge và cộng sự, 2020; Santamarina, Boisier, và cộng sự, 2020; Santamarina, Boisier Riscal, và cộng sự, 2020), giả thuyết thứ hai phản ánh tình trạng viêm mạch máu hoặc thay đổi trương lực mạch (Busana và cộng sự, 2021). Các vùng giảm tưới máu chứng tỏ nhu mô phổi và khoảng không khí gần như gần bình thường. Ngoài ra, còn có bằng chứng cho thấy thể tích máu phổi được phân phối lại theo các vùng kính mờ, có khả năng làm trầm trọng thêm shunt (Si-Mohamed và cộng sự, 2020). Những phát hiện này phù hợp với bằng chứng lâm sàng về việc tăng khoảng chết, được đo bằng tỷ lệ thông khí (Chiumello và cộng sự, 2020; Patel và cộng sự, 2020), ngoài trộn lẫn tĩnh mạch (Chiumello và cộng sự, 2020) trong viêm phổi COVID-19.
Dựa trên những nghiên cứu hình ảnh này và rối loạn chức năng nội mô đã biết do nhiễm SARS-CoV2, một trong những nguyên nhân gây ra không phù hợp thông khí – tưới máu và do đó giảm oxy máu trong viêm phổi COVID-19 được giả thuyết là mất phản ứng co mạch phổi do thiếu oxy bình thường (HPV) (Gattinoni, Chiumello, Caironi và cộng sự, 2020; Ramos và cộng sự, 2021), ngoài sự phân phối lại vật lý của máu do huyết khối làm tắc mạch.
Các biến chứng mạch máu vĩ mô, bao gồm thuyên tắc phổi, cũng thường gặp trong nhiễm trùng SARSCoV-2 nặng (Helms và cộng sự, 2020) và có thể phát sinh từ các nguồn chi dưới phù hợp với huyết khối miễn dịch lan rộng hoặc từ huyết khối phổi tại chỗ (Loo và cộng sự, 2021).
So sánh với ards cổ điển
Trong ARDS với các nguyên nhân khác, mức độ nghiêm trọng của bệnh, được đánh giá bằng cách sử dụng tỷ lệ PaO2/FiO2 theo định nghĩa Berlin (Ranieri và cộng sự, 2012), tỷ lệ thuận với số lượng phù phổi và số lượng mô phổi không được thông khí (Caironi và cộng sự, 2015). Mối quan hệ nghịch đảo này giữa tỷ lệ PaO2/FiO2 và số lượng mô phổi không được thông khí là một dấu hiệu của ARDS và do mối quan hệ chặt chẽ nên có thể ước tính tỷ lệ shunt và do đó PaO2/FiO2 từ lượng mô xẹp thu được từ CT phổi (Reske và cộng sự, 2013).
Hàm ý của mối quan hệ này là một bệnh tiến triển nặng hơn có liên quan đến thể tích phổi ngày càng nhỏ hơn để thông khí (‘phổi bé’) và lượng phổi bị xẹp dần nhưng có khả năng huy động (Gattinoni và cộng sự, 2006). Hai đặc điểm này làm cơ sở cho các khuyến nghị được chấp nhận rộng rãi về việc sử dụng hệ thống thông khí với thể tích khí lưu thông thấp hơn (để bảo vệ phổi bé) và lượng PEEP tăng dần (theo bảng PEEP/FiO2), để tiếp tục mở phổi bị xẹp phổi nhưng có khả năng huy động.
Mặc dù vẫn còn một số chưa chắc chắn về các cơ chế cơ bản, tình trạng giảm oxy máu được quan sát sớm trong COVID-19 là kết quả của sự tương tác phức tạp hơn giữa rối loạn điều hòa tưới máu phổi thông qua thay đổi chuyển hóa angiotensin II, viêm mạch máu, mất co mạch phổi do thiếu oxy, tân tạo mạch và chứng huyết khối miễn dịch (Ackermann, Verleden, và cộng sự, 2020; Busana và cộng sự, 2021; Habashi và cộng sự, 2021; Sherren và cộng sự, 2020). Khi bệnh tiến triển, bằng chứng là chụp CT hàng loạt và khám nghiệm tử thi, người ta thấy những thay đổi phù hợp với ARDS cổ điển. Do đó, hai kiểu hình khác nhau của bệnh viêm phổi COVID19 đã được đề xuất: ‘loại L’, liên quan đến độ đàn hồi, tỷ lệ V/Q, trọng lượng phổi và khả năng huy động thấp, và ‘loại H’, liên quan đến độ đàn hồi, shunt từ phải sang trái, trọng lượng phổi và khả năng huy động cao (Gattinoni, Chiumello, Caironi và cộng sự, 2020). Về mặt sinh lý bệnh cơ bản, loại L liên quan đến quá trình bệnh ngoại vi ban đầu, trong đó tình trạng thiếu oxy là trung gian của sự thiếu hụt tưới máu và tăng khoảng chết, trong khi loại H liên quan đến sinh lý bệnh phù hợp với ARDS cổ điển. Sự phân biệt như vậy phải được thực hiện một cách thận trọng, bởi vì rõ ràng là một số bệnh nhân sẽ biểu hiện các đặc điểm của cả hai loại, một số sẽ chuyển đổi giữa các loại, và một số sẽ ở lại loại này hoặc loại khác trong toàn bộ quá trình bệnh của họ. Việc hiểu rõ về sinh lý bệnh cơ bản cụ thể ở bất kỳ bệnh nhân cụ thể nào là rất quan trọng để lựa chọn chế độ thở máy phù hợp, nhằm tối ưu hóa sự trao đổi khí và ngăn ngừa tổn thương thêm cho phổi vốn đã bị tổn thương.
Do hiện tượng mạch máu vượt trội trong bệnh loại L, sự thay đổi trong trao đổi khí (trộn lẫn tĩnh mạch và thông khí khoảng chết dẫn đến giảm oxy máu và tăng CO2 máu) có thể xảy ra khi có thể tích phổi gần như bình thường (Gattinoni, Chiumello, Rossi, và cộng sự , 2020; Gattinoni, Coppola, và cộng sự, 2020; Gattinoni, Meissner, và cộng sự, 2020; Gattinoni và cộng sự, 2021). Trong trường hợp này, có sự phân biệt hoàn toàn giữa mức độ nghiêm trọng của các thay đổi trong trao đổi khí (chủ yếu là giảm oxy máu) và thể tích phổi được và do đó độ giãn nở của hệ thống hô hấp bảo tồn tương đối (Chiumello và cộng sự, 2020).
Cuối cùng, một số bệnh nhân bị viêm phổi COVID19 phát triển thành xơ phổi không hồi phục (George và cộng sự, 2020; Mo và cộng sự, 2020), cũng xuất hiện muộn trong ARDS (Masclans và cộng sự, 2011). Kiểu hình này biểu hiện như một bệnh lý phổi hạn chế với khả năng huy động phổi tối thiểu (PLR) và có liên quan đến khó cai thở máy và tiên lượng xấu, trong một số trường hợp cần phải ghép phổi (Bharat và cộng sự, 2020).
Những cân nhắc trên là cần thiết để xử trí thích hợp bệnh nhân suy hô hấp giảm oxy máu thứ phát sau COVID-19 (Habashi và cộng sự, 2021; Robba và cộng sự, 2020). Việc quản lý này đòi hỏi sự thay đổi giữa các khái niệm chọn thể tích khí lưu thông thấp dựa trên mức độ nghiêm trọng của tình trạng giảm oxy máu và lựa chọn PEEP dựa trên tỷ lệ PaO2/FiO2 (Marini & Gattinoni, 2020) và sẽ yêu cầu đánh giá toàn cục hơn về bệnh nhân, bắt đầu với sự hiểu biết về thời gian của các triệu chứng, đặc điểm X quang (đặc biệt là CT) và đánh giá cơ học phổi, tốt nhất là ở PEEP 5 cmH2O (Caironi và cộng sự, 2015; Chiumello và cộng sự, 2020).
Lựa chọn thể tích khí lưu thông
Thông thường, thể tích khí lưu thông dự đoán là 6 ml/kg trọng lượng cơ thể (PBW) được sử dụng ở bệnh nhân ARDS vì so với việc cung cấp thể tích khí lưu thông lớn hơn, nó làm tăng cả khả năng sống sót và số ngày sống mà không cần thông khí (ARDSnet, 2000). Với sự phân biệt đã đề cập ở trên giữa mức độ nghiêm trọng của oxy và thể tích phổi, thể tích khí lưu thông là 6 ml/kg PBW có thể không thích hợp cho mọi bệnh nhân ở mọi giai đoạn của quá trình bệnh. Các nghiên cứu gần đây cho thấy rõ ràng rằng việc chọn tổng thể tích dựa trên giá trị của áp lực đẩy (DP; được đo bằng áp lực bình nguyên trừ PEEP hoặc theo thể tích khí lưu thông chia cho độ giãn nở) là một cách tốt hơn để cá nhân hóa tổng thể tích phù hợp với phổi, và do đó thể tích phổi, do đó điều chỉnh thể tích khí lưu thông với các kiểu hình khác nhau của bệnh, với mục đích duy trì strain của phổi trong một phạm vi hẹp (Amato và cộng sự, 2015; Costa và cộng sự, 2021; Goligher và cộng sự, 2021).
Trên thực tế, cách tiếp cận đầu tiên ở một bệnh nhân được thở máy có kiểm soát nên chọn thể tích khí lưu thông phản ánh ngưỡng áp lực kiểm soát thay vì dựa trên PBW, hoặc đặt áp lực đẩy thấp nhất (trong kiểm soát áp lực) để đạt được bất kỳ mức khí lưu thông ban đầu nào trong vòng thể tích 8 ml/kg PBW. Nếu áp lực đẩy 2O (Tsolaki và cộng sự, 2021), thể tích khí lưu thông liên quan có thể được duy trì. Tuy nhiên, áp lực đẩy có thể cao hơn 14 cmH2O ở những bệnh nhân giảm độ giãn nở và trong trường hợp này, thể tích khí lưu thông cần phải được hạ xuống cho đến khi đạt được áp lực đẩy mục tiêu (Marini & Gattinoni, 2020). Cách tiếp cận chọn tổng thể tích này dựa trên áp lực đẩy 2O đảm bảo tránh được cả tình trạng giảm thông khí ở những bệnh nhân độ giãn nở được bảo tồn và căng thẳng quá mức ở những bệnh nhân có thể tích phổi nhỏ hơn và độ giãn nở của phổi thấp hơn.
Tổng năng lượng do máy thở cơ học cung cấp cho hệ thống hô hấp mỗi phút có thể được tính toán bằng cách kết hợp thể tích khí lưu thông, PEEP, áp lực bình nguyên và áp lực đỉnh và tần số hô hấp, tất cả đều được sử dụng để xác định năng lượng cơ học. Sự cân bằng giữa sự giảm thể tích khí lưu thông và sự gia tăng nhịp hô hấp để đạt được sự thông khí phút nhất định cần thiết để loại bỏ một lượng carbon dioxide đủ có thể được tính toán bằng cách sử dụng công thức của năng lượng cơ học (Giosa và cộng sự, 2019) hoặc một công thức thực tế viết tắt của 4DPRR (4 × áp lực đẩy + tần số hô hấp) (Costa và cộng sự, 2021). Sử dụng công thức này, có thể chọn tổng thể tích thích hợp nhất (dựa trên áp lực đẩy) và tần số hô hấp sẽ cho tổng giá trị thấp nhất có thể là 4DPRR (Costa và cộng sự, 2021).
Lựa chọn peep
Việc lựa chọn PEEP trong COVID-19 rất phức tạp, dựa trên sự phân ly giữa giảm oxy máu và tỷ lệ shunt giải phẫu, thường phản ánh số lượng mô phổi không được thông khí (Chiumello và cộng sự, 2020). Việc chọn PEEP cao chỉ dựa trên mức độ nghiêm trọng của tình trạng giảm oxy máu ở những bệnh nhân có độ giãn nở phổi được bảo tồn sẽ gây thêm stress và strain tĩnh, thay đổi tưới máu phổi và huyết động, và cuối cùng, tăng thành phần tĩnh của năng lượng cơ học và góp phần gây ra chấn thương (Güldner và cộng sự, 2016).
Cách tiếp cận tốt nhất để đánh giá tác động của các mức PEEP khác nhau là đo khả năng huy động phổi thông qua chụp CT hoặc đơn giản hơn là tại giường bệnh bằng cách sử dụng tỷ lệ bơm phồng phổi trên một lần hít thở (tỷ lệ R/I). Tỷ lệ này được tính bằng độ giãn nở của thể tích phổi được giải phóng đột ngột PEEP từ 15 đến 5 cmH2O (hoặc áp lực mở đường thở) chia cho độ giãn nở ở mức PEEP 5 cmH2O (hoặc áp lực mở đường thở). Tỷ lệ R/I> 0,5 cho thấy khả năng huy động của phổi cao hơn và những bệnh nhân này có thể được hưởng lợi từ mức PEEP cao hơn (Chen và cộng sự, 2020). Trong COVID-19, khả năng huy động rất thay đổi (Beloncle và cộng sự, 2020) và dường như phụ thuộc chủ yếu vào sự chậm trễ từ các triệu chứng đến khi nhập viện chăm sóc đặc biệt hoặc đặt nội khí quản, ngoài việc điều trị tại bệnh viện trước khi tổ chức thở máy.
Điều quan trọng cần nhấn mạnh là sự cải thiện ôxy sau khi tăng PEEP không nhất thiết cho thấy khả năng huy động. Áp lực dương trong lồng ngực có mối quan hệ phức tạp với quá trình oxy hóa. Bằng cách giảm áp lực xuyên qua mao mạch phế nang, nó có thể làm suy giảm tưới máu phổi (Versprille, 1987) và thậm chí tái phân phối nó đến những vùng không thông khí (Cronin và cộng sự, 2020), nhưng bằng cách tăng thể tích phổi, nó cũng có thể làm tăng lưu lượng qua mạch máu ngoài phế nang và, ngoài ra, làm giảm tỷ lệ shunt bằng tác dụng làm giảm cung lượng tim (Dantzker và cộng sự, 1980). Do đó, nhiều bệnh nhân có thể đáp ứng với sự gia tăng PEEP với sự cải thiện về oxygen hóa nhưng suy giảm khả năng thông khí trong khoảng chết, giảm độ giãn nở của hệ thống hô hấp và tăng áp lực đẩy (Grieco và cộng sự, 2020). Chỉ khi tất cả những thay đổi này được xem xét, thì mới có thể xác định được liệu có cần thiết đặt PEEP cao hơn hay thấp hơn cho từng bệnh nhân hay không.
Can thiệp cứu nạn
Khi quyết định sử dụng các quy trình huy động (RM), việc xác định khả năng huy động phổi một lần nữa là vô cùng quan trọng. Các thủ thuật huy động và PEEP cao ở những bệnh nhân có khả năng huy động phổi thấp có thể gây căng quá mức các vùng phổi đã được mở, làm tăng strain động, volutrauma và barotrauma do tác động của các yếu tố gây căng thẳng (các vùng phổi nơi diễn ra quá trình khuếch đại các lực cơ học), có thể chiếm 14– 23% nhu mô phổi (Cressoni và cộng sự, 2014). Ở những bệnh nhân này, chiến lược hiệu quả nhất là sử dụng PEEP 5 – 8 cmH2O, tránh RM và tư thế nằm sấp sớm, lý tưởng nhất là trong vòng 24 giờ đầu tiên đặt nội khí quản (Guerin và cộng sự, 2013; Langer và cộng sự, 2021; Mathews và cộng sự, 2021; Shelhamer và cộng sự, 2021; Weiss và cộng sự, 2021; Zarantonello và cộng sự, 2020).
Ngược lại, ở những bệnh nhân có khả năng huy động phổi cao, PEEP> 10 cmH2O (nhưng có thể ≤ 15–18 cmH2O) có thể dẫn đến mở các đơn vị phế nang mới, làm giảm strain động và tăng thể tích huy động. Ở những bệnh nhân này, PEEP cao hơn có thể cải thiện tính đồng nhất của phổi.
Trong cả hai trường hợp, cách hiệu quả nhất để đạt được sự đồng nhất của phổi và thông khí bảo vệ cũng như tối ưu hóa V/Q đối sánh là sử dụng định vị nằm sấp (Beitler và cộng sự, 2014; Gattinoni và cộng sự, 2003; Munshi và cộng sự, 2017; Weiss và cộng sự, 2021). Tư thế nằm sấp đã có hiệu quả trong việc cải thiện trao đổi khí ở bệnh nhân ARDS và ở những bệnh nhân có COVID-19 (Guérin và cộng sự, 2020; Scaramuzzo và cộng sự, 2021), và các nghiên cứu khác đang được tiến hành để xác định khả năng giảm tỷ lệ tử vong của nó. Trong đại dịch COVID-19, việc sử dụng tư thế nằm sấp đã được mở rộng cho những bệnh nhân không được đặt nội khí quản nhưng được hỗ trợ cơ học không xâm lấn hoặc chỉ đơn giản là thở oxy qua mũi với lưu lượng cao. Nằm sấp thức tỉnh đã cải thiện sự trao đổi khí, nhưng tác dụng cuối cùng trong việc ngăn ngừa đặt nội khí quản, cải thiện kết quả hoặc thay đổi tiến trình của quỹ đạo của bệnh là không rõ ràng (Coppo và cộng sự, 2020; Ferrando và cộng sự, 2020).
Thở tự nhiên và nguy cơ tổn thương phổi do bệnh nhân tự gây ra
Giảm oxy máu nghiêm trọng có liên quan đến tăng thông khí (Weil và cộng sự, 1970), nhưng mối tương quan của nó với triệu chứng khó thở tốt nhất là vừa phải, với các yếu tố khác, chẳng hạn như tăng CO2 máu và hạn chế cơ học của thông khí, cho thấy mối quan hệ chặt chẽ hơn dựa trên cơ sở được chấp nhận của nguyên tắc sinh lý (Manning & Schwartzstein, 1995). Trong trường hợp nhiễm SARS-CoV-2 nặng, một nhóm bệnh nhân có thể chịu đựng được tình trạng giảm oxy máu ở mức độ đe dọa đến tính mạng mà không có biểu hiện suy hô hấp hoặc đói khí rõ ràng (Tobin và cộng sự, 2020). Một số cơ chế được đề xuất để giải thích cho hiện tượng này. Sự thiếu hụt tương đối của những thay đổi trong nhu mô phổi và độ giãn nở của hệ thống hô hấp được thấy khi bị nhiễm trùng sớm có thể ghi đè lên phản ứng khó thở có thể xảy ra giảm oxy máu do không phù hợp V/Q nặng (Couzin -Frankel, 2020). Các biểu hiện thần kinh của nhiễm trùng SARS-CoV-2 là phổ biến, đặc biệt là chứng mất khứu giác, và sự suy giảm trực tiếp của trung tâm kiểm soát hô hấp có thể là hậu quả của tình trạng viêm thân não do vi rút gây ra (Matschke và cộng sự, 2020).
Trong đại dịch COVID-19, người ta đã thấy rõ rằng các nhóm bệnh nhân khác bị suy hô hấp giảm oxy máu nặng có biểu hiện chấn thương khí áp, khí phế thũng trung thất và khí phế thũng dưới da sinh ra trong quá trình thở tự phát, thường khi không có thêm bất kỳ áp lực dương đường thở nào. Chứng chấn thương khí áp này gây ra trong quá trình thở tự phát đã được đặt tên là chấn thương phổi do bệnh nhân tự gây ra (P-SILI) (Cruces và cộng sự, 2020; Yoshida và cộng sự, 2017), để phản ánh thực tế là thường xuyên cố gắng thở quá mức (ví dụ:> 15 cmH2O) (Esnault và cộng sự, 2020; Roesthuis và cộng sự, 2021), ngay cả khi không có thông khí áp lực cao, có thể góp phần gây tổn thương phổi nặng và tiến triển bệnh phổi. Do nguy cơ cao của P-SILI ở những bệnh nhân COVID-19 này, điều quan trọng là phải theo dõi các nỗ lực thở máy trong cả thông khí không xâm nhập và xâm nhập.
Theo dõi nỗ lực hít vào trong quá trình thông khí không xâm nhập khó hơn và phụ thuộc vào việc ghi lại tổng thể tích, di động cơ hoành được đo bằng siêu âm, hoặc các dấu hiệu kích hoạt các cơ hít vào. Tuy nhiên, phép đo chính xác nhất về nỗ lực hít vào thu được bằng cách đưa một ống thông bóng vào thực quản, mặc dù có một số khó khăn thực tế, nhưng có thể ghi lại sự thay đổi áp lực trong thực quản (Tonelli và cộng sự, 2020). Sự dao động trong (hoặc delta) áp lực thực quản phản ánh những thay đổi của áp lực đa lượng và do đó có thể đưa ra dấu hiệu về việc liệu nỗ lực hít vào nhất định có quá mức và có thể dẫn đến P-SILI hay không. Chiến lược này có hiệu quả trong việc theo dõi nỗ lực hô hấp và dự đoán thất bại khi thở máy không xâm nhập (Tonelli và cộng sự, 2020).
Ở những bệnh nhân được thông khí xâm lấn, có thể đo P0.1 (áp lực đường thở trong 100 ms đầu tiên khi hít vào), phản ánh trung khu điều hòa hít vào và để tính áp lực tắc (DPocc, là sự khác biệt giữa áp lực đường thở âm nhất thu được trong quá trình tắc đường thở và giá trị của PEEP). Tầm quan trọng của các phép đo này đã được chỉ ra gần đây trong một nghiên cứu nơi 62,5% bệnh nhân có P0,1 cao (> 4 cmH2O) và DPocc (2O) bị suy hô hấp tái phát so với không có bệnh nhân nào nếu P0.1 và DPocc thấp (Esnault và cộng sự, 2020).
Nhân DPocc với 0,75 cho phép ước tính áp lực cơ hô hấp (Pmus = – 0,75 x DPocc) và áp lực xuyên phổi động (DPL = DP – ⅔DPocc). Như một hướng dẫn chung, người ta đã gợi ý rằng nếu Pmusc ước tính là> 13–15 cmH2O hoặc DPL ≥ 16 cmH2O, nên theo dõi cẩn thận hơn áp lực xuyên phổi với áp lực thực quản, hoặc nên thực hiện các thay đổi trong chiến lược an thần và thở máy để giảm stress và strain cho phổi (Bertoni và cộng sự, 2020).
Kết luận
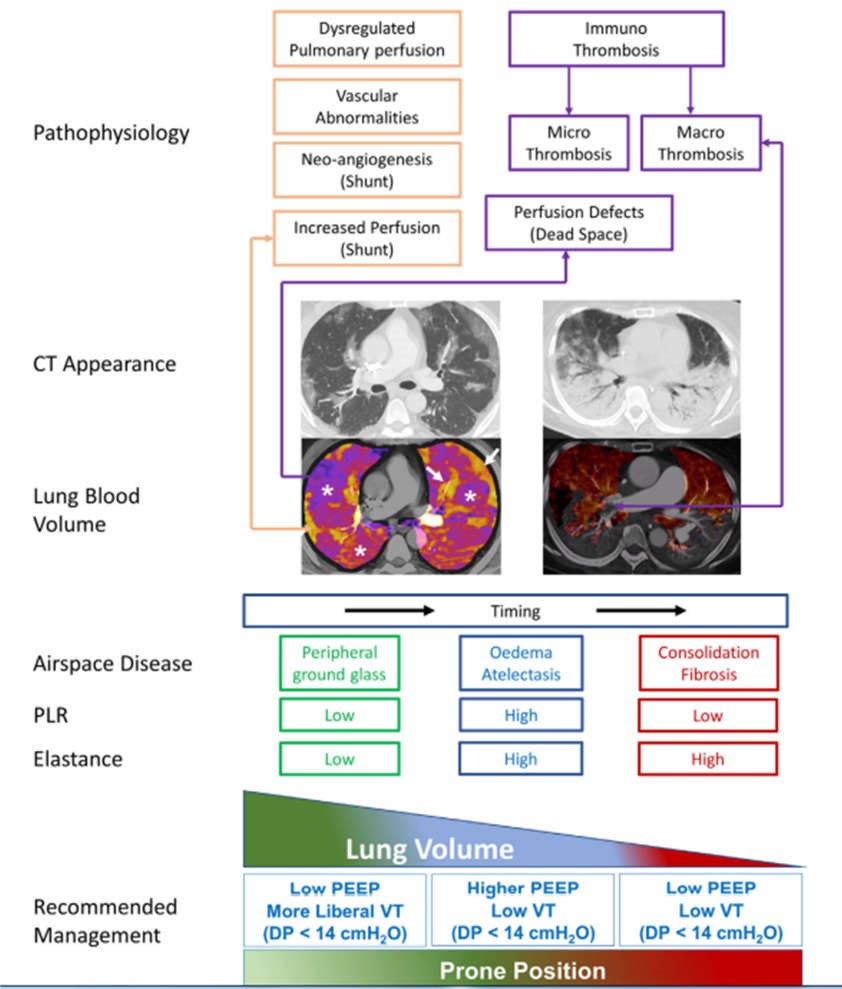
Viêm phổi COVID-19 là một thực thể sinh lý bệnh khác biệt với ARDS cổ điển và yêu cầu xử trí thông khí khác nhau (Hình 3). Ở giai đoạn đầu, bệnh loại L, tình trạng giảm oxy máu chủ yếu được củng cố bởi khoảng chết tăng lên và không phù hợp V/Q và không tương quan với thể tích phổi khỏe mạnh. Do đó, thể tích khí lưu thông không nên bị giới hạn nghiêm ngặt, mà nên tự do hơn miễn là áp lực đẩy có giới hạn. Tương tự như vậy, mức PEEP không nên được chuẩn hóa theo liên quan đến tình trạng giảm oxy máu mà dựa trên khả năng huy động của phổi, không nhất thiết phải cao nếu có bệnh lý về khoảng khí tối thiểu. Nằm sấp ở cả bệnh nhân thở tự nhiên và thở máy thường có lợi và cần được xem xét sớm.
HÌNH 3 Sơ đồ tóm tắt các đặc điểm sinh lý bệnh liên quan đến nhiễm coronavirus 2 (SARS-CoV-2) hội chứng hô hấp cấp nặng và đề xuất xử trí thở máy cho bệnh nhân mắc bệnh coronavirus nặng 2019 (COVID-19) tại khoa chăm sóc đặc biệt. Hình bên cho thấy các cơ chế sinh lý bệnh chính đã biết có thể dẫn đến giảm oxy máu, với các hình ảnh CT ghép nối (hàng trên) và bản đồ tưới máu i-ốt (hàng dưới) cho biết các giai đoạn chính. Ban đầu, giảm oxy máu liên quan đến tăng shunt (mũi tên) và thông khí khoảng chết (dấu hoa thị), với bệnh lý nhu mô phổi tối thiểu có nguy cơ tổn thương phổi do máy thở. Thể tích khí phổi có thể giảm theo thời gian vì phù và xẹp phổi, có thể hồi phục khi nằm sấp hoặc PEEP cao hơn. Cuối cùng, sự đông đặc và/hoặc xơ hóa có thể làm cho tình trạng kém đáp ứng với cả nằm sấp và PEEP (khả năng huy động thấp). Huyết khối lớn cũng xuất hiện, với thuyên tắc phổi gây giảm hoặc không có tưới máu trên diện rộng. Viết tắt: CT, chụp cắt lớp vi tính; DP, áp lực đẩy (áp lực bình nguyên trừ PEEP); PEEP, áp lực dương cuối kỳ thở ra; PLR, khả năng huy động hoặc huy động phổi (khả năng mở các vùng phổi không có khí trước đó với sự gia tăng áp lực xuyên phổi); VT, thể tích khí lưu thông. Hình ảnh bên trái lấy từ Santamarina, Boisier Riscal, và cộng sự (2020) và hình ảnh bên phải từ Ridge và cộng sự (2020), với sự cho phép.