Tần suất tăng áp lực trong ổ bụng (IAH, intra abdominal hypertension) cao và vẫn chưa được các bác sĩ hồi sức trên khắp thế giới đánh giá cao. Một phần tư đến một phần ba bệnh nhân sẽ có IAH khi nhập viện, trong khi phân nửa bệnh nhân sẽ phát triển IAH trong tuần đầu tiên ở Đơn vị Chăm sóc Đặc biệt (ICU). IAH có liên quan đến tỷ lệ mắc bệnh và tử vong cao. Mặc dù đã đạt được nhiều tiến bộ đáng kể trong những thập kỷ qua, một số câu hỏi quan trọng vẫn còn liên quan đến việc xử trí thông khí tối ưu cho bệnh nhân IAH. Bước đầu tiên quan trọng là đo áp lực trong ổ bụng (IAP, intra-abdominal pressure). Nếu có IAH (IAP > 12 mmHg), các điều trị nội khoa nên được bắt đầu để giảm IAP vì giảm nhẹ thể tích trong ổ bụng có thể làm giảm đáng kể áp lực IAP và đường thở. Bảo vệ thông khí phổi với thể tích khí lưu thông thấp ở bệnh nhân suy hô hấp và IAH là quan trọng. Sự truyền áp lực ổ bụng-lồng ngực khoảng 50%. Ở những bệnh nhân có IAH, mức áp lực dương cuối thì thở ra (PEEP) cao hơn thường được yêu cầu để tránh xẹp phế nang nhưng PEEP tối ưu ở những bệnh nhân này vẫn chưa được biết. Trong quá trình huy động phế nang, áp lực mở cao hơn có thể được yêu cầu trong khi theo dõi chặt chẽ quá trình oxygen hóa và đáp ứng huyết động. Trong quá trình thông khí bảo vệ phổi, trong khi giữ áp lực đẩy trong giới hạn an toàn, áp lực cao nguyên cao hơn mức bình thường được coi là có thể chấp nhận được. Theo dõi chức năng hô hấp và điều chỉnh các cài đặt thông khí trong quá trình gây mê và chăm sóc đặc biệt là rất quan trọng. Bài tổng quan này sẽ tập trung vào cách đối phó với các rối loạn hô hấp ở những bệnh nhân bị bệnh nặng với IAH.
Mở đầu
Tăng áp lực trong ổ bụng (IAH) được định nghĩa là sự gia tăng liên tục áp lực trong ổ bụng (IAP) bằng hoặc trên 12 mmHg [1]. Các bác sĩ chăm sóc đặc biệt trên khắp thế giới vẫn đánh giá thấp tỷ lệ mắc IAH cao, khoảng 25% ở bệnh nhân ICU hỗn hợp [2, 3].
IAH có liên quan đến tăng tỷ lệ mắc bệnh và tử vong [2, 4] và chủ yếu là do thể tích dịch trong ổ bụng quá nhiều [5, 6].
IAH tác động trực tiếp đến chức năng nội tạng của các cơ quan trong ổ bụng như thận, gan.
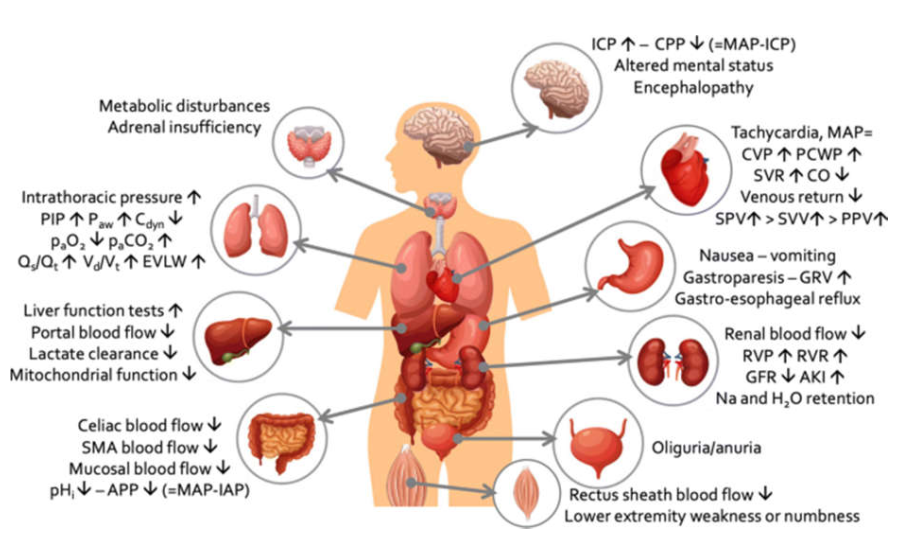
Hơn nữa, IAH có thể ảnh hưởng đến chức năng của các cơ quan bên ngoài khoang bụng bao gồm não, hệ thống tim mạch và phổi [7]. Hình 1 tóm tắt tác động sinh lý bệnh của IAH đối với chức năng của cơ quan nội tạng. IAH ảnh hưởng chủ yếu đến cơ học hô hấp và chỉ một phần đến quá trình oxygen hóa. IAH gây ra sự thay đổi cơ hoành do đó làm tăng áp lực trong lồng ngực và giảm độ giãn nở của thành ngực và thể tích phổi [8]. Bảng 1 liệt kê các yếu tố khác ảnh hưởng đến việc độ giãn nở “thành ngực”.
Hình 1. Tóm tắt những tác động sinh lý bệnh quan trọng nhất của việc tăng áp lực trong ổ bụng lên chức năng của cơ quan nội tạng trong và ngoài khoang bụng. Tổn thương thận cấp AKI, áp lực tưới máu ổ bụng APP, độ giãn nở hô hấp động Cdyn, cung lượng tim CO, áp lực tưới máu não CPP, áp lực tĩnh mạch trung tâm CVP, nước ngoài mạch máu phổi EVLW, tốc độ lọc cầu thận GFR, thể tích tồn dư trong dạ dày GRV, nhịp tim HR, áp lực trong ổ bụng IAP, áp lực nội sọ ICP, áp lực nội lồng ngực ITP, áp lực động mạch trung bình MAP, áp lực đỉnh hít vào PIP, áp lực đường thở Paw, áp lực bờ mao mạch phổi PCWP, pH dạ dày trong niêm mạc pHi, thay đổi áp lực mạch PPV, Phân suất shunt Qs/Qt, áp lực tĩnh mạch thận RVP, sức cản mạch thận RVR, động mạch mạc treo tràng trên SMA, biến đổi áp lực tâm thu SPV, sức cản mạch hệ thống SVR, biến đổi thể tích hành trình SVV, thông khí khoảng chết Vd/Vt.
Bảng 1. Các yếu tố ảnh hưởng đến độ giãn nở “thành ngực”
|
Tác dụng trực tiếp lên thành ngực Tràn dịch màng phổi Ghép phổi Cắt đốt (hậu CABG) Béo phì Tình trạng quá tải dịch Gãy xương sườn Ảnh hưởng gián tiếp đến thành ngực — tăng áp lực trong ổ bụng (IAH) Chướng bụng Cổ trướng Tình trạng quá tải dịch Béo phì |
Mục đích của tổng quan này là thảo luận về ảnh hưởng của IAH đối với chức năng hô hấp và xử trí thông khí của bệnh nhân IAH, và xử trí thông khí của bệnh nhân IAH không chỉ phải tính đến các tác động hô hấp của IAH mà còn hậu quả của bất kỳ bệnh phổi mãn tính tiềm ẩn nào hoặc chấn thương phổi mới mắc phải.
Dịch tễ học
Tăng áp lực trong ổ bụng
Khoảng một phần tư đến một phần ba bệnh nhân có IAH khi nhập viện chăm sóc đặc biệt (ICU) trong khi khoảng một phần hai sẽ phát triển IAH trong tuần đầu tiên ở ICU [2, 9]. Hơn nữa, một trong hai mươi bệnh nhân ICU hỗn hợp sẽ phát triển hội chứng khoang bụng quá mức, một hội chứng gây chết người với tỷ lệ tử vong trên 75% khi không được điều trị [4]. Cho đến ngày nay, bệnh nhân có thể chưa nhận biết được IAH do nhận thức vẫn còn thấp [3]. Các yếu tố nguy cơ đối với IAH bao gồm phẫu thuật bụng, phẫu thuật được thực hiện trong cơ sở cấp cứu, đa chấn thương nặng, chấn thương bụng, sốc xuất huyết nặng, bỏng nặng, viêm tụy cấp nặng, dịch hồi sức thể tích lớn (đặc biệt là tụ dịch) dẫn đến ứ dịch, tắc ruột, và rối loạn chức năng gan [10].
Suy hô hấp và tăng áp lực trong ổ bụng
Bệnh nhân thở máy có nhiều khả năng mắc IAH hơn [11, 12]. Ngoài ra, bệnh nhân suy hô hấp có tỷ lệ PaO2/FiO2 10 cmH2O hoặc có áp lực đỉnh đường thở> 28 cmH2O có nhiều khả năng bị IAH [12, 13]. Các yếu tố khác không tìm thấy mối liên quan giữa thở máy và IAH [14]. Bảng 2 liệt kê các tác động hô hấp do IAH gây ra.
Bảng 2. Tác động hô hấp liên quan đến tăng IAP
|
Ảnh hưởng đến cơ hô hấp (Độ cao cơ hoành) |
|
Áp lực trong lồng ngực ↑ Áp lực màng phổi ↑ Áp lực đỉnh đường thở ↑ (kiểm soát thể tích) Áp lực đường thở trung bình ↑ Áp lực đường thở cao nguyên ↑ Độ giãn nở hệ thống hô hấp ↓ Độ giãn nở thành ngực ↓ Độ giãn nở phổi = Thể tích phổi ↓ (kiểm soát áp lực) Dung tích cặn chức năng (FRC) ↓ Xẹp phổi do lực nén ↑ Sức cản mạch máu phổi ↑ Điểm uốn dưới trên đường cong PV ↑ |
|
Giảm trao đổi khí |
|
Hypercarbia ↑ Oxygen hóa ↓ Thông khí khoảng chết ↑ Shunt trong phổi ↑ Thông khí tưới máu không phù hợp ↑ Phù phế nang ↑ |
|
Tác dụng lâm sàng (Khó cai máy) |
|
Mức tiêu thụ oxy ↑ Chi phí chuyển hóa và công thở ↑ |
|
Tác dụng sinh học |
|
Bạch cầu trung tính ở phổi hoạt hóa ↑ Thâm nhiễm viêm phổi (thử nghiệm) ↑ |
Thông điệp chính 1: Dịch tễ học và IAH
Tỷ lệ trung bình của IAH ở những bệnh nhân nặng là khoảng 25–30% khi nhập viện, và tỷ lệ tích lũy là khoảng 50% trong tuần đầu tiên ở ICU. Có mối liên quan giữa bệnh nhân bị IAH và suy hô hấp.
Ảnh hưởng của tăng áp lực trong ổ bụng đến chức năng hô hấp
Ảnh hưởng của tăng áp lực trong ổ bụng lên thể tích phổi
Sinh lý bệnh
IAH gây ra sự dịch chuyển lên phía trên của cơ hoành, do đó làm tăng áp lực trong lồng ngực ảnh hưởng đến thể tích phổi và cơ hô hấp [8]. IAH có liên quan đến việc giảm thể tích phổi như trong nhiều thí nghiệm trên động vật [15-19]. Thể tích phổi giảm khi mức độ IAH ngày càng tăng [18, 19].
Dữ liệu động vật
Ở lợn, tăng IAP từ ban đầu lên 12, 18 và 22 mmHg làm giảm thể tích phổi cuối kỳ thở ra lần lượt là 30, 46 và 49% [19]. Không có đủ dữ liệu để biết thể tích IAP phổi giảm hoặc xẹp phổi ở mức độ nào. Ít nhất ở lợn, thể tích phổi giảm khi mức độ IAH ngày càng tăng [18, 19]. Ví dụ, Mutoh et al. [20] bơm căng bóng bụng ở heo con với số lượng nhỏ và nhận thấy rằng thể tích phổi cuối kỳ thở ra giảm ngay cả sau khi IAP tăng nhỏ. Quintel và cộng sự [15] áp dụng IAP ở lợn là 15 mmHg và đo thể tích phổi lồng ngực bằng chụp cắt lớp vi tính. IAH làm tăng tỷ lệ phổi bị xẹp phổi và thông khí kém.
Dữ liệu con người
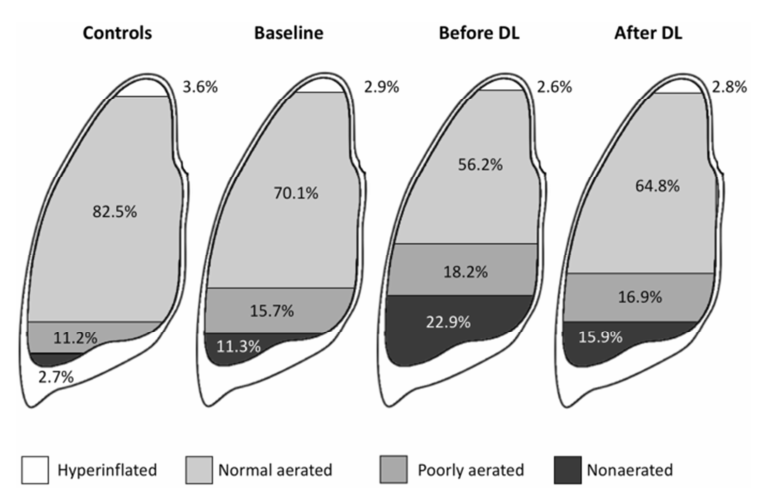
Trong một nghiên cứu khác bao gồm 16 bệnh nhân trải qua phẫu thuật mở bụng giải áp, các thể tích phổi khác nhau đã được tính toán bằng chụp cắt lớp vi tính tại thời điểm ban đầu, trước và sau khi phẫu thuật mở bụng giải áp [21]. IAP tăng từ 12 mmHg lúc ban đầu lên 25 mmHg trước khi phẫu thuật mở bụng. Tổng thể tích phổi giảm từ 3,2 xuống 2,4 L, và tỷ lệ phổi xẹp phổi và kém thông khí tăng lên. Sau khi phẫu thuật mở bụng, những thay đổi ở phổi này bị đảo ngược một phần (Hình 2). Ở những bệnh nhân này, phẫu thuật mở bụng làm giảm IAP từ 25 đến 15 mmHg và cải thiện thể tích phổi từ 2,4 đến 2,9 L [21]. Không chỉ cơ hoành bị dịch chuyển lên phía đầu mà phổi cũng mở rộng đường kính ngang để bù trừ [21].
Thông điệp chính 2: Ảnh hưởng của IAH đến thể tích phổi
Sự hiện diện của IAH có liên quan đến việc giảm thể tích phổi, trong khi phẫu thuật mở bụng giải áp dẫn đến cải thiện thể tích phổi.
Ảnh hưởng của tăng áp lực trong ổ bụng trên cơ học hô hấp
Sinh lý bệnh
Bằng cách sử dụng catheter thực quản, độ giãn nở toàn bộ hệ thống hô hấp (CRS) có thể được phân tách ra độ giãn nở thành ngực (CCW) và độ giãn nở của phổi (CL) (xem bên dưới). Bảng 1 tóm tắt các yếu tố có thể ảnh hưởng đến CCW và có thể được chia thành ảnh hưởng trực tiếp và ảnh hưởng gián tiếp đến thành ngực qua IAH.
Dữ liệu động vật
Ở lợn có IAH và phổi khỏe mạnh, khả năng độ giãn nở hô hấp giảm chủ yếu do giảm CCW [15, 19, 22]. Với việc tăng IAP, cả độ giãn nở CRS và CCW đều giảm đáng kể [19, 22]. Sự giảm này rõ ràng hơn đối với thành ngực và cho thấy mối tương quan nghịch với IAP [22]. Các nghiên cứu trước đây trên động vật và con người tập trung vào tầm quan trọng của IAH cho thấy độ giãn nở của thành bụng và sau đó là thành ngực được cải thiện sau khi giải áp ổ bụng [16, 17].
Dữ liệu con người
Ở người, IAH cũng làm giảm độ giãn nở của hệ thống hô hấp chủ yếu thông qua việc giảm độ giãn nở của thành ngực. Ranieri và cộng sự [16] đánh giá cơ học hô hấp ở 18 bệnh nhân có hội chứng suy hô hấp cấp (ARDS). Một nửa số bệnh nhân này yêu cầu phẫu thuật lớn ở bụng. Trước khi phẫu thuật, những bệnh nhân này có CRS và CCW nhỏ hơn so với những bệnh nhân không cần phẫu thuật ổ bụng và cơ học hô hấp của họ được cải thiện một phần sau khi phẫu thuật mở ổ bụng giải áp.
Gattinoni và cộng sự [23] đánh giá cơ học hô hấp tương đồng nhau ở 9 bệnh nhân ARDS ngoài phổi và 12 bệnh nhân ARDS phổi. Bệnh nhân ARDS ngoài phổi có mức IAP cao hơn và CCW nhỏ hơn.
Mặc dù IAH là nguyên nhân thường xuyên làm giảm độ giãn nở của thành ngực, nó vẫn bị các bác sĩ hồi sức bỏ qua [5].
Thông điệp chính 3: Ảnh hưởng của IAH đến cơ học hô hấp
Tác động của IAH lên chức năng hô hấp có thể được đặc trưng bởi sự giảm độ giãn nở của thành ngực.
Áp lực đường thở và sự truyền tải từ ổ bụng – lồng ngực
Sinh lý bệnh
IAH có thể làm tăng áp lực trong lồng ngực và do đó ảnh hưởng đến áp lực đường thở cũng như áp lực màng phổi và mạch máu trung tâm [7, 19, 21]. Trong bối cảnh này, truyền dẫn từ ổ bụng – lồng ngực (ATT, abdominal-thoracic transmission) mô tả phần trăm tăng áp lực lồng ngực cho mỗi lần gia tăng IAP [22].
Hình 2. Ảnh hưởng của tăng áp ổ bụng và phẫu thuật mở bụng giải áp (DL, decompressive laparotomy) trên tổng thể tích phổi được biểu thị theo tỷ lệ phần trăm của các thể tích phổi được tạo khí khác nhau.
Dữ liệu động vật
Ở lợn, áp lực đường thở đỉnh và cao nguyên tăng tỷ lệ thuận với việc tăng cao IAP [24, 25]. ATT làm tăng áp lực cao nguyên từ 40 đến 50% [22, 26, 27]. ATT làm tăng áp lực đỉnh của đường thở từ 38 đến 62% [18, 22]. Tương tự, áp lực thực quản là đối tượng của ATT. Tăng áp lực màng phổi thì hít vào chủ yếu do IAH với mức tăng được báo cáo là từ 35 đến 63% [19, 22]. Trong một nghiên cứu trên lợn (n = 11), IAH lên đến 30 mmHg dẫn đến ATT từ 17 đến 62% khi xem xét áp lực thực quản cuối hít vào và cuối thở ra tương ứng [22].
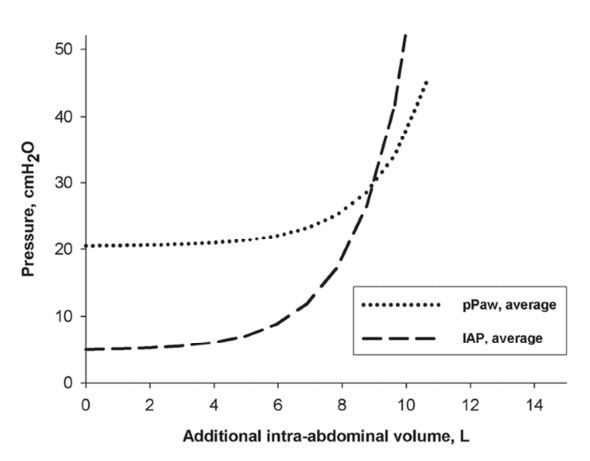
Hình 3. Đường cong hàm mũ áp lực – thể tích của áp lực trong ổ bụng (IAP) (đường cong đứt nét) và áp lực đỉnh của đường thở (pPAW) (đường cong chấm) tính bằng cm nước tùy theo làm tăng thêm thể tích trong ổ bụng tính bằng lít (nguồn từ 7 con lợn).
Tăng thể tích trong ổ bụng làm tăng IAP theo cấp số nhân [5, 6, 26, 28]. Trong mô hình IAH trên heo, việc tăng thể tích trong ổ bụng cũng được chứng minh là làm tăng áp lực đỉnh đường thở theo cấp số nhân (Hình 3) [26]. Mối quan hệ theo cấp số nhân áp lực-thể tích này được biết đến nhiều từ học thuyết Monroe-Kellie được sử dụng ở những bệnh nhân tăng áp lực nội sọ. Tương tự, ở những bệnh nhân có IAH đã có thêm một lượng lớn thể tích trong ổ bụng, những thay đổi nhỏ của thể tích trong ổ bụng có thể ảnh hưởng đáng kể đến IAP và áp lực đường thở [5, 6].
Dữ liệu con người
Một nghiên cứu quan sát hồi cứu trên 123 bệnh nhân thở máy cho thấy những bệnh nhân đạt được cân bằng dịch âm trong tuần đầu tiên ở ICU có EVLW, IAP và protein phản ứng C thấp hơn so với tỷ lệ albumin cũng như tỷ lệ sống sót sau 28 ngày cao hơn [38]. Mối tương quan giữa IAP, cân bằng dịch và EVLW cho thấy mối liên hệ giữa nhiễm trùng huyết, rò rỉ mao mạch, quá tải dịch, IAH và phù phổi. Điều này có thể giải thích tại sao loại bỏ dịch tích cực hoặc cái gọi là hồi sức với điều trị PAL (PEEP tính bằng cmH2O đặt ở mức IAP tính bằng mmHg, tiếp theo là albumin hyperoncotic 20% và Lasix®) có thể làm giảm cân bằng tích lũy dịch, IAP, EVLW và tỷ lệ tử vong 28 ngày trong một nghiên cứu bệnh chứng phù hợp hồi cứu trên 57 bệnh nhân suy hô hấp cấp [39, 40]. Các bệnh lý và phương pháp điều trị khác nhau có thể ảnh hưởng rõ rệt đến sinh lý bệnh của hệ bạch huyết với những tác động đáng kể đến chức năng của cơ quan nội tạng.
Thông điệp chính 5: Ảnh hưởng của IAH đối với hệ bạch huyết
Sự hiện diện của IAH ảnh hưởng đến sự dẫn lưu bạch huyết giữa lồng ngực và khoang bụng và có thể đóng một vai trò quan trọng trong sự phát triển của sự hình thành phù nề.
Oxygen hóa và thông khí
Sinh lý bệnh
Nói chung, IAH dẫn đến giảm oxygen hóa và gia tăng CO2 máu do tăng thông khí khoảng chết, shunt và sự không phù hợp về thông khí và tưới máu.
Dữ liệu động vật
Ở lợn, người ta đã chứng minh rằng IAH có liên quan đến sự phân phối lại lưu lượng máu từ phổi xẹp phụ thuộc đến các vùng phổi được thông khí tốt hơn không phụ thuộc, do đó cải thiện sự phù hợp thông khí/tưới máu [41]. Điều này giúp giải thích tại sao IAH trong điều kiện phổi không bị tổn thương chỉ ảnh hưởng tối thiểu đến quá trình oxygen hóa ở động vật [18, 19, 22] và người [42].
Dữ liệu con người
Kết quả từ một phân tích tổng hợp lớn trên 1664 bệnh nhân bị bệnh nặng cho thấy rằng IAH có tương quan với điểm số phụ suy cơ quan hô hấp tuần tự (respiratory sequential organ failure subscore) [9].
Thông điệp chính 6: Ảnh hưởng của IAH đến quá trình oxygen hóa
Sự hiện diện của IAH có thể dẫn đến giảm oxygen hóa.
Tăng áp lực trong ổ bụng và chấn thương phổi
Sinh lý bệnh
Người ta giả thuyết rằng IAH có thể dẫn đến việc đóng và mở các đơn vị phổi và ứng suất cắt (shear stress) này có thể dẫn đến tổn thương phổi do máy thở.
Dữ liệu động vật
Các nghiên cứu trên động vật đã chỉ ra rằng tăng IAP trong khi thở máy có thể dẫn đến giải phóng cytokine và tổn thương phổi sau đó. RezendeNeto và cộng sự [43] cho thấy trong một nghiên cứu trên 50 con chuột rằng 60–90 phút IAH (IAP 20 mmHg bằng không khí trong phúc mạc không được làm sạch) dẫn đến tăng nồng độ IL-6 trong huyết tương, tăng hoạt động của bạch cầu đa nhân trung tính trong phổi theo đánh giá của xét nghiệm myeloperoxidase và thâm nhiễm viêm phổi dữ dội bao gồm xẹp phổi và phù phế nang trên mô học phổi. Mức PEEP được áp dụng không được đề cập. Schachtrupp và cộng sự [44] cho thấy trong một nghiên cứu trên 12 con lợn rằng IAH trong 24 giờ (IAP là 30 mmHg) cũng dẫn đến các phát hiện mô học tương tự như các phát hiện về tổn thương phổi (bạch cầu và fibrin ở mô kẽ và phế nang) nhưng cũng gây hoại tử ống gần và cạnh trung tâm ở thận và gan tương ứng. Mức PEEP là 2 cmH2O đã được áp dụng. Trong mô hình ARDS ở chuột, IAH (15 mmHg) có liên quan đến tăng viêm và tạo sợi [45]. Lima và cộng sự [46] đã phát hiện ra trong một nghiên cứu trên 20 con chuột rằng việc tiếp xúc với IAP 15 mmHg trong 3 giờ là đủ để gây xẹp phế nang, xuất huyết, phù nề mô kẽ, và bạch cầu trung tính xâm nhập vào phổi và tăng quá trình chết tế bào phổi mặc dù đã áp dụng phương pháp thông khí bảo vệ phổi.
Dữ liệu con người
Không có dữ liệu về con người liệu IAH có phải là tác nhân gây tổn thương phổi do máy thở hay không. Có khả năng là áp lực xuyên phổi thấp trong bối cảnh của IAH có thể thúc đẩy ứng suất cắt với sự gia tăng sự đóng mở lặp đi lặp lại của các đơn vị phế nang, ngay cả khi sử dụng thể tích khí lưu thông bảo vệ [47].
Thông điệp chính 7: Ảnh hưởng của IAH đến VILI
Sự hiện diện của IAH có thể thêm vào sự phát triển của VILI.
Tóm tắt tác dụng của iah đối với chức năng hô hấp
Tóm lại, tác động của IAH lên chức năng hô hấp có thể được đặc trưng bởi sự giảm thể tích phổi và độ giãn nở của thành ngực và tăng áp lực đường thở. Việc truyền áp lực từ ổ bụng đến khoang ngực được ước tính từ 20 đến 60%, nhưng cần có thêm dữ liệu về con người. IAH làm giảm dẫn lưu bạch huyết ổ bụng. Sự hiện diện của IAH có thể làm giảm khả năng thông khí và oxygen hóa. Mặc dù IAH có liên quan đến tổn thương phổi, cơ chế chính xác vẫn chưa được hiểu đầy đủ.
Hiệu quả hô hấp của iah trong điều kiện nộ khoa cụ thể
Béo phì
Các nghiên cứu đã chỉ ra rằng bệnh nhân béo phì có chỉ số khối cơ thể cao hơn 35–40 kg/m2 có giá trị IAP cao hơn so với bệnh nhân không béo phì [25, 48]. Tương tự, đối với bệnh nhân IAH, giá trị IAP tăng lên ở bệnh nhân béo phì sẽ dẫn đến suy giảm cơ học hô hấp và trao đổi khí, và giảm thể tích phổi đặc biệt khi dùng thuốc an thần, liệt cơ và thở máy [49]. Kết quả là, tải trọng cơ học tác động lên cơ hoành được tăng lên, đặc biệt là ở tư thế nằm ngửa cả khi thở tự phát và gây mê toàn thân [8].
Trong khi CCW ở điều kiện bình thường chỉ chiếm 15% CRS, con số này có thể tăng lên đến 50% ở bệnh nhân béo phì hoặc IAH với IAP trên 20 mmHg (do sự cứng của thành ngực) [23, 50-52]. Với việc tăng IAP, cả CRS và CCW đều giảm đáng kể [19, 22]. Sự giảm này rõ ràng hơn đối với thành ngực và cho thấy mối tương quan nghịch với IAP [22]. Ở lợn bị tổn thương phổi, IAH được phát hiện làm giảm CRS bằng cách giảm không chỉ CCW mà cả CL [15, 19]. Việc gây mê cho bệnh nhân béo phì đối với các thủ thuật phẫu thuật không có bệnh lý đòi hỏi kiến thức về các bệnh đi kèm điển hình và các lựa chọn điều trị tương ứng của họ [49, 53]. Phương pháp tiếp cận giảm đau đa phương thức có thể hữu ích để giảm biến chứng phổi sau phẫu thuật [54].
Hội chứng nguy kịch hô hấp cấp tính
ARDS là một hội chứng chứ không phải bệnh. Do đó, không phải tất cả các bệnh nhân ARDS đều giống nhau, điều này có thể giải thích cho một số kết quả mâu thuẫn trong các nghiên cứu ARDS trước đây.
Ảnh hưởng của IAH trên hệ hô hấp dường như bị ảnh hưởng mạnh bởi sự hiện diện của tổn thương phổi. Ở lợn bị tổn thương phổi, IAH được phát hiện làm giảm CRS bằng cách giảm không chỉ CCW mà cả CL [15, 55]. Hơn nữa, chỉ trong phổi bị thương, IAH có ảnh hưởng sâu sắc đến quá trình oxygen hóa [15, 55]. Sự giảm CL và oxygen hóa trong bối cảnh IAH và phổi bị tổn thương là đáng kể và có thể giúp hiểu một số khác biệt được tìm thấy khi áp dụng các chiến lược thông khí ở bệnh nhân IAH. Điều này cũng có liên quan trong việc tìm hiểu các tác động sinh lý bệnh của nằm sấp ở bệnh nhân ARDS thứ phát do IAH [56].
Ranieri và cộng sự [16] nhận thấy rằng bệnh nhân ARDS có cơ học hô hấp khác nhau tùy thuộc vào căn nguyên cơ bản và sự hiện diện của IAH. Ông nhận thấy rằng những bệnh nhân phẫu thuật có thành ngực cứng hơn so với những bệnh nhân nội khoa, có thể là do sự hiện diện ngày càng nhiều của chướng bụng. Hệ thống hô hấp và độ giãn nở của thành ngực được cải thiện sau khi phẫu thuật mở ổ bụng giải áp ở những bệnh nhân này. Thật không may, ảnh hưởng của áp lực dương cuối thở ra (PEEP), dung tích cặn gắng sức và IAP không được đo lường. Mergoni và cộng sự [57] đã nghiên cứu cơ học hô hấp phân vùng và chỉ ra rằng trong một phân nhóm bệnh nhân ARDS trong đó điểm uốn dưới chủ yếu được xác định bởi CCW rằng PEEP không hiệu quả trong việc cải thiện oxygen hóa (CCW xác định ARDS). Tuy nhiên, PEEP có hiệu quả ở những bệnh nhân ARDS trong đó điểm uốn dưới được xác định bởi CL (CL xác định ARDS),
Ngược lại với điều này, Gattinoni et al. [23] cho thấy ARDS nguyên phát dẫn đến CL giảm nhưng CCW bình thường (CL xác định ARDS) trong khi ARDS thứ phát có CL bảo tồn nhưng giảm CCW (CCW xác định ARDS), và PEEP chỉ cho phép huy động các đơn vị phổi ở ARDS thứ phát chứ không phải ở ARDS nguyên phát. Trong nghiên cứu này, bệnh nhân ARDS thứ phát có IAH trái ngược với bệnh nhân ARDS nguyên phát [23]. Kết quả cho thấy việc áp dụng PEEP trong ARDS tại phổi không có IAH có thể gây căng quá mức các đơn vị phổi đã mở, khiến những bệnh nhân này dễ bị tổn thương phổi do thở máy hơn những bệnh nhân ARDS thứ phát và IAH. Sự khác biệt được tìm thấy giữa hai nghiên cứu này một phần có thể được giải thích bởi sự khác biệt trong các thao tác và kỹ thuật đo lường cũng như các giả định được sử dụng [23, 57].
Hiện tượng tương tự cũng có thể là nguyên nhân dẫn đến sự thay đổi cơ học hô hấp ở bệnh nhân béo phì [52]. Do đó, đo IAP có thể là một phương pháp thực hiện dễ dàng tại giường để ước tính cơ học thành ngực bị thay đổi và ngăn chặn nhu cầu đo áp lực thực quản (xem bên dưới). IAP cũng ảnh hưởng đến hình dạng của đường cong áp lực – thể tích (với sự dẹt xuống và dịch chuyển sang phải) của tổng hệ hô hấp và thành ngực trong khi cơ học phổi vẫn không bị ảnh hưởng [15].
Tóm lại, sự hiện diện của tổn thương phổi có ảnh hưởng mạnh mẽ đến cách IAH ảnh hưởng đến cơ học hô hấp và oxygen hóa. Lý tưởng nhất, IAP được đo ở những bệnh nhân ARDS được đăng ký vào các thử nghiệm lâm sàng để giải thích bất kỳ ảnh hưởng nào của IAH tiềm ẩn cùng tồn tại.
Hội chứng đa ngăn (polycompartment syndrome)
Khoang bụng có những tác dụng độc đáo vì nó nằm ở vị trí giải phẫu “thượng lưu” từ các chi và “hạ lưu” từ ngực và sọ [7]. Do đó, IAH có thể ảnh hưởng đến sinh lý và sinh lý bệnh của từng ngăn khác này. Bởi vì ổ bụng đóng một vai trò quan trọng trong sự tương tác giữa các ngăn khác nhau, IAP ảnh hưởng đến áp lực tĩnh mạch cửa và gan, do đó tạo điều kiện cho máu chảy ra khỏi phổi, đôi khi được gọi là hội chứng gan-bụngphổi [7]. Tương tự, IAP đã được xác định là không có liên kết kích hoạt suy thận (do tăng áp lực tĩnh mạch thận) ở những bệnh nhân bị bệnh tim sung huyết mãn tính, được gọi là hội chứng tim-bụng-thận [58]. Tương tự như vậy, suy giảm chức năng thận ở bệnh nhân xơ gan được gọi là hội chứng gan-bụng-thận.
Ý nghĩa thực hành tại giường và xử trí hô hấp trong tăng áp lực trong ổ bụng
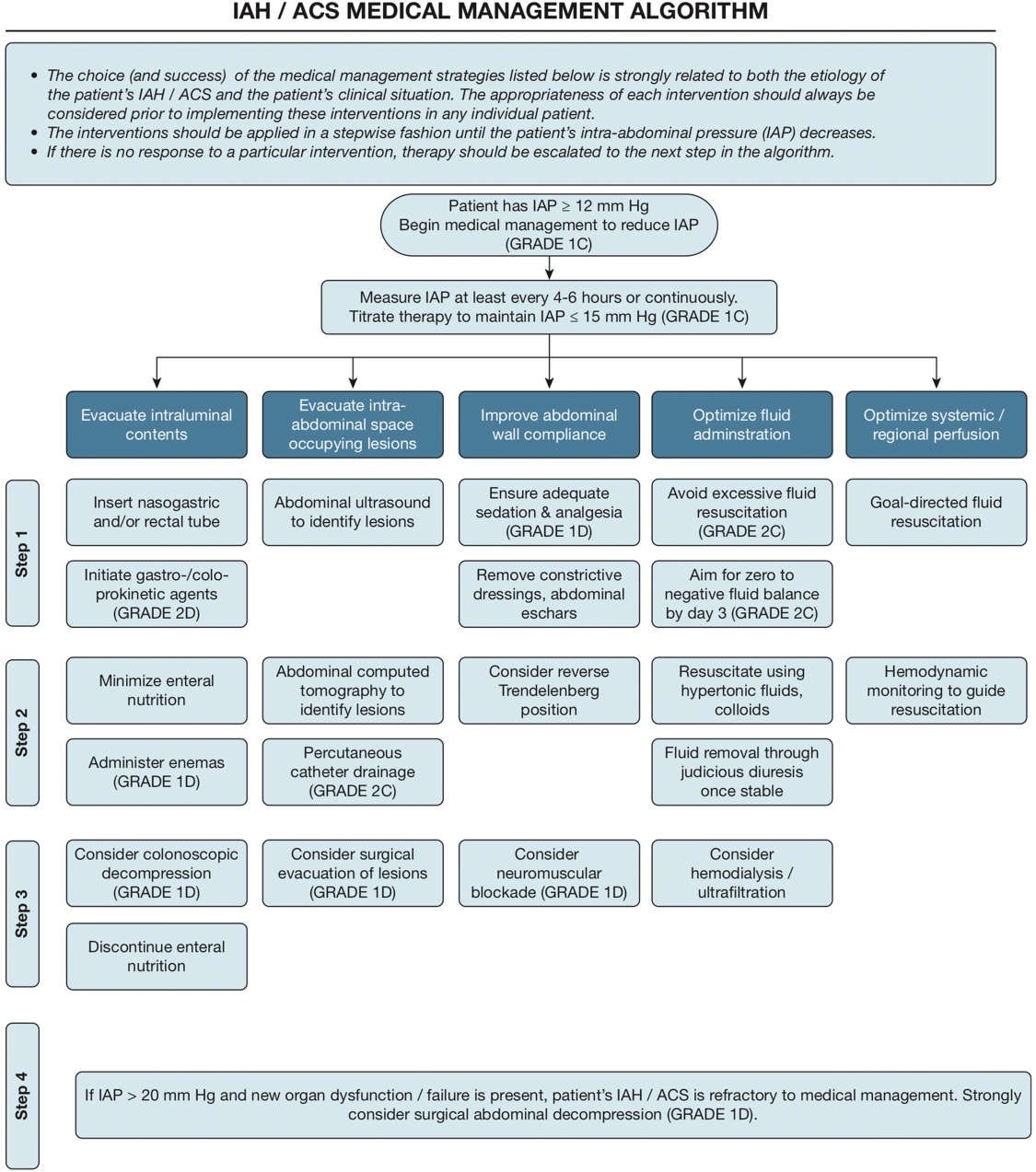
Bảng 3 liệt kê các chiến lược thông khí được đề xuất cho bệnh nhân IAH và ARDS.
Đo áp lực trong ổ bụng
Cách dễ nhất để đánh giá IAP trong thực hành lâm sàng là đo áp lực bàng quang [1, 59, 60]. Tiêu chuẩn tham chiếu cho phép đo IAP ngắt quãng là qua bàng quang với thể tích nhỏ giọt tối đa là 25 mL nước muối vô trùng và IAP phải được đo khi thở ra ở tư thế nằm ngửa sau khi đảm bảo rằng không có các cơn co thắt cơ bụng và với đầu dò (transducer) được chuẩn hóa mức zero ở mức của đường nách giữa.
Bảng 3 Các chiến lược thông khí được đề xuất tùy thuộc vào sự hiện diện của ARDS và IAH
|
Thông số |
Bình thường |
ARDS |
IAH |
IAH và suy hô hấp |
|
|
Thể tích khí lưu thông |
6 đến 8 mL/kg PBW có thể có lợi |
Khuyến nghị 4–8 mL/kg PBW (Grade 1B) [123, 124] |
6 đến 8 mL/kg PBW có thể có lợi |
4–8 mL/kg PBW có thể có lợi |
|
|
Áp lực cao nguyên hít vào |
Khuyến nghị 2O để giảm nguy cơ căng quá mức phế nang (Grade 1B) [123] |
Áp lực đường thở cao hơn có thể chấp nhận được và có thể tăng do giảm độ giãn nở của thành ngực. Áp lực cao nguyên mục tiêu đã hiệu chỉnh = áp lực cao nguyên mục tiêu – 7 + IAP (mmHg) * 0,7 |
Áp lực đường thở cao hơn có thể chấp nhận được và có thể tăng do giảm độ giãn nở của thành ngực. Áp lực cao nguyên mục tiêu đã hiệu chỉnh = áp lực cao nguyên mục tiêu – 7 + (mmHg) * 0,7 |
||
|
Áp lực đẩy |
2O |
2O (Grade 2B) [84] |
2O |
2O |
|
|
Áp lực xuyên phổi cao nguyên hít vào |
2O là hợp lý |
2O là hợp lý [29] |
2O là hợp lý |
2O có thể là mục tiêu hợp lý |
|
|
PEEP |
5 cmH2O |
Mức PEEP cao hơn trong ARDS từ trung bình đến nặng giúp cải thiện tỷ lệ sống sót (Grade 2B) [123]. Chúng tôi đề nghị 5–10 cmH2O trong ARDS nhẹ đến trung bình và 10–15 trong ARDS trung bình đến nặng |
Mức PEEP cao hơn có thể làm giảm xẹp phổi và atelectrauma. Chúng tôi đề nghị không vượt quá 15 cmH2O |
Mức PEEP cao hơn bình thường có thể được yêu cầu để cải thiện quá trình oxygen hóa và cơ học hô hấp. Chúng tôi đề nghị không vượt quá 15 cmH2O |
|
|
Chuẩn độ PEEP |
Chúng tôi khuyên bạn nên tránh áp lực đẩy quá mức |
Độ giãn nở hô hấp tối ưu, tức là áp lực đẩy thấp nhất trong khi VT bảo vệ hằng định. Áp lực thực quản hướng dẫn là một thay thế hợp lý |
Độ giãn nở hô hấp tối ưu, tức là áp lực đẩy thấp nhất trong khi VT bảo vệ hằng định. Chúng tôi đề xuất PEEP tính bằng cmH2O = IAP tính bằng mmHg |
Độ giãn nở hô hấp tối ưu, tức là áp lực đẩy thấp nhất trong khi VT bảo vệ hằng định. Áp lực thực quản hướng dẫn là một thay thế hợp lý |
|
|
Thủ thuật huy động (RM) |
RM không khuyến khích thường xuyên |
RM cải thiện oxygen hóa, nhưng kết quả có thể tồi tệ hơn với RM. Phương pháp RM tốt nhất chưa được biết [65, 123] |
RM không được khuyến khích thường xuyên |
Áp lực đường thở cao hơn có thể được yêu cầu để RM có hiệu quả |
|
|
Nằm sấp |
Không được khuyến khích |
Được khuyến nghị vì nó cải thiện oxygen hóa và tỷ lệ sống sót ở bệnh nhân ARDS (Grade 1B) [108, 123] |
Không được khuyến khích |
Có thể giảm IAP và cải thiện oxygen hóa. Điều quan trọng để đảm bảo bụng treo tự do và không tăng IAP [29] |
|
|
NMBA |
Không được khuyến khích |
NMBA ngắn hạn có thể có lợi [125] |
Có thể giảm IAP [121] |
Có thể làm giảm IAP và/hoặc cải thiện quá trình oxygen hóa |
|
|
Điều trị bổ trợ |
|
Oxit nitric |
Cân bằng dịch âm |
Cân bằng dịch âm |
|
|
ECCO2R |
Thoát nước cổ trướng |
Thoát nước cổ trướng |
|||
|
ECMO |
Laparostoma [26, 121] |
Laparostoma |
|||
|
|
|
Oxit nitric, ECCO2R, ECMO |
|||
Mặc dù các cơn co thắt vùng bụng có thể làm tăng sai giá trị IAP, chúng tôi không khuyên bạn nên tăng cường an thần hoặc sử dụng các thuốc ngăn chặn thần kinh cơ để cải thiện độ chính xác của các phép đo IAP. Theo kinh nghiệm lâm sàng của chúng tôi, IAP có thể được đo chính xác ở những bệnh nhân được hỗ trợ thở khi thở máy hoặc không có bất kỳ hỗ trợ hô hấp nào. Tuy nhiên, điều quan trọng là phải kéo dài đủ thời gian quan sát để nắm bắt được áp lực cuối kỳ thở ra thấp nhất khi không có các cơn co thắt bụng trên lâm sàng (có thể nhìn thấy và sờ thấy).
Đo áp lực thực quản
Từ việc chia thể tích khí lưu thông cho chênh lệch giữa áp lực cao nguyên và áp lực dương cuối thở ra (áp lực đẩy), có thể tính được CRS. Bằng cách sử dụng một ống thông thực quản (thay thế cho áp lực trong lồng ngực), CCW và CL cũng có thể được ước tính. Ngoài ra, áp lực xuyên phổi là sự chênh lệch giữa áp lực đường thở và màng phổi và được cho là yếu tố quyết định chính gây ra tổn thương phổi do máy thở [29, 30].
Tuy nhiên, việc đo áp lực thực quản không dễ dàng do một số vấn đề thực tế tại giường bệnh [8, 61]. Nó yêu cầu một quả bóng nhỏ chứa đầy không khí có thể truyền áp lực thực quản qua ống thông đến một đầu dò áp lực. Các ống thông thực quản mới hơn được tích hợp vào một ống thông mũi dạ dày. Đầu tiên ống thông được đặt vào dạ dày, sau đó rút trở lại thực quản và yêu cầu kiểm tra tắc để xác nhận vị trí chính xác. Ngoài ra, các ống thông dễ bị đánh giá dưới mức và quá mức áp lực thực quản nếu lượng không khí được đưa vào quá ít hoặc quá nhiều. Ở một số bệnh nhân không thể đặt đúng vị trí.
Thủ thuật huy động
Một thủ thuật huy động (RM, recruitment manoeuvre) sử dụng sự gia tăng áp lực xuyên phổi động và thoáng qua để mở các vùng phổi không được thông khí hoặc kém thông khí [62]. Lợi ích của việc cải thiện oxygen hóa có thể được bù đắp bằng tổn thương tế bào biểu mô và nội mạc tiềm ẩn và tăng tính thấm của mao mạch phế nang [63, 64]. Hơn nữa, trong một thử nghiệm đối chứng ngẫu nhiên lớn gần đây, bệnh nhân ARDS nhận RM và PEEP đã điều chỉnh mức độ độ giãn nở hệ thống hô hấp tốt nhất của họ (áp lực đẩy thấp nhất trong khi thể tích khí lưu thông bảo vệ không đổi) trái ngược với không có RM và PEEP thấp có tỷ lệ sống sót giảm [65].
Thông thường, một thao tác RM nhanh được thực hiện bằng cách tạo áp lực hít vào 40 cmH2O trong 40 giây (huy động 40 x 40) [66, 67].
Tuy nhiên, trong những năm gần đây, theo kết quả của một số nghiên cứu thử nghiệm [67-70] và thử nghiệm lâm sàng [66, 71] RM chậm được ưa chuộng hơn RM nhanh vì điều này có liên quan đến việc cải thiện oxygen hóa, ít viêm hơn và cải thiện huyết động không ổn định.
Về nguyên tắc, RM chậm được thực hiện bằng cách tăng dần và sau đó giảm dần PEEP và/hoặc thể tích khí lưu thông cho đến khi đạt được áp lực cao nguyên từ 40 đến 50 cmH2O trong khi vẫn duy trì thông khí khí lưu thông [66, 72].
Người ta ước tính rằng một áp lực mở xuyên phổi bằng 30 cmH2O là cần thiết để mở xẹp phổi. Trong bối cảnh của IAH với tỷ lệ CL/CRS thay đổi từ 0,85 đến 0,5, áp lực xuyên phổi kết quả trong quá trình huy động 40 x 40 có thể chỉ là 20 cmH2O, do đó các đơn vị phế nang có hằng số thời gian dài sẽ vẫn bị xẹp [61]. Do đó, trong bối cảnh của IAH, có thể yêu cầu áp lực mở cao hơn [29]. Sự hợp lý để thêm IAP trong cmH2O/2 là do ATT vào khoảng 50% [18, 19, 22, 24, 27, 55]. Tuy nhiên, việc áp dụng áp lực mở thì hít vào cao hơn trong RM có nhiều khả năng gây ra tổn hại huyết động hơn. Do đó, RM chỉ nên được áp dụng ở những bệnh nhân ổn định về huyết động (ví dụ không phụ thuộc vào tiền tải) và huyết áp của họ cần được theo dõi chặt chẽ nếu RM được áp dụng.
Tóm lại, không có nghiên cứu nào được thực hiện ở bệnh nhân IAH đánh giá các phương pháp RM khác nhau. Do đó, chúng tôi đề nghị sử dụng các thao tác RM một cách thận trọng ở những bệnh nhân mắc bệnh IAH.
Cài đặt máy thở trong quá trình thông khí bảo vệ phổi ở bệnh nhân iah
Thông thường khuyến cáo cung cấp thông khí bảo vệ phổi ở bệnh nhân IAH và ARDS [29]. Ngay cả ở những bệnh nhân có phổi không bị tổn thương, thông khí bảo vệ phổi đang được áp dụng thường xuyên hơn vì điều này có liên quan đến ít viêm hơn và ít biến chứng phổi hơn [73].
Thể tích khí lưu thông
Không có nghiên cứu đánh giá thể tích khí lưu thông tối ưu ở bệnh nhân IAH. Trong mô hình chuột ARDS và IAH (15 mmHg), Santos và cộng sự [45] nhận thấy rằng 10 mL/kg so với 6 mL/kg có liên quan đến việc giảm viêm trong phân nhóm ARDS ngoài phổi và tăng viêm trong phân nhóm ARDS tại phổi. Tuy nhiên, có nhiều nghiên cứu chứng minh thể tích khí lưu thông cao ở bệnh nhân ARDS làm xấu đi kết quả [74].
Việc sử dụng thể tích khí lưu thông thấp hơn trước khi phẫu thuật (6–8 mL/kg trọng lượng cơ thể dự đoán) cộng với việc áp dụng PEEP trái ngược với việc sử dụng thể tích khí lưu thông cao hơn (10–12 mL/kg trọng lượng cơ thể dự đoán) và không liên quan đến PEEP với giảm các biến chứng hô hấp ở bệnh nhân trải qua cuộc phẫu thuật lớn ở bụng [73]. Tuy nhiên, các nghiên cứu khác và phân tích tổng hợp cho thấy rằng, ngay cả trong các điều kiện lâm sàng được đặc trưng bởi IAH cao hơn, việc giảm thể tích khí lưu thông và PEEP không cao hơn có liên quan đến cải thiện kết quả sau mổ [75, 76].
Trong trường hợp không có bất kỳ bằng chứng nào liên quan đến thể tích khí lưu thông tối ưu ở bệnh nhân IAH, không phải là không hợp lý khi áp dụng thông khí bảo vệ phổi với thể tích khí lưu thông thấp 6–8 mL/kg trọng lượng cơ thể dự đoán cũng ở tất cả bệnh nhân IAH và đặc biệt ở bệnh nhân với IAH và tổn thương phổi.
Áp lực đường thở
Thông khí bảo vệ phổi có nghĩa là mở phổi bằng RM (áp lực phế nang cao thích hợp) và giữ cho phổi mở (với thiết lập PEEP thích hợp) [77]. Cơ học phổi bị thay đổi trong bối cảnh của IAH có thể đòi hỏi áp lực cao hơn bình thường để mở đường thở và giữ cho đường thở mở vượt quá những quy định trong hướng dẫn hiện hành [55]. Thông khí bảo vệ phổi được khuyến nghị sử dụng mục tiêu giới hạn trên cho áp lực cao nguyên là 30 cmH2O ở bệnh nhân ARDS nặng [78]. Các đề xuất này không tính đến IAP. Cơ sở lý luận của việc hạn chế áp lực cao nguyên là để tránh tăng áp lực xuyên phổi, quá căng phế nang và cuối cùng là tổn thương phổi do máy thở [79].
Lý tưởng nhất, để tránh phế nang căng quá mức, người ta đo áp lực thực quản ở những bệnh nhân bị bệnh nặng và đặt mục tiêu áp lực xuyên phổi 2O tương ứng [29, 61, 79, 80]. Tuy nhiên, việc đo áp lực thực quản không dễ thực hiện và nhiều thách thức [61, 81].
Như đã nêu ở trên, IAH có liên quan đến việc tăng áp lực đường thở. ATT khoảng 50% ảnh hưởng đến áp lực thực quản và đường thở tương tự nhau [19, 22, 31]. Điều này có nghĩa là trong bối cảnh của IAH, khi áp dụng mức PEEP thích hợp và thể tích khí lưu thông bảo vệ phổi là 6 mL/kg PBW, áp lực cao nguyên có thể vượt quá 30 cmH2O khuyến nghị mà không ảnh hưởng đến áp lực xuyên phổi.
Do đó, khi có IAH áp lực đường thở có thể được điều chỉnh bằng cách sử dụng ATT. Ở những đối tượng bị bệnh nặng, IAP trung bình là 10 mmHg = 13,6 cmH2O [4, 9, 82] và chúng ta có thể giả thuyết rằng một nửa áp lực này được truyền đi bình thường khi có thành ngực bình thường. Do đó, mục tiêu áp lực cao nguyên đã hiệu chỉnh trong cmH2O có thể được tính như sau: mục tiêu áp lực cao nguyên tính bằng cmH2O + [(IAP tính bằng mmHg * 1,36) – 13,36 (IAP bình thường ở bệnh nhân nguy kịch)]/2 hoặc đơn giản hóa: mục tiêu áp lực cao nguyên – 7 + 0,7 * IAP tính bằng mmHg.
Ví dụ, đối với áp lực cao nguyên mục tiêu là 30 cmH2O và IAP là 20 mmHg, áp lực cao nguyên mục tiêu đã hiệu chỉnh sẽ là: 30 – 7 + 0,7 * 20 = 37 cmH2O. Trong trường hợp không có IAH, mục tiêu áp lực cao nguyên sẽ không yêu cầu bất kỳ hiệu chỉnh nào. Ví dụ, đối với áp lực cao nguyên mục tiêu là 30 và IAP 10 mmHg, mục tiêu áp lực cao nguyên hiệu chỉnh sẽ là 23 + 10 * 0,7 = 30 cmH2O.
Tóm lại, mặc dù áp lực đường thở cao hơn có thể chấp nhận được ở bệnh nhân ARDS với IAH, chúng tôi vẫn thiếu bất kỳ dữ liệu lâm sàng hỗ trợ nào để đưa ra bất kỳ khuyến nghị nào.
Áp lực đẩy
Trong những năm gần đây, áp lực đẩy (chênh lệch áp lực giữa áp lực đường thở cao nguyên và PEEP) như một biện pháp bảo vệ thông khí phổi đã được chú ý nhiều hơn.
Áp lực đẩy dường như hữu ích để tối ưu hóa thể tích khí lưu thông và tránh strain động quá mức. Sử dụng dữ liệu từ chín thử nghiệm ngẫu nhiên và tổng số 3562 bệnh nhân mắc ARDS, người ta đã chứng minh được rằng áp lực đẩy có ảnh hưởng lớn hơn đến tỷ lệ tử vong so với áp lực đường thở cao nguyên, thể tích khí lưu thông hoặc PEEP [83]. Một nghiên cứu quan sát quốc tế lớn trên 29.144 bệnh nhân thở máy cho thấy áp lực đẩy dưới 14 cmH2O liên quan đến cải thiện thời gian sống sót tại bệnh viện ở bệnh nhân ARDS [84]. Tuy nhiên, ở bệnh nhân ARDS béo phì, tăng áp lực đẩy không liên quan đến tăng tỷ lệ tử vong [85]. Không có nghiên cứu nào đánh giá cụ thể ảnh hưởng của các áp lực đẩy khác nhau đối với kết cục ở bệnh nhân IAH hoặc bệnh nhân béo phì với IAH. Tuy nhiên, không phải là không có lý khi áp dụng áp lực đẩy dưới 14 cmH2O ở bệnh nhân IAH.
Áp lực đẩy cũng có thể hữu ích trong việc điều chỉnh PEEP và đã được thử nghiệm với kết quả sinh lý đầy hứa hẹn ở bệnh nhân béo phì được gây mê toàn thân [86, 87] và ở bệnh nhân béo phì mắc ARDS [88, 89]. Một phân tích tổng hợp dữ liệu bệnh nhân riêng lẻ cho thấy bệnh nhân béo phì trải qua phẫu thuật nhận được mức PEEP cao hơn dẫn đến tăng áp lực đẩy có nhiều biến chứng phổi sau phẫu thuật hơn [90]. Hiện không có đủ dữ liệu cho thấy việc sử dụng áp lực đẩy để điều chỉnh PEEP có thể giúp cải thiện tỷ lệ sống sót của bệnh nhân mắc IAH hoặc béo phì có hoặc không kèm theo ARDS. Do đó, theo quan điểm của chúng tôi, áp lực đẩy nên được sử dụng để tránh PEEP quá mức và không để “tối ưu hóa” (tăng) PEEP.
PEEP
Cho đến nay, PEEP tốt nhất được sử dụng trong thiết lập của IAH vẫn chưa được biết [91]. Như đã nêu ở trên, trong môi trường IAH, phổi sẽ xẹp xuống ở áp lực đóng cao hơn trong thời gian thở ra. Vẫn còn lo sợ rằng trong bối cảnh của IAH, tăng atelectrauma (còn gọi là atelectotrauma) do tăng hình thành xẹp phổi và PEEP không đủ có thể góp phần vào tổn thương phổi khi có IAH [8, 47, 92]. Do đó, mức PEEP cao hơn có thể được yêu cầu để giữ cho phổi mở và giảm tổn thương phổi trong bối cảnh của IAH. Ngược lại với điều này, mức PEEP cao hơn có thể không chỉ có tác động tiêu cực về huyết động mà còn gây tổn thương phổi nếu phế nang căng quá mức [44, 92].
Các nghiên cứu trên động vật khác nhau đã kiểm tra các mức PEEP khác nhau trong môi trường IAH. Một nghiên cứu đầu tiên được thực hiện trên 13 con lợn có phổi khỏe mạnh và IAH được tạo ra bằng một quả bóng bơm hơi, mức PEEP (5, 8, 12 và 15 cmH2O) không phù hợp với mức IAP [18]. Các kết luận là mức PEEP thường được áp dụng, được đặt dưới mức IAP có thể không ngăn được sự suy giảm thể tích phổi cuối kỳ thở ra. Đáng chú ý là IAP đạt 18 mmHg hoặc do đó là 25 cmH2O, trong khi PEEP chỉ được thiết lập tối đa là 15 cmH2O. Trong nghiên cứu thứ hai, được thực hiện trên 9 con lợn có phổi khỏe mạnh, IAH một lần nữa được tạo ra bằng một quả bóng bơm hơi, mức PEEP bây giờ phù hợp với IAP [19]. Các tác giả nhận thấy việc duy trì thể tích phổi cuối kỳ thở ra, không cải thiện áp lực oxy động mạch nhưng làm giảm CO. Trong nghiên cứu thứ ba, được thực hiện trên 8 con lợn bị tổn thương phổi do rửa nước muối và IAH được tạo ra với sự bơm CO2 lên đến 20 mmHg, mức PEEP (27 cmH2O) phù hợp với IAP [93]. Những phát hiện chính trong quá trình áp dụng PEEP là điểm uốn thấp hơn, cải thiện độ giãn nở, giảm gradient động mạch phế nang và ít shunt hơn. Trong một nghiên cứu trên động vật thứ tư trên 9 con lợn, IAH gây ra bởi một quả bóng bơm hơi được kết hợp với tổn thương phổi do axit oleic gây ra, và mức PEEP phù hợp với IAP [55]. Các tác giả nhận thấy thể tích phổi cuối kỳ thở ra tốt hơn, phân suất shunt thấp hơn, khoảng chết thấp hơn và oxygen hóa tốt hơn.
Chỉ có một số nghiên cứu lâm sàng. Krebs và cộng sự [94] đã kiểm tra các mức PEEP khác nhau ở 20 bệnh nhân ARDS, 10 bệnh nhân bình thường (IAP 8 mmHg) và 10 bệnh nhân IAH cấp II (IAP 16 mmHg). Không có sự khác biệt nào được tìm thấy giữa các nhóm ở thời điểm ban đầu. Điều này có thể giải thích tại sao không tìm thấy sự khác biệt giữa các nhóm về ảnh hưởng của mức PEEP cao hơn đối với cơ học phổi hoặc oxygen hóa.
Trong một nghiên cứu khác, Krebs et al. [95] đã kiểm tra hai phương pháp chuẩn độ PEEP ở 13 bệnh nhân ARDS từ trung bình đến nặng. Họ phát hiện ra rằng ở những bệnh nhân có IAH, PEEP tốt nhất được thiết lập theo độ giãn nở tốt nhất của hệ hô hấp, không phải lúc nào cũng liên quan đến áp lực xuyên phổi cuối kỳ thở ra.
Gattinoni và cộng sự [23] áp dụng các mức PEEP khác nhau (5, 10, 15, và 20 cmH2O) ở bệnh nhân ARDS. Bệnh nhân ARDS ngoài phổi có IAH (IAP 16 mmHg) và PEEP cải thiện CRS do giảm CCW. Ngược lại, bệnh nhân ARDS tại phổi có IAP bình thường (4 mmHg) và PEEP làm CRS xấu đi do tăng CL.
Talmor và cộng sự [29, 96] nhận thấy rằng IAP (đo qua dạ dày) và áp lực thực quản (đo qua bóng thực quản) có tương quan chặt chẽ. Do đó, không chỉ áp lực mở mà cả áp lực đóng cũng tăng lên trong thời gian IAH và do đó, mức PEEP cao hơn có thể được yêu cầu để ngăn ngừa xẹp phổi cuối kỳ thở ra.
Trong một nghiên cứu thí điểm trên 15 bệnh nhân có IAH (IAP là 17 mmHg), các mức PEEP khác nhau được áp dụng phù hợp với mức IAP [97]. Ngược lại với PEEP = 50% IAP, PEEP = 100% IAP (cả hai thông số được đo bằng đơn vị bằng nhau) không được dung nạp tốt do hạ oxy máu, hạ huyết áp hoặc rò rỉ bóng chèn nội khí quản.
Rất khó để đưa ra kết luận nào từ những nghiên cứu thực nghiệm và lâm sàng này. Về nguyên tắc, việc áp dụng mức PEEP cao hơn trong bối cảnh của IAH là hợp lý. Hơn nữa, rất hấp dẫn khi áp dụng một công thức dễ sử dụng tại giường để thiết lập mức PEEP ở bệnh nhân IAH, ví dụ: PEEP (cmH2O) được đặt ở mức IAP (mmHg).
Có một lo ngại rằng việc tăng PEEP có thể làm tăng IAP. Nhiều nghiên cứu được công bố cho thấy PEEP chỉ có ảnh hưởng tối thiểu đến IAP (tăng PEEP từ thấp đến 0 đến cao 15 cmH2O và tăng IAP trung bình là 1 mmHg) [25]. Ngược lại với điều này, Verzilli et al. [98] đã kiểm tra hiệu quả của việc nâng PEEP từ 0 lên 12 cmH2O ở 30 bệnh nhân ARDS và thấy rằng IAP tăng chủ yếu ở những bệnh nhân mắc IAH (tức là IAP tăng từ 15 lên 20 cmH2O).
Tóm lại, trong khi PEEP có thể chống lại các tác động tiêu cực của IAH đối với thể tích phổi và độ giãn nở của thành ngực, không có bằng chứng cho thấy mức PEEP nhất định cải thiện kết quả ở bệnh nhân IAH. Trong trường hợp không có bằng chứng, chúng tôi khuyên bạn nên đặt PEEP theo độ giãn nở tốt nhất của hệ thống hô hấp [92].
Chế độ thông khí và hỗ trợ thở trong IAH
Thở hỗ trợ là kiểu thông khí phổ biến nhất ở bệnh nhân nặng [99] và ngay cả ở bệnh nhân ARDS [84]. Những lợi thế tiềm ẩn của việc thở hỗ trợ bao gồm ít cần an thần hơn và ít suy giảm huyết động, teo cơ tối thiểu, dẫn lưu bạch huyết tốt hơn và tưới máu cơ quan vùng [36, 100].
Người ta biết rất ít về chế độ thông khí tối ưu được áp dụng ở bệnh nhân IAH nhưng một số dữ liệu thực nghiệm vẫn tồn tại. Một số bằng chứng thực nghiệm về ARDS không có IAH cho thấy giảm tổn thương phổi khi thông khí hỗ trợ [101-104]. Kết quả gần đây từ một thí nghiệm trên động vật cho thấy rằng thông khí hỗ trợ có thể liên quan đến việc cải thiện oxygen hóa và ít tổn thương phổi và viêm ở ARDS từ nhẹ đến trung bình (ngoài phổi) khi có IAH (15 mmHg) [105]. Điều này có thể do giảm xẹp phổi và phân bố thông khí khu vực đồng đều hơn. Tuy nhiên, các bằng chứng thực nghiệm khác báo cáo rằng việc bổ sung hơi thở tự phát không được hỗ trợ vào BiPAP không cải thiện chức năng huyết động và hô hấp và gây ra tổn thương mô bệnh học nặng hơn cho phổi, khi có IAH nghiêm trọng [106]. Sự khác biệt trong các kết quả này có thể là do lượng gắng sức thở đạt được trong quá trình thở tự phát và/hoặc các phương thức thông khí khác nhau.
Kết luận, chúng tôi đề nghị sử dụng thận trọng thông khí hỗ trợ ở bệnh nhân, đặc biệt nếu có IAH nặng.
Nằm sấp và tư thế khác
Nằm sấp cải thiện cơ học hô hấp, oxygen hóa và giảm căng phế nang quá mức [107]. Thông khí nằm sấp đã được chứng minh là cải thiện kết cục ở bệnh nhân ARDS nặng [108]. Đặt bệnh nhân ARDS ở tư thế nằm sấp hoặc đứng thẳng không dẫn đến các tác dụng có lợi đồng bộ trên cơ học hô hấp và các thông số oxygen hóa [52].
Trong bối cảnh của IAH, dường như có một số lợi ích là ngưng và giảm tải trong ổ bụng khi thở máy nằm sấp. Mure và cộng sự [109] đã chứng minh trên một mô hình động vật thú vị rằng tư thế nằm sấp cải thiện sự trao đổi khí ở phổi ở mức độ cao hơn khi có IAH, thể hiện bằng sự gia tăng PaO2 và giảm sự không đồng nhất thông khí – tưới máu. Sự giảm IAP quan sát được (ước tính thông qua áp lực dạ dày), dẫn đến giảm đồng thời áp lực màng phổi ở tư thế nằm sấp có thể là lời giải thích cho những quan sát này, do đó tạo điều kiện thông khí khu vực trong các vùng phổi phụ thuộc gần cơ hoành.
Trong một nghiên cứu thử nghiệm gần đây trên 12 con lợn được rửa phổi bằng nước muối và thông khí gây tổn thương để mô phỏng ARDS, các tác giả đã chỉ ra rằng tư thế nằm sấp và PEEP cải thiện độc lập độ giãn nở của phổi mà không cần tương tác [110]. Như mong đợi, IAH (15 mmHg) làm tăng mức PEEP cần thiết để độ giãn nở phổi tốt nhất. Tuy nhiên, PEEP tốt nhất không khác biệt đáng kể giữa tư thế nằm sấp (12,8 ± 2,4 cmH2O) và nằm ngửa (11,0 ± 4,2 cmH2O) khi nhắm mục tiêu độ giãn nở phổi.
De Jong và cộng sự [111] đã áp dụng thành công tư thế nằm sấp ở bệnh nhân béo phì và không béo phì mắc ARDS. Ở bệnh nhân béo phì, quá trình oxygen hóa được cải thiện đáng kể so với bệnh nhân không béo phì. Mặc dù không được đo, những bệnh nhân béo phì này có thể có mức IAP cao hơn.
Đặt bệnh nhân ARDS ở tư thế nằm sấp không thay đổi hoặc chỉ ảnh hưởng nhẹ đến mức IAP với tác dụng rõ rệt hơn ở bệnh nhân IAH [25, 112]. Ví dụ, Jozwiak và cộng sự [112] nhận thấy IAP tăng nhẹ từ 15 đến 18 mmHg khi bệnh nhân ARDS được nằm sấp.
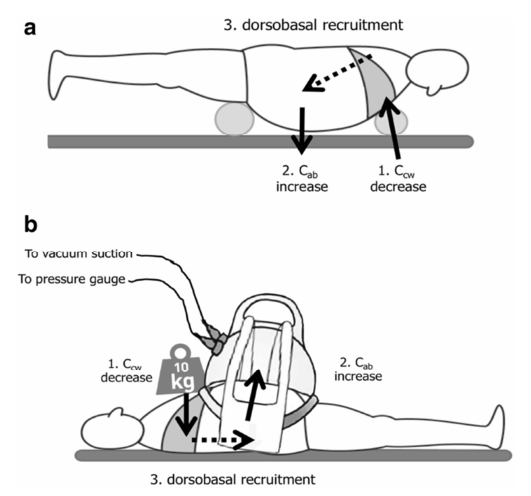
Việc sử dụng phương pháp treo ngực và vùng chậu (chest and pelvic suspension) có ảnh hưởng lớn đến áp lực IAP [113]. Áp lực do hệ thống treo ngực tạo ra sẽ dẫn đến giảm CCW, trong khi hệ thống treo ngực sẽ đảm bảo bụng lơ lửng tự do và do đó hạn chế sự truyền IAP đến vùng phổi lưng và đáy phổi và cơ hoành. Điều này làm giảm IAP và cải thiện độ giãn nở của ổ bụng và giảm xẹp phổi thông qua việc huy động phổi lưng và đáy. Lợi ích lý thuyết của việc theo dõi bệnh nhân mắc IAH cần phải vượt trội so với các rủi ro thực tế (ví dụ bệnh nhân bị hở bụng).
Điều thú vị là không trọng lượng dường như có lợi trong bối cảnh IAH [114]. Sự kết hợp của một trọng lượng đặt trên ngực với một hộp hút chân không đặt trên bụng có tác dụng tương tự như không trọng lượng với việc giảm CCW và cải thiện độ giãn nở của bụng (Hình 4).
Hình 4. Ảnh hưởng của tư thế đến độ giãn nở của ngực và thành bụng. a Ảnh hưởng của tư thế nằm sấp với treo bụng đối với độ giãn nở của ngực và thành bụng. Hệ thống treo được đặt dưới lồng ngực sẽ làm giảm độ giãn nở của thành ngực (1) trong khi treo ở bụng hệ thống treo sẽ tạo ra một trọng lực hấp dẫn làm tăng độ giãn nở của thành bụng (2). Điều này sẽ dẫn đến việc huy động các vùng phổi phía lưng và vùng đáy phổi (3). b Tác dụng của tư thế nằm ngửa kết hợp với trọng lượng đặt vào ngực và hút chân không trên bụng. Trọng lượng đặt lên ngực sẽ làm giảm độ giãn nở của thành ngực (1) trong khi chuông chân không ở bụng sẽ làm tăng độ giãn nở của thành bụng (2). Điều này sẽ dẫn đến việc huy động các vùng phổi phía lưng và vùng đáy phổi (3)
Tóm lại, nằm sấp dường như không làm tăng IAP và có khả năng cải thiện oxygen hóa ở bệnh nhân suy hô hấp và IAH. Tuy nhiên, cần có các nghiên cứu sâu hơn để so sánh hiệu quả trên kết quả của các phương pháp tiếp cận khác nhau này ở bệnh nhân IAH và suy hô hấp.
Khả năng ảnh hưởng đến huyết động ở bệnh nhân iah và việc áp dụng peep
Hiệu quả tim mạch cá nhân của iap và peep
Tác dụng cá nhân của IAH cũng như PEEP cao trên hệ tim mạch được mô tả rõ ràng [115-118]. Cả IAH và PEEP cao đều có liên quan đến giảm cung lượng tim. IAH làm giảm hồi lưu tĩnh mạch chủ yếu do sự chèn ép vào ổ bụng của tĩnh mạch chủ dưới nhưng áp lực đổ đầy mạch máu trung tâm như áp lực tĩnh mạch trung tâm và áp lực động mạch phổi bít tăng lên. Áp lực trong lồng ngực thông qua ATT tăng lên do đó làm tăng hậu tải thất phải. Hậu tải thất trái tăng lên do sự chèn ép trực tiếp của các mạch máu mao mạch ổ bụng và thông qua sự hoạt hóa của con đường renin – angiotensin – aldosterone. Người ta cho rằng ở bệnh nhân IAH, cung lượng tim chủ yếu bị ảnh hưởng bởi hậu tải [116].
PEEP có ảnh hưởng đến tim mạch bằng cách tăng áp lực trong lồng ngực [117]. Hồi lưu tĩnh mạch của thất phải và trái giảm, hậu tải thất phải tăng nhưng hậu tải thất trái giảm.
Hiệu quả tim mạch kết hợp của iap và peep
Không có nhiều nghiên cứu đánh giá tác dụng huyết động kết hợp của cả IAP và PEEP. Cả IAP và PEEP đều đồng thời làm giảm việc tăng hậu tải thất phải. Về lý thuyết, IAP và PEEP có thể có hai tương tác đối kháng. Thứ nhất, hậu tải thất trái tăng do IAH nhưng giảm do mức PEEP cao. Thứ hai, hồi lưu tĩnh mạch từ tĩnh mạch chủ dưới về tâm nhĩ phải phần lớn được xác định bởi áp lực tâm nhĩ phải (RAP) hơn là độ chênh IAP [119].
Trong trường hợp không có IAH (RAP > IAP), tăng mức độ IAP có thể làm tăng hồi lưu tĩnh mạch và cải thiện cung lượng tim bằng cách phân phối lại máu từ ổ bụng đến khoang ngực. Tuy nhiên, khi có IAH (RAP IAP) và do đó cải thiện cả hồi lưu tĩnh mạch và cung lượng tim.
Chỉ có một số nghiên cứu trên động vật và con người kiểm tra tác dụng huyết động kết hợp của IAH và PEEP. Trong các nghiên cứu trên động vật, PEEP (dao động từ 4–22 mmHg) có tác động tiêu cực mạnh hơn đến cung lượng tim so với IAP (phạm vi lên đến 26 mmHg) [18, 19, 55]. PEEP được điều chỉnh bằng một nửa IAP (PEEP = 50% IAP) không làm giảm đáng kể cung lượng tim trái ngược với PEEP được điều chỉnh hoàn toàn theo IAP.
Krebs và cộng sự [94] đã áp dụng các mức PEEP khác nhau lên đến 15 mmHg (20 cmH2O) ở 20 bệnh nhân ARDS nhưng không tìm thấy bất kỳ sự khác biệt nào về tim mạch giữa những bệnh nhân có và không có IAH.
Trong một nghiên cứu thí điểm trên 15 bệnh nhân có IAH nhưng phổi khỏe mạnh, các mức PEEP khác nhau đã được áp dụng và không tìm thấy sự khác biệt về huyết áp hoặc nhịp tim có lẽ do kích thước mẫu nhỏ [97].
Ở 8 tình nguyện viên với quần chống sốc y tế căng phồng (không đo IAP), PEEP bổ sung 10 cmH2O được áp dụng và siêu âm tim được thực hiện [120]. Người ta kết luận rằng sự gia tăng hậu tải thất trái gây ra bởi bơm phồng quần chống sốc y tế có thể được chống lại bằng cách sử dụng PEEP.
Tóm lại, dữ liệu thực nghiệm và lâm sàng hạn chế gợi ý rằng tác dụng huyết động tiêu cực của PEEP ở một mức độ nào đó sẽ bị phản tác dụng ở những bệnh nhân mắc IAH. Tuy nhiên, rất khó để đưa ra bất kỳ kết luận nào từ các nghiên cứu trên và bác sĩ lâm sàng nên thận trọng khi áp dụng mức PEEP cao hơn ở bệnh nhân IAH vì phản ứng của tim mạch với mức PEEP cao hơn rất khó dự đoán.
Xử trí nội khoa tăng áp lực trong ổ bụng
Các chiến lược xử trí nội khoa đối với IAP tăng cao có thể được chia thành năm loại tùy theo cơ chế hoạt động được đề xuất của chúng. Đầu tiên, cải thiện độ giãn nở của thành bụng (an thần và giảm đau, phong tỏa thần kinh cơ, gây tê ngoài màng cứng và thay đổi vị trí cơ thể); thứ hai, hút sạch các chất trong dạ dày (giải áp dạ dày hoặc trực tràng và sử dụng các thuốc tăng nhu động [prokinetic agents]); thứ ba, dẫn lưu các tụ dịch trong ổ bụng (nội soi hoặc dẫn lưu catheter qua da); thứ tư, tránh hồi sức dịch quá mức và điều chỉnh cân bằng dịch của bệnh nhân dương tính (với việc sử dụng dịch một cách hợp lý, ví dụ như các dung dịch ưu trương thay vì dịch tinh thể); và thứ năm, hỗ trợ cơ quan (theo dõi hô hấp và tim mạch như đã nêu ở trên) [1, 121, 122]. Việc thảo luận chi tiết các chiến lược xử trí nội khoa khác nhau sẽ nằm ngoài phạm vi của bài đánh giá này. Tổng quan về thuật toán xử trí nội khoa WSACS IAH/hội chứng khoang bụng (và các Grade khuyến nghị liên quan) được trình bày trong Hình 5. Cụ thể đối với những bệnh nhân mắc IAH cần thở máy, cần lưu ý rằng việc giảm nhỏ thể tích trong ổ bụng có thể cải thiện đáng kể áp lực đường thở và IAP [26].
Hình 5. WSACS 2013 Thuật toán xử trí nội khoa tăng áp lực trong ổ bụng/hội chứng khoang bụng. Chất lượng của bằng chứng cho mỗi khuyến nghị và độ mạnh của khuyến nghị được đánh giá theo thang điểm thứ tự bốn điểm phù hợp với các nguyên tắc Đánh giá, Phát triển và Đánh giá (GRADE) của Các khuyến nghị (http://www.gradeworkinggroup.org), trong đó mỗi bằng chứng điểm được ký hiệu bằng chữ cái từ D đến A: rất thấp (D), thấp (C), trung bình (B) và cao (A) và độ mạnh của khuyến nghị được đưa ra bằng một số: mạnh (1) và yếu (2 ). Hội chứng khoang bụng ACS, tăng áp trong ổ bụng IAH, áp lực trong ổ bụng IAP.
Theo dõi nước ngoài mạch máu phổi và tính thấm mạch máu phổi (được tính bằng phương pháp pha loãng nhiệt xuyên phổi và được định nghĩa là EVLW chia cho thể tích máu phổi) có thể cung cấp thông tin bổ sung hữu ích. An thần sâu với một đợt ngắn thuốc chẹn thần kinh cơ có thể hữu ích ở một số bệnh nhân được chọn hoặc làm cầu nối tiến tới phẫu thuật mở bụng giải áp.
Kết luận
Mặc dù đã đạt được nhiều tiến bộ đáng kể trong những thập kỷ qua, một số câu hỏi quan trọng vẫn còn liên quan đến việc xử trí thông khí tối ưu ở bệnh nhân IAH. Khi chăm sóc bệnh nhân IAH và ARDS cần thở máy, bước đầu tiên quan trọng là đo IAP và hướng tới giảm IAP để giảm áp lực đường thở, lưu ý rằng giảm nhẹ thể tích trong ổ bụng có thể làm giảm đáng kể IAP và áp lực đường thở [26].
Mặc dù thách thức, việc đo áp lực thực quản thay thế cho áp lực trong lồng ngực có thể cung cấp áp lực xuyên phổi có thể giúp hướng dẫn thông khí [92]. Cần lưu ý rằng IAH có thể dẫn đến hội chứng đa ngăn với sự tương tác liên quan giữa các áp lực ngăn khác nhau [7]. Về mặt này, nên tránh kê đầu giường trên 45° ở những bệnh nhân có chỉ số khối cơ thể cao vì điều này có liên quan đến tăng IAP.
Trong quá trình thông khí bảo vệ phổi, chúng tôi khuyến nghị áp dụng thông khí bảo vệ phổi với thể tích khí lưu thông thấp 6–8 mL/kg và áp lực đẩy tối đa là 15 cmH2O. Có thể yêu cầu áp lực cao nguyên cao hơn khuyến nghị là 30 cmH2O trong bối cảnh IAH. Tính đến IAP bình thường là 10 mmHg và ATT là khoảng 50%, 23 cmH2O + 0,7 * IAP tính bằng mmHg có thể là giới hạn trên thích hợp của áp lực cao nguyên.
Ngoài ra, ở những bệnh nhân mắc IAH, mức PEEP cao hơn có thể được yêu cầu để ngăn ngừa xẹp phổi cuối kỳ thở ra. Tuy nhiên, PEEP tốt nhất trong môi trường IAH vẫn chưa được biết. Vòng lặp áp lực-thể tích hoặc sử dụng áp lực thực quản có thể hữu ích để xác định PEEP tốt nhất ở bệnh nhân IAH. Biết rằng ATT là khoảng 50%, có thể thích hợp để đặt PEEP (cmH2O) bằng 50% IAP trong cmH2O. Trong trường hợp không có bằng chứng, chúng tôi khuyên bạn nên đặt PEEP theo CRS tốt nhất.
Anti-Trendelenburg hoặc nằm sấp với treo bụng có thể có tác dụng có lợi trên cơ học hô hấp ở bệnh nhân IAH. Theo dõi chức năng hô hấp và điều chỉnh cài đặt máy thở cho phù hợp trong quá trình gây mê và chăm sóc tích cực là rất quan trọng.
Với sự hiểu biết nâng cao của chúng tôi về sinh lý bệnh và dịch tễ học, các nghiên cứu ngẫu nhiên trong tương lai nên tập trung vào việc xác định xem liệu các can thiệp nội khoa mục tiêu hay đa phương diện (và phẫu thuật xâm lấn tối thiểu) nhằm mục đích giảm IAP và cải thiện độ giãn nở của ổ bụng cuối cùng sẽ cải thiện kết quả ở bệnh nhân IAH và hội chứng khoang bụng.
References
|
1. |
Kirkpatrick AW, Roberts DJ, De Waele J, et al. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013;39:1190–206. |
|
2. |
Reintam Blaser A, Regli A, De Keulenaer B, et al. Incidence, risk factors, and outcomes of intra-abdominal hypertension in critically ill patients-a prospective multicenter study (IROI study). Crit Care Med. 2019;47:535–42. |
|
3. |
Wise R, Roberts DJ, Vandervelden S, et al. Awareness and knowledge of intra-abdominal hypertension and abdominal compartment syndrome: results of an international survey. Anaesthesiol Intensive Ther. 2015;47:14–29. |
|
4. |
Malbrain ML, Chiumello D, Pelosi P, et al. Incidence and prognosis of intraabdominal hypertension in a mixed population of critically ill patients: a multiple-center epidemiological study. Crit Care Med. 2005;33:315–22. |
|
5. |
Malbrain ML, Peeters Y, Wise R. The neglected role of abdominal compliance in organ-organ interactions. Crit Care. 2016;20:67. |
|
6. |
Blaser AR, Bjorck M, De Keulenaer B, Regli A. Abdominal compliance: a bench-to-bedside review. J Trauma Acute Care Surg. 2015;78:1044–53. |
|
7. |
Malbrain ML, Roberts DJ, Sugrue M, et al. The polycompartment syndrome: a concise state-of-the-art review. Anaesthesiol Intensive Ther. 2014;46:433–50. |
|
8. |
Pelosi P, Quintel M, Malbrain ML. Effect of intra-abdominal pressure on respiratory mechanics. Acta Clin Belg. 2007;62(Suppl):78–88. |
|
9. |
Malbrain ML, Chiumello D, Cesana BM, et al. A systematic review and individual patient data meta-analysis on intra-abdominal hypertension in critically ill patients: the wake-up project. World initiative on abdominal hypertension epidemiology, a unifying project (WAKE-Up!). Minerva Anestesiol. 2014;80:293–306. |
|
10. |
Holodinsky JK, Roberts DJ, Ball CG, et al. Risk factors for intra-abdominal hypertension and abdominal compartment syndrome among adult intensive care unit patients: a systematic review and meta-analysis. Crit Care. 2013;17:R249. |
|
11. |
Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidence and clinical effects of intra-abdominal hypertension in critically ill patients. Crit Care Med. 2008;36:1823–31. |
|
12. |
Reintam Blaser A, Parm P, Kitus R, Starkopf J. Risk factors for intra-abdominal hypertension in mechanically ventilated patients. Acta Anaesthesiol Scand. 2011;55:607–14. |
|
13. |
Malbrain ML, Chiumello D, Pelosi P, et al. Prevalence of intra-abdominal hypertension in critically ill patients: a multicentre epidemiological study. Intensive Care Med. 2004;30:822–9. |
|
14. |
Kim IB, Prowle J, Baldwin I, Bellomo R. Incidence, risk factors and outcome associations of intra-abdominal hypertension in critically ill patients. Anaesth Intensive Care. 2012;40:79–89. |
|
15. |
Quintel M, Pelosi P, Caironi P, et al. An increase of abdominal pressure increases pulmonary edema in oleic acidinduced lung injury. Am J Respir Crit Care Med. 2004;169:534–41. |
|
16. |
Ranieri VM, Brienza N, Santostasi S, et al. Impairment of lung and chest wall mechanics in patients with acute respiratory distress syndrome: role of abdominal distension. Am J Respir Crit Care Med. 1997;156:1082–91. |
|
17. |
Mutoh T, Lamm WJ, Embree LJ, Hildebrandt J, Albert RK. Abdominal distension alters regional pleural pressures and chest wall mechanics in pigs in vivo. J Appl Physiol. 1991;70:2611–8. |
|
18. |
Regli A, Hockings LE, Musk GC, et al. Commonly applied positive end-expiratory pressures do not prevent functional residual capacity decline in the setting of intra-abdominal hypertension: a pig model. Crit Care. 2010;14:R128. |
|
19. |
Regli A, Chakera J, De Keulenaer BL, et al. Matching positive end-expiratory pressure to intra-abdominal pressure prevents end-expiratory lung volume decline in a pig model of intra-abdominal hypertension. Crit Care Med. 2012;40:1879–86. |
|
20. |
Mutoh T, Lamm WJ, Embree LJ, Hildebrandt J, Albert RK. Volume infusion produces abdominal distension, lung compression, and chest wall stiffening in pigs. J Appl Physiol. 1985;1992(72):575–82. |
|
21. |
Zhou JC, Xu QP, Pan KH, Mao C, Jin CW. Effect of increased intra-abdominal pressure and decompressive laparotomy on aerated lung volume distribution. J Zhejiang Univ Sci B. 2010;11:378–85. |
|
22. |
Wauters J, Claus P, Brosens N, et al. Relationship between abdominal pressure, pulmonary compliance, and cardiac preload in a porcine model. Crit Care Res Pract. 2012;2012:763181. |
|
23. |
Gattinoni L, Pelosi P, Suter PM, Pedoto A, Vercesi P, Lissoni A. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am J Respir Crit Care Med. 1998;158:3–11. |
|
24. |
Torquato JA, Lucato JJ, Antunes T, Barbas CV. Interaction between intra-abdominal pressure and positive-end expiratory pressure. Clinics (Sao Paulo). 2009;64:105–12. |
|
25. |
De Keulenaer BL, De Waele JJ, Powell B, Malbrain ML. What is normal intra-abdominal pressure and how is it affected by positioning, body mass and positive end-expiratory pressure? Intensive Care Med. 2009;35:969–76. |
|
26. |
Regli A, De Keulenaer BL, Singh B, Hockings LE, Noffsinger B, van Heerden PV. The respiratory pressureabdominal volume curve in a porcine model. Intensive Care Med Exp. 2017;5:11. |
|
27. |
Cortes-Puentes GA, Cortes-Puentes LA, Adams AB, Anderson CP, Marini JJ, Dries DJ. Experimental intraabdominal hypertension influences airway pressure limits for lung protective mechanical ventilation. J Trauma Acute Care Surg. 2013;74:1468–73. |
|
28. |
Malbrain ML, Roberts DJ, De Laet I, et al. The role of abdominal compliance, the neglected parameter in critically ill patients—a consensus review of 16. Part 1: definitions and pathophysiology. Anaesthesiol Intensive Ther. 2014;46:392–405. |
|
29. |
Talmor D, Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med. 2008;359:2095–104. |
|
30. |
Marini JJ, Gattinoni L. Ventilatory management of acute respiratory distress syndrome: a consensus of two. Crit Care Med. 2004;32:250–5. |
|
31. |
Wauters J, Wilmer A, Valenza F. Abdomino-thoracic transmission during ACS: facts and figures. Acta Clin Belg. 2007;62(Suppl 1):200–5. |
|
32. |
Malbrain ML, Pelosi P, De Laet I, Lattuada M, Hedenstierna G. Lymphatic drainage between thorax and abdomen: please take good care of this well-performing machinery. Acta Clin Belg. 2007;62(Suppl 1):152–61. |
|
33. |
Moriondo A, Mukenge S, Negrini D. Transmural pressure in rat initial subpleural lymphatics during spontaneous or mechanical ventilation. Am J Physiol Heart Circ Physiol. 2005;289:H263–9. |
|
34. |
Toens C, Schachtrupp A, Hoer J, Junge K, Klosterhalfen B, Schumpelick V. A porcine model of the abdominal compartment syndrome. Shock. 2002;18:316–21. |
|
35. |
Tons C, Schachtrupp A, Rau M, Mumme T, Schumpelick V. Abdominal compartment syndrome: prevention and treatment. Chirurg. 2000;71:918–26. |
|
36. |
Lattuada M, Hedenstierna G. Abdominal lymph flow in an endotoxin sepsis model: influence of spontaneous breathing and mechanical ventilation. Crit Care Med. 2006;34:2792–8. |
|
37. |
Malbrain M, Pelosi P. Open up and keep the lymphatics open: they are the hydraulics of the body! Crit Care Med. 2006;34:2860–2. |
|
38. |
Cordemans C, De Laet I, Van Regenmortel N, et al. Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak, and fluid balance. Ann Intensive Care. 2012;2(Suppl 1):S1. |
|
39. |
Cordemans C, De Laet I, Van Regenmortel N, et al. Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment. Ann Intensive Care. 2012;2(Suppl 1):S15. |
|
40. |
Malbrain ML, Marik PE, Witters I, et al. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anaesthesiol Intensive Ther. 2014;46:361–80. |
|
41. |
Strang CM, Freden F, Maripuu E, Hachenberg T, Hedenstierna G. Ventilation-perfusion distributions and gas exchange during carbon dioxide-pneumoperitoneum in a porcine model. Br J Anaesth. 2010;105:691–7. |
|
42. |
Andersson L, Lagerstrand L, Thörne A, Sollevi A, Brodin LA, Odeberg-Wernerman S. Effect of CO(2) pneumoperitoneum on ventilation-perfusion relationships during laparoscopic cholecystectomy. Acta Anaesthesiol Scand. 2002;46:552–60. |
|
43. |
Rezende-Neto JB, Moore EE, Melo de Andrade MV, et al. Systemic inflammatory response secondary to abdominal compartment syndrome: stage for multiple organ failure. J Trauma. 2002;53:1121–8. |
|
44. |
Schachtrupp A, Lawong G, Afify M, Graf J, Toens C, Schumpelick V. Fluid resuscitation preserves cardiac output but cannot prevent organ damage in a porcine model during 24 h of intraabdominal hypertension. Shock. 2005;24:153–8. |
|
45. |
Santos CL, Moraes L, Santos RS, et al. Effects of different tidal volumes in pulmonary and extrapulmonary lung injury with or without intraabdominal hypertension. Intensive Care Med. 2012;38:499–508. |
|
46. |
Lima R, Silva PL, Capelozzi VL, et al. Early impact of abdominal compartment syndrome on liver, kidney and lung damage in a rodent model. Anaesthesiol Intensive Ther. 2017;49:130–8. |
|
47. |
Pinhu L, Whitehead T, Evans T, Griffiths M. Ventilator-associated lung injury. Lancet. 2003;361:332–40. |
|
48. |
Malbrain ML, De Keulenaer BL, Oda J, et al. Intra-abdominal hypertension and abdominal compartment syndrome in burns, obesity, pregnancy, and general medicine. Anaesthesiol Intensive Ther. 2015;47:228–40. |
|
49. |
Schetz M, De Jong A, Deane AM, et al. Obesity in the critically ill: a narrative review. Intensive Care Med. 2019. https://doi.org/10.1007/s00134-019-05594-1. |
|
50. |
Pelosi P, Croci M, Ravagnan I, et al. Respiratory system mechanics in sedated, paralyzed, morbidly obese patients. J Appl Physiol. 1985;1997(82):811–8. |
|
51. |
Pelosi P, Croci M, Ravagnan I, et al. The effects of body mass on lung volumes, respiratory mechanics, and gas exchange during general anesthesia. Anesth Analg. 1998;87:654–60. |
|
52. |
Pelosi P, Croci M, Ravagnan I, Vicardi P, Gattinoni L. Total respiratory system, lung, and chest wall mechanics in sedated-paralyzed postoperative morbidly obese patients. Chest. 1996;109:144–51. |
|
53. |
Bluth T, Pelosi P, de Abreu MG. The obese patient undergoing nonbariatric surgery. Curr Opin Anaesthesiol. 2016;29:421–9. |
|
54. |
Pelosi P, Luecke T, Rocco PR. Chest wall mechanics and abdominal pressure during general anaesthesia in normal and obese individuals and in acute lung injury. Curr Opin Crit Care. 2011;17:72–9. |
|
55. |
Regli A, Mahendran R, Fysh ET, et al. Matching positive end-expiratory pressure to intra-abdominal pressure improves oxygenation in a porcine sick lung model of intra-abdominal hypertension. Crit Care. 2012;16:R208. |
|
56. |
Kirkpatrick AW, Pelosi P, De Waele JJ, et al. Clinical review: intra-abdominal hypertension: does it influence the physiology of prone ventilation. Crit Care. 2010;14:232. |
|
57. |
Mergoni M, Martelli A, Volpi A, Primavera S, Zuccoli P, Rossi A. Impact of positive end-expiratory pressure on chest wall and lung pressure-volume curve in acute respiratory failure. Am J Respir Crit Care Med. 1997;156:846– 54. |
|
58. |
Verbrugge FH, Dupont M, Steels P, et al. Abdominal contributions to cardiorenal dysfunction in congestive heart failure. J Am Coll Cardiol. 2013;62:485–95. |
|
59. |
Cheatham ML, Malbrain ML, Kirkpatrick A, et al. Results from the international conference of experts on intraabdominal hypertension and abdominal compartment syndrome. II. Recommendations. Intensive Care Med. 2007;33:951–62. |
|
60. |
De Keulenaer BL, Regli A, Malbrain ML. Intra-abdominal measurement techniques: is there anything new? Am Surg. 2011;77(Suppl 1):S17–22. |
|
61. |
Mietto C, Malbrain ML, Chiumello D. Transpulmonary pressure monitoring during mechanical ventilation: a bench-to-bedside review. Anaesthesiol Intensive Ther. 2015;47(Spec No):s27–37. |
|
62. |
Silva PL, Pelosi P, Rocco PR. Recruitment maneuvers for acute respiratory distress syndrome: the panorama in 2016. Rev Bras Ter Intensiv. 2016;28:104–6. |
|
63. |
Santiago VR, Rzezinski AF, Nardelli LM, et al. Recruitment maneuver in experimental acute lung injury: the role of alveolar collapse and edema. Crit Care Med. 2010;38:2207–14. |
|
64. |
Silva PL, Cruz FF, Fujisaki LC, et al. Hypervolemia induces and potentiates lung damage after recruitment maneuver in a model of sepsis-induced acute lung injury. Crit Care. 2010;14:R114. |
|
65. |
ART-Investigators, Cavalcanti AB, Suzumura ÉA, et al. Effect of lung recruitment and titrated positive endexpiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318:1335–45. |
|
66. |
Hodgson CL, Tuxen DV, Davies AR, et al. A randomised controlled trial of an open lung strategy with staircase recruitment, titrated PEEP and targeted low airway pressures in patients with acute respiratory distress syndrome. Crit Care. 2011;15:R133. |
|
67. |
Santos RS, Moraes L, Samary CS, et al. Fast versus slow recruitment maneuver at different degrees of acute lung inflammation induced by experimental sepsis. Anesth Analg. 2016;122:1089–100. |
|
68. |
Rzezinski AF, Oliveira GP, Santiago VR, et al. Prolonged recruitment manoeuvre improves lung function with less ultrastructural damage in experimental mild acute lung injury. Respir Physiol Neurobiol. 2009;169:271–81. |
|
69. |
Silva PL, Moraes L, Santos RS, et al. Impact of pressure profile and duration of recruitment maneuvers on morphofunctional and biochemical variables in experimental lung injury. Crit Care Med. 2011;39:1074–81. |
|
70. |
Silva PL, Moraes L, Santos RS, et al. Recruitment maneuvers modulate epithelial and endothelial cell response according to acute lung injury etiology. Crit Care Med. 2013;41:e256–65. |
|
71. |
Hodgson CL, Tuxen DV, Bailey MJ, et al. A positive response to a recruitment maneuver with PEEP titration in patients with ARDS, regardless of transient oxygen desaturation during the maneuver. J Intensive Care Med. 2011;26:41–9. |
|
72. |
Bluth T, Teichmann R, Kiss T, et al. Protective intraoperative ventilation with higher versus lower levels of positive end-expiratory pressure in obese patients (PROBESE): study protocol for a randomized controlled trial. Trials. 2017;18:202. |
|
73. |
Maia LA, Silva PL, Pelosi P, Rocco PRM. Controlled invasive mechanical ventilation strategies in obese patients undergoing surgery. Expert Rev Respir Med. 2017;11:443–52. |
|
74. |
Moran JL, Bersten AD, Solomon PJ. Meta-analysis of controlled trials of ventilator therapy in acute lung injury and acute respiratory distress syndrome: an alternative perspective. Intensive Care Med. 2005;31:227–35. |
|
75. |
PROVE NIFTCTNOTESOA, Hemmes SN, Gama de Abreu M, Pelosi P, Schultz MJ. High versus low positive endexpiratory pressure during general anaesthesia for open abdominal surgery (PROVHILO trial): a multicentre randomised controlled trial. Lancet. 2014;384:495–503. |
|
76. |
Serpa Neto A, Hemmes SN, Barbas CS, et al. Protective versus conventional ventilation for surgery: a systematic review and individual patient data meta-analysis. Anesthesiology. 2015;123:66–78. |
|
77. |
Lachmann B. Open up the lung and keep the lung open. Intensive Care Med. 1992;18:319–21. |
|
78. |
Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43:304–77. |
|
79. |
Gattinoni L, Protti A, Caironi P, Carlesso E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit Care Med. 2010;38:S539–48. |
|
80. |
Talmor D, Sarge T, O’Donnell CR, et al. Esophageal and transpulmonary pressures in acute respiratory failure. Crit Care Med. 2006;34:1389–94. |
|
81. |
Milic-Emili J, Mead J, Turner JM, Glauser EM. Improved technique for estimating pleural pressure from esophageal balloons. J Appl Physiol. 1964;19:207–11. |
|
82. |
Malbrain ML, Cheatham ML, Kirkpatrick A, et al. Results from the international conference of experts on intraabdominal hypertension and abdominal compartment syndrome. I. Definitions. Intensive Care Med. 2006;32:1722–32. |
|
83. |
Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015;372:747–55. |
|
84. |
Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. |
|
85. |
De Jong A, Cossic J, Verzilli D, et al. Impact of the driving pressure on mortality in obese and non-obese ARDS patients: a retrospective study of 362 cases. Intensive Care Med. 2018;44:1106–14. |
|
86. |
Nestler C, Simon P, Petroff D, et al. Individualized positive end-expiratory pressure in obese patients during general anaesthesia: a randomized controlled clinical trial using electrical impedance tomography. Br J Anaesth. 2017;119:1194–205. |
|
87. |
Pereira SM, Tucci MR, Morais CCA, et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis. Anesthesiology. 2018;129:1070–81. |
|
88. |
Fumagalli J, Berra L, Zhang C, et al. Transpulmonary pressure describes lung morphology during decremental positive end-expiratory pressure trials in obesity. Crit Care Med. 2017;45:1374–81. |
|
89. |
Fumagalli J, Santiago RRS, Teggia Droghi M, et al. Lung recruitment in obese patients with acute respiratory distress syndrome. Anesthesiology. 2019. https://doi.org/10.1097/ALN.0000000000002638. |
|
90. |
Neto AS, Hemmes SN, Barbas CS, et al. Association between driving pressure and development of postoperative pulmonary complications in patients undergoing mechanical ventilation for general anaesthesia: a meta-analysis of individual patient data. Lancet Respir Med. 2016;4:272–80. |
|
91. |
Malbrain ML. The saga continues: how to set best PEEP in intra-abdominal hypertension [editorial]. J Crit Care. 2018;43:387–9. |
|
92. |
Pelosi P, Vargas M. Mechanical ventilation and intra-abdominal hypertension: ‘Beyond Good and Evil’. Crit Care. 2012;16:187. |
|
93. |
da Silva Almeida JR, Machado FS, Schettino GP, Park M, Azevedo LC. Cardiopulmonary effects of matching positive end-expiratory pressure to abdominal pressure in concomitant abdominal hypertension and acute lung injury. J Trauma. 2010;69:375–83. |
|
94. |
Krebs J, Pelosi P, Tsagogiorgas C, Alb M, Luecke T. Effects of positive end-expiratory pressure on respiratory function and hemodynamics in patients with acute respiratory failure with and without intra-abdominal hypertension: a pilot study. Crit Care. 2009;13:R160. |